-
Medical journals
- Career
PROBLEMATIKA ORÁLNÍHO LICHEN PLANUS – NYNĚJŠÍ POHLED
Authors: M. Janovská 1; Š. Podzimek 2
Authors‘ workplace: Oddělení orální medicíny, Stomatologická klinika, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice, Praha 1; Laboratoř pro ústní biologii, Stomatologická klinika, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice, Praha 2
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 119, 2019, 4, s. 100-111
Category: Review Article
Overview
Úvod a cíl: Orální lichen planus patří k nejčastějším onemocněním ústních sliznic. V současnosti se vyskytuje u 0,5 % až 2,2 % populace. Přes značný počet vědeckých prací, které se orálnímu lichen planus věnují, zůstává jednoznačná etiologie tohoto onemocnění zatím neobjasněna. Rozlišuje se několik základních forem, z nichž nejčastější je forma retikulární. Subjektivní pocity provázející orální lichen planus mohou být značně variabilní – od minimální symptomatologie po silnou bolest postižených tkání znemožňující mluvu, příjem potravy či provádění orální hygie - ny. Maligní zvrat lichenových lézí byl opakovaně popsán a je tématem, kterým se zabývá řada odborníků z různých odvětví medicíny. Některé projevy připomínající orální lichen planus jsou klasifikovány jako lichenoidní polékové reakce (lichenoid drug eruptions), kontaktní léze (contact lesions) – projevy v těsném kontaktu s dentálním mate - riálem a lichenoidní manifestace v rámci reakce štěpu proti hostiteli, zatímco ostatní případy jsou definovány jako idiopatický lichen planus, u kterého není známa příčina. Cílem předloženého sdělení je prezentace současných poznatků týkajících se orálního lichen planus a lichenoidní stomatitidy.
Metodika: Sdělení je zaměřeno na patogenezi, klinický obraz a možné terapeutické intervence těchto slizničních onemocnění. Kriticky byly hodnoceny studie uvedené v databázi PubMed věnující se zejména rizikovým faktorům, terapeutickým možnostem a malignímu zvratu orálního lichen planus a lichenoidní stomatitidy.
Výsledky: Orální lichen planus je chronické onemocnění, které může v mnoha případech vést ke značné limitaci života. Výzkumné aktivity na tomto poli podporují vědecké práce věnující se především problematice možného maligního zvratu orálního lichen planus a rozšíření terapeutického armamentária. Na základě výsledků řady vědeckých prací je zřejmá snaha tento trend podporovat.
Závěr: Diagnostikovat toto onemocnění pouze na bázi klinické či pouze histopatologické může vést k nezanedbatelnému procentu chyb v diagnostice. To může mít fatální následky zejména v případě nevyloučení jiných poten - ciálně maligních chorob, které mohou orální lichen planus mnohdy imitovat na klinické úrovni, ale v konečném důsledku mají odlišný průběh. Pokud možno jednoznačná klinická a histopatologická definice orálního lichen planus, respektive lichenoidní stomatitidy, je tedy kruciálním momentem celého diagnostického algoritmu.
Klíčová slova:
orální lichen planus – lichenoidní stomatitida – orální sliznice – histopatologie – terapie
ÚVOD
Orální lichen planus byl poprvé popsán Wilsonem v roce 1869 a v současné době patří mezi nejčastější onemocnění ústních sliznic. Jeho prevalence se pohybuje okolo dvou procent u dospělé populace s vyšším výskytem u žen středního věku [1].
Jedná se o onemocnění, které může mít značný vliv na kvalitu života a v konečném důsledku může vést k četným omezením, která se týkají limitů mimo jiné v příjmu určitých potravin, provádění orální hygieny či obtíží při mluvě, žvýkání a v některých případech i při polykání.
Navzdory rozsáhlému počtu studií, které se problematice orálního lichen planus věnují, jednoznačný etiologický faktor stále ještě nebyl stanoven. Současným trendem je nahlížet na určité spektrum mikrobiálních agens jako na rizikový faktor rozvoje orálního lichen planus. Stejný vědecký i klinický pohled si zaslouží stres, lokální a systémová buněčně indukovaná imunitní odpověď [2]. Hepatopatie, léky a dentální materiály jsou jedním z majoritních rizikových faktorů lichenoidní stomatitidy.
Otázkou maligní transformace orálního lichen planus se zabývalo mnoho specialistů, stále však zůstává určitým kontroverzním tématem, které je v současné době velmi aktuální a týká se mnoha medicínských specializací.
Cílem předloženého sdělení je zaměřit se na rekapitulaci poznatků o orálním lichen planus a lichenoidní stomatitidě. Důraz je kladen na rizikové faktory, maligní potenciál orálního lichen planus a lichenoidní stomatitidy a terapeutické možnosti těchto dvou entit.
ORÁLNÍ LICHEN PLANUS – INCIDENCE, PATOGENEZE, SYMPTOMY
Lichen planus patří mezi chronická zánětlivá onemocnění s kožní nebo slizniční manifestací postihující dlaždicový epitel [3]. Výskyt orální formy lichen planus se zdá být častější než formy kožní, slizniční projevy onemocnění se mohou objevit i bez jasné návaznosti na kožní formu [4].
Podle rozsáhlé švédské studie z roku 1970 se výskyt orálního lichen planus pohyboval kolem 1,9 % a kožní lichen planus okolo 0,23 % [3]. V současnosti se vyskytuje v průměru u 0,5 % až 2,2 % populace. Charakteristické věkové rozmezí pro výskyt orálního lichen planus se pohybuje mezi 30 až 60 lety [6].
Existují onemocnění, která svým klinickým a histopatologickým nálezem imitují lichen planus [5, 7, 8]. V rámci diferenciální diagnostiky je nutné vyloučit jiná potenciálně maligní onemocnění, jež mohou napodobovat orální lichen planus, avšak liší se svým průběhem i konečnou prognózou.
Některé projevy připomínající orální lichen planus jsou klasifikovány jako lichenoidní polékové reakce (lichenoid drug eruptions), kontaktní léze (contact lesions) – projevy v těsném kontaktu s dentálním materiálem a lichenoidní manifestace v rámci reakce štěpu proti hostiteli. Ostatní případy jsou definovány jako idiopatický lichen planus, u kterého není známa příčina [9, 10, 11].
Reakce, které orální lichen napodobují (lichen-like reactions), mohou být vyvolány celou řadou činitelů, mezi něž se řadí především léky (zejména betablokátory, alopurinol, diuretika či antimalarika), dentální pryskyřice (akryláty) nebo kovové dentální materiály.
Role imunitní dysregulace v patogenezi orálního lichen planus je zřejmá a týká se imunitních mechanismů vrozených (cytokiny, komplement, APC, NK lymfocyty, žírné buňky atd.) i získaných (CD4+ a CD8+ T lymfocyty). Konečným důsledkem této dysregulace je kolikvace bazální membrány keratinocytů [2, 12].
Podle současného obecného názoru lichenoidní reakce představují imunitní odezvu na zevní, alterované vnitřní antigeny či podle literatury takzvané superantigeny [37]. Tyto reakce se mohou vyskytovat pouze na integumentu či sliznicích, ale v některých případech se vyskytují simultánně na kožním i slizničním povrchu [13].
I přes značný počet vědeckých prací, které se problematice orálního lichen planus věnují, zůstává jednoznačná etiologie neobjasněna. Značného posunu bylo dosaženo v pochopení patogeneze [14]. S velkou pravděpodobností se jedná o onemocnění vyvolané imunitní reakcí na antigenní podnět [15]. Ze značného množství dat je zřejmé, že imunitní mechanismy jsou podstatným faktorem, který se podílí na iniciaci i samotném patologickém procesu orálního lichen planus a T lymfocyty hrají v tomto procesu velmi významnou roli. Rozsáhlé vědecké práce podporují uvedenou tezi imunitní dysregulace v procesu patogeneze orálního lichen planus, týkající se zejména buněčně indukované imunitní odpovědi [16]. Základem je jejich nakupení v oblasti bazální membrány. Kombinací exogenních a endogenních faktorů je iniciována jejich diferenciace na CD4+ T lymfocyty a CD8+ T lymfocyty, které jsou schopné vést k apoptóze keratinocytů.
Mezi nejvíce frekventovaná místa výskytu slizničních projevů orálního lichen planus patří bukální sliznice, jazyk a gingiva. Přítomnost Wickhamových strií nebo bílých papul reprezentuje nejčastější klinický nález u orálního lichen planus. Symetričnost projevů a jejich bilaterální umístění patří mezi další klinické charakteristiky orálního lichen planus [2]. Klinicky je možné uvažovat o diagnóze lichenoidní stomatitidy v případě unilaterální lokalizace slizničních projevů (kontaktní lichenoidní stomatitida). Děje se tak v těsné blízkosti zubu ošetřeného amalgámovou výplní, v rámci určité chronické medikace jako suspektního etiologického faktoru z lichenoidní erupce (z angl. lichenoid drug eruptions) nebo v případě diagnózy reakce štěpu proti hostiteli s intraorální manifestací u pacienta po transplantaci kostní dřeně.
V současné době existuje několik klasifikací orálního lichen planus, z nichž nejznámější je klasifikace Adreasenova, který onemocnění rozdělil do šesti základních forem: retikulární, papulární, plakovitá, erozivní, atrofická a bulózní [17].
Orální lichen planus bývá značně variabilní ve svém klinickém projevu. V průběhu času může u lichenových změn docházet ke změnám vzhledu i symptomatologie. Běžně dochází ke střídání období remise a exacerbace, v řadě případů probíhá i asymptomaticky.
Subjektivní projevy zahrnující pocit pálení orálních sliznic, citlivost až bolestivost se týkají zejména erozivní a bulózní formy onemocnění [3]. Zmíněné obtíže mohou být někdy natolik výrazné, že interferují s příjmem potravy, omezují mluvu a polykání či narušují proces orální hygieny [11]. Orální lichen planus a lichenoidní stomatitida tedy patří mezi onemocnění, která mohou markantně ovlivnit kvalitu života.
ORÁLNÍ LICHEN PLANUS A LICHENOIDNÍ STOMATITIDA – HISTOPATOLOGICKÝ NÁLEZ
Obecně doporučovaným postupem pro potvrzení klinické diagnózy orálního lichen planus či lichenoidní stomatitidy je histopatologická verifikace, doplněná případně vyšetřením přímou imunofluorescencí. Adekvátní klinické i řádné histopatologické vyšetření je základním pilířem kompletní diagnostiky a zhodnocení maligního potenciálu onemocnění [18].
Onemocnění je provázeno typickým histopatologickým obrazem zahrnujícím akantózu epitelu, hyperkeratózu, denzní kulovitý infiltrát v oblasti bazální membrány a Civatteho tělíska prezentující apoptotické keratinocyty [19].
Ve většině případů je nemožné na základě klinického vyšetření rozlišit orální lichen planus a lichenoidní stomatitidu. Alberdi-Navarro a kol. na základě retrospektivní studie zabývající se histopatologickým nálezem u 85 pacientů s diagnózou lichenoidní stomatitidy poukázal na nespecifičnost histopatologických aspektů a nemožnost diferencovat mezi jednotlivými subtypy lichenoidní stomatitidy. Hlavní důvod histopatologického vyšetření viděl ve vyloučení dysplazie nebo karcinomu. Subepidermální zánětlivý infiltrát (band-like infiltrát) a nález apoptotických keratinocytů ve formě Civatteho tělísek je společným histopatologickým jmenovatelem orálního lichen planus a lichenoidní erupce. Zánětlivý infiltrát je tvořen zejména CD4+ a CD8+ T lymfocyty, některé studie uvádějí vyšší zastoupení cytotoxických T lymfocytů, zejména u déle trvajících slizničních projevů [20]. Existují určitá diagnostická kritéria k odlišení polékové lichenoidní reakce (lichenoid-drug eruptions), ovšem s nepříliš dobrou klinicko-patologickou korelací. Výraznější zánětlivý infiltrát, perivaskulární zánětlivé změny a přítomnost polymorfonukleárních leukocytů je možno zařadit mezi histopatologická kritéria k odlišení orálního lichen planus a lichenoidní stomatitidy [18] (obr. 1).
Image 1. Deskvamativní gingivitida v rámci orálního lichen planus (z archivu autorky) Fig. 1
Desquamative gingivitis in oral lichen planus (author´s archive)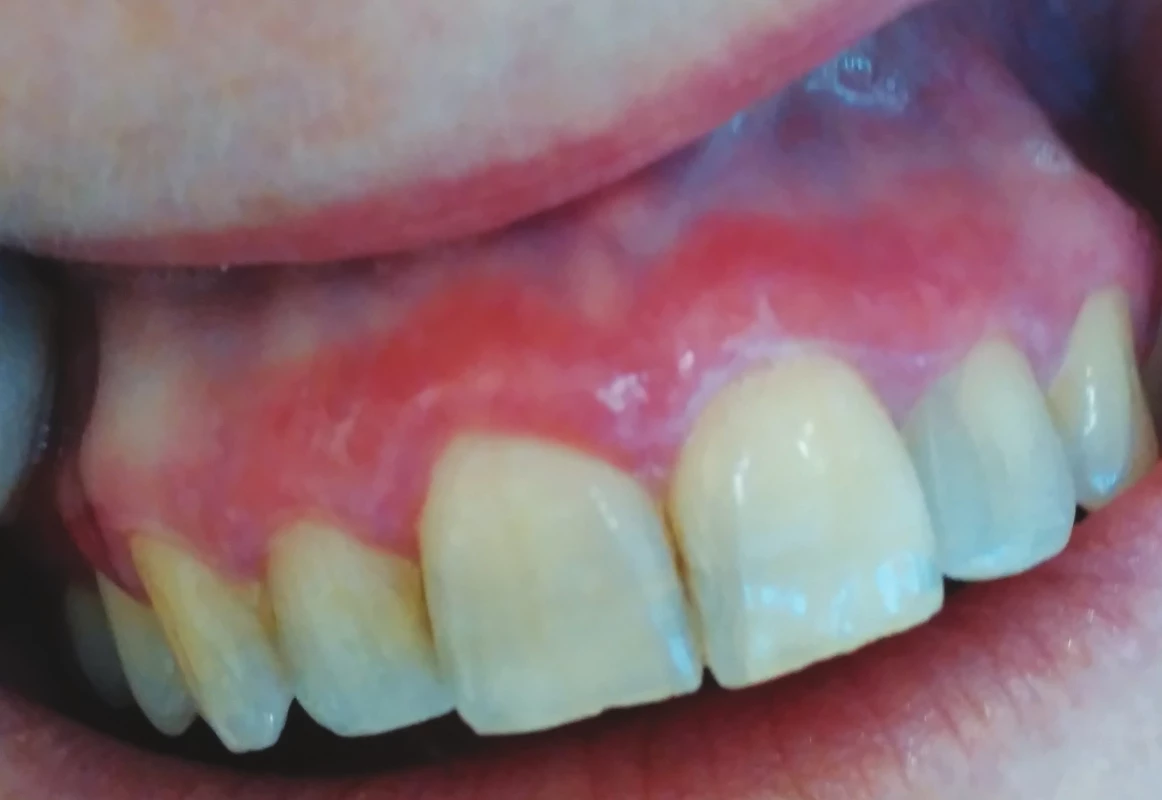
ORÁLNÍ LICHEN PLANUS, LICHENOIDNÍ STOMATITIDA – RIZIKOVÉ FAKTORY
Mikrobiální agens, stres a dysregulace imunitního systému se řadí mezi zvažované vyvolávající činitele orálního lichen planus. Mezi základní příčinné faktory lichenoidní stomatitidy patří již uvedená chronická medikace, dentální materiály a hepatopatie.
Chronické infekce virem hepatitidy C v etiologii orálního lichen planus
Souvislost orálního lichen planus a chronické infekce virem hepatitidy C (HCV) byla intenzivně studována [63]. Extrahepatální manifestace chronické HCV infekce byly poprvé popsány v roce 1990. Asociace orálního lichenu a chronických jaterních onemocnění je známa [73]. První zmínky o souvislosti mezi orálním lichen planus a HCV je datována do roku 1991. S postupným rozvojem vyšetřovacích technik docházelo i k většímu záchytu lichenoidních lézí asociovaných s HCV. Významné studie italských, španělských a amerických odborníků prokázaly korelaci mezi HCV a lichen planus, a to zejména s jeho orální formou [4, 21–25].
Signifikantní histopatologické změny mezi pacienty s chronickou hepatitidou C a zdravými jedinci nebyly zaznamenány [26]. HCV-asociovaný orální lichen planus však bývá spojen s relativně vyšším zastoupením CD8+ T lymfocytů ve srovnání s idiopatickým lichen planus [1].
Stres jako rizikový faktor orálního lichen planus
Existuje celá řada studií, které se věnují úloze stresu u pacientů s lichen planus a většinou se zaměřují na orální formu [27]. Psychosomatické faktory onemocnění a obecně jejich asociace s dermatózami je známa [28]. Chaudhary ve své práci se 43 pacienty potvrdil souvislost stresu, úzkosti a deprese s orálním lichen planus. Tyto faktory navíc mohou iniciovat mnoho autoimunitních onemocnění, která mohou podporovat vznik lichen planus [29]. Je tedy zřejmé, že mimo uváděnou T lymfocyty řízenou imunitní reakci rovněž i psychologický status a genetika mají vliv na rozvoj tohoto chronického onemocnění [30]. Ústní dutina reaguje na určité psychické podněty už jen z důvodu své komplexity [31].
V roce 2004 Soto Araya a kol. potvrdili pozitivní korelaci mezi psychickou alterací a orálním lichen planus [68]. Stupeň úzkosti spolu s hladinou kortizolu ve slině u pacientů s lichen planus byly sledovanými parametry ve studii Koraye. Prokázána byla pozitivní korelace mezi oběma sledovanými ukazateli, což potvrdilo poměrně úzký vztah mezi lichen planus a psychickou kondicí [33]. Proto je kromě tradiční terapie vhodná i intervence psychologa či psychiatra. Ivanovski a kol. na základě vyšetření 40 pacientů s orálním lichen planus potvrdili dlouhodobou stresovou zátěž. Prolongovaný stres vedoucí k psychosomatizaci s sebou nese riziko iniciace lichenu s následnými klinickými projevy tohoto chronického onemocnění [30].
Chronická medikace jako etiologický faktor lichenoidní stomatitidy
Nežádoucí účinky léků mohou mít variabilní projevy s postižením téměř všech tělesných kompartmentů. Často mohou být zaměněny i za příznaky klinikem zvažovaného probíhajícího systémového onemocnění [34]. Dutina ústní může být cílovou lokalitou polékové nežádoucí reakce. S ohledem na množství v současnosti předepisovaných léků je do jisté míry poléková hypersenzitivita očekávatelná. Habbab v rámci své práce vyšetřil 531 pacientů dispenzarizovaných na kardiologické klinice. Prokázal, že 14,1 % z vyšetřených pacientů mělo klinicky přítomné příznaky nežádoucích účinků kardiotonik. Lichenoidní stomatitida byla popsána u 3,6 % pacientů s kardiologickou medikací.
Většina léků je metabolizována přes enzymatický systém cytochromu P 450 a týkají se zejména genů patřících do skupiny CYP1–3, které se podílejí mimo jiné i na procesu metabolismu léků. Právě snížená funkce CYP genové skupiny účastnící se metabolismu léků je považovana za možnou příčinu vzniku lichenoidní stomatitidy u některých pacientů, kteří byli léčeni zidovudinem [34]. Na základě výsledků četných studií je známo, že řada léků může vyvolávat změny odpovídající lichenoidní stomatitidě. V odborné literatuře jsou nazývány lichenoidní polékové „erupce“ (z angl. lichenoid drug eruptions – LDE). Mezi ně patří antihypertenziva, antimalarika, nesteroidní antiflogistika, diuretika, penicilamin, anxiolytika či léky patřící do skupiny antiretrovirotik. Podle platných názorů není ale možné jednoznačně stanovit farmakologickou patogenezi orálního lichen planus (respektive lichenoidní stomatitidy) pouze na základě snížené aktivity CYP, proto je problematika polékové etiologie lichenoidní stomatitidy stále intenzivně studována [36].
Lichenoidní polékové reakce se mohou vyskytovat pouze na integumentu či sliznicích, ale v některých případech se vyskytují simultánně na kožním i slizničním povrchu [13]. Typická je střední až vyšší věková hranice výskytu tohoto typu polékových reakcí, ač některé studie poukazují na jejich výskyt i v pediatrické populaci [38]. Časově jednoznačná souvislost mezi vznikem lichenoidních změn v dutině ústní a nasazením léků nemusí být vždy patrná, v některých případech je interval od nasazení medikace ke vzniku lichenoidních reakcí značně variabilní a pohybuje se od několika týdnů k několika měsícům s průměrným dvouměsíčním až tříměsíčním mediánem [39] (obr. 2).
Image 2. Lichenoidní poléková reakce na alopurinol (z archivu autorky)
Fig. 2 Lichenoid drug eruption, reaction to alopurinol (author´s archive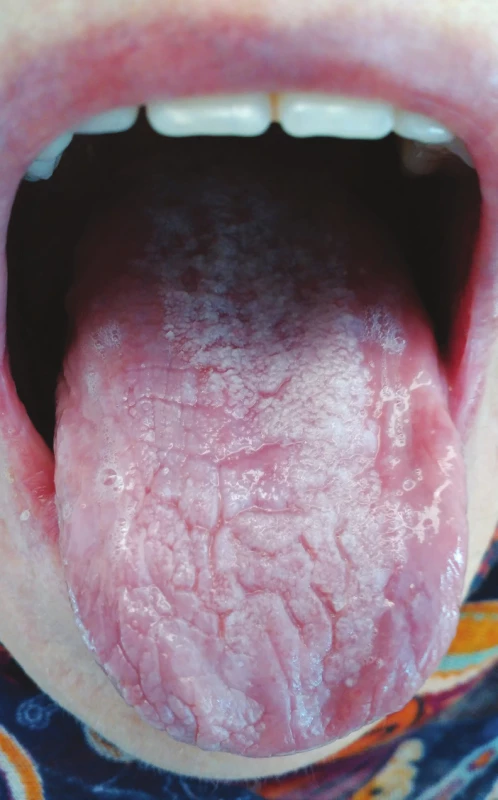
Klinicky je lichenoidní lékově podmíněná stomatitida charakteristická většinou unilaterální lokalizací a přítomností sekundárních eflorescencí charakteru erozí. Histopatologické odlišení lichenoidní polékové stomatitidy od orálního lichen planus je mnohdy obtížné.
V současné době je však pozornost orientována i na dentální materiály, z nichž by některé mohly fungovat jako spouštěč složité kaskády imunitních dějů, které vedou k projevům orálního lichen planus resp. lichenoidní stomatitidy.
Dentální materiály – možný vyvolávající činitel lichenoidní stomatitidy
Protetická a konzervační sanace jsou běžnou pracovní náplní praktického zubního lékaře. Dentální ošetření zahrnuje celou škálu materiálů [40]. V zubním lékařství našly uplatnění jak ušlechtilé (zlato, stříbro, platina), tak i neušlechtilé (kobalt, nikl, molybden) kovy ve formě slitin. Uvolňování iontů z kovových slitin predisponuje k imunitním změnám, které v konečném důsledku mohou vést ke kontaktní alergii (obr. 3).
Image 3. Lichenoidní stomatitida, hypersenzitivita na kovové dentální materiály (z archivu autorky)
Fig. 3 Lichenoid stomatitis, hypersensitivity to dental metal materials (author´s archive)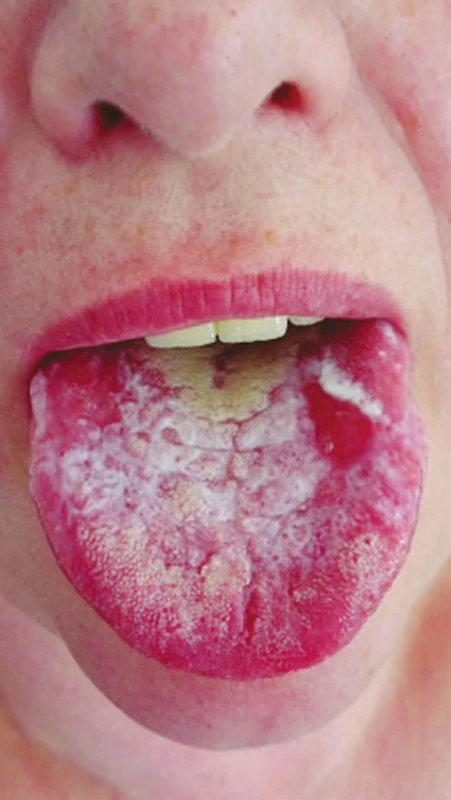
Jsou známy dva hlavní typy tkáňových reakcí na uvolněné kovové ionty: nespecifické granulomatózní reakce zprostředkované makrofágy anebo častěji imunitní odpověď lymfocytů s převahou cytokinů uvolněných T lymfocyty. Cytokiny jsou rozpustné glykoproteiny nebo peptidy, které působí neenzymaticky v pikomolárních až nanomolárních koncentracích přes specifické receptory zajišťující přenos intercelulárních signálů a různé buněčné funkce [41]. Reakce okolní tkáně jsou na základě převládající buněčné odpovědi popisovány buď jako typ s dominantní převahou makrofágů bez imunologické paměti, nebo typ s dominujícími T lymfocyty s imunologickou pamětí [42]. Těchto reakcí se mohou účastnit také různé zánětlivé mediátory, jako jsou právě cytokiny (IL-1, IL-2, IL-4, IL-5, IL-6, IL-10, IL-13, IL-17, IFN-γ, IP-10), chemokiny (MIP-1a a MIP-1b) a růstové faktory (GM-CSF a PDGF) [42].
Mnoho dentálních materiálů může v konečném důsledku vyvolat kontaktní alergii s rozličnými projevy, například symptom pálení orálních sliznic, stomatitidu, cheilitidu či lichenoidní reakce lokalizované přímo v místě kontaktu s materiálem; u zdravotnického personálu mohou vyvolat kontaktní dermatitidu [70]. Objektivní změny zaznamenatelné v praxi klinického lékaře tedy mohou zahrnovat celé spektrum projevů, např. stomatitidu nebo cheilitidu, mnohdy s přítomností erozivních až ulcerativních tkáňových defektů [43]. Kovovými ionty indukovaná reakce přecitlivělosti může vyvolat změny srovnatelné se zánětem vyskytujícím se v rámci bakteriální či virové infekce. Je známo, že pacienti s reakcí na kovové materiály mohou po zubním ošetření zaznamenat příznaky srovnatelné s chřipkou [44]. Předpokládá se, že chronická zánětlivá reakce iniciovaná kovy může na základě uvolnění cytokinů regulovat hypotalamo-pituitárně-adrenální osu (HPA-osa) a vést k nespecifickým příznakům zahrnujícím chronickou únavu, depresivní syndrom, poruchy spánku a další psychosomatické projevy [45].
Pacienti s předpokládanou přecitlivělostí na dentální materiály mohou podstoupit vyšetření za účelem identifikace iritujících agens.
Diagnostické metody k verifikaci hypersenzitivity na materiály
Ke stanovení hypersenzitivity na tyto materiály byly navrženy různé diagnostické metody, včetně epikutánních testů, histologických postupů, testu transformace lymfocytů (LTT), testu inhibice migrace leukocytů (LIF), testu aktivace lymfocytů (LAT) a imunostimulačního testu paměťových lymfocytů MELISA® (Memory Lymphocyte Immunostimulation Assay). Epikutánní testy jsou stále nejčastěji používanou diagnostickou metodou pro hodnocení hypersenzitivity na různé materiály. V nynější době jsou však často označovány za metodu do určité míry kontroverzní. LTT test a jeho modifikace (MELISA®), který hodnotí přímo složky imunitního systému zodpovědné za přecitlivělost na daný materiál, je více vypovídající.
MELISA® (InVitaLab Medizindiagnostik, Neuss, SRN) je vědecky ověřený a klinicky validovaný krevní test, který detekuje imunopatologickou reakci na různé druhy kovů, jako je například rtuť, zlato, paladium a titan [45, 72]. Test je určen k vyhodnocení reaktivity lymfocytů periferní krve in vitro (modifikace LTT – test transformace lymfocytů) po expozici kovovým iontům. Výsledky slouží k přesnému stanovení hypersenzitivity na dané kovy, což má nejenom diagnostický, ale i preventivní význam. Existuje několik faktorů, které mohou ovlivnit výsledky testu MELISA®, mezi něž se standardně řadí imunosupresivní terapie či některé typy proběhlých infekčních onemocnění. Epikutánní testy jsou užitečnou jednoduchou a neinvazivní metodou k detekování kontaktních alergií u pacientů a členů dentálního týmu, kteří s kovovými materiály přicházejí do styku [46] (obr. 4, 5).
Image 4. Lichenoidní kontaktní léze (z archivu autorky)
Fig. 4 Lichenoid contact lesion (author´s archive)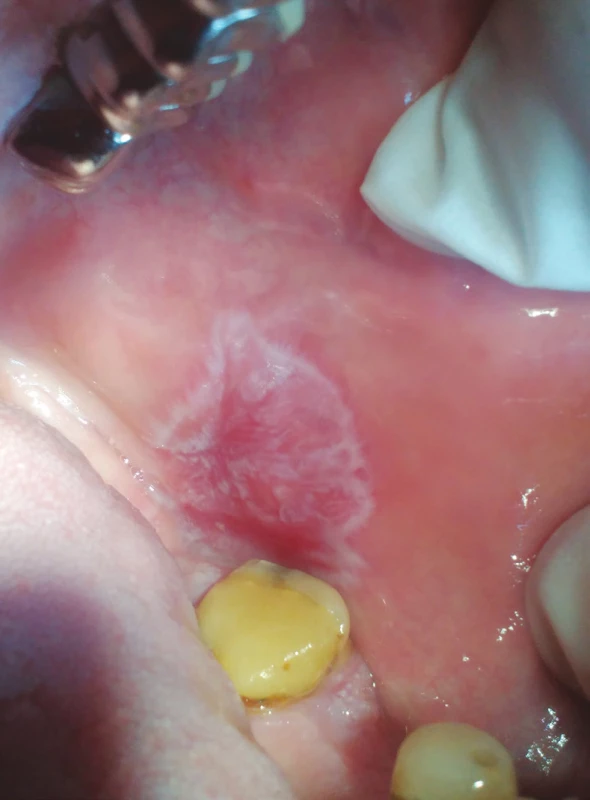
Image 5. hypersenzitivita na kovové stomatologické materiály (z archivu autorky)
Fig. 5 Lichenoid stomatitis, immune reaction to dental metal materials (author´s archive)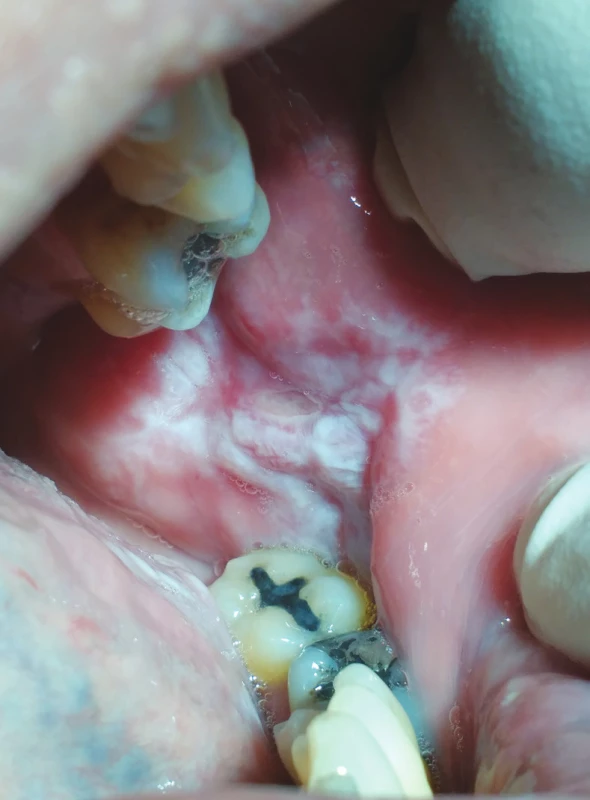
Epikutánní testy mohou být pomocným prostředkem pro potvrzení klinicky zvažované lichenoidní reakce [47, 69] a jsou stále nejčastěji používanou diagnostickou metodou pro hodnocení hypersenzitivity na různé materiály. Výsledky epikutánních testů mohou hrát významnou roli při rozhodování o materiálech, které budou nahrazovat při prokázané citlivosti materiály původního konzervačního či protetického ošetření. V současné době jsou však tyto testy často označovány za kontroverzní metodu, neboť buňky přítomné v kůži se nevyskytují v hlubších tkáních.
Lichenoidní reakce mají určité charakteristiky kompatibilní s diagnózou hypersenzitivity IV. typu a patří mezi nejčastější projevy reaktivity na materiály v ústní dutině. V současné době je podporována teze transepiteliálního průniku kovových iontů, které po navázání na plazmatické proteiny vytvářejí hapteny, a ty mohou indukovat imunitní odpověď organismu. Lichenoidní reakce mohou být vyvolány celou řadou dentálních materiálů. Je zřejmé, že riziko vzniku nežádoucích reakcí v souvislosti s kovovými materiály bude záviset na expozici daným kovům a může se lišit interindividuálně. První uvažovaná souvislost mezi rtutí a orálním lichen planus byla popsána již v 90. letech 19. století [47].
PROBLEMATIKA MALIGNÍ TRANSFORMACE U ORÁLNÍHO LICHEN PLANUS A LICHENOIDNÍ STOMATITIDY
Problematika maligního zvratu orálního lichen planus je v současnosti velmi aktuálním tématem a je stále intenzivněji studována. Od prvního reportu, který popisoval maligní změny v rámci diagnózy orálního lichen planus, bylo tomuto, mnohdy až kontroverznímu tématu věnováno mnoho vědeckých prací. V letech 1924–2007 se vědecké studie zabývaly problematikou maligní transformace orálního lichen planus s výsledky velmi variabilními – některé studie ukazovaly na takřka nulový maligní potenciál tohoto onemocnění a jiné přinesly výsledky v podstatě protichůdné, tzv. malignant transformation rate se pohyboval od 0 % do 12,5 % [2]. Světová zdravotnická organizace (World Health Organization – WHO) nahlíží na orální lichen planus jako na prekancerózu [48].
Problematika maligního zvratu je však stále předmětem intenzivních diskusí. Určitou komplikací pro možnost všeobecné jednoznačné shody ohledně maligního potenciálu orálního lichen planus je dosud relativní nedostatek všeobecně akceptovaných diagnostických kritérií [49]. Obecné riziko maligní transformace pro orální lichen planus se pohybuje kolem jednoho procenta až dvou procent; vyšší riziko je zaznamenáno v Itálii, snad i pro vyšší geograficky podmíněnou prevalenci chronické infekce virem hepatitidy C. Diskuse se věnují zejména otázce, jakým způsobem dochází k malignizaci primárně benigních lézí v rámci orálního lichen planus.
Může se jednat o záchyt dysplazie v rámci prvotní histopatologické verifikace predisponující k orálnímu lichen planus či se jedná o obecně vyšší riziko dlaždicobuněčného karcinomu u konkrétního pacienta vyplývající i z dalších rizikových kofaktorů (např. kouření). V případech, kdy je pacient opakovaně v kontaktu s kancerogeny, je obtížné diferencovat mezi maligní transformací vyvolanou primárně tabákově specifickými kancerogeny a mezi kancerogenním potenciálem orálního lichen planus [51].
Krutchkoff a kol. poukazovali na fakt, že v době jejich výzkumu nebyl k dispozici dostatek vědeckých důkazů prokazujících jednoznačný maligní potenciál orálního lichen planus, ale už tehdy zdůrazňovali, že tito pacienti měli zvýšené riziko karcinomu ústní dutiny v porovnání se zdravou populací [64]. Van der Meij a kol. kladli důraz na nutnost standardizovat diagnostická kritéria pro možnost jednoznačné a správné identifikace orálního lichen planus, což znamenalo jistý krok k modifikaci diagnostických kritérií WHO, která byla publikována v roce 1978 (WHO Collaborating Centre for Oral Precancerous Lesions, 1978). Nová kritéria byla přijata i z toho důvodu, aby reflektovala v té době novou entitu, a to lichenoidní stomatitidu. Bylo podstatné pokusit se ji definovat na klinické i histopatologické úrovni a na tomto podkladě ji odlišit od orálního lichen planus [50]. Některé lichenoidní reakce mohou vést ke zvýšenému riziku maligního zvratu a jejich klinické i histopatologické charakteristiky mohou být velmi často podobné těm, které se objevují v rámci orálního lichen planus [51]. Všeobecně se uvažuje o vyšším riziku maligního zvratu v případech lichenoidních reakcí [51]. V roce 2003 se uskutečnily první kroky k modifikaci kritérií, postupem času, v roce 2005, byly zavedeny další novinky, které se týkaly zejména diferenciální diagnostiky orálního lichen planus a lichenoidní stomatitidy. Diagnóza orálního lichen planus je vždy určována na základě řádného klinického vyšetření a histopatologické charakteristiky. Diagnostikovat toto onemocnění pouze na bázi klinické či pouze histopatologické může vést k nezanedbatelnému procentu chyb v diagnostice, což může mít fatální následky zejména v případě nevyloučení jiných potenciálně maligních onemocnění, které mohou orální lichen planus mnohdy imitovat na klinické úrovni, ale mají odlišný průběh. Jednoznačná klinická a histopatologická definice orálního lichen planus, respektive lichenoidní stomatitidy, je tedy kruciálním momentem celého diagnostického algoritmu.
Fitzpatrik a kol. zhodnotili 352 histopatologických vzorků dysplazie dlaždicobuněčného karcinomu ústní dutiny a u 29 % z nich prokázali lichenoidní změny [65].
American Academy of Oral Medicine (AAOM) poukazuje na zvýšené riziko karcinomu ústní dutiny u pacientů s orálním lichen planus, a proto je pravidelná dispenzarizace těchto pacientů pilířovým momentem celého léčebného algoritmu [66]. Mnoho autorů [11, 52, 53] ve svých výsledcích došlo k závěru, že pravidelná a pečlivá kontrola pacientů s lichen planus je základem pro včasné rozpoznání incipientní formy nádorového onemocnění [51]. V průměru by se četnost prohlídek měla pohybovat od dvou do čtyř za rok s ohledem na nutnou individualizaci periodizace kontrolních vyšetření. Všichni pacienti s verifikovaným orálním lichen planus by měli být pravidelně sledováni bez ohledu na to, zda jsou, či nejsou v jejich anamnéze přítomny další rizikové faktory pro spinocelulární tumor ústní dutiny. Vyhodnotit skutečné riziko maligní transformace u pacientů s diagnózou orálního lichen planus je složité mimo jiné i z toho důvodu, že celá řada pacientů vykazuje nulovou či naprosto minimální symptomatologii, což může někdy vést k „poddiagnostikování“ asymptomatických lézí, a pozornost kliniků je pak orientována na pacienty se symptomatologií [2]. Vyřazení pacienta z pravidelných kontrolních vyšetření pro klinicky stacionární nález je postup, který je vyhodnotitelný jako non lege artis. Podle mnoha studií je totiž frekvence výskytu dlaždicobuněčného karcinomu u pacientů s retikulární i nonretikulární formou orálního lichen planus obdobná [51, 53, 54]. Na základě vědeckých prací se odborná veřejnost přiklání k názoru, že pacienti s erozivní (ulcerózní) a atrofickou formou lichen planus jsou ve zvýšeném riziku progrese v dlaždicobuněčný karcinom, ač několik citovaných reportů poukazuje na nekompletní dokumentaci klinických a histopatologických nálezů, a to především z důvodu retrospektivity prezentovaných dat s neadekvátní velikostí vyšetřovaného vzorku [55] (obr. 6, 7).
Image 6. Orální lichen planus, retikulární forma (z archivu autorky)
Fig. 6 Oral lichen planus, reticular form (author´s archive)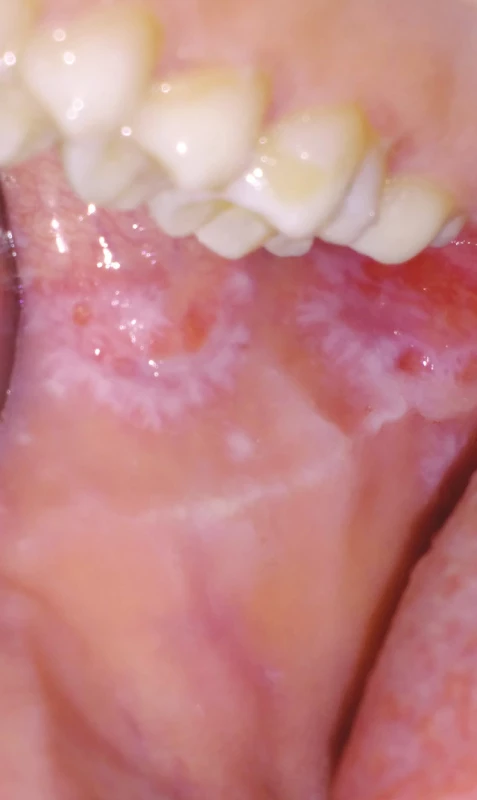
Image 7. Orální lichen planus, retikulární forma (z archivu autorky)
Fig. 7 Oral lichen planus, reticular form (author´s archive)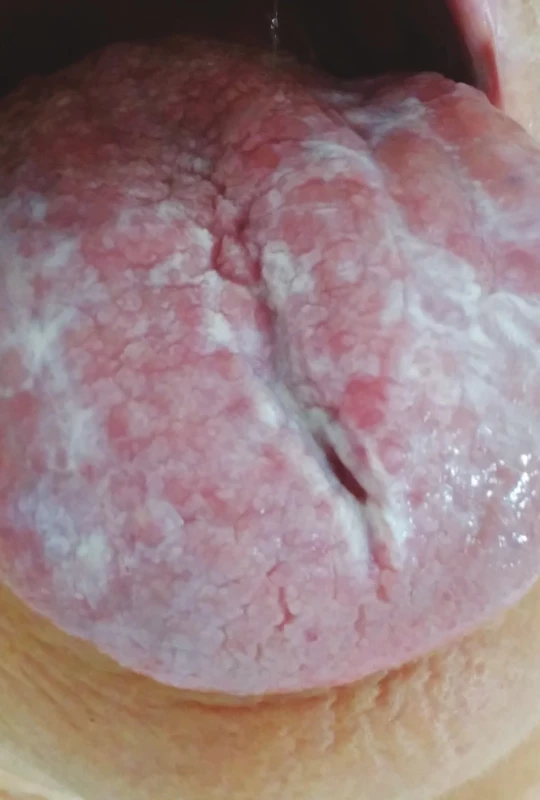
Podle standardních doporučení AAOM by měli být pacienti informováni o potenciálním kancerogenním riziku orálního lichen planus a docházet na pravidelné kontroly i v případě nulové nebo minimální symptomatologie [66].
Panuje všeobecná shoda ohledně nutnosti doplnění prospektivních studií věnujících se problematice maligního zvratu orálního lichen planus, stanovení rizika dlaždicobuněčného karcinomu u pacientů s orálním lichen planus a lichenoidní stomatitidou a definování spektra pacientů s nejvyšším rizikem pro vznik maligního tumoru dutiny ústní.
TERAPEUTICKÝ MANAGEMENT ORÁLNÍHO LICHEN PLANUS
Na etiopatogenezi orálního lichen planus se podílí celá řada odlišných faktorů. Navzdory novým poznatkům a přibývajícím studiím, které se tématu orálního lichen planus věnují, je jednoznačné určení vyvolávajícího činitele velmi obtížné, mnohdy až nemožné. V rámci diagnostického procesu je vhodné na základě zevrubné anamnézy určit suspektní faktory, které by mohly s největší pravděpodobností figurovat v etiopatogenezi orálního lichen planus nebo lichenoidní stomatitidy (léky, stres, hepatopatie atd.). Na základě důsledné multioborové spolupráce je možné diskutovat s ošetřujícími lékaři jiných odborností o možnosti například výměny určité medikace za jinou lékovou skupinu (typicky záměna betablokátorů) či po důkladném zhodnocení i možnost vysazení některého léku. V rámci prevence dekompenzace základního onemocnění, pro které byl původně lék nasazen, by měla být jakákoli manipulace s dávkováním a lékovou skupinou v rukou erudovaného specialisty (kardiologa, diabetologa, internisty a dalších). Samostatnou kapitolou je terapeutický management u lichenoidních lézí, které jsou s vysokou pravděpodobností vyvolané hypersenzitivitou na uvolňované kovové ionty z kovových dentálních prací a výplní. Zde je systematická spolupráce mezi stomatologem a specialistou z oboru orální medicíny klíčovým faktorem pro dosažení remise až zhojení lichenoidních reakcí.
Z důvodu nemožnosti jednoznačně identifikovat vyvolávající činitele je terapie orálního lichen planus především symptomatická [56]. První terapeutickou linii léků představují topické kortikosteroidy. Dexamethason, triamcinolon a clobetasol tvoří známé představitele kortikosteroidů, které se dají využít v lokální terapii a jsou vhodné k topické aplikaci na slizniční povrch. Mohou být adjustovány nejčastěji do podoby gelu, výplachu či mukoadhezivní pasty. Lékovou formu klinik volí podle místa aplikace, kdy musí respektovat rozsah plochy, na kterou bude lék nanášen, stejně jako obecné fyziologické aspekty dané lokalizace (riziko rychlého odplavení léku slinou v sublingvální či tvářové krajině, možnost rychlého otěru přípravku v rámci každodenních běžných aktivit při aplikaci na ret atd.).
Terapie topickými kortikosteroidy tedy tvoří zlatý standard v léčbě orálního lichen planus a lichenoidní stomatitidy. Rozdílné koncentrace a odlišná vehikula kortikosteroidů jsou volena podle závažnosti, lokalizace a velikosti defektů [57].
Systémová terapie kortikosteroidy je vhodná u těžkých progresivních forem orálního lichen planus. Zahájení celkové kortikosteroidní terapie vyžaduje důsledné a pravidelné monitorování pacientů.
V některých případech je odezva na topicky aplikované kortikosteroidy velmi nízká, proto se volí medikace alternativní, a to především u pacientů, kteří nereagují na běžnou terapii [56, 71]. Imunosupresiva makrolidového typu našla své využití především v transplantační medicíně, kde jsou podávána systémově za účelem prevence rejekce štěpu. Topické formy byly intenzivně studovány při léčbě chronických zánětlivých dermatóz [58]. Takrolimus jako představitel inhibitorů kalcineurinu se využívá jak v transplantační medicíně, tak i v terapii různých imunologicky podmíněných onemocnění. Díky svému inhibičnímu efektu na T lymfocyty našel uplatnění i v terapeutickém managementu refrakterního orálního lichen planus. Jedním z nejčastějších nežádoucích účinků při léčbě topickým takrolimem je pacientem uváděný pocit parestezie ošetřované oblasti kombinovaný se symptomem pálení sliznic [56]. Při jeho preskripci je nutná obezřetnost, některé studie ukazují na jeho možný vliv v kancerogenezi, a to zejména u celkově imunosuprimovaných pacientů. Proto je nutné při jeho použití důsledně monitorovat pacienta, včetně pravidelných krevních vyšetření zahrnujících mimo jiné stanovení hladiny kreatininu, urey a jaterního panelu [59]. V současné době není na českém trhu dostupný preparát s takrolimem pro topické podání na orální sliznice.
Evidence o užití retinoidů v terapii refrakterních forem orálního lichen planus je dosud založena spíše na kazuistických sděleních. Slibným by mohl být ale jejich efekt na modulaci imunitní odpovědi a funkci imunokompetentních buněk včetně T lymfocytů a makrofágů [56].
Polyfenolický antioxidant kurkumin je známý svými biologickými účinky – protizánětlivými, antiseptickými a do určité míry i analgetickými [60]. Prokázalo se, že u pacientů s orálním lichen planus dokáže působit preventivním mechanismem proti lipidové peroxidaci a narušení DNA [67].
Z nefarmakologických intervencí se v léčbě orálního lichen planus využívá především fototerapie. Nízkofrekveční laser (z angl. low-level laser therapy – LLLT) se používá pro svůj biostimulační efekt, který podporuje hojení ran, epitelizaci tkáňových defektů a přispívá k prevenci rozvoje mukozitidy [62].
ZÁVĚR
Orální lichen planus patří mezi nejčastější onemocnění ústních sliznic. S ohledem na jeho stále narůstající incidenci je zřejmé, že pacienti s orálním lichen planus či lichenoidní stomatitidou tvoří nezanedbatelné procento ošetřovaných i v běžné praxi praktického zubního lékaře. Z toho důvodu je důležité apelovat na rozšiřování znalostí o těchto dvou entitách nejen mezi odborníky specializovanými na onemocnění ústních sliznic, ale i mezi praktickými stomatology. Lze říci, že základní klinické i histopatologické charakteristiky, maligního potenciálu a terapeutických možností by měla být známa všem lékařům bez ohledu na specializaci.
Tento výzkum byl podpořen projektem Progres Q29/1 LF.
MDDr. Markéta Janovská, Diplomat in Oral Medicine
Stomatologická klinika 1. LF UK a VFN
Oddělení orální medicíny
Karlovo nám. 32, 120 00 Praha 2
e-mail: marketa.janovska@vfn.cz
Sources
1. Carrozzo M, Thorpe P.
Oral lichen planus. A review. Minerva Stomatol. 2009; 58 : 519–537.
2. Giuliani M, Troiano G, Cordaro M. Rate of malignant transformation of oral lichen planus: A systematic review.
Oral Dis. 2018; 25 : 693–709.
3. Carrozzo M, Gandolfo S.
The management of oral lichen planus.
Oral Dis. 1999; 5 : 196–205.
4. Carrozzo M, Gandolfo S, Carbone M.
Hepatitis C virus infection in Italian patients with oral lichen planus: a prospective case-control study. J Oral Pathol Med. 1996; 25 : 527–533.
5. Axéll T. Hypersensitivity of the oral mucosa: clinics and pathology. Acta Odontol Scand. 2000; 5 : 315–319.
6. Al-Hashimi I, Schifter M, Lockhart PB. Oral lichen planus and lichenoid lesions: diagnostic and therapeutic considerations. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007; 103: S25e1–S25e12.
7. Alves MGO, Balducci I, Carvalho YR, Nunes FD, Almeida JD. Oral lichen planus: a histopathological study. Histopathology. 2015; 66 : 463–464.
8. Au J, Patel D, Campbell JH. Oral lichen planus. Oral Maxillofac Surg Clin North Am. 2013; 25 : 93–100.
9. Henriksson E, Mattsson U, Hakansson J. Healing of lichenoid reactions following removal of amalgam. J Clin Periodontol. 1995; 22 : 287–294.
10. McCartan BE, Mccreary CE. Oral lichenoid drug eruptions. Oral Dis. 1997; 3 : 58–63.
11. Scully C, Beyli M, Ferreiro MC, Ficarra G, Gill Y, Griffiths M, Holmstrup P, Mutlu S, Porter S, Wray D. Update on oral lichen planus: etiopathogenesis and management. Crit Rev Oral Biol Med. 1998; 9 : 86–122.
12. Roopashree M, Gondhalekar R, Shashikanth M, George J, Thippeswamy SH, Shukla A. Pathogenesis of oral lichen planus – a review. J Oral Pathol Med. 2010; 39(10): 729–734.
13. Korstanje MJ. Drug-induced mouth disorders. Clin Exp Dermatol. 1995; 20 : 10–18.
14. Dřízhal I, Paulusová V. Orální lichen planus – současné poznatky. Čes stomatol Prakt zubní lék. 2008; 108(2): 35–38.
15. Walsh LJ, Savage NW, Ishii T. Immunopathogenesis of oral lichen planus. J Oral Pathol Med. 1990; 19 : 389–396.
16. Lodi G, Carrozzo M, Furness S, Thongprasom K. Interventions for treating oral lichen planus: A systematic review. Br J Dermatol. 2012; 166 : 938–947.
17. Adreasen JO. Oral lichen planus. 1. A clinical evaluation of 115 cases. Oral Surg Oral Med Oral Pathol. 1968; 25 : 31–42.
18. Alberdi-Navarro J, Marichalar-Mendia, Lartitegui-Sebastián MJ, Gainza-Cirauqui ML, Echebarria-Goikouria MA, Aguirre-Urizar JM. Histopathological characterization of the oral lichenoid disease subtypes and the relation with clinical data. Med Oral Patol Oral Cir Bucal. 2017; 3 : 307–313.
19. Firth NA, Rich AM, Radden B, Reade PC. Assessment of the value of immunofluorescence microscopy in the diagnosis of oral lichen planus. J Oral Pathol Med. 1990; 219 : 295–297.
20. Lage D, Juliano PB, Metze K, de Souza EM, Cintra ML. Lichen planus and lichenoid drug-induced eruption: a histological and imunohistochemical study. Int J Dermatol. 2012; 51 : 1199–1205.
21. Sanchez-Perez J, Castro M, Buezo GF, Fernandez-Herrera J, Borque MJ, Garcia-Diez A. Lichen planus and hepatitis C virus: prevalence and clinical presentation of patients with lichen planus and hepatitis C virus infection. Br J Dermatol. 1996; 134 : 715–719.
22. Bagan JV, Ramon C, Gonzales L. Preliminary investigation of the association of oral lichen planus and hepatitis. Oral Surg Oral Med Oral Pathol. 1998; 85 : 532–536.
23. Bellman B, Reddy RK, Falanga V. Lichen planus associated with hepatitis C. Lancet. 1995; 346 : 1234.
24. Chuang TY, Stitle L, Brashear R, Lewis C. Hepatitis C virus and lichen planus: a case control study. J Am Acad Dermatol. 1999; 41 : 787–789.
25. Beaird LM, Kahloon N, Franco J, Fairley JA. Incidence of hepatitis C in lichen planus. J Am Acad Dermatol. 2001; 44 : 311–312.
26. Kirby AC, Lodi GL, Olsen I, Porter SR. Immunohistochemical and serological comparison of idiopathic and hepatitis C virus-associated forms of oral lichen planus. Eur J Epidemiol. 1998; 16 : 853–862.
27. Manolache L, Seceleanu-Petrescu D, Benea V. Lichen planus patients and stressful events. JEADV. 2008; 22 : 437–441.
28. Koo JYM, Pham CT. Psychodermatology: Practical guidelines on pharmacotherapy. Arch Dermatol. 1992; 128 : 381–388.
29. Chaudhary S. Psychosocial stressors in oral lichen planus. Aust Dent J. 2004; 4 : 192–195.
30. Ivanovski K, Nakova M, Warburton G, Pesevska S, Filipovska A, Nares S, Nunn ME, Angelova D, Angelov N. Psychological profile in oral lichen planus. J Clin Periodontol. 2005; 32 : 1034–1040.
31. Preda EG, Passeti P, Caggiula S, Nidoli G, Boggio E, Azzi R. Oral pathology of psychosomatic origin. Review of the literature. Dent Cadmos. 1990; 58 : 66–72.
32. Eversole LR. Cellular immune correlates of clinical severity in oral lichen planus: preliminary association with mood states. Oral Dis. 1997; 3 : 64–70.
33. Koray M, Dulger O, Horasanli S, Ucok A, Tanyeri H, Badur S. The evaluation of axiety and salivary cortisol levels in patients with oral lichen planus. Oral Dis. 2003; 9 : 298–301.
34. Habbab KM, Moles DR, Porter SR. Potential oral manifestations of cardiovascular drugs. Oral Dis. 2010; 16 : 769–773.
35. Ingelman-Sundberg M. Genetic susceptibility to adverse effects of drugs and environmental toxicants. The role of the CYP family of enzymes. Mutat Res. 2001; 482 : 11–19.
36. Roblero-Sierra J, Mattsson U, Jontell M. Use of systemic medication in patients with oral lichen planus – a possible association with hypothyroidism. Oral Dis. 2013; 19 : 313–319.
37. Schlosser B. Lichen planus and lichenoid reactions of the oral mucosa. Dermatol Ther. 2010; 23 : 251–267.
38. Scully C, Carrozzo M. Oral mucosal disease: lichen planus. Oral Dis. 2008; 46 : 15–21.
39. Gunes AT, Fetil E, Ilknur T, Birgin B, Ozkan S. Naproxen-induced lichen planus: report of 55 cases. Pediatr Dermatol. 2009; 26 : 458–464.
40. Scott A, Egner W, Gawkrodger DJ, Hatton PV, Sherriff M, van Noort R, Yeoman C, Grummitt J. The national survey of adverse reactions to dental materials in the UK: a preliminary study by UK Adverse Reactions Reporting Project. Br Dent J. 2004; 8 : 471–477.
41. Barbucci R. Integrated biomaterials science. Springer Science & Business Media, 2007.
42. Lohmann CH, Hameister R, Singh G. Allergies in ortopaedic and trauma surgery. Orthopaedics Traumatology. Surg Res. 2017; 103 : 75–81.
43. Koch P, Bahmer FA. Oral lichenoid lesions, mercury hypersensitivity and combined hypersensitivity to mercury and other metals: histologically-proven reproduction of the reaction by patch testing with metal salts. Contact Dermat. 1995; 5 : 323–328.
44. Prochazkova J, Sterzl I, Kucerova H, Bartova J, Stejskal VDM. The beneficial effect of amalgam replacement on health in patients with autoimmunity. Neuroendocrinol Lett. 2004; 25(3): 211–218.
45. Stejskal J, Stejskal VDM. The role of metals in autoimmunity and the link to neuroendocrinology. Neuroendocrinol Lett. 1999; 20 : 351–364.
46. Rai R. Hypersensitivity of the oral mucosa: clinics and pathology. Indian Dermatol Online J. 2014; 3 : 282–286.
47. Lamey PJ, McCartan BE, Macdonald DG.
Basal cell cytoplasmic autoantibodies in oral lichenoid reactions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1995; 79 : 44–49.
48. Kramer IR, Lucas RB, Pindborg JJ, Sobin LH. Definition of leukoplakia and related lesions: an aid to studies on oral cancer. Oral Surg Oral Med Oral Pathol. 1978; 45 : 518–539.
49. Shirasuna K. Oral lichen planus: Malignant potential and diagnosis. Oral Sci Int. 2014; 11 : 1–7.
50. Van der Meiji E, Van der Wall I. Lack of clinicopathological correlation in the diagnosis of oral lichen planus based on the presently available diagnostic criteria and suggestions for modifications. J Oral Pathol Med. 2003; 32(9), 507–512.
51. Gonzales-Moles MA, Scully C, Gil-Montoya JA. Oral lichen planus: controversies surrounding malignant transformation. Oral Dis. 2008; 14 : 229–243.
52. Mignogna MD, Lomuzio L, Favia G, Mignogna RE, Carbone R, Bucci E. Oral lichen planus and HCV infection: a clinical evaluation of 263 cases. Int J Dermatol. 1998; 37 : 575–578.
53. Gandolfo S, Richiardi L, Carrozzo M, Broccoletti R, Carbone M, Pagano M, Vestita C, Rosso S, Merletti F. Risk of oral squamous cell carcinoma in 402 patients with oral lichen planus: a follow-up study in an Italian population. Oral Oncol. 2004; 40 : 77–83.
54. Mattson U, Jontell M, Holmstrup P. Oral lichen planus and malignant transformation: is a recall of patients justified? Crit Rev Oral Biol Med. 2002; 13 : 390–396.
55. Greenberg M. AAOM Clinical Practise Statement, subject: Oral lichen planus and oral cancer, 2016.
56. Yang H, Wu Y, Ma H, Jiang L, Zeng X, Dan H, Zhou Y, Chen Q. Possible alternative therapies for oral lichen planus cases refractory to steroid therapies. Oral Surg Oral Med Oral Pathol Oral Radiol. 2016; 121 : 496–509.
57. Lodi G, Scully C, Carrozzo M, Griffiths M, Sugerman PB, Thongprasom K. Current controversies in oral lichen planus: report of an international consensus meeting. Part 1. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2005; 100 : 40–51.
58. Gutfreund K, Bienias W, Szewczyk A, Kaszuba A. Topical calcineurin inhibitors in dermatology. Postepy Dermatol Alergol. 2013; 30 : 65–169.
59. Georgakopoulou EA, Scully C. Systemic use of non-biologic agents in orofacial diseases: other immunomodulatory agents. Oral Dis. 2015; 21 : 273–282.
60. Wilken R, Veena MS, Wang MB, Srivatsan ES. Curcumin: a review of anti-cancer properties and therapeutic activity in head and neck squamous cell-carcinoma. Mol Cancer. 2011; 10 : 1–19.
61. Rai B, Kaur J, Jacobs R. Possible action mechanism for curcumin in pre-cancerous lesions based on serum and salivary markers of oxidative stress. J Oral Sci. 2010; 52 : 251–256.
62. Cafaro A, Arduino PG, Massolini G, Romagnoli E, Broccoletti R. Clinical evaluation of the efficiency of low-level laser therapy for oral lichen planus: a prospective case series. Lasers Med Sci. 2014; 29 : 185–190.
63. Carrozzo M. Oral health in patients with hepatitis C virus infection: an underestimated problem? Oral Dis. 2001; 7 : 267–270.
64. Krutschkoff DJ, Cutler L, Laskowski S. Oral lichen planus: the evidence regarding potential malignant transformation. J Oral Pathol. 1978; 7 : 1–7.
65. Fitzpatrick SG, Hirsch SA, Gordon SC. The malignant transformation of oral lichen planus and oral lichenoid lesions: a systema-tic review. J Am Dent Assoc. 2014; 145 : 45–56.
66. Cheng Y-SL, Gould A, Kurago Z, Fantasia J, Muller S. Diagnosis of oral lichen planus: a position paper of American Academy of Oral and Maxillofacial Pathology. Oral Surg Oral Med Oral Pathol Oral Radiol. 2016; 122 : 332–354.
67. Sarkar R, Chugh S, Garg VK. Acitretin in dermatology. Indian J Dermatol Venereol Leprol. 2013; 79 : 759–771.
68. Soto Araya M, Rojas Alcayaga G, Esguep A. Association between psychological disorders and the presence of oral lichen planus, burning mouth syndrom and recurrent aphthous stomatitis. Med Oral. 2004; 9 : 1–7.
69. Valentine-Thon E, Muller K, Guzzi G, Kreisel S, Ohnsorge P, Sandkamp M. LTT-MELISSA© is clinically relevant for detecting and monitoring metal sensitivity. Neuro Endocrinol Lett. 2006; 27 : 17–24.
70. Rai R, Dinakar D, Kurian SS, Bindoo YA. Investigation of contact allergy to dental materials by patch testing. Indian Dermatol Online J. 2014; 3 : 282–286.
71. Thongprasom K. Novel therapies for oral lichen planus. J Oral Pathol Med. 2013; 42 : 721–727.
72. Valentine-Thon E, Sandkamp M, Muller K, Guzzi G, Hartmann T. Metallsensibilisierung: nachweis, validierung und verlaufskontrolle mittels lymphocyten--transformations-test (LTT-MELISA©). OM Zs Orthomol Med. 2005; 20 : 12–15.
73. Gruppo Italiano Studi Epidemiologici in Dermatologia (GISED). Lichen planus and liver diseases: a multicente case-control study. BMJ; 300 : 227–230.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2019 Issue 4
Most read in this issue- PROBLEMATIKA ORÁLNÍHO LICHEN PLANUS – NYNĚJŠÍ POHLED
- Protetické ošetření chybějícího horního špičáku U implantátu s bukálním sklonem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

