-
Medical journals
- Career
Účinek extraktu Macleaya cordata (Willd) R.Br. na expresi markerů zánětu a oxidačního stresu v gingiválních fibroblastech
Authors: K. Chytilová 1; A. Galandáková 2; J. Pazdera 1; A. Rajnochová Svobodová 2; V. Šimánek 2
Authors‘ workplace: Klinika ústní, čelistní a obličejové chirurgie, LF UP a FN, Olomouc 1; Ústav lékařské chemie a biochemie LF UP, Olomouc 2
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 112, 2012, 2, s. 47-56
Category: Original Article – Experimental Study
Overview
Úvod:
Macleaya cordata (Willd.) obsahuje kvarterní benzo[c]fenanthridinové alkaloidy sanguinarin a chelerythrin. Alkaloidový extrakt M. cordata (MCE) je znám pro své antimikrobiální a protizánětlivé účinky a je užíván jako aktivní složka v přípravcích ústní hygieny.Cíl práce:
Práce se zabývá ověřením účinku MCE na zánětlivou reakci a oxidační stres vyvolaný v lidských gingiválních fibroblastech působením bakteriálního lipopolysacharidu (LPS).Materiál a metodika:
Účinek MCE (0,01–10 µg/ml) na viabilitu lidských gingiválních fibroblastů byl hodnocen stanovením inkorporace neutrální červeně do buněk. Netoxické koncentrace extraktu (0,25 a 0,5 µg/ml) byly použity pro studium vlivu MCE na hladinu redukovaného gluthathionu (GSH), produkci reaktivních kyslíkových sloučenin (ROS), expresi cyklooxygenázy-2 (COX-2) a interleukinu-6 (IL-6) v buňkách vystavených působení LPS.Výsledky:
Působením obsahových složek MCE došlo u gingiválních fibroblastů vystaveným LPS ke zvýšení intracelulárního GSH, snížení produkce ROS a k redukci exprese IL-6 a COX-2.Závěr:
Alkaloidový extrakt M. cordata potlačil zánětlivou reakci a oxidační stres v lidských gingiválních fibroblastech a může být prakticky využit při ošetření parodontitid a alveolitid.Klíčová slova:
Macleaya cordata – protizánětlivý účinek – antioxidační účinek – reaktivní kyslíkové sloučeniny – gluthathion – lipopolysacharid – interleukin-6 – cyklooxygenáza-2ÚVOD
Macleaya cordata (Willd), (Okecek srdčitý) patří do čeledi makovitých (Papaveraceae). Rostlina obsahuje biologicky aktivní látky zejména kvarterní benzo[c]fenanthridinové alkaloidy (KBA) [12]. M. cordata je po dlouhou dobu využívána pro své protizánětlivé a antimikrobiální vlastnosti v tradiční čínské medicíně. Její alkaloidový extrakt, sanguiritrin, je na Ukrajině a v evropské části Ruska používán jako antiseptikum u lidských a zvířecích kožních onemocněních. Extrakt z M. cordata (MCE) je aktivní složkou Sangrovitu®, který se ve státech EU používá jako aditivum do krmiv pro hospodářská zvířata. Hlavní alkaloidy obsažené v M. cordata, sanguinarin (SG) a chelerythrin (CHE), plní funkci fytoalexinů, tedy sekundárních metabolitů chránících rostlinu před působením patogenních mikroorganismů. U těchto alkaloidů byla prokázána inhibiční aktivita vůči širokému spektru gram-pozitivních a gram-negativních bakterií (Staphylococcus aureus, Enterococcus faecalis, Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis a Candida albicans), která je srovnatelná s gentamycinem. Vedle antimikrobiálního byl popsán také protizánětlivý účinek [5, 13, 25]. V klinických studiích bylo popsáno, že po aplikaci MCE dochází ke zmírnění zánětu gingivy [24]. Přestože jsou SG a CHE využívány v přípravcích ústní hygieny (Santoin), je stále diskutována jejich biobezpečnost. Jedna z prací poukazuje na skutečnost, že tyto alkaloidy by mohly být příčinou leukoplakie [6]. Studie prováděné in vivo, zaměřené na sledování genotoxicity a mutagenicity či onkogenetické studie naproti tomu tyto nežádoucí účinky nepotvrdily [15, 21].
Lidské gingivální fibroblasty jsou nejdůležitější buňky, které se podílí na tvorbě periodontální tkáně. Při vzniku gingivitidy, parodontitidy a alveolitidy dochází k produkci celé řady chemických mediátorů např. prostaglandinu E2 a zánětlivých cytokinů [1, 8]. V in vitro studiích se běžně jako modelový systém pro studium onemocnění periodoncia používají primární lidské gingivální fibroblasty, u nichž se k vyvolání zánětlivé reakce a stimulace tvorby mediátorů zánětu využívá intoxikace lipopolysacharidem (LPS) izolovaným z bakteriální stěny Porphyromonas gingivalis, Escherichia coli nebo Aggregatibacter actinomycetemcomitans [2, 11]. Inkubace gingiválních fibroblastů s LPS vede ke zvýšené produkci prozánětlivých cytokinů (interleukinu-1β (IL-1β), interleukinu-6 (IL-6), interleukinu-8, tumor nekrotizujícího faktoru-α (TNF-α)) a reaktivních kyslíkových sloučenin (ROS) [16, 23]. Prozánětlivé cytokiny (IL-1β a TNF-α) silně indukují expresi cyklooxygenázy-2 (COX-2), jejíž hladina je za normálních okolností velmi nízká. Prozánětlivé cytokiny pronikají při zánětlivé reakci v určitém množství do sliny pasivní filtrací a mohou tak ovlivňovat i vzdálenější část tkáně [7]. Při zvýšené produkci ROS tyto reaktivní sloučeniny atakují okolní molekuly včetně nenasycených mastných kyselin přítomných v biomembránách. Při jejich oxidaci vzniká řada dalších produktů jako je 4-hydroxynonenal, malondialdehyd a hydroxyalkény a je narušena integrita membrán. Pokud je lipidová peroxidace v rovnováze s tkáňovým gluthathionem (GSH) a jeho peroxidázou, k poškození membrán nedochází. Při parodontitidě se však produkty lipidové peroxidace hromadí a naopak klesá hladina antioxidantů včetně GSH, což může vést k destrukci postižené tkáně [10].
GSH je jedním z nejvýznamnějších buněčných antioxidantů. Je kofaktorem důležitých oxidoreduktáz a podílí se mimo jiné na odstraňování peroxidu vodíku a detoxikaci volných radikálů, čímž působí jako ochrana buněk před oxidačním stresem [10]. Z tohoto důvodu byla hladina intracelulárního GSH vybrána jako marker pro posouzení schopnosti MCE snížit oxidační poškození gingiválních fibroblastů, vyvolané působením LPS.
Tato práce se zaměřila na studium schopností alkaloidového extraktu M. cordata potlačit změny vyvolané v lidských gingiválních fibroblastech působením bakteriálního LPS. Experimenty sledovaly účinky na vybrané parametry oxidačního poškození a markery zánětu.
MATERIÁL A METODIKA
Materiál
Pro stanovení IL-6 byl použit specifický imunologický kit firmy R&D Systems (USA). Western blotting luminol reagent Solution A a Solution B, primární králičí protilátka pro detekci COX-2, primární kozí protilátka pro detekci aktinu (I-19), sekundární kozí a králičí protilátky konjugované s křenovou peroxidázou byly zakoupeny od firmy Santa Cruz Biotechnology (USA). Dihydrofluorescein acetát dodala firma Fluka Chemie (SRN) a 5,5´-dithio-bis(benzoovou kyselinu) firma Serva (SRN).
Dále byl použit proteázový inhibitor CompleteTM (Roche Diagnostic GmbH, SRN). Dulbecco’s modified Eagle’s medium (DMEM), L-glutamin, stabilizovaný roztok penicilinu se streptomycinem, sterilní dimethylsulfoxid (DMSO), roztok trypsin-EDTA, roztok trypanové modři a neutrální červeně (NČ) a další chemikálie, které dodala firma Sigma-Aldrich (USA).
Extrakt M. cordata
MCE (identifikační číslo 051044, obsahující 59,6 % KBA z toho 44,9 % SG a 14,7 % CHE) byl získán od firmy Phytobiotics Futterzusatzstoffe GmbH, Eltville (SRN).
Zásobní roztoky MCE (0,02–2 mg/ml) byly připraveny v DMSO a před aplikací na buňky byly naředěny v bezsérovém DMEM tak, aby výsledná koncentrace DMSO v médiu byla 0,5 % (v/v).
Buněčný model
Lidské gingivální fibroblasty byly izolovány ze zdravé gingivální tkáně získané od pacientů při chirurgických zákrocích, prováděných na Klinice ústní, čelistní a obličejové chirurgie, FN Olomouc. Odběry a zpracování byly prováděny se souhlasem etické komise FN a LF UP Olomouc. Všichni pacienti byli před odběrem tkáně poučeni o smyslu a cílech studie a podepsali informovaný souhlas. Izolace a kultivace lidských gingiválních fibroblastů se uskutečnila na Ústavu lékařské chemie a biochemie LF UP Olomouc a je podrobně popsána v práci Zdařilové a spol. [26].
Do experimentů byly buňky vysety na 6 - nebo 96jamkové kultivační desky a po dosažení 95% monovrstvy byly použity pro jednotlivá stanovení.
Stanovení životnosti buněk
Buňky na 96jamkové kultivační desce byly inkubovány s MCE (0,1; 0,25; 0,5; 1; 5 a 10 µg/ml; DMSO) v bezsérovém DMEM. Kontrolní buňky byly kultivovány v bezsérovém DMEM, obsahujícím DMSO (0,5%, v/v). Po 24hodinové inkubaci (37 °C; 5 % CO2) bylo médium s látkami odstraněno a byl aplikován roztok neutrální červeně (100 µl/jamka). Po čtyřech hodinách byl roztok neutrální červeně odstraněn, buňky byly opláchnuty roztokem formaldehydu (0,5%, v/v) s CaCl2 (0,125%, v/v) a následně lyzovány v 100 µl roztoku kyseliny octové (1%, v/v) v methanolu (50%, v/v). Po pěti minutách byla změřena absorbance při 540 nm (Sunrise, Tecan, Švýcarsko).
Vliv MCE na účinky vyvolané LPS v gingiválních fibroblastech
Buňky byly 24 hodin preinkubovány s LPS (1 nebo 10 µg/ml; sterilní voda), poté opláchnuty fosfátovým pufrem (PBS). Následně byl aplikován MCE (0,25 a 0,5 µg/ml; DMSO) v bezsérovém DMEM. Kontrolní buňky byly preinkubovány se sterilní vodou (místo LPS) a následně byl na buňky aplikován MCE (0,25 a 0,5 µg/ml; DMSO) nebo čisté DMSO (0,5%, v/v) v bezsérovém DMEM. Po čtyřhodinové inkubaci bylo odebráno médium pro stanovení IL-6. Buňky byly opláchnuty roztokem PBS a zpracovány pro stanovení hladiny GSH, produkce ROS a exprese COX-2.
Stanovení hladiny GSH
Po odstranění média a opláchnutí PBS byly buňky seškrabány do 1% HClO4 a homogenizovány ultrazvukem. Část vzorku byla odebrána pro stanovení proteinu dle Bradfordové [3]. Zbytek buněčné suspenze byl centrifugován (10 min, 13 000 rpm, 4 °C). Supernatant byl použit pro stanovení hladiny GSH, které je založeno na reakci GSH s 2,2´dinitro-5,5´dithiobenzoovou kyselinou za vzniku žlutého chromoforu, který je měřen spektrofotometricky při 412 nm [19].
Stanovení hladiny ROS
Ke sledování produkce ROS v buňkách byla použita pre-flourescenční sonda dihydrofluorescein acetát [17]. Po odstranění média byly buňky opláchnuty PBS a byl k nim aplikován dihydrofluorescein acetát (5 µmol/l, 30 min) v bezsérovém médiu. Poté byly buňky opláchnuty PBS, seškrabány do 1 ml PBS a homogenizovány ultrazvukem. Buněčný lyzát byl centrifugován (10 min, 13 000 rpm, 4 °C) a fluorescence supernatantu byla měřena při 500/525 nm (INFINITE M200, Tecan, Švýcarsko). Koncentrace proteinu byla stanovena podle Bradfordové [3].
Stanovení hladiny IL-6
Koncentrace IL-6 byla stanovena použitím specifického imunologického kitu (Quantikine®, R&D Systeme, USA). Test byl proveden podle protokolu dodaného výrobcem. Médium bylo naředěno (1 : 2) a aplikováno na 96jamkovou kultivační desku pokrytou specifickou monoklonální protilátkou. Po inkubaci (2 hod., pokojová teplota) bylo médium odstraněno a jamky opláchnuty promývacím pufrem (3krát). Následně byl aplikován roztok enzymaticky značené sekundární protilátky (2 hod., pokojová teplota). Poté byl roztok odstraněn, jamky opláchnuty promývacím pufrem (3krát) a byl přidán roztok substrátu. Po inkubaci (30 min., pokojová teplota, tma) byla reakce ukončena zastavovacím roztokem a změřena absorbance vzniklého produktu při 450 nm (Sunrise, Tecan, Švýcarsko).
Stanovení exprese COX-2
Buňky byly opláchnuty roztokem PBS a seškrabány do vychlazeného lyzačního pufru. Po inkubaci (15 min, 4 °C) byl lyzát centrifugován (14 000 rpm, 10 min, 4°C) a byla stanovena koncentrace proteinu dle Bradfordové [3]. Proteiny byly separovány s využitím elektroforézy na 10% SDS-polyacrylamidovém gelu a přeneseny na polyvinylidendifluoridovou membránu. Po přenosu byla membrána blokována (5% odtučněné mléko, Tris pufr (100 mmol/l; pH 7,5) s přídavkem 0,05% Tween-20 (TBS/T), 2 hod., pokojová teplota) a poté inkubována v primární protilátce proti COX-2 nebo aktinu (I-19) (5% odtučněné mléko v TBS/T, přes noc, 4 °C). Následně byla membrána promyta TBS/T a inkubována se sekundární králičí nebo kozí protilátkou značenou křenovou peroxidázou (5% odtučněné mléko v TBS/T, 2 hod., pokojová teplota). Exprese COX-2 a aktinu byla detekována chemiluminiscenčně (Western blotting luminol reagent) a zaznamenána na fotografický film.
Statistická analýza
Data jsou vyjádřena jako průměr ± SMODCH (směrodatná odchylka) ze tří nezávislých experimentů provedených v tripletech v každém pokusu. Pro statistickou analýzu byl použit Studentův t-test. Signifikance byla stanovena na hladině p < 0,01 (#) resp. p < 0,05 (*).
VÝSLEDKY
Životnost buněk
Buňky byly inkubovány s MCE v koncentračním rozmezí 0,1–10 µg/ml po 24 hodin. Z výsledků (graf 1) vyplývá, že koncentrace 0,1, 0,25 a 0,5 µg/ml výrazně neovlivňovaly životnost buněk (do 90 %) ve srovnání s kontrolními buňkami (DMSO). V koncentracích 1–10 µg/ml MCE signifikantně (p < 0,01) snížil viabilitu fibroblastů (25 % kontroly).
Graph 1. Vliv MCE na viabilitu gingiválních fibroblastů 
Buňky byly inkubovány s MCE (0,1-10 μg/ml) v bezsérovém médiu po dobu 24 hodin. Kontrolní buňky byly inkubovány s DMSO (0,5%; v/v). Data jsou vyjádřena jako průměr ± SMODCH. # hodnota je statisticky odlišná (p < 0,01) od kontroly. Pro studium protizánětlivých a antioxidačních vlastností MCE byly na základě inkorporace neutrální červeně do buněk vybrány koncentrace 0,25 a 0,5 µg/ml.
Vliv MCE na LPS vyvolané oxidační poškození
Inkubací buněk se samotným MCE (0,25 a 0,5 µg/ml, 4 hod.) nedošlo k ovlivnění bazální hladiny intracelulárního GSH (graf 2A). Naproti tomu u buněk inkubovaných s LPS (1 µg/ml, 24 hod.) došlo k výraznému snížení hladiny GSH (graf 2B). Po aplikaci MCE (0,25 a 0,5 µg/ml, 4 hod.) na buňky preinkubované s LPS došlo ke zpětnému zvýšení intracelulárního GSH (graf 2B) u obou testovaných koncentrací MCE. Nicméně protekce byla signifikantní (p < 0,05) pouze u nižší koncentrace MCE (0,25 µg/ml).
Graph 2. Vliv MCE na hladinu GSH v lidských gingiválních fibroblastech po preinkubaci buněk s LPS 
Gingivální fibroblasty byly (A) inkubovány s MCE (0,25 a 0,5 μg/ml) po dobu 4 hodin nebo (B) preinkubovány s LPS (1 μg/ml) po dobu 24 hodin a poté byl aplikován MCE (0,25 a 0,5 μg/ml, 4 hod.). Kontrolní buňky byly inkubovány s DMSO (0,5%; v/v). Data jsou vyjádřena jako průměr ± SMODCH. * p < 0,05 je statisticky odlišná od buněk inkubovaných s LPS. Dřívější studie rovněž prokázaly, že LPS stimuluje produkci ROS [11]. Pro potvrzení schopnosti MCE snížit oxidační poškození buněk, vyvolané působením LPS, byla hodnocena hladina ROS v lidských gingiválních fibroblastech. Jak je patrné z grafu 3A, MCE v použitých koncentracích (0,25 a 0,5 µg/ml, 4 hod.) neovlivnil hladinu ROS. U buněk vystavených účinkům LPS (1 µg/ml, 24 hod.) došlo k výraznému zvýšení produkce ROS (graf 3B). Aplikace MCE (0,25 a 0,5 µg/ml, 4 hod.) k buňkám preinkubovaným s LPS měla za následek redukci tvorby ROS v závislosti na koncentraci MCE (graf 3B).
Graph 3. Vliv MCE na produkci ROS v lidských gingiválních fibroblastech stimulovanou LPS 
Gingivální fibroblasty byly (A) inkubovány s MCE (0,25 a 0,5 μg/ml) po dobu 4 hodin nebo (B) preinkubovány s LPS (1 μg/ml) po dobu 24 hodin a poté byl aplikován MCE (0,25 a 0,5 μg/ml, 4 hod.). Kontrolní buňky byly inkubovány s DMSO (0,5%; v/v). Data jsou vyjádřena jako průměr ± SMODCH. # hodnota je statisticky odlišná (p < 0,01) od buněk inkubovaných s LPS.
Vliv MCE na zánětlivé markery stimulované LPS v lidských gingiválních fibroblastech
IL-6 je známý prozánětlivý protein, který je zapojený do mnoha dějů imunitního systému. Je produkován gingiválními fibroblasty při odpovědi na zánětlivé stimuly [16]. Z grafu 4A je patrné, že MCE (0,25 a 0,5 µg/ml, 4 hod.) nesignifikantně zvýšil bazální hladinu IL-6 v gingiválních fibroblastech. Inkubace buněk s LPS (10 µg/ml, 24 hod.) vedla k šestinásobnému zvýšení hladiny IL-6 v porovnání s hladinou tohoto proteinu v kontrolních buňkách (graf 4B). Po aplikaci MCE (0,25 a 0,5 µg/ml, 4 hod.) na buňky stimulované LPS bylo pozorováno signifikantní (p < 0,05) snížení hladiny IL-6 (graf 4B). Zvýšení hladiny IL-6 nezáviselo na koncentraci MCE.
Graph 4. Vliv MCE na expresi IL-6 v lidských gingiválních fibroblastech stimulovanou LPS 
Gingivální fibroblasty byly (A) inkubovány s MCE (0,25 a 0,5 μg/ml) po dobu 4 hodin nebo (B) preinkubovány s LPS (10 μg/ml) po dobu 24 hodin a poté byl aplikován MCE (0,25 a 0,5 μg/ml, 4 hod.). Kontrolní buňky byly inkubovány s DMSO (0,5%; v/v). Data jsou vyjádřena jako průměr ± SMODCH. * hodnota je statisticky odlišná (p < 0,05) od buněk inkubovaných s LPS. COX-2 se fyziologicky v tkáních sice nevyskytuje, ale jeho tvorba je indukována působením zánětlivých faktorů. Enzym následně katalyzuje tvorbu prostaglandinů, které se podílí na rozvoji zánětu. LPS (10 µg/ml, 24 hod.) výrazně stimuluje expresi COX-2 (obr. 1, sloupec 1) v porovnání s kontrolními buňkami, které účinkům LPS nebyly vystaveny (sloupec 2). Po aplikaci MCE (0,25 a 0,5 µg/ml, 4 hod.) na buňky preinkubované s LPS došlo k výraznému poklesu exprese COX-2, a to v obou testovaných koncentracích MCE (sloupec 3 a 4).
Image 1. Vliv MCE na expresi COX-2 stimulovanou LPS v gingiválních fibroblastech 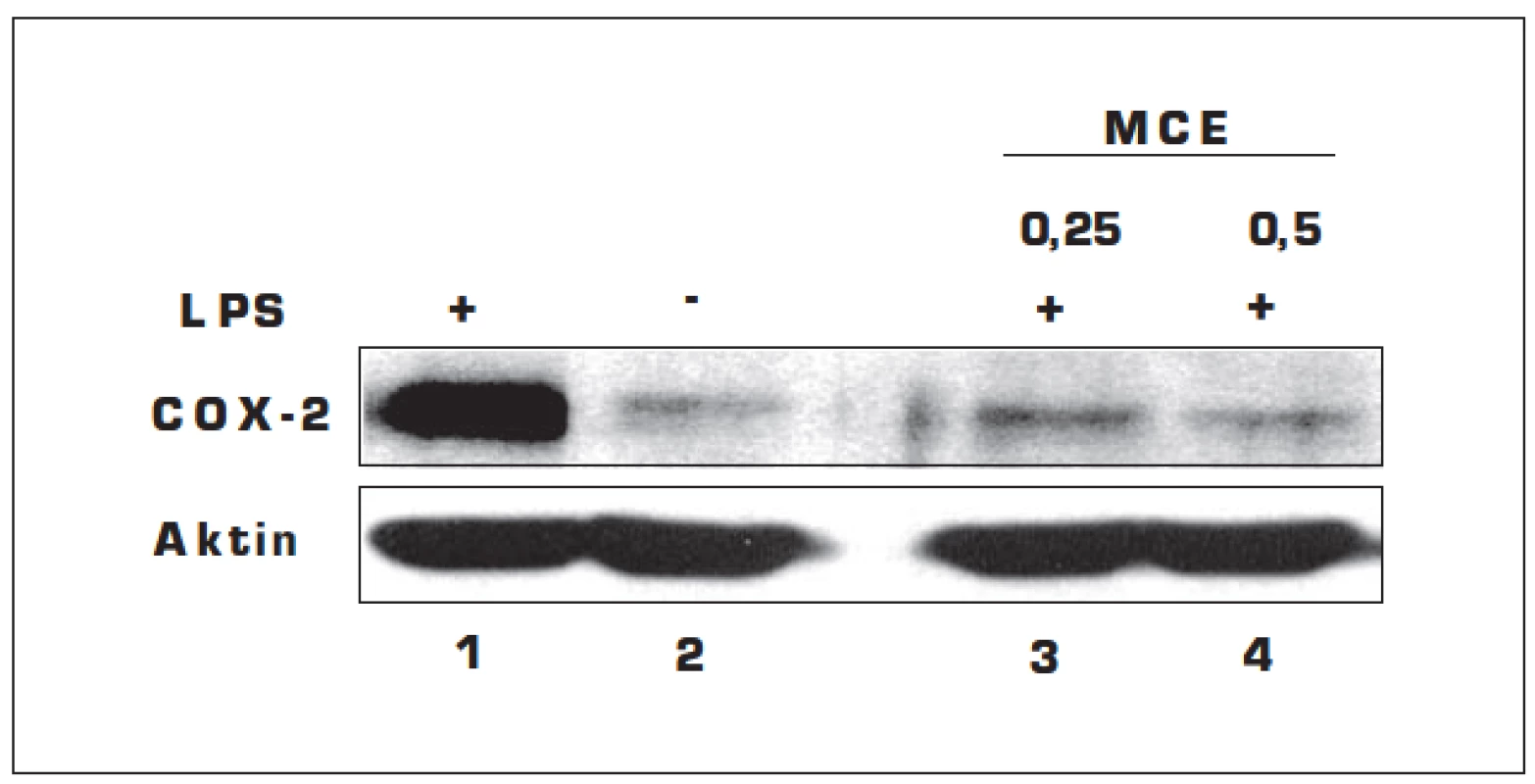
Gingivální fibroblasty byly preinkubovány s LPS (10 μg/ml) po dobu 24 hod. a poté inkubovány s MCE (0,25 a 0,5 μg/ml, 4 hod.). Kontrolní buňky byly inkubovány s DMSO (0,5%; v/v). Data jsou reprezentativním výsledkem ze tří nezávislých experimentů. DISKUSE
Zánětlivá onemocnění parodontu, zejména gingivitidy, jsou velmi rozšířená a postihují značnou část populace na celém světě. Průběh a rozsah zánětlivého onemocnění gingivy závisí na kvantitě plaku, virulenci mikroorganismů a imunitním systému pacienta. V posledních letech se ukázalo, že prevence gingivitidy a parodontitidy je úspěšná, jestliže se provádí důkladně a trvale. Nicméně mechanické odstraňování plaku není vždy stoprocentně účinné. Z tohoto důvodu je již dlouhou dobu cílem vyvinout přípravek, který by inhiboval tvorbu plaku. Za tímto účelem byla studována antimikrobiální a protizánětlivá aktivita mnoha čistých látek/směsí.
V současné době jsou při léčbě těžkých zánětů, kdy po počáteční terapii nedojde ke zlepšení stavu, podávána nesteroidní antiflogistika. Řada studií prokázala, že jejich podávání zabraňuje tvorbě plaku a tedy i zánětu gingivy. Naproti tomu bylo zjištěno, že tyto nesteroidní léky mají řadu nežádoucích vedlejších účinků (např. způsobují dysfunkci gastrointestinálního traktu), které limitují jejich dlouhodobé používání [18]. In vitro a in vivo studie ukazují, že některé skupiny přírodních látek mají schopnost potlačovat tvorbu mikrobiálního plaku a mohou být použity k prevenci vzniku parodontálních onemocnění [2]. Mezi tyto látky patří i SG. U extraktu z M. cordata jsme studovali schopnost potlačit oxidační poškození a zánětlivou reakci vyvolanou působením bakteriálního LPS na lidské gingivální fibroblasty. Výsledky potvrdily, že MCE obnovuje hladinu redukovaného GSH a snižuje produkci ROS vyvolanou působením bakteriálního LPS. Aplikace MCE potlačuje expresi IL-6 a inducibilní formy COX-2.
Parodontální onemocnění jsou spojena se zvýšenou produkcí reaktivních kyslíkových sloučenin (ROS) [4, 23]. ROS, vznikající působením aktivovaných neutrofilů, mají dvojí účinek. Snižují zánětlivé působení patogenních mikroorganismů a naproti tomu jejich zvýšená koncentrace působí oxidační poškození tkáňových lipidů, proteinů a DNA. Gingivální fibroblasty jsou vybaveny enzymatickým a neenzymatickým systémem, který slouží k obraně buněk před oxidačním poškozením. Nejvýznamnějším intracelulárním antioxidantem podílejícím se na udržení redoxního stavu buněk je GSH. U buněk preinkubovaných s LPS jsme po aplikaci MCE (0,25 µg/ml) zaznamenali zpětné zvýšení hladiny intracelulárního GSH. Rovněž došlo k statisticky významnému snížení produkce ROS (0,5 µg/ml MCE). Výsledky korelují s výsledky Slunské a spol. [20], kteří prokázali snížení generování ROS účinkem SG. Byly publikovány také práce, které poukazují na pro-oxidační účinky SG [14]. Tyto studie však byly provedeny na nádorových buněčných liniích s SG v několikanásobně vyšší koncentraci (1,8 µg/ml) než byla koncentrace SG (0,25 µg/ml) v námi testovaném extraktu.
Dalším průvodním jevem parodontálního onemocnění je zánětlivá reakce postižené tkáně, na které se výrazně podílí gingivální fibroblasty. Regulace produkce prozánětlivých molekul představuje další nadějnou strategii v léčbě/regulaci onemocnění parodontu [22]. Řada klinických studií se zabývala studiem protizánětlivé aktivity extraktu ze S. canadensis s obsahem SG nebo zubních past a ústních vod obsahujících tuto složku [9, 24]. Přestože SG a extraktům obsahujícím tento alkaloid je připisována protizánětlivá aktivita, dosud neexistuje žádná studie, která by se podrobněji zabývala přímo mechanismem jeho působení na markery zánětu. Jeho protizánětlivý účinek je spojován s jeho antimikrobiální aktivitou. Naše experimenty prokázaly, že MCE v obou testovaných koncentracích (0,25 a 0,5 µg/ml) signifikantně snižoval produkci IL-6. Tento cytokin je hojně produkován v zanícené tkáni a stimuluje gingivální fibroblasty k produkci kolagenolytických enzymů, což má za následek destrukci postižené tkáně [22]. MCE rovněž výrazně inhiboval expresi COX-2, stimulovanou v gingiválních fibroblastech bakteriálním LPS.
ZÁVĚR
Výsledky in vitro studie ukázaly, že MCE potlačoval účinky stimulované působením LPS v lidských gingiválních fibroblastech snížením produkce ROS, obnovením tvorby intracelulárního GSH a snižoval expresi IL-6 a COX-2. Výsledky potvrdily, že potlačením zánětlivé reakce a oxidačního stresu, může být MCE prospěšný pro prevenci a léčbu zánětlivých onemocnění ústní sliznice. Protizánětlivé účinky MCE jsme ověřili při léčbě zánětů zubního lůžka po extrakci dolních třetích molárů. Výsledky klinické části studie budou předmětem dalšího sdělení.
Seznam zkratek:
COX-2: cyklooxygenáza-2
DMEM: Dulbeccoem modifikované Eaglovo médium
DMSO: dimethylsulfoxid
GSH: gluthathion
CHE: chelerythrin
IL-1: interleukin-1β
IL-6: interleukin-6
KBA: kvarterní benzo[c]fenanthridinové alkaloidy
LPS: lipopolysacharid
MCE: extrakt z Macleaya cordata
NČ: neutrální červeň
ROS: reaktivní kyslíkové sloučeniny
SG: sanguinarin
SMODCH: směrodatná odchylka
TNF-α: tumor nekrotizující faktor-α
Poděkování
Práce byla podpořena grantem MŠMT (MSM 6198959216).
MUDr. Karin Chytilová
Klinika ústní, čelistní a obličejové chirurgie LF UP a FNO
I. P. Pavlova 6
775 20 Olomouc
e-mail: karin.chytilova@seznam.cz
Sources
1. Ara, T., Kurata, K., Hirai, K., Uchihashi, T., Uematsu, T., Imamura, Y., Furusawa, K., Kurihara, S., Wang, P. L.: Human gingival fibroblasts are critical in sustaining inflammation in periodontal disease. J. Periodont. Res., roč. 44, 2009, č. 1, s. 21–27.
2. Ara, T., Honjo, K., Rujánami, Y., Hattori, T., Imamura, Y., Wang, P. L.: Preventive effects of a kampo medicine, orento on inflammatory responses in lipopolysaccharide treated human gingival fibroblasts. Biol. Pharm. Bull., roč. 33, 2010, č. 4, s. 611–616.
3. Bradford, M. M.: A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., roč. 72, 1976, s. 248–254.
4. Canakçi, C. F, Cilek, Y., Canakçi, V.: Reactive oxygen species and human inflammatory periodontal diseases. Biochemistry Mosc., roč. 70, 2005, č. 6, s. 619–628.
5. Černá, H., Fiala, B., Lenfeld, J., Maršálek, E., Preininger, V., Šimánek, V.: Isoquinoline alkaloids in local periodontal disease therapy (preliminary notice). Acta Univ. Palacki Olomouc Fac. Med., roč. 107, 1984, 159–162.
6. Damm, D. D., Curran, A., White, D. K., Drummond, J. F.: Leukoplakia of the maxillary vestibule – an association with Viadent? Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., roč. 87, 1999, č. 1, s. 61–66.
7. Dušková, J., Broukal, Z.: Slinné markery pro onemocnění parodontu a dalších orgánů. Čes. Stomat., roč. 109, 2009, č. 3, s. 43–47.
8. Graves, D.: Cytokines that promote periodontal tissue destruction. J. Periodontol., roč. 79, 2008, č. 8 Suppl., s. 1585–1591.
9. Hannah, J. J., Johnson, J. D., Kuftinec, M. M.: Long-term clinical evaluation of toothpaste and oral rinse containing sanguinaria extract in controlling plaque, gingival inflammation, and sulcular bleeding during orthodontic treatment. Am. J. Orthod. Dentofacial. Orthop., roč. 96, 1989, č. 3, s. 199–207.
10. Holeček, V., Mašek, V., Hecová, H., Zicha, A., Netolický, J.: Volné radikály a antioxidanty. Čes. Stomat., roč. 108, 2008, č. 1, s. 20–23.
11. Kim do, Y., Jun, J. H., Lee, H. L., Woo, K. M., Ryoo, H. M., Kim, G. S., Baek, J. H., Han, S. B.: N-acetylcysteine prevents LPS-induced pro-inflammatory cytokines and MMP2 production in gingival fibroblasts. Arch. Pharm. Res., roč. 30, 2007, č. 10, s. 1283–1292.
12. Kosina, P., Gregorová, J., Gruz, J., Vacek, J., Kolář, M., Vogel, M., Roos, W., Neumann, K., Šimánek, V., Ulrichová, J.: Phytochemical and antimicrobial characterization of Macleaya cordata herb. Fitoterapia., roč. 81, 2010, č. 8, 1006–1012.
13. Lenfeld, J., Kroutil, M., Maršálek, E., Slavík, J., Preininger, V., Šimánek, V.: Antiinflammatory activity of quaternary benzophenanthridine alkaloids from Chelidonium majus. Planta Med., roč. 43, 1981, č. 2, 161–165.
14. Malíková, J., Zdařilová, A., Hlobilková, A.: Effects of sanguinarine and chelerythrine on the cell cycle and apoptosis. Biomed. Pap. Med. Fac. Univ. Palacki Olomouc Czech Repub., roč. 150, 2006, č. 1, 5–12.
15. Munro, I. C., Delzell, E. S., Nestmann, E. R., Lunch, B. S.: Viadent usage and oral leukoplakia: a spurious association. Regul. Toxicol. Pharmacol., roč. 30, 1999, č. 3, s. 182–196.
16. Okada, H., Murakami, S.: Cytokine expression in periodontal health and disease. Crit. Rev. Oral Biol. Med., roč. 9, 1998, s. 248–266.
17. Royall, J. A., Ischiropoulos, H.: Evaluation of 2`,7`-dichlorofluorescin and dihydrorhodamine 123 as fluorescent probes for intracellular H2O2 in cultured endothelial cells. Arch. Biochem. Biophys., roč. 302, 1993, s. 348–355.
18. Salvi, G. E., Lang, N. P.: Host response modulation in the management of periodontal diseases. J. Clin. Periodontol., roč. 32, 2005, č. 6 Suppl., s. 108–129.
19. Sedlak, J., Lindsay, R. H.: Estimation of total, protein-bound, and nonprotein sulfhydryl groups in tissue with Ellman‘s reagent. Anal. Biochem., roč. 26, 1968, s. 192–205.
20. Slunská, Z., Gelnarová, E., Hammerová, J., Táborská, E., Slaninová, I.: Effect of quaternary benzo[c]phenanthridine alkaloids sanguilutine and chelilutine on normal and cancer cells. Toxicol. In Vitro., roč. 24, 2010, č. 3, s. 697–706.
21. Stiborová, M., Vostálová, J., Zdařilová, A., Ulrichová, J., Hudeček, J., Tschirner, K., Šimánek, V.: Macelaya cordata extrakt and Sangrovit genotoxicity. Assessment in vivo. Biomed. Pap. Med. Fac. Univ. Palacki Olomouc Czech Repub., roč. 152, 2008, č. 1, s. 35–39.
22. Takashiba, S., Naruishi, K., Murayama, Y.: Perspective of cytokine regulation for periodontal treatment: fibroblast biology. J. Periodontol., roč. 74, 2003, č. 1, s. 103–110.
23. Waddington, R. J., Moseley, R., Embery, G.: Reactive oxygen species: a potential role in the pathogenesis of periodontal diseases. Oral Dis., roč. 6, 2000, č. 3, s. 138–151.
24. Walterová, D., Ulrichová, J., Válka, I., Vičar, J., Vavrečková, C., Táborská, E., Harjrader, R. J., Meyer, D. L., Černá, H., Šimánek, V.: Benzo[c]phenanthridine alkaloids sanguinarine and chelerythrine: biological activities and dental care applications. Acta Univ. Palacki Olomouc Fac. Med., roč. 139, 1995, 7–16.
25. Zdařilová, A., Malíková, J., Dvořák, Z., Ulrichová, J., Šimánek, V.: Kvartérní isochinolinové alkaloidy sanguinarin a chelerythrin. Účinky in vitro a in vivo. Chem. listy, roč. 100, 2006, s. 30–41.
26. Zdařilová, A., Rajnochová Svobodová, A., Chytilová, K., Šimánek, V., Ulrichová, J.: Polyphenolic fraction of Lonicera caerulea L.fruits reduces oxidative stress and inflammatory markers induced by lipopolysaccharide in gingival fibroblasts. Food Chem. Toxicol., roč. 48, 2010, č. 6, s. 1555–1561.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2012 Issue 2-
All articles in this issue
- Účinek extraktu Macleaya cordata (Willd) R.Br. na expresi markerů zánětu a oxidačního stresu v gingiválních fibroblastech
- Vliv povrchové úpravy kompozitní výplně na dlouhodobou životnost vazby při její opravě
- Použití nitrokostních miniimplantátů k retenci celkových snímatelných náhrad. Dvouletá studie
- Dlaždicobuněčný karcinom ústní sliznice a rtu v dokumentaci Stomatologické kliniky LF UK a FN v Hradci Králové v letech 1988–2008
- Tvorba alveolární kosti pohybem zubu
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Tvorba alveolární kosti pohybem zubu
- Dlaždicobuněčný karcinom ústní sliznice a rtu v dokumentaci Stomatologické kliniky LF UK a FN v Hradci Králové v letech 1988–2008
- Vliv povrchové úpravy kompozitní výplně na dlouhodobou životnost vazby při její opravě
- Účinek extraktu Macleaya cordata (Willd) R.Br. na expresi markerů zánětu a oxidačního stresu v gingiválních fibroblastech
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

