-
Medical journals
- Career
Rastlinné inhibítory α-amylázy a ich vplyv na využiteľnosť polysacharidov obsiahnutých v strave
: Slavomír Kurhajec; Aleš Franc
: Čes. slov. Farm., 2019; 68, 148-156
: Review Articles
S rozvojom civilizačných chorôb, ako je diabetes mellitus, metabolický syndróm, prípadne obezita, rastie aj úsilie nachádzať nové liečivá predovšetkým z prírodných zdrojov. Patria medzi ne aj inhibítory α-amylázy, enzýmu, ktorý v tele zdravého človeka štiepi polysacharidy na jednoduchšie cukry. Vzhľadom k tomu, že toto štiepenie ovplyvňuje glykémiu, ktorú je snaha terapeuticky meniť, vzrastá aj záujem o tieto látky. Tento prehľadový článok mapuje druhy inhibítorov amylázy vrátane ich prírodných zdrojov.
Klíčová slova:
inhibítory amylázy – α-amyláza – rastlinné inhibítory – štiepenie škrobu
Metabolizmus polysacharidov a α-amyláza
K tomu, aby vôbec došlo k resorbcii polysacharidov z gastrointestinálneho traktu do krvného riečiska, musí najskôr prebehnúť ich premena na monosacharidy. Tento dej sa odohráva pomocou dvoch hlavných enzýmov. Jedným z nich je amyláza, glykoproteín patriaci do skupiny α-1,4-glukozidáz. Je lokalizovaný v slinách a v tráviacej šťave, ktorú do tenkého čreva vylučuje pankreas. Katalyzuje hydrolytickú degradáciu polysacharidov, a to škrobu (amylózy i amylopektínu) a v potrave obsiahnutého glykogénu. Naštiepením α-1,4-glykozidických väzieb vznikajú rôzne produkty ako maltóza, izomaltóza, maltotrióza, no predovšetkým dextríny. Tie sú tvorené značne vetvenými molekulami s minimálne piatimi glukózovými jednotkami. α-amyláza nedokáže štiepiť α-1,6-glykozidické a ani β-1,4--glykozidické väzby celulózy. Jej účinok stabilizujú ióny vápnika a chloridové, bromidové, jodidové či dusičnanové anióny zvyšujú aktivitu tohto enzým21).
Trávenie polysacharidov už teda začína v ústnej dutine prostredníctvom slinnej amylázy. Tá je schopná naštiepiť asi len 5 % škrobu obsiahnutého v potrave. Jeho trávenie v žalúdku už ďalej neprebieha, nakoľko sa pri pH nižšom než 3,5 úplne inaktivuje2, 3). Zvyšné kyseliny obsiahnuté v žalúdočnej trávenine sú neutralizované bikarbonátom, ktorý do tenkého čreva vylučuje pankreas. Tejto neutralizácii napomáha aj alkalický hlien pokrývajúci povrch tenkého čreva. Výkyvy v hodnotách pH, ktorým je trávenina vystavená, slúžia k jej lepšiemu spracovaniu a zefektívňujú tak aj činnosť vyššie spomínaných enzýmov2). Amyláza pankreatickej šťavy v porovnaní s amylázou slín je síce o niečo účinnejšia, avšak zo štrukturálneho hľadiska je s ňou viac-menej zhodná. Rozdielna účinnosť sa vysvetľuje tým, že pH pankreatickej šťavy sa takmer zhoduje s optimálnym pH enzýmu (6,8–7,1)4). Ďalším enzýmom, ktorý sa uplatňuje pri trávení sacharidov je α-glukozidáza. Nachádza sa v kefkovom leme buniek mikroklkov, v sliznici tenkého čreva. Vyvoláva rozklad všetkých oligosacharidov s obsahom glukózy naviazanej α-glykozidovou väzbou na akúkoľvek hexózu. V organizme sa uplatňuje pri hydrolýze disacharidov, predovšetkým sacharózy, maltózy či laktózy. Z produktov štiepneho procesu polysacharidov, ktoré nachádzame na konci duodena sú najviac zastúpené doposiaľ nehydrolyzované disacharidy (α-maltóza, sacharóza) a pochopiteľne aj nestráviteľné sacharidy (celulóza, pektín)5). Nestrávené zvyšky vysokomolekulárneho škrobu a glykogénu z potravy ako posledná štiepi glukoamyláza, ktorá z neredukujúceho konca odstraňuje koncové jednotky glukózy. Vzniknuté monosacharidy organizmus už dokáže absorbovať. Zaujímavosťou je, že slinná amyláza úplne chýba u malých detí a niektorých zvierat ako pes, mačka, kôň a vtáky, no napriek tomu to pre ne nepredstavuje žiadne závažné ťažkosti v trávení6, 7).
Inhibtory α-amylázy
K najznámejším inhibítorom α-amylázy patrí akarbóza. V mnohých štúdiách je považovaná za štandard pri hodnotení inhibičného účinku rozličných látok na tento enzým8). Jedná sa o aminocyklitolovú zlúčeninu, u ktorej bol zaznamenaný účinok aj na α-glukozidázu. Zo štrukturálneho hľadiska je pseudotetrasacharidom zahŕňajúcim jeden atóm dusíka. K jej prednostiam patrí to, že sa po perorálnom podaní vôbec nevstrebáva a pôsobí tak len v zažívacom trakte, kde kompetitívne inhibuje oba vyššie spomínané enzýmy. Nakoľko je produkovaná vláknitými baktériami (Actinoplanes sp. a Streptomyces diastaticus) dá sa považovať za prírodnú látku9). Používa sa u diabetických pacientov na zníženie výkyvov postprandiálnej glykémie a nakoľko pomáha redukovať nadváhu, je v kombinácii s racionálnou stravou mimoriadne vhodná pre obéznych diabetikov10). Po požití preparátov na báze akarbózy sa často stretávame so zvýšenou produkciou črevných plynov, čo samozrejme súvisí s malabsorpciou sacharidov a s činnosťou baktérií. Nežiaduce účinky, ku ktorým patrí nauzea, flatulencia a hnačky, sa u pacientov objavujú predovšetkým pri nedodržaní diétnych opatrení11). V kultúre Streptomyces dimorphogenes boli nájdené zložky so štruktúrou pseudosacharidov tak isto s viazaným dusíkom. Jedná sa o zlúčeniny označované ako trestatín A, B, C12). Sú to účinné inhibítory, o ktorých sa špekuluje, že by mohli v terapii nahradiť akarbózu a zmierniť tak jej nežiadúce účinky. K sekundárnym metabolitom kultúry Streptomyces coelico flavus zg0656 okrem iného spadajú aj akarvirostatíny13). Patria do skupiny trestatínov a tak isto vykazujú inhibičný účinok na α-amylázu14). V súčastnosti sa uvažuje o zavedení medikovaných potravín s obsahom inhibítorov α-glukozidázy, čo by mohlo pohodlne a bezpečne znížiť postprandiálnu hyperglykémiu diabetických pacientov. V poslednej dobe sa pozornosť venuje skôr rastlinným derivátom opísaným nižšie15).
Rastlinné inhibitory α-amylázy
Rastliny v rámci svojho metabolizmu produkujú široké spektrum látok, ktoré im pomáha chrániť sa pred škodcami16). Niektoré druhy dokážu produkovať aj inhibítory α-amylázy, o čom svedčia testy in vitro vykonané na rozličných extraktoch17). Keďže ide o rôznorodé látky a každá má o čosi inú rozpustnosť, účinok rastlinného výťažku na enzým závisí aj od rozpúšťadla, ktoré sa použilo pri jeho príprave. V experimentoch sa zvyknú používať metanolové, etanolové, chloroformové, prípadne etylacetátové výluhy, no pomerne často sa stretávame s metodikou, ktorá pracuje s vodnými výťažkami s prídavkom pufru. Najlepšie inhibičné účinky vykazovali extrakty z rastlín ako Amaranthus caudatus L. (Amaranthaceae), Cajanus cajan Millsp. (Fabaceae), Tamarindus indica L. (Fabaceae), Hibiscus sabdarifa L. (Malvaceae), Psidium guajava L. (Myrtaceae), Syzygium cumini Skeels. (Myrtaceae), Bergenia ciliata Sternb. (Saxifragaceae). Z druhov, ktoré sú na našom území prirodzené, alebo sa tu umelo vysádzajú ako okrasné rastliny je možné spomenúť Ginkgo biloba L. (Ginkgoaceae), kde etanolový extrakt z listov o koncentrácii 50 mg/ml vykazoval až 70% schopnosť inhibovať α-amylázu. Vodný výluh vňate Taraxacum officinale Wigg. (Asteraceae) o koncentrácii 200 mg/ml dokáže spomínaný enzým inhibovať v intervale od 20 do 45 %. Vodný výťažok z listov druhu Vaccinium myrtillus L. (Ericaceae) s koncentráciou 200 mg/ml preukázal 75% inhibíciu. Vodný extrakt z Rosmarinus officinalis L. (Lamiaceae), ktorého koncentrácia je 200 mg/ml dokáže inhibovať α-amylázu s účinnosťou 60 %. Inhibícia vodného extraktu pripraveného z oplodia Phaseolus vulgaris L. (Fabaceae) s koncentráciou 200 mg/ml sa pohybovala od 45 do 75 %18). Inhibítory niektorých rastlín vykazujú rozdielnu afinitu k slinnej a rozdielnu afinitu k pankreatickej α-amyláze. Tento jav bol pozorovaný na roztoku inhibítora α-amylázy získaného zo semien prosa, Panicum miliaceum L. (Poaceae). Takéto látky by sa teoreticky mohli využiť na odlíšenie slinnej a pankreatickej amylázy v diagnostike séra19). Poznáme už aj konkrétne molekuly, ktoré priamo zodpovedajú za účinok spomínaných extraktov. Ide predovšetkým o látky polyfenolickej povahy, kde za vysokú inhibičnú aktivitu priamo zodpovedajú zlúčeniny s väčším počtom hydroxylových skupín. Inhibítory amylázy je možné podľa štruktúry rozdeliť na neproteínové a proteínové20).
Inhibítory s neproteínovou štruktúrou
K rastlinným inhibítorom nebielkovinového typu patria organické zlúčeniny rôznorodej chemickej štruktúry, no najčastejšie sa jedná o látky patriace k flavonoidom, prokyanidínom a antokyánom, trieslovínám, terpenoidom, alebo to môžu byť rozmanité druhy organických kyselín, akou je kyselina ibišková. Nebielkovinovú štruktúru majú aj cyklodextríny (α-, β - a γ-)18, 20).
Flavonoidy
V pokusoch mali zlúčeniny ako luteolín, myricetín a kvercetín pomerne výrazný inhibičný účinok na prasaciu pankreatickú α-amylázu (IC50 dosahovala hodnoty menšie než 500 µmol)21). Sila inhibičného účinku flavonolov a flavónov priamo závisí od množstva hydroxylových skupín na B-kruhu. Pri interakcii dochádza k vytvoreniu vodíkových väzieb medzi hydroxylovými skupinami flavonoidu v pozícii R6, R7 a-kruhu a R4´ alebo R5´ kruhu B spolu s katalytickými zvyškami väzobného miesta enzýmu. Zároveň sa pri tomto procese vytvorí konjugovaný π-systém, ktorý celý vzniknutý komplex stabilizuje18, 22). Pri podrobnejšom zaoberaní sa vzťahom medzi štruktúrou a účinkom bolo dokázané, že dvojitá väzba C2–C3, 5-OH, väzba s B kruhom v polohe TRI a substitúcia hydroxylom na B-kruhu zväčšuje inhibičnú aktivitu, zatiaľ čo 3-OR ju redukuje21). Najnovšia literatúra sa orientuje na štúdium zložitejších derivátov flavonoidových štruktúr s obsahom transchalkónov23) (obr. 1, tab. 1).
1. Inhibičný účinok najčastejšie opisovaných flavonoidov na prasaciu pankreatickú α-amylázu21) 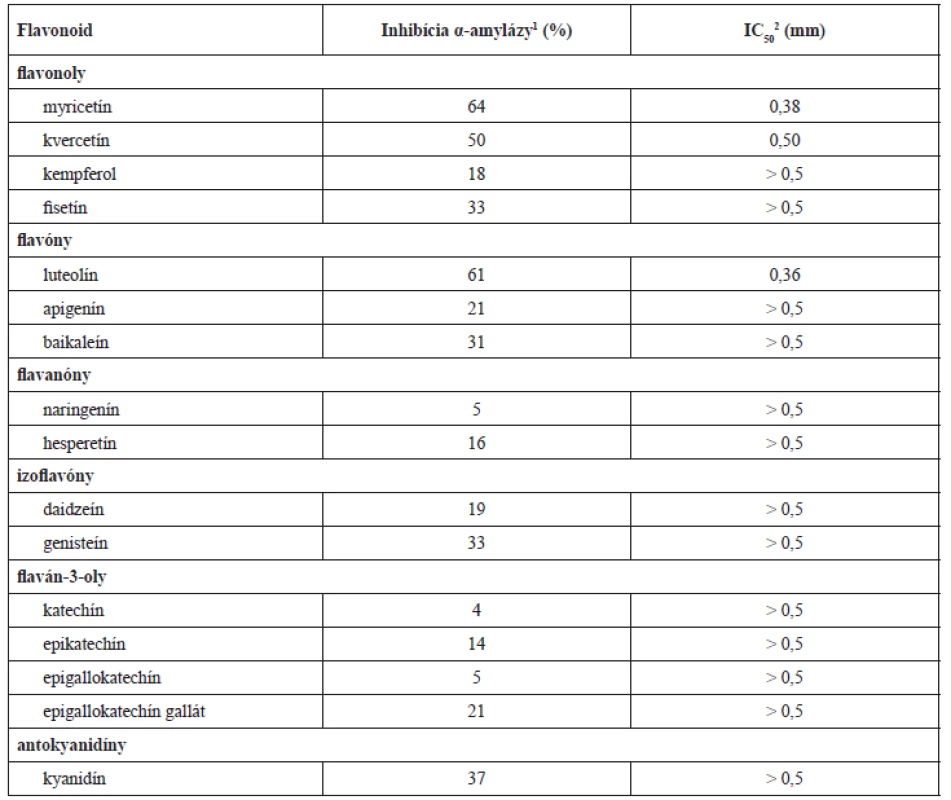
1Je stanovená pri koncentrácii 0,5 mmol ⸱ dm–3 príslušného flavonoidu. 2IC50 je koncentrácia ktorej zodpovedá 50 % inhibície enzýmovej aktivity pri určitých podmienkach. 1. Základný skelet flavonoidov 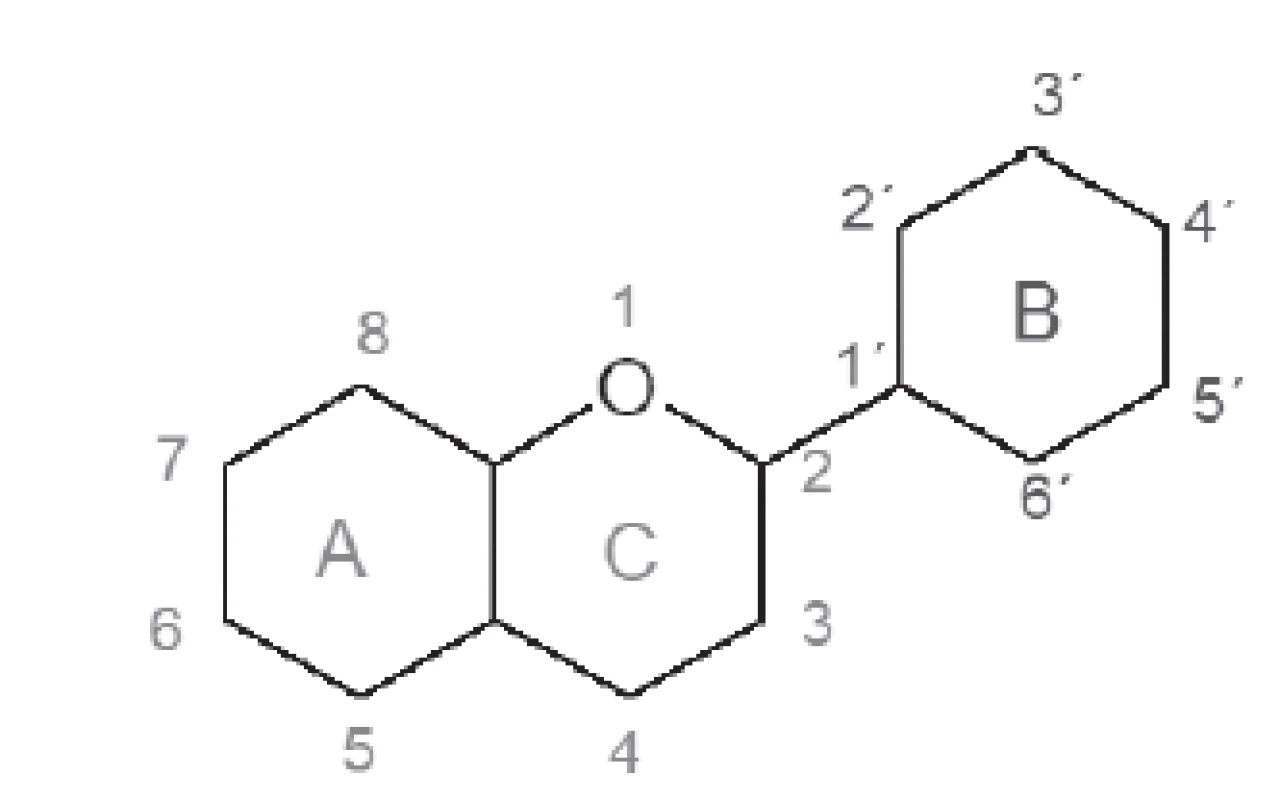
Prokyanidíny a antokyány
Zistilo sa, že etanolické extrakty z kôry a ihličia niektorých druhov borovíc (Pinus densiflora Siebold. Zucc., Pinus thunbergii Parl., Pinus koraiensis Siebold. Zucc.) majú enormnú schopnosť kompetitívne inhibovať slinnú a pankreatickú α-amylázu ošípaných24). Pri použití mikrobiálnych amyláz a glukozidáz je inhibícia zmiešaná, teda nekompetitívna a kompetitívna. Dokonca u Pinus densiflora Siebold. Zucc. a Pinus koraiensis Siebold. Zucc. je účinok extraktu z kôry rovnaký ako je účinok akarbózy25). Výhodou extraktov je aj to, že sú relatívne stabilné v podmienkach ľudského tráviaceho systému (vyššie teploty a nízke hodnoty pH)26). Konkrétne molekuly, ktorým vďačíme za vyššie opísané účinky, zatiaľ známe nie sú, avšak doterajšie štúdie naznačujú, že sa s najväčšou pravdepodobnosťou jedná o látky zo skupiny prokyanidínov (tiež sa označujú ako proantokyaníny či leukoantokyaníny). Polyfenolické látky inhibujú skôr α-amylázu zatiaľ čo antokyány sú účinnejšie pri α-glukozidáze27).
Triesloviny
V celej rastlinnej ríši sú pomerne hojne rozšírené triesloviny, ktoré zo štrukturálneho hľadiska zaraďujeme k polyfenolom. Často sa vyskytujú v nezrelých plodoch, no v priebehu dozrievania môžu vymiznúť28). Nie všetky triesloviny patria k účinným inhibítorom α-amylázy, no už dávno je známe, že tie z nich, ktoré nachádzame v červenom víne, dokážu po požití potravy bohatej na škrob mierniť výkyvy v hladinách krvného cukru29). Presný mechanizmus tohto účinku nie je známy, no predpokladá sa, že ich silná schopnosť denaturovať bielkoviny a vytvárať tak nerozpustné komplexy je práve základným princípom inhibičného pôsobenia18). Zelený nefermentovaný čaj (Camelia sinensis Kuntze) obsahuje (-)-3-O-galloylepikatechín a (-)-3-O-galloylkatechín, ktoré v súčinnosti s flavonoidmi a ďalšími katechínmi disponujú antioxidačnými a antiflogistickými vlastnosťami30) (obr. 2). Nakoľko inhibujú α-amylázu a zároveň aj α-glukozidázu, efektívne znižujú postprandiálnu hyperglikémiu. U týchto látok je pre inhibičný účinok nevyhnutná esterifikácia kyselinou gallovou27).
2. Štruktúra trieslovín zo zeleného čaju s inhibičným účinkom na α-amylázu 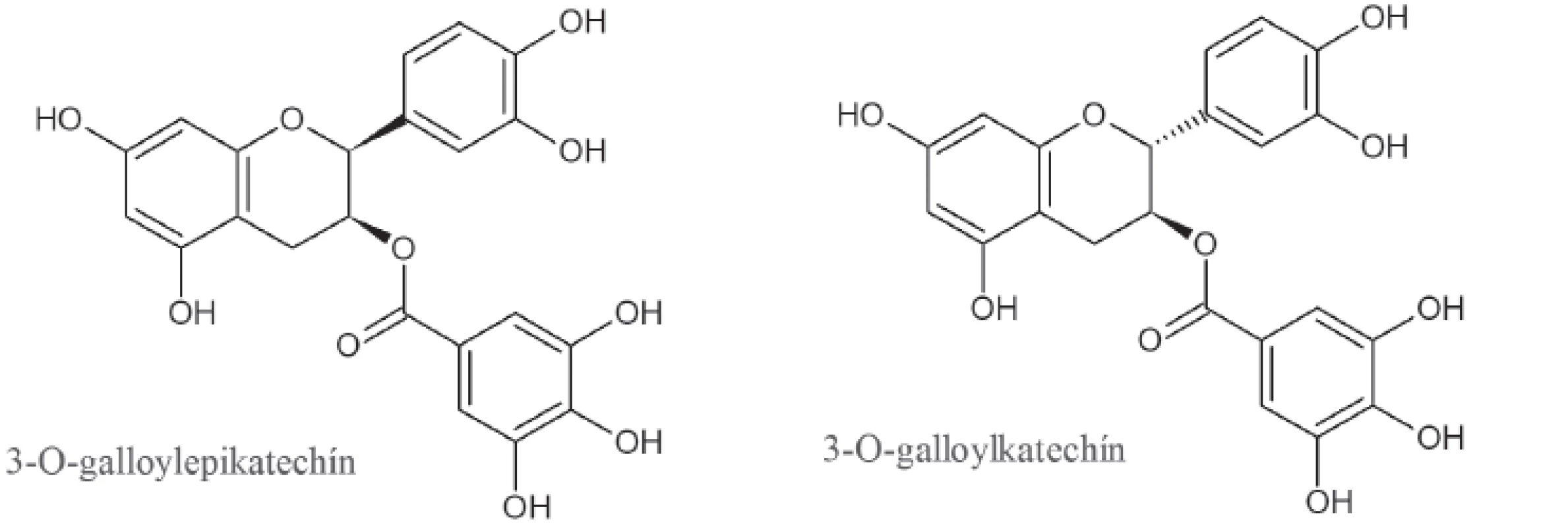
Terpenoidy
Napriek tomu, že triterpenoidy tvoria pestrú škálu látok, inhibičná aktivita voči α-amyláze bola zaznamenaná, len u oleanových, ursánových a lupánových typov. Mechanizmus účinku, ktorý by bližšie vysvetľoval toto pozorovanie, zatiaľ nie je jasný18) (obr. 3).
3. Štruktúra lupánu, oleánu a ursánu 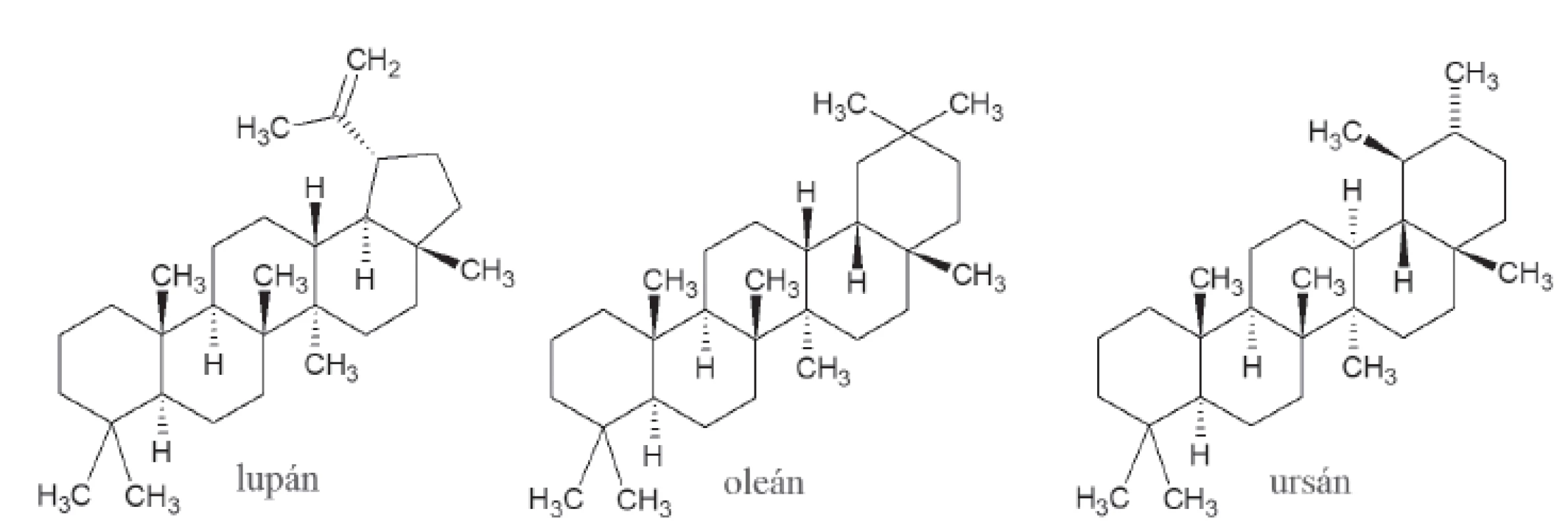
Kyselina ibišková
V Afrike sa už od nepamäti používa ibištek sudánsky (Hibiscus sabdarifa L.), pretože jeho diuretické vlastnosti napomáhajú pri hypertenzii, ľadvinových a močových kameňoch31). Existujú však štúdie, ktoré popisujú pozitívny vplyv aj na pacientov trpiacich obezitov32). Za tento účinok sú zodpovedné dve obsahové látky, a síce kyselinya ibišková a jej 6-metylester27) (obr. 4). Sú vysoko účinné voči ľudskej a prasacej pankreatickej α-amyláze. S ostatnými substrátmi pre α-amylázu majú podobnú cyklickú štruktúru a práve tá im zaručuje schopnosť viazať sa na katalytické miesto tohto enzýmu a následne ho aj inhibovať20). Pri kyseline ibiškovej sa uvažovalo o jej schopnosti ovplyvňovať aj α-glukozidázu, no pri bližšom skúmaní bolo dokázané, že je tento účinok neobyčajne malý. Keďže extrakty z ibišteka obsahujú antokyány, predpokladá sa ich pozitívny vplyv aj na metabolizmus tukov a cholesterolu33). Napriek tomu, že presnejšie informácie o tomto účinku ešte nie sú celkom známe, odporúča sa prípravky z ibišteka zahrnúť do terapie obéznych pacientov34).
4. Štruktúra kyseliny ibiškovej a jej 6-metylesteru 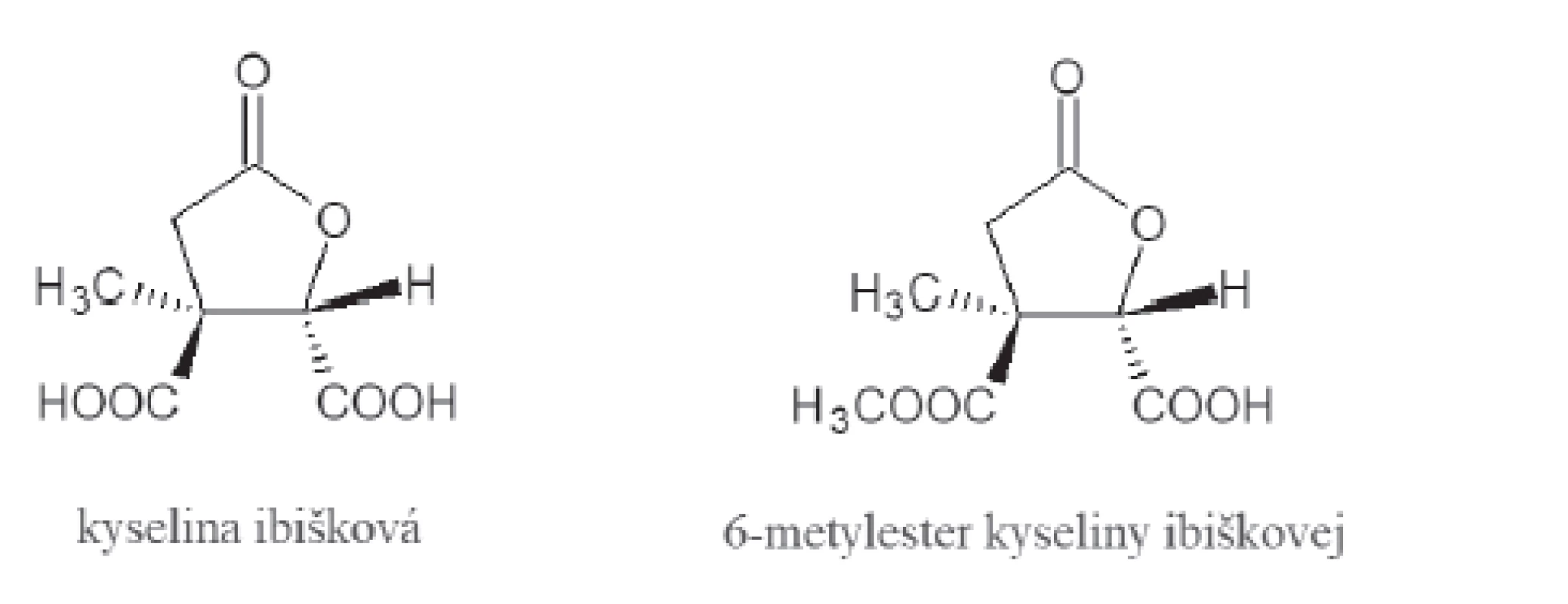
Kurkuminoidy
Podzemok z rastliny Curcuma longa je často používaný pri príprave orientálnyh jedál. Obsahuje kurkuminoidy, látky u ktorých boli pozorované antioxidačné, protinádorové a protizápalové vlastnosti35). Pri dôkladnejšom skúmaní sa zistilo, že jedna z molekúl, bidesmetoxykurkumín, dokáže nekompetitívne inhibovať ľudskú pankreatickú α-amylázu už pri koncentrácii 0,026 prípadne 0,025 mmol × l–1. Z experimentov je zrejmé, že molekula môže zohrať dôležitú úlohu pri vývoji nových liečiv ovplyvňujúcich trávenie škrobu36).
Inhibítory s proteínovou štruktúrou
Proteínové inhibítory α-amylázy nachádzame vo viacerých zdrojoch. Sú produkované rastlinami, živočíchmi ale aj mikroorganizmami. Z rastlín je možné spomenúť obilniny ako pšenica (Triticum aestivum L.), jačmeň (Hordeum vulgare L.), cirok (Sorghum bicolor Moench), žito (Secale cereale L.) a ryža (Oryza sativa L.). Z čeľade bôbovitých (Fabaceae) je možné zmieniť sa o kajane indickom (Cajanus cajan Millsp.), vigne čínskej (Vigna unguiculata Walp.) a fazuli obyčajnej (Phaseolus vulgaris L.)37). Rozdielne rastlinné inhibítory sa vyznačujú odlišnou špecificitou k α-amyláze získanej z rôznych zdrojov21) (tab. 2).
2. Rozdielna inhibičná aktivita vybraných inhibítorov α-amylázy20) 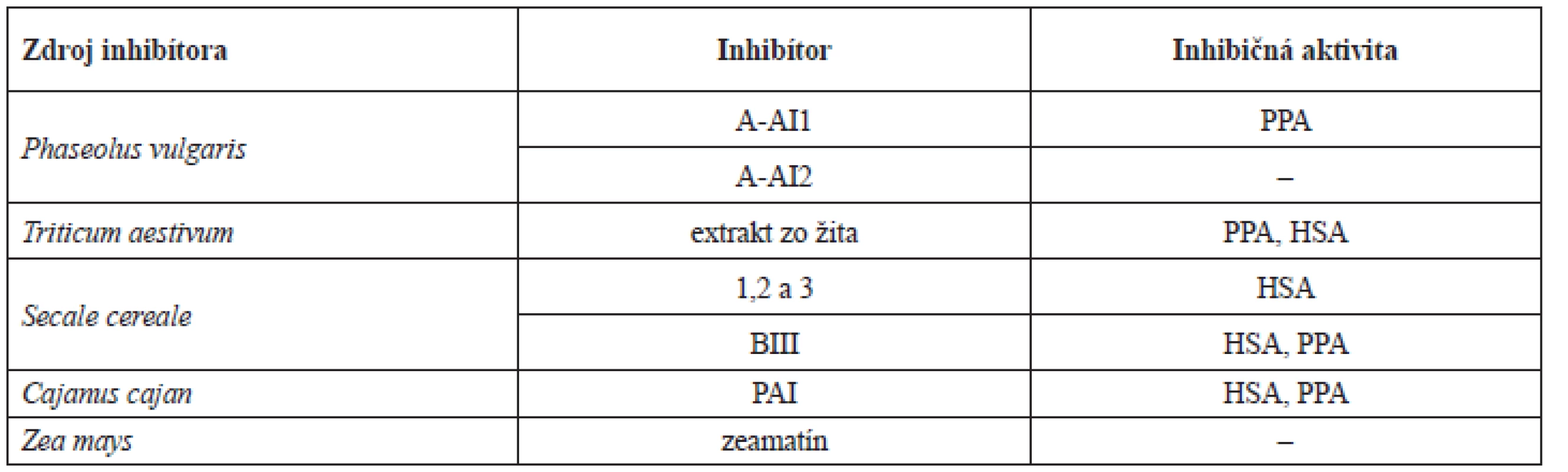
PPA – prasacia pankreatická amyláza, HSA – ľudská slinná amyláza Proteínové inhibítory α-amylázy obsiahnuté v rastlinných zdrojoch sa na základe terciárnej štruktúry rozdeľujú do šiestich skupín. Poznáme tak inhibítory cereálneho typu, deriváty lektínu, knottínu, purotionínu, thaumatínu a kunitzove inhibítory. Niektoré z nich, ako napríklad inhibítory podobné lektínu, účinkujú na α-amylázu škodcov, iné ako napríklad jačmenný inhibítor α-amylázy a subtilizínu (basi), dokáže špecificky inhibovať len α-amylázy z rastlinných zdrojov. Najviac popísanými skupinami sú inhibítory cereálneho typu (patria do skupiny cm proteínov) a inhibítory lektínového typu obsiahnuté v semenách fazuli38).
Lektinu podobné inhibítory α-amylázy
Semená fazule obyčajnej (Phaseolus vulgaris L.) obsahujú krátke lektíny, u ktorých bola popísaná schopnosť inhibovať nielen α-amylázu cicavcov, ale aj hmyzu. Účinok na rastlinné enzýmy však u nich pozorovaný nebol39, 40). Nachádzame tu tri rozdielne izoformy inhibítora, ktoré označujeme α-AI1, α-AI2 a α-AI3. V najväčšom množstve je zastúpená práve izoforma α-AI1 s molekulovou hmotnosťou 43 kda41). Je obsiahnutá len v zárodku a v klíčnych listoch semien, kde pravdepodobne vykonáva ochrannú funkciu. Jedná sa o dimerický glykoproteín (A2H2) a zároveň je homológom fytohemaglutinínu (PHA). Dokáže inhibovať slinnú a pankreatickú α-amylázu cicavcov a hmyzu42). Zabraňuje tráveniu škrobu tak, že úplne blokuje prístup substrátu k aktívnemu miestu enzýmu. Aktivita inhibítora izoformy α-AI je ovplyvňovaná viacerými faktormi, no najväčší vplyv má na neho teplota, pH, inkubačná doba či prítomnosť jednotlivých iónov. Optimum pre účinok inhibítora je pH v rozmedzí 4,5–5,5 a teplota od 22 do 37 °C. Pri teplote 0 °C nepozorujeme žiadnu aktivitu. Úpravou vzorky 10-minútovým varením, dôjde k denaturácii a úplnej inaktivácii inhibítora. Inkubačná doba závisí od reakčných podmienok, pričom pri pH 6,9 bola stanovená na 120 minút a pri pH 4,5 na 10 minút39). Izoforma α-AI2 sa nachádza v niektorých divo rastúcich druhoch fazule. Na rozdiel od izoformy α-AI1 dokáže inhybovať amylázu zrnokaza mexického (Zabrotes subfasciatus Boheman), avšak účinok na prasaciu pankreatickú amylázu je minimálny20). Tretiu izoformu α-AI3 predstavuje molekula proteínu s jednoduchým reťazcom, u ktorej nebola zaznamenaná aktivita k doposiaľ testovaným α-amylázam. S najväčšou pravdepodobnosťou je vývojovým medziproduktom medzi PHA a spomínanými dvoma účinnými izoformami. Molekuly s obdobnou štruktúrou základného reťazca vykazujú inhibičnú aktivitu k α-amylázam húb. To naznačuje, že takáto izoforma by mohla zvyšovať obranyschopnosť rastlín voči plesniam. Rozdiely v inhibičnej špecifickosti spomínaných izoforiem sa vysvetľujú štruktúrnymi zmenami v cieľových proteínoch39). V rámci štúdia inhibičného účinku α-amylázy sa zistilo, že počiatočné reakcie medzi enzýmom a inhibítorom sú pomalé. Inhibícia bola efektívnejšia v prípade, keď sa inhibítor nechal vopred inkubovať so samotným enzýmom po dobu desiatich minút a až potom sa pridal substrát3). Potkanom, ktorým sa do krmiva pridával extrakt z fazuľových semien s obsahom spomínaných inhibítorov α-amylázy (v krmive dosahoval koncentráciu 3,3 a 6,6 g/kg), došlo k viditeľnému spomaleniu rastu v porovnaní s kontrolnými zvieratami. Výrazná strata hmotnosti bola spôsobená nedostatočnou využiteľnosťou – predovšetkým škrobu a z časti aj proteínov. Zároveň u týchto pokusných zvierat dochádzalo k stratám dusíka, lipidov a karbohydrátov. Pri pitve im bola zistená hypertrofia a hyperplázia tenkého čreva a pankreasu, no hmotnosť týmusu a pečene bola menšia než v kontrolnej skupine potkanov. Existuje tu však aj riziko blokády čreva zhustenou tráveninou. Použitie týchto prírodných látok teda nie je vždy bez zdravotného rizika43). Z klinických štúdií pre ľudí po požití extraktov z fazule nevyplývajú závažné nežiaduce účinky. Vzhľadom k tomu, že α-amyláza zabraňuje degradácii polysacharidov na oligosacharidy, dostávajú sa vo väčšej miere do hrubého čreva. Tam sa vplyvom baktérií rozkladajú a môžu navodiť gastrointestinálne potiaže ako flatulenciu či diareu44). Surové semená fazule obsahujú fytohemaglutinín (PHA), ktorého vysoké dávky sa u zvierat prejavujú toxickými účinkami a u ľudí vyvolávajú závažné poruchy zažívania45). Nakoľko je termolabilný, jeho účinky sa dajú úplne eliminovať varom46). Semená bielej fazule majú v porovnaní s farebnými semenami zanedbateľný obsah fytohemaglutinínu, no pri výrobe rôznych prípravkov je nevyhnutný postup zaručujúci inaktiváciu tejto zlúčeniny47). V osemdesiatych rokoch 20. storočia na americký trh prichádzalo veľké množstvo preparátov zaručujúcich chudnutie, ktoré boli práve na báze fazuľových extraktov. Vtedajšie klinické štúdie poukázali na ich neuspokojivú účinnosť, a preto v roku 1982 FDA (Americká správa pre potraviny a liečivá v USA) pozastavila predaj týchto produktov3). V poslednej dobe sa stretávame s opätovným zavádzaním prípravkov na báze vodného extraktu zo semien fazule – Phase 2®. Používa sa ako doplnok výživy napomáhajúci redukovať hmotnosť48). Býva formulovaný do rôznych liekových foriem zahrňujúc prášky, tablety, tobolky či žuvacie tablety. Extrakt je tiež možné pridávať aj formou medikovaných potravín bez toho, aby ovplavňoval vzhľad, konzistenciu či chuť daného jedla44).
Knottínu podobné inhibítory α-amylázy
Zo semien láskavca červenoklasého (Amaranthus hypochondriacus L.) bol získaný doteraz najmenší proteínový inhibítor α-amylázy – AAI. Obsahuje totiž len 32 aminokyselinových zvyškov a tri disulfidické väzby49). V rámci jeho molekuly nachádzame knottínovú časť tvorenú tromi antiparalelnými β-vláknami a charakteristické rozmiestnenie disulfidických väzieb. Vykazuje štrukturálnu podobnosť s proteínmi, ako je charybdotoxín a conotoxín50). Má špecifickú schopnosť inhibovať α-amylázu hmyzu, avšak voči cicavčej α-amyláze nie je účinný. Mechanizmus pôsobenia tohto inhibítora je podobný tomu, s ktorým sa stretávame u lektínových inhibítorov. Spočíva teda v blokáde katalytického miesta enzýmu20).
Inhibítory cereálneho typu
Inhibítory tejto skupiny sú zložené zo 120 až 160 aminokyselinových zvyškov tvoriacich päť disulfidických väzieb. Tieto inhibítory sú taktiež známe senzibilizujúce látky. Pri opakovanej expozícii totiž u ľudí môžu vyvolať alergickú reakciu, dermatitídu či takzvanú „pekársku astmu“, ktorej spúšťačom je cereálna múka. Z tejto skupiny je najviac preskúmaný pšeničný α-amylázový inhibítor, ktorý na základe gélovej elektroforetickej mobility dostal označenie inhibítor 0,19. Jedná sa o dimér obsiahnutý v zrnách pšenice (Triticum aestivum L.)51). Dokáže ovplyvňovať účinok α-amylázy vtákov, hmyzu, cicavcov, niektorých baktérií a ľudských slín. Obsahuje 124 amynokyselinových zvyškov a je homologický (štrukturálne podobný) s RBI52). Táto zlúčenina bola izolovaná z indického prosa (Panicum indicum L.) a tak isto patrí do skupiny inhibítorov cereálneho typu53). RBI je bifunkčný, nakoľko inhibuje α-amylázu ale aj trypsín. Pozostáva zo 122 aminokyselín s piatimi disulfidickými väzbami. Je odolný voči tepelnej denaturácii, močovine a guanidínhydrochloridu. Podobne ako ostatné inhibítory tejto skupiny môže kompetitívne inhibovať viaceré druhy α-amyláz vrátane tej, ktorú nachádzame v prasacej pankreatickej šťave20). Pšeničná múka obsahuje aj ďalšie štyri druhy inhibítorov α-amylázy. Ide o molekuly s označením WRP24, WRP25, WRP26 a WRP2754). Tie, vďaka svojej polypeptidickej štruktúre a molekulovej hmotnosti, ktorá sa pohybuje okolo hodnoty 14 kDa patria do rodiny inhibítorov cereálneho typu. Analýza sedimentačnej rýchlosti dokazuje, že WRP25 a WRP27 sú monoméry, zatiaľ čo WRP24 patrí medzi diméry. Zistilo sa, že zlúčenina WRP24 má spolu s vyššie spomínanou látkou označovanou ako inhibítor 0,19 totožnú istú časť n-koncovej aminokyselinovej sekvencie. Dokáže rovnako dobre inhibovať amylázu hmyzu ako aj človeka. WRP25 a WRP26 inhibujú však len α-amylázu hmyzu (zrniar ryžový – Sitophilus oryzae L., potemník hnedý – Tribolium castaneum Herbst, múčiar obyčajný Tenebrio molitor L.), teda bez účinku na enzýmy obsiahnuté v ľudských slinách47).
Kunitzove inhibítory
Kunitzove inhibítory α-amylázy sú tvorené približne 180 aminokyselinovými zvyškami so štyrmi molekulami cystínu. Proteázové inhibítory tejto skupiny sú zastúpené vo viacerých rastlinných druhoch, no predovšetkým v obilninách ako pšenica (WASI), ryža (RASI) a prípadne aj raž či jačmeň20). BASI je jačmenný inhibítor α-amylázy a subtilizínu s molekulovou hmotnosťou 20 kDa. Nachádza sa vo vnútri zŕn jačmeňa, pričom v zrelých zrnách tvorí 0,5 % z celkového množstva obsiahnutých proteínov. Primárne bol označený ako inhibítor subtilizínu a až neskôr sa prišlo na to, že má dvojaký účinok a tak isto pôsobí aj na izoenzým 2 jačmennej α-amylázy (na izoenzým 1 neúčinkuje)42). BASI, WASI a RASI vykazujú charakteristické kvantitatívne rozdiely v účinkoch s α-amylázou. WASI má o niečo nižšiu afinitu v porovnaní s BASI. Izoenzýmová špecificita týchto homológov je rovnaká. RASI ochotne inhibuje α-amylázu hmyzu, no disponuje len veľmi slabou inhibičnou aktivitou k α-amyláze, ktorá pochádza z ryži či jačmenného sladu. Tento špecifický rozdiel medzi RASI a BASI môže vychádzať z toho, že BASI má v rámci svojej molekuly zachované zvyšky, ktoré nepriamo interagujú s katalytickými skupinami väzobného miesta α-amylázy55). Predpokladá sa, že úloha inhibítorov α-amylázy závisí od rastlinného druhu, v ktorom sú obsiahnuté. RASI ponúka rastline ochranu pred hmyzom, čo prostredníctvom schopnosti ovplyvňovať subtilizín to tak isto dokáže aj BASI a WASI. Špecifickosť týchto zlúčenín k endogénnej α-amyláze naznačuje schopnosť podieľať sa na ovplyvňovaní predčasného klíčenia56).
Taumatínu podobné inhibítory α-amylázy
K tejto skupine inhibítorov zaraďujeme proteíny s molekulovou hmotnosťou približne 22 kDa so značnou podobnosťou na taumatín. Jedná sa o obzvlášť sladký proteín obsiahnutý v plodoch rastliny Thaumatococcus danielli Benth57). Z tejto skupiny látok je však najviac opisovaný zeamatín, inhibítor izolovaný z kukurice siatej (Zea mays L.). Je homológom taumatínu58). Na povrchu tohto proteínu sa nachádzajú bohato zastúpené zvyšky arginínu a lyzínu. Napriek svojej podobnosti s taumatínom nemá sladkú chuť. Zeamatín je schopný inhibovať prasací trypsín a α-amylázu z niektorých druhov hmyzu. Je známy predovšetkým kvôli antifungálnemu účinku, ale ten nesúvisí so schopnosťou inhibovať hydrolytické enzýmy. Zeamatín sa dokáže viazať na β-1,3-glukány, následne zvyšuje permeabilitu plesňových membrán, čo v konečnom dôsledku vedie k bunkovej smrti. Ostatné proteíny z tejto skupiny, ako napríklad proteíny R a S získané zo semien jačmeňa, nevykazujú inhibičnú aktivitu proti trypsínu alebo α-amyláze20).
Purotionínu podobné inhibítory α-amylázy
Inhibítory so štruktúrou γ-purotionínu tvorí spravidla 47 alebo 48 aminokyselinových zvyškov. Tieto proteíny obsahujú veľký podiel síry, ktorá je obsiahnutá predovšetkým v γ-tioníne59). Rastlinám ponúkajú ochranu sprostredkovanú viacerými mechanizmami. Ovplyvňujú napríklad membránovú permeabilitu, inhibujú syntézu proteínov, alebo zastávajú funkciu inhibítorov proteináz. V rastline známej pod názvom cirok (Sorghum bicolor Moench) sa nachádzajú tri izoformy inhibítorov amylázy – SIα-1, SIα-2 a SIα-360). Bola u nich zistená výrazná inhibičná aktivita k α-amyláze kobyliek a švábov, avšak schopnosť inhibovať tento enzým v ľudských slinách či v prasacej pankreatickej šťave je nepatrná61).
Záver
Ako je uvedené v samotnom článku, rastlinné inhibítory α-amylázy je možné získať z viacerých zdrojov, pričom ich účinnosť je rôzna a nie všetky nachádzajú uplatnenie práve v ľudskom organizme. Napriek tomu môžu byť niektoré z nich súčasťou perorálne podávaných liekov či už v pevnej alebo tekutej liekovej forme, prípadne tvoriť vhodné potravinové doplnky na zníženie hmotnosti alebo aspoň posprandiálnej hyperglykémie. Tento prehľadový článok sa snaží poskytnúť prehľad nielen týchto inhibítorov, ale aj ich prírodných zdrojov, a to vrátane náčrtu chemickej štruktúry a účinnosti.
Střet zájmů: žádný.
S. Kurhajec
Department of Pharmacognosy and Botany
University of Veterinary Medicine and Pharmacy in Košice
Slovakia
Assoc. prof. PharmDr. Aleš Franc, Ph.D. (∗)
Department of Pharmaceutics, Faculty of Pharmacy
University of Veterinary and Pharmaceutical Sciences
Palackého 1946/1, 612 42 Brno, Czech Republic
e-mail: franca@vfu.cz
Sources
1. Bush D. S., Sticher L., Van Huystee R., Wagner D., Jones R. L. The calcium requirement for stability and enzymatic activity of two isoforms of barley aleurone alpha-amylase. J. Biol Chem. 1989; 32, 19392–19398.
2. Suržin J., Ledvina M. Lekárska biochémia. Košice a Hradec Králové: Michal Vaško 2002.
3. Preuss H. G. Bean amylase inhibitor and other carbohydrate absorption blockers: effects on diabesity and general health. J. Am. Coll. Nutr. 2009; 28, 266–276.
4. Perry G. H., Dominy N. J., Claw K. G., Lee A. S., Fiegler H., Redon R., Carter N. P. Diet and the evolution of human amylase gene copy number variation. Nat. Genet. 2007; 39, 1256.
5. Tan K., Tesar C., Wilton R., Keigher L., Babnigg G., Joachimiak A. Novel α-glucosidase from human gut microbiome: substrate specificities and their switch. Faseb. J. 2010; 24, 3939–3949.
6. Bush D. S., Sticher L., van Huystee R., Wagner D., Jones R. L. The calcium requirement for stability and enzymatic activity of two isoforms of barley aleurone alpha-amylase. J. Biol. Chem. 1989; 32, 19392–19398.
7. Boehlke C., Zierau O., Hannig C. Salivary amylase – the enzyme of unspecialized euryphagous animals. Arch. Oral. Biol. 2015; 60, 1162–1176.
8. Kim M. J., Lee S. B., Lee H. S., Lee S. Y., Baek J. S., Kim D., Park K. H. Comparative study of the inhibition of α-glucosidase, α-amylase, and cyclomaltodextrin glucanosyltransferase by acarbose, isoacarbose, and acarviosine – glucose. Arch. Biochem. Biophys. 1999; 371, 277–283.
9. Mahmud T., Tornus I., Egelkrout E., Wolf E., Uy C., Floss H. G., Lee S. Biosynthetic studies on the α-glucosidase inhibitor acarbose in actinoplanes sp.: 2-epi-5-epi-valiolone is the direct precursor of the valienamine moiety. JACS 1999; 121, 6973–6983.
10. Chiasson J. L., Josse R. G., Gomis R., Hanefeld M., Karasik A., Laakso M. Acarbose for prevention of type 2 diabetes mellitus: the stop-niddm randomised trial. Lancet 2002; 9323, 2072–2077.
11. Laube H. Acarbose. Clin. Drug Investig. 2002; 22, 141–156.
12. Truscheit E., Frommer W., Junge B., Müller L., Schmidt D. D., Wingender W. Chemistry and biochemistry of microbial α‐glucosidase inhibitors. Angew. Chem. Int. Ed. Engl. 1981; 20, 744–761.
13. Geng P., Qiu F., Zhu Y., Bai G. Four acarviosin-containing oligosaccharides identified from streptomyces coelicoflavus zg0656 are potent inhibitors of α-amylase. Carbohydr. Res. 2008; 343, 882–892.
14. Kuhlmann J., Pils J. Oral antidiabetics. Berlin: Springer 1996.
15. Agnieszka S. Food biofortification technologies. Boca Raton, Florida: CRC Press 2017.
16. Barbosa A. E., Albuquerque É. V., Silva M. C., Souza D. S., Oliveira-Neto O. B., Valencia A., Grossi-De-Sá M. F. α-amylase inhibitor-1 gene from Phaseolus vulgaris expressed in coffea arabica plants inhibits α-amylases from the coffee berry borer pest. BMC Biotechnol. 2010; 10, 44.
17. Jbilou R., Amri H., Bouayad N., Ghailani N., Ennabili A., Sayah F. Insecticidal effects of extracts of seven plant species on larval development, α-amylase activity and offspring production of Tribolium castaneum. Bioresour. Technol. 2008; 99, 959–964.
18. Sales P. M., Souza P. M., Simeoni L. A., Magalhães P. O., Silveira D. α-amylase inhibitors: a review of raw material and isolated compounds from plant source. J. Pharm. Pharm. Sci. 2012; 15, 143–183.
19. Nagaraj R. H., Pattabiraman T. N. Purification and properties of an α-amylase inhibitor specific for human pancreatic amylase from proso (panicium miliaceum) seeds. J. Biosci. 1985; 7, 257–268.
20. Franco O. L., Rigden D. J., Melo F. R., Grossi-de-Sá M. F. Plant α-amylase inhibitors and their interaction with insect α-amylases: structure, function and potential for crop protection. Eur. J. Biochem. 2002; 269, 397–412.
21. Tadera K., Minami Y., Takamatsu K., Matsuoka T. Inhibition of α-glucosidase and α-amylase by flavonoids. J. Nutr. Sci. Vitaminol. 2006; 52, 149–153.
22. lo Piparo, E., Scheib H., Frei N., Williamson G., Grigorov M., Chou C. J. Flavonoids for controlling starch digestion: structural requirements for inhibiting human α-amylase. J. Med. Chem. 2008; 51, 3555–3561.
23. Buchtová E., Šturdíková M. Mikrobiálne produkované inhibítory hydroláz a ich terapeutický potenciál. Chem. Listy 2013; 107, 30–36.
24. Kim Y. M., Wang M. H., Rhee H. I. A novel α-glucosidase inhibitor from pine bark. Carbohydr. Res. 2004; 339, 715–717.
25. Shpatov A. V., Popov S. A., Salnikova O. I., Kukina T. P., Shmidt E. N., Um B. H. Composition and bioactivity of lipophilic metabolites from needles and twigs of korean and siberian pines (Pinus koraiensis siebold & Pucc. and Pinus sibirica du tour). Chem. Biodivers 2017; 14, e1600203.
26. Arabshahi-D S., Devi D. V., Urooj A. Evaluation of antioxidant activity of some plant extracts and their heat, ph and storage stability. Food Chem. 2007; 100, 1100–1105.
27. Martin J., Dušek, J. Inhibice α-amylázy a α-glukosidázy přírodními látkami. Prakt. Lékárenství 2009; 5, 92–95.
28. Zheng H. Z., Hwang I.. W., Kim, S. K., Lee S. H., Chung S. K. Optimization of carbohydrate-hydrolyzing enzyme aided polyphenol extraction from unripe apples. J. Korean Soc. Appl. Biol. Chem. 2010; 53, 342–350.
29. Ujwala T. K., Tomy S., Celine S., Chander J. S. J. U., Udaya S. J. A systematic review of some potential anti-diabetic herbs used in india characterized by its hypoglycemic activity. Int. J. Pharm. Sci. Res. 2015; 12, 4940–4957.
30. Kania M., Baraniak J. Wybrane właściwości biologiczne i farmakologiczne zielonej herbaty (Camellia sinensis L. O. Kuntze). Post. Fitoter. 2011; 1, 34–40.
31. Jiménez-Ferrer E., Alarcón-Alonso J., Aguilar-Rojas A., Zamilpa A., Tortoriello J., Herrera-Ruiz M. Diuretic effect of compounds from hibiscus sabdariffa by modulation of the aldosterone activity. Planta Med. 2012; 78, 1893–1898.
32. Alarcon-Aguilar F. J., Zamilpa A., Perez-Garcia M. D., Almanza-Perez J. C., Romero-Nunez E., Campos-Sepulveda E. A., Roman-Ramos R. Effect of hibiscus sabdariffa on obesity in msg mice. J. Ethnopharmacol. 2007; 114, 66–71.
33. Mozaffari-Khosravi H., Jalali-Khanabadi B. A., Afkhami-Ardekani M., Fatehi F. Effects of sour tea (hibiscus sabdariffa) on lipid profile and lipoproteins in patients with type ii diabetes. J. Altern. Complement. Med. 2009; 15, 899–903.
34. Chang H. C., Peng C. H., Yeh D. M., Kao E. S., Wang C. J. Hibiscus sabdariffa extract inhibits obesity and fat accumulation, and improves liver steatosis in humans. Food Funct. 2014; 5, 734–739.
35. Darvesh A., Aggarwal B., Bishayee A. Curcumin and liver cancer: a review. Curr. Pharm. Biotechnol. 2012; 13, 218–228.
36. Ponnusamy S., Zinjarde S., Bhargava S., Rajamohanan P. R., RaviKumar A. Discovering bisdemetoxycurcumin from curcuma longa rhizome as a potent small molecule inhibitor of human pancreatic α-amylase, a target for type-2 diabetes. Food Chem. 2012; 135, 2638–2642.
37. Kalve N. D., Lomate P. R., Hivrale, V. K. A proteinaceous thermo labile α-amylase inhibitor from albizia lebbeck with inhibitory potential toward insect amylases. Arthropod Plant Interact. 2012; 6, 213–220.
38. Pusztai A., Bardocz S. Lectins: biomedical perspectives. London: Tylor & Francis 1995.
39. Fabre C., Causse H., Mourey L., Koninkx J., Rivière M., Hendriks H., Rougé P. Characterization and sugar-binding properties of arcelin-1, an insecticidal lectin-like protein isolated from kidney bean (Phaseolus vulgaris L. Cv. Raz-2) seeds. Biochem. J. 1998; 329, 551–560.
40. Kluh I., Horn M., Hýblová J., Hubert J., Dolečková-Marešová L., Voburka Z., Mareš M. Inhibitory specificity and insecticidal selectivity of α-amylase inhibitor from Phaseolus vulgaris. Phytochem. 2005; 66, 31–39.
41. le Berre-Anton V., Bompard-Gilles C., Payan F., Rouge P. Characterization and functional properties of the α-amylase inhibitor (α-AI) from kidney bean (Phaseolus vulgaris) seeds. BBA. Prot. St. 1997; 1343(1), 31–40.
42. Bellincampi D., Camardella L., Delcour J. A., Desseaux V., D’Ovidio R., Durand A., Sǿrensen J. F. Potential physiological role of plant glycosidase inhibitors. Biochim. Biophys Acta Proteins Proteom. 2004; 1696, 265–274.
43. Pusztai A., Grant, G., Duguid T., Brown, D. S., Peumans W. J., van Damme E. J., Bardocz S. Inhibition of starch digestion by α-amylase inhibitor reduces the efficiency of utilization of dietary proteins and lipids and retards the growth of rats. J. Nutr. 1995; 125, 1554–1562.
44. Barrett M. L., Udani J. K. A proprietary alpha-amylase inhibitor from white bean (Phaseolus vulgaris): a review of clinical studies on weight loss and glycemic control. J Nutr. 2011; 10, 24.
45. Kumar S., Verma A. K., Das M., Jain S. K., Dwivedi P. D. Clinical complications of kidney bean (Phaseolus vulgaris L.) Consumption. Nutrition 2013; 29, 821–827.
46. Confalonieri M., Bollini R., Berardo N., Vitale A., Allavena A. Influence of phytohemagglutinin on the agronomic performance of beans (Phaseolus vulgaris L.). Plant Breeding 1992; 109, 329–334.
47. Feng G. H., Richardson M., Chen M. S., Kramer K. J., Morgan T. D., Reeck G. R α-amylase inhibitors from wheat: amino acid sequences and patterns of inhibition of insect and human α-amylases. Insect Biochem. Mol. Biol. 1996; 26, 419–426.
48. Celleno L., Tolaini M. V., D’Amore A., Perricone N. V., Preuss, H. G. A dietary supplement containing standardized Phaseolus vulgaris extract influences body composition of overweight men and women. Int. J. Med. Sci. 2007; 4, 45.
49. Lu S., Deng P., Liu X., Luo J., Han R., Gu X., Patthy A. Solution structure of the major α-amylase inhibitor of the crop plant amaranth. J. Biol. Chem. 1999; 274, 20473–20478.
50. Carugo O., Lu S., Luo J., Gu X., Liang S., Strobl S., Pongor S. Structural analysis of free and enzyme-bound amaranth α-amylase inhibitor: classification within the knottin fold superfamily and analysis of its functional flexibility. Protein Eng. 2001; 14, 639–646.
51. Heidari R., Zareae S., Heidarizadeh M. Extraction, purification, and inhibitory effect of alpha-amylase inhibitor from wheat (Triticum aestivum var. Zarrin). Pakistan. J. Nutr. 2005; 4, 101–105.
52. Strobl S., Maskos K., Wiegand G., Huber R., Gomis-Rüth F. X., Glockshuber R. A novel strategy for inhibition of α-amylases: yellow meal worm α-amylase in complex with the ragi bifunctional inhibitor at 2.5 å resolution. Struct. 1998; 6, 911–921.
53. Wang J., Yang L., Zhao X., Li J., Zhang D. Characterization and phylogenetic analysis of allergenic tryp alpha amyl protein family in plants. J. Agric. Food. Chem. 2013; 62, 270–278.
54. Franco O. L., Rigden D. J., Melo F. R., Bloch Jr, C., Silva C. P., Grossi-de-Sá M. F. Activity of wheat α‐amylase inhibitors towards bruchid α‐amylases and structural explanation of observed specificities. Eur. J. Biochem. 2000; 267, 2166–2173.
55. Yamagata H., Kunimatsu K., Kamasaka H., Kuramoto T., Iwasaki T. Rice bifunctional α-amylase/subtilisin inhibitor: characterization, localization, and changes in developing and germinating seeds. Biosci. Biotechnol. Biochem. 1998; 62, 978–985.
56. Nielsen P. K., Bønsager B. C., Fukuda K., Svensson B. Barley α-amylase/subtilisin inhibitor: structure, biophysics and protein engineering. BBA-Proteins. Proteom. J. 2004; 1696, 157–164.
57. Liu J. J., Sturrock R., Ekramoddoullah A. K. The superfamily of thaumatin-like proteins: its origin, evolution, and expression towards biological function. Plant Cell Reports 2010; 29, 419–436.
58. Batalia M. A., Monzingo A. F., Ernst S., Roberts W., Robertus J. D. The crystal structure of the antifungal protein zeamatin, a member of the thaumatin-like, pr-5 protein family. Nat. Struct. Mol. Biol. 1996; 3, 19.
59. Colilla F. J., Rocher A., Mendez E. Γ‐purothionins: amino acid sequence of two polypeptides of a new family of thionins from wheat endosperm. FEBS Lett. 1990; 270, 191–194.
60. Kotkar H. M., Sarate P. J., Tamhane V. A., Gupta V. S., Gir A. P. Responses of midgut amylases of helicoverpa armigera to feeding on various host plants. J. Insect Physiol. 2009; 55, 663–670.
61. Mehrabadi M., Franco O. L., Bandani A. R. Plant proteinaceous alpha-amylase and proteinase inhibitors and their use in insect pest control. In new perspectives in plant protection. Intechopen. 2012; 11, 230–246.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2019 Issue 4-
All articles in this issue
- Plant α-amylase inhibitors and their effect on the utilization of polysaccharides contained in the diet
- Theory and practice of pharmacopoeial control of quality of drugs and excipients X. Number of parallel determinations, processing of results and their use in the assessment of the content of active substances and excipients in the European Pharmacopoeia (Ph. Eur.)
- New approach for detoxification of patients dependent on benzodiazepines and Z-drugs for reduction of psychogenic complications
- Study of biocompatibility of peritoneal dialysis solutions measured as in vitro cells viability
- Nephroprotective effect of N-acetylglucosamine in rats with acute kidney injury
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- New approach for detoxification of patients dependent on benzodiazepines and Z-drugs for reduction of psychogenic complications
- Plant α-amylase inhibitors and their effect on the utilization of polysaccharides contained in the diet
- Nephroprotective effect of N-acetylglucosamine in rats with acute kidney injury
- Theory and practice of pharmacopoeial control of quality of drugs and excipients X. Number of parallel determinations, processing of results and their use in the assessment of the content of active substances and excipients in the European Pharmacopoeia (Ph. Eur.)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

