-
Medical journals
- Career
Idiopatická trombocytopénia refraktérna na terapiu cyklosporínom A v klinickej praxi
: Lucia Schwarzová; Zdenko Pirník; Natália Štecová
: Čes. slov. Farm., 2017; 66, 233-237
:
Primárna idiopatická trombocytopénia (idiopatická trombocytopenická purpura) je autoimunitná porucha charakterizovaná izolovanou trombocytopéniou bez abnormalít v erytroidnej a myeloidnej/lymfoidnej línii, ktorej incidencia sa pohybuje okolo 1,6–3,9 na 100 000 osôb za rok. Cieľom našej práce bolo zanalyzovať prípad pacientky s diagnostikovaným ochorením imunitnej trombocytopénie (D69.3) rezistentnej na terapiu cyklosporínom A a zhodnotenie faktorov, ktoré mohli v danom prípade prispieť k neadekvátnej odpovedi na toto liečivo. Získané výsledky poukazujú pravdepodobne na multifaktoriálny pôvod ochorenia pacientky, pričom k refrakterite na terapiu cyklosporínom A mohli prispieť viaceré faktory, a to dlhodobé fajčenie, polymorfizmus MDR-1 génu, genetická predospozícia na výskyt autoimunitných ochorení, hypersenzitivita imunitného systému v podobe alergických stavov, diskutabilná compliance zo strany pacientky, prekonané infekcie ako aj vplyv niektorých užívaných liečiv.
Kľúčové slová:
imunitná trombocytopénia • refraktérna forma • cyklosporín A • terapia • trombocytyÚvod
Počas posledných troch dekád sa chápanie a manažment imunitnej trombocytopénie viackrát zmenili. Idiopatická trombocytopenická purpura (ITP) je hemoragické ochorenie spôsobené autoimunitnou poruchou charakterizovanou trombocytopéniou, normálnym stavom kostnej drene a absenciou iných zrejmých príčin nízkeho počtu trombocytov (PLT). Hoci existuje možnosť spontánnej remisie tohto ochorenia, u dospelých nebýva častá (5 %). Hlavným cieľom terapie ITP je preto zabezpečiť na hemostázu potrebný počet trombocytov, a to viac ako 20–30 × 109/l1). V súčasnej dobe je podľa odporúčaní medzinárodných odborných hematologických spoločností k dispozícii viac alternatív v rámci v prvej, druhej, resp. tretej línie terapie ITP (tab. 1). Pri tzv. núdzovej terapii (pri stavoch nekontrolovaného krvácania u pacientov s ITP) je možné použiť vysoké dávky kortikoidov spolu s intravenóznymi inmunoglobulínmi, transfúziu trombocytov2) či rekombinantný faktor VIIa1). V podpornej terapii ITP sa používajú hemostyptiká (etamsylát, dobesilát), antifibrinolytiká (kyselina paraminobenzoová, kyselina ε-aminokapronová, kyselina tranexámová), plazmaferéza, vitamín K či alternatívne aj terlipresín3).
1. Odporúčaná terapia ITP<sup>2)</sup> 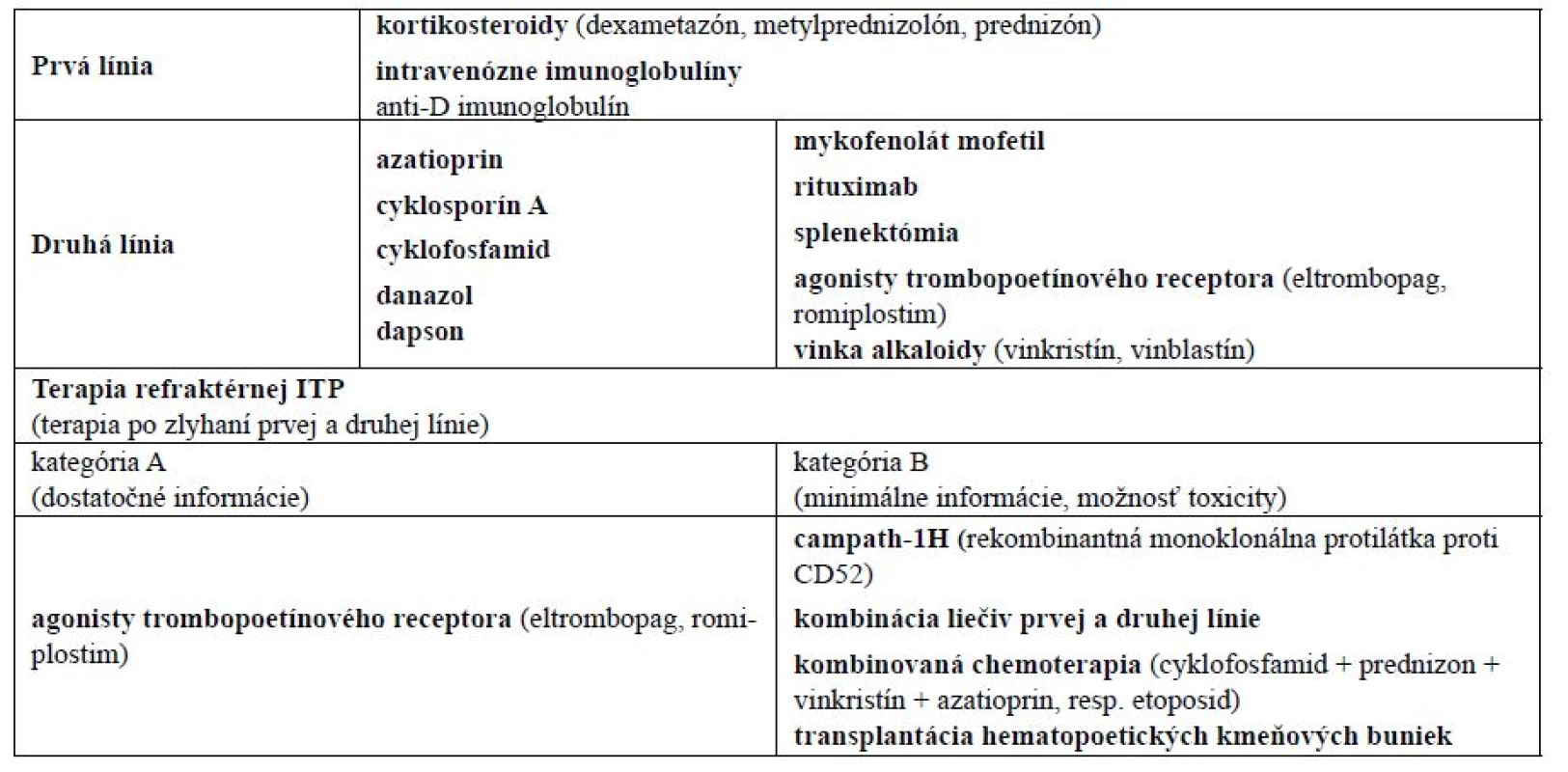
Novodiagnostikovaní pacienti, resp. pacienti s miernou alebo ťažkou symptomatickou formou trombocytopénie sú konvenčne liečení kortikosteroidmi, ktoré zvyšujú počet trombocytov supresiou systémovej retikulo-endoteliálnej fagocytickej funkcie a redukujú aj tvorbu protilátok4). Aj keď väčšina pacientov reaguje na liečbu kortikosteroidmi, po znížení ich dávkovania, resp. po ich úplnom vysadení dochádza neskôr u časti z nich k relapsu ITP. Optimálna terapia takýchto pacientov zostáva kontroverzná. V rámci farmakoterapie sa v druhej línii odporúčajú viaceré liečivá (tab. 1) a jednou z terapeutických možností je u pacientov nereagujúcich na kortikosteroidy aj niektorými autormi preferovaná splenektómia1).
Cyklosporín A (CSA) bol ako endekapeptid izolovaný z huby Tolypocladium inflatum objavený v roku 1971 a stal sa prvým imunosupresívnym liečivom so selektívnou imunoreguláciou T buniek bez excesívnej toxicity. CSA sa viaže na cyklofylín a tento komplex následne inhibuje kalcineurínom stimulovanú kaskádu dejov, čím je redukovaná transkripcia viacerých génov. Okrem toho, že CSA inhibuje produkciu cytokínov (predovšetkým IL-2), zvyšuje aj expresiu transformujúceho rastového faktora-B, ktorý inhibuje IL-2 stimulovanú proliferáciu T buniek5). Pre svoj imunosupresívny efekt je CSA používaný po orgánových transplantáciách, pri aplastickej anémii, pri aplázii červených krviniek ako aj pri ďalších autoimunitne podmienených ochoreniach. V dávke 2,5–3 mg/kg/deň je CSA efektívnym liečivom aj v terapii ITP a je ho možné kombinovať aj s prednizonom. Pri jeho použití bolo klinické zlepšenie pozorované u viac ako 80 % pacientov rezistentných na terapiu prvej línie ITP pričom až 42 % z nich dosiahlo kompletnú odpoveď6). Klinické použitie CSA je limitované hlavne jeho interakčným potenciálom (jeho plazmatickú hladinu zvyšujú inhibítory CYP P-450, zatiaľ čo induktory CYP P-450 ju naopak znižujú) ako aj pre výskyt viacerých nežiaducich účinkov (hlavne u niektorých skupín pacientov, ako sú starší pacienti či pacienti s renálnou insuficienciou)5). CSA môže u pacientov spôsobiť nielen imunologické komplikácie (zvýšený výskyt infekcií), ale aj neurologické abnormality (neuropatie, parestézie, tremor, kŕče, bolesti hlavy, zmätenosť, ospalosť), kožné komplikácie (hirsutizmus, akné), gastrointestinálne poruchy (nauzeu a zvracanie, hypertrofiu ďasien, hepatotoxicitu, hnačky), metabolické zmeny (hyperglykémiu), kardiovaskulárne komplikácie (hypertenziu, trombózy) či renálnu dysfunkciu5).
Predložená práca približuje prípad pacientky s ITP a jej terapiu zaznamenanú počas osemnástich rokov, ako aj analýzu faktorov, ktoré mohli viesť k vzplanutiu ochorenia a k refrakterite ochorenia na terapiu CSA.
Kazuistika pacientky s ITP
Pacientka vo veku 31 rokov bola po vykonanom gynekologickom zákroku pre protrahovanú metrorágiu s kritickým poklesom hematologických parametrov (Hb 30 g/l, PLT 12–109/l) odoslaná na kliniku hematológie a onkohematológie pre suspektnú diagnózu autoimunitnej trombocytopénie pri verifikovaných antitrombocytárnych protilátkach.
Rodinná anamnéza: Otec a matka zomreli na infarkt myokardu, brat zomrel na lupus erythematosus a sestra na diabetes mellitus, pacientka má ešte dvoch žijúcich súrodencov.
Osobná anamnéza: Matka dvoch detí, po druhom pôrode sa objavilo krvácanie do mozgu, inak bez ďalších vážnejších predchádzajúcich ochorení, nikotinizmus (dlhodobo 20 cigariet denne) a udávaná alergia na gumu a plast, výška 152 cm, 71 kg, BMI = 30,7, TK 140/75 mm Hg, teplota 36,7 °C.
Lieková anamnéza: Pred hospitalizáciou na gynekologickej klinike neudávala žiadnu farmakoterapiu, na gynekologickej klinike jej bol naordinovaný medroxyprogesterón.
ORL vyšetrenie: laryngitis chronica acuta exacerbata.
Kožné vyšetrenie: dermatitis contacta irritativa (post laeucoplast).
Stomatologické vyšetrenie: extrakcia zuba 14 (fokus).
Fyzikálne a biologické vyšetrenie pri prijatí: orientovaná, normostenická, výživa a hydratácia primeraná, afebrilná, s prejavmi hemoragickej diatézy na koži (početné hematómy a petéchie na horných končatinách). Hlava je orientovaná, neurologicky v norme, orofarynx začervenaný, uši a nos bez výtoku, tonzily nezväčšené. Krk je súmerný, štítna žľaza a lymfatické uzliny nezväčšené, pulzácie na karotidách hmatné. Hrudník súmerný, eupnoe, dýchanie vezikulárne, bez vedľajších fenoménov. Frekvencia srdca pravidelná (78/min), ozvy ohraničené. Abdomen priehmatný, bez palpačnej citlivosti, hepar negatívny, lien negatívny, tapot bilaterálne negatívny. Dolné končatiny bez opuchov a varixov. V rámci hematologických ukazovateľov boli viaceré z nich mimo referenčných hodnôt (erytrocyty 2,1–2,9 × 1012/l, stredný objem erytrocytov 79,0–88,5 fl, hemoglobin 69–109 g/l, leukocyty 16,0–15,6 × 109/l, trombocyty 12–35 × 109/l).
Farmakoterapia počas hospitalizácie: erytrocytárne preparáty (i.v.), etamsylát (i.v. aj p.o,), terlipresín (i.v.), perorálne preparáty železa, kyselina askorbová (p.o.), medroxyprogesterón (p.o.), hydroxyprogesterón (p.o.), prednizon (p.o.), perorálne antacidá (p.o.), ranitidín (p.o.), ofloxacín (p.o.), roxitromycín (p.o.), flukonazol (p.o.).
Priebeh ochorenia: Počas prvotnej hospitalizácie bola pacientka saturovaná erytrocytmi a boli realizované kompletné hematologické vyšetrenia so záverom imunitnej trombocytopénie a s vylúčením lymfoproliferatívneho ochorenia. V rámci prvého roka po stanovení diagnózy (Dg) bola realizovaná farmakoterapia glukokortikoidmi a vykonaná splenektómia (ako prvé doporučované postupy terapie ITP s udávanou účinnosť u cca 85 % pacientov), ktoré však mali len limitovaný terapeutický efekt. Z uvedeného dôvodu bola pacientka okrem prednizonu (v prvom, treťom, siedmom, ôsmom a jedenástom roku po stanovení Dg) intermitentne opakovane preliečená aj viacerými imunosupresívne pôsobiacimi liečivami ako boli CSA (obr. 1), interferón alfa-2b (v treťom roku po stanovení Dg), danazol (v treťom a štvrtom roku po stanovení Dg), cyklosporín (v šiestom roku po stanovení Dg), cyklofosfamid (v siedmom roku po stanovení Dg), resp. mykofenolát mofetil (v 3. a 4. roku po stanovení Dg) no bez očakávaného terapeutického účinku. Pozitívny dlhodobejší terapeutický efekt a vzostup trombocytov bol zaznamenaný až po terapii rituximabom (v priebehu 8. roka po stanovení Dg). Potreba viacerých naplánovaných chirurgických zákrokov si u pacientky vyžadovala prípravu intravenóznymi imunoglobulínmi (v 6. a 7. roku po stanovení Dg), po ktorých nastal krátkodobý vzostup trombocytov. Etamsylát, terlipresín a kyselina paraaminobenzoová boli podávané na zvládnutie krvácania v čase, kedy nebolo možné pacientke podať transfúzie krvných preparátov, kvôli prítomnosti protilátok. K primárnej diagnóze ITP sa neskôr pridružila aj autoimunitná hemolytická anémia (AIHA), ktorej ataky boli kompenzované metylprednizolónom, prednizonom, cyklofosfamidom, CSA a erytropoetínom.
1. Namerané hodnoty počtu trombocytov (PLT) vo vzťahu k plazmatickej hladine cyklosporínu A (CSA) zaznamenané počas kontrolných vyšetrení v jednotlivých etapách liečby u pacientky s diagnostikovanou primárnou idiopatickou trombocytopéniou 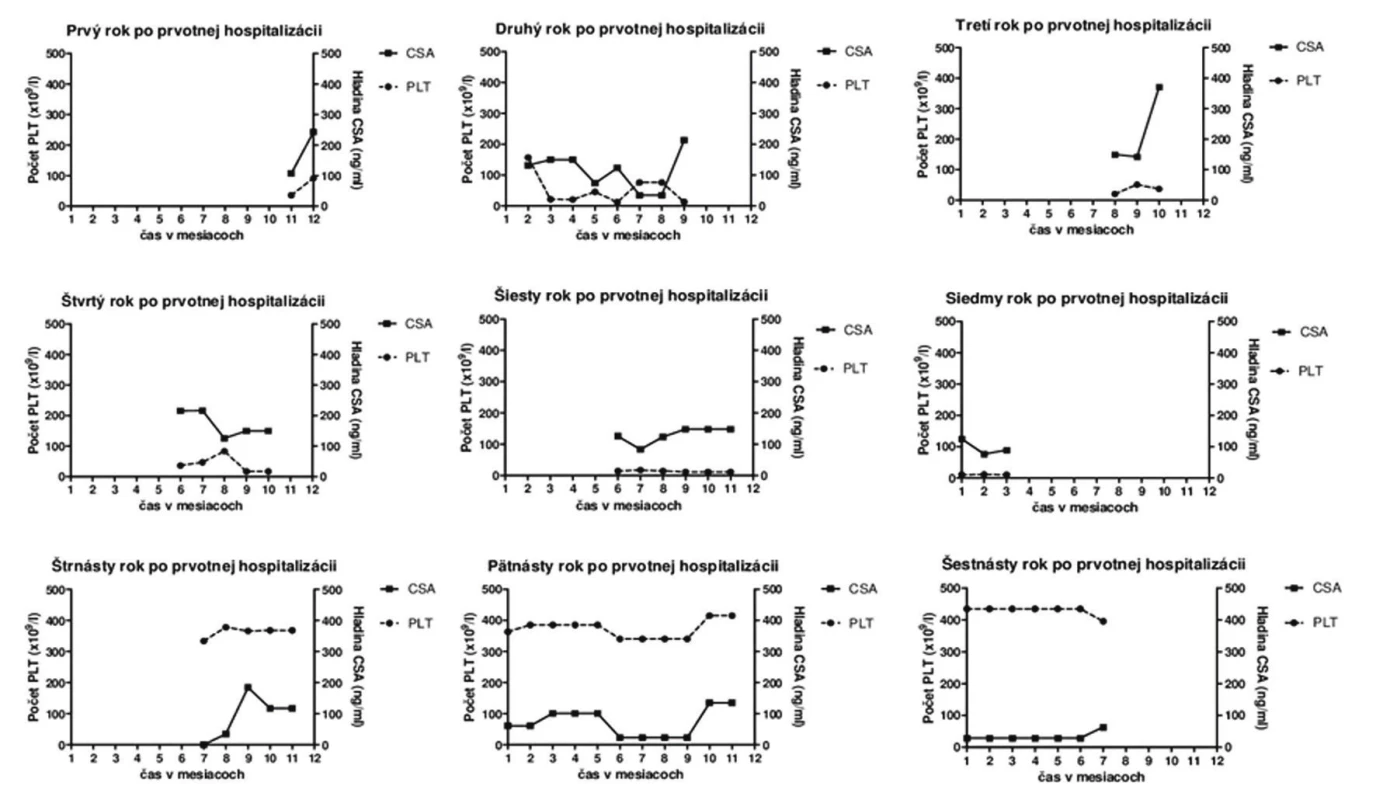
Diskusia
Aj keď sa pacientke pre použitú imunosupresívnu terapiu nepodarilo jednoznačne verifikovať diagnózu systémového lupus erythematosus (SLE), v jej rodinnej anamnéze bol jeho výskyt potvrdený, pričom bolo dokázané, že ak má už jeden súrodenec SLE, riziko výskytu tohto, resp. iného autoimunitného ochorenia u druhého súrodenca je až 20-krát vyššie v porovnaní so zvyškom populácie7). Okrem uvedeného viaceré štúdie poukazujú aj na vyššie riziko výskytu SLE resp. iného autoimunitného ochorenia k prvotne stanovenej diagnóze ITP u žien v strednom veku8–11). Na autoimunitnú príčinu ITP môže u pacientky poukazovať aj to, že u nej bola tesne pred stanovením diagnózy ITP zaznamenaná aj dermatitída po aplikácii leukoplastu, pričom v literatúre sú údaje o asociácii trombocytopénie refraktérnej na terapiu CSA či iné imunosupresíva s výskytom alergickej reakcie na plasty12).
Vzhľadom k tomu, že prednizon ako liečivo prvej voľby ITP mal u pacientky len krátkodobý terapeutický efekt, bol nahradený CSA. Hoci je CSA na Slovensku, resp. v Českej republike v danej indikácii používaný iba v “off-label” indikácii13–14) je jeho podávanie pri ITP klinicky zdokumentované a odpublikované15). CSA bol v terapii u pacientky použitý celkovo 6krát, z toho 2krát ako monoterapia ITP, resp. AIHA, pričom použitie CSA pri refraktérnej trombocytopénii sa považuje za efektívne vzhľadom k supresii aktivácie CD4 T buniek16) a hoci efektívna odpoveď nie je vždy zaručená17), pohybuje sa odhadom na úrovni 25 % u refraktérnych ITP stavov18). U pacientky bol CSA v terapii ITP intermitentne použitý v dávkach od 1,25–5 mg/kg/deň, pričom sa za optimálnu terapeutickú dávku CSA v terapii ITP dá považovať rozmedzie 2,5–3 mg/kg/deň19). Už terapia nízkymi dávkami CSA u refraktérnej formy ITP je však asociovaná s odpoveďou na jeho liečbu u 40–55 % pacientov20) a až u jednej tretiny pacientov je asociovaná aj s dlhodobou remisiu ochorenia6).
Napriek tomu, že boli pacientke počas celej doby užívania CSA stanovované jeho hladiny na zabezpečenie minimalizácie nežiaducich účinkov terapie, neexistuje jednoznačná korelácia medzi dávkou CSA a jeho hladinou v krvi. Hladina CSA by sa však počas terapie ITP mala pohybovať v rozmedzí 200–400 ng/ml20), pričom priemerná nameraná hladina CSA sa u pacientky pohybovala na úrovni 124,09 ± 12,98 ng/ml (najnižšia 34,2 ng/ml a najvyššia 370,91 ng/ml) a počet trombocytov na úrovni 140,3 ± 28,33 × 109/l (najnižší 10 × 109/l a najvyšší 435 × 109/l). Jedným z možných vysvetlení refrakterity na účinok CSA u pacientky by mohla byť jej len čiastočná compliance, vzhľadom k tomu, že sa v jej anamnéze už viackrát vyskytol prípad non-compliance s diklofenakom a tolperizonom či dokonca aj s imunosupresívne pôsobiacim liečivom (mykofenolát mofetilom), ktoré si sama naordinovala v priebehu šiesteho roka po stanovení Dg. K refrakterite na CSA však v danom prípade mohlo prispievať aj viacero ďalších skutočností, ako napríklad to, že pacientka je dlhodobá silná fajčiarka a dlhodobí fajčiari zároveň vykazujú aj vyššie percento rezistencie na CSA21). Ďalším dôvodom refrakterity na terapiu CSA by mohol byť génový polymorfizmus MDR-1 génu súvisiaci s rezistenciou na uvedené liečivo, pričom je známe, že TT genotyp uvedeného génu je asociovaný nielen s vyšším zastúpením v rómskej populácii22), ku ktorej patrí aj uvedená pacientka (polymorfizmus MDR-1 génu sa však u danej pacientky nestanovoval), no je frekventovanejší aj u žien, a je spojený aj s vyšším výskytom rezistencie na CSA21).
Výskyt, resp. vznik autoimunitnej trombocytopénie môže byť ojedinele navodený aj užívaním niektorých liečiv, pričom sa u pacientky počas sledovaného obdobia vyskytli aj také, u ktorých bol tento fakt aj klinicky zdokumentovaný, ako to bolo napr. pri užívaní penicilínu, sulfametoxazol/trimetoprimu23), flukonazolu, diklofenaku, ibuprofenu, hydrochlorotiazidu, furosemidu, diazepamu24–25), gliklazidu26), ranitidínu27), metylprednizolónu28), či nízkomolekulárnych heparínov29–30). Prechodné zníženie počtu PLT bolo popísané aj v dvoch kazuistikách po užívaní kaptoprilu31) a ciprofloxacínu32), ktoré sa v pacientkinej liekovej anamnéze taktiež vyskytovali.
Keďže pacientka nereagovala na viacnásobné pokusy terapie rôznymi typmi liečiv, naskytá sa otázka, prečo nakoniec dosiahla dlhodobú remisiu. Za kompletnú remisiu pacientky je pravdepodobne zodpovedná terapia rituximabom, čím pacientka spadá do skupiny asi 30 % refraktérnych pacientov, ktorí dosahujú dlhodobú kompletnú remisiu indukovanú rituximabom33). Neskorší efekt terapie rituximabom bol u pacientky zaznamenaný po ôsmich mesiacoch od prvotného podania, čím korešponduje s priemerom prejavu oneskorenej terapeutickej odpovede, ktorá sa pohybuje od piatich mesiacov po jeden rok34–35).
Výsledky tejto práce poukazujú pravdepodobne na multifaktoriálny pôvod ochorenia pacientky, pričom k refrakterite na terapiu CSA mohli prispieť viaceré z nich, ako bolo dlhodobé fajčenie, možný polymorfizmus MDR-1 génu, genetická predospozícia na výskyt autoimunitných ochorení, hypersenzitivita imunitného systému v podobe alergických stavov, diskutabilná compliance zo strany pacientky, prekonané infekcie ako aj vplyv niektorých užívaných liečiv.
Práca bola súčasťou rigorózneho konania prvého autora článku.
Konflikt záujmov: žiadny.
Došlo 2. júla 2017
Prijato 2. októbra 2017
doc. PharmDr. Zdenko Pirník, PhD.
Ústav experimentálnej endokrinológie BMC SAV
Ústav humánnej a klinickej farmakológie UVLF
Komenského 73, 041 81 Košice, SR
e-mail: pirnik@uvm.sk
L. Schwarzová
Ústav humánnej a klinickej farmakológie, Katedra farmakológie a toxikológie
Univerzita veterinárskeho lekárstva a farmácie, Košice, SR
N. Štecová
Klinika hematológie a onkohematológie, Univerzitná nemocnica
Louisa Pasteura, Košice, SR
Sources
1. Lakshmanan S., Cuker A. Contemporary management of primary immune thrombocytopenia in adults. Journal of Thrombosis and Haemostasis 2012; 10, 1988–1998.
2. Cines D. B., et al. The Handbook First Edition. Immune thrombocytopenia. European School of Haematology 2011.
3. Penka M., a kol. Neonkologická hematologie. Praha: Grada Publishing 2009.
4. Mizutani H., et al. Mechanisms of corticosteroid action in immune thrombocytopenic purpura (ITP): experimental studies using ITP-prone mice. Blood 1992; 79, 942–947.
5. Kahan B. D. Cyclosporine. The New England Journal of Medicine 1989; 321, 1725–1738.
6. Emilia G., et al. Long-term salvage therapy with cyclosporin A in refractory idiopathic thrombocytopenic purpura. Blood 2002; 99, 1482–1485.
7. Vyse T. J., Todd J. A. Genetic analysis of autoimmune disease. Cell 1996; 85, 311–318.
8. Shiozaki H., et al. Autoantibodies neutralizing thrombopoietin in a patient with amegakaryocytic thrombocytopenic purpura. Blood 2000; 95, 2187–2188.
9. Gesundheit B., et al. Cyclosporin A in the treatment of refractory immune thrombocytopenic purpura in children. European Journal of Haematology 2001; 66, 347–351.
10. Neylon A. J., et al. Clinically significant newly presenting autoimmune thrombocytopenic purpura in adults: a prospective study of a population-based cohort of 245 patient. British Journal of Haematology 2003; 122, 966–974.
11. Simanek R., et al. Late spontaneous remissions in severe adult autoimmune thrombocytopenia. Annals of Hematology 2007; 86, 705–710.
12. Khawandanah M. O., et al. Autoimmune hemolytic anemia and thrombocytopenia attributed to an intrauterine contraceptive device. Transfusion 2015; 55, 657–660.
13. Súhrn charakteristických vlastností lieku. Equoral 100 mg. Štátny ústav pre kontrolu liečiv. Dostupné z: https://www.adcc.sk/web/humanne-lieky/spc/equoral-100-mg-spc-6549.html
14. Súhrn charakteristických vlastností lieku. Sandimmun Neoral. 100mg. Státní ústav pro kontrolu léčiv. http://www.sukl.cz/modules/medication/detail.php?code=0015641&tab=texts
15. Tesfaye H., et al. Cyclosporine use in miscellaneous clinical settings other than organ transplantations: Is there any evidence for target levels? Annals of Transplantation 2008; 13, 34–40.
16. Choi P. Y., et al. A novel triple therapy for ITP using high-dose dexamethasone, low-dose rituximab, and cyclosporine (TT4). Blood 2015; 126, 500–503.
17. Pasquale D., et al. Chronic relapsing thrombotic thrombocytopenic purpura: role of therapy with cyclosporine. American Journal of Hematology 1998; 57, 57–61.
18. Souček M., a kol. Vnitřní lékařství. 1. díl. Praha: Grada Publishing 2011.
19. Provan, D., Newland A. C. Current Management of Primary Immune Thrombocytopenia. Advances in therapy 2015; 32, 875–887.
20. Choudhary D. R., et al. Efficacy of cyclosporine as a single agent therapy in chronic idiopathic thrombocytopenic purpura. Haematologica 2008; 93, e61.
21. Daniel F., et al. Multidrug Resistance Gene-1 Polymorphisms and Resistance to Cyclosporine A in Patients with Steroid Resistant Ulcerative Colitis. Inflammatory Bowel Disease 2007; 13, 19–23.
22. Sipeky C., et al. Genetic variability and haplotype profile of MDR1 (ABCB1) in Roma and Hungarian population samples with a review of the literature. Drug metabolism and Pharmacokinetics 2011; 26, 206–215.
23. Abrams C.S., et al. Thrombocytopenia. Goldman’s Cecil Medicine. 25th ed. Philadelphia, PA: Elsevier Saunders 2016.
24. Agarwal A., et al. Fluconazole-induced thrombocytopenia. Annals of Internal Medicine 1990; 113, 899.
25. Bemt V. D., et al. Drug-induced immune thrombocytopenia. Drug Safety 2004; 27, 1243–1252.
26. Buck M. L. Drug-induced Thrombocytopenia. Pediatric Cases from the Medical Literature. Pediatric Pharmacology 2010; 16, 1–4.
27. Visentin G. P., Liu C. Y. Drug induced Thrombocytopenia. Hematology/Oncology Clinics of North America 2007; 21, 685–693.
28. Bangia A. V., et al. Ranitidine-induced thrombocytopenia: A rare drug reaction. Indian Journal of Pharmacology 2011; 43, 76–77.
29. Royer B., et al. Methylprednisolone-induced immune thrombocytopenia. Blood 2010; 115, 5431–5432.
30. Ahmed I., et al. Heparin induced thrombocytopenia: diagnosis and management update. Postgraduate Medical Journal 2007; 83, 575–582.
31. Reese J. A., et al. Identifying drugs that cause acute thrombocytopenia: an analysis using 3 distinct methods. Blood 2010; 116, 2127–2133.
32. Grosbois B., et al. Thrombocytopenia induced by angiotensin converting enzyme inhibitors. British Journal of Medicine 1989; 298, 189–190.
33. Teh C, McKendrick M. Ciprofloxacin-induced thrombocytopenia. Journal of Infection and Chemotherapy 1993; 27, 213–215.
34. Hasan A., et al. Treatment with rituximab in chronic ITP patients induces long-lasting responses in approximately 30% of patients but even these patients may relapse. Repeated Courses of Rituximab in Chronic ITP: Three Different Regimens. American Journal of Hematology 2009; 84, 661–665.
35. Cooper N., et al. The efficacy and safety of B-cell depletion with anti-CD20 monoclonal antibody in adults with chronic immune thrombocytopenic purpura. British Journal of Haematology 2004; 125, 232–239.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2017 Issue 5-
All articles in this issue
- Idiopathic thrombocytopenia refractery to therapy of cyclosporine A in clinical practice – case report
- Active substances from marine organisms in clinical trials and practice
- Herbs for increasing breast-milk production
- Fatty acid composition of lipids of Iris sibirica
- Development of the composition of intramammary combined preparation based on silver citrate for veterinary use
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Herbs for increasing breast-milk production
- Idiopathic thrombocytopenia refractery to therapy of cyclosporine A in clinical practice – case report
- Active substances from marine organisms in clinical trials and practice
- Development of the composition of intramammary combined preparation based on silver citrate for veterinary use
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

