-
Medical journals
- Career
Obsahové látky listov Cornus officinalis Sieb. et Zucc.*
: Vladimír Forman; Daniel Grančai; Branislav Horváth
: Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra farmakognózie a botaniky, Bratislava 1; Univerzita Komenského v Bratislave, Farmaceutická fakulta, Centrálne laboratórium NMR 2
: Čes. slov. Farm., 2016; 65, 128-131
: Review Articles
*Venované Dr.h.c. prof. RNDr. Václavovi Suchému, DrSc. pri príležitosti jeho životného jubilea.
Predložená práca sa zaoberá izoláciou a identifikáciou obsahových látok prítomných v listoch drieňa lekárskeho (Cornus officinalis Sieb. et Zucc.). Z petroléterového extraktu listov tejto rastliny bol izolovaný β-sitosterol, z metanolového extraktu glukóza a sacharóza a z vodno-metanolového extraktu kyselina galová, kvercetín a kvercetín-3-O-glukozid (izokvercitrín). Izolované látky boli identifikované pomocou fyzikálno-chemických metód, porovnaním výsledkov so štandardami a literatúrou. Z listov Cornus officinalis Sieb. et Zucc. boli látky I–V izolované prvýkrát.
Kľúčové slová:
Cornus officinalis Sieb. et Zucc. • Cornaceae • petroléterový extrakt • metanolový extrakt • vodno-metanolový extraktÚvod
Cornus officinalis Sieb. et Zucc. – drieň lekársky z čeľade Cornaceae je ker alebo strom dosahujúci výšku 4–10 m. Rastie v lesoch a na horských svahoch, pochádza z Japonska a Kórei1). Obsahovým látkam z listov tohto druhu a ich biologickým účinkom bolo doteraz venovaných málo prác. Zistenie antiproliferatívnej a imunomodulačnej aktivity vodných záparov (lyofilizátov)2, 3) nás viedlo k štúdiu sekundárnych metabolitov, ktoré sa môžu na nich podieľať. V druhu Cornus officinalis boli doteraz opísané najmä terpény a látky polyfenolového charakteru ako flavonoidy, antokyány a triesloviny4–8). Z listov tohto druhu boli doteraz izolované kyselina oleánolová, izokvercitrín a 1,7-di-O-galoyl-D-sedoheptulóza9, 10).
Predložená práca opisuje izoláciu a identifikáciu obsahových látok petroléterového, metanolového a vodno-metanolového extraktu z listov Cornus officinalis Sieb. et Zucc. a prináša nové poznatky o ich výskyte v tejto časti rastliny.
Experimentálna časť
Materiál a metódy
Pri izolácii a identifikácii obsahových látok Cornus officinalis Sieb. et Zucc. sa použil petroléterový, metanolový a vodno-metanolový extrakt z listov. Listy sa nazbierali v Arboréte Tesárske Mlyňany, Ústave ekológie lesa Slovenskej akadémie vied v septembri 2014 a usušili pri laboratórnej teplote. Botanická charakteristika bola potvrdená Ing. Petrom Hoťkom z Arboréta Tesárske Mlyňany.
Na separáciu obsahových látok sa použil silikagél zn. Silpearl, pripravený podľa Pitru a Štěrbu11), na tenkovrstvovú chromatografiu Silufol UV 254 a 366 nm, Lucefol Quick (Kavalier, Votice, ČR) a silikagélové platne Kiessselgel 60 F254 (Merck). Detekcia chromatogramov sa robila UF žiarením pri 254 a 366 nm, kyselinou sírovou v éteri (1 : 4) s následným zahriatím na 120 °C, Neuovým skúmadlom a anilínftalátom12). Rozpúšťadlá použité pri chromatografii boli vopred predestilované.
Pri navažovaní sa používali analytické váhy Mettler AE200 (Mettler Toledo, Švajčiarsko). Teploty topenia sa merali na Koflerovom bloku (VEB Analytik, Dresden). Ultrafialové spektrá sa merali na prístroji GENESYSTM 10 (Thermo Electron Corporation, Veľká Británia) a na prístroji Specord UV/VIS (Carl Zeiss, Jena, Nemecko) v metanole a po pridaní špecifických diagnostických skúmadiel13). 1H NMR a 13C NMR spektrá boli merané na Varian NMR System 600 MHz (Varian, Inc., USA). Kyslá hydrolýza sa robila 2% kyselinou sírovou; vodná fáza sa potom neutralizovala na DOWEX-e (FLUKA AG CHEMISCHE FABRIK BUCHS SG) podľa literatúry14, 15).
Extrakcia a izolácia látok
Usušené a pomleté listy Cornus officinalis Sieb. et Zucc. (800 g) sme extrahovali v Soxhletovej aparatúre a po odparení rozpúšťadla vo vákuu sme získali petroléterový (20,5 g), chloroformový (28,5 g), etylacetátový (17,5 g) a metanolový (91,0 g) extrakt.
Petroléterový extrakt sme delili kolónovou chromatografiou na silikagéli č. 3 s obsahom 13 % vody. Kolónu sme eluovali zmesou rozpúšťadiel cyklohexán : acetón v rôznom pomernom zastúpení. Eluáty sme zachytávali v množstvách približne po 20 ml. Tieto sme postupne odparovali a na základe výsledkov tenkovrstvovej chromatografie spojili do siedmich frakcií hrubého delenia. Z frakcie č. 4 sme kryštalizáciou z uvedenej zmesi rozpúšťadiel získali látku I.
Rovnakým spôsobom sme delili látky prítomné v metanolovom extrakte. Kolónu sme eluovali zmesou rozpúšťadiel chloroform : metanol : cyklohexán v rôznom pomernom zastúpení. Eluáty sme zachytávali v množstvách približne po 50 ml. Na základe výsledkov tenkovrstvovej chromatografie sme získali deväť frakcií hrubého delenia.
Frakciu č. 4 hrubého delenia sme rechromatografovali na silikagéli č. 4 v sústave chloroform : metanol (90 : 10, 85 : 15 a 80 : 20). Frakcie sme zachytávali po 5 ml a na základe výsledkov tenkovrstvovej chromatografie spojili do siedmich frakcií. Z frakcie č. 4 sme samovoľnou kryštalizáciou z uvedenej zmesi rozpúšťadiel získali látku II.
Frakciu č. 7 hrubého delenia sme rechromatografovali na silikagéli č. 4 v sústave chloroform : metanol (80 : 20, 70 : 30 a 50 : 50). Frakcie sme zachytávali po 5 ml a na základe výsledkov tenkovrstvovej chromatografie spojili do piatich frakcií. Z frakcie č. 3 sme samovoľnou kryštalizáciou z uvedenej zmesi rozpúšťadiel získali látku III.
Vodno-metanolový extrakt sme pripravili maceráciou 340 g usušených a pomletých listov Cornus officinalis Sieb. et Zucc. (metanol : voda = 95 : 5) po predchádzajúcej macerácii chloroformom. Extrakt sme rozpustili vo vode. Prítomný chlorofyl sme oddelili vytrepávaním s petroléterom. Takto prečistený extrakt sme vytrepali do butanolu a odparili do sucha (15,0 g). Pripravený extrakt sme delili kolónovou chromatografiou na silikagéli č. 3 s obsahom 13 % vody. Kolónu sme eluovali zmesou rozpúšťadiel chloroform : metanol : acetón (90 : 5 : 5 – metanol : voda (95 : 5). Eluáty sme zachytávali v množstvách približne po 50 ml. Tieto sme postupne odparovali a na základe výsledkov tenkovrstvovej chromatografie spojili do siedmich frakcií hrubého delenia.
Frakciu č. 2 hrubého delenia sme rechromatografovali na silikagéli č. 4 v sústave chloroform : metanol : cyklohexán v rôznom pomernom zastúpení. Frakcie sme zachytávali po 5 ml a na základe výsledkov tenkovrstvovej chromatografie spojili do piatich frakcií. Z frakcie č. 3 sme samovoľnou kryštalizáciou z uvedenej zmesi rozpúšťadiel získali látku IV.
Frakciu č. 3 hrubého delenia sme rechromatografovali na silikagéli č. 4 v sústave chloroform : metanol : cyklohexán (80 : 15 : 5 a 70 : 20 : 10). Frakcie sme zachytávali po 5 ml a na základe výsledkov tenkovrstvovej chromatografie spojili do troch frakcií. Z frakcie č. 2 sme kryštalizáciou z uvedenej zmesi rozpúšťadiel získali látku V.
Frakciu č. 4 hrubého delenia sme rechromatografovali na silikagéli č. 4 v sústave chloroform : metanol : cyklohexán (70 : 20 : 10 a 60 : 30 : 10). Frakcie sme zachytávali po 5 ml a na základe výsledkov tenkovrstvovej chromatografie spojili do štyroch frakcií. Z frakcie č. 3 sme kryštalizáciou z metanolu získali látku VI.
Výsledky a diskusia
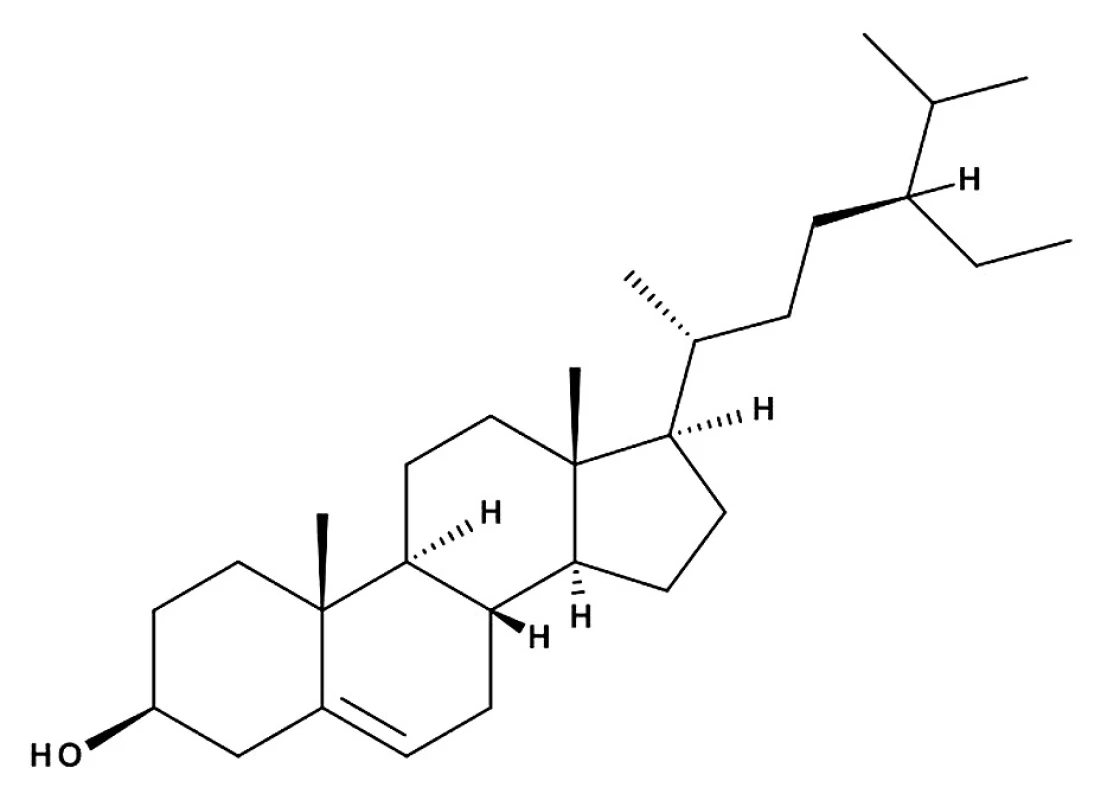
Látka I (4,5 mg) (obr. 1) bola izolovaná vo forme kryštálov s teplotou topenia 136–139 °C. V ultrafialovom spektre je transparentná. V infračervenom spektre sú pásy pri 3360 a 1035 cm–1 (-OH), 1460 cm–1 (-CH2), 1377 cm–1 (angul. CH3). Porovnaním nameraných hodnôt s literatúrou16) a so štandardom sme izolovanú látku (I) identifikovali ako β-sitosterol.
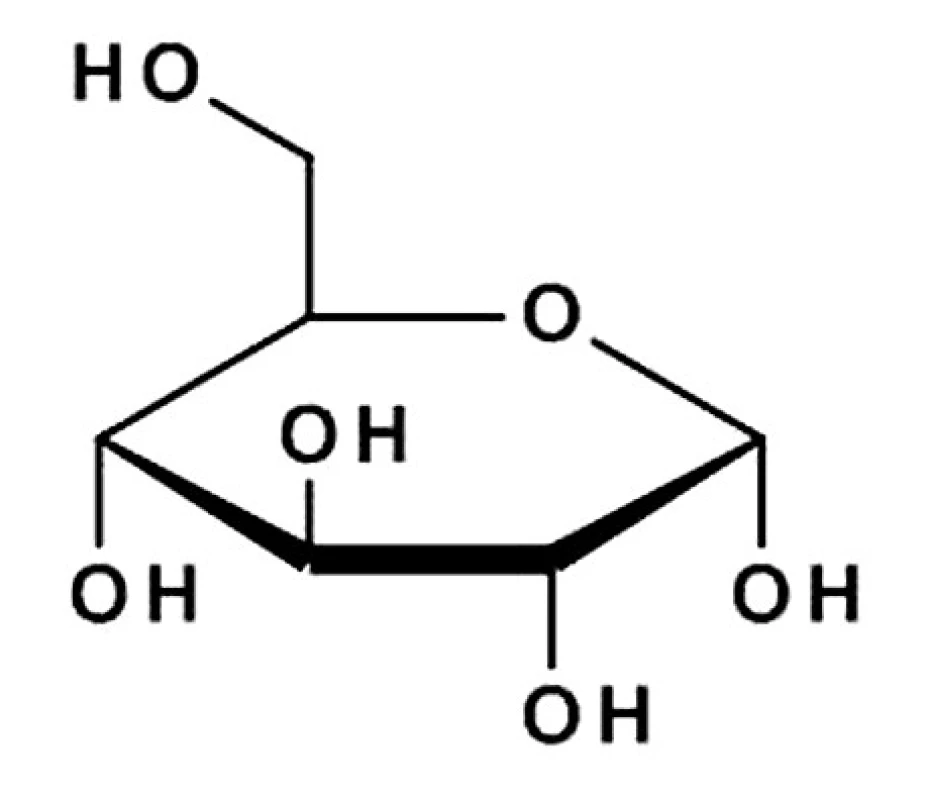
Látka II (314,0 mg) (obr. 2) bola izolovaná vo forme bielych kryštálov sladkej vône s teplotou topenia 142 až 146 °C. S anilínftalátovým skúmadlom dávala pozitívnu reakciu. V ultrafialovom spektre je transparentná. V infračervenom spektre je pás pri 3312 cm–1 charakteristický pre hydroxylové skupiny sacharidovej zložky a pásy CO - skupiny esterovej väzby pri 900–1200 cm–1 . Porovnaním nameraných hodnôt s literatúrou17) a so štandardom sme izolovanú látku (II) identifikovali ako glukóza.
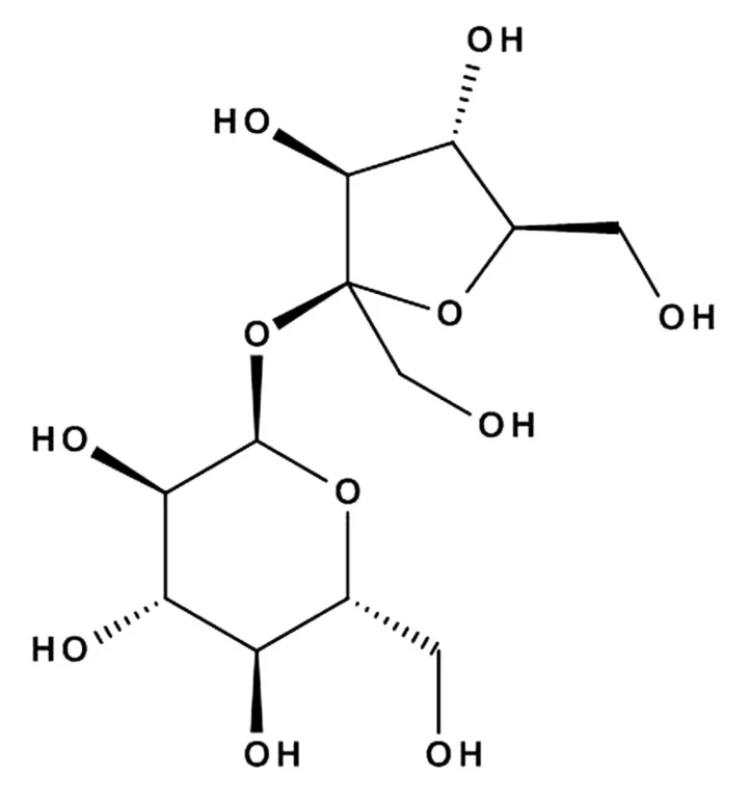
Látka III (169,9 mg) (obr. 3) bola izolovaná ako biela kryštalická sladkej vône s teplotou topenia 178 až 184 °C. S anilínftalátovým skúmadlom dávala pozitívnu reakciu. V ultrafialovom spektre je transparentná. V infračervenom spektre je pás pri 3354 cm–1 charakteristický pre hydroxylové skupiny sacharidovej zložky a pásy CO - skupiny esterovej väzby pri 900–1200 cm–1 . Porovnaním nameraných hodnôt s literatúrou17) a so štandardom sme izolovanú látku (III) identifikovali ako sacharóza.
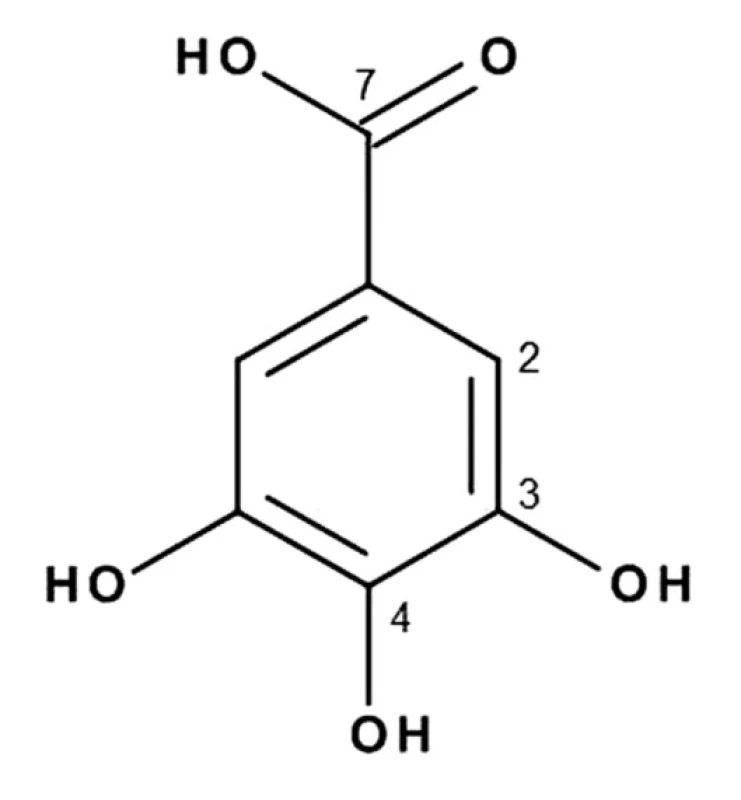
Látka IV (5,0 mg) (obr. 4) bola izolovaná ako biela kryštalická s teplotou topenia 220–225 °C. V ultrafialovom spektre pri vlnovej dĺžke 366 nm vykazuje modrú fluoreskujúcu škvrnu. V infračervenom spektre sú pásy pri 1020 a 3274 cm–1 typické pre hydroxylové skupiny, pás pri 3067 cm–1 charakteristický pre aromatické vodíky, široký difúzny pás karboxylovej skupiny pri 2358–2660 cm–1 a pásy pri 1697, 1615 a 1540 cm–1 charakteristické pre benzénové jadro. Porovnaním nameraných hodnôt s literatúrou18) a so štandardom sme izolovanú látku (IV) identifikovali ako kyselina galová.
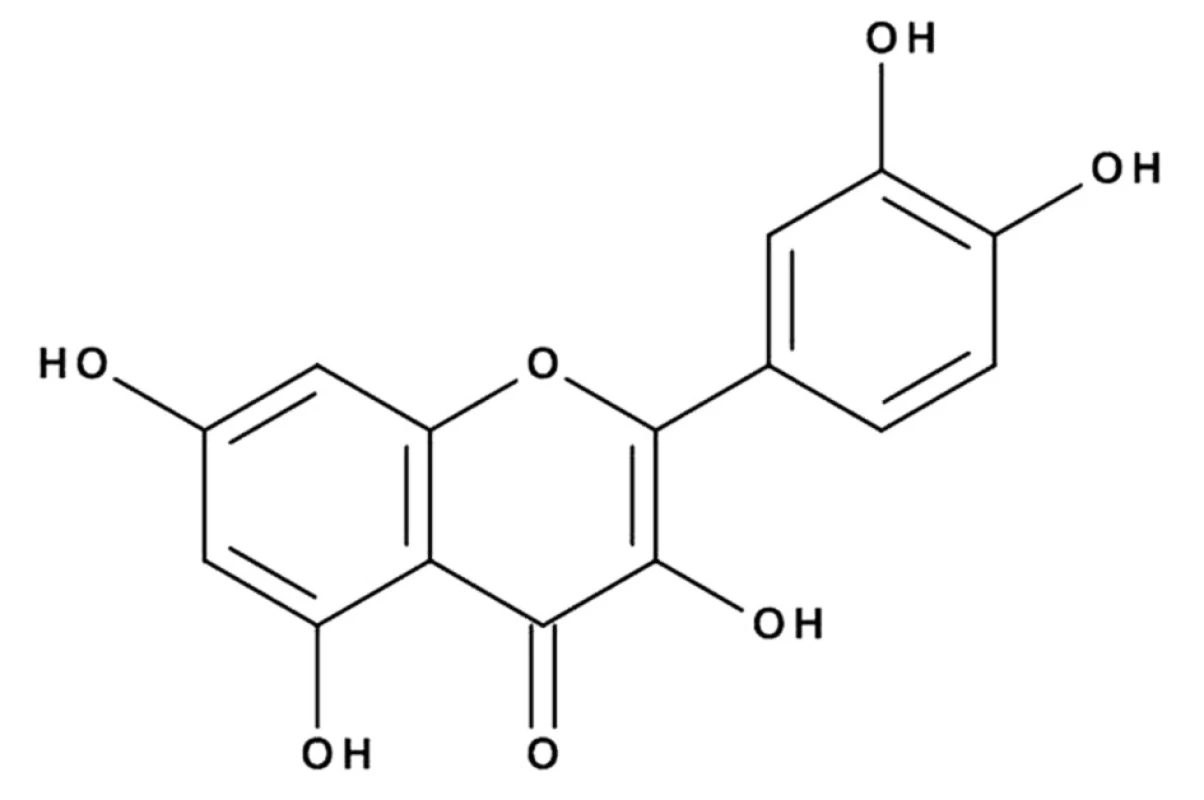
Látka V (5,0 mg) (obr. 5) bola izolovaná ako žltá práškovitá s teplotou topenia 310–314 °C. Utrafialové spektrum v metanole vykazuje pásy typické pre flavón: λMeOHmax nm: 255 a 371. Porovnaním nameraných hodnôt s literatúrou19) a so štandardom sme izolovanú látku (V) identifikovali ako kvercetín.
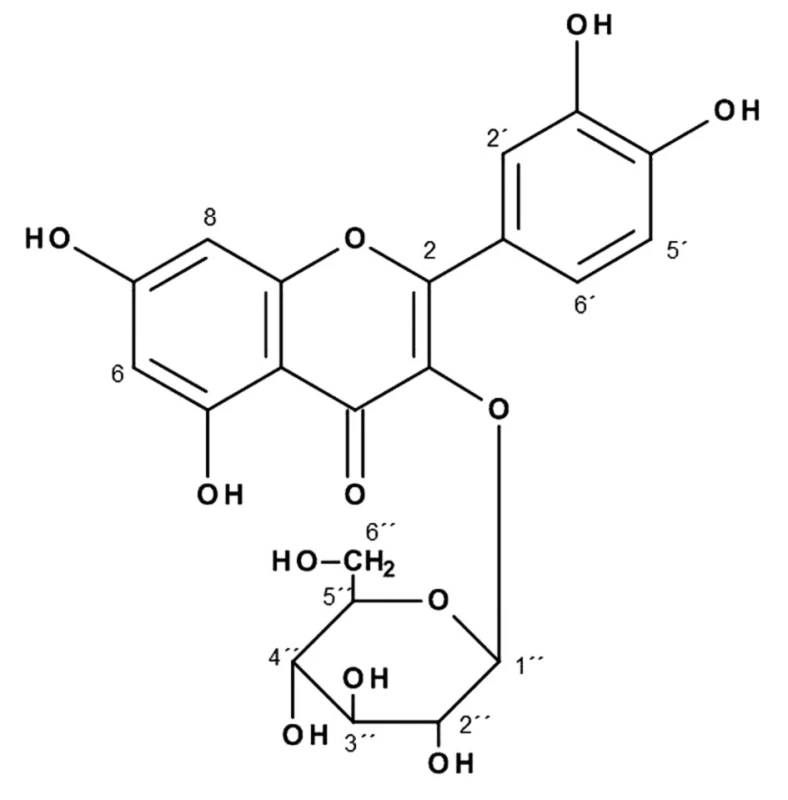
Látka VI (6,0 mg) (obr. 6) bola izolovaná ako svetložltá práškovitá s teplotou topenia 180–182 °C. Hmotnostné spektrum vykazuje molekulový ión [M-H] o m/z 463 (glykozid kvercetínu, cukor 162) a fragment o m/z 301 (aglykón). Utrafialové spektrum v metanole vykazuje pásy typické pre flavón: λMeOHmax nm: 254, 265sh, 293 a 358.
Po pridaní špecifických diagnostických skúmadiel sme namerali nasledujúce posuny maxím:
λNaOMemax nm: 270, 320sh, 409 ; λAlCl3max nm: 270, 295sh, 430; λAlCl3/HClmax nm: 265, 295sh, 400; λNaOAcmax nm: 267, 398; λNaOAc/H3BO3max nm: 256, 368
1H NMR: δ ppm (DMSO-d6, 600 MHz): δ 12,52 (1H, s, HO-C(5)); 10,91 (1H, br. s, HO-C(7)); 9,72 (1H, br. s, HO-C(3´)); 9,32 (1H, br. s, HO-C(4´)); 7,65 (1H, br. s., J = 2,2 Hz, H-C(2´)); 7,55 (1H, dd, J = 8,5, 2,0 Hz, H-C(6´)); 6,81 (1H, d, J = 8,5 Hz, H-C(5´)); 6,39 (1H, d, J = 2,0, H-C(8)); 6,19 (1H, d, J = 2,0, H-C(6)); 5,69 (1H, s, br., HO); 5,45 (1H, d, J = 7,0, H-C(1´´)); 5,18 (1H, s, br., HO); 5,00 (1H, s, br., HO); 4,8 (1H, s, br., HO); 3,67 (1H, m, H-C(6´´)); 3,54 (1H, m, H-C(2´´ alebo 3´´ alebo 4´´ alebo 5´´)); 3,43 (1H, m, H-C(6´´)) 3,36–3,27 (3H, m, H-C(2´´), H-C(3´´), H-C(4´´), H-C(5´´)
13C NMR: δ ppm (DMSO-d6, 151 MHz): δ 177,67 (C-4), 164,70 (C-7), 156,80 (C-9 alebo C-2), 156,73 (C-9 alebo C-2), 149,05 (C-4´), 145,36 (C-3´), 132,16 (C-3), 122,00 (C-6´), 121,24 (C-1´), 116,72 (C-2´), 115,67 (C-5´), 101,72 (C-1´´), 76,48 (C-2´´ alebo C-3´´ alebo C-4´´ alebo C-5´´), 76,13 (C-2´´ alebo C-3´´ alebo C-4´´ alebo C-5´´), 74,25 (C-2´´ alebo C-3´´ alebo C-4´´ alebo C-5´´), 71,74 (C-2´´ alebo C-3´´ alebo C-4´´ alebo C-5´´), 61,59 (C-6´´)
Na základe výsledkov spektrálnej analýzy a tenkovrstvovej chromatografie na Silufole možno predpokladať, že látka (VI) je glykozid kvercetínu. Aglykón získaný kyslou hydrolýzou bol zhodný so štandardom kvercetínu. Sacharidová zložka sa zhodovala so štandardom glukózy.
Na základe nameraných hodnôt sme izolovanú látku (VI) identifikovali ako kvercetín-3-O-glukozid (izokvercitrín).
Práca bola realizovaná s podporou grantovej úlohy č. 1/0059/11 VEGA Ministerstva školstva SR.
Stret záujmov: žiadny.
Došlo: 15 júla 2016
Prijato: 15 augusta 2016
V. Forman • prof. RNDr. Daniel Grančai, CSc.
Univerzita Komenského v Bratislave
Farmaceutická fakulta, Katedra farmakognózie a botaniky
Odbojárov 10, 832 32 Bratislava, SK
e-mail: grancai@fpharm.uniba.sk
B. Horváth
Univerzita Komenského v Bratislave
Farmaceutická fakulta, Centrálne laboratórium NMR
Sources
1. Xiang Q., Boufford D. E. Cornaceae. Flora of China. 2005; 14, 206–221.
2. Forman V., Haladová M., Grančai D., Ficková M. Antiproliferative activities of water infusions from leaves of five Cornus L. species. Molecules 2015; 20, 22546–22552.
3. Forman V., Bukovský M., Grančai D. Immunomodulatory activity of leaf infusions of selected Cornaceae species on human leukocytes. Nat. Prod. Commun. 2016; 11, 685–687.
4. Miyazawa M., Kameoka H. Volatile flavor components of crude drugs 7. Volatile flavor components of Corni fructus (Cornus officinalis Sieb. et. Zucc.). Agric. Biol. Chem. 1989; 53, 3337–3340.
5. Hatano T., Yasuhara T., Abe R,. Okuda T. Tannins of cornaceous plants 3. A galloylated monoterpene glucoside and a dimeric hydrolyzable tannin from Cornus officinalis. Phytochemistry 1990; 29, 2975–2978.
6. He Y-Q., Ma G-Y., Peng J., Ma Z-Y., Hamann M. T. Liver X receptor and peroxisome proliferator-activated receptor agonist from Cornus alternifolia. Biochim. Biophys. Acta 2012; 1820, 1021–1026.
7. Hatano T., Yasuhara T., Okuda T. Tannins of cornaceous plants 2. Cornusiin-D, cornusiin-E and cornusiin-F, new dimeric and trimeric hydrolyzable tannins from Cornus officinalis. Chem. Pharm. Bull. 1989; 37, 2665–2669.
8. Seeram N. P., Schutzki R., Chandra A., Nair M. G. Characterization, quantification, and bioactivities of anthocyanins in Cornus species. J. Agric. Food Chem. 2002; 50, 2519–2523.
9. Ma Z-Y., Yao B-h., Wang L-j., He Y-Q. Chemical constituents from Cornus officinalis and their biological activity. Chron. Young Scientists 2012; 3, 209–211.
10. Lee S. H., Tanaka T., Nonaka G-I., Nishioka I. Tannins and related compounds 86. Sedoheptulose digallate from Cornus officinalis. Phytochemistry 1989; 28, 3469–3472.
11. Pitra J., Štěrba J. Třídění silikagélu pro chromatografii. Chem. Listy 1963; 57, 389–391.
12. Šaršúnová M., Schwarz V., Michalec Č. Chromatografia na tenkých vrstvách vo farmácii a klinickej biochémii. Bratislava: Osveta 1977.
13. Mabry T. J., Markham K. R., Thomas M. R. The systematic identification of flavonoids, New York: Springer Verlag 1970.
14. Friedrich H. Über das Vorkommen von Isorhamnetin-Glykosiden in den Blüten von Calendula officinalis L. Arch. Farm. 1962; 295, 59–66.
15. Friedrich H. Untersuchungen über die Isorhamnetin-Glykoside aus den Blüten von Calendula officinalis L. Arch. Farm. 1962; 295, 464–471.
16. Suchý V., Grančai D., Grznár K., Tomko J., Dolejš L., Buděšínský M. Non-alkaloidal constituents of Veratrum album subsp. Lobelianum (BERNH.) Suessenguth. Acta Universitatis Palackianae Olomucensis 1980; 93, 141–147.
17. Devon T. K., Scott A. I. Handbook of Naturally Occuring Compounds: Vol. I Acetogenins, Shikimates and Carbohydrates. New York: Academic Press 1975.
18. PUBCHEM database. [online]. [cit. 2016-20-04]. Dostupné na:
http://pubchem.ncbi.nlm.nih.gov
19. Dictionary of Natural Products on CD-ROM, Chapman and Hall, Version 6 : 2, January 1998.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2016 Issue 4-
All articles in this issue
- Constituents of the leaves of Cornus officinalis Sieb. et Zucc.
- Cellular and molecular mechanisms of action of bitter compounds: recent knowledge and perspective
- Phenolic compounds in leaves insertions of Mentha × villosa Huds. cv. Snežná
- Use of plant extracts as an efficient alternative therapy of respiratory tract infections*
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Use of plant extracts as an efficient alternative therapy of respiratory tract infections*
- Cellular and molecular mechanisms of action of bitter compounds: recent knowledge and perspective
- Phenolic compounds in leaves insertions of Mentha × villosa Huds. cv. Snežná
- Constituents of the leaves of Cornus officinalis Sieb. et Zucc.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career