-
Medical journals
- Career
MUTÁCIA BRAF A MOŽNOSTI IDENTIFIKÁCIE PROGNOSTICKÝCH MARKEROV METASTÁZOVANIA UVEÁLNEHO MELANÓMU
Authors: K. Horkovičová 1; J. Markus 2; I. Krčová 1; P. Babál 3; D. Kobzová 3; B. Smolková 4
Authors‘ workplace: Klinika oftalmológie Lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice, Nemocnica Ružinov, Bratislava 1; Oddelenie genetiky, Onkologický ústav sv. Alžbety, Bratislava 2; Ústav patologickej anatómie LFUK a UNB, Bratislava 3; Ústav experimentálnej onkológie BMC SAV, Bratislava 4
Published in: Čes. a slov. Oftal., 72, 2016, No. 4, p. 149-156
Category: Original Article
Overview
Cieľ práce:
Cieľom našej práce bolo vyhodnotiť prítomnosť mutácie génu BRAF (v-Raf murine sarcoma viral oncogene homolog B1) v súbore pacientov na Klinike oftalmológie LF UK a UNB za 15 mesačné obdobie.Materiál a metodika:
Súbor pacientov s malígnym melanómom uvey, u ktorých bola indikovaná enukleácia v období 1. 1. 2015 do 1. 3. 2016. Analyzovali sme štádiá, objem, bunkový typ a mutácie génu BRAF.Výsledky:
V období od 1. 1. 2015 do 1. 3. 2016 sme na Klinike oftalmológie LFUK a UN v Bratislave indikovali 20 enukleácii pre malígny melanóm uvey. Primerný vek pacientov v súbore bol 62 rokov (od 22 do 89 rokov). V 14 prípadoch (70%) bola indikovaná primárna enukleácia pre melanóm a v 6 prípadoch (30%) išlo o enukleáciu po predchádzajúcej liečbe žiarením (brachyterapia, Leksellov gama nôž, lineárny urýchlovač). V súbore sa v 17 prípadoch (85 %) hodnotila mutácia génu BRAF ako negatívna a v 3 prípadoch bola vzorka nehodnotiteľná na mutáciu BRAF.Záver:
Mutácia génu BRAF je potvrdená viacerými štúdiami, že sa nachádza v malígnom melanóme kože. Pri histologizácii malígneho melanómu uvey sa v našom súbore nepotvrdila naša teória, že uveálny melanóm ako taký, keďže pochádza z rovnakého histologického základu, by mal taktiež obsahovať mutácie génu BRAF.Kľúčové slová:
malígny melanóm uvey, mutácia BRAF génu, chromozómové anomálie ako prognostický faktorÚVOD
Najfrekventovanejším z hľadiska výskytu, v prípade vnútroočných nádorov je malígny melanóm uvey (MMU). Najčastejšie sa vyskytuje v choroidei 78–85 %, v corpus cilliare sa nachádza okolo 9–16 % a okolo 6–9 % sa nachádza v dúhovke. Aj rozsiahle štúdie to potvrdili (12).
Z hľadiska histopatológie je možné MMU členiť na nasledovné typy, vretenobunkový typ A, v prípade ktorého majú bunky nedostatok cytoplazmy, husté jadro s absentujúcim jadierkom a uniformný tvar aj veľkosť, druhý typ je vretenobunkový typ B, v prípade ktorého majú bunky vretenovitý tvar s viditeľným jadierkom, tretím typom je epiteloidný typ, ktorý tvoria polyedrické bunky s rôznou veľkosťou, viditeľnými jadierkami, a štvrtý typ sa nazýva zmiešaný typ, kde ide o syntézu epiteloidého a vretenobunkového typu (12, 16, 19, 46).
V prípade liečby MMU v pokročilejších štádiách ide o snahu o odstránenie tumoru ako celku a zabráneniu rozšírenia metastáz do okolitých štruktúr hlavne do orbity ale aj do celého organizmu. V minulosti sa pri liečbe MMU pristupovalo výlučne k enukleácii bulbu, prípadne k exenterácii očnice (11). V súčasnosti sa pri liečbe využívajú aj iné metódy (ionizujúce žiarenie – aplikáca brachyterapie, Leksellov gama nôž, lineárny urýchľovač, protónové žiarenie) (13, 14, 15, 17, 18).
Na základe klinických štúdii a histopatologických obrazov je prognóza prežívania priaznivejšia u žien do 40 rokov, u pacientov s malými nádormi bez sklerálnej infiltrácie a taktiež v prípade výskytu vretenobunkových typov (A alebo B) nádorov. Z hľadiska prognostického je možné za nepriaznivý označiť epiteloidný typ MMU, vysokú mitotickú aktivitu, taktiež určitý typ vaskularizácie. Vaskularizácia sa v minulosti považovala ako možný prognostický faktor, avšak v súčasnosti prognostická váha tohto faktora je omnoho nižšia v porovnaní s ostatnými. Prognostická váha indikátorov je zhrnutá v súčasnej TNM klasifikácii (rozmery nádoru, prítomnosť alebo neprítomnosť extrasklerálnej progresie, atď.) a v morfologickej klasifikácii vychádzajúcej z Callenderovej klasifikácie (17, 18).
Molekulárne aspekty uveálneho melanómu
Vývoj nádorového ochorenia je často spájaný s genómovou nestabilitou a získaním genómovej heterogenity, generujúce obe populácie nádorových buniek a to klonálnu a neklonálnu (2, 29, 49). Niektoré mutácie v bunkovom cykle môžu viesť k aneuploidii, napríklad počas mitózy (2, 35). Tu je veľmi tenká hranica rovnováhy medzi možným prínosom z hromadenia genetických a epigenetických zmien a medzi smrtiacimi geneticky nestabilnými bunkami (32). Polyploidia je známa pri nádorovom bujnení a má tendenciu sa vyskytovať v nádoroch s agresívnejším fenotypom (4, 28).
Súčasný výskum sa zameriava na hľadanie ciest zapojených do karcinogénneho potenciálu, a tým sa snaží porozumieť vzniku, rozvoju tumoru v rannom štádiu a prechod až na metastatické ochorenie.
Chromozómové anomálie ako prognostický faktor
Určité chromozomálne anomálie, ako delécie chromozómu 1p, monozómie chromozómu 3 alebo získanie chromozómu 8q, veľmi silno korelujú so zníženým prežívaním pacientov s uveálnym melanómom. Chromozomálna aberácia monozómia chromozómu 3 sa najčastejšie nachádza v uveálnom melanóme a nachádza sa predovšetkým v metastázujúcich tumoroch (41). V univarietnej analýze, monozómia 3 bola najvýznamnejším prediktorom (p < 0,0001) zlej prognózy uveálneho melanómu, nasledujúc lokalizácia nádoru a priemer (2, 34). Toto sa považuje za primárne z hľadiska toho, že sa vyskytujú v kombinácii s ostatnými chromozomálnymi aberáciami v uveálnych melanómoch ako napríklad strata chromozómu 1p, zosilnenie 6p a zisk 8Q (35). Zriedka boli opísané melanómy s parciálnymi aberáciami na chromozóme 3 alebo translokácie, takže je veľmi obtiažne zmapovať predpokladané tumorsupresorové gény (36, 37).
Súčasná strata chromozómov 1p a 3 má silnejšiu koreláciu s metastatickým ochorením ako jeden z nich samostatne (30). Bežne vymazávaná oblasť na chromozóme 1 sa pohybuje od 1p34.3 do 36.2 (1, 21, 25). Združenie s chromozóm 8q bolo o niečo menej významné ako u monozómie chromozómu 3, ale bola pozorovaná silná inverzná korelácia (p < 0,0001) ďalších kópií 8q na prežitie (26). Zisk chromozómu 8, alebo zaobstaranie izochromozómie 8q, je sekundárna udalosť v uveálnom melanóme, pretože môže byť prítomný v jednom nádore variabilný počet kópií 8Q (24, 39). To sa často vyskytuje u nádorov, ktoré stratili jednu kópiu chromozómu 3, a je to nezávislý prognostický faktor progresívneho ochorenia (36, 38, 43, 46).
V skupine zadných uveálnych melanómov, prítomnosť chromozómu 6p je prediktívna k priaznivejším výsledkom (27, 28). Tieto nádory sa ziskom chromozómu 6p predstavujú špecifickú skupinu uveálnych melanómov s alternatívnou genetickou dráhou v karcinogenéze, pretože zisk 6p sa vyskytuje často u nádorov s dizómiou 3 (10, 23, 29, 31, 32).
Gény zapojené v uveálnom melanóme
Deregulácia RAS-RAF-MEK-EKR ( Rat sarcoma – Rapidly Accelerated Fibrosarcoma -Mitogen-activated protein kinase kinase extracellular-signal-regulated kinases) alebo mitogénom aktivovanej proteín kinázy (MAPK – mitogen-activated protein kinase), je bežná u mnohých ľudských zhubných nádorov (27). Mutácie konkrétnych častí týchto kľúčových molekulárnych signálnych dráh boli včlenené do tumorigenézy kožného melanómu. Mnoho z týchto často známych onkogénov (napr. BRAF) alebo supresorových génov nádoru (PTEN – Phosphatase and tensin homolog, CDKN2A - cyclin-dependent kinase Inhibitor 2A) boli tiež analyzované u uveálneho melanómu a zistilo sa, že občas sa vyskytnú mutácie týchto génov. Aj keď nebola doteraz nájdená žiadna súvislosť s rozvojom metastatického ochorenia, môže prítomnosť somatických mutácií u týchto génov poskytnúť východiskový bod pre včasné odhalenie metastatických buniek v krvi. Nádejnejšie sú nedávne výsledky dvoch často mutovaných členov MAP-kinázovej dráhy, GNAQ (G protein subunit alpha q) a GNA11 (G protein subunit alpha 11), a BAP1 (BRCA1 associated protein 1) gén. (20)
BRAF
Braf gén vyskytujúci sa na chromozóme 7q34 sa označuje ako protoonkogén BRAF a v-RAF murine sarcoma viral oncogene homolog B1. Pozostáva z 18 exónov a jeho dĺžka transkribovanej mRNA je 2478 bp. BRAF je možné označiť ako onkogén, ktorý pôsobí vo viacerých typoch tumorov, pričom má rôzne podoby, v ktorých sa vyskytujú zmeny v BRAF proteíne. Tieto môžu spôsobiť zjednodušený rast a taktiež rozšírený výskyt tumorových buniek.
Analýzou BRAF-u bolo identifikovaných najmenej 30 mutácii so zmenou v zmysle tzv. missence mutácii. Rôzne podoby mutácii BRAF génu možno identifikovať na kinázových doménach, ktoré sú lokalizované na exónoch 11 a 15. Značná časť, až 89 %, BRAF mutácii je lokalizovaných v kodónoch 595–600 exónu 15. Najtypickejšia mutácia vyskytujúca sa v exóne 15 vzniká v dôsledku bodovej mutácie DNA nukleotidu 1799, ktorá je spojená so substitúciou dusíkatej bázy thymínu (T) na adenín (A), ktorá sa označuje ako T1799A. Táto mutácia má za následok zámenu aminokyselín a následnú aktiváciu BRAF kinázy. Dochádza k substitúcii aminokyseliny valín (V) za kyselinu glutámovú (E) v kodóne 600 (7). Mutácia sa označuje ako BRAF V600E , alebo Val600Glu. Substitúcia V za E spôsobuje konštitutívnu aktiváciu BRAF.
BRAF gén kóduje proteín s rovnakým označením, ktorý parí k rodine RAF kináz. BRAF V600E destabilizuje kinázy a prispieva k tumorogenéze na základe aktivácie MAPK dráhy (47). BRAF proteín reguláciou MAPK/ERK signálnej kaskády vplýva na bunkové delenie, diferenciáciu a sekréciu. Defosforylovaný štandardný BRAF proteín zotrváva v neaktívnom stave v dôsledku hydrofóbnych interakcií medzi aktivačným miestom a ATP-väzbovým miestom. V600E mutácia vplýva k rozširovaniu týchto interakcií v dôsledku čoho dochádza k fosforylácii, ktorá v aktivačnom segmente reguluje transkripčnú aktivitu BRAF prostredníctvom začlenenia BRAF do membrány aktivovaným RAS. Fosforylácia umožnuje dosiahnutie maximálnej kinázovej aktivity a taktiež prispieva k bazálnej aktivite, ktorá je pri BRAF-e vyššia než zvyšné RAF izoméry.
Uveálny melanóm je najčastejšie sa vyskytujúci druh nádoru v oftalmológii, ktorý postihuje dospelých. Ročná incidencia je 6 až 7 prípadov na jeden milión, v 50 % je 5-ročné úmrtie pre následné metastázy, ktorú sú asociované aj s histologickými aj demografickými prognostickými faktormi (bunkový typ, rozmer tumoru, lokalizácia, chromozómové aberácie, vek a taktiež pohlavie).
Uveálne aj kožné melanómy pochádzajú z rovnakých prekurzorových buniek, z melanocytov, ktoré migrujú z neurálnej lišty na príslušné miesto počas doby embryonálneho vývoja. Podobné genetické pozadie a niektoré spoločné histologické charakteristiky poukazujú na to, že patogenéza uveálneho a kožného melanómu by mohla byť veľmi podobná. Avšak rizikové faktory ako bledá pokožka a modrá farba dúhovky môžu byť patognomické, avšak UV žiarenie a slnečné efekty sa zdajú byť signifikantné hlavne v patogenéze kožných melanómov. Okrem toho, uveálny melanóm metastázuje krvnou cestou, najmä do pečene, zatiaľ čo kožný melanóm má skôr tendenciu metastázovať a prechádzať cez lymfatický systém, zvyčajne postihujúci regionálne lymfatické uzliny. Napriek tomu je však stále málo poznatkov o molekulárnej patogenéze uveálneho melanómu. Strata funkcie génu v dôsledku delécie alebo inaktivujúcimi mutáciami je charakteristickým znakom nádorových buniek.
Dôležitosť onkogenetických mutácii v RAS/F/RAF/MEK/ERK dráhe bola dobre zdokumentovaná. Viac ako 15 % nádorov skrýva bodové mutácie RAS. Konštantná aktivácia tejto dráhy poskytuje silnú mitogénnu silu, čo vedie k abnormálnej proliferácii a diferenciáciu v mnohých druhoch nádorov. Asociácie medzi RAS a mutáciou a uveálnym melanómom bola skúmaná v niekoľkých štúdiách. Stále avšak nie je známe, či ostatné gény v RAS/RAF/MEK/ERK dráhe hrajú rolu pri vzniku uveálneho melanómu.
Mutácia BRAF V600 bola identifikovaná v prekanceróznych léziách, čo naznačuje účasť pri transformácii melanocytov. Niektoré névy, ktoré obsahujú túto mutáciu môžu mať za následok transformácui na melanóm, ale je potrebné poznamenať, že nie všetky névy s touto mutáciou sú prekancerózami. Okrem toho, zatiaľ čo BRAF mutácia V600 prispieva k vývoju melanómu, štúdie zistili, že mutácie v iných bunkových proteínoch môžu tiež hrať úlohu v tomto type nádorového ochorenia. (5).
Štúdie naznačujú významnú a nevyhnutnú úlohu RAS-RAF signalizácie na vznik melanómu. Prítomnosť aktivujúcich BRAF mutácií bola zistená až u 82 % benígnych névov. Niektorí odborníci sa domnievajú, že BRAF mutácie v benígnych névov môžu slúžiť ako markery malígneho melanómu pri citlivosti jednotlivca.
Signalizačná kaskáda RAF
Enzýmy katalyzujúce väzbu fosfátu na bočné reťazce aminokyselín serínu, threonínu alebo thyrosínu sú označované ako proteínové kinázy. Zohrávajú úlohu v množstve aspektov bunkovej biológie. Fosforyláciou dochádza k zmenám vlastností enzýmov ako napríklad k regulácii ich metabolizmu, katalytickej aktivity, transktipcie, apoptózy. Mutácie RAF vykazujú výskyt približne v jednej tretine všetkých detekovaných typov ľudských tumorov (44).
Štruktúra RAF proteínov
Za RAF je označovaná rodina proteín-serín/threonínových kináz. RAF proteíny možno označiť za esenciálne konektory medzi RAS a MEK-ERK signálnou dráhou. V prípade cicavcov môžeme rozoznávať tri odlišné RAF izoformy: ARAF (v-raf murine sarcoma 3611 viral oncogene homolog 1 ), BRAF a CRAF (v-raf-1 murine leukemia viral oncogene homolog 1). Z hľadiska funkčnosti sú RAF proteín-kinázové domény typické N-terminálne malé a veľké C – terminálne slučky. N-terminálne slučky obsahujú ATP-fosfátovú viažúcu slučku, ktorá sa označuje aj ako P-slučka. C-terminálne slučky sú zvyčajne alfa-helikálne, viažúce MEK 1/2. V prípade všetkých troch RAZ izoforiem nachádzame spoločnú výstavbovú štruktúru, ktorá pozostáva z troch konzervatívnych regiónov, ktoré sa líšia funkciami s označeným ako CR1 (Conserved region 1), CR2 (Conserved region 2) a CR3 (Conserved region 3) (44). CR1 pozostáva z RAS viažucej domény, ktorá je nevyhnutná v dôsledku interakcie s RAS a membránovými fosfolipidmi a taktiež na cysteín bohatú domému, ktorá slúži ako sekundárne RAS – viažuce miesto. V CR2 dochádza k fosforylácii CRAF. CR3 sa vyskytuje v oblasti C konca, obsahuje kinázovú doménu a taktiež aktivačný segment, ktorého fosforylácia je nevyhnutná pre kinázovú aktiváciu BRAF (26).
RAS-RAF-MEK-ERK signálna dráha
V prípade všetkých troch izoforiem RAF rodiny je prítomný ich podiel na tzv. RAS - RAF-MEK-ERK signálnej transdukčnej kaskáde. Označuje sa ako mitogénom aktivovaná proteínová kinázová kaskáda (50). Zúčastňuje sa širokého spektra procesov vrátane apoptózy, progresie bunkového cyklu, diferenciácie, proliferácie a transformácie na rakovinový stav. Kostra RAF dráhy je široko rozvetvená, pozostáva z trojúrovňovej kinázovej kaskády čo umožňuje rozšírenie regulácie krížením signalizačných dráh a taktiež zvýšenie citlivosti na vstupné signály (3). Signálna dráha sa aktivuje RAS proteínom. Inaktívny RAS – GDP, ktorý sa viaže na membránu,sa vplyvom fosforylácie mení na aktívny membránový RAS – GTP, ktorý následne aktivuje ďalších členov dráhy. Väzbou RAS – GTP s RBD, ktorá sa nachádza na N – terminálnom regulačnom úseku kinázy dochádza k aktivácii. Dôsledná analýza RAS rodiny preukázala, že schopné aktivovať BRAF sú iba H-RAS, N-RAS a K-RAS (43).
Neaktívne RAF kinázové proteíny sa nachádzajú v cytosole. Všetky RAF proteíny zdieľajú ako substrát MEK 1/2 kinázu. Napriek schopnosti všetkých členov rodiny RAF viazať a fosforylovať MEK in vitro aktivita sa smerov k MEK široko líši. Ako najsilnejší z hľadiska aktivity k MEK je BRAF. V prípade ARAF a CRAF je aktivita na hranici detekovateľnosti. Aktivované RAF kinázy fosforylujú obe MEK izoformy v aktivačnej slučke. Fosforyláciou proteínov RAF sa aktivita MEK zvyšuje a následne je schopná viazať, fosforylovaťa aktivovať ERK. MEK 1/2 sú duálne špecifické proteínové kinázy, ktoré sprostredkúvajú aktiváciu tyrozínu a serínu v ERK 1 alebo ERK2 vplyvom ich fosforylácie. ERK dráha sa vyznačuje následnou reguláciou veľkého množstva proteínov, ktoré sprostredkuvajú cross-talk so zvyšnými signálnymi dráhami, pričom ERK reguluje rôzne biologické funkcie ako napríklad bunkovú proliferáciu, diferenciáciu, migráciu alebo apoptózu. K udržaniu RAS – signalizácie je potrebná postranslačná modifikácia, v dôsledku ktorej je možné RAS proteíny prichytiť na vnútornú bunkovú membránu – farnezylácia a prenylácia (33).
Materiál a metodika
Súbor tvorí 20 pacientov s malígnym melanómom uvey, u ktorých bola indikovaná enukleácia postihnutého bulbu v období od 1.1.2015 do 1.3.2016. U pacientov boli zhrnuté základné klinické údaje o nádore. Tkanivové vzorky boli rutinne spracované formol-parafínovou metódou. Histopatologický nález bol doplnený histologickou typizáciou nádorov a vyhodnotením ich propagácie. Realizovali sme analýzu charakteristík uveálneho melanómu (štádium, objem, bunkový typ) a hladiny BRAF.
Výsledky
V období od 1. 1. 2015 do 1. 3. 2016 sme na Klinike oftalmológie LFUK a UN v Bratislave indikovali 20 enukleácii pre malígny melanóm uvey. Priemerný vek pacientov bol 62 rokov (od 22 do 89 rokov). Vekový priemer mužov bol 62 rokov a vekový priemer žien bol 59 rokov. V súbore prevládali muži. Indikácia enukleácie bola v 14 prípadoch (70 %) primárna enukleácia pre melanóm a v 6 prípadoch (30 %) išlo o enukleáciu po predchádzajúcej liečbe žiarením (brachyterapia, Leksellov gama nôž, lienárny urýchľovač). V našom súbore bol ľavý bulbus postihnutý MMU viackrát ako pravý bulbus. V čase indikovanej enukleácie ani u jedného z pacientov neboli zistené metastázy. V 17 prípadoch (85 %) bola mutácia BRAF génu negatívna a v troch prípadoch sa nepodarilo na mutáciu BRAF génu odobraný materiál vyšetriť (tab. 1).
Table 1. Prehľad súboru pacientov po enukleácii pre malígny melanóm na Klinike oftalmológie LF UK a UNB v období od 1. 1. 2015 do 1. 3. 2016 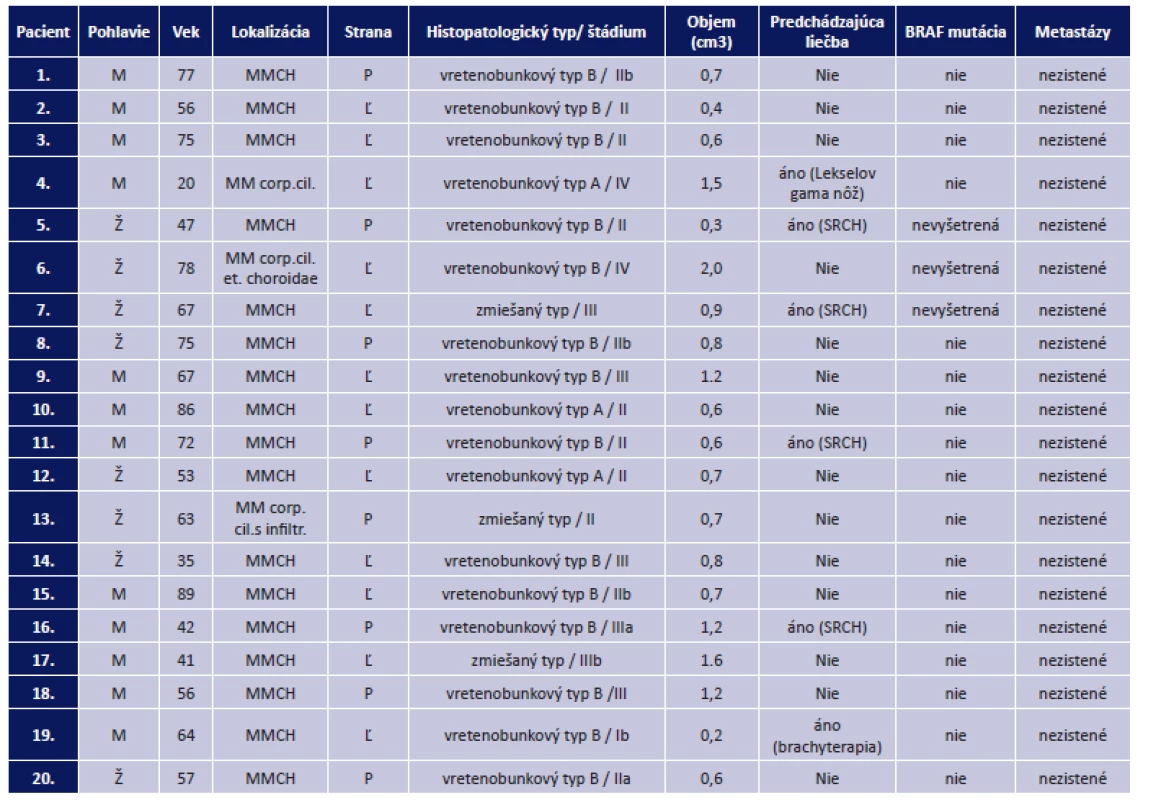
(MM – malígny melanóm, MMCH – malígny melanóm choroidey, SRCH – stereotaktická rádiochirurgia) V našom súbore bol najviac zastúpený vretenobunkový typ B v počte 14-krát, vretenobunkový typ A 3-krát a zmiešaný typ 3-krát (obr. 1, 2, 3). Priemerný objem pre vretenobunkový typ B bol 0,81 cm3, pre vretenobunkový typ A bol 0,93 cm3 a pre zmiešaný typ bol 1,07 cm3 (graf 1).
Graph 1. Súbor pacientov po enukleácii pre malígny melanóm na Klinike oftalmológie LF UK a UNB v období od 1. 1. 2015 do 1. 3. 2016 – objemy melanómu u jednotlivých bunkových typov 
Image 1. Pacient č. 13 - makrofoto enukleovanej očnej gule po enukleácii pre MM corpus cilliare s infiltráciou do irido-korneálneho uhla; histopatologicky sa jedná o zmiešaný typ, ktorý preniká do povrchu bulbu, bez propagácie do n. opticus 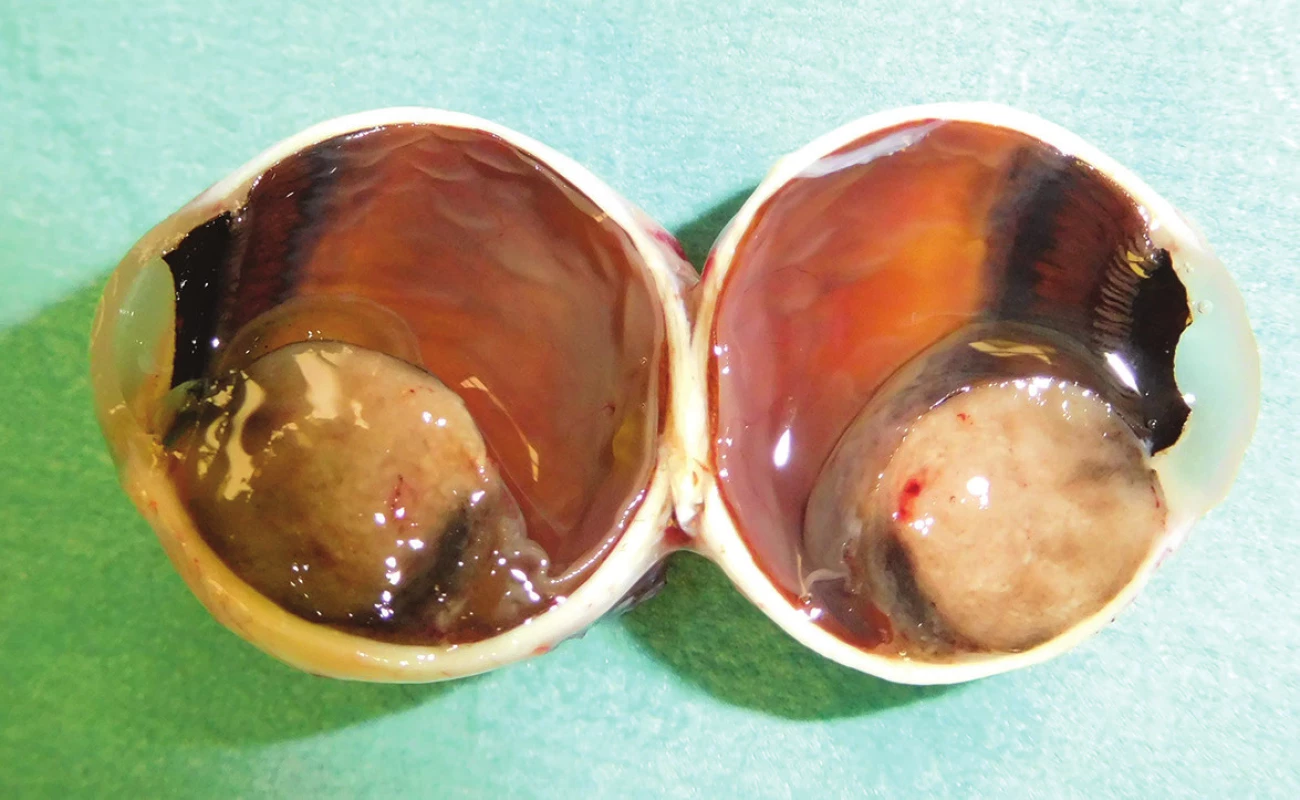
(foto - A. Furdová) Image 2. Pacient č. 20 - Makrofoto enukleovanej očnej gule po enukleácii pre MMCH; histopatologicky sa jedná o vretenobunkový typ B, ktorý prerastá do povrchu steny bulbu, bez propagácie do n. opticus 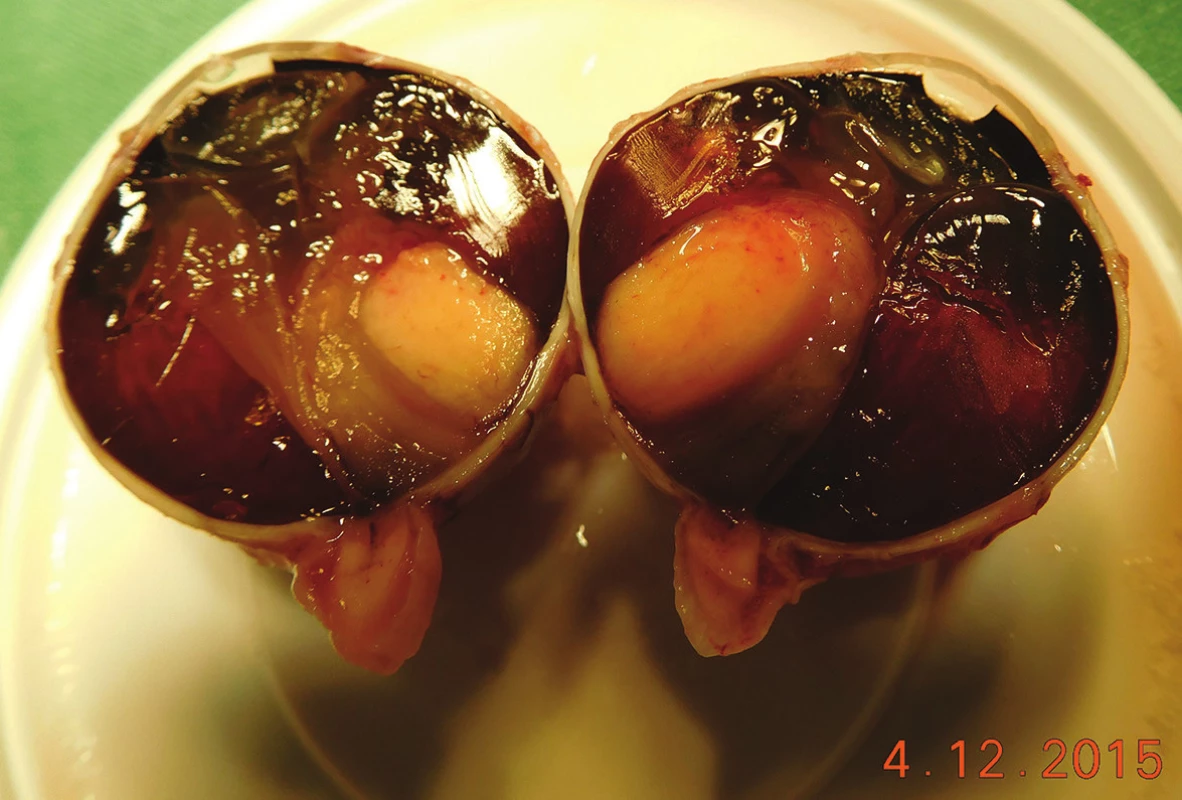
(foto - A. Furdová) Image 3. Pacient č. 1 - Makrofoto enukleovanej očnej gule po enukleácii pre MMCH; histopatologicky sa jedná o vretenobunkový typ B, ktorý prerastá do povrchu steny bulbu, bez propagácie do n. opticus 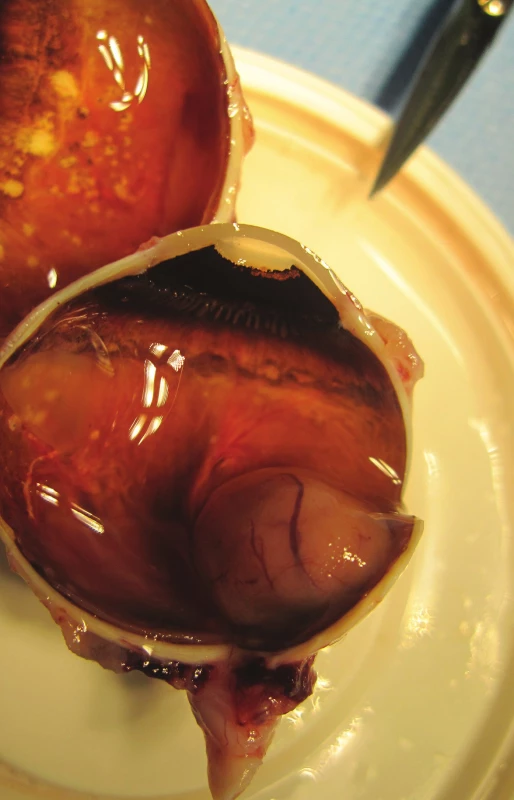
(foto - A. Furdová) Diskusia
U pacientov s BRAF mutáciou vplyv na celkové prežívanie nepoznáme. Vo všeobecnom kontexte sa teraz uplatňujú snahy spojiť nejakým spôsobom benefity „imunitnej“ úrovne a „molekulárnej“. Do klinickej praxe sa to premieta spustením nových, buď kombinovaných režimov alebo sekvencií vo forme klinických skúšaní. V metastatickom štádiu ochorenia máme teda na obzore minimálne dva nové lieky a to biologická liečba a imunologická liečba a veľa otázok. V poslednom období boli odhalené viaceré kľúčové molekulárne dráhy v patogenéze melanómu, predpokladajúc dopad pre klinickú prax, v zmysle rozdelenia do jednotlivých podskupín. V závislosti od „vedúcej“ onkogénnej dráhy by sme potom boli schopní vyvinúť a aj aplikovať tzv. cielenú biologickú liečbu. Za najdôležitejšie dráhy, ktoré ovplyvňujú diferenciáciu, proliferáciu, prežívanie a migráciu melanocytov, by sme mohli považovať MAPK (Mitogen – Activated Protein Kinase) a c-kit kinázovú dráhu. Prevalencia BRAF mutácií je rozdielna u rôznych onkologických ochorení, väčšinou však sa vyskytuje na kodóne 600 a má za následok substitúciu glutamátu za valín. U malígnych melanómov predstavuje cca 50–60 % (8).
Miesto výskytu primárneho ložiska je zdá sa späté s génovou expresiou. Melanómy lokalizované na miestach s malou expozíciou slnečného žiarenia, ako sú akrálne a slizničné melanómy, alebo v miestach s chronickým poškodením kože slnečným žiarením, majú nízky výskyt BRAF mutácií. Ďalšou „aktivačnou dráhou“ u melanómu sa zdá byť c-kit signálna kaskáda. Skoršie štúdie poukázali na to, že rast a invázia melanómu môžu byť spojené so stratou c - kit expresie (9). Posledné štúdie selektujú význam tejto dráhy, a tým aj selektujú melanómy ako také. V rámci juxtamembránovej domény c-kit-u bývajú prítomné aktivačné mutácie, napr. až u 21 % slizničných melanómov, 11 % akrálnych melanómov, 17 % melanómov vznikajúcich v koži po slnečnom žiarení, 15 % u análnych melanómov (10, 11).
Takto definovaná podskupina melanómov s c-kit aberáciami vo všeobecnosti bude pravdepodobne kandidátom pre cielenú liečbu tyrozín kinázovými inhibítormi (TKi) špeciálne voči c-kit mutovanej forme. Prebiehajú zatiaľ fázy III klinických štúdií s niekoľkými preparátmi, problém je však okrem relatívne malého počtu pacientov aj v nábore do štúdie, keďže musia mať vhodnú mutáciu (22).
Biologická liečba pri mnohých nádorových ochoreniach už dokázala efektívne predĺžiť čas do progresie ochorenia, ako aj celkové prežívanie. Donedávna bol MMU „zlým ochorením“, považoval sa za chemo - aj rádiorezistentný, preto jeho prognóza v IV. klinickom štádiu bola veľmi nepriaznivá. Intenzívny výskum v oblasti intracelulárnych dráh, ktoré odhaľujú „vedúce“ kaskády onkogenézy pri MM, viedol k nájdeniu účinnej liečby inhibítormi dráhy BRAF-MEK-ERK. Táto terapia je však zatiaľ len pre vybranú podskupinu pacientov s mutáciou BRAF (40, 45).
Imunoterapia je druhou platformou pre rozvíjanie liečby, a to bez jednoznačného prediktora. Zdá sa, že existujú viaceré kontrolné body v protinádorovej imunite, ktoré je možné účinnou cielenou imunomodulačnou liečbou ovplyvniť tak, že sa dajú dosiahnuť dlhodobé remisie. V nasledujúcom období bude dôležité, samozrejme okrem príchodu ďalších nových molekúl, vedieť správne načasovať liečbu a vybrať skupinu pacientov, ktorí budú mať z tej ktorej liečby maximálny prospech pri minimálnych nežiaducich účinkoch. V súčasnosti adjuvantná liečba interferonom nemá dokladovanú účinnosť rovnako ako žiadna iná súčasná skúšaná adjuvantná liečba uveálneho melanómu, ani pri možnom vzplanutí ochorenia nie je na Slovensku indikovaná žiadna „biologická“ liečba, ale chemoterapia DTIC.
ZÁVER
Mutácia génu BRAF je potvrdená viacerými štúdiami a to, že sa nachádza najmä v malígnom melanóme kože. V roku 2003 Rimoldi a Cruz potvrdil, že mutácia BRAF génu sa pri uveálnom melanóme nevyskytuje. Pri histologickom výsledku sa v našej štúdii táto mutácia nepotvrdila, aj keď uveálny melanóm a kožný melanóm majú rovnaký histologický základ. Toto je možno zapríčinené aj veľmi malým výskytom malígneho melanómu uvey (6, 42).
Podporené grantom KEGA 008 UK – 4/2014
Autori článku prehlasujú, že vznik odborného článku, jeho publikovanie a zverejnenie nie je predmetom stretu záujmov a nie je podporené žiadnou farmaceutickou firmou.
Do redakce doručeno dne 4. 4. 2016
Do tisku přijato dne 26. 7. 2016
MUDr. Horkovičová Kristína
Klinika oftalmológie LFUK a UNB
Nemocnica Ružinov
Ružinovská 6
826 06 Bratislava
mail: khorkovicova@gmail.com,
afrf@mail.t-com.sk
Sources
1. Aalto, Y., Eriksson, L., Seregard, S., et al.: Concomitant loss of chromosome 3 and whole arm losses and gains of chromosome 1, 6, or 8 in metastasizing primary uveal melanoma. Invest Ophthalmol Vis Sci, 2001; 42(2): 313–317.
2. Bayani, J., Selvarajah, S., Maire, G. et al.: Genomic mechanisms and measurement of structural and numerical instability in cancer cells. Semin Cancer Biol, 2007; 17(1): 5–18.
3. Brown, GC., Hoek, JB., Kholodenko, BN.: Why do protein kinase cascades have more than one level? Trends in Biochemical Sciences, 1997; 22(8): 288.
4. Castedo, M., Coquelle, A., Vitale, I. et al.: Selective resistance of tetraploid cancer cells against DNA damage-induced apoptosis. Ann N Y Acad Sci, 2006; 1090 : 35–49.
5. Cohen,Y., Goldenberg-Cohen,N., Parrella,P., et all.: Lack of BRAF Mutation in Primary Uveal Melanoma. Invest. Ophthalmol. Vis. Sci, 2003; 44(7): 2876–2878.
6. Cruz, F., Rubin, BP, Wilson, D. et al.: Absence of BRAF and NRAS mutations in uveal melanoma. Cancer Res, 2003; Sep 15; 63(18): 5761–6.
7. Curry, JL., Torres-Cabala, CA., Tetzlaff, MT. et al.: Molecular platforms utilized to detect BRAF V600E mutation in melanoma. Seminars in Cutaneous Medicine and Surgery, 2012; 31(4): 267–273.
8. Davies, H., Bignell, G.R., Cox, C. et al.: Mutations of the BRAF gene in human cancer. Nature, 2002; 417(6892): 949-954.
9. Eggermont, A.M., Suciu, S., Santinami, M. et al.: EORTC 18991 phase III trial: Long-term adjuvant pegylated interferon-α2b (PEG-IFN) versus observation in resected stage III melanoma: Long-term results at 7.6 years follow-up. J Clin Oncol, 2011; 21: suppl; abstr 8506b.
10. Ehlers, J.P., Worley, L. Onken, M.D. et al.: Integrative genomic analysis of aneuploidy in uveal melanoma. Clin Cancer Res, 2008; 14(1): 115–122.
11. Furdová, A., Furdová, Ad., Krásnik, V., Krčová, I., Horkovičová, K.: Exenterácia očnice pre malígny melanóm choroidey v štádiu T4; možnosti epitetického riešenia. Čes a slov Oftalmol, 2015; 71(3): 150-157.
12. Furdová, A., Oláh, Z.: Nádory oka a okolitých štruktúr. Brno: Akademické nakladatelství CERM, 2010, 151 s.
13. Furdová A, Růžička J, Sramka M. et.al.:. Choroidal melanoma stage T1 - comparison of the planning protocol for stereotactic radiosurgery and proton beam irradiation. Čes a slov Oftalmol, 2012; 68(4): 156–61.
14. Furdová A, Strmeň P, Šramka M. Complications in patients with uveal melanoma after stereotactic radiosurgery and brachytherapy. Bratisl Lek Listy, 2005; 106(12): 401–6.
15. Furdová A., Šramka M., Waczulíková I. et.al.: Stereotaktická rádiochirurgia (Linac) uveálnych melanómov; postradiačné komplikácie. Čes a slov Oftal, 2015; 71(3): 135–141.
16. Furdova, A., Sramka, M.: Uveal malignant melanoma and stereotactic radiosurgery. Intraocular uveal melanoma and one-day session stereotactic radiosurgery at linear accelerator. Saarbrűcken: LAP LAMBERT Academic Publishing, 2014; 181 p.
17. Furdová, A., Šramka, M., Chorváth, M. et.al.: Stereotactic radiosurgery intraocular malignant melanoma – retrospective study. Neuroendocrinology Letters, 2014; 35(1): 28–36.
18. Furdová A, Strmeň P, Waczulíková I. et al.: One-day session LINAC-based stereotactic radiosurgery of posterior uveal melanoma. Eur J Ophthalmol, 2012; 22(2): 226–235.
19. Furdová A.: Malígny melanóm v oku. Via Pract, 2008; 5(11): 480–482.
20. Gaudi, S., Messina, J. et al.: Molecular Bases of Cutaneous and Uveal Melanomas Pathology Research International, 2011; 2011, 8 p.
21. Hausler, T., Stang, A., Anastassiou, G., et al: Loss of heterozygosity of 1p in uveal melanomas with monosomy 3. Int J Cancer, 2005, 116(6): 909–913.
22. Hlavatá Z.: Biologická liečba malígneho melanómu. Farmakoterapia, 2013, 3(1): 60–64.
23. Hoglund, M., Gisselsson, D., Hansen, G.B., et al.: Dissecting karyotypic patterns in malignant melanomas: temporal clustering of losses and gains in melanoma karyotypic evolution. Int J Cancer, 2004, 108(1): 57–65.
24. Horsman, D.E., White, V.A.: Cytogenetic analysis of uveal melanoma. Consistent occurrence of monosomy 3 and trisomy 8q. Cancer, 1993, 71(3): 811–819.
25. Hughes, S., Damato, B.E., Giddings, I., et al.: Microarray comparative genomic hybridisation analysis of intraocular uveal melanomas identifies distinctive imbalances associated with loss of chromosome 3. Br J Cancer, 2005; 93(10): 1191–1196.
26. Chong, H., Lee, J., Guan, KL.: Positive and negative regulation of Raf kinase activity and function by phosphorylation. EMBO Journal, 2001; 20 : 3716–3727.
27. Inamdar, G.S., Madhunapantula, S.V, Robertson, G.P.: Targeting the MAPK pathway in melanoma: why some approaches succeed and other fail. Biochem Pharmacol, 2010; 80(5): 624–637.
28. Kaneko, Y., Knudson, A.G.: Mechanism and relevance of ploidy in neuroblastoma. Genes Chromosomes Cancer, 2000, 29(2): 89–95.
29. Katona, T.M., Jones, T.D., Wang, M., et al.: Genetically heterogeneous and clonally unrelated metastases may arise in patients with cutaneous melanoma. Am J Surg Pathol. 2007, 31(7): 1029–1037.
30. Kilic, E., Naus, N.C., van Gils, W., et al.: Concurrent loss of chromosome arm 1p and chromosome 3 predicts a decreased disease-free survival in uveal melanoma patients. Invest Ophthalmol Vis Sci, 2005, 46(7): 2253–2257.
31. Kops, G.J., Weaver, B.A., Cleveland, D.W.: On the road to cancer: aneuploidy and the mitotic checkpoint. Nat Rev Cancer, 2005, 5(10):773–785.
32. Landreville, S., Agapova, O.A., Harbour, J.W.: Emerging insights into the molecular pathogenesis of uveal melanoma. Future Oncol, 2008; 4(5): 629–636.
33. Matallanas, D., Birtwistle, M., Romano, D. et al.: Raf Family Kinases. Genes & Cancer, 2011; 2(3): 232–260.
34. Nguyen, H.G., Ravid, K.: Tetraploidy/aneuploidy and stem cells in cancer promotion: The role of chromosome passenger proteins. J Cell Physiol, 2006; 208(1):1–22.
35. Olaharski, A.J., Sotelo, R., Solorza-Luna, G., et al.: Tetraploidy and chromosomal instability are early events during cervical carcinogenesis. Carcinogenesis, 2006; 27(2): 337–343.
36. Onken, M.D., Worley, L.A., Person, E., et al.: Loss of heterozygosity of chromosome 3 detected with single nucleotide polymorphisms is superior to monosomy 3 for predicting metastasis in uveal melanoma. Clin Cancer Res, 2007; 13(10): 2923–2927.
37. Parrella, P., Fazio, V.M., Gallo, A.P., et al.: Fine mapping of chromosome 3 in uveal melanoma: identification of a minimal region of deletion on chromosomal arm 3p25.1-p25.2. Cancer Res, 2003; 63(23): 8507–8510.
38. Patel, K.A., Edmondson, N.D., Talbot, F., et al.: Prediction of prognosis in patients with uveal melanoma using fluorescence in situ hybridisation. Br J Ophthalmol, 2001; 85(12): 1440–1444.
39. Prescher, G., Bornfeld, N., Becher, R.: Two subclones in a case of uveal melanoma. Relevance of monosomy 3 and multiplication of chromosome 8q. Cancer Genet Cytogenet, 1994; 77(2): 144–146.
40. Prescher, G., Bornfeld, N., Friedrichs, W., et al.: Cytogenetics of twelve cases of uveal melanoma and patterns of nonrandom anomalies and isochromosome formation. Cancer Genet Cytogenet, 1995; 80(1): 40–46.
41. Prescher, G., Bornfeld, N., Hirche, H., et al.: Prognostic implications of monosomy 3 in uveal melanoma. Lancet. 1996, 347(9010): 1222–1225.
42. Rimoldi, D., Salvi, S., Liénard, D., et al.: Lack of BRAF Mutations in Uveal Melanoma. Cancer Res September, 15 : 2003 63 : 5712.
43. Rodríguez-Viciana, P., Sabatier, C., McCormick, F.: Signalling specificity by Ras family GTPases is determined by the full spectrum of effectors they regulate. Molecular and Cell Biology, 2010; 24 : 4943–4954.
44. Roskoski R.: RAF protein-serine/threonine kinases: Structure and regulation. Biochemical and Biophysical Research Communications. 2010, 399 : 313–317.
45. Sisley, K., Rennie, I.G., Parsons, M.A., et al.: Abnormalities of chromosomes 3 and 8 in posterior uveal melanoma correlate with prognosis. Genes Chromosomes Cancer, 1997; 19(1): 22–28.
46. Svetlošáková, Z., Krásnik, V.: Malígny melanóm – diagnostika, liečba, prognóza. Onkológia, 2012; 7(1): 35–37.
47. Wellbrock, C., Ogilvie, L., Hadley, D., et al.: V599EB-RAF is an Oncogene in Melanocytes. Cancer Research, 2004; 64 : 2338–2342.
48. White, V.A., Chambers, J.D., Courtright, P.D., et al.: Correlation of cytogenetic abnormalities with the outcome of patients with uveal melanoma. Cancer, 1993; 83(2): 354–359.
49. Ye, C.J., Liu, G., Bremer, S.W., et al.: The dynamics of cancer chromosomes and genomes. Cytogenet Genome Res, 2007; 118(2-4): 237–246.
50. Zebisch, A., Troppair, J.: Back to the roots: the remarkable RAF oncogene story. Cellular and Molecular Life Sciences, 2006; 63 : 1314–1330.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2016 Issue 4-
All articles in this issue
- Nová diagnostická zobrazovací metoda – shear waves elastografie
- Historický přehled technik zadní lamelární keratoplastiky
- Hodnocení očního povrchu u pacientů léčených analogy prostaglandinů s ohledem na obsaženou konzervační látku
- Genová terapie dědičných onemocnění SÍTNICE A ZRAKOVÉHO NERVU: současný stav poznání
- HEMANGIOMY ORBITÁLNÍ KRAJINY U DĚTÍ
- MUTÁCIA BRAF A MOŽNOSTI IDENTIFIKÁCIE PROGNOSTICKÝCH MARKEROV METASTÁZOVANIA UVEÁLNEHO MELANÓMU
- Porucha motility bulbu s diplopií jako první příznak tumoru prorůstajícího do orbity z vedlejších dutin nosních
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Genová terapie dědičných onemocnění SÍTNICE A ZRAKOVÉHO NERVU: současný stav poznání
- Nová diagnostická zobrazovací metoda – shear waves elastografie
- HEMANGIOMY ORBITÁLNÍ KRAJINY U DĚTÍ
- MUTÁCIA BRAF A MOŽNOSTI IDENTIFIKÁCIE PROGNOSTICKÝCH MARKEROV METASTÁZOVANIA UVEÁLNEHO MELANÓMU
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


