-
Medical journals
- Career
Vztah mezi objemem postresekčního rezidua a celkovým přežíváním pacientů s glioblastomem – studie v rámci jednoho neuroonkologického centra
Authors: M. Halaj 1; O. Kalita 1,2; M. Šlachta 1; J. Valošek 1; O. Burkot 3; P. Kouřilová 4; E. Čecháková 5; M. Doležel 6; D. Hraboš 7; J. Drábek 5; P. Kudlová 2; L. Hrabálek 1
Authors‘ workplace: Neurochirurgická klinika LF UP a FN Olomouc 1; Ústav zdravotnických věd FHS UTB ve Zlíně 2; Oddělení biomedicínského inženýrství, FN Olomouc 3; Ústav molekulární a translační medicíny, LF UP, Olomouc 4; Radiologická kliniky LF UP a FN Olomouc 5; Onkologická klinika LF UP a FN Olomouc 6; Ústav klinické a molekulární patologie, FN Olomouc 7
Published in: Cesk Slov Neurol N 2024; 87(1): 53-60
Category: Original Paper
doi: https://doi.org/10.48095/cccsnn202453Overview
Cíl: Cílem této práce je ukázat technické možnosti volumetrického hodnocení objemu rezidua a zhodnotit vliv přesně definovaného objemu reziduálního nádoru na celkové přežívání (overall survival; OS) u pacientů s glioblastomem (GBM). Soubor a metodika: Retrospektivně byli vybráni dospělí pacienti, kteří podstoupili resekční výkon GBM ve FN Olomouc mezi roky 2012 a 2016. Pacienti byli podrobeni pravidelným klinickým a MR kontrolám každé 3 měsíce. Do studie byly zahrnuty časné pooperační snímky MR. U každého pacienta bylo provedeno segmentování nádorového procesu s následným vytvořením 3D modelu objemu nádoru, což umožnilo výpočet jeho objemu před i po operaci. Výsledky: Výsledky retrospektivní analýzy zahrnovaly 50 pacientů. Naše práce ukázala signifikantní prodloužení OS pouze u skupiny bez postkontrastně se sytícího rezidua (medián OS = 16,1 vs. 6,3 měsíce). Pacienti s kombinací radikální resekce a onkoterapie v Stuppově režimu dosáhli dalšího prodloužení OS s průměrem 19,6 měsíce a mediánem 14 měsíců. Závěr: Naše práce popisuje postup výpočtu objemu pooperačního rezidua GBM s využitím snadno dostupného softwaru. Na základě zjištění této studie bylo dosaženo signifikantně lepších léčebných výsledků u pacientů s úplným odstraněním postkontrastně se sytící části GBM doplněným o co nejradikálnější resekci postkontrastně se nesytící části nádoru.
Klíčová slova:
glioblastom – pooperační reziduum – celkové přežívání
Úvod
Glioblastom (GBM) je nejčastější a nejmalignější primární nádor CNS stupně malignity 4 podle klasifikace WHO s nadále nepříznivou celkovou dobou přežívání (overall survival; OS) dosahující 16–24 měsíců [1,2]. Klasifikace WHO z roku 2016 [1] rozdělila nejmalignější formy astrogliálních nádorů na převažující GBM bez mutace isocitrát dehydrogenázy (IDH) (GBM IDH wild-type) a málo frekventní GBM s mutací IDH (GBM IDH mutant), které v 5–10 % vznikají sekundárně, maligní transformací z difuzního astrocytomu či anaplastického astrocytomu. Avšak pokrok v poznání genotyp-fenotypických charakteristik gliomů si brzo vynutil další modifikaci nomenklatury [2,3]. Klasifikace WHO z roku 2021 [4] přiřadila název GBM všem astrogliomům bez mutace IDH, které splňují genetické charakteristiky tzv. molekulárních glioblastomů [3]. Gliomy bez mutace IDH jsou označovány jako astrocytomy IDH wild-type, WHO skupina 4.
Nejlepší výsledky dosahuje agresivní multimodální terapie GBM [4,5], která zahrnuje i maximálně radikální bezpečnou resekci. Jak vyplývá z uvedeného, jedním z mála potvrzených pozitivních prognostických faktorů je radikalita operační resekce [6–13].
Cílem této práce bylo ukázat technické možnosti volumetrického hodnocení objemu pooperačního rezidua u GBM a zhodnotit vliv přesně definovaného objemu reziduálního nádoru na OS pacientů s GBM.
Soubor pacientů
Retrospektivně byli vybíráni dospělí pacienti, u kterých byla dostupná potřebná data a kteří podstoupili resekční výkon GBM ve FN Olomouc od roku 2012 do roku 2016. Vyloučeny byly rekurentní GBM a nádory diagnostikované pomocí jehlové biopsie. Cílem chirurgické léčby byla maximálně radikální bezpečná resekce následovaná, pokud to bylo možné, standardní agresivní onkoterapií podle Stuppova protokolu [5]. Všichni pacienti absolvovali časnou pooperační MR do 48 h od operace k posouzení radikality zákroku. Nádorová tkáň byla u všech pacientů hodnocena lokálním patologem jako glioblastom podle klasifikace WHO z roku 2016 [1]. Následně pacienti docházeli pravidelně každé 3 měsíce až do úmrtí na klinické a MR kontroly. Vzorky nádorové tkáně byly uchovávány jednak jako formalinem fixované a v parafínu zalité bločky, jednak i jako nefixované, hluboko zmražené vzorky skladované v tekutém dusíku.
Metodika hodnocení
Všem pacientům s histologicky potvrzeným GBM doplněným molekulárně-biologickým vyšetřením mutace IDH a metylace promotoru O6-methylguanine-DNA methyltransferázy (MGMT) v daném období bylo dostupné předoperační a pooperační vyšetření MR na 1,5T MR přístroji (Siemens MAGNETOM SYMPHONY nebo Siemens MAGNETOM AVANTO, Mnichov, Německo). Pooperační kontrola MR byla provedena nejpozději do 48 h od operačního výkonu. Jak předoperační, tak pooperační vyšetření zahrnovalo sekvence fluid attenuated inversion recovery (FLAIR) a postkontrastní T1 vážené sekvence (velikost voxelu 0,4 × 0,4 × 6 mm3 až 0,7 × 0,7 × 6,5 mm3), tak abychom byli schopni od sebe diferencovat pooperační změny od postkontrastně se sytícího a nesytícího rezidua nádoru. Přítomnost pooperačního rezidua byla nezávisle hodnocena radiologem a dvěma neurochirurgy, kteří provedli operační výkon.
U každého pacienta byla provedena segmentace nádorového procesu s následným vytvořením 3D modelu a výpočet jeho objemu ve třech rovinách na základě semiautomatického hodnocení. Jako zdroj byly použity postkontrastní T1 vážené snímky, které byly extrahovány z prohlížeče nemocničního systému a poté konvertovány z formátu DICOM do formátu NIFTI. Tyto snímky byly následně vloženy do softwaru FSLeyes, což je multiplatformní nástroj (Wellcome Center for Integrative Neuroimaging [FMRIB], University of Oxford, Velká Británie) [14] (obr. 1). Z těchto sekvencí byly za pomoci zmíněného softwaru vytvořeny masky obsahující nádor ve třech na sebe kolmých rovinách a následně zkontrolovány dalším neurochirurgem, který posuzoval komplexnost vytvořených masek (obr. 2).
Pomocí softwaru ITK-SNAP (Penn Image Computing and Science Laboratory [PICSL], University of Pennsylvania, USA) se z těchto masek podařilo poloautomaticky vytvořit 3D model nádoru [15] (obr. 3). Následně byl vypočten objem nádoru ve 3D rozměru s přesností na tři desetinná místa. Pooperačně, pokud bylo identifikováno a popsáno pooperační reziduum, byl použit stejný postup výpočtu jeho objemu na základě vytvořených masek. I v tomto případě byly masky rezidua nezávisle kontrolovány neurochirurgy (obr. 4 a 5). Poměr vypočteného objemu pooperačního rezidua k objemu nálezu na MR před operací udává procentuální operační radikalitu chirurgické resekce.
Image 1. Zdrojová data nádoru v T1 vážených sekvencích po konverzi do formátu NIFTI. 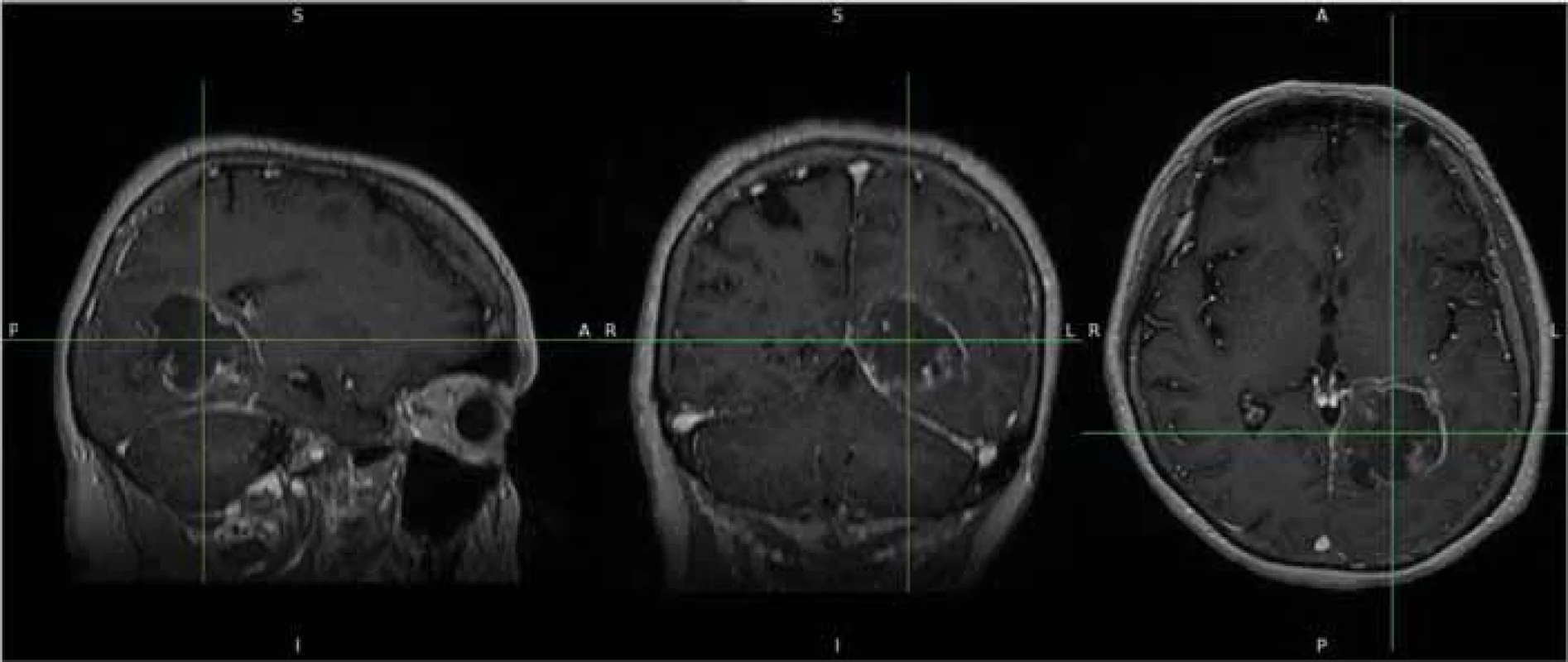
Fig. 1. Source data of the tumour in T1-weighted sequences after conversion to the NIFTI format. Image 2. Vytvoření masek v programu FSLEyes. 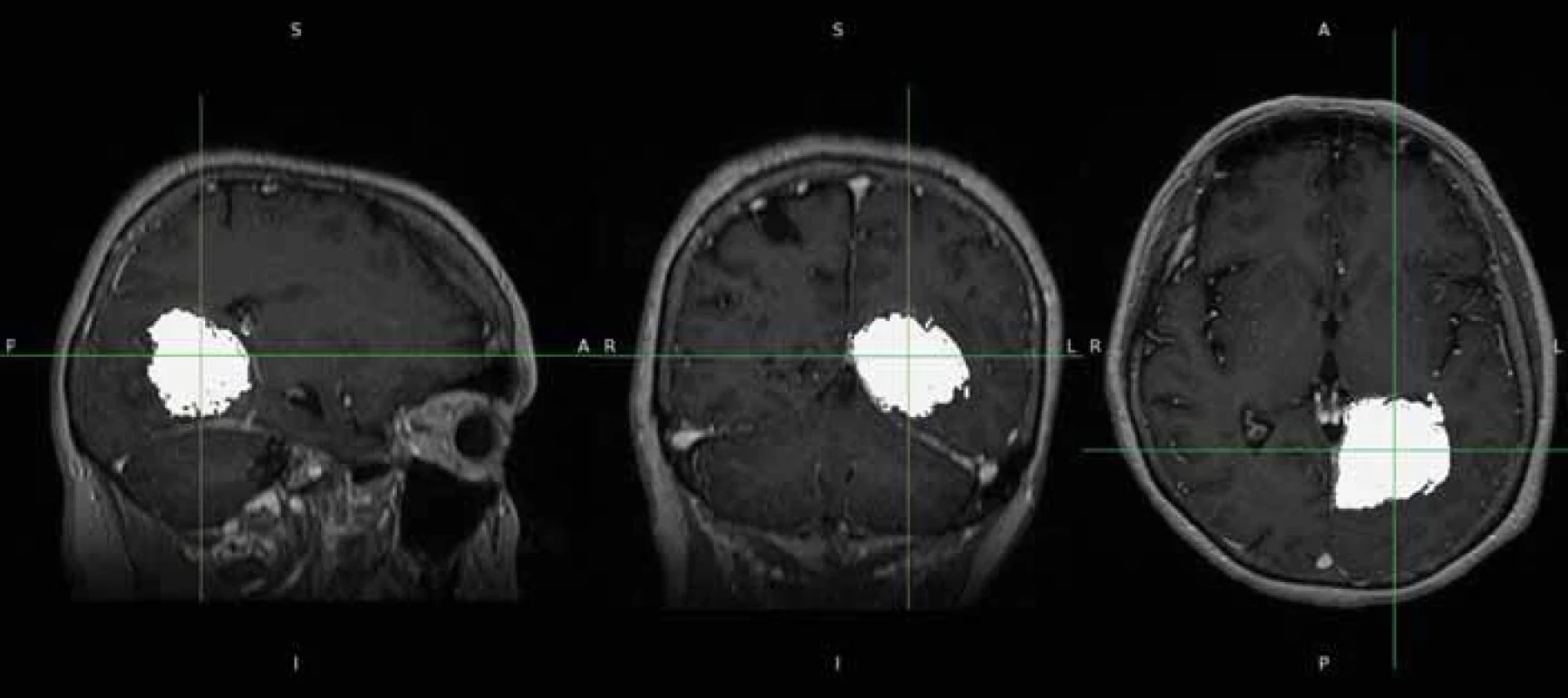
Fig. 2. Mask creation with FSLEyes programme. Image 3. Vytvoření 3D modelu nádoru (vlevo dole) v programu ITK-SNAP. 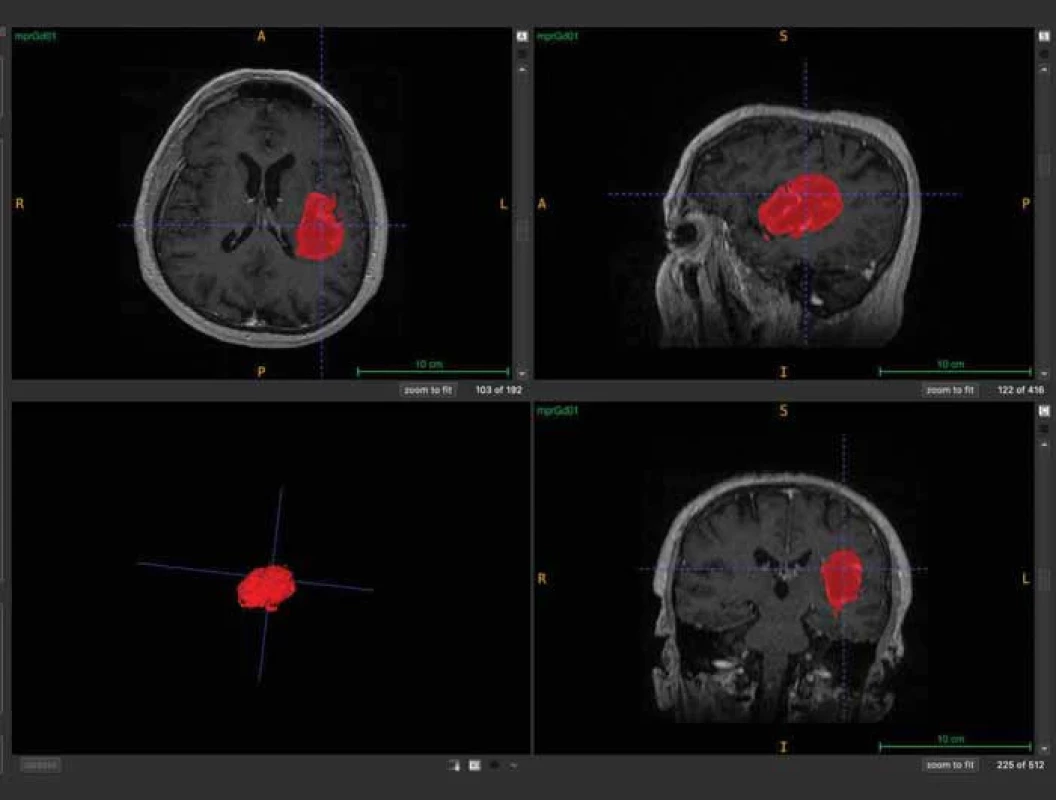
Fig. 3. Creating a 3D tumour model (bottom left) with ITK-SNAP programme. Image 4. Pooperační nález zdrojových dat s drobným reziduem. 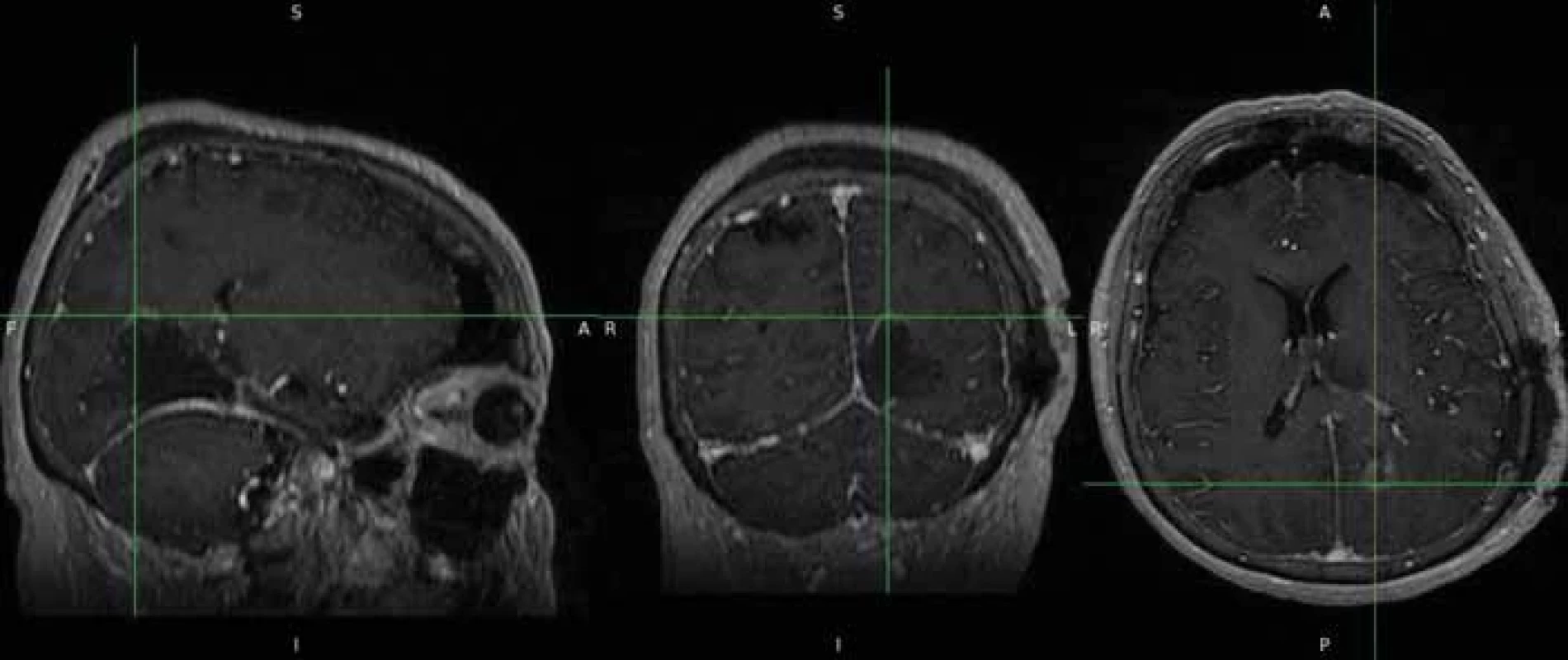
Fig. 4. Source data of post-operative findings with small tumour residue. Image 5. Semiautomatické vytvoření masek pooperačního rezidua. 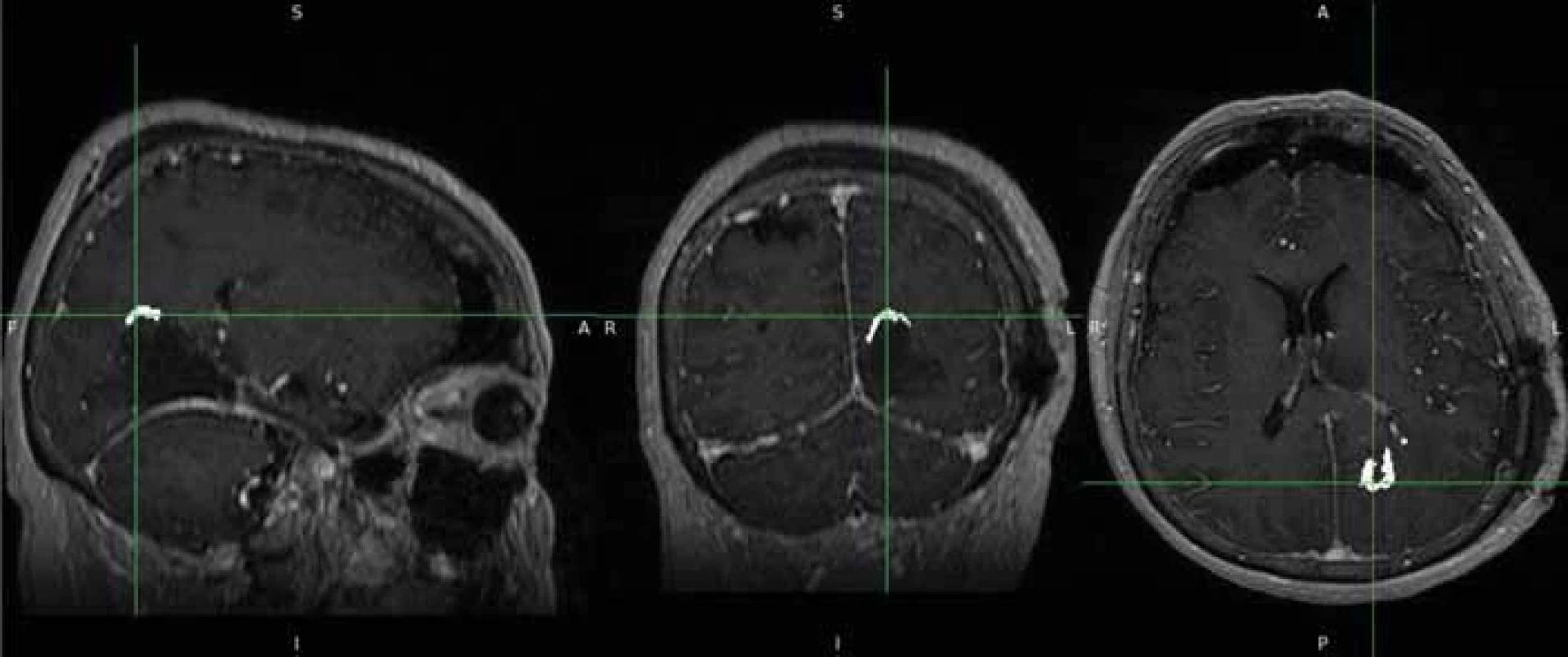
Fig. 5. Semiautomatic mask creation of post-operative residue. Vyšetření mutace IDH a MGMT
Vyšetření mutace IDH a metylace promotoru MGMT bylo prováděno standardní technikou v olomouckém neuroonkocentru [16–18]. Prvním krokem bylo imunohistochemické vyšetření kanonické mutace IDH (anti-IDH1R132H), doplněné o genotypizaci IDH pomocí Next-Generation Sequencing (Nextera XT kit, Illumina, San Diego, CA, USA), a vyšetření metylace promotoru MGMT pomocí Real-time methylation-specifické PCR (Zymo Research, Irvine, USA).
Statistická analýza
Popis sledovaných parametrů byl proveden pomocí frekvenčních tabulek a popisných statistik (průměr, medián, minimum, maximum). Pro zobrazení přežití pacientů byly použity Kaplan-Meierovy křivky. Všechny analýzy a grafické výstupy byly provedeny ve statistických softwarech R, ver. 3.5.2 (Core Team, R Foundation for Statistical Comput-ing, Vídeň, Rakousko 2018). Testy byly provedeny na 5% hladině statistické významnosti. Výsledky, u nichž byla hodnota p nižší než 0,05, byly považovány za statisticky významné.
Table 1. Skupiny pacientů dle radikality resekce. 
Image 6. Srovnání celkového přežití mezi pacienty s totální a parciální resekcí. 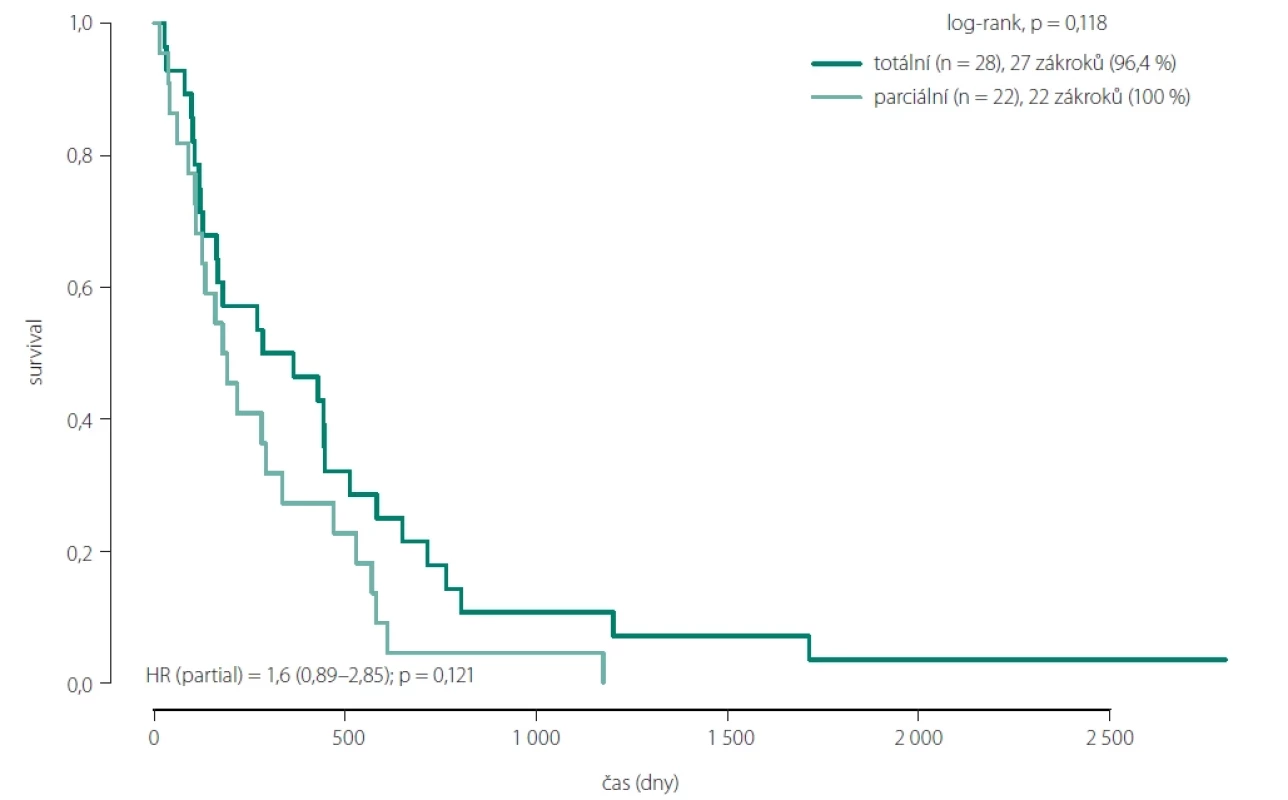
Fig. 6. Overall survival comparison between patients with total and partial resection. Image 7. Porovnání celkového přežtí pacientů dle typu onkoterapie. 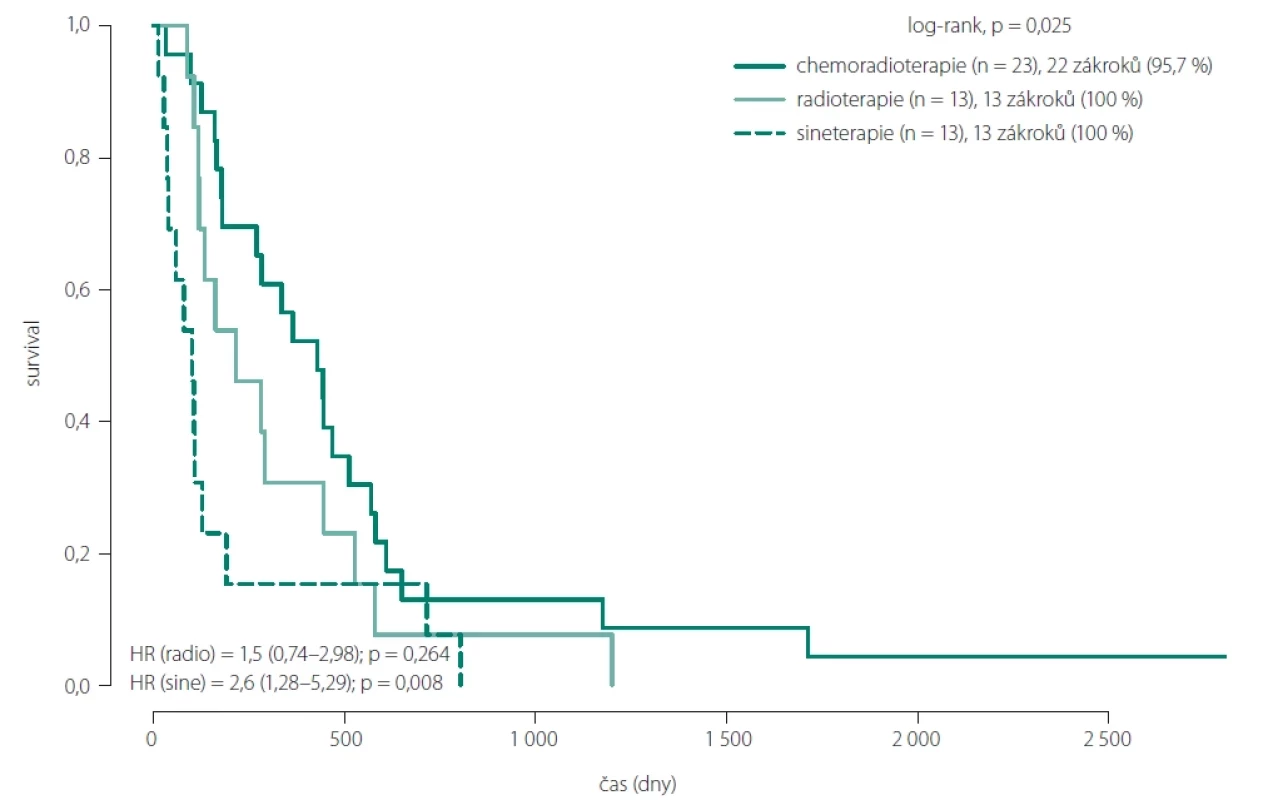
Fig. 7. Overall survival comparison of patients according to oncological therapy type. Výsledky
Pro retrospektivní analýzu byly dostupné výsledky 50 pacientů, 32 mužů a 18 žen, jejichž věk se pohyboval mezi 33 a 82 lety s mediánem 62 let. Doba sledování variovala od 1,2 měsíce do 92 měsíců (7,6 let), průměrná doba byla 13,1 měsíce a medián 7,9 měsíce. Všichni pacienti byli operováni s histologickou diagnózou GBM, doplněnou v dostupných případech o imunohistochemickou a molekulárně genetickou analýzu. GBM bez IDH mutací byl potvrzen u 41 pacientů, GBM s IDH mutací u 4 pacientů. V pěti případech nebylo možné vyšetřit IDH mutaci z důvodu nedostatečné kvality odebraného vzorku. U 12 pacientů byla potvrzena metylace promotoru MGMT. Z technických důvodů nebyla metylace promotoru MGMT vyšetřena u 19 pacientů.
Celkem 13 pacientů podstoupilo pouhou radioterapii v celkové dávce (60 Gy/30 Gy), a to buď ve formě intenzivně modulované radioterapie (iMRT), nebo 3D konformní radioterapie. Dalších 23 pacientů absolvovalo kompletní konkomitantní chemoradioterapii podle Stuppova protokolu. Pouze u tří z těchto pacientů byla nutná redukce dávky pokračovací chemoterapie z důvodu hematotoxicity. Na začátku analýzy bylo stanoveno, že aplikace více než 40 Gy radioterapie v normofrakcionaci bude považována za provedenou onkotereapii. Nakonec však žádný pacient nedostal dávku radioterapie mezi 40 a 59 Gy. Čtrnáct pacientů nedokončilo nebo nepodstoupilo žádnou onkologickou léčbu z důvodu neuspokojivého klinického stavu.
Operovaní pacienti byli na základě zjištěného pooperačního rezidua rozděleni podle reziduálního objemu do skupin (tab. 1). Byla přidána i skupina 1 s pacienty s tzv. supramaximální resekcí [11], která byla definována kompletním odstraněním jak postkontrastně se sytící porce nádoru, tak i resekcí nekontrastně se sytící tkáně (MR/T1 hyposignální, MR/T2/FLAIR hypersignální) s reziduem pod 5 cm3. Skupina 2A zahrnovala pacienty s kompletní resekcí charakterizovanou úplným odstraněním postkontrastně se sytící složky nádoru. Skupina 2B byla definována objemem reziduálního nádoru ≤ 1 cm3. Skupina 3A byla charakterizována reziduálním objemem postkontrastně se sytící tkáně ≤ 5 cm3. Skupina 3B byla charakterizována reziduem postkontrastní tkáně větším než 5 cm3. U jednoho pacienta ve skupině 4 byl resekční výkon předčasně ukončen pro kardiovaskulární nestabilitu. Výsledná radikalita resekce odpovídala spíše rozšířené biopsii.
Rozsah provedené resekce v případě parciální resekce se pohyboval od 15 %, což je na úrovni spíše provedené biopsie, až po resekci 99 % objemu, vč. postkontrastně se nesytící složky nádoru. Největší předoperační nádor měl objem 117,74 cm3, nejmenší pak 10,76 cm3 (medián 22,23 cm3 a průměr 29,49 cm3). Průměrná radikalita resekce ze všech operovaných pacientů činila 92 %.
Statisticky signifikantní efekt radikality resekce na prodloužení OS byl nalezen pouze u skupin pacientů 1 a 2A. Tedy ve skupině bez nálezu postkontrastně se sytícího rezidua GBM, popř. doplněné i o resekci postkontrastně se nesytící části nádoru (obr. 6). Jednalo se o skupinu 6 pacientů se supramaximální resekcí, s OS mezi 16,8 a 92,1 měsíce (7,6 let), s průměrem 35,6 měsíce a mediánem 18 měsíců. Do skupiny 2A patřilo celkem 23 pacientů s OS mezi 4,6 a 39,4 měsíce (3,3 roku), s průměrem 10,8 měsíce a mediánem 5,8 měsíce. Po spojení obou skupin byl průměrný OS 16,1 měsíce, s mediánem 10,7 měsíce.
Ve skupině 2B bylo 7 pacientů s OS mezi 1,3 a 38,6 měsíce (3,2 roku), s průměrem 13,2 měsíce a mediánem 9,3 měsíce, nejkratší 0,4 měsíce a nejdelší 38,6 měsíce. Ve skupině 3A bylo 5 pacientů s OS mezi 2 a 19 měsíci, s průměrným OS 10,7 měsíce a mediánem 9,6 měsíce. Ve skupině 3B se nacházelo 8 pacientů s OS mezi 1,3 a 17,3 měsíce, s průměrem OS 6,7 měsíce a mediánem 4,8 měsíce. Do skupiny číslo 4 byl zařazen pouze 1 pacient s OS 1,2 měsíce. Ve společné skupině 2B, 3A, 3B a 4 hodnocené jako parciální resekce, byl průměrný OS 9,6 měsíce, s mediánem 5,9 měsíce.
Při hodnocení vlivu onkoterapie dosáhli pacienti s lepší resekcí, dobrým pooperačním klinickým stavem a schopností absolvovat kompletní onkologickou léčbu (Stuppův protokol) jednoznačně lepšího OS (obr. 7). Ve skupinách 1 a 2A s kompletní resekcí (celkem 29 pacientů) absolvovalo Stuppův protokol 15 pacientů s průměrným OS 19,6 měsíce a mediánem 14,1 měsíce. Pouhou pooperační radioterapii absolvovalo 5 pacientů s průměrným OS 13,5 měsíce a mediánem 5,4 měsíce. Bez onkologické léčby zůstalo 9 pacientů s průměrným OS 11,2 měsíce a mediánem 3,8 měsíce.
Ve zbylých skupinách s parciální resekcí (celkem 21 pacientů) podstoupilo Stuppův protokol 8 pacientů s průměrným OS 14,9 měsíce a mediánem 13,2 měsíce. Pouhou radioterapii podstoupilo 8 pacientů s průměrným OS 9,2 měsíce a mediánem 8,2 měsíce. Bez onkologické léčby bylo 5 pacientů s průměrným OS 1,7 měsíce a mediánem 1,3 měsíce.
Diskuze
Chirurgická resekce nádoru je základní součástí léčby gliomů a radikalita resekce byla opakovaně potvrzena jako pozitivní prognostický faktor ovlivňující OS [6–13]. Na základě pooperačního vyšetření MR provedeného nejpozději do 72 h od operačního výkonu byla radikalita resekce hodnocena několika způsoby [9,10]. Jednou z možností bylo dělení podle radiologického, MR postkontrastního obrazu, reziduální nádoru: gross total resection (GTR) = úplné odstranění postkontrastně se sytící složky nádoru, near total resection (NTR) = postkontrastně se sytící tenký okrsek nádoru na stěně resekční dutiny, subtotal resection (STR) = postkontrastně se sytící drobné nodulace na stěně resekční dutiny a partial resection (PR) = přítomnost velkého postkontrastně se sytícího rezidua nádoru.
Další možností bylo hodnocení rozsahu resekce porovnáním předoperačního a pooperačního objemu a stanovení procentuální redukce původního objemu nádoru: GTR = úplné odstranění postkontrastně se sytící složky nádoru, NTR = více než 90% redukce původního objemu nádoru, STR = odstranění 51–90 % objemu původní nádorové expanze a PR = s exstirpací menší nebo rovno než 50 % původního nádorového objemu. V případě exstirpace méně než 10 % původního objemu nádoru byla považována tato operaci za pouhou biopsii. Oba zmíněné postupy hodnocení pooperační rezidua však mají své nedostatky. První systém rozdělující pooperační nález na MR podle radiologických stupňů radikality je zatížen značnou subjektivitou a systém využívající procentuálního hodnocení radikality resekce je zatížen bias vycházejícím z rozdílného předoperačního objemu jednotlivých nádorů.
Jednou z prvních zásadních studií byla práce autorů Sanaie a Bergera z roku 2011 [10] zaměřená na volumetrickou analýzu rozsahu resekce u 500 pacientů s nově diagnostikovanými supratentoriálními GBM. Medián pooperačního reziduálního objemu nádoru byl 2,3 cm3 a střední rozsah resekce byl 96 %. Tato práce prokázala signifikantní prodloužení přežívání při redukci více než 78 % původního objemu nádoru.
V retrospektivní studii Orringer a Lau et al. [13] použili semiautomatickou techniku hodnocení rozsahu resekce u GBM. Střední rozsah resekce byl 91 %. I zde se rozsah resekce pojil se signifikantně delším přežíváním (76,5 %), a to v případě resekce vyšší nebo rovno než 90 % oproti resekci menší než 90 %.
Další práce z roku 2014 autorů Grabowski et al. [19] ukázala, že objem reziduálního postkontrastně se sytícího GBM je mnohem signifikantnějším prediktorem prodloužení OS než procentuální rozsah resekce. Jako hraniční objem pro signifikantní dopad resekce na prodloužení OS byl určen objem 2 cm3 reziduálního nádoru.
V roce 2023 byly publikovány práce [12,20,21], které ukázaly dopad úplné exstirpace postkontrastně se sytící tkáně GBM na výrazné prodloužení OS. Úsilí o zjištění objemu reziduálního nádoru, který ještě signifikantně prodlouží OS, vedlo až ke studii organizované EANO [12], která potvrdila výše zmíněné závěry a posunula hranici na 1 cm3 reziduálního postkontrastně se sytícího nádoru.
Na základě naší studie jsme pro naši klinickou praxi k původním radiologickým stupňům radikality přiřadili námi zjištěné hraniční objemy reziduálního nádoru: supramaximální resekce, GTR: bez postkontrastně se sytícího rezidua, NTR: ≤ 1 cm3 rezidua, STR: > 1 cm3 a ≤ 5 cm3 a PR: > 5 cm3.
Naše práce ukázala jasně signifikantní prodloužení OS pouze u skupin bez postkontrastně se sytícího rezidua (medián OS = 16,1 vs. 6,3 měsíce). Ve skupině s reziduálním objemem nádoru do 1 cm3 se již objevila redukce prodloužení OS (medián OS = 10,7 měsíce). Naše studie prokázala, že reálná velikost reziduálního nádoru je významnějším prognostickým faktorem pro OS než procentuálně vyjádřený rozsah resekce.
Opakovaně probíraným tématem v literatuře je otázka tzv. supramaximální resekce MR/T1 hyposignální oblasti v okolí postkontrastně se sytícího nádoru [11]. Tuto oblast tvoří peritumorózní infiltrační zóna [22], která vzniká při průniku migrujících nádorových buněk do mozkové tkáně a je patobiologickým podkladem reziduálního nádorového onemocnění u GBM [23]. Ze závěrů plyne, že efekt úplné exstirpace postkontrastně se sytící tkáně GBM na prodloužení OS může být dále navýšen při alespoň 50% redukci postkontrastně se nesytící části nádoru [11,24, 25]. I naše studie prokázala pozitivní prognostický efekt resekce peritumorózní infiltrační zóny, kde medián OS u těchto pacientů dosáhl 18 měsíců.
Vzrůstající radikalita resekce se nutně pojí se vzrůstajícím rizikem permanentního neurologického deficitu, který kompromituje aplikaci standardní onkologické terapie [26] a v konečném důsledku zkracuje OS [27]. Naopak bylo prokázáno, že pozitivní prognostický efekt onkoterapie v Stuppově režimu je znásoben radikální resekcí GBM [5]. I v našem souboru dosáhli pacienti s radikální resekcí a s onkoterapií ve Stuppově režimu nejlepšího výsledku s průměrnou OS 19,6 měsíce a mediánem 14,1 měsíce. Omezené procento pacientů, kteří nakonec byli schopni absolvovat standardní chemoradioterapii, odpovídá údajům publikovaným i v české literatuře [28].
Závěr
Naše práce popisuje jednoduchý postup výpočtu objemu pooperačního rezidua nádoru s pomocí snadno dostupného softwaru. Dle závěrů naší studie signifikantně nejlepších výsledků dosáhli pacienti s úplným odstraněním postkontrastně se sytící části GBM doplněným o co nejradikálnější resekci postkontrastně se nesytící části nádoru. Na základě získaných dat o objemech reziduálního nádoru jsme mohli přesně definovat stupně radikality.
U GBM existuje jen několik kontrolovatelných faktorů, u kterých bylo prokázáno, že jsou schopny ovlivňovat léčebné výsledky, a maximálně radikální bezpečná resekce mezi ně patří. Naopak nepříznivý pooperační klinický stav pacienta může tento efekt minimalizovat. Proto nalezení rovnováhy mezi radikalitou resekce a pooperační kvalitou života musí být nedílnou součástí na pacienta orientované individualizované chirurgické léčebné strategie.
Etické aspekty
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Pacienti byli léčeni standardním postupem. Studie nepodléhá schválení etickou komisí. Všichni pacienti podepsali informovaný souhlas s anonymizovanou analýzou získaných dat a souhlas s diagnostickým a léčebným procesem.
Grantová podpora
Tato studie byla částečně podpořena grantem MZ ČR – AZV (NU21-03-00195). Tato studie byla podpořena prostředky konceptuálního rozvoje výzkumné organizace FNOL, 00098892.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Sources
1. Louis DN, Perry A, Reifenberger G et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 2016; 131 (6): 803–820. doi: 10.1007/s00401-016-15.
2. Konečná A, Netuka D. Difuzní nízkostupňové gliomy. Cesk Slov Neurol N 2020; 83/116 (5): 467–490. doi: 10.14735/amcsnn2020467.
3. Hendrych M, Valeková H, Kazda T et al. Integrated diagnostics of diffuse gliomas. Klin Onkol 2020; 33 (4): 248–259. doi: 10.14735/amko2020248.
4. Louis DN, Perry A, Wesseling P et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Ann Oncol 2010; 21 (Suppl 5): v190ev193. doi: 10.1016/j.annonc.2010.08.016.
5. Lakomy R, Kazda T, Selingerova I et al. Real-world evidence in glioblastoma: Stupp’s regimen after a decade. Front Oncol 2020; 10 : 840. doi: 10.3389/fonc.2020.00840.
6. Di L, Heath RN, Shah AH et al. Resection versus biopsy in the treatment of multifocal glioblastoma: a weighted survival analysis. J Neurooncol 2020; 148 (1): 155–164. doi: 10.1007/s11060-020-03508-6.
7. Halaj M, Kalita O, Tuckova L et al. Life expectancy in glioblastoma patients who had undergone stereotactic biopsy: a retrospective single-center study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2023. doi: 10.5507/bp.2023.030.
8. Ushio Y, Kochi M, Hamada J et al. Effect of surgical removal on survival and quality of life in patients with supratentorial glioblastoma. Neurol Med Chir (Tokyo) 2005; 45 (9): 454–460; discussion 460–461. doi: 10.2176/nmc.45.454.
9. McGirt MJ, Chaichana KL, Gathinji M et al. Independent association of extent of resection with survival in patients with malignant brain astrocytoma. J Neurosurg 2009; 110 (1): 156–162. doi: 10.3171/2008.4.17536.
10. Sanai N, Berger MS. Extent of resection influences outcomes for patients with gliomas. Rev Neurol (Paris) 2011; 167 (10): 648–654. doi: 10.1016/j.neurol.2011.07.004.
11. Que T, Huang G, Tan JE et al. Supramaximal resection based on en-bloc technique reduces tumor burden and prolongs survival in primary supratentorial lobar glioblastoma. J Neurooncol 2023; 164 (3): 557–568. doi: 10.1007/s11060-023-04399-z.
12. Karschnia P, Young JS, Dono A et al. Prognostic validation of a new classification system for extent of resection in glioblastoma: a report of the RANO resect group. Neuro Oncol 2023; 25 (5): 940–954. doi: 10.1093/neuonc/ noac193.
13. Orringer D, Lau D, Khatri S et al. Extent of resection in patients with glioblastoma: limiting factors, perception of resectability, and effect on survival. J Neurosurg 2012; 117 (5): 851–859. doi: 10.3171/2012.8.JNS12234.
14. McCarthy P. Source code for: FSLeyes Zenodo. [online]. Dostupné z: https: //zenodo.org/records/10122614.
15. Yushkevich PA, Piven J, Hazlett HC et al. User-guided 3D active contour segmentation of anatomical structures: significantly improved efficiency and reliability. Neuroimage 2006; 31 (3): 1116–1128. doi: 10.1016/j.neuroimage.2006.01.015.
16. Sporikova Z, Slavkovsky R, Tuckova L et al. IDH1/2 mutations in patients with diffuse gliomas: a single centre retrospective massively parallel sequencing analysis. Appl Immunohistochem Mol Morphol 2022; 30 (1): 178–183. doi: 10.1097/PAI.0000000000000997.
17. Urbanovska I, Megova MH, Dwight Z et al. IDH mutation analysis in glioma patients by CADMA compared with SNaPshot assay and two immunohistochemical methods. Pathol Oncol Res 2019; 25 (4): 971–978. doi: 10.1007/s12253-018-0413-9.
18. Kalita O, Sporikova Z, Hajduch M et al. The influence of gene aberrations on survival in resected IDH wildtype glioblastoma patients: a single-institution study. Curr Oncol 2021; 28 (2): 1280–1293. doi: 10.3390/curroncol28020122.
19. Grabowski MM, Recinos PF, Nowacki AS et al. Residual tumor volume versus extent of resection: predictors of survival after surgery for glioblastoma. J Neurosurg 2014; 121 (5): 1115–1123. doi: 10.3171/2014.7.JNS132449.
20. Bjorland LS, Mahesparan R, Fluge Ø et al. Impact of extent of resection on outcome from glioblastoma using the RANO resect group classification system: a retrospective, population-based cohort study. Neurooncol Adv 2023; 5 (1): vdad126. doi: 10.1093/noajnl/vdad126.
21. Mendoza Mireles EE, Skaga E, Server A et al. The benefit of complete resection of contrast enhancing tumor in glioblastoma patients: a population-based study. Neurooncol Pract 2023; 10 (6): 555–564. doi: 10.1093/nop/npad037.
22. Giambra M, Di Cristofori A, Valtorta S et al. The peritumoral brain zone in glioblastoma: where we are and where we are going. J Neurosci Res 2023; 101 (2): 199–216. doi: 10.1002/jnr.25134.
23. Zarkoob H, Taube JH, Singh SK et al. Investigating the link between molecular subtypes of glioblastoma, epithelial-mesenchymal transition, and CD133 cell surface protein. PLoS One 2013; 8 (5): e64169. doi: 10.1371/journal.pone.0064169.
24. Karschnia P, Dietrich J, Bruno F et al. Surgical management and outcome of newly diagnosed glioblastoma without contrast enhancement (low grade appearance): a report of the RANO resect group. Neuro Oncol 2024; 26 (1): 166–177. doi: 10.1093/neuonc/noad160.
25. Brown TJ, Brennan MC, Li M et al. Association of the extent of resection with survival in glioblastoma: a systematic review and meta-analysis. JAMA Oncol 2016; 2 (11): 1460–1469. doi: 10.1001/jamaoncol.2016.1373.
26. Young JS, Morshed RA, Hervey-Jumper SL et al. The surgical management of diffuse gliomas: current state of neurosurgical management and future directions. Neuro Oncol 2023; 25 (12): 2117–2133. doi: 10.1093/neuonc/noad133.
27. Rahman M, Abbatematteo J, De Leo EK et al. The effects of new or worsened postoperative neurological deficits on survival of patients with glioblastoma. J Neurosurg 2017; 127 (1): 123–131. doi: 10.3171/2016.7.JNS16396.
28. Bartos R, Ospalik D, Malucelli A et al. Retrospektivní autoevaluace výsledků operací intrinsických mozkových nádorů – konsekutivní kohorta 270 operací v rámci jednoho neurochirurgického centra NOS ČOS (Neuroonkologické sekce České onkologické společnosti) z let 2015–2017. Cesk Slov Neurol N 2019; 82 (4): 401–409. doi: 10.14735/amcsnn2019401.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2024 Issue 1-
All articles in this issue
- Nízkotlaký hydrocefalus
- Tonsilla cerebelli – anatomie, funkce a její význam pro neurochirurgii
- Editorial
- Využitie umelej inteligencie pri hodnotení obrazu CT u pacientov s CMP – aktuálne možnosti
- Adaptace a psychometrická validace české verze Addenbrookského kognitivního testu (ACE-III-CZ) – pilotní studie
- Retrospektivní hodnocení a jednoleté sledování 58 pacientů podle etiologie defektu nervové trubice
- Vztah mezi objemem postresekčního rezidua a celkovým přežíváním pacientů s glioblastomem – studie v rámci jednoho neuroonkologického centra
- Poděkování recenzentům
- Začiatky mozgovej angiografie vo svete a v Československu
- Ischemie corpus callosum
- Standardizace využití MR v managementu roztroušené sklerózy 69 Konsenzus českého expertního radiologicko-neurologického panelu
- Zpráva o 36. českém a slovenském neurologickém sjezdu
- Zpráva ze světového neurochirurgického kongresu 2023
- Přehled difuzních gliomů dle klasifikace WHO 2021, 2. část – difuzní gliomy dětského typu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přehled difuzních gliomů dle klasifikace WHO 2021, 2. část – difuzní gliomy dětského typu
- Tonsilla cerebelli – anatomie, funkce a její význam pro neurochirurgii
- Standardizace využití MR v managementu roztroušené sklerózy 69 Konsenzus českého expertního radiologicko-neurologického panelu
- Adaptace a psychometrická validace české verze Addenbrookského kognitivního testu (ACE-III-CZ) – pilotní studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

