-
Medical journals
- Career
Standardizace využití MR v managementu roztroušené sklerózy 69 Konsenzus českého expertního radiologicko-neurologického panelu
Authors: M. Vaněčková 1; D. Horáková 2; D. Šťastná 2; R. Tupý 3; M. Keřkovský 4; P. Ryška 5; M. Holešta 6; M. Peterka 7,8; P. Hradílek 9; J. Palíšek 10; J. Prokešová 11; M. Vachová 2,12; J. Mareš 13
Authors‘ workplace: Oddělení MR, Radiodiagnostická klinika 1. LF UK a VFN v Praze 1; Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze 2; Klinika zobrazovacích metod LF UK a FN Plzeň 3; Klinika radiologie a nukleární medicíny LF MU a FN Brno 4; Radiologická klinika LF UK a FN Hradec Králové 5; Klinika radiologie a nukleární medicíny 3. LF UK a FNKV, Praha 6; Neurologická klinika LF UK a FN Plzeň 7; Neurologická klinika LF UK a FN Hradec Králové 8; Neurologická klinika LF OU a FN Ostrava 9; Oddělení zobrazovacích metod, KNTB Zlín 10; Radiodiagnostické oddělení, KZ – Nemocnice Teplice 11; Neurologické oddělení, KZ – Nemocnice Teplice 12; Neurologická klinika LF UP a FN Olomouc 13
Published in: Cesk Slov Neurol N 2024; 87(1): 69-78
Category:
doi: https://doi.org/10.48095/cccsnn202469Overview
U onemocnění RS má MR nezastupitelnou roli. Pro maximální využití potenciálu této metody, tedy pro časnou a přesnou diagnostiku s určením prognostických markerů, časný signál neefektivity terapie či bezpečnostního problému, ale i pro dostupnost adekvátní péče pro všechny pacienty, je klíčová unifikace managementu MR napříč jednotlivými pracovišti. Zároveň je podstatná komunikace mezi radiologem a neurologem a s tím související standardizace jak žádanky, tak popisu MR. Jednotná forma dat z MR by vedle zkvalitnění péče o individuálního pacienta vedla i k možnosti sběru dat na národní úrovni. Tím by umožnila získat strukturované informace pro výzkum a také využití dat z MR při jednáních s plátci zdravotní péče. Za tímto účelem vznikl pod záštitou Sekce klinické neuroimunologie a likvorologie České neurologické společnosti tento konsenzus českého expertního radiologicko-neurologického panelu vycházející z mezinárodních doporučení Magnetic Resonance Imaging in Multiple Sclerosis (MAGNIMS). Přichází s návrhem doporučení základního a rozšířeného diagnostického, monitoračního a bezpečnostního protokolu MR, stanovuje frekvenci jednotlivých vyšetření, nutné informace na žádance na MR a představuje normovaný popis diagnostické i monitorační MR u pacientů s podezřením či stanovenou diagnózou RS.
Klíčová slova:
roztroušená skleróza – diagnostická kritéria – magnetická rezonance – bezpečnost – doporučení – prognostické markery – monitorační protokol – diagnostický protokol – žádanka – normovaný popis
Úvod
Role MR je u pacientů s RS naprosto klíčová, a to již v období vlastní diagnostiky onemocnění. Proto došlo k jejímu začlenění do mezinárodních diagnostických McDonaldových kritérií a postupně při jejích dalších revizích dochází k upevňování její role (poslední revize kritérií je z roku 2017 [1]). Protokol MR využívaný při diagnostice onemocnění musí reflektovat zmiňovaná kritéria, umožnit odlišit RS od jiných chorob, a především co nejrychleji dospět k diagnóze. Co nejčasněji zahájená adekvátní terapie je pro prognózu pacienta zcela zásadní [2–8].
Vlastní diagnostika ale není jedinou úlohou MR v managementu nových pacientů s RS. Průběh této nemoci je u jednotlivých pacientů velmi variabilní a v době stanovení diagnózy je další prognóza vývoje nejistá. Správné vyhodnocení prediktivních ukazatelů je proto nezbytné pro nastavení další léčebné strategie, a to zejména kvůli možnosti včasného nasazení účinnější terapie i za cenu vyššího rizika nežádoucích účinků této léčby [9]. Základním, a tím i klíčovým prediktivním ukazatelem je právě nález na vstupním vyšetření MR [10]. Za optimální situaci tedy považujeme vyhodnocení těchto důležitých ukazatelů již v rámci diagnostického zobrazení. Horší prognózu predikují větší počet a objem ložisek [11,12], infratentoriální uložení [13,14], intramedulární lokalizace lézí [15,16] a enhancement prokazující aktivní zánět s porušenou hematoencefalickou bariérou [16]. Zapomínat nesmíme ani na přítomnost časných známek atrofie a černých děr již při vstupním vyšetření [17]. Nepříznivým prediktorem pro kognici i celkovou disabilitu (dle Kurtzkeho škály – Expanded Disability Status Scale [EDSS]) je pak také velké ložiskové postižení v oblasti mozkové kůry [18].
Jakmile je zahájena terapie, je neméně důležité sledovat její efektivitu a bezpečnost a případně terapeutickou strategii včas měnit. Hlavním klinickým a prakticky měřitelným výstupem je míra klinické disability hodnocená pomocí EDSS. Při progresi disability je však již na dostatečně účinnou intervenci často pozdě. Pro včasnou účinnou změnu terapie je nezbytný paraklinický marker schopný zachytit i subklinickou aktivitu RS, a tím je zejména MR. To je reflektováno i v současných evropských a českých léčebných standardech, které jako jeden z hlavních léčebných cílů zmiňují koncept No Evidence of Disease Activity (NEDA). Pacient, který dosáhne NEDA-3, nemá klinické relapsy, neprogreduje na stupnici EDSS a nejsou u něj patrné aktivní zánětlivé léze ani nové či zvětšené T2 léze [19–21]. Dosažení NEDA-3 vede k výrazně nižšímu riziku dlouhodobé progrese [22]. Vedle indikačních kritérií vycházejících z medicínských poznatků je však léčba v ČR řízena i kritérii úhradovými. I ta parametry MR zohledňují. V současnosti se jedná o hodnocení negativních prognostických markerů v MR obraze, to znamená přítomnosti infratentoriálních a intramedulárních ložisek, celkový počet ložisek a přítomnost enhancujících lézí. Dále je možné eskalovat léčbu jen na základě aktivity v obraze MR – při výskytu tří nebo více nových nebo zvětšených ložisek. Vzhledem k prokázanému významu MR pro detekci subklinické aktivity lze předpokládat další rozšíření léčebných schémat dle nálezu na MR.
V neposlední řadě je pak velmi aktuálním problémem sledování neurodegenerace zodpovědné za kumulaci disability, respektive zejména progrese nezávislé na relapsech (progression independent of relapse activity; PIRA), která je dle dostupných dat přítomna již v počátku nemoci a s postupem času začíná dominovat [23,24]. PIRA je způsobena zánětem doutnajícím za uzavřenou hematoencefalickou bariérou. Tento zánět je typicky lokalizovaný na okrajích již existujících ložisek a je zprostředkovaný zejména aktivovanou mikroglií [25,26]. Pro sledování tohoto fenoménu na MR se uplatňuje detekce chronicky aktivních ložisek, ať už ve formě pomalu progredujících ložisek (slowly evolving lesions; SEL) nebo ložisek s prstenčitým hyposignálním ohraničením na susceptibilitně váženém zobrazení, tzv. paramagnetic rim lézi (PRL). Pro predikci tíže onemocnění je ideální sledovat jak SEL, tak i PRL, protože u pacientů s lézemi pozitivními na oba znaky byl popsán větší nárůst disability [27]. Patrná je i postupující atrofie [25]. Klinicky významnou roli získává sledování PIRA zejména s blížícím se ukončením klinických studií fáze III hned u několika inhibitorů Brutonovy tyrosinkinázy se schopností pronikat do CNS a ovlivňovat mj. i mikroglii, potažmo tedy doutnající zánět [28–34]. Stále se rozšiřující portfolio terapeutických možností i zlepšující se MR metody vedou i k novým léčebným cílům, přičemž začíná být vedle již zmiňovaného konceptu NEDA-3 široce akceptován i koncept NEDA-4 zohledňující navíc i sledování atrofie [35].
Magnetická rezonance je již od svého zavedení do praxe nejdůležitějším biomarkerem u RS a v současnosti její význam ještě narostl. Jednak vzhledem k možnosti nasadit vysoce efektivní léčbu dominantně na podkladě MR nálezu, jednak s ohledem na možnost eskalace při subklinické aktivitě na základě MR progrese. Pro co největší využití potenciálu této metody, tedy pro časnou a přesnou diagnostiku s určením prognostických markerů, časný signál neefektivity terapie či bezpečnostního problému, ale i pro dostupnost adekvátní péče pro všechny pacienty, je pak klíčová unifikace protokolů napříč jednotlivými pracovišti. Standardizace vede k větší specificitě i senzitivitě vyšetření MR. Zároveň je neméně podstatná kvalitní komunikace mezi radiologem a neurologem a s tím související standardizace jak žádanky, tak vyhodnocení vyšetření MR, resp. standardizace jeho popisu. Jednotná forma dat z MR vedle zkvalitnění péče o individuálního pacienta umožní i sběr dat na národní úrovni [36] a lepší vyjednávací podmínky při jednání s plátci zdravotní péče. Za tímto účelem vychází pravidelně doporučení standardizovaných protokolů dle Magnetic Resonance Imaging in Multiple Sclerosis (MAGNIMS) a Consortium of Multiple Sclerosis Centres [37]. Trendem poslední doby je pak upevnit optimalizaci na národní úrovni. Tímto směrem se vydává i Česká republika a pod záštitou Sekce klinické neuroimunologie a likvorologie (SKNIL) České neurologické společnosti vydává tento konsenzus českého expertního radiologicko-neurologického panelu vycházející a modifikovaný dle MAGNIMS [37–39].
Table 1. Standardní protokoly MR pro vyšetření mozku. 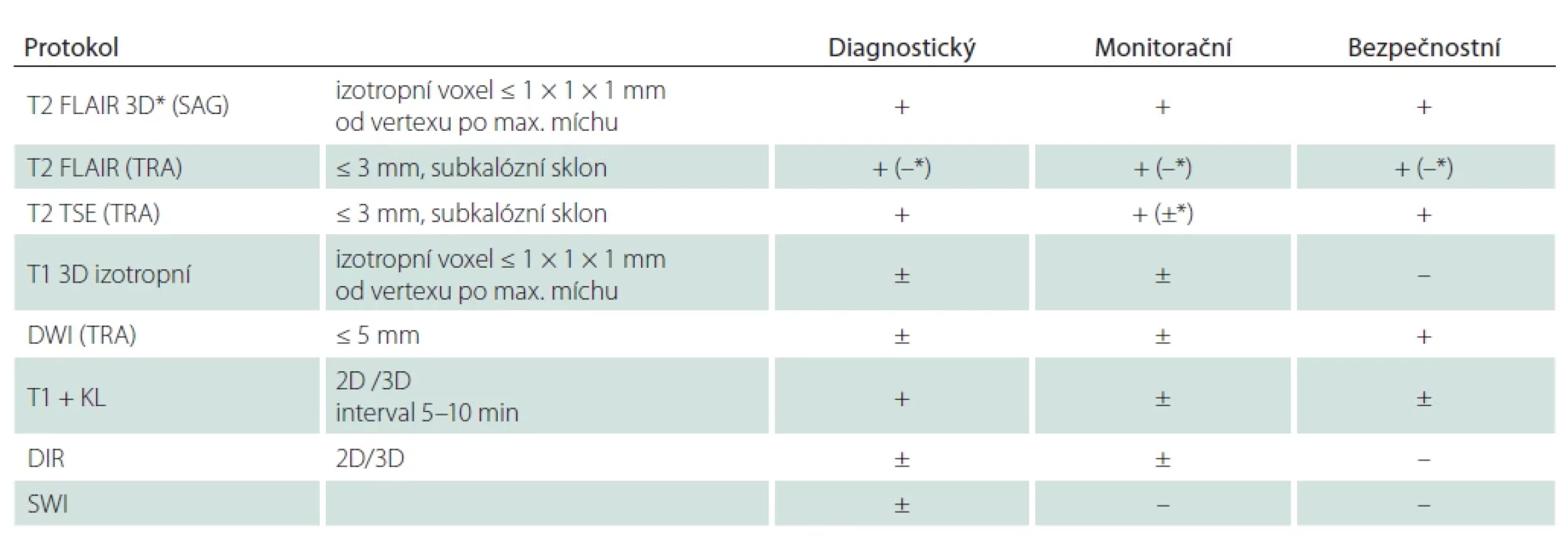
*když není možné provést 3D FLAIR, nebo když není 3D FLAIR v dostatečné kvalitě
DIR – double inversion recovery; DWI – difuzí vážené obrazy; FLAIR – fl uid attenuated inversion recovery; KL – kontrastní látka; SAG – sagitální; SWI – susceptibilně vážené zobrazení; TRA – transverzální; TSE – turbo spin echoImage 1. Bazální diagnostický protokol MR mozku dle konsensu panelu: (a) 3D FLAIR; (b) FLAIR transverzální rekonstrukce; (c) T2 vážený obraz v transverzální rovině; (d) postkontrastní T1 vážené zobrazení v transverzální rovině; (e) difuzí vážené zobrazení; (f) pokud lze, doplnění o 3D T1 vážený obraz s vysokým rozlišením a izotropním voxelem pro měření mozkové atrofi e. 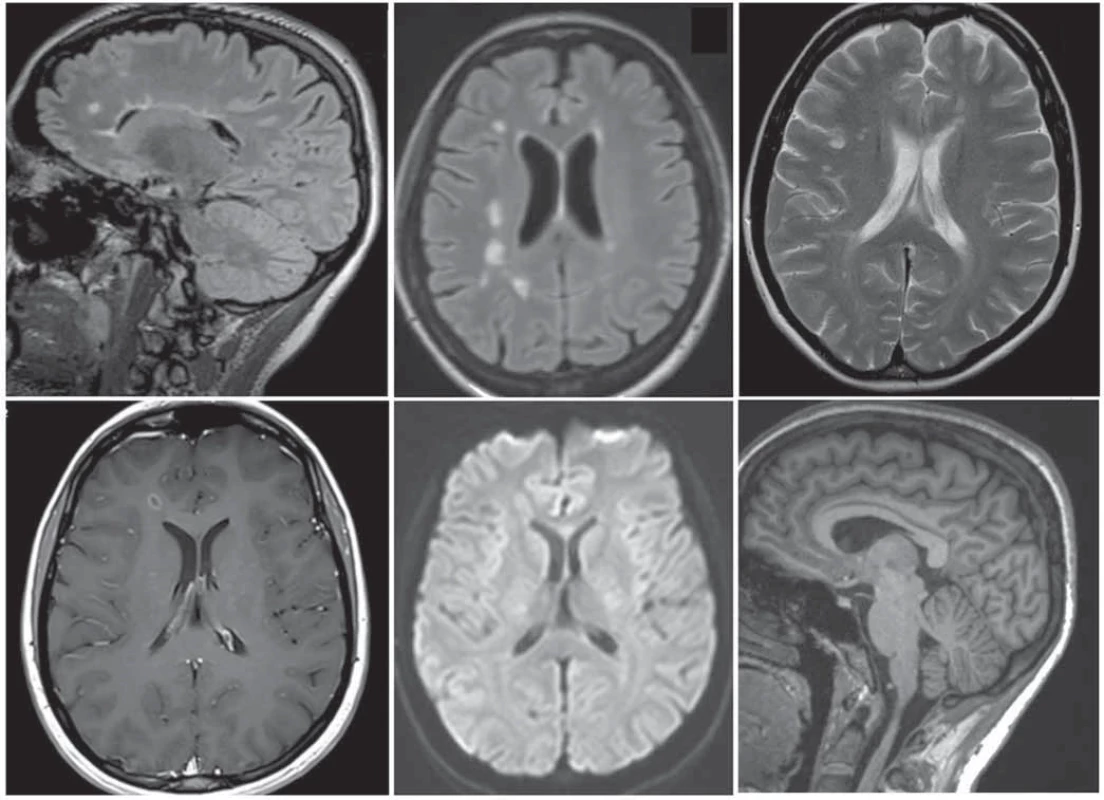
Fig. 1. Basal brain MRI diagnostic protocol according to the panel consensus: (a) 3D FLAIR; (b) FLAIR transverse reconstruction; (c) T2-weighted image in the transverse plane; (d) post-contrast T1-weighted image in the transverse plane; (e) diff usion-weighted image; (f) if it can be completed, adding a high-resolution 3D T1-weighted image and an isotropic voxel to measure brain atrophy.
FLAIR – fluid attenuated inversion recoveryStandardizace MR diagnostického protokolu u dospělých pacientů
Základní minimální diagnostický protokol pro vyšetření mozku stanovený konsenzem českého expertního radiologicko-neurologického panelu po vzoru MAGNIMS [37] je doporučeno preferenčně provést na 3T přístroji, je-li k dispozici. Obsahuje (tab. 1, obr. 1, 2):
- Sagitální 3D fluid attenuated inversion recovery (FLAIR) – klíčová sekvence (možná i s potlačením signálu tuku);
- T2 vážený obraz v transverzální rovině (turbo spin echo [TSE] nebo fast spin echo [FSE]; tloušťka řezu menší nebo rovna 3 mm) – sekvence FLAIR a T2 vážený obraz se může provádět postkontrastně, aby se neprodlužoval čas vyšetření a dodržel se interval postkontrastního skenování;
- Postkontrastní T1 vážený obraz 2D v transverzální rovině nebo 3D (důležité je dodržet interval od podání kontrastní látky a skenování 5–10 min tak, aby byla maximální detekce enhancementu);
- Difuzí vážený obraz (diffusion weighted image; DWI) – může pomoci v diferenciální diagnostice, např. u cévních lézí, vaskulitid, zánětlivých změn (typická ložiska RS nemají restrikci difuze), je ale nutné mít na paměti, že hyperakutní plaka může mít restrikci difuze (týden před objevením enhancementu) [40] + T1 vážený obraz 3D (s izotropním voxelem a s vysokým rozlišením, nativně) – je doporučováno doplnit již při diagnostickém vyšetření, lze-li, jako baseline pro možnost měření atrofie mozku a SEL v budoucnosti.
- V souladu se současnými poznatky o významu detekce kortikálních ložisek je doporučeno ke zvážení rozšíření protokolu o (obr. 2):
- Double inversion recovery (DIR) – tato sekvence je velmi senzitivní pro detekci kortikálních ložisek, které jsou započítávány dle platných diagnostických kritérií pro diseminaci v prostoru (DIS). Kortikální ložiska jsou pro RS specifická, a to více než ložiska v bílé hmotě. Naopak nejsou typická pro neuromyelitis optica a poruchy jejího širšího spektra (neuromyelitis optica spectrum disorder; NMOSD), nevyskytují se u pacientů s migrénou ani u zdravých dobrovolníků – v těchto skupinách však může být drobný ložiskový nález v bílé hmotě. Problémem může být prodloužení vyšetřovacího času a vyhodnocení, které je časově náročnější a vyžaduje určitou odbornou erudici. Pro vyšší detekci je vhodné zařadit DIR ve 3D.
- Susceptibilně vážené zobrazení (susceptibility weighted imaging; SWI) – toto zobrazení může zvýšit specificitu vyšetření MR, protože je schopno vizualizovat perivenulární demyelinizaci tím, že zobrazí centrální venulu procházející ložiskem. Tuto sekvenci je vhodné použít tam, kde očekáváme diferenciálně diagnostické problémy, např. u starších pacientů pro odlišení postischemických změn. Pokud je přítomno vyšší procento ložisek s příznakem centrální venuly, potom se nejspíše jedná o RS a ne o onemocnění ji napodobující. Nevýhodou této sekvence je fakt, že dosud nebyla provedena standardizace akvizice a jsou vyšší nároky na erudici při jejím vyhodnocení. Dalším problémem je absence stanovené cut-off hodnoty. RS od jiných onemocnění s ložisky v bíle hmotě však dle dostupné literatury jednoznačně odlišuje minimum 50 % ložisek s přítomností centrální venuly [41]. Někteří autoři navrhují zvolit určitý minimální počet ložisek s přítomností centrální venuly, např. pravidlo tří či šesti ložisek [42–44]. SWI může zobrazit i chronicky aktivní ložiska, to znamená ložiska, která mají hyposignální ohraničení. Detekujeme aktivovanou mikroglii na okraji ložiska, respektive její zvýšený obsah železa (PRL). Ložiska se vyskytují jak u relaps-remitentní, tak ve větší míře i u progresivní RS [45,46]. Jejich výskyt je udáván u 20–40 % pacientů [44,47–49]. Při porovnání ložisek s hyposignálním ohraničením na MR s histopatologickým nálezem bylo prokázáno, že se jedná o chronicky aktivní ložiska (SEL), která jsou destruktivní v centru (axonální ztráta) a na jejichž okrajích je doutnající zánět a demyelinizace [48]. Problém je zde obdobný jako při vyhodnocení příznaků centrální venuly, sekvence není standardizovaná (rozdílná u různých time to echo [TE]; nižší senzitivita u 1,5T přístroje) a vyhodnocení ložisek vyžaduje odbornou erudici a je časově náročné.
Základní minimální diagnostický protokol obsahuje i vyšetření míchy v sagitální rovině s tloušťkou maximálně 3 mm bez mezer, a to alespoň po obratlové tělo Th4–5. Obsahuje vždy dvě sekvence ze tří (tab. 2, obr. 3):
- T2 vážený obraz;
- protondenzitně vážené zobrazení;
- T2 vážený obraz s potlačením tuku technikou short tau inversion recovery (STIR) (sekvence T2 STIR pro zobrazení míchy by měla být provedena ještě před aplikací kontrastní látky, a to vzhledem k možnému potlačení kontrastu případných sytících se ložisek).
Vzhledem k tomu, že je při diagnostické MR aplikována kontrastní látka za účelem zobrazení enhancementu ložisek v mozkové tkáni, doporučuje se provést i postkontrastní vyšetření míchy – v sagitální rovině řezu (i když je výskyt enhancementu intramedulárních ložisek řádově nižší než intracerebrálně).
MR vyšetření míchy může být rozšířeno o další sekvence: - T2 vážený obraz v transverzální rovině – může pomoci s konfirmací ložiska (např. při zatížení sagitálních řezů artefakty), velký význam má ve zvýšení specificity; ložiska RS jsou typicky lokalizována laterodorzálně na rozdíl od centrální lokalizace u NMOSD a onemocnění s pozitivitou protilátek proti myelinovému oligodendrocytárnímu glykoproteinu (MOGAD).
Standardizace monitoračního protokolu MR u dospělých pacientů
Základní nepodkročitelný protokol MR pro monitoraci RS stanovený konsenzem českého expertního radiologicko-neurologického panelu po vzoru MAGNIMS [37] obsahuje (tab. 1, obr. 4):
- Sagitální 3D FLAIR – klíčová sekvence (s rekonstrukcemi v transverzální rovině sklopené dle corpus callosum, možné i s potlačením tuku), při nižší kvalitě je vhodné doplnit T2 vážený obraz v trans - verzální rovině;
- DWI.
Lze-li, je doporučeno za účelem standardizovaného měření atrofie doplnit:
- T1 vážený obraz 3D (s izotropním voxelem s vysokým rozlišením).
Image 2. Bazální monitorační protokol: (a) 3D FLAIR (b) s transverzální rekonstrukcí; (c) difuzí vážené zobrazení; (d) ideálně doplněné 3D T1 pro měření atrofi e. 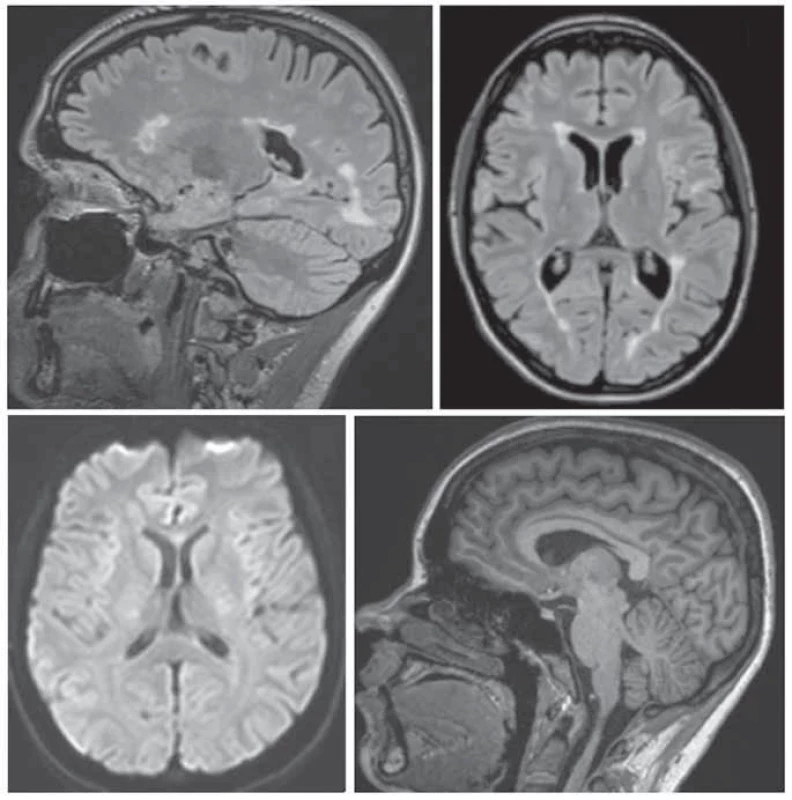
FLAIR – fluid attenuated inversion recovery
Fig. 4. Basal monitoring protocol: (a) 3D FLAIR (b) with transverse reconstruction; (c) diff usion-weighted image; (d) ideally supplemented with 3D T1 to measure atrophy.Standardizace bezpečnostního monitoračního protokolu MR
U pacientů s rizikem rozvoje progresivní multifokální leukoencefalopatie (PML) je nutno nadefinovat i podskupinu monitoračního protokolu, a to protokol bezpečnostní. Ten by dle konsenzu radiologicko-neurologického panelu měl obsahovat (tab. 1):
- sagitální 3D FLAIR – klíčová sekvence (s rekonstrukcemi v transverzální rovině sklopené dle corpus callosum);
- T2 vážený obraz v transverzální rovině;
- DWI.
Standardizace MR žádanky a logistiky monitorace
Vedle vlastních protokolů je s ohledem na dynamiku nemoci a terapeutické odpovědi zásadní i načasování vyšetření MR. Český expertní radiologicko-neurologický panel doporučil:
- Frekvence vyšetření (obr. 5) – MR mozku a míchy je nutno provést v diagnostickém protokolu před zahájením léčby (optimálně ne déle než 3 měsíce před zahájením léčby). Rebaseline MR mozku je na stejném přístroji v monitoračním protokolu doporučeno následně provést vždy po 6 měsících od zahájení/po změně terapie. Další monitorace by měla probíhat každých 12 měsíců. Co se vyšetření míchy týče, požadavek na zařazení do monitoračního protokolu musí neurolog uvést na žádanku na základě individuálního zvážení. Doporučené je zejména u míšní symptomatiky, a to i dle MAGNIMS [37]. Ke zvážení je zařazení MR míchy (částečné po Th4) i do pravidelné monitorace, byť s delším intervalem (např. à 2–3 roky) [50].
- Těhotenství a laktace – v těhotenství se v prvním trimestru vyšetření MR neprovádí, ve druhém nebo třetím může být vyšetření MR provedeno, vždy ale bez podání kontrastní látky (z důvodu přestupu do fetálního oběhu). Po porodu již žádná omezení pro monitoraci MR ani aplikaci kontrastní látky nejsou. Do mateřského mléka se dostává zanedbatelné množství a současná doporučení Evropské společnosti urogenitální radiologie již dřívější pokyn přerušení laktace na 24 h po podání gadoliniové kontrastní látky neudávají [51]. V případě porodu je nutné provést s odstupem do 3 měsíců rebaseline vyšetření MR.
- Bezpečnostní monitorace: Zobrazení v bezpečnostním monitoračním protokolu by mělo probíhat u pacientů s pozitivitou protilátkového indexu viru Johna Cunninghama (JCV) v 3měsíčním intervalu.
- Podání kontrastní látky (obr. 5) – podání kontrastní látky je nutné provést před zahájením léčby v rámci diagnostického protokolu uvedeného výše (s výjimkou pacientů s kontraindikací pro aplikaci gadoliniové kontrastní látky nebo při zcela negativním ložiskovém nálezu), dále pak pouze ve specifických případech dle dohody radiologa a neurologa. Indikovat podání kontrastní látky v rámci monitorace musí neurolog, na žádance je nutné adekvátně zdůvodnit tuto indikaci (např. při plánovaní eskalace léčby či podezření na koincidenci s jiným onemocněním), poté bude MR s kontrastní látkou se souhlasem radiologa provedena, nejsou-li kontraindikace.
- Konzistence – vyšetření MR by optimálně mělo probíhat u jednotlivých pacientů vždy na stejném přístroji s nutností zachování stejného příslušného protokolu a parametrů.
- Management termínů vyšetření – sledování termínů vyšetření je v kompetenci neurologa, žádanku je nutné dodat co nejdříve, aby bylo možné s předstihem rozplánovat kontroly MR.
- Standardizace informací na žádance na MR – pro zefektivnění spolupráce mezi neurologem a radiologem, ale i pro umožnění využívání příslušných standardizovaných protokolů je zásadní uvést na žádanku veškeré potřebné informace. Na každé žádance k vyšetření by mělo zaznít podezření na RS, případně již stanovená diagnóza RS vč. fenotypu, léčba a klinická aktivita. V případě žádosti o bezpečnostní protokol je nutné uvést informaci o vysokém riziku PML + eventuálně přítomnost atypického klinického příznaku.
Image 3. Logistika monitorace MR, rozplánování kontrol. 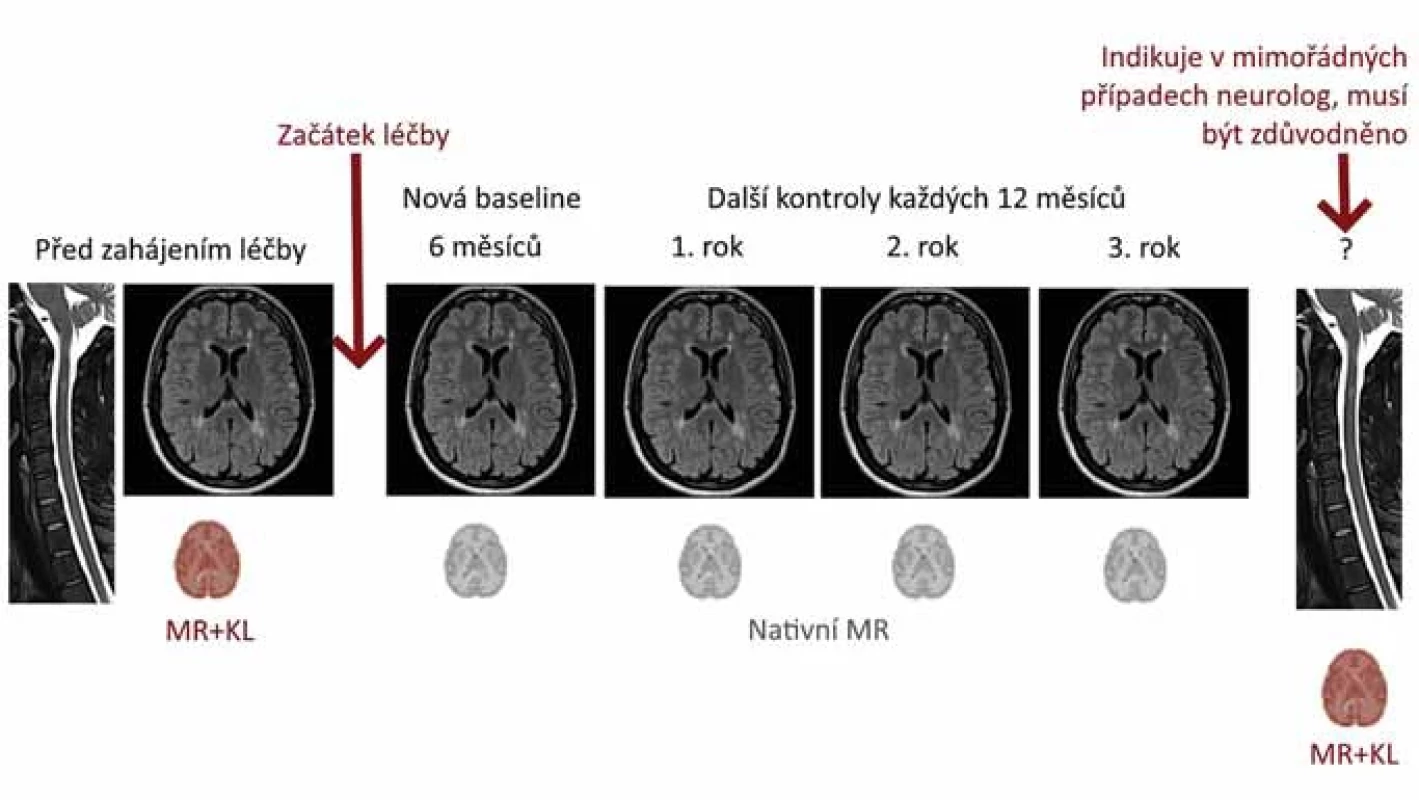
KL – kontrastní látka
Fig. 5. Logistics of MRI monitoring, control scheduling.
KL – contrast agentStandardizace popisu
Posledním, ale neméně významným bodem konsenzu je důležitost a forma standardizovaného popisu MR v rámci jak diagnostického, tak monitoračního protokolu (tab. 3, 4). Standardizace popisů i jejich závěrů je trendem napříč obory i státy. Umožňuje zrychlení práce radiologů i snadnější terapeutické rozhodování neurologů na základně znalosti všech zásadních informací z MR nutných k určení prognózy i vhodné léčby [52,53]. Zásadní je uvedení zejména přítomnosti DIS a diseminace v čase (DIT) a přítomnosti negativních prognostických markerů (větší počet ložisek, přítomnost infratentoriálních, intramedulárních, ale i kortikálních lézí, enhancement, černé díry, míra atrofie). Opomenout nelze (i s ohledem na diagnostická a úhradová kritéria) ani počet nových a zvětšujících se lézí v jednotlivých lokalizacích i celkově (obr. 6). Dostatečné se však zdá být semikvantitativní hodnocení dle schématu: 1, 2, 3, > 3, > 20 reflektující i doporučení MAGNIMS [37]. Pro vyhodnocení monitorace MR je s výhodou použití automatických postprocessingových technik, které zrychlují a unifikují vyhodnocení aktivních ložisek. K dispozici jsou softwary v rámci vyhodnocovacích konzolí výrobců scannerů (např. 3D koregistrovaná fúze se subtrakcí), volně dostupné softwary (např. ITK-SNAP [University of North Carolina, Charlotte, NC, USA]) [54] nebo akademické softwary vyvinuté na jednotlivých pracovištích (obr. 6) [55].
Table 2. Standardní diagnostický popis MR. 
DIS – diseminace v čase; DIT – diseminace v prostoru; HEB – hematoencefalická bariéra; KL – kontrastní látka Table 3. Standardní monitorační popis MR. 
HEB – hematoencefalická bariéra;
KL – kontrastní látkaImage 4. Vyhodnocení aktivních ložisek (nových/ zvětšených; červeně označena) s pomocí automatických softwarů pro jejich detekci (jsou-li k dispozici). 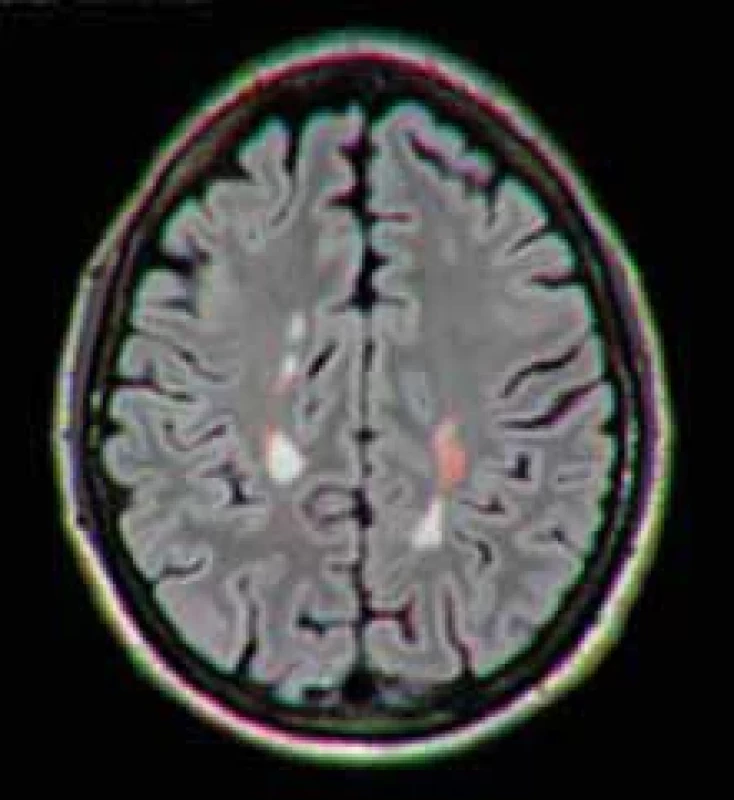
Fig. 6. Evaluation of active foci (new/enlarged; marked in red) with automated detection software (if available). Závěr
U RS došlo zejména v poslední dekádě k významným pokrokům v oblasti pochopení etiopatogeneze i k pokrokům na poli terapeutickém, diagnostickém a monitoračním. Zásadní roli hrála MR. Pro maximální využití této zobrazovací metody ke zlepšení prognózy pacientů je nutná její standardizace na všech úrovních – od správně zvoleného diagnostického a monitoračního protokolu přes sledování na stejném přístroji, dodržování doporučených intervalů vyšetření až k normovaným radiologickým popisům a žádankám. Správná a včasná indikace MR může pomoci k rychlému zahájení terapie i její případné změně a výraznému omezení disability na individuální úrovni napříč všemi RS centry. Zároveň pak normovaná MR data umožní analýzu velkých kohort a pokroky vědy vedoucí k dalšímu zlepšení péče. První kroky k nastolení unifikovaného postupu napříč ČR přináší tento konsenzus českého expertního radiologicko-neurologického panelu podpořený SKNIL. Dalším nezbytným krokem je jeho implementace do běžné klinické praxe.
Grantová podpora
Práce byla podpořena grantem MZ ČR-RVO-VFN64165; výzkumným programem Univerzity Karlovy Cooperatio, neurovědy, a projektem Národního ústavu pro neurologický výzkum (Program EXCELES, ID: LX22NPO5107) – Financováno Evropskou unií – Next Generation EU.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Sources
1. Thompson AJ, Banwell BL, Barkhof F et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17 (2): 162–173. doi: 10.1016/S1474-4422 (17) 30470-2.
2. He A, Merkel B, Brown JWL et al. Timing of high-efficacy therapy for multiple sclerosis: a retrospective observational cohort study. Lancet Neurol 2020; 19 (4): 307–316. doi: 10.1016/S1474-4422 (20) 30067-3.
3. Prosperini L, Mancinelli CR, Solaro CM et al. Induction versus escalation in multiple sclerosis: a 10-year real world study. Neurotherapeutics 2020; 17 (3): 994–1004. doi: 10.1007/S13311-020-00847-0.
4. Harding K, Williams O, Willis M et al. Clinical outcomes of escalation vs early intensive disease-modifying therapy in patients with multiple sclerosis. JAMA Neurol 2019; 76 (5): 536–541. doi: 10.1001/JAMANEUROL.2018.4905.
5. Uher T, Krasensky J, Malpas C et al. Evolution of brain volume loss rates in early stages of multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2021; 8 (3): e979. doi: 10.1212/NXI.0000000000000979.
6. Brown JWL, Coles A, Horakova D et al. Association of initial disease-modifying therapy with later conversion to secondary progressive multiple sclerosis. JAMA 2019; 321 (2): 175–187. doi: 10.1001/JAMA.2018.20588.
7. Hrnciarova T, Drahota J, Spelman T et al. Does initial high efficacy therapy in multiple sclerosis surpass escalation treatment strategy? A comparison of patients with relapsing-remitting multiple sclerosis in the Czech and Swedish national multiple sclerosis registries. Mult Scler Relat Disord 2023; 76 : 104803. doi: 10.1016/J.MSARD.2023.104803.
8. Spelman T, Magyari M, Piehl F et al. Treatment escalation vs immediate initiation of highly effective treatment for patients with relapsing-remitting multiple sclerosis: data from 2 different national strategies. JAMA Neurol 2021; 78 (10): 1197–1204. doi: 10.1001/JAMANEUROL.2021.2738.
9. Šťastná D, Seňavová J, Andělová M et al. Internal comorbidities and complications of multiple sclerosis therapy – don’t be caught off guard! Vnitr Lek 2023; 69 (5): 294–298. doi: 10.36290/vnl.2023.058.
10. Cortese R, Giorgio A, Severa G et al. MRI prognostic factors in multiple sclerosis, neuromyelitis optica spectrum disorder, and myelin oligodendrocyte antibody disease. Front Neurol 2021; 12 : 679881. doi: 10.3389/FNEUR.2021.679881.
11. Tintore M, Rovira À, Río J et al. Defining high, medium and low impact prognostic factors for developing multiple sclerosis. Brain 2015; 138 (Pt 7): 1863–1874. doi: 10.1093/BRAIN/AWV105.
12. Fisniku LK, Brex PA, Altmann DR et al. Disability and T2 MRI lesions: a 20-year follow-up of patients with relapse onset of multiple sclerosis. Brain 2008; 131 (3): 808–817. doi: 10.1093/BRAIN/AWM329.
13. Tintore M, Rovira A, Arrambide G et al. Brainstem lesions in clinically isolated syndromes. Neurology 2010; 75 (21): 1933–1938. doi: 10.1212/WNL.0B013E3181FEB26F.
14. Preziosa P, Rocca MA, Mesaros S et al. Relationship between damage to the cerebellar peduncles and clinical disability in multiple sclerosis. Radiology 2014; 271 (3): 822–830. doi: 10.1148/RADIOL.13132142.
15. Brownlee WJ, Hardy TA, Fazekas F et al. Diagnosis of multiple sclerosis: progress and challenges. Lancet 2017; 389 (10076): 1336–1346. doi: 10.1016/S01 40-6736 (16) 30959-X.
16. Swanton JK, Fernando KT, Dalton CM et al. Early MRI in optic neuritis: the risk for disability. Neurology 2009; 72 (6): 542–550. doi: 10.1212/01.WNL.0000341935.41852.82.
17. Rush CA, Maclean HJ, Freedman MS. Aggressive multiple sclerosis: proposed definition and treatment algorithm. Nat Rev Neurol 2015; 11 (7): 379–389. doi: 10.1038/NRNEUROL.2015.85.
18. Calabrese M, Poretto V, Favaretto A et al. Cortical lesion load associates with progression of disability in multiple sclerosis. Brain 2012; 135 (Pt 10): 2952–2961. doi: 10.1093/BRAIN/AWS246.
19. Kubala Havrdová E, Piťha J. Klinický doporučený postup pro diagnostiku a léčbu roztroušené sklerózy a neuromyelitis optica a onemocnění jejího širšího spektra. [online]. Dostupné z: https: //www.czech-neuro.cz/content/uploads/2020/04/rs_odborna-2.0_final_pub_web-2.pdf.
20. Uher T, Havrdova E, Sobisek L et al. Is no evidence of disease activity an achievable goal in MS patients on intramuscular interferon beta-1a treatment over long-term follow-up? Mult Scler 2017; 23 (2): 242–252. doi: 10.1177/1352458516650525.
21. Montalban X, Gold R, Thompson AJ et al. ECTRIMS/EAN Guideline on the pharmacological treatment of people with multiple sclerosis. Mult Scler 2018; 24 (2): 96–120. doi: 10.1177/1352458517751049.
22. Tsantes E, Curti E, Collura F et al. Five - and seven-year prognostic value of new effectiveness measures (NEDA, MEDA and six-month delayed NEDA) in relapsing-remitting multiple sclerosis. J Neurol Sci 2020; 414 : 116827. doi: 10.1016/J.JNS.2020.116827.
23. Tur C, Carbonell-Mirabent P, Cobo-Calvo Á et al. Association of early progression independent of relapse activity with long-term disability after a first demyelinating event in multiple sclerosis. JAMA Neurol 2023; 80 (2): 151–160. doi: 10.1001/JAMANEUROL.2022.4655.
24. Šťastná D, Menkyová I, Horáková D. Progresivní roztroušená skleróza ve světle nejnovějších poznatků. Cesk Slov Neurol N 2023; 86/119 (1): 10–17. doi: 10.48095/cccsnn202310.
25. Giovannoni G, Popescu V, Wuerfel J et al. Smouldering multiple sclerosis: the „real MS“. Ther Adv Neurol Disord 2022; 15 : 17562864211066751. doi: 10.1177/1756286 4211066751.
26. Macaron G, Ontaneda D. Diagnosis and management of progressive multiple sclerosis. Biomedicines 2019; 7 (3): 56. doi: 10.3390/BIOMEDICINES7030056.
27. Elliott C, Rudko DA, Arnold DL et al. Lesion-level correspondence and longitudinal properties of paramagnetic rim and slowly expanding lesions in multiple sclerosis. Mult Scler 2023; 29 (6): 680–690. doi: 10.1177/13524585231162262.
28. Contentti EC, Correale J. Current perspectives: evidence to date on BTK inhibitors in the management of multiple sclerosis. Drug Des Devel Ther 2022; 16 : 3473–3490. doi: 10.2147/DDDT.S348129.
29. Kaul M, End P, Cabanski M et al. Remibrutinib (LOU064): a selective potent oral BTK inhibitor with promising clinical safety and pharmacodynamics in a randomized phase I trial. Clin Transl Sci 2021; 14 (5): 1756–1768. doi: 10.1111/CTS.13005.
30. Dolgin E. BTK blockers make headway in multiple sclerosis. Nat Biotechnol 2021; 39 (1): 3–5. doi: 10.1038/S41587-020-00790-7.
31. Bhargava P, Kim S, Reyes AA et al. Imaging meningeal inflammation in CNS autoimmunity identifies a therapeutic role for BTK inhibition. Brain 2021; 144 (5): 1396–1408. doi: 10.1093/BRAIN/AWAB045.
32. Krämer J, Bar-Or A, Turner TJ et al. Bruton tyrosine kinase inhibitors for multiple sclerosis. Nat Rev Neurol 2023; 19 (5): 289–304. doi: 10.1038/S41582-023-00800-7.
33. Montalban X, Arnold DL, Weber MS et al. Placebo-controlled trial of an oral BTK inhibitor in multiple sclerosis. N Engl J Med 2019; 380 (25): 2406–2417. doi: 10.1056/NEJMoa1901981.
34. Reich DS, Arnold DL, Vermersch P et al. Safety and efficacy of tolebrutinib, an oral brain-penetrant BTK inhibitor, in relapsing multiple sclerosis: a phase 2b, randomised, double-blind, placebo-controlled trial. Lancet Neurol 2021; 20 (9): 729–738. doi: 10.1016/S1474-4422 (21) 00237-4.
35. Pandit L. No evidence of disease activity (NEDA) in multiple sclerosis – shifting the goal posts. Ann Indian Acad Neurol 2019; 22 (3): 261–263. doi: 10.4103/AIAN.AIAN_159_19.
36. Stastna D, Drahota J, Lauer M et al. The Czech Na - tional MS Registry (ReMuS): data trends in multiple sclerosis patients whose first disease-modifying therapies were initiated from 2013 to 2021. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2023. doi: 10.5507/BP.2023.015.
37. Wattjes MP, Ciccarelli O, Reich DS et al. 2021 MAGNIMS-CMSC-NAIMS consensus recommendations on the use of MRI in patients with multiple sclerosis. Lancet Neurol 2021; 20 (8): 653–670. doi: 10.1016/S1474-4422 (21) 00095-8.
38. Vaněčková M, Adámek D, Horáková D. Vyšetřo-vací MR protokoly pro diagnostiku a monitoraci aktivity u onemocnění roztroušené sklerózy. Neurol Praxi 2022; 23 (Suppl CH): 3–14.
39. Vaněčková M, Horáková D. Současná doporučení pro využití MR u onemocnění roztroušené sklerózy v klinické praxi. Neurol Praxi 2023; 24 (4): 300–308.
40. Eisele P, Szabo K, Griebe M et al. Reduced diffusion in a subset of acute MS lesions: a serial multiparametric MRI study. AJNR Am J Neuroradiol 2012; 33 (7): 1369–1373. doi: 10.3174/AJNR.A2975.
41. Maggi P, Absinta M, Grammatico M et al. Central vein sign differentiates multiple sclerosis from central nervous system inflammatory vasculopathies. Ann Neurol 2018; 83 (2): 283–294. doi: 10.1002/ANA.25146.
42. Clarke MA, Samaraweera APR, Falah Y et al. Single Test to ARrive at Multiple Sclerosis (STAR-MS) diagnosis: a prospective pilot study assessing the accuracy of the central vein sign in predicting multiple sclerosis in cases of diagnostic uncertainty. Mult Scler 2020; 26 (4): 433–441. doi: 10.1177/1352458519 882282.
43. Sinnecker T, Clarke MA, Meier D et al. Evaluation of the central vein sign as a diagnostic imaging biomarker in multiple sclerosis. JAMA Neurol 2019; 76 (12): 1446–1456. doi: 10.1001/JAMANEUROL.2019.2478.
44. Mistry N, Dixon J, Tallantyre E et al. Central veins in brain lesions visualized with high-field magnetic resonance imaging: a pathologically specific diagnostic biomarker for inflammatory demyelination in the brain. JAMA Neurol 2013; 70 (5): 623–628. doi: 10.1001/JAMANEUROL.2013.1405.
45. Maggi P, Sati P, Nair G et al. Paramagnetic rim lesions are specific to multiple sclerosis: an international multicenter 3T MRI study. Ann Neurol 2020; 88 (5): 1034–1042. doi: 10.1002/ANA.25877.
46. Harrison DM, Li X, Liu H et al. Lesion heterogeneity on high-field susceptibility MRI is associated with multiple sclerosis severity. AJNR Am J Neuroradiol 2016; 37 (8): 1447. doi: 10.3174/AJNR.A4726.
47. Absinta M, Sati P, Masuzzo F et al. Association of chronic active multiple sclerosis lesions with disability in vivo. JAMA Neurol 2019; 76 (12): 1474–1483. doi: 10.1001/JAMANEUROL.2019.2399.
48. Absinta M, Sati P, Schindler M et al. Persistent 7-tesla phase rim predicts poor outcome in new multiple sclerosis patient lesions. J Clin Invest 2016; 126 (7): 2597–2609. doi: 10.1172/JCI86198.
49. Suthiphosuwan S, Sati P, Guenette M et al. The central vein sign in radiologically isolated syndrome. AJNR Am J Neuroradiol 2019; 40 (5): 776–783. doi: 10.3174/AJNR.A6045.
50. Tomassini V, Sinclair A, Sawlani V et al. Diagnosis and management of multiple sclerosis: MRI in clinical practice. J Neurol 2020; 267 (10): 2917–2925. doi: 10.1007/S00415-020-09930-0.
51. European Society of Urogenital Radiology. ESUR guidelines on contrast agents. [online]. Dostupné z: https: //www.esur.org/esur-guidelines-on-contrast-agents/.
52. Alessandrino F, Pichiecchio A, Mallucci G et al. Do MRI structured reports for multiple sclerosis contain adequate information for clinical decision making? AJR Am J Roentgenol 2018; 210 (1): 24–29. doi: 10.2214/AJR.17.18451.
53. Lee JK, Bermel R, Bullen J et al. Structured reporting in multiple sclerosis reduces interpretation time. Acad Radiol 2021; 28 (12): 1733–1738. doi: 10.1016/ J.ACRA.2020.08.006.
54. Eichinger P, Schön S, Pongratz V et al. Accuracy of unenhanced MRI in the detection of new brain lesions in multiple sclerosis. Radiology 2019; 291 (2): 429–435. doi: 10.1148/radiol.2019181568.
55. Vaněčková M, Seidl Z, Krásenský J et al. Naše zkušenosti s MR monitorací pacientů s roztroušenou sklerózou v klinické praxi. Cesk Slov Neurol N 2010; 73/106 (6): 716–720.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2024 Issue 1-
All articles in this issue
- Low-pressure hydrocephalus
- Tonsilla cerebelli – anatomy, function and its significance for neurosurgery
- Editorial
- Use of artificial intelligence in CT image evaluation in stroke patients – current options
- Adaptation and validation of the Czech version of the Addenbrooke‘s Cognitive Examination (ACE-III-CZ) – pilot study
- Retrospective evaluation and one year monitoring of 58 patients according to neural tube defect etiology
- Relation between residual tumor volume after surgery and overall survival in patients with glioblastoma – a single neuro-oncology center study
- Poděkování recenzentům
- The beginnings of cerebral angiography in the world and in Czechoslovakia
- Ischemia of corpus callosum
- Standardization of MRI in Multiple Sclerosis Management Consensus by the Czech Expert Radiology-Neurology Panel
- Zpráva o 36. českém a slovenském neurologickém sjezdu
- Zpráva ze světového neurochirurgického kongresu 2023
- Diffuse glioma overview based on the 2021 WHO classifi cation part 2 – pediatric type
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diffuse glioma overview based on the 2021 WHO classifi cation part 2 – pediatric type
- Tonsilla cerebelli – anatomy, function and its significance for neurosurgery
- Standardization of MRI in Multiple Sclerosis Management Consensus by the Czech Expert Radiology-Neurology Panel
- Adaptation and validation of the Czech version of the Addenbrooke‘s Cognitive Examination (ACE-III-CZ) – pilot study
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

