-
Medical journals
- Career
Stiff -person syndrom
Authors: P. Potužník; J. Vejskal; R. Kotas
Authors‘ workplace: Neurologická klinika LF UK a FN Plzeň
Published in: Cesk Slov Neurol N 2021; 84(6): 581-582
Category: Letters to Editor
doi: https://doi.org/10.48095/cccsnn2021581Vážená redakce,
stiff-person syndrom je vzácné autoimunitní onemocnění projevující se progresivní svalovou ztuhlostí, rigiditou a křečemi axiálního svalstva. Dochází k trvalé svalové kontrakci agonistů a antagonistů.
Klinicky dominují tzv. Frankensteinova chůze, zvýrazněná bederní lordóza, pády a ataky křečí, akcentované úlekem (resp. různými stimuly [1], hlavně sluchovými). Běžná je také dyspnoe, vyskytuje se v klidu i při námaze a narušuje spánek. Je způsobena restrikcí pohybů mezižeberních svalů [2]. Při křečích může dojít ke svalové ruptuře a dále mohou být přítomny autonomní poruchy. Sekundárně se vyskytují anxieta a deprese.
Diagnostika se zakládá na typickém klinickém obraze podpořeném EMG nálezem, vč. vyloučení jiné etiologie onemocnění [3], a průkazu protilátek anti-GAD65 (protilátky proti dekarboxyláze kyseliny glutamové). Vzhledem k časté paraneoplastické etiologii se doplňuje PET/CT trupu a stanovují se protilátky anti-Amphiphysin, jež bývají asociovány s malobuněčným karcinomem plic a karcinomem prsu u žen [4].
Patofyziologický vliv protilátek anti-GAD65 je stále nejasný, působí na intracelulární antigen. Jedna z teorií na úrovni CNS považuje za hlavní ovlivnění inhibičních interneuronů na úrovni míšního segmentu, kdy kvůli poruše dekarboxylázy kyseliny glutamové dochází k nedostatku kyseliny g-aminomáselné (g-aminobutyric acid; GABA), což vede ke zvýšené excitabilitě míšních motoneuronů, jejich zvýšenému pálení a kontinuální svalové aktivitě [5]. Druhá teorie zvažuje působení na neuromuskulární ploténce, kde narušením degradace acetylcholinu protilátkami proti dekarboxyláze kyseliny glutamové dojde k neschopnosti svalové relaxace [6].
Protilátky anti-GAD65 se kromě stiff-person syndromu mohou vyskytovat u cerebelární ataxie, temporální epilepsie, limbických encefalitid a diabetu mellitu 1. typu [7].
V naší kazuistice popisujeme případ pacienta, ročník narození 1948. Jedná se o hypertonika, po revmatické horečce v dětství s chlopenní vadou, který přechodně v mládí kouřil (mezi 20.–25. rokem).
První potíže začaly v létě 2019 bolestmi v lumbosakrální oblasti, kdy užíval analgetika s dobrým efektem. V listopadu 2019 upadl a zlomil si 8. a 9. žebro vpravo, tyto si opět zlomil o měsíc později. Na přelomu let 2019 a 2020 prodělal „těžkou virózu“, měsíc měl bolesti celého těla, potil se, byl slabý a schvácený. Od konce roku 2019 měl dále parestézie obou stehen po zevních stranách ke kolenům a začaly se objevovat nejprve klonické a později tonické ataky spasmů stehenních svalů. Provedená CT lumbosakrální páteře ozřejmila absolutní stenózu páteřního kanálu L3–S1. EMG prokázala axonální senzitivní polyneuropatii, bez denervačních projevů v myotomech L3–4 oboustranně, v klidu s nedokonalou relaxací. Pacient byl celý ztuhlý od krku distálně. Od dubna 2020 vymizely klonické křeče a přetrvává pouze ztuhlost, která se zlepšila po klonazepamu a tramadolu. Doplněná MR hrudní páteře prokázala degenerativní změny, skoliózu a lokální rozšíření centrálního míšního kanálku v úseku Th 7–8 (obr. 1).
Image 1. MR hrudní páteře – T2 TIRM vážený obraz: rozšíření centrálního míšního kanálku v segmentech Th 7–8.
TIRM – turbo inversion recovery magnitude
Fig. 1. MRI of thoracic spine T2 – TIRM weighted image: widening of the central spinal canal in the segments Th 7–8.
TIRM – turbo inversion recovery magnitude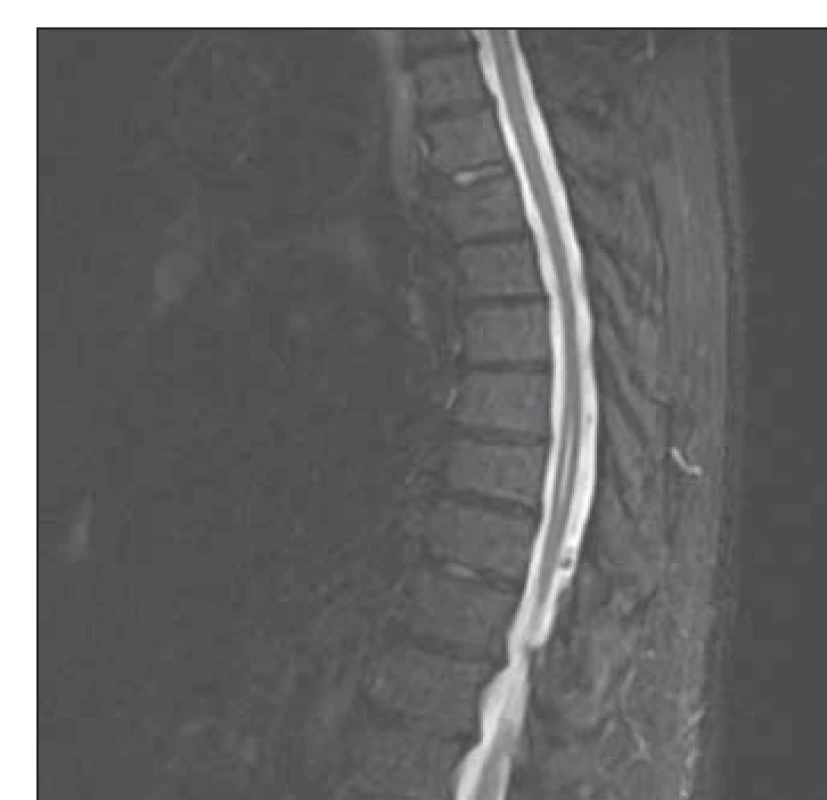
Při prvním vyšetření na naší klinice v květnu 2020 dominovalo váznutí šíje ve všech směrech, hlavně při inklinaci vlevo, svalový tonus na dolních končetinách byl výrazně zvýšený, na horních jen velmi lehce, pyramidové spastické jevy negativní a chůze toporná. Svalová síla byla normální, šlachookosticové reflexy povšechně zvýšené a byly přítomny i reflexy břišní. Udával dysestézie a algické hypestézie v dermatomech L3 oboustranně.
Vyšetření MR krční páteře prokázalo degenerativní změny s absolutní stenózou páteřního kanálu C3/4 a vícečetnou foraminostenózu, bez míšních ložisek. Motorické evokované potenciály byly s normálním nálezem, senzitivní s periferní lézí všech končetin (odpovídající diagnostikované senzitivní polyneuropatii) a lehkou supraspinální lézí oboustranně. MR mozku ozřejmila pouze mikrovaskulární léze starého data s gliózou hemisferálně i ojediněle v mozečku.
Vzhledem k axonální polyneuropatii byla doplněna širší laboratoř, jež prokázala zvýšené sérové koncentrace imunoglobulinu (Ig) E (158 kUI/l), eosinofilního kationického proteinu (50,4 μg/l) a revmatoidního faktoru (IgM 19,52 kUI/l a IgA 163,21 kUI/l), dále byly lehce zvýšeny hladiny C4 komplementu, ANA (antinuclear antibodies) a ANCA (anti-neutrophil cytoplasmic antibody) a středně zvýšena sedimentace erytrocytů (FW) (34/62). Glykémie a hormony štítné žlázy byly v normě.
V té době jsme stav vyhodnotili jako hydromyelii Th7–8 dekompenzovanou po opakované fraktuře 8. a 9. žebra v roce 2019. Pro senzitivní axonální polyneuropatii, suspektní při autoimunitním onemocnění, jsme pacienta přeložili k dovyšetření na revmatologii, kde toto ale neprokázali.
Pacientovy potíže však dále progredovaly, v srpnu 2020 mu při křeči praskl kvadriceps femoris vpravo, od října opakovaně padal, způsobil si několikrát lehké mozkové poranění, a začal proto chodit o holi. Od listopadu byl schopen chůze pouze v chodítku, křeče jej budily ze spaní, zmírňovaly je klonazepam a baklofen. Při delším ležení pociťoval neklid a bolesti trupu, raději spal vsedě. Výrazné potíže mu činilo posazení z lehu pro omezenou hybnost břišních svalů. Objektivně v prosinci 2020 výrazně vázla šíje při spazmu axiálního svalstva, na horních končetinách byl hraničně vyšší tonus. Dominovala těžká hypertonie břišního svalstva, břišní reflexy byly nevýbavné, pro omezenou hybnost břišního svalstva výrazně vázlo posazení z lehu, vertikalizace ze sedu byla relativně lepší, ale při obojím se rozvíjela dyspnoe, paravertebrální svaly byly také výrazně hypertonické. Na dolních končetinách byl přítomen výrazně zvýšený tonus, více vpravo, který limitoval hybnost. Chůze byla toporná, pouze v chodítku.
EMG nález kvůli trvalé aktivitě motorických jednotek, která odezněla po podání diazepamu, vč. vyšší perzistence F-vln, podporuje diagnózu stiff-person syndromu. Doplněná PET/CT trupu neprokazuje fluorodeoxyglukózu akumulující viabilní tkáň. Likvor je cytobiochemicky bez patologického nálezu, ale je přítomna oligoklonální syntéza (18 pásů bez sérového korelátu – 6 v silně alkalické, 5 ve slabě alkalické, 5 v neutrální a 2 v kyselé oblasti). Protilátky anti-GAD65 jsou silně pozitivní v séru (semikvantitativně +, kvantitativně nad horní hranicí normy laboratoře – nad 280 kIU/l) i likvoru (+++), což prokazuje intrathékální syntézu. Dále jsou silně pozitivní protilátky anti-Titin (protilátky proti intracelulárnímu svalovému proteinu – asociované s myastenií gravis a v 50 % s tymomem), anti-Amphiphysin protilátky jsou negativní.
Vzhledem ke klinickému nálezu podpořenému pomocnými metodami diagnóza odpovídá stiff-person syndromu autoimunitní neparaneoplastické etiologie.
Pacienta od prosince 2020 léčíme vysokými dávkami kortikosteroidních hormonů (zpočátku 5x1 g metylprednisolonu, následně prednison dle hmotnosti) a intravenózními imunoglobuliny (zpočátku 2 g/kg, nyní 0,6 g/kg à měsíc), symptomaticky baklofenem a klonazepamem s velmi dobrým efektem. Tonus se výrazně snížil, pacient již chodí bez pomůcek a lépe se posadí. Nežádoucím účinkem léčby je rozvoj steroidního diabetu, resp. diabetu mellitu 2. typu, nyní léčeného perorálními antidiabetiky.
V prosinci 2021 plánujeme provést kontrolní PET/CT trupu.
V léčbě pacientů se stiff-person syndromem lze symptomaticky při přetrvávání příznaků přidat levetiracetam, pregabalin a intrathékální baklofen [8]. V rámci udržovací terapie i kortikosteroidy šetřící imunosupresiva (metotrexát, mykofenolát mofetil, azathioprin – přechodně podáván, ale vysazen pro mutaci TPMT). V imunomodulační léčbě je možné použít i výměnné plazmaferézy, v druhé linii rituximab a takrolimus [8].
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.MUDr. Pavel Potužník
Neurologická klinika
LF UK a FN Plzeň
E. Beneše 1128
301 00 Plzeň
e-mail: potuznikp@fnplzen.czPřijato k recenzi: 4. 10. 2021
Přijato do tisku: 9. 11. 2021
Sources
1. Matsui N, Tanaka K, Kaji R. Stiff-Person syndrome and related autoantibodies. Brain Nerve 2018; 70 (4): 357–362. doi: 10.11477/mf.1416201008.
2. Sexauer W, Woodford M, Pack K et al. Dyspnea in patients with Stiff-Person syndrome. Am J Med Sci 2019; 358 (4): 268–272. doi: 10.1016/j.amjms.2019.07.007.
3. Li Y, Thakore N. An appraisal of electrodiagnostic studies in Stiff-Person syndrome. J Clin Neuromuscul Dis 2020; 22 (2): 84–89. doi: 10.1097/CND.0000000000000302.
4. Folli F, Solimena M, Cofiell R et al. Autoantibodies to a 128-kd synaptic protein in three women with the stiff-man syndrome and breast cancer. N Engl J Med 1993; 328 (8): 546–551. doi: 10.1056/NEJM199302253280 805.
5. Rakocevic G, Floeter MK. Autoimmune stiff person syndrome and related myelopathies: understanding of electrophysiological and immunological processes. Muscle Nerve 2012; 45 (5): 623–634. doi: 10.1002/mus.23234.
6. Chapel H, Haeney M, Mishab S et al. Základy klinické imunologie. 6. vyd. Praha: Triton 2018.
7. Muñoz-Lopetegi A, de Bruijn MA, Boukhrissi S et al. Neurologic syndromes related to anti-GAD65: Clinical and serologic response to treatment. Neurol Neuroimmunol Neuroinflamm 2020; 7 (3): e696. doi: 10.1212/NXI.0000000000000696.
8. Ortiz JF, Ghani MR, Morillo Cox Á et al. Stiff-Person syndrome: a treatment update and new directions. cureus 2020; 12 (12): e11995. doi: 10.7759/cureus.11995.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2021 Issue 6-
All articles in this issue
- Normotenzní hydrocefalus
- Synukleinopatie a jejich laboratorní biomarkery
- Klinicko-radiologický paradox u roztroušené sklerózy – význam vyšetření míchy
- Perorální kladribin v léčbě roztroušené sklerózy – data z celostátního registru ReMuS®
- Protein S 100B a jeho prognostické možnosti u kraniocerebrálních traumat
- Nodo-paranodopatie s protilátkami IgG4 proti neurofascinu-155
- Stiff -person syndrom
- Bilaterální paréza hlasivek v rámci recidivujících ischemických cévních mozkových příhod
- Guillain-Barrého syndrom u pacienta s COVID-19
- Obstrukční spánková apnoe u revmatoidního postižení subaxiální krční páteře
- Interpretace plazmatických hladin fenytoinu a valproátu při enterálním podávání u hypoalbuminemické pacientky
- Informace vedoucího redaktora
- Diferenciální diagnostika glioblastomu a solitárních metastáz mozku – úspěch modelů umělé inteligence vytvořených na základě radiomických dat získaných automatickou segmentací z konvenčních MR sekvencí
- Zobrazení průtoku mozkomíšního moku jednou sekvencí – variable flip angle turbo spin echo
- Aseptická meningitida při akutní hepatitidě E – zkušenosti z jednoho centra
- Rozsáhlé mnohočetné intraneurální gangliony peroneálního nervu
- Syndrom spinální sulkální arterie po stentem asistované embolizaci neprasklého aneuryzmatu vertebrální tepny embolizačním koilem
- Trombóza horní orbitální žíly
- Testy ALBA a POBAV použité k současnému vyšetření dvou pacientů s demencí a jejich dospělých dětí
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stiff -person syndrom
- Normotenzní hydrocefalus
- Synukleinopatie a jejich laboratorní biomarkery
- Perorální kladribin v léčbě roztroušené sklerózy – data z celostátního registru ReMuS®
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

