-
Medical journals
- Career
Intradurálne extramedulárne nádory chrbtice
Authors: P. Moják 1; M. Filip 2,3; P. Linzer 1; P. Jurek 1; M. Mitaľ 1; A. Švehlák 1; K. Trenzová 1
Authors‘ workplace: Neurochirurgické oddělení, Krajská nemocnice T. Bati, a. s., Zlín 1; Ústav rehabilitace, LF OU, Ostrava 2; Neurochirugická klinika LF UK, SZU a UN Bratislava 3
Published in: Cesk Slov Neurol N 2019; 82(2): 125-140
Category: Minimonography
doi: https://doi.org/10.14735/amcsnn2019125Overview
Intradurálne extramedulárne nádory predstavujú pomerne malú skupinu spomedzi všetkých nádorov CNS. V tejto práci sú popísané ich najčastejšie typy, etiológia, makroskopická a histologická charakteristika, klinické prejavy, diagnostika a liečba. Popisuje klinické výsledky pri jednotlivých operačných postupoch a ich vplyv na stabilitu chrbtice, radikalitu resekcie a výsledný neurologický stav pacienta. Rozoberá dôležitosť predoperačnej prípravy, plánovania, polohy pacienta počas operácie, perioperačnej medikamentóznej liečby a využitia možností prístrojového vybavenia. Hodnotí ich vplyv na pooperačný priebeh, možné komplikácie a celkovú prognózu pacienta. Tieto aspekty práca hodnotí predovšetkým pri najčastejších typoch intradurálnych extramedulárnych nádorov a to pri nádoroch nervových obalov a meningeóme. Stručne sú popísané aj menej časté nádory. V diskusii a závere práce sú zhrnuté jednoduché a stručné odporúčania týkajúce sa diagnostiky a liečby intradurálnych extramedulárnych nádorov, ktoré sú zamerané na zlepšenie efektu liečby a minimalizovanie rizika vzniku komplikácií v súlade s odbornou literaturou.
Klíčová slova:
intradurálny extramedulárny nádor – schwanóm – meningeóm – diagnostika – operačná liečba
Úvod
Nádory chrbtice, resp. spinálne tumory sú všetky nádory, ktoré svojou lokalizáciou zasahujú do štruktúr chrbtice, miechových obalov alebo miechy. Sú to všetky nádory lokalizované od foramen magnum po kostrč. Keďže v tejto oblasti sa tesne vedľa seba nachádzajú štruktúry periférneho aj CNS, kostné tkanivo, mäkké tkanivá, lymfoidné elementy, mediastinálne a retroperitoneálne štruktúry, vyskytuje sa v nej veľké množstvo primárnych aj sekundárnych nádorov rôznych typov. Často predstavujú zložitý diagnostický problém, nakoľko vyžadujú nielen podrobné anatomické znalosti chrbtice a miechy, ale i schopnosť precízneho neurologického vyšetrenia s náročnou diferenciálnou diagnostikou, ktorá musí zohľadňovať prakticky každú patológiu, ktorá sa môže vyskytovať v tejto oblasti [1,2].
Z anatomického hľadiska, vzhľadom k vzťahu k tvrdej plene (dura mater), sa nádory chrbtice rozdeľujú na:
- intradurálne nádory;
- extradurálne nádory.
Intradurálne nádory sa vzhľadom k vzťahu k mieche ďalej rozdeľujú na:
- intradurálne intramedulárne (IDIM) nádory;
- intradurálne extramedulárne (IDEM) nádory.
V odbornej literatúre je uvádzaný výskyt extradurálnych a intradurálnych nádorov v rôznych pomeroch. Udávané hodnoty sa pohybujú od 80 : 20 % (extradurálne vs. intradurálne nádory), až po 50 : 50 % [3–5]. Približne 1/3 z intradurálnych nádorov tvoria IDIM nádory a 2/3 tvoria IDEM nádory [1,2,6]. Až 75 % IDEM nádorov tvoria meningeómy spolu so schwanómami a až 60 % IDIM nádorov tvoria ependymómy spolu s astrocytómami. Pomer IDEM a IDIM nádorov je uvádzaný od 84 : 16 % až po 60 : 40 % [3,4,7–13].
Intradurálne extramedulárne nádory sú prevažne nezhubné, dobre ohraničené a často opúzdrené. Vzhľadom k tomu je šanca na ich úplné odstránenie vysoká. Chirurgická resekcia je preto pri IDEM nádoroch metóda voľby.
História operačnej liečby
V roku 1887 uskutočnil prvú resekciu spinálneho tumoru britský neurochirurg Victor Horsley (1857–1916) (obr. 1), ktorý prispel k založeniu a rozvoju neurochirurgie ako samostatného chirurgického odboru [14,15].
Obr. 1. Sir Victor A. H. Horsley [121]. Fig. 1. Sir Victor A. H. Horsley [121]. ![Obr. 1. Sir Victor A. H. Horsley [121].
Fig. 1. Sir Victor A. H. Horsley [121].](https://pl-master.mdcdn.cz/media/image_pdf/3e0da539bb5c7392ed072d613e9dd551.jpeg?version=1555325655)
V roku 1919 uverejnil Alfred W. Adson (1887–1951) (obr. 2), zakladateľ neurochirurgického oddelenia na Mayo Clinic, Rochester (Minnesota, USA), prvý ucelený súbor 16 pacientov s nádorom chrbtice, ktorí podstúpili chirurgickú liečbu. Do roku 1924 sa tento súbor rozrástol na 151 pacientov.
Obr. 2. Alfred W Adson [16]. Fig. 2. Alfred W Adson [16]. ![Obr. 2. Alfred W Adson [16].
Fig. 2. Alfred W Adson [16].](https://pl-master.mdcdn.cz/media/image_pdf/29055d5b67f85d9d6fcb654ad3fd5f1c.jpeg?version=1555325711)
V roku 1917 Adson diagnostikoval a operačne liečil pacienta s meningeómom hrudnej chrbtice s príznakmi Brown-Séquardovho syndrómu. Rozvinul algoritmus trojokruhovej symptomatológie spinálnych nádorov, podľa ktorej sa všetky spinálne tumory rastúce z nervových koreňov, ciev alebo meningov prejavujú bolesťou, následne príznakmi kompresie miechy a nakoniec poruchou funkcie miechy pod úrovňou lézie. Bol zástancom unilaterálnej laminektómie (hemilaminektómie) pri nádoroch cervikálnej oblasti ako prevencie instability krčnej chrbtice. Pri veľkých neurofibrómoch v tvare presýpacích hodín v hrudnej oblasti bol zástancom kombinovaného prístupu (laminektómie kombinovanej s torakotómiou).
Adson popísal a aplikoval viacero techník na zlepšenie výsledku operácie. V rokoch 1916–1925 publikoval 19 monografií venovaných problematike spinálneho kanála a spinálnych tumorov [16].
Epidemiológia
Incidencia IDEM nádorov je 0,3–0,45 prípadov na 100 000 obyvateľov za rok. Neurochirurg sa s diagnózou IDEM nádoru stretne priemerne 1–2× za rok, neurológ v priemere 1× za 5–6 rokov a praktický lekár v priemere 1× počas celej svojej praxe.
Pri IDEM nádoroch, s výnimkou IDEM meningeómov, nie sú pozorované výrazné rozdiely výskytu medzi pohlaviami. Je zaznamenaná mierna prevaha mužského pohlavia 54–57 % [5]. Pri meningeómoch sa približne 80 % nádorov vyskytuje u žien.
Medián veku u pacientov s IDEM nádormi je 46 rokov. Sú pozorované výrazné vekové rozdiely v závislosti od histologického typu nádoru. Vrcholy výskytu IDEM nádorov sú zaznamenané okolo 40. a okolo 75. roku života. Prvý vrchol súvisí so zvýšeným výskytom schwanómov, druhý so zvýšeným výskytom meningeómov. Až 90 % pacientov s IDEM nádormi je starších ako 20 rokov [5].
Lokalizácia
Výskyt nádorov v jednotlivých výškových úrovniach chrbtice je rovnako závislý od histologického typu nádoru. Najčastejší výskyt IDEM nádorov je však zaznamenaný v poradí hrudná chrbtica > krčná chrbtica > drieková chrbtica (56 > 22 > 22 %) [3–5,7–13,17–21].
I keď sú IDEM nádory uložené vo vnútri tvrdej pleny, môžu vykazovať aj kombinovaný, intra - extradurálny rast. Tento rast je typický pre nádory nervových obalov (nerve sheath tumour; NST), ale menej často sa s ním môžeme stretnúť aj pri iných typoch IDEM nádorov. Vzhľadom k anatomickým pomerom chrbtice tieto nádory rastú väčšinou cez neuroforamen paravertebrálne, kde je spravidla uložená väčšia časť nádoru. Tvar takéhoto nádoru pripomína presýpacie hodiny (obr. 3). Nádory typu presýpacích hodín tvoria 18 % IDEM nádorov, približne 69 % z nich sú schwanómy, 12 % neurofibrómy a 5 % meningeómy [5].
Obr. 3 A, B. Gigantický schwanóm Th 1 s maximom v hrudnej dutine, MR vyšetrenie: A Axiálny rez v T1W sekvencii s podaním kontrastnej látky; B. frontálny rez v T1W sekvencii s podaním kontrastnej látky. Viditeľné je rozšírenie foramen intervertebrale vpravo spôsobené rastom tumoru.
Fig. 3 A, B. Giant schwannoma at Th 1 peaking in the thoracic region, MR image A. post-contrast axial T1W sequence; B. post-contrast coronal T1W sequence. Intervertebral foramina is significatly enlarged due to the growth of the tumor.
Diagnostika
Diagnostickou metódou voľby pri všetkých IDEM tumoroch je vyšetrenie MR. Ostatné vyšetrovacie metódy buď predchádzajú MR alebo slúžia na jej doplnenie.
Iba pri absolútnej kontraindikácii MR je postačujúce vyšetrenie CT, prípadne doplnenej o myelografiu. Natívne RTG snímky v bočnej, predo-zadnej a dynamických projekciách sú nápomocné na verifikovanie anatomických pomerov v danej oblasti chrbtice. Môžu verifikovať prípadnú predoperačnú instabilitu a umožnia v prípade potreby modifikovať operačný postup.
Na natívnych RTG snímkach sú v niektorých prípadoch viditeľné zmeny, ktoré môžu vyvolať podozrenie, že sa jedná o IDEM nádor (uzurácia kosti, nápadné rozšírenie foramen intervertebrale a pod.). Vyšetrenie CT slúži predovšetkým na zobrazenie anatómie kostných štruktúr, často však pri diagnostike predchádza vyšetreniu MR.
Jednotlivé histologické typy IDEM nádorov môžu na zobrazovacích vyšetreniach vykazovať určité charakteristické znaky (napr. kalcifikácia, prítomnosť cýst, krvácanie a pod.).
Histologická klasifikácia
Medzi IDEM nádory patria NST, meningeóm, myxopapilárny ependymóm (ependymóm filum terminale), paraganglióm filum terminale, hemangiopericytóm, melanocytové nádory, mezenchymálny chondrosarkóm, metastatické tumory a niektoré vzácne typy tumorov (teratómy, dermoidy, lipómy).
Nádory nervových obalov sa delia na schwanómy a neurofibrómy. Neurofibróm častejšie vyrastá z ventrálneho motorického nervového koreňa a často je asociovaný s neurofibromatózou 1. typu. Schwanóm vyrastá väčšinou z dorzálneho senzorického nervového koreňa a vyskytuje sa prevažne solitárne. Mnohopočetný výskyt schwanómu je väčšinou asociovaný s neurofibromatózou 2. typu [4,7–13,18,19]. Schwanóm je zložený výlučne zo Schwannových buniek. Malígna transformácia je veľmi zriedkavá. Neurofibróm je tvorený zmesou Schwannových buniek, perineurálnych buniek a fibroblastov. Spinálny neurofibróm je mimo neurofibromatózy 1. typu extrémne zriedkavý [2].
Zaujímavosťou je zaradenie ependymómov filum terminale medzi IDEM nádory. Napriek tomu, že ependymómy sú z dôvodu neuroektodermálneho pôvodu filum terminale klasifikované ako intramedulárne lézie, v oblasti filum terminale je ich rast z chirurgického hľadiska extramedulárny. Aj možnosti liečby a prognóza je podobná ako u ostatných IDEM nádorov [3].
Najčastejšími IDEM nádormi sú NST a meningeómy. Schwanómy s meningeómami spolu tvoria až 80 % IDEM nádorov. Zriedkavejšie sú ependymómy filum terminale. Ostatné typy IDEM nádorov sa vyskytujú raritne [4,7–13,17–19].
Až 90 % IDEM nádorov je nezhubných, a teda potenciálne radikálne resekovateľných [4,7–13,18–19]. Malígne IDEM nádory zahŕňajú malígny NST – WHO grade III a IV, anaplastický meningeóm – WHO grade III a metastázy zanesené hematogénnou cestou resp. likvorovými ciestami, tzv. drop metastázy, ktoré sa vyskytujú napr. pri meduloblastóme – WHO grade IV [22].
Klinické prejavy
Klinické príznaky intradurálnych extramedulárnych tumorov sú veľmi podobné nezávisle od histologického typu nádoru.
Prvým klinickým prejavom u pacientov s extramedulárnymi nádormi je bolesť, pričom bolesť je najčastejším príznakom spinálnych nádorov vôbec. Typ bolesti závisí od umiestnenia a typu nádoru. Lokálna bolesť je pri väčšine IDEM nádorov intenzívna. Schwanómy sa môžu manifestovať silnou unilaterálnou monoradikulárnou bolesťou. Prítomná môže byť aj centrálna neuropatická bolesť, ktorej vznik zápríčiňuje postihnutie senzorických dráh zadného stĺpca miechy a spinotalamickej dráhy. Niekedy môže imitovať srdcovú alebo brušnú bolesť.
Okrem bolesti sa objavujú parestézie. Šlachovo-okosticové reflexy sú zachované a postupne sa zvyšujú, poruchy citlivosti nie je možné v začiatkoch určiť. Neskôr sa objavuje syringomyelická disociácia alebo disociácia typu Brown-Séquard, ojedinele môžu byť prítomné výrazné iritačné prejavy (hyperestézie, priapizmus). Zo segmentových príznakov to môžu byť: poruchy motoneurónu lokalizované o segment nižšie, ako je kompresia predného koreňa alebo predného rohu miechy, ako aj porucha citlivosti z útlaku dorzálnych koreňov. Horná hranica poruchy citlivosti je lokalizovaná o 2–3 segmenty nižšie [2].
Motorické príznaky sa štandardne objavujú až neskôr, hoci u 10–15 % pacientov s IDEM nádormi sú popisované ako prvotné príznaky. Motorické deficity sú väčšinou nesúmerné, ich charakteristika závisí od úrovne postihnutia miechy nádorom, jeho šírením, rýchlosťou rastu a stupňom blokády likvorových ciest v subarachnoidálnom priestore. V 70 % prípadov sa v rôznej miere vyskytuje slabosť dolných končatín, najčastejšie pri tumoroch hrudnej oblasti.
U väčšiny pacientov sa časom pridružia radikulárne ťažkosti, ktoré veľmi často stranovo korelujú a zhoršujú sa po záťaži.
Ďaľšími nekonštantnými príznakmi (podľa výšky uloženia nádoru) sú: slabosť a neobratnosť horných končatín, poruchy sfinkterov, pocit pásu na prsiach a bruchu, dysfunkcia čriev, anesnestézia typu jazdeckých nohavíc, sexuálne poruchy, pozitívny Babinského reflex a príznaky myelopatie. Syndrómy miechových lézií podľa výšky postihnutia detailne popísal vo svojej práci Kalina (tab. 1). Zriedkavo sa objavia príznaky subarachnoidálneho krvácania a ojedinele je prítomný edém papily očného nervu (zvýšením intrakraniálneho tlaku [intracranial pressure; ICP] pri blokáde likvorových ciest, pri výraznej hyperproteinorhachii).
Table 1. Syndrómy miechových lézií (podľa výšky postihnutia) [2]. ![Syndrómy miechových lézií (podľa výšky postihnutia) [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/2dbff320fe2d7b03025881777e2145b9.jpeg)
Nie každý symptóm indikuje úroveň útlaku miechy alebo koreňa. Dôležitú úlohu zohráva aj postihnutie ciev. Kompresia radikulárnych artérií a/alebo arteria spinalis anterior môže viesť k neočakávanému komplexu príznakov. Pri útlaku prívodných ciev sú ako prvé postihnuté oblasti miechy v povodí medzi veľkými radikulárnymi artériami. Tieto príznaky môžu predchádzať príznaky z priameho útlaku miechy alebo koreňa aj o niekoľko mesiacov [1,2,22–25].
Diagnostika, diferenciálna diagnostika
V rámci diferenciálnej diagnostiky je nutné sa zamerať najmä na tieto ochorenia: SM, syringomyelia, Chiariho malformácia, myelopatia pri spinálnej stenóze, myelopatia pri hernii disku, myelitis transversa, myelomalácia, hematóm, arteriovenózna malformácia, fistula, kontúzia miechy, absces, tuberkulóm, arachnoidálna cysta, sarkoidóza a iné granulomatózne ochorenia, familiárna spastická paraparéza, amyotrofická laterálna skleróza a adrenoleukodystrofia [1,2,22–25].
Kalina uvádza, že rozdiely v klinických prejavoch medzi intramedulárnymi a extramedulárnymi nádormi sú evidentné, aj keď sú tieto nádory lokalizované v rovnakej etáži chrbtice (tab. 2).
Table 2. Diferenciálna diagnóza medzi intramedulárnou a extramedulárnou léziou [2]. ![Diferenciálna diagnóza medzi intramedulárnou a extramedulárnou léziou [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a54b5cdcce193238d97002246b17531d.jpeg)
Liečba
Indradurálne extramedulárne nádory sú prevažne nezhubné, dobre ohraničené a často i opúzdrené. Vzhľadom k tomu je šanca na ich úplné odstránenie vysoká. Chirurgická resekcia je preto pri IDEM nádoroch metóda voľby. Cieľom je „gross total resection“ (GTR), čiže také odstránenie nádoru, kedy peroperačne pod mikroskopom, ale ani na včasnom pooperačnom MRi vyšetrení nie je detekované reziduum nádoru. GTR sa dá docieliť u väčšiny pacientov (89–98 %) [5,17,22,23,26,27].
Pacient by mal byť pred operáciou poučený o pravdepodobnom benígnom charaktere ochorenia, ale aj o riziku ťažkého neurologického deficitu, ktorý môže vzniknúť poškodením ciev alebo nervových tkanív počas operácie. Toto riziko je signifikantne vyššie u starších pacientov a u pacientov s iniciálnym ťažším neurologickým deficitom [22].
Prístrojové vybavenie
Nevyhnutným prístrojovým vybavením pri operáciách IDEM tumorov by malo byť RTG C rameno, operačný mikroskop a neuromonitoring evokovaných potenciálov. Peroperačná ultrasonografia (USG) je taktiež veľmi užitočná. V mnohých prípadoch je nevyhnutná aj kavitronová UZ odsávačka (Cavitron Ultrasonic Surgical Aspirator; CUSA), s použitím ktorej je možné šetrné intrakapsulárne zmenšovanie (debulking) aj pri nádore tuhšej konzistencie, ktorý je bežnými inštrumentmi ťažko debulkovateľný.
Poloha pacienta, plánovanie prístupu
Pacient je pri operácii IDEM nádoru v pronačnej polohe na bruchu. Výhodné je napolohovanie pacienta tak, aby operačné pole bolo v najvyššom bode, s cieľom minimalizovať evakuáciu mozgovomiechového moku. Pri operácii krčnej chrbtice sa hlava pacienta fixuje v trojbodci (Mayfield). Pri operácii IDEM nádoru v krčnej oblasti, ktorý vypĺňa podstatnú časť priemeru spinálneho kanála, postupujeme pri polohovaní pacienta veľmi opatrne, nakoľko môžeme negatívne ovplyvniť výsledný neurologický deficit. Pri veľkých nádoroch v krčnej oblasti sa na zamedzenie hyperextenzie pri intubácii odporúča použitie fibroskopu [5,22]. Poloha v sede pri operácii hornej krčnej chrbtice a kraniocervikálneho prechodu sa neodporúča. Aj keď je v tejto polohe lepšia venózna drenáž, je tu však aj oveľa väčšie riziko vzniku vzduchovej embólie. V tejto polohe dochádza i k masívnej evakuácii likvoru, čo so sebou prináša okrem pooperačných bolestí hlavy aj riziko vzniku subdurálneho hematómu. Ďalšou nevýhodou je obmedzenie pozície asistenta pri operácii (plnohodnotne môže asistovať iba jednou rukou). V pronačnej polohe pacienta má asistent výrazne komfortnejšiu pozíciu [22].
Veľký dôraz sa kladie aj na plánovanie samotného rezu a prístupu. RTG C rameno je pri plánovaní nevyhnutné. Nie je vhodné spoliehať sa iba na metódu odpočtu tŕňových výbežkov. Okrem rizika zlyhania ľudského faktora je tu i možnosť mobility nádorov kraniálnym smerom pri pronačnej polohe pacienta, popísaná napr. pri schwanómoch [28]. Pri pochybnostiach je vhodné realizovať peroperačnú perimyelografiu, po laminektómii peroperačné USG [5,22,28]. Inou možnosťou je realizovanie peroperačného MR vyšetrenia. Jeho nevýhodou je však nízka dostupnosť, vysoké obstarávacie náklady a nutnosť prerušenia operačného výkonu na čas potrebný na realizáciu vyšetrenia. V tejto súvislosti sa ako výhodná alternatíva javí realizovanie dynamického MR vyšetrenia (G-scan) pred operáciou s cieľom verifikovania prípadnej mobility nádoru v pronačnej polohe/predklone pacienta.
Neuromonitoring
Peroperačný neuromonitoring (obr. 4A a B) je pri všetkých väčších a ventrálne uložených IDEM nádoroch považovaný za esenciálny v záujme zabezpečenia dobrého neurologického výsledku. Funkcia dorzálnych stĺpcov je jednoducho monitorovateľná pomocou somatosenzorických evokovaných potenciálov (SSEP). Štandardne sa indukuje nervus tibialis. Pri nádoroch krčnej oblasti je možnosť stimulovať nervus medianus, čo vedie k stabilnejšej odpovedi a kratšej latencii. Motorické evokované potenciály (MEP) umožňujú monitorovať kortikospinálny trakt transkraniálnou stimuláciou (elektrickou, magnetickou). Výhodou SSEP je, že môžu byť sledované kontinuálne. MEP sa kvôli veľkým pohybom svalstva po stimule štandardne nevybavujú kontinuálne, ale jednorázovo na popud operatéra. V rámci neuromonitoringu má svoje miesto aj tzv. D-vlna. Jej vybavenie slúži na monitorovanie motorických dráh.
Obr. 4 A,B Peroperačný neuromonitoring.
Fig. 4 A,B Intraoperative neurophysiological monitoring.
Obr. 5 A, B. Normálny peroperačný sonografický obraz: 1. hypoechogénna miecha s hyperechogénnym povrchom; 2. dura mater spinalis – hyperechogénny lem; 3. likvor v subarachnoidálnom priestore – hypoechogénny voči mieche; 4. medzistavcová platnička – hyperechogénny pruh; 5. fyziologický roztok s bublinami vzduchu.
Fig. 5 A, B. Normal intraoperative sonographic image: 1. hypoechoic spinal cord with hyperechoic surface; 2. spinal dura mater with hyperechoic outer contours; 3. cerebrospinal fluid in the subarachnoid space – hyperechoic compared to the spinal cord; 4. intervertebral disc – hyperechoic line; 5. physiological saline with air bubbles.
Z hľadiska zachovania funkcií miechy sú významnejšie MEP ako SSEP [15]. Ak dôjde k poklesu MEP a amplitúdy D-vlny o viac ako 50 %, resekcia má byť prerušená. Ak sa MEP neupravia ani po prerušení resekcie, je niekedy nutné operáciu ukončiť s cieľom eliminácie rizika trvalého pooperačného zhoršenia funkcií miechy [6]. Úplné vymiznutie D-vlny je veľmi zlým prognostickým faktorom z hľadiska zachovania motorických funkcií po operácii. Pri operáciách NST, ale aj pri iných typoch IDEM nádorov v oblasti cauda equina je možné efektívne využiť EMG. Umožňuje identifikáciu konkrétneho koreňa a sledovanie jeho aktuálneho funkčného stavu. Neuromonitoring má obrovský význam najmä pri operatíve v oblasti conus medullaris, kde je obzvlášť potrebná šetrnosť a niektorí autori ju prirovnávajú k operatíve intramedulárnych nádorov [5,6,22,29–33].
Operačný prístup
Voľba operačného prístupu závisí od lokalizácie, veľkosti, rastu nádoru a iných parametrov. Cieľom operačného prístupu je získať maximálny peroperačný priestor na resekciu tumoru pri minimálnom poškodení priľahlých štruktúr [5].
S rozvojom miniinvazívnych prístupov s využitím operačního mikroskopu a endoskopických technik pri chirurgickej liečbe ochorení chrbtice je tendencia využívať tento typ prístupov aj pri chirurgickej liečbe nádorov chrbtice. Unilaterálna laminektómia (hemilaminektómia) bola používaná už v počiatkoch spinálnej operatívy. S pokrokom operačného mikroskopu ju v 80. rokoch 20. storočia spopularizovali najmä Eggert et al [34–37]. Deklarované výhody unilaterálneho prístupu sú: menšia pooperačná bolesť, prevencia instability, skoršia mobilizácia pacienta, menšie krvné straty, lepšie hojenie rany, menšie riziko pooperačnej infekcie, kratšia doba hospitalizácie a nie je potrebný korzet. Okrem bezprostredných výhod nie je zanedbateľný ani fakt, že pri operácii recidívy nádoru sa dá s výhodou využiť unilaterálny prístup z druhej strany, čím sa vyhneme prístupu cez pôvodnú jazvu. Medzi nevýhody patrí: užší pohľad, menší manipulačný priestor, neúplná expozícia nádoru, resp. nemožnosť ho vidieť naraz celý bez potreby zmeny pohľadu, čo môže viesť k vyššiemu riziku poškodenia zdravého nervového tkaniva a vyššiemu riziku rezidua tumoru [35,38,39]. Napriek tomu sa väčšina autorov v odborných publikáciách v prípade operatívy IDEM tumov prikláňa k širšiemu operačnému prístupu, k laminektómii [5,6,22,24]. Pri laminektómii by sa mal dostatočne sprístupniť tumor s ohľadom na zachovanie stability. Excesívne odstránenie kostných štruktúr môže viesť k instabilite v danom segmente chrbtice [5]. V prípade potrebe radikálnejšieho prístupu s odstránením facetových kĺbov či časti pediklov sa odporúča kombinovať resekciu tumoru so stabilizačným výkonom [5].
Po realizovaní chirurgického prístupu je možné využiť peroperačnú USG (obr. 5–7).
Obr. 6 A. Sonografické charakteristiky – meningeóm: hyperechogénny voči mieche, vyššia echogenicita v porovnaní s neurinómami, častejší nepravidelný tvar, absencia súčasného pohybu s pulzáciami likvoru, hyper/hypoechogénne škvrny v tumore, kalcifikáty môžu vytvárať akustický tieň.
Fig. 6 A. Sonographic features – meningioma: hyperechoic in contrast with the spinal cord, higher echogenicity compared to a neurinoma, irregular shape is more frequent, absence of simultaneous movement with cerebrospinal fluid, hyper/hypoechoic zones within the tumor, and calcification can create an acoustic shadow.
Obr. 6 B. Sonografické charakteristiky – schwannóm: oblý a hladký povrch, častejšie hypoechogénny stred, event. mikrocysty, je zjavný súčasný pohyb so srdcovým rytmom.
Fig. 6 B. Sonographic features – schwannoma: round and smooth surface, hypoechoic center is more frequent, possible occurence of microcysts, and obvious simultaneous movement with cerebrospinal fluid.
Obr.7 A. Meningeóm Th9–10, MR vyšetrenie, sagitálny rez v T1W sekvencii s podaním kontrastnej látky (Obr. 7 A) a USG vyšetrenie (Obr. 7 B): 1. meningeóm; 2. spinálny kanál; 3. medzistavcová platnička. USG – ultrasonografie
Fig. 7 A. Meningioma at Th9–10, MR post-contrast sagittal T1W sequence (Fig. 7 A) and USG imaging (Fig.7 B): 1. meningioma; 2. spinal canal; 3. intervertebral disc. USG – ultrasonography
Obr.7 B. Meningeóm Th9–10, MR vyšetrenie, sagitálny rez v T1W sekvencii s podaním kontrastnej látky (Obr. 7 A) a USG vyšetrenie (Obr. 7 B): 1. meningeóm; 2. spinálny kanál; 3. medzistavcová platnička. USG – ultrasonografie
Fig. 7 B. Meningioma at Th9–10, MR post-contrast sagittal T1W sequence (Fig. 7 A) and USG imaging (Fig.7 B): 1. meningioma; 2. spinal canal; 3. intervertebral disc. USG – ultrasonography
Obr. 8 A–D. Schwannóm C1 zasahujúci do foramen intervertebrale C1/2 vľavo, MR vyšetrenie: A Axiálny rez v T2W sekvencii; B Axiálny rez v T1W sekvencii s podaním kontrastnej látky; C. sagitálny rez v T1W sekvencii s podaním kontrastnej látky; D. frontálny rez T1W sekvencii s podaním kontrastnej látky.
Fig. 8 A–D. Schwannoma at C1 encroaching the foramen intervertebrale C1/2 on the left side, MR image: A Axial T2W sequence; B. post-contrast axial T1W sequence; C. post-contrast sagittal T1W sequence; D. post-contrast coronal T1W sequence.
Obr. 9 A, B. Schwannóm Th9/10 zasahujúci do foramen Th9/10 vľavo, MR vyšetrenie: A. sagitálny rez v T2W sekvencii; B Axiálny rez v T1W sekvencii s podaním kontrastnej látky.
Fig. 9 A, B. Schwannoma at Th9/10 encroaching the left foramen intervertebrale Th9/10, MR image: A. sagittal T2W sequence; B. post-contrast axial T1W sequence.
Napriek tomu, že USG sa všeobecne častejšie využíva pri operačnej liečbe IDIM nádorov, jej prínos je nesporný aj pri chirurgickej liečbe IDEM nádorov. USG zabezpečuje transdurálne zobrazenie nádoru v reálnom čase, ktorý môže po napolohovaní pacienta migrovať.
Peroperačné USG je využívané na verifikovanie dostatočnosti operačného prístupu (kraniálne a kaudálne od tumoru) a na kontrolu lokalizácie nádoru v sagitálnej a transverzálnej rovine po laminektómii. Využitie USG minimalizuje riziko krvácania do subarachnoidálneho priestoru, ktoré môže vzniknúť pri dodatočnom odstraňovaní laminy pri otvorenej dura mater. USG je i zdrojom informácií o samotnom nádore (zobrazuje príp. cysty, krvácania, hyperechogénne časti) a veľmi efektívnym nástrojom na posúdenie radikality realizovanej resekcie [40,41].
Technika resekcie IDEM
Samotná durotómia je realizovaná väčšinou v strednej čiare. Pri laterálnych tumoroch môže byť posunutá laterálne alebo môže byť zakrivená laterálnym smerom [22]. V závislosti od uloženia nádoru je niekedy potrebné kombinovať rezy do tvaru písmena „T“ alebo kríža. Typicky pri NST, pri ktorých je potrebné realizovať kolmý rez v úrovni postihnutého koreňa. Niektorí autori odporúčajú, najmä v lumbálnej oblasti, incíziu dura mater najskôr proximálne od nádoru a následnú durotómiu kraniokaudálnym smerom, kvôli riziku herniácie koreňov kaudy pri evakuácii likvoru v kaudálnom póle prístupu [5]. V oblasti miechy je niekedy nutné najprv prerušiť ligamentum denticulatum s cieľom minimalizovania manipulácie s miechou, najmä pri ventrálne uložených nádoroch. Pri nádoroch koreňa sa v prvom rade snažíme identifikovať koreň, z ktorého nádor vyrastá. Pri meningeómoch je potrebné identifikovať spojenie s dura mater s cieľom včasnej devaskularizácie tumoru [5,22–24]. Malé nádory je môžné extirpovať „in toto“. Pri väčších ventrálnych nádoroch tuhšej konzistencie je nevyhnutné nádor intrakapsulárne zmenšiť (debulkovať) v jeho centrálnej časti pri minimálnej manipulácii s miechou, čo umožňuje napr. CUSA. Povrch tumoru sa odstráni na záver [5,6,22,29–32]. Okrem CUSA je pri resekcii týchto nádorov možné využiť i thuliový laser. Laser umožňuje súčasný rez a evaporáciu nádoru bez hlbokej penetrácie, nekontrolovanej nekrózy, generovania tlakových vĺn alebo traumy na okolité tkanivá a orgány. Takisto zabezpečuje kvalitnú hemostázu. Vďaka tomu je možné mikroskopickou operačnou technikou púzdro nádoru bezpečne devaskularizovať a následne tumor zmenšiť evaporáciou za účelom bezpečnej manipulácie pri jeho odstraňovaní.
Približne 89–98 % IDEM nádorov je odstrániteľných úplne. V prípade schwanómov a neurofibrómov sa popisuje možnosť odstránenia koreňa, z ktorého nádor vyrastá, pretože väčšina schwanómov a niektoré neurofibrómy vyrastajú z dorzálneho koreňa. Aj v prípade postihnutia predného koreňa je možné uvažovať o jeho resekcii, nakoľko funkcia predného koreňa je kompenzovaná susednými koreňmi už pred operáciou a neurologický deficit sa väčšinou po operácii neobjaví. Kim et al zaznamenali výskyt neurologického deficitu po odstránení postihnutého koreňa iba u 23 % pacientov. Vo všetkých prípadoch sa jednalo o neurologický deficit nezávažného charakteru. Úplné odstránenie neurofibrómu vyžaduje resekciu koreňa, z ktorého nádor vyrastá. V prípade rastu nádoru zadného koreňa až za ganglion spinale by totálna resekcia znamenala vznik výrazného pooperačného deficitu. V takomto prípade, za predpokladu evidentne benígnej povahy nádoru, mnohí autori preferujú dobrý neurologický výsledok aj za cenu subtotálnej resekcie. Pri rozhodovaní je veľmi nápomocné rýchle peroperačné histologické vyšetrenie [6,22,24,28,42].
Radikalita resekcie pri spinálnych meningeómoch je posudzovaná analogicky k intrakraniálnym meningeómom. Popísané sú tri prístupy, ktoré je možné aplikovať:
- odstránenie dura mater spolu s tumorom;
- odstránenie vnútornej časti dura mater v mieste kontaktu s tumorom;
- koagulácia miesta kontaktu dura mater s tumorom bipolárnou koaguláciou.
Resekcia nádoru spolu s miechovými obalmi je v spinálnom kanáli veľmi náročná a je dosiahnuteľná iba za cenu veľmi vysokého rizika unikania mozgovomiechového moku v pooperačnom období. Nakoľko sa medzi uvedenými troma prístupmi nepreukázali signifikantné rozdiely z hľadiska tendencie nádoru recidivovať, autori preferujú v tejto lokalite menej radikálny spôsob [22,24].
Vzhľadom na to, že ostatné histologické typy IDEM nádorov (s výnimkou meningeómov a NST) sú pomerne zriedkavé, neexistujú pre ich operačnú liečbu všeobecné odporúčania [22].
V priebehu operačného zákroku je nevyhnutné vodotesné uzavretie tvrdej pleny, príp. aplikácia tuku a tkanivového lepidla epidurálne, s cieľom zmenšenia mŕtveho priestoru a následný pooperačný kľudový režim pacienta (48 h na lôžku) ako prevencia vzniku likvorei [5].
Kortikosteroidy
Názory na podávanie kortikosteroidov pri operáciách IDEM nádorov sú rôzne. Niektorí autori odporúčajú podávať kortikoidy v perioperačnom období za účelom prevencie pooperačného zhoršenia funkcií miechy [6,22,29–32]. Goldbrunner et al odporúčajú na minimalizovanie rizika edému miechy a nervových štruktúr podať pred operáciou vyššie dávky dexametazonu (16 mg) a počas samotnej operácie odporúčajú pridať metylprednizon, podľa peroperačného nálezu až do 1 000 mg jednorázovo [22]. Základnou podmienkou úspešného chirurgického výkonu je však šetrná mikrochirurgická manipulácia s nervovými štruktúrami [6].
Onkologická liečba
Onkologická liečba sa štandardne v prípade IDEM nádorov nevyužíva. Adjuvantná rádioterapia prípadne veľmi ojedinele chemoterapia sú v závislosti na type nádoru využívané najmä pri inkompletnej resekcii, po operácii recidívy nádoru alebo pri zriedkavých malígnych IDEM nádoroch. Prínos onkologickej liečby pri niektorých histologických podtypoch IDEM nádorov je predmetom diskusie [22].
Výsledky, prognóza
IDEM nádory majú prevažne benígny charakter a vo väčšine prípadov je možné ich kompletné odstránenie. Ak sa nádor odstráni úplne, pacient väčšinou nepotrebuje žiadnu ďaľšiu liečbu [5,22]. Mnohí autori odborných štúdií uvádzajú zlepšenie neurologického stavu u všetkých operovaných pacientov [23,24]. Výsledný neurologický stav pacienta závisí od predoperačného neurologického stavu, veľkosti nádoru, rozsahu resekcie a histopatologického nálezu. Popísané bolo výrazné zlepšenie neurologického stavu po operácii aj pri zlom vstupnom neurologickom stave pacienta [22,24].
Komplikácie
K najčastejším chirurgickým komplikáciám, ktoré vyžadujú včasnú reoperáciu. patrí hematóm v mieste operačného prístupu a likvorová fistula. Riziko vzniku hematómu je možné minimalizovať dôkladnou peroperačnou hemostázou a ponechaním podtlakových drénov. Drény na aktívny podtlak však zároveň zvyšujú riziko likvorei. Riziko vzniku secernácie mozgovomiechového moku je možné čiastočne eliminovať použitím rôznych druhov tkanivových lepidiel, dôslednou sutúrou, eventuálne plastikou dura mater s použitím rôznych materiálov a pooperačným kľudom na lôžku (odporúča sa min. 48 h). K ďalším, menej častým komplikáciám patria infekcia operačnej rany, pooperačná instabilita a prehĺbenie neurologického deficitu (možnosti minimalizácie rizika vzniku týchto komplikácií už boli v tejto práci popísané). Ak sa napriek tomu komplikácie vyskytnú, je potrebné ich riešiť. Infekcia operačnej rany sa rieši lokálne ošetrovaním a celkovo podávaním antibiotík. Instabilitu chrbtice je možné chirurgicky riešiť dodatočnou stabilizáciou. Najzávažnejšou komplikáciou je vznik ťažkého neurologického deficitu. Môže byť čiastočne ovplyvnený rehabilitáciou, väčšinou však do určitej miery pretrváva doživotne. Riziko vzniku ťažkého neurologického deficitu je však vzhľadom na štandardné peroperačné využívanie operačného mikroskopu a neuromonitoringu evokovaných potenciálov iba minimálne [5,6,22–24].
Najčastejšie IDEM nádory
Schwanóm
Schwanóm (neurilemóm) je najčastejší benígny NST. Typicky má guľatý, príp. oválny laločnatý tvar, je ohraničený a vyrastá excentricky z obalu nervového koreňa [43–45].
Schwanóm je zložený výlučne zo Schwannových buniek. Schwannové bunky preberajú funkciu oligodendroglií v mieste abruptného prechodu z CNS na periférny nervový systém, na miechových koreňoch, 1–2 mm od piálneho povrchu [1,6].
Viac ako 95 % schwanómov vyrastá zo zadných miechových koreňov. Ventrálne uloženie schwanómu nebýva typické a nie vždy sa pri ňom potvrdí rast súvisiaci s predným miechovým koreňom [42–51].
Schwanómy sú uložené prevažne intradurálne (70 %), menej často extradurálne (15 %). Pomerne často je pozorovaný intra-extradurálny rast (15 %),
Schwanómy sa môžu vyskytovať v ktorejkoľvek úrovni chrbtice. Najčastejšie je pozorovaný vyskyt v lumbálnej oblasti (60 %), následne v hrudnej, krčnej a sakrálnej oblasti chrbtice [42,46,52].
Schwanómy rastú väčšinou pomaly, lokálne môžu rásť agresívne, niekedy aj s uzuráciou alebo prestavbou kosti (obr. 3 a 8). Nie je zriedkavý ani rast pozdĺž nervového koreňa do foramen intervertebrale alebo extraspinálne (obr. 8 a 9). Makroskopický obraz schwanómu bezprostredne po resekcii je zobrazený na obr. 10.
Obr. 10. Schwanóm, makroskopický pohľad po resekcii [122].
Fig. 10. Schwannoma, macroscopic view after resection [122].![Obr. 10. Schwanóm, makroskopický pohľad po resekcii [122].<br>
Fig. 10. Schwannoma, macroscopic view after resection [122].](https://pl-master.mdcdn.cz/media/image_pdf/d7af111e02deb04581716589d4c2f009.jpeg?version=1555331731)
Obr. 11. Schwanóm, histologická mikrofotografia. Viditeľné oblasti Antoni A a Antoni B [46].
Fig. 11. Schwannoma, histological microimage. Visible Antoni A and Antoni B areas [46].![Obr. 11. Schwanóm, histologická mikrofotografia. Viditeľné oblasti Antoni A a Antoni B [46].<br>
Fig. 11. Schwannoma, histological microimage. Visible Antoni A and Antoni B areas [46].](https://pl-master.mdcdn.cz/media/image_pdf/1fcc52295461c17c77b8f299beb9f841.png?version=1555331838)
Obr. 12 A, B. Spinálny neurofibróm Th9–10, MR vyšetrenie: A. sagitálny rez v T1W sekvencii s podaním kontrastnej látky; B. transverzálny rez v T1W sekvencii s podaním kontrastnej látky [123].
Fig. 12 A, B. Spinal neurofibroma at Th9–10, MR image: A. post-contrast sagittal T1W sequence; B. post-contrast axial T1W sequence [123].![Obr. 12 A, B. Spinálny neurofibróm Th9–10, MR vyšetrenie: A. sagitálny rez v T1W sekvencii s podaním kontrastnej látky; B. transverzálny rez v T1W sekvencii s podaním kontrastnej látky [123].<br>
Fig. 12 A, B. Spinal neurofibroma at Th9–10, MR image: A. post-contrast sagittal T1W sequence; B. post-contrast axial T1W sequence [123].](https://pl-master.mdcdn.cz/media/image_pdf/8007bf3b52adf6685c209e85ea231967.jpeg?version=1555332535)
Obr. 13. Spinálny neurofibróm, makroskopický obraz nádoru po resekcii [123].
Fig. 13. Spinal neurofibroma, macroscopic view after resection [123].![Obr. 13. Spinálny neurofibróm, makroskopický obraz nádoru po resekcii [123].<br>
Fig. 13. Spinal neurofibroma, macroscopic view after resection [123].](https://pl-master.mdcdn.cz/media/image_pdf/7ba03896a0288e36b5a67549b0a32acc.jpeg?version=1555332653)
Obr. 14 A, B. Meningeóm cervikokraniálneho prechodu, MR vyšetrenie: A Axiálny rez v T1W sekvencii s podaním kontrastnej látky; B. sagitálny v T1W sekvencii s podaním kontrastnej látky.
Fig. 14 A, B. Meningioma at cervicocranial transition , MR image: A. post-contrast axial T1W sequence; B. post-contrast sagittal T1W image.
Obr. 15. Meningeóm, pohľad cez operačný mikroskop pri jeho resekcii [122].
Fig. 15. Meningioma, photographic view through the operating microscope showing the tumor during resection [122].![Obr. 15. Meningeóm, pohľad cez operačný mikroskop pri jeho resekcii [122].<br>
Fig. 15. Meningioma, photographic view through the operating microscope showing the tumor during resection [122].](https://pl-master.mdcdn.cz/media/image_pdf/84cfe34f2f1570d41512df202df9b801.jpeg?version=1555333188)
Majú prevažne benígny charakter. V dôsledku ich pomalého rastu nie je zriedkavý ani výskyt tzv. obrovských schwanómov (giant schwanomas). Obrovské schwanómy sa najčastejšie vyskytujú ako extraspinálny komponent tumoru a zasahujú do hrudnej, břušnej alebo panvovej dutiny, podľa primárneho rastu. Nádory sa preto môžu klinicky prejaviť až pomerne neskoro, v štádiu, kedy už dosahujú značné rozmery (obr. 3).
Intradurálne schwanómy sú prevažne solídne nádory. Niektoré schwanómy môžu mať v MRi obraze charakter cysty. Pre vznik cystických schwanómov, resp. pre ich cystickú premenu existuje viacero teórií. Jednou z nich je postupná cystická premena porcie Antoni B, ktorá je hypocelulárna a môže sa postupne formovať do väčšej cysty. Iné teórie hovoria o centrálnych ischemických nekrózach, nekrózach spôsobených trombózou ciev, hemorágiách a neovaskularizácii súvisiacej s rýchlym rastom tumoru [46,53–56].
Histológia
Z histologického hľadiska je schwanóm zložený výlučne so Schwannovych buniek a tvorí dva základné vzory – kompaktné oblasti s občasným nukleárnym palisádovaním (Antoni A) a menej celulárne, často lipidizované oblasti (Antoni B) (obr. 11). Jednou zo základných histologických charakteristík sú mikrokrvácania [47,57]. Malígna transformácia je veľmi zriedkavá [1]. Výskyt malígneho schwanómu je približe 2 % spomedzi všetkých spinálnych schwanómov [58].
Obr. 16. Meningeóm, histologická mikrofotografia. Prítomné psamomatózne teliesko (kalcifikát) [77].
Fig. 16. Meningioma, histological microimage. Psammoma body – whorls and a single calcification are present [77].![Obr. 16. Meningeóm, histologická mikrofotografia. Prítomné psamomatózne teliesko (kalcifikát) [77].<br>
Fig. 16. Meningioma, histological microimage. Psammoma body – whorls and a single calcification are present [77].](https://pl-master.mdcdn.cz/media/image_pdf/43ee57e0236d061ce55244a2717dccc0.jpeg?version=1555333305)
Neurofibróm
Neurofibróm spolu so schwanómom patria k NST. Neurofibróm častejšie ako schwanóm vyrastá z ganglion spinale, alebo z ventrálneho motorického nervového koreňa a väčšinou je asociovaný s neurofibromatózou 1. typu (NF-1, m. Recklinghausen). Na rozdiel od schwanómu nie je zložený výlučne zo Schwannových buniek, ale je tvorený zmesou Schwannových, perineurálnych buniek a fibroblastov [59].
Neurofibrómy môžu vykazovať zvýšenú celularitu, obsahovať atypické jadrá a mitózy, čo môže byť základom pre malígne zvrhnutie [22]. Malígne NST (WHO grade III a IV) sú v oblasti periférnych nervov dobre definovanou entitou a predstavujú približne 5% všetkých NST. V spinálnom kanáli sú však extrémne zriedkavé.
Podobne ako schwanóm aj neurofibrómy môžu rásť ako nádor typu presýpacích hodín. Výskyt spinálneho neurofibrómu mimo neurofibromatózy 1. typu (m. Recklinghausen) je zriedkavý, môže sa však vyskytovať aj solitárne [1,6,21,22,46,47,59,60].
Na obr. 12 je znázornený neurofibróm v MR obraze a na obr. 13 makroskopický vzhľad nádoru bezprostredne po jeho resekcii.
Table 3. Obr. 17 A, B. Myxopapilárny ependymóm L1- 2 , MR vyšetrenie: A. sagitálny rez v T2W sekvencii s podaním kontrastnej látky, B. sagitálny rez v T1W sekvencii s podaním kontrastnej látky.
Fig. 17 A, B. Myxopapillary ependymoma, MR image: A. post-contrast sagittal T2W sequence, B. post-contrast sagittal T1W sequence.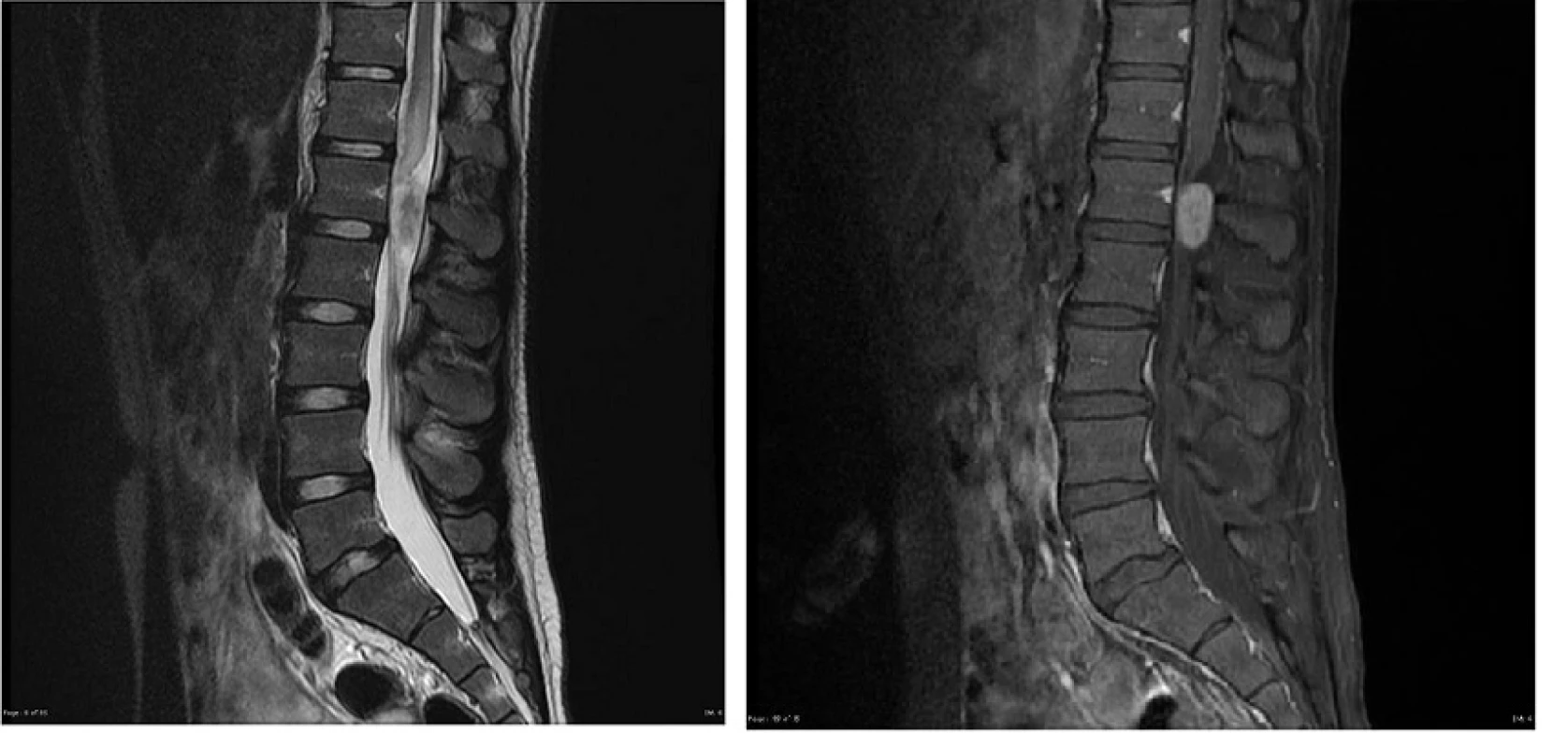
Obr. 18 A, B. Myxopapilárny ependymóm filum terminale: peroperačné snímky [95].
Fig. 18 A, B. Myxopapillary ependymoma of the filum terminale, photographic view through the operating microscope [95].![Obr. 18 A, B. Myxopapilárny ependymóm filum terminale: peroperačné snímky [95].<br>
Fig. 18 A, B. Myxopapillary ependymoma of the filum terminale, photographic view through the operating microscope [95].](https://pl-master.mdcdn.cz/media/image_pdf/d0badb711c0d368bf99796702203aa30.png?version=1555333537)
Meningeóm
Spinálne meningeómy sú nádory, ktoré typicky vyrastajú z meningoteliálnych buniek pavúčnice, tzv. arachnoid cap cells, a sú často prirastené k rukávcu nervového koreňa, ku koreňovej pošve. Pavúčnica (tela arachnoidea) je jednou z troch vrstiev tvoriacich obaly mozgu (meningy). Nachádza sa medzi mäkkou mozgovou plenou (pia mater) a tvrdou mozgovou plenou (dura mater).
Arachnoid cap cells sú súčasťou arachnoidálnych granulácií, ktoré sú projekciou arachnoidálnej membrány cez tvrdú mozgovú plenu do venóznych splavov a lakún. Tvoria rozhranie medzi mozgovomiechovým mokom a venóznou krvou a umožňujú návrat mozgovomiechového moku späť do cirkulácie, čím zabezpečujú reguláciu.
Môžu však vyrastať aj z piálnych alebo durálnych fibroblastov, čo vysvetľuje ich mezodermálny pôvod.
Incidencia spinálnych meningeómov je 0,32 prípadu na 100 000 obyvateľov za rok [21]. Spinálne meningeómy sú pomerne vzácne a predstavujú iba 1,2–12,7 % zo všetkých meningeómov CNS. Napriek tomu je meningeóm 2. najčastejší nádor tejto lokality. Predstavuje 25 % všetkých spinálnych tumorov a približne 2/5 všetkých intradurálnych extramedulárnych tumorov.
Meningeómy sa zvyčajne vyskytujú po 40. roku života, viac ako 70 % pacientov je vo veku od 40 do 70 rokov, s priemerným vekom 50 rokov. Meningeómy sa častejšie vyskytujú u žien než u mužov. Kým pri intrakraniálnych meningeómoch je pomer ženského a mužského pohlavia 2 : 1, u intraspinálnych je tento pomer 4 : 1 až 9 : 1 (80 – 90 % tvoria ženy) [61–66].
Meningeómy sú uložené prevažne intradurálne extramedulárne (90 %), rešpektujúc mäkkú plenu miechy. Takmer vždy adherujú k vnútornej vrstve tvrdej pleny. Extradurálny rast je v literatúre popisovaný (5 %), je však veľmi zriedkavý. Udáva sa, že až 80 % meningeómov sa vyskytuje v hrudnej chrbtici, avšak táto predominancia sa ukazuje iba v súvislosti so ženským pohlavím. V porovnaní s hrudnou oblasťou (64 %) ich v menšej miere nachádzame aj v krčnej chrbtici (28 %), ešte menej často v driekovej chrbtici (2–14 %). [61–64,67–81]
Meningeómy rastú typicky pomaly a majú prevažne benígny charakter. Môžu recidivovať, väčšinou však ako dôsledok nekompletnej resekcie tumoru. Rastú takmer vždy intradurálne extramedulárne a na tvrdú plenu najčastejšie naliehajú z dorzolaterálnej strany. Kontakt s tvrdou plenou je takmer vždy pomerne široký [63,77,82–84].
Na obr. 14 je zobrazený meningeóm cervikokraniálneho prechodu v MR obraze. Na obr. 15 je zobrazený pohľad na meningeóm cez operačný mikroskop.
Obr. 19. Myxopapilárny ependymóm, histologická mikrofotografia. Mucinózna zmena strómy [95].
Fig. 19. Myxopapillary ependymoma, histological microimage. Stroma showing mixoid change [95].![Obr. 19. Myxopapilárny ependymóm, histologická mikrofotografia. Mucinózna zmena strómy [95].<br>
Fig. 19. Myxopapillary ependymoma, histological microimage. Stroma showing mixoid change [95].](https://pl-master.mdcdn.cz/media/image_pdf/5119b096e02c9db975d72ef2a41df3eb.png?version=1555333618)
Obr. 20 A, B. Spinálny paraganglióm, MR vyšetrenie obraze A. sagitálny rez v T1W sekvencii s podaním kontrastnej látky; B Axiálny rez v T1W sekvencii s podaním kontrastnej látky.
Fig. 20 A, B. Spinal paraganglioma, MR image: A. post-contrast sagittal T1W sequence; B. post-contrast axial T1W sequence.
Histológia
Meningeómy sú väčšinou benígne nádory WHO grade I. Najčastejšie histologické podtypy v tejto oblasti sú:
- meningoteliálny meningeóm, ktorý sa vyskytuje cca v 40 % prípadov a
- psamomatózny meningeóm, ktorý sa vyskytuje v 20 % prípadov.
Typický histologický obraz meningeómu je znázornený na obr. 16. Niektoré histologické subtypy sú spojené s menej priaznivým klinickým priebehom: WHO grade II (chordoidný, svetlobunkový, atypický meningióm) a WHO grade III (papilárny, rabdoidný, anaplastický meningióm). Atypický meningeóm tvorí 4,7–7,2 % všetkých meningeómov a anaplastický 1,0–2,8 %. V oblasti spinálnych meningov sú však oveľa zriedkavejšie [63,69].
Table 4. Obr. 21. Spinálny paraganglióm, makroskopický pohľad po jeho resekcii.
Fig. 21. Spinal paraganglioma, macroscopic view after resection.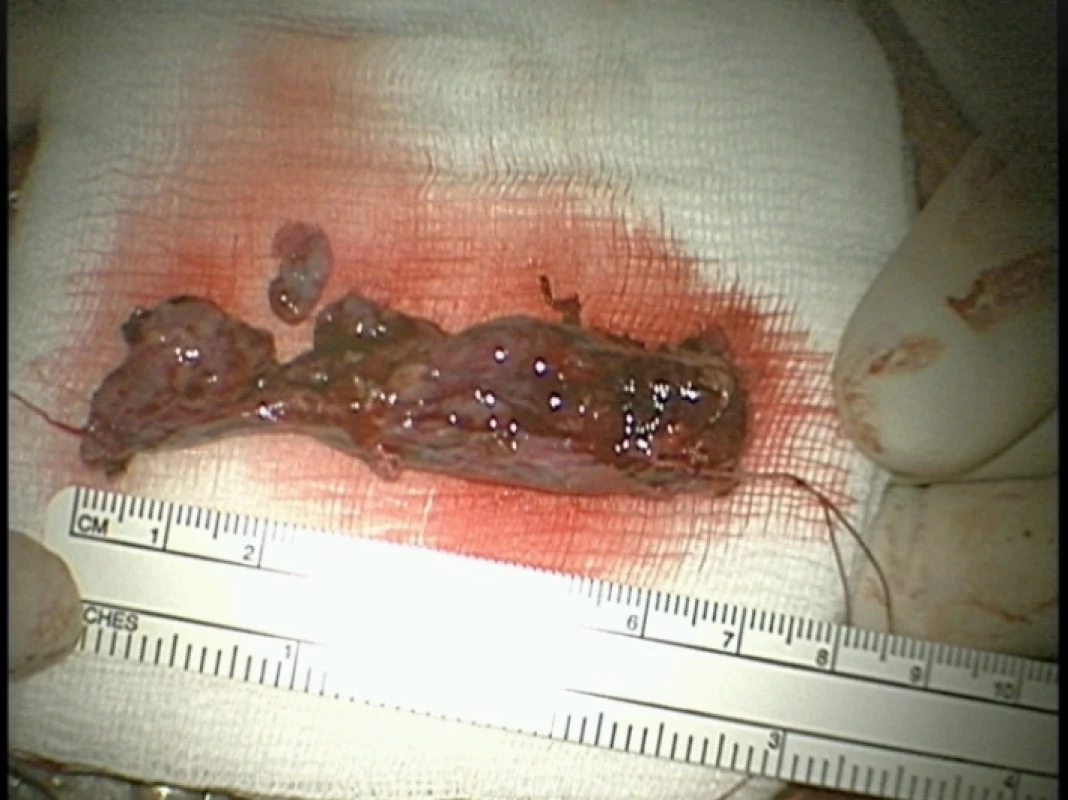
Ependymóm filum terminale (myxopapilárny ependymóm)
Myxopapilárne ependymómy sú pomaly rastúce gliómy pochádzajúce z diferencovaných buniek ependymálnej výstelky, ktoré sa vyskytujú v mladšom dospelom veku a nachádzajú sa takmer výlučne v oblasti conus medullaris a filum terminale. Sú samostatným variantom ependymómov. Prvýkrát boli popísané Kernohanom v roku 1932 [85].
Myxopapilárny ependymóm je najčastejším typom nádoru v oblasti conus medullaris [86]. Je najčastejším typom spinálnych ependymómov (27 %) a tretím najčastejším (15 %) typom intradurálnych extramedulárnych tumorov po meningeómoch a NST. Myxopapilárne ependymómy sa vyskytujú častejšie u mužov; pomer mužského a ženského pohlavia je 1,7 : 1 [87–99].
MR obraz ependymómu a jeho vzhľad perioperačne v operačnom mikroskope sú na obr. 17, resp. 18.
Obr. 22. Paraganglióm filum terminale, histologická mikrofotografia [107].
Fig. 22. Paraganglioma of the filum terminale, histological microimage [107].![Obr. 22. Paraganglióm filum terminale, histologická mikrofotografia [107].<br>
Fig. 22. Paraganglioma of the filum terminale, histological microimage [107].](https://pl-master.mdcdn.cz/media/image_pdf/f5446dc15a6093be26cf6159b9ed9760.png?version=1555333867)
Myxopapilárny ependymóm je nezhubný nádor charakterizovaný pomalým rastom. Často postihuje viac segmentov [95,98–101].
Ependymómy môžu zakladať vzdialené ložiská v rámci neurálnej osi (tzv. drop metastázy) [88,92,95,102].
Histológia
Zaradenie myxopapilárneho ependymómu medzi extramedulárne nádory je zaujímavé preto, že z hľadiska neuroektodermálneho pôvodu filum terminale sú ependymómy klasifikované ako intramedulárne lézie. Avšak z chirurgického hľadiska je ich rast v oblasti filum terminale extramedulárny [3].
Charakteristické histologické vlastnosti myxopapilárneho ependymómu súvisia s priamou apozíciou ependymálnych buniek na spojivové tkanivo vo filum terminale. Mucinózna zmena strómy spojivového tkaniva je pre myxopapilárny ependymóm charakteristická (obr.19) [95,97,103,104].
Paraganglióm filum terminale
Paragangliómy sú neuroendokrinné nádory vznikajúce z neuroepiteliálnych bunkových skupín nazývaných paraganglia [105,106]. Zaznamenaná je mierna prevaha mužského pohlavia v pomere 1,7 : 1 [105,107–110]. Paragangliómy sú benígne nádory rastúce z neuroepiteliálnych buniek (paraganglia). Majú potenciálne endokrinnú funkciu. Sú rozdelené do dvoch skupín: paraganglia tvorené dreňou nadobličky (85–90 %) a extraadrenálne paraganglia.
Extraadrenálne paragangliómy sú zriedkavé neuroendokrinné nádory, ktoré sa môžu objaviť kdekoľvek v tele. Vyskytujú sa najmä v karotickom teliesku a glomus jugulare. Extraadrenálny výskyt je menej častý. Spinálne paragangliómy sa zvyčajne vyskytujú v oblasti cauda equina. Na základe neuroendokrinného charakteru a pôvodu sa rozdeľujú na sympatické – vylučujúce katecholamíny, alebo parasympatické – nesekretorické. Obr. 20 znázorňuje paraganglióm v MR obraze, na obr. 21 môžeme vidieť fotografiu spinálneho paragangliómu bezprostredne po jeho resekcii.
Histológia
Paragangliómy vznikajú z buniek neuroektodermálneho pôvodu. Histopatologická diagnóza je založená na prítomnosti hlavných buniek (typ I) s granulovanou eozinofilnou cytoplazmou, tvoriacimi hniezda alebo lalôčiky známe ako ,,bunkové guľôčky“ (nem.„Zellballen“) obklopené jednou vrstvou sustentakulárnych buniek (typ II). Zellballen sú obklopené jemnou kapilárnou sieťou pripomínajúcou pseudorosety. Histologická diagnostika založená na rutinnom farbení je preto veľmi náročná [107,108,110–113]. Histologická mikrofotografia spinálneho paragangliómu je zobrazená na obr. 22. Kľúčové k stanoveniu diagnózy je imunohistochemické vyšetrenie [112,114]. Charakteristický vzhľad v T2 vážení pri MRi vyšetrení je v anglosaskej literatúre popisovaný aj ako ,,soľ a korenie“ (salt and pepper) a je výsledkom bohatej vaskulárnej povahy paragangliómov [115]. Niektorí autori odporúčajú u každého pacienta s nádorom tejto oblasti využiť pri MRi vyšetrení váženie gradientového echa (GE). Najpoužívanejšou GE sekvenciou je FLASH (fast long angle shot). Je rýchla a umožňuje aj 3D zobrazenie [110].
Recidíva ochorenia sa môže objaviť aj po rokoch, a preto by pacienti s paragangliómami mali byť sledovaní dlhodobo, najmä ak sa nedá dosiahnuť úplná chirurgická resekcia [105,108,109,116–118].
Diskusia
Podľa našich skúseností podporených literatúrou je z klinického obrazu IDEM nádorov bolesť často na určitú dobu iba jediným príznakom. Jej trvanie po stanovenie diagnózy, ktoré väčšinou súvisí s objavením sa ďalších príznakov ako napríklad paraparéza alebo radikulopatia, je variabilné. Niektorí autori dokonca udávajú, že radikulárne ťažkosti sa v určitej miere vyskytujú u každého pacienta s diagnózou IDEM [24]. Keďže ich prvotné štádiá sú veľmi podobné symptómom pri hernii disku, je potrebné mať túto diagnózu na zreteli, najmä keď je u pacienta zaznamenaná akákoľvek odchýlka od bežného klinického obrazu pri vertebrogénnom ochorení. Ahn vo svojom súbore pacientov s IDEM nádorom popisuje prípady dvoch pacientov, ktorí boli vzhľadom na klinické príznaky prvotne nesprávne diagnostikovaní a chirurgicky liečení pre degeneratívne ochorenie chrbtice (jeden pacient pre foraminálnu stenózu, druhý pre spondylolistézu). U oboch pacientov popisuje výrazné pooperačné zhoršenie klinického stavu nasledované dodiagnostikovaním a chirurgickou liečbou nádorov, z ktorej už pacienti profitovali. Dôvod zhoršenia klinického stavu po prvej operácii autori nevedia vysvetliť [24]. Podľa Goldbrunnera je priemerný čas pro stanovenie diagnózy 48 mesiacov [22]. Song et al udávajú priemerný čas 59,4 mesiaca [23]. Ahn et al popisujú čas od vzniku ťažkostí v rozmedzí od 1–120 mesiacov, v priemere 19,3 mesiaca [24]. Klinický obraz poskytuje cenné informácie pri diagnostických pochybnostiach a pri nejednoznačných nálezoch MR vyšetrenia (napr. veľmi čerstvé extrúzie disku imitujúce v MR obraze NST).
Zo zobrazovacích metód je MR pri IDEM nádoroch metóda voľby. Rozhodnúť sa pre operačný postup bez nej je možné iba pri závažných kontraindikáciách MR vyšetrenia. Pokiaľ je pacient na začiatku svojich ťažkostí vyšetrovaný inými zobrazovacími metódami, ako sú napríklad RTG, dynamické RTG, CT, CTA, je potrebné venovať zvýšenú pozornosť najmä abnormalitám oproti fyziologickému obrazu. Song udáva, že u 38–56 % pacientov s IDEM nádormi sa nájdu zmeny na natívnych RTG snímkach, napr. erózia pediklov, erózie tela stavca, kalcifikáty, rozšírenie nervového otvoru a iné [23]. Tieto vyšetrenia sú zároveň zdrojom na doplnenie informácií o nádore samotnom a o pomeroch v danej oblasti chrbtice (verifikujú lokalizáciu Adamkieviczovej artérie, výskyt iných patológií, príp. instabilitu), ktoré môžu modifikovať plánovanie alebo postup operácie (ovplyvnia prístup, rozhodovanie o prípadnej stabilizácii, atď.). Aj keď je MRi metódou voľby a pre plánovanie operácie má rozhodujúci význam, nie je postačujúca pre jednoznačné určenie definitívnej diagnózy (konkrétneho histologického typu IDEM nádoru). Z rádiologického hľadiska sa odporúča pri podozrení na IDEM nádor vždy doplniť sekvenciu gradientového echa, ktorá dokáže diagnózu spresniť. Keď je prítomná bolesť s iradiáciou do dolných končatín a MR driekovej chrbtice nevysvetlí príčinu, odporúča sa doplniť MR proximálnejších segmentov [24,25] a zamerať sa na klinický obraz, ktorý je pre správne stanovenie diagnózy smerodajný. Zobrazovacie metódy využívame aj pri lokalizácii tumoru na operačnej sále. Peroperačná skiaskopia je dôležitá z hľadiska plánovania operačného postupu a určovania výšky tumoru. Metóda odpočtu podľa tŕňových výbežkov môže byť nepresná. Zvýšená pozornosť je potrebná pri napolohovaní pacienta kedy môže dôjsť k posunu nádoru kraniálnym smerom. Aj napriek dodržaniu všetkých z uvedených zásad však môže dôjsť k posunu a tumor na očakávanom mieste nájsť nemusíme. Kim et al popísali 3 prípady pohybu schwanómu v porovnaní s predoperačnými snímkami. Vo všetkých prípadoch sa jednalo o posun kraniálnym smerom. Preto vždy, keď sa jedná o NST, autori odporúčajú myslieť na možnosť mobility tumoru. Na našom pracovisku sme zaznamenali posun nádoru aj u meningeómu. Preto je vhodné pri akýchkoľvek pochybnostiach počas operácie doplniť peroperačnú sonografiu. Peroperačná USG je užitočná v prvom rade pri plánovaní prístupu. USG každopádne realizujeme ešte pred durotómiou. Zabránime tak nepríjemnému zatekaniu krvi do subarachnoidálneho priestoru pri rozširovaní laminektómie po otvorení dura mater. Už počas laminektómie môžeme priebežne použiť USG, abysme verifikovali dostatočnosť prístupu, event. potrebu jeho rozšírenia niektorým smerom. Druhý význam súvisí so samotnou resekciou nádoru. Peroperačné USG sa využíva ako pri IDIM, tak pri IDEM nádoroch, po ich resekcii, za účelom verifikovania prípadného rezidua nádoru. Nápomocná môže byť aj spinálna navigácia a peroperačné MR vyšetrenie [28,41].
Na základe záverov uvádzaných štúdií, ako aj na základe osobných skúseností z praxe, preferujeme pri operatíve IDEM tumorov zadný prístup, laminektómiu zo stredného rezu, v prípade potreby rozšírenú o facetektómiu. Väčšinu nádorov považuje prevaha autorov za resekovateľnú z tohto prístupu. Pri veľkých ventrálne uložených meningeómoch (najmä v krčnej oblasti) prichádza do úvahy predný prístup. Rešpektujeme výhody vyplývajúce z tohto prístupu. Pri krčnej korpektómii troch a viacerých segmentov je potrebné operačný výkon doplniť o náhradu tela a zadnú stabilizáciu. Ak tumor zasahuje do hrudnej alebo brušnej dutiny, je pri jeho odstránení možná spolupráca s chirurgom.
Vďaka novým technologiám je široko diskutovaný rozsah prístupovej cesty od miniinvazívnej po rozsiahlu dekompresiu. Hemilaminektómiu pomocou operačného mikroskopu, ktoú popularizovali v 80. rokoch minulého storočia najmä Eggert et al [34–37], nepovažujeme za prístup voľby. Ukázalo sa, že riziko instability je menšie iba pri monosegmentálnych hemilaminektómiách, a preto má pri operatíve IDEM nádorov obmedzené využitie. Ďaľším dôvodom, pre ktorý preferujeme pri operačnom prístupe laminektómiu, je menšie riziko pooperačného zhoršenia neurologického stavu pri monosegmentálnom prístupe ako pri unilaterálnom prístupe, napriek väčšiemu riziku vzniku instability. Tento fakt považujeme za najdôležitejší. Zhoršenie neurologického deficitu z malého prístupu môže byť nevratné v porovnaní s prípadnou kyfotizáciou úseku alebo instabilitou, ktorú je možné vyriešiť stabilizačným výkonom v druhej dobe. V prípade naznačenej instability pred operáciou, nálezu spondylolistézy alebo potreby excesívneho odstránenia kostných štruktúr v rámci prístupu preferujeme operačný výkon rozšíriť o stabilizačný výkon v tej istej dobe. Pri vlastnej resekcii nádoru je nevyhnutná mikroskopická operačná technika. Niektoré štúdie preukázali, že nie je rozdiel v radikalite resekcie IDEM nádorov pri mikroskopickej resekcii. Ukázalo sa však, že je signifikantne nižšie riziko zhoršenia neurologického statusu bezprostredne po operácii s využitím operačného mikroskopu. V odbornej literatúre je popisovaná endoskopicky asistovaná resekcia nádoru umožňujúca pohľad na rozhranie tumoru a ventrálneho povrchu miechy s možnosťou minimalizovať retrakciu miechy [47,49]. S týmto typom operatívy nemáme na našom pracovisku skúsenosti. Endoskopické operácie na našom pracovisku sú zatiaľ vyhradené pre operatívu hernií diskov.
Neuromonitoring evokovaných potenciálov zahŕňa monitorovanie SSEP, motorických evokovaných potenciálov (MEP) a D-vlny. Pri operáciách IDEM nádorov je neodmysliteľnou súčasťou. Pri malých, dorzálne uložených tumoroch je prínos neuromonitoringu otázny, nakoľko riziko neurologickej deteriorácie po operácii je minimálne [5,22].
Kavitrónová ultrazvuková odsávačka je v niektorých prípadoch nevyhnutná na šetrný debulking nádoru s minimalizáciou manipulácie miechy a nervových štruktúr. Jedná sa predovšetkým o ventrálne uložené nádory z tuhšou konzistenciou. Laser podľa našich skúsenosti i skúseností niektorých autorov umožňuje bezpečnú koaguláciu povrchu tumoru a evaporáciu mäkkých tkanív obsahujúcich vodu. Tým dochádza k retrakcii objemu tumoru a k jeho bezpečnejšiemu odstráneniu. Keďže väčšina IDEM nádorov je úplne odstrániteľná, cieľom operácie je ich úplné odstránenie. Ak je to nutné, pri nádoroch nervových obalov odstraňujeme aj koreň, z ktorého nádor vyrastá.
Za negatívne prognostické faktory je považovaná veľká dĺžka trvania ťažkostí pred operáciou a ventrálne a proximálnejšie uloženie nádoru. Ahn et al však vo svojej práci tieto faktory nepotvrdili ako prognosticky negatívne a za hlavný faktor považujú množstvo nádoru v axiálnom reze chrbtice. Čím väčšiu časť spinálneho kanála tumor vypĺňa, tým je štatisticky väčšie riziko horšieho funkčného výsledku po operácii [24].
Keďže k zlepšeniu neurologického stavu došlo aj u pacientov vo vyššom veku, s ťažkým neurologickým deficitom a dlhotrvajúcimi ťažkosťami, pacient s diagnózou IDEM nádoru by mal byť operovaný vždy [5,22–24].
Riziko recidívy je pri väčšine typov nádorov po radikálnej resekcii nízke, je skôr závislé od histologického typu nádoru. Za rizikové faktory recidívy sa považujú ventrálna poloha, extradurálne prerastanie tumoru a diagnóza ependymómu filum terminale. [22,119,120]. Riziko recidívy po operácii IDEM nádoru je 1–16 % a platí, že až 46 % recidív je spôsobených tumormi, ktoré zo svojej histologickej povahy recidivujú častejšie. Medzi recidívami u meningeómov a NST nie je zaznamenaný významný rozdiel. Významný rozdiel nie je ani v počte recidív pri meningeómoch operovaných s resekciou dura mater a bez nej. Klekamp a Samii zaznamenali recidívu ependymómov v 29,5 % prípadov do 5 rokov od kompletnej resekcie, čo je výrazne viac ako pri ostatných typoch IDEM nádorov [82].
K najčastejším komplikáciám patrí hematóm v operačnej rane a likvorea. K menej častým patrí infekcia rany, pooperačná instabilita a zhoršenie neurologického deficitu. Vzniku hematómu predchádzame dôslednou hemostázou a použitím drénu. Riziko likvorei, ako bolo uvedené, minimalizujeme dôslednou sutúrou dura mater s plastikou, použitím tkanivových lepidiel, vlastného tuku a odloženej vertikalizácie (48 h po operácii). Napriek týmto opatreniam nie je vznik likvorovej fistuly vzácny. Song et al zaznamenali likvoreu až u 16,7 % pacientov po operácii IDEM nádoru [19]. Išlo však o pomerne malý súbor 12 pacientov. Štandardne sa podávajú antibiotiká v perioperačnom období ako prevencia včasnej infekcie rany.
Pri preexistujúcej instabilite alebo spondylolistéze v operovanom segmente volíme stabilizáciu v jednej dobe spolu s resekciou nádoru. Riziko zhoršenia neurologického deficitu minimalizujeme dostatočne priestranným prístupom, šetrnou manipuláciou s nervovými štruktúrami pri mikroskopickej resekcii nádoru a peroperačným neuromonitoringom evokovaných potenciálov.
Pacientov sledujeme v 3, 6, 12 a 24 mesačných kontrolách. Kontrolné MR pri štandardnom priebehu (stabilizovanom alebo lepšiacom sa klinickom náleze) odporúčame po 3, 12 a 24 mesiacoch. Následne observuje pacienta neurológ.
Onkologická liečba (rádioterapia, veľmi zriedka chemoterapia) sa u týchto typov nádorov štandardne nevyužíva. Vyhradená je pre pacientov s neúplnou resekciou, po operácii pre recidívu IDEM nádoru a pri vzácnych malignitách v tejto oblasti. Jej význam je však pre vzácnosť výskytu takýchto typov nádorov v IDEM oblasti predmetom diskusie. Prognóza je u väčšiny pacientov výborná a tieto typy nádorov má zmysel operovať aj vo vyššom veku, pri dlhotrvajúcich ťažkostiach a pri ťažkom motorickom deficite.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Pavol Moják
Neurochirurgické oddělení, Krajská nemocnice T. Bati, a. s.
Havlíčkovo nábřeží 600
760 01 Zlín
Přijato k recenzi: 5. 11. 2018
Přijato do tisku: 11. 2. 2019
MUDr. Pavol Moják
#other:30#
Pavol Moják ukončil štúdium na Lekárskej fakulte Univerzity Komenského v Bratislave v roku 2007. Svoju profesionálnu kariéru začal ako sekundárny lekár na Neurochirurgickej klinike Fakultnej nemocnice v Nitre. Od roku 2016 pracuje na neurochirurgickom oddelení Krajskej nemocnice Tomáša Baťu v Zlíne, v súčasnosti v pozícii vedúceho lekára oddelenia. V roku 2017 ukončil špecializačné štúdium v odbore neurochirurgia na Lekárskej fakulte Univerzity Komenského v Bratislave.
Sources
1. Rychlý B. Histopatológia nádorov chrbtice a miechy. Neurol praxi 2009; 10(4): 213–215.
2. Kalina P. Klinické prejavy nádorov chrbtice a miechy. Neurol praxi 2009; 10(4): 209–212.
3. Náhlovský J (eds). Neurochirurgie. Praha: Galén 2006.
4. Gebauer GP, Farjoodi P, Sciubba DM et al. Magnetic resonance imaging of spine tumors: classification, differential diagnosis, and spectrum of disease. J Bone Joint Surg Am 2008; 90(Suppl 4): 146–162. doi: 10.2106/JBJS.H.00825.
5. Arnautovic K, Arnautovic A. Extramedullary intradural spinal tumors: a review of modern diagnostic and treatment options and a report of a series. Bosn J Basic Med Sci 2009; 9(Suppl 1): S40–S45. doi: 10.17305/bjbms.2009.2755.
6. Šteňo J, Illéš R. Súčasné princípy chirurgického liečenia nádorov chrbtice a miechy. Neurol praxi 2009; 10(4): 224–227.
7. Thamburay VA. Spinal cord tumors: textbook of contemporary neurosurgery. New Delhi: Jaypee Brothers Medical Publishers 2012.
8. Murphey MD, Smith WS, Smith SE et al. From the archives of the AFIP. Imaging of musculoskeletal neurogenic tumors: radiologic-pathologic correlation. Radiographics 1999; 19(5): 1253–1280. doi: 10.1148/radiographics.19.5.g99se101253.
9. Ross JS, Brant-Zawadzki M, Moore KR et al. Diagnostic imaging: spine. 1st ed. Salt Lake City: Amirsys 2004.
10. Hufana V, Tan JS, Tan KK. Microsurgical treatment for spinal tumors. Singapore Med J 2005; 46(2): 74–77.
11. Albanese V, Platania N. Spinal intradural extramedullary tumors. Personal experience. J Neurosurg Sci 2002; 46(1): 18–24.
12. Helseth A, Mork SJ. Primary intraspinal neoplasms in Norway 1955 to 1986. A population-based survey of 467 patients. J Neurosurg 1989; 71(6): 842–845.
13. Stawicki SP, Guarnaschelli JJ. Intradural extramedullary spinal cord tumors: a retrospective study of tumor types, locations, and surgical outcomes. [online]. Int J Neurosurg 2007; 4(2). Available from URL: https://print.ispub.com/api/0/ispub-article/5818.
14. Mahalingam SS. Victor Horsley and spinal surgery. J Spinal Surg 2016; 3(2): 68–69.
15. Tan TC, Black PM. Sir Victor Horsley (1857–1916): pioneer of neurological surgery. Neurosurgery 2002; 50(3): 607–612.
16. Griessenauer CJ, Tubbs RS, Shoja MM et al. Alfred W. Adson (1887–1951): his contributions to surgery for tumors of the spine and spinal cord in the context of spinal tumor surgery in the late 19th and early 20th centuries. J Neurosurg Spine 2013; 19(6): 750–758. doi: 10.3171/2013.9.SPINE13220.
17. Jagadesh BK, Reddy S, Ponraj S et al. clinicopathological study of intradural extramedullary spinal cord tumors. In Sch J Med Case Rep 2014; 2(2): 108–111.
18. Van Goethem JW, van den Hauwe L, Özsarlak Ö. Spinal tumors. Eur J Radiol 2004; 50(2): 159–176. doi: 10.1016/j.ejrad.2003.10.021.
19. Bhatt M, Lieberman G. Spinal tumors. [online]. Lieberman´s eRadiology Learning Sites 2009. Available from URL: http://eradiology.bidmc.harvard.edu/LearningLab/central/Bhatt.pdf.
20. Iacob G. Spinal meningiomas. Personal experience and review of literature. Romanian Neurosurg 2014; 21(2): 147–161. doi: https://doi.org/10.2478/romneu-2014-0016.
21. Govind M, Radheyshyam M, Achal S et al. Intradural extramedullary spinal cord tumors. Romanian Neurosurgery 2016; 30(1): 106–112. doi: 10.1515/romneu-2016-0017.
22. Goldbrunner R. Intradural extramedullary tumors. In: Tonn JC, Westphal M, Rutka JT. Oncology of CNS tumors. Berlin, Heidelberg: Springer 2010 : 709–718.
23. Song KW, Shin SI, Lee JY et al. Surgical results of intradural extramedullary tumors. Clin Orthop Surg 2009; 1(2): 74–80. doi: 10.4055/cios.2009.1.2.74.
24. Ahn DK, Park HS, Choi DJ et al. Surgery for spinal intradural extramedullary tumors. Clinics Orthop Sur 2009; 1(3): 165–172. doi: 10.4055/cios.2009.1.3.165.
25. Shin BJ, Lee JC, Yoon TK et al. Surgical treatments of intradural extramedullary tumor. J Korean Soc Spine Surg 2002; 9(3): 230–237.
26. Jung KW, Park KH, Ha J et al. Primary spinal cord tumors in Korea. Cancer Res Treat 2015; 47(2): 166–172. doi: 10.4143/crt.2014.017.
27. Bhat AR, Kirmani AR, Wani MA et al. Incidence, histopathology, and surgical outcome of tumors of spinal cord, nerve roots, meninges, and vertebral column – data based on single institutional (Sher-i-KashmirInstitute of Medical Sciences) experience. J Neurosci Rural Pract 2016; 7(3): 381–391. doi: 10.4103/0976-3147.181489.
28. Kim SB, Kim AS, Jang JS et al. Mobility of Schwannoma at spine. J Korean Neurosurg Soc 2010; 47(1): 64–67. doi: 10.3340/jkns.2010.47.1.64.
29. Rudinský B. Manažment liečby pacientov s nádormi chrbtice s pohľadu spinálneho chirurga. Onkológia (Bratislava) 2008; 3(4): 253–256.
30. McCulloch JA, Young PH. Essentials of Spinal Microsurgery. 7th ed. Philadelphia: LWW 1998 : 668.
31. Menezes AH, Sonntag VK (eds). Principles of spinal surgery. New York: McGraw-Hill Healthcare 1996 : 817.
32. Vaccaro AR, Betz RR, Zeidman SM. Principles and practice of spine surgery. 1st ed. Phliladelphia: Mosby 2002 : 888.
33. Němec M. Peroperační neurofyziologické monitorování míchy. Neurol pro praxi 2008; 9(2): 79–82.
34. Sim JE, Noh SJ, Song YJ et al. Removal of intradural-extramedullary spinal cord tumors with unilateral limited laminectomy. J Korean Neurosur Soc 2008; 43(5): 232–236. doi: 10.3340/jkns.2008.43.5.232.
35. Tandra N, Tamrakar BB, Dapeng L et al. Removal of intradural-extramedullary spinal cord tumors with unilateral limited laminectomy. J Dent Med Sci 2018; 13(6): 62–64.
36. Chiou SM, Eggert HR, Laborde G et al. Microsurgical unilateral approaches for spinal tumour surgery: eight years' experience in 256 primary operated patients. Acta Neurochir (Wien) 1989; 100(3–4): 127–133.
37. Eggert HR, Scheremet R, Seeger W et al. Unilateral microsurgical approaches to extramedullary spinal tumours. Operative technique and results. Acta Neurochir (Wien) 1983; 67(3–4): 245–253.
38. Bertalanffy H, Mitani S, Otani M et al. Usefullness of hemilaminectomy for microsurgical management of intraspinal lesions. Keio J Med 1992; 41(2): 76–79.
39. Tredway TL, Santiago P, Hrubes MR et al. Minimally invasive resection of intradural-extradullary spinal neoplasms. Neurosurgery 2006; 58(Suppl 1): 52–58.
40. Jurek P, Linzer P, Filip M. Intraoperative sonography in spinal tumor surgery. Prezentováno na: XXIII. postgraduálním kurzu v neurochirurgii 2016, Hradec Králové, Česká republika.
41. Šulla I, Šanta M, Fagula J. Twodimensional ultrasonoghraphy during spinal surgery. Zentbl Neurochir 1990; 51(3): 160–163.
42. Jeon JH, Hwang HS, Jeong JH et al. Spinal schwannoma: analysis of 40 cases. J Korean Neurosurg Soc 2008; 43(3): 135–138.
43. Wu D, Ba Z, Huang Y et al. Totally cystic schwannoma of the lumbar spine. Orthopedics 2013; 36(5): e679–e682. doi: 10.3928/01477447-20130426-36.
44. Yeh HM, Leung JH, Huang KC et al. Atypical hemorrhagic spinal schwannoma. J Radiol Sci 2011; 36(9): 191–194.
45. Osborn AG. Intradural extramedullary tumors, cysts, and tumor like masses. In: Diagnostic Neuroradiology. 2nd ed. St Louis: Mosby 1994 : 895–906.
46. Hsieh CT, Tsai WC, Liu MY. Intradural lumbar cystic schwannoma. Neurosciences (Riyadh) 2011;16(4): 366–368.
47. Yamahata H, Yamaguchi S, Mori M et al. Ventral schwannoma of the thoracolumbar spine. Asian Spine J 2013; 7(4): 339–344. doi: 10.4184/asj.2013.7.4.339.
48. Ueda R, Yoshida K, Kawase T. Intradural C-1 ventral root schwannomas treated by surgical resection via the lateral suboccipital transcondylar approach: three case reports. Neurol Med Chir (Tokyo) 2006; 46(6): 298–301.
49. Mahore A, Chagla A, Goel A. Giant ventral midline schwannoma of cervical spine: agonies and nuances. J Korean Neurosurg Soc 2010; 47(6): 454–457. doi: 10.3340/jkns.2010.47.6.454.
50. Kanemoto Y, Ohnishi H, Koshimae N et al. Ventral T-1 neurinoma removed via hemilaminectomy without costotransversectomy: case report. Neurol Med Chir (Tokyo) 1999; 39(9): 685–688.
51. Turgut M, Erkus M. Giant schwannoma of the cauda equina: case report and review of the literature. Zentralbl Neurochir 2008; 69(2): 99–101. doi: 10.1055/s-2008-1073124.
52. Karagoz Guzey F, Bas NS, Emel E et al. Planning of surgical management of giant spinal schwannomas: report of four cases. Turkish Neurosurg 2006; 16(3): 139–144.
53. Stepanov S, Kozic D, Prvulovic N. An unusual MR finding of spinal schwannoma. Arch Oncol 2008; 17(3): 86–87. doi: 10.2298/AOO0904086S.
54. Parmar H, Patkar D, Gadani S et al. Cystic lumbar nerve sheath tumours: MRI features in five patients. Australas Radiol 2001; 45(2): 123–127.
55. Santhosh K, Kesavadas C, Thomas B et al. Fluid-fluid levels in cystic lumbosacral schwannomas: a report of three cases. Singapore Med J 2009; 50(1): 16–21.
56. Shiono T, Yoshikawa K, Iwasaki N. Huge lumbar spinal cystic neurinomas with unusual MR findings. AJNR Am J Neuroradiol 1995; 16(Suppl 4): 881–882.
57. Thamburaj K, Radhakrishnan VV, Thomas B et al. Intratumoral microhemorrhages on T2 - weighted gradient-echo imaging helps differentiate vestibular schwannoma from meningioma. AJNR Am J Neuroradiol 2008; 29(3): 552–557. doi: 10.3174/ajnr.A0887.
58. Celli P, Cervoni L, Tarantino R et al. Primary spinal malignant schwannomas: clinical and prognostic remarks. Acta Neurochir (Wien) 1995; 135(1): 52–55.
59. Safaee M, Parsa AT, Barbaro NM et al. Association of tumor location, extent of resection, andneurofibromatosis status with clinical outcomes for 221 spinal nerve sheath tumors. Neurosurg Focus 2015; 39(2): 1–8.
60. Antinheimo J, Sankila R, Carpén O et al. Population based analysis of sporadic and type 2 neurofibromatosis associated meningiomas and schwannomas. Neurology 2000; 54(1): 71–76.
61. Levy WJ Jr, Bay J, Dohn D. Spinal cord meningioma. J Neurosurg 1982; 57(6): 804–812. doi: 10.3171/jns.1982.57.6.0804.
62. Solero CL, Fornari M, Giombini S et al. Spinal meningiomas: review of 174 operated cases. Neurosurgery 1989; 25(2): 153–160.
63. Keskin F, Kalkan E, Karatas Y et al. A case of upper thoracic spinal multiple meningiomas. Neurosurg Q 2013; 23(3): 224–225.
64. Yoshiura T, Shriee DA, Pilcher WH et al. Cervical spinal meningioma with unusual MR contrast enhancement. AJNR Am J Neuroradiol 1998; 19(6): 1040–1042.
65. Deen HG Jr, Scheithauer BW, Ebersold MJ. Clinical and pathological study of meningiomas of the first two decades of life. J Neurosurg 1982; 56(3): 317–322. doi: 10.3171/jns.1982.56.3.0317.
66. Glasier CM, Husain MM, Chadduck W et al. Meningioma in children: MR and histopathological findings. AJNR Am J Neuroradiol 1993; 14(1): 237–241.
67. Mawrin C, Perry A. Pathological classification and molecular genetics of meningiomas. J Neurooncol 2010; 99(3): 379–391. doi: 10.1007/s11060-010-0342-2.
68. Mclendon RE, Rosenblum MK, Bigner DD. Russell and Rubinstein’s pathology of tumors of the nervous system. Boca Raton: CRC Press 2006 : 1104.
69. Roux FX, Nataf F, Pinaudeau M et al. Intraspinal meningiomas: review of 54 cases with discussion of poor prognosis factors and modern therapeutic management. Surg Neurol 1996; 46(5): 458–463.
70. Preston-Martin S, Monroe K, Lee PJ et al. Spinal meningiomas in women in Los Angeles County: investigation of an etiological hypothesis. Cancer Epidemiol Biomarkers Prev 1995; 4(4): 333–339.
71. Lee JH. Meningiomas: diagnosis, treatment, and outcome. London: Springer-Verlag 2009 : 639.
72. Hafiz MG, Rahman MR, Yeamin MB. Intradural intramedullary spinal cord meningioma in a seven years old female child. Mymensingh Med J 2013; 22(1): 180–185.
73. Moriuchi S, Nakagawa H, Yamada M et al. Intramedullary spinal cord meningioma: a case report. Neurol Med Chir (Tokyo) 1996; 36(12): 888–892.
74. Sahni D, Harrop JS, Kalfas IH et al. Exophytic intramedullary meningioma of the cervical spinal cord. J Clin Neurosci 2008; 15(10): 1176–1179. doi: 10.1016/j.jocn.2007.08.025.
75. Yuan D, Liu D, Yuan XR et al. Intramedullary thoracic spinal cord meningioma: a rare case report and review of the literature. J Neurol Surg A Cent Eur Neurosurg 2013; 74(Suppl 1): 136–139. doi: 10.1055/s-0032-1330959.
76. Teo M, Zrinzo L, King A et al. Giant extradural sacral meningioma. Acta Neurochir (Wien) 2010; 152(3): 485–488. doi: 10.1007/s00701-009-0414-2.
77. Galgano MA, Beutler T, Brooking A et al. Spinal meningiomas: a review. J Spine 2014; 3(1): 157.
78. Gezen F, Kahraman S, Canakci Z et al. Review of 36 cases of spinal cord meningioma. Spine (Phila Pa 1976) 2000; 25(6): 727–731.
79. Ciurea AV, Tascu A, Palade CL et al, Microsurgical approach in a thoracic meningioma. Case report. Romanian Neurosurg 2010; XVII(1): 81–87.
80. Matsumoto S, Hasuo K, Uchino A et al. MRI of intraduralextramedullary spinal neurinomas and meningiomas. Clin Imaging 1993; 17(1): 46–52.
81. Brown MH. Intraspinal meningioma: a clinical and pathologic study. Arch Neur Psych 1942; 47(2): 271–292. doi:10.1001/archneurpsyc.1942.02290020087008.
82. Klekamp J, Samii M. Surgical results for spinal meningiomas. Surg Neurol 1999; 52(6): 552–562.
83. Gamache FW Jr, Wang JC, Deck M et al. Unusual appearance of an en plaque meningioma of the cervical spinal canal. A case report and literature review. Spine (Phila Pa 1976) 2001; 26(5): E87–E89.
84. Salpietro FM, Alafaci C, Lucerna S et al. Do spinal meningiomas penetrate the pial layer? Correlation between magnetic resonance imaging and microsurgical findings and intracranial tumor interfaces. Neurosurgery 1997; 41(1): 254–257.
85. Kernohan JW. Primary tumors of the spinal cord and intradural filum terminale. Penfield W. Cytology and cellular pathology of the nervous system. New York: Paul B.Hoeber 1932 : 993–1035.
86. Quiles AM, Roselló EG, Laguillo G et al. A Comprehensive review of intraspinal tumors: diagnostic, classification and radio-pathologic correlation. [online]. Available form URL: http://pdf.posterng.netkey.at/download/index.php?module=get_pdf_by_id&poster_id=11702.
87. Wager M, Lapierre F, Blanc JL et al. Cauda equina tumors: a French multicenter retrospective review of 231 adult cases and review of the literature. Neurosurg Rev 2000; 23(3): 119–129.
88. Meneses MS, Leal AG, Periotto LB et al. Primary filum terminale ependymoma: a series of 16 cases. Arq Neuropsiquiatr 2008; 66(3A): 529–533.
89. Fearnside MR, Adams CB. Tumors of the cauda equina. J Neurol Neurosurg Psychiatry 1987; 41(1): 24–31.
90. Shimada Y, Miyakoshi N, Kasukawa Y et al. Clinical features of cauda equina tumors requiring surgical treatment. Tohoku J Exp Med 2006; 209(1): 1–6
91. Kumar V, Solanski RS. Myxopapillary ependymoma of the filum terminale. Pediatr Radiol 2009; 39(4): 415. doi: 10.1007/s00247-008-1100-x.
92. Wippold FJ, Smirniotopoulos JG, Morgan CJ et al. MR imaging of myxopapillary ependymoma: findings and value to determine extent of tumour and its relation to intraspinal structures. AJR Am J Roentgenol 1995; 165(5): 1263–1267. doi: 10.2214/ajr.165.5.7572515.
93. Carragher AM, Heatley MK, Mirakhur M et al. A clinicopathological review of spinal ependymomas in Northern Ireland. Ulster Med J 1990; 59(1): 51–54.
94. Rewcastle NB, Berry K. Neoplasms of the lower spinal canal. Neurology 1964; 14 : 608–615.
95. Kim JS, Choi KC, Jung B et al. Myxopapillary ependymoma of filum terminale mimicking nerve sheath tumor. Kor J Spine 2008; 5(2): 95–98.
96. McCormick PC, Torres R, Post KD et al. Intramedullary ependymoma of the spinal cord. J Neurosurg 1990; 72(4): 523–532. doi: 10.3171/jns.1990.72.4.0523.
97. Do-Dai DD, Rovira MJ, Ho VB et al. Childhood onset of myxopapillary ependymomatosis: MR features. AJNR Am J Neuroradiolog 1995; 16(Suppl 4): 835–839.
98. Sonneland PR, Scheithauer BW, Onofrio BM. Myxopapillary ependymoma: a clinicopathologic and immunocytochemical study of 77 cases. Cancer 1985; 56(4): 883–893.
99. Macedo LT, Rogerio F, Pereira E.B et al. Cerebrospinal tumor dissemination in a patient with myxopapillary ependymoma. J Clin Oncol 2011; 29(32): e795–e798. doi: 10.1200/JCO.2011.36.6625.
100. Wiestler OD, Schiffer D, Coon SW et al. Myxopapillary ependymoma. In: Kleihues P, Cavenee WK (eds). Pathology and Genetics Tumors of the Nervous System. Lyon: IARC Press 2000 : 78–79.
101. Yoshii S, Shimizu K, Ido K et al. Ependymoma of the spinal cord and the cauda equina region. J Spinal Disord 1999; 12(2): 157–161.
102. Lin YH, Huang CI, Wong TT et al. Treatment of spinal cord ependymomas by surgery with or without postoperative radiotherapy. J Neurooncol 2005; 71(2): 205–210. doi: 10.1007/s11060-004-1386-y.
103. Sato H, Ohmura K, Mizushima M et al. Myxopapillary ependymoma of the lateral ventricle: a study on the mechanism of its stromal myxoid change. Acta Pathol Jpn 1983; 33(5): 1017–1025.
104. Rawlinson DG, Herman MM, Rubinstein LJ. The fine structure of a myxopapillary ependymoma of the filum terminale. Acta Neuropathol 1973; 25(1): 1–13.
105. Landi A, Mancarella C, Marotta N et al. Diagnosis and treatment of paragangliomas of the filum terminale, an extremely rare entity: personal experience and literature review. J Spine 2013; S3(1): 1–4. doi:10.4172/2165-7939.S3-001.
106. Kohn A. Die paraganglien. Arch Mikrobiol 1903; 62 : 263–265.
107. Kalani MA, Cchang SD, Vu B. Paraganglioma of the filum terminale: case report, pathology and review of the literature. Cureus 2015; 7(10): e354. doi: 10.7759/cureus.354.
108. Brock RS, Noleto G, Oliveira MF et al. Paraganglioma of the filum terminale – a case report. J Spine Neurosurg 2016; 5(2): 1–3.
109. Aggarwal S, Deck JH, Kucharczyk W. Neuroendocrine tumor (paraganglioma) of the cauda equina: MR and pathologic findings. AJNR Am J Neuroradiol 1993; 14(4): 1003–1007.
110. Ho WT, Tai KS. Magnetic resonance imaging evaluation of paraganglioma in the cauda equina. J HK Coll Radiol 2002; 5, 230–232.
111. Herman M, Pozzi-Mucelli RS, Skrap M. Paraganglioma of the cauda equina: case report and review of the MRI features. Acta Univ Palacki Olomouc Fac Med 1998; 141 : 27–30.
112. Hong JY, Hur CY, Modi HN et al. Paraganglioma in the cauda equina. A case report. Acta Orthop Belg 2012; 78(3): 418–423.
113. Midi A, Yener AR, Sav A et al. Cauda equina paraganglioma. Turkish Neurosurg 2012; 22(3): 353–359. doi: 10.5137/1019-5149.JTN.3389-10.1.
114. Moran CA, Rush W, Mena H. Primary spinal paragangliomas: a clinicopathological and immunohistochemical study of 30 cases. Histopathology 1997; 31(2): 167–173.
115. Koeller KK, Rosenblum RS, Morrison AL. Neoplasms of the spinal cord and filum terminale: radiologic-pathologic correlation. Radiographics 2000; 20(6): 1721–1749. doi: 10.1148/radiographics.20.6.g00nv151721.
116. da Silva ME, Carvalho MJ, Rodrigues AP et al. Rare vertebral metastasis in a case of hereditary paraganglioma. Hered Cancer Clin Pract 2012; 10(1): 12. doi: 10.1186/1897-4287-10-12.
117. Ilgren EB, Teddy PJ. Chemodectoma of the cauda equina: case report. Clin Neuropathol 1984; 3(4): 148–152.
118. Russel CD, Jander HP, Dubovsky EV. Demonstration of a chemodectoma by perfusion scanning: case report. J Nucl Med 1975; 16(6): 472–473.
119. El-Mahdy W, Kane PJ, Powell MP et.al. Spinal intradural tumours: Part I. Extramedullary. Br J Neurosurg 1999; 13(6): 550–557.
120. Asazuma T, Toyama Y, Watanabe M et al. Clinical features associated with recurrence of tumours of the spinal cord and cauda equina. Spinal Cord 2003; 41(2): 85–89. doi: 10.1038/sj.sc.3101394.
121. Wikipedia. Sir Victor Alexander Haden Horsley. [online]. Available form URL: https://en.wikipedia.org/wiki/Victor_Horsley.
122. Ball JR. Intradural spinal cord tumours. [online]. Available from URL: http://spinesurgeon.sydney/services/spinal-tumours/intradural-spinal-cord-tumours/.
123. Wein S. Spinal neurofibroma. [online]. Available from URL:https://radiopaedia.org.Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2019 Issue 2-
All articles in this issue
- Intradurálne extramedulárne nádory chrbtice
- Roztroušená skleróza mozkomíšní, úloha střevní mikrobioty v poškozujícím zánětu
- Genetické a neurobiologické aspekty komorbidního výskytu poruch autistického spektra a epilepsie
- Extra-intrakraniální bypass iniciovaný rehabilitačním lékařem pro kognitivní deterioraci
- Traumatické pseudoaneuryzma arterie temporalis superficialis
- Roztroušená skleróza mozkomíšní, těhotenství, mateřství a kojení
- Roztroušená skleróza a těhotenství z pohledu gynekologa – možnosti asistované reprodukce
- Moderní mikrochirurgie jako trvalé, bezpečné a šetrné řešení nekrvácejících mozkových výdutí
- Explantace stimulátoru nervus vagus odpovídající protokolu vyšetření magnetickou rezonancí
- Obecné pohyby a neurologický vývoj raného věku u dětí s novorozeneckou hypoglykemií
- Srovnání kosmetického efektu krátkého podélného a příčného kožního řezu při karotické endarterektomii
- Rychlá diagnostika chemokinu CXCL13 v mozkomíšním moku u pacientů s neuroboreliózou
- Genetika nervosvalových onemocnění
- Analýza dat v neurologii LXXIV. - Neparametrický Spearmanův koeficient korelace
- Recenze knih
- Doc. Vladimír Škorpil, 100 let od narození zakladatele naší elektromyografie
- Hraje leptin roli v rozvoji intrakraniálních meningeomů?
- Srovnávací studie pacientů s myastenií České a Slovenské republiky
- Změny v obsahu esenciálních a stopových prvků v lidských degenerujících meziobratlových ploténkách nekorespondují s klinickým stavem pacientů
- Jak náhrada extracelulárního sodíku ovlivňuje distribuci rychlosti vedení periferním nervem u krysy
- Aneuryzmatické subarachoidální krvácení v těhotenství – úspěšný kliping po selhání koilingu
- Klíšťová meningitida komplikovaná kardioembolickým intraluminálním trombem v krkavici a mozkovou mrtvicí
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intradurálne extramedulárne nádory chrbtice
- Rychlá diagnostika chemokinu CXCL13 v mozkomíšním moku u pacientů s neuroboreliózou
- Genetika nervosvalových onemocnění
- Roztroušená skleróza a těhotenství z pohledu gynekologa – možnosti asistované reprodukce
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

