-
Medical journals
- Career
Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
Authors: S. Kurčová 1; K. Menšíková 1; M. Kaiserová 1; E. Kurča 2; L. Tučková 3; P. Kaňovský 1
Authors‘ workplace: Centrum pro diagnostiku a léčbu neurodegenerativních onemocnění, Neurologická klinika LF UP a FN Olomouc 1; Neurologická klinika JLF a UN Martin, Slovenská republika 2; Ústav klinické a molekulární patologie, LF UP a FN Olomouc 3
Published in: Cesk Slov Neurol N 2016; 79/112(3): 255-270
Category: Minimonography
doi: https://doi.org/10.14735/amcsnn2016255Overview
Parkinsonova choroba (PCh) je multisystémové degeneratívne ochorenie asociované s typickou alfa-synukleinopatiou Lewyho typu, ktoré sa klinicky manifestuje okrem klasickej motorickej symptomatiky celým radom ďalších príznakov nazývaných non-motorické (Non-Motor Symptoms; NMS). Recentne sa uvádza, že NMS sa vyskytujú až u 100 % pacientov s PCh. NMS determinujú stupeň neurologického postihnutia ako aj kvalitu života pacientov často omnoho viac ako príznaky motorické. NMS môžu dokonca predbiehať vznik klasického klinického obrazu PCh o niekoľko desiatok rokov a v tomto prípade ich označujeme ako pre-motorické príznaky. Ďalšie NMS sa objavujú až v neskoršom štádiu ochorenia a zapadajú do klinického obrazu pokročilej PCh. NMS PCh sú podmienené poškodením centrálnych a/ alebo perifernych extranigrálnych štruktúr neurodegeneratívnym procesom s prítomnosťou Lewyho teliesok. Napriek tomu, že v poslednej dekáde bol realizovaný celý rad pomerne rozsiahlych klinicko-patologických a zobrazovacích štúdií, nie je doteraz patomechanizmus viacerých NMS uspokojivo vysvetlený.
Kľúčové slová:
Parkinsonova choroba – non-motorické symptómy – Lewyho telieska – neurodegenerácia – alfa-synukleinopatiaÚvod
Parkinsonova choroba (PCh) je chronické, progresívne ochorenie nervovej sústavy, ktoré sa prejavuje typickým extrapyramídovým hypokineticko-rigidným syndrómom. Jeho základnú charakteristiku predstavuje tetráda hlavných príznakov – bradykinézia, rigidita, tremor a posturálna instabilita. Už James Parkinson však uviedol skutočnosť, že klasické motorické príznaky PCh sú sprevádzané celým radom ďalších symptómov (napr. poruchy spánku, obstipácia, poruchy defekácie, siallorhoe alebo močové dysfunkcie), ktoré dnes označujeme ako non-motorické [1].
Recentne sa uvádza, že non-motorické symptómy (Non-Motor Symptoms; NMS) sa vyskytujú až u 100 % pacientov s PCh [2]. NMS determinujú stupeň neurologického poškodenia a kvalitu života pacientov často omnoho viac ako príznaky motorické, a preto je potrebné na tieto myslieť a v prípade potreby ich adekvátne liečiť. Špeciálne je potrebné myslieť na tie NMS, ktoré môžu mať výrazný vplyv na život pacienta, ale nemusia byť bezpodmienečne zistiteľné počas štandardného neurologického vyšetrenia [3]. Devastujúci vplyv NMS na kvalitu života (Health-Related Quality of Life; HRQoL) bol opakovane demonštrovaný mnohými rozsiahlymi štúdiami uskutočnenými v zahraničí a rovnako aj u nás [4 – 6]. Napriek tomu zostávajú v klinickej praxi NMS frekventne nerozpoznané z dôvodu, že ich pacienti spontánne nezmieňujú a zdravotnícky personál po nich cielene nepátra [7,8].
NMS sa môžu manifestovať v ktorejkoľvek fáze ochorenia a okrem deficitu dopamínu sa na ich vzniku podieľajú dysfunkcie noradrenergného, serotonínergeného a cholínergného systému. Tieto NMS môžu dokonca predbiehať vlastný vznik a rozvoj klasického obrazu PCh až o niekoľko desiatok rokov. V týchto prípadoch označujeme predmetné NMS ako pre-motorické (graf 1). Ďalšie NMS sa objavujú až v neskoršom štádiu ochorenia a zapadajú do klinického obrazu pokročilej PCh.
Graph 1. Rozvoj špecifických symptómov PCh môže niekedy trvať až 20 rokov, avšak radnon-motorických príznakov sa môže objaviť už mnoho rokov pred rozvojom motorickej symptomatiky. 
Prevzaté z [182]. Recentná štúdia u pacientov s pokročilou PCh preukázala fluktuáciu niektorých NMS (okrem dysfágie, nadmerného potenia a močovej urgencie) spolu s motorickou fluktuáciou a na ich častejší výskyt a väčšiu závažnosť v „off“ fáze v porovnaní s „on“ [9]. Prevalencia týchto non-motorických fluktuácií sa podľa predchádzajúcich štúdií pohybuje v širokom rozpätí od 17 % [10] až do 100 % [11] pacientov s motorickými fluktuáciami. Multicentrická štúdia realizovaná v Japonsku zaznamenala, že pacienti so psychiatrickými a senzorickými symptómami vykazujú vyššiu frekvenciu s levodopou spojených fluktuácií. Tieto sú teda pravdepodobne reakciou na aplikovanú dopamínergnú medikáciu. Zlepšená identifikácia na levodope závislých non-motorických fluktuácií môže viesť k modifikácii terapie s cieľom zmierniť prejavy týchto NMS [12].
V posledných rokoch bolo poukázané aj na určité rozdiely v manifestácii NMS medzi obidvoma pohlaviami. Jedna štúdia zaznamenala, že v porovnaní so zdravými jedincami sú vybrané NMS typicky prítomné v pre-motorickom alebo včasnom štádiu PCh viac frekventné v skupine mužov ako žien. V skupine zatiaľ neliečených pacientov s PCh inklinovali muži viac k sexuálnym dysfunkciám a k problémom s vnímaním chuti a čuchu v porovnaní so ženským pohlavím [13].
NMS PCh sú spôsobené poškodením centrálnych a/ alebo periférnych extranigrálnych štruktúr. Najpravdepodobnejšou príčinou tejto multisystémovej lézie je neurodegeneratívny proces charakterizovaný patologickými zmenami označovanými súhrnne ako alfa-synukleinopatia alebo „Lewyho patológia“. Túto mikroskopicky charakterizuje prítomnosť Lewyho teliesok obsahujúcich alfa-synuklein a dystrofických neuritov Lewyho typu v parenchýme mozgového kmeňa a mozgového kortexu (obr. 1–3). Alfa-synuklein patrí do malej skupiny celulárnych transportných proteínov s rozvinutým reťazcom. Za určitých okolností vytvára tzv. „misfolded“ patologické oligomérne štruktúry a nerozpustné fibrily, pričom presný mechanizmus tejto transformácie ale doposiaľ nie je známy. Rovnako nie je objasnená funkcia Lewyho teliesok v celom procese, ale predpokladá sa úzky súvis s celulárnym transportom [14,15].
Image 1. Klasické Lewyho telieska v substantia nigra v rutinnom farbení hematoxylínom-eosinom (A) a imunohistochemickom farbení alfa-synukleinom (B). Fig. 1. Typical Lewy bodies in the substantia nigra under routine hematoxylin and eosin staining (A) and immunohistochemical staining with alpha-synuclein (B). 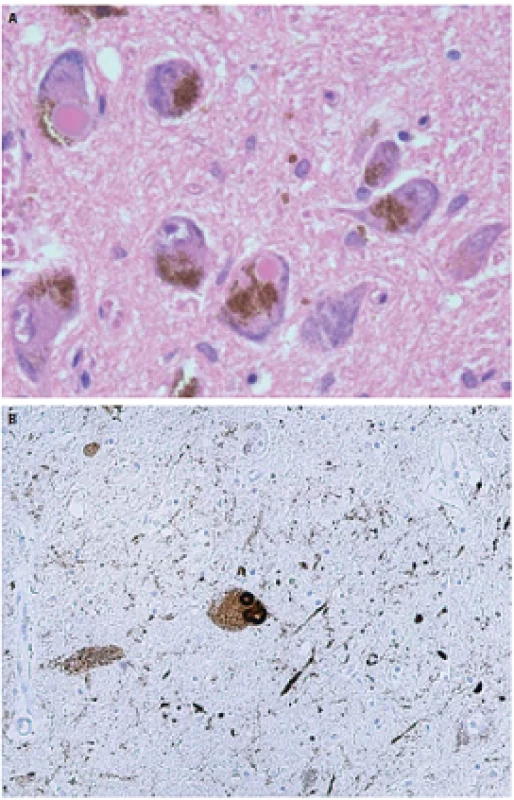
Image 2. Lewyho telieska vo frontálnom kortexe v rutinnom farbení hematoxylínom-eosinom (A) a imunohistochemickom farbení alfa-synukleinom (B). Fig. 2. Lewy bodies in the frontal cortex under routine hematoxylin and eosin staining (A) and immunohistochemical staining with alpha-synuclein (B). 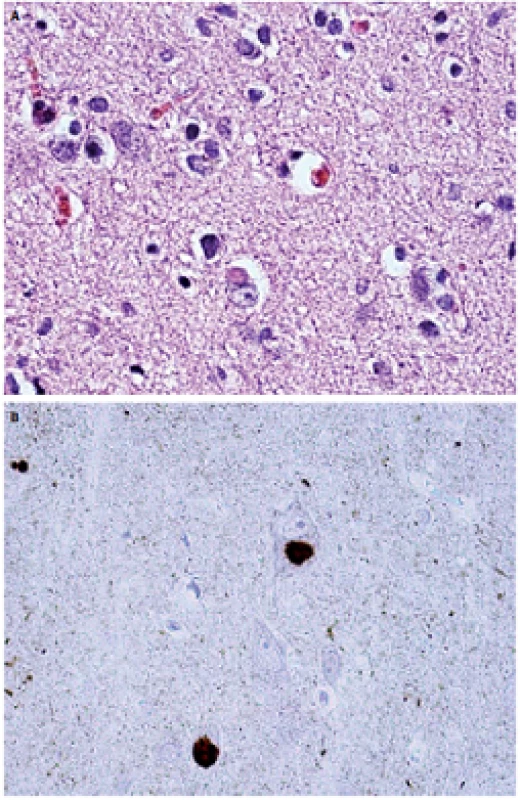
Image 3. Dystrofické Lewyho neurity v oblongate vizualizované imunohistochemicky farbením alfa-synukleinom. Ojedinele sú patrnné i neuróny s cytoplazmatickými depozitami, tie majú v jednom mieste i charakter Lewyho teliesok. Fig. 3. Dystrophic Lewy neurites in oblongata visualized by immunohistochemical staining for alpha-synuclein. Neurons with cytoplasmic deposits are rarely seen, these have a character of Lewy bodies in one location. 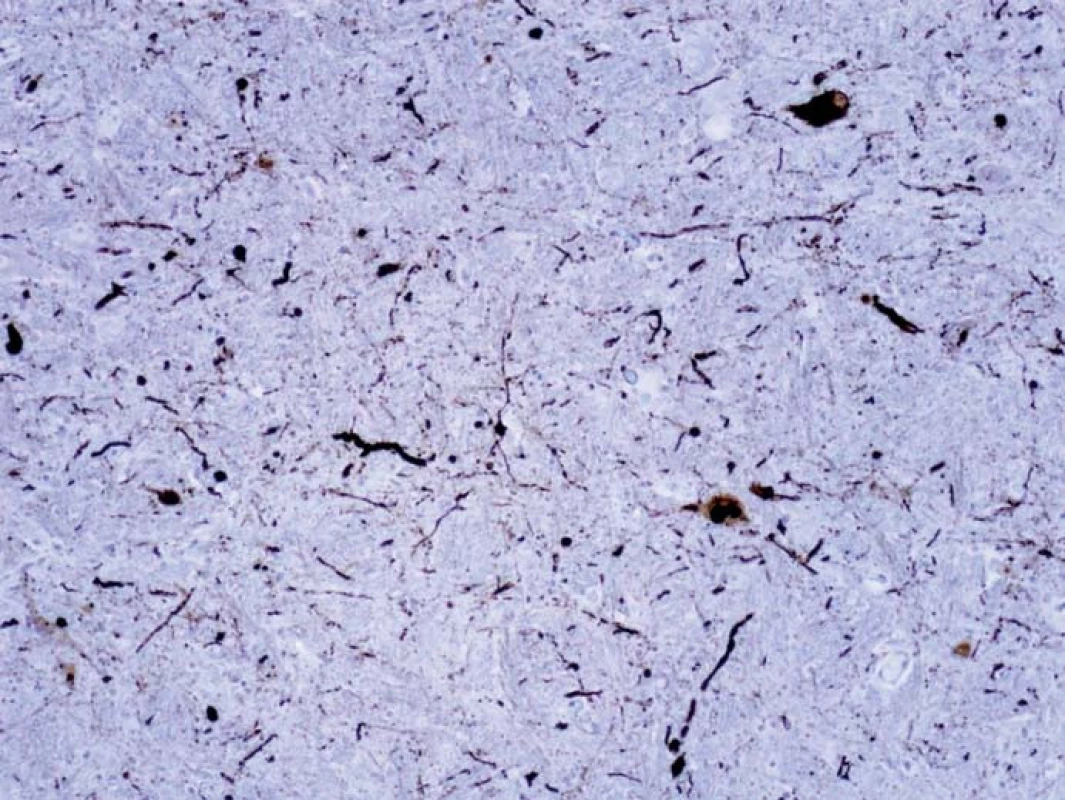
Ďalej je potrebné uviesť, že v posledných rokoch sa rozvíja koncept vzťahu medzi neurodegeneratívnymi likvorologickými markermi (tau proteín, beta-amyloid a index tau proteín/ beta-amyloid) a jednotlivými klinickými subtypmi PCh, ktorý sa v doteraz vykonaných pilotných štúdiách javí byť perspektívnym. V budúcnosti môže byť prínosom k lepšiemu poznaniu patogenézy PCh a následnému zlepšeniu patogeneticky orientovanej terapie a prognózy pacientov [16].
Braak et al ako prví upozornili už na včasné extranigrálne poškodenie a na základe rozsiahlej histopatologickej štúdie vytvorili „staging“ neurodegeneratívnych procesov pri PCh (obr. 4) [17]. Neurodegeneratívne zmeny začínajú v prednom čuchovom jadre, v zadnom motorickom jadre nervus vagus, v locus coeruleus a v nucleus raphe (1. a 2. štádium) a podmieňujú vznik a rozvoj hyposmie, porúch správania sa v REM spánku a nadmernú dennú spavosť, ktoré predstavujú prvé pre-motorické príznaky PCh. Následne dochádza k neurodegeneratívnemu postihnutiu substantia nigra a k rozvoju typickej motorickej symptomatiky PCh (3. a 4. štádium). Príčinou kognitívnej deteriorácie pri PCh je podľa Braaka et al rozšírenie neurodegeneratívnych procesov do mozgového kortexu (5. a 6. štádium). Okrem Braakovho stagingu je v patológii používaný aj McKeithov staging, ktorý skóruje závažnosť a hlavne regionálnu distribúciu prítomnej Lewyho patológie [18].
Image 4. Progresia patologických zmien u PCh. Stupne intenzity červenej farby udávajú stupeň postihnutia mozgu typickou tzv. Lewy patológiou, šípky znázorňujú šírenie patologických zmien v čase a centrifugálny smer od mozgového kmeňa (a) do limbického a frontoorbitálného kortexu (b) a neskôr difúzne (c, d). dm – dorzálne motorické jadro n. vagus, co – locus coeruleus; sn – substantia nigra, mc – predný frontoorbitálny a temporálny mezokortex, hc – senzorický asociačný a prefrontálny kortex, fc – frontálny kortex vrátane primárneho senzomotorického kortexu, PD-stages – štádia PCh podľa Braaka (1–6) (prevzaté z [17]). Fig. 4. Progression of pathological changes in the PD. Intensity of the red color indicates the level at which the brain is affected with so-called typical Lewy pathology; the arrows show the spread of pathological changes over time and centrifugal direction from the brain stem (a) to the limbic and frontoorbital cortex (b), follow by diffuse spread (c, d). ![Progresia patologických zmien u PCh.
Stupne intenzity červenej farby udávajú stupeň postihnutia mozgu typickou tzv. Lewy patológiou, šípky znázorňujú šírenie patologických zmien v čase a centrifugálny smer od mozgového kmeňa (a) do limbického a frontoorbitálného kortexu (b) a neskôr difúzne (c, d).
dm – dorzálne motorické jadro n. vagus, co – locus coeruleus; sn – substantia nigra, mc – predný frontoorbitálny a temporálny mezokortex, hc – senzorický asociačný a prefrontálny kortex, fc – frontálny kortex vrátane primárneho senzomotorického kortexu, PD-stages – štádia PCh podľa Braaka (1–6) (prevzaté z [17]).
Fig. 4. Progression of pathological changes in the PD.
Intensity of the red color indicates the level at which the brain is affected with so-called typical Lewy pathology; the arrows show the spread of pathological changes over time and centrifugal direction from the brain stem (a) to the limbic and frontoorbital cortex (b), follow by diffuse spread (c, d).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/23608ee0e27888d0e1e38133242f0886.jpg)
NMS doteraz úspešne vzdorovali systematickej klasifikácii a až v roku 2015 sa objavil prvý návrh londýnskej skupiny vychádzajúci z Jellingerovho konceptu troch spôsobov šírenia Lewyho patológie. Autori prichádzajú s termínom „non-motorického fenotypu“. Tento má tri základné typy: kmeňový, limbický a kortikálny. Každý z nich obsahuje ďalšie „podfenotypy“ zaradené podľa dominantného NMS. Kmeňový fenotyp obsahuje „podfenotypy“ s poruchou spánku a autonómne dysfunkcie, limbický „podfenotyp“ s depresiou, únavou, bolesťou a stratou hmotnosti a kortikálny „podfenotyp“ s kognitívnou dysfunkciou. Táto klasifikácia je podľa nás trochu ťažkopádna a komplikovaná. Predpokladáme, že budúca denná prax otestuje jej životaschopnosť [19].
Pre-motorické príznaky úvodného štádia Parkinsonovej choroby
Hyposmia
Hyposmia alebo zníženie čuchu predstavuje jeden z najčastejších pre-motorických príznakov PCh. Je spôsobená neurodegeneratívnym procesom s Lewyho telieskami, ktorý postihuje bulbus olfactorius, súvisiace oblasti mozgu, ako je amygdala a perirhinálny kortex [20]. Bolo preukázané, že tieto zmeny, manifestujúce sa poruchou čuchu, môžu predbiehať vznik a rozvoj samotnej PCh aj o štyri až šesť rokov [21]. Hyposmiu môžeme reálne považovať za jeden z najcitlivejších markerov v diagnostike včasného štádia tohto ochorenia. Vyskytuje sa až u 90 % pacientov [22] a má význam v diferenciálnej diagnostike medzi PCh a atypickými parkinsonskými syndrómami alebo vaskulárnym parkinsonizmom, pri ktorých je postihnutie čuchu zriedkavé [23,24]. Rovnako môže byť hyposmia užitočná pri odlíšení trasu pri PCh od esenciálneho trasu v čase, kedy ešte ďalšia parkinsonská motorická symptomatika nie je vyjadrená [25]. Úplne recentná štúdia PARS (Parkinson Associate Risk Syndrome) ukázala, že hyposmia spolu so špecifickou exekutívnou dysfunkciou môže byť markerom neskoršieho vzniku PCh u doposiaľ zdravých jedincov vo veku vyššom ako 50 rokov [26]. V posledných rokoch sa tiež rozvíja idea morfologickej verifikácie PCh u žijúcich pacientov, a to napr. aj biopsiou bulbus olfactorius. Bolo preukázané, že prítomosť alfa-synukleinopatie Lewyho typu v bulbus olfactorius má väčšiu ako 90% senzitivitu a špecifitu pre neuropatologicky potvrdenú PCh alebo DLB a jej závažnosť koreluje so závažnosťou synukleinopatie v ostatných oblastiach mozgu a rovnako aj s rozsahom deteriorácie kognitívnych a motorických funkcií. Biopsia bulbus olfactorius by mohla mať význam pri hodnotení pacienta ako kandidáta pre chirurgickú terapiu PCh, ale jej validita pre včasnú diagnostiku tohto ochorenia je stále predmetom diskusie [27].
Zanechanie fajčenia – včasný NMS Parkinsonovej choroby?
Viaceré epidemiologické štúdie zaznamenali o 60 – 70 % nižšie riziko PCh v skupine fajčiarov v porovnaní s nefajčiarmi [28 – 31]. Tieto výsledky sú v súlade s predchádzajúcimi zisteniami a podporujú teóriu možného neuroprotektívneho účinku fajčenia. Ďalej bola preukázaná aj zvýšená prevalencia bývalých fajčiarov medzi pacientmi s PCh, ktorí takto pravdepodobne viac inklinovali k dobrovoľnému zanechaniu fajčenia v porovnaní so zdravými jedincami fumátormi. Vzniká otázka, či nie je spontánne ukončenie fajčenia včasným predklinickým príznakom pri diagnóze PCh [32]. Presný patologický a patofyziologický korelát tohto suponovaného fenoménu nie je v súčasnosti objasnený.
Poruchy spánku
Väčšina pacientov s PCh trpí poruchami spánku, ktoré sa môžu objaviť už desiatky rokov pred manifestáciou samotného ochorenia. Ich prevalencia sa pohybuje medzi 60 – 98 % [33 – 35]. Najčastejšie sa vyskytujú tieto typy spánkových porúch: poruchy správania sa počas REM spánku, nespavosť, syndróm nepokojných nôh a nadmerná denná spavosť.
Poruchy správania sa počas REM spánku
Poruchy správania sa počas REM spánku (REM sleep Behavior Disorder; RBD) sa považujú za jeden z dôležitých včasných biomarkerov PCh [36]. Sú to epizódy abnormálnych a vysoko intenzívnych pohybov hlavy, končatín aj celého tela. Spolupodmieňujú ich tzv. živé sny, v ktorých sa často pacient proti niečomu bráni. Nie úplne výnimočne môže pri RBD dôjsť aj k zraneniu samotného pacienta alebo jeho partnera. Časť pacientov (najmä tí, ktorí spia na samostatnom lôžku alebo aj v samostatnej miestnosti) si nie je vôbec tejto poruchy vedomá [37]. Je dokázané, že až u 45 % pacientov s idiopatickým RBD dochádza v budúcnosti k vzniku neurodegeneratívneho parkinsonizmu, a to v podobe PCh, multisystémovej atrofie alebo demencie s Lewyho telieskami. Približný časový interval do vzniku a rozvoja parkinsonizmu sa v týchto prípadoch pohybuje okolo 13 rokov [38,39]. Za patologický korelát RBD sa považuje poškodenie niekoľkých jadier mozgového kmeňa, ktoré sú zasiahnuté vo veľmi včasných štádiach PCh (1.–3. štádium podľa Braaka) [40]. Aj keď presný typ poškodenia spojený s RBD nie je stále dokázaný [41], recentné informácie svedčia pre komplexnú dysfunkciu zasahujúcu GABAergný, glutamátergný aj cholínergný systém na podklade poškodenia kmeňových štruktúr v latero-dorzálnom pontínnom tegmente, ktorých úlohou je modulácia REM spánku [42,43]. Nigrostriatálna dopamínergná degenerácia môže byť súčasťou patogenézy RBD, ale pravdepodobne nezohráva zásadnú úlohu [44].
Insomnia
Nespavosť (insomnia) v podobe sťaženého zaspávania a/ alebo problémového udržania spánku sú ďalším veľmi frekventným problémom pacientov s PCh [45]. Za príčinu častého nočného prebúdzania sa sú považované nočná akinézia a ďalšie motorické aj non-motorické príznaky spojené s off-stavom (nyktúria, syndróm nepokojných nôh, porušenie spánkového vzorca a stereotypu a pod.) [33,46]. Neuropatologický podklad tejto poruchy nebol zatiaľ preukázaný.
Syndróm nepokojných nôh a periodické pohyby končatín
Syndróm nepokojných nôh (Restless Legs Syndrome; RLS) je charakterizovaný nepríjemnými pocitmi v dolných končatinách, ktoré sú akcentované v pokoji (sed, ľah). RLS sa obyčajne vyskytuje vo večerných a nočných hodinách a jeho príznaky vymiznú alebo sa minimalizujú prinajmenšom v čase, kedy pacient postihnutou končatinou/ končatinami pohybuje [47]. Vzťah medzi PCh a RLS nie je stále presne objasnený [48] a naviac pre určité prekrývanie sa ich príznakov je v niektorých prípadoch problémom stanoviť súbeh RLS a PCh. Niektoré štúdie preukázali zvýšenú prevalenciu RLS v skupine osôb s PCh. Aj periodické pohyby dolných končatín v spánku (Periodic Limb Movement Disorder; PLMD) sú považované za ďalšiu častú príčinu porúch spánku [48 – 50]. Je udávaná 20% prevalencia RLS pri PCh v porovnaní s približne 10% v bežnej populácii [51]. Patologicko-anatomický korelát týchto končatinových fenoménov nie je v súčasnosti známy.
Nadmerná denná spavosť
Nadmerná denná spavosť je veľmi častý NMS PCh, ktorý sprevádza toto ochorenie počas celého jeho priebehu. Môže vznikať ako primárny príznak PCh spôsobený neurodegeneratívnym postihnutím mozgových štruktúr, ktoré riadia cyklus spánok – bdenie [52]. U pacientov trpiacich nadmernou dennou spavosťou boli preukázané neurodegeneratívne zmeny s prítomnosťou Lewyho teliesok v locus coeruleus [53]. Nadmerná denná spavosť môže byť zároveň priamym dôsledkom porúch nočného spánku. Spôsobuje zhoršenú koncentráciu a pamäť a môže vyústiť až do dopravných nehôd alebo pracovných pochybení [54].
Autonómne dysfunkcie
Súčasťou PCh je široké spektrum autonómnych porúch, ktoré sa manifestujú včasne a nezriedka už v pre-motorickej fáze ochorenia. Z tohto dôvodu je v poslednej dobe autonómnym dysfunkciám venovaná veľká pozornosť ako potencionálnym markerom záchytu PCh ešte pred rozvinutím samotnej motorickej symptomatiky [55]. Ich prevalencia je udávaná v širokom rozpätí 20 – 80 % [56]. V úvodných štádiách PCh sa vyskytuje prevažne obstipácia, ťažkosti s močením, sexuálne dysfunkcie a znížená kardiálna chronotropná odpoveď v priebehu cvičenia [57]. S postupnou progresiou ochorenia sa pridávajú ďalšie poruchy. Ich podkladom je neurodegeneratívne poškodenie častí centrálneho a/ alebo periférneho sympatikového a parasympatikového vegetatívneho nervového systému [58]. V centrálnom nervovom systéme bola Lewyho patológia opísaná v hypothalame, v dorzálnom motorickom jadre nervus vagus a aj v centrách sympatikového nervového systému (jadrá v predĺženej mieche a intermediolaterálneho a intermediomediálneho jadra v mieche) [59]. Na periférii nachádzame Lewyho telieska a Lewyho neurity v rôznych častiach autonómneho nervového systému, pričom jasná deštrukcia bola však preukázaná iba v noradrenergných neurónoch inervujúcich srdce a kožu a dopamínergných neurónoch enterického nervového systému, čo je najskôr aj podkladom rozvoja ortostatickej hypotenzie, poruchy potenia a obstipácie [60].
Gastrointestinálne príznaky
K poruchám postihujúcim gastrointestinálny systém zaraďujeme zníženú tvorbu slín, dysfágiu, oneskorené vyprázdňovanie žalúdka a poruchu defekácie. Už vo včasných štádiách PCh nachádzame inklúzie abnormného alfa-synukleinu v enterickom nervovom systéme a v dorzálnom motorickom jadre nervus vagus [61], ktoré vysvetľujú prítomnosť gastrointestinálnych ťažkostí už v pre-motorickej fáze ochorenia.
Porucha tvorby slín
Pri PCh je často opisovaná hypersalivácia alebo až vytekanie slín z úst. Pacienti s týmto ochorením majú však tvorbu slín zníženú [62] a obyčajne sa sťažujú na subjektívny pocit sucha v ústach [63]. Sialorrhoe je podmienená poruchou prehĺtania s následným nadmerným hromadením slín v ústach [64]. Nateraz nie sú známe presné neurodegeneratívne zmeny, ktoré by boli zodpovedné za túto poruchu. Avšak Lewyho patológia bola zistená v ganglion submandibulare, v ganglion cervicale superius a taktiež v samotnej glandula submandibularis, ktorá predstavuje hlavný zdroj slín [60,65].
Dysfágia
Porucha prehĺtania je relatívne frekventný a často poddiagnostikovaný symptóm PCh s výskytom až u štyroch z piatich pacientov [66]. Typicky sa vyskytuje v neskorších štádiách ochorenia a koreluje so stupňom motorického deficitu [67]. Dysfágia môže byť až natoľko závažná, že spôsobí aspiračnú pneumóniu alebo až asfyxiu vedúcu k exitu pacienta [68]. Patologický korelát tejto dysfunkcie nie je doposiaľ jasne preukázaný.
Porucha vyprázdňovania žalúdka
Oneskorené vyprázdňovanie žalúdka spôsobuje pacientom s PCh pri jedle pocit rýchleho nasýtenia s nekonštantnou nauzeou a abdominálnou distenziou. Táto porucha je prítomná už vo včasných štádiách ochorenia, čo bolo dokázané napr. dynamickou abdominálnou scintigrafiou [69]. Môže zásadne narušovať postup a distribúciu levodopy do proximálnej časti tenkého čreva, kde dochádza k jej vstrebávaniu [70], a môže sa teda podieľať na motorických fluktuáciách pri PCh vrátane „delayed on“ fenoménu [71]. Porucha motility žalúdka je jedným z dôvodov, prečo nepodávať levodopu súčasne s jedlom. Príčina tejto dysfunkcie je zrejme multifaktoriálna a predpokladá sa hlavný podiel neuropatológie nucleus dorsalis nervus vagus a cholínergných neurónov myenterického plexu, ktoré sú postihnuté už od včasných štádií ochorenia [72,73].
Obstipácia
Obstipácia je všeobecne považovaná za jeden z najčastejších NMS. Vo väčšine prípadov je prítomná už dlhý čas pred rozvojom motorickej symptomatiky [74]. Rôzne štúdie odhadujú frekvenciu zápchy na 20 – 89 % [75] a jej závažnosť koreluje so stupňom PCh hodnotenej na základe Hoehn & Yahr škály [76]. Obstipácia je spôsobená hypomotilitou gastrointestinálneho traktu (predĺženie tzv. colonic transit time). Inklúzie alfa-synukleinu boli preukázané v myenterickom plexe, a to už v úvodných štádiách ochorenia – podľa Braakovho stagingu v stupni I [77,78]. Na porušenej motilite sa pravdepodobne podieľa aj postihnutie dorzálneho motorického jadra nervus vagus, ktorého aktivita pôsobí facilitačne na neuróny myenterického plexu Auerbachi a tým vyvoláva peristaltický reflex [79].
Poruchy defekácie
Porucha defekácie pri PCh je spôsobená stratou koordinácie činnosti svalov, ktoré sa na nej podieľajú. Porucha relaxácie m. puborectalis a m. sphincter ani externus môže spôsobiť funkčnú obštrukciu pasáže stolice. Rovnako bola opísaná paradoxná kontrakcia vôľou ovládateľného sfinkteru a m. puborectalis, ktorá viedla k poruche evakuácie stolice, pričom táto porucha je považovaná za prejav fokálnej dystónie asociovanej s extrapyramídovým ochorením [79,80]. Novšie manometrické štúdie dokázali, že postihnutie sa vyskytuje už v skupine novodiagnostikovaných a zatiaľ neliečených pacientov [81]. Na porušenej defekácii sa pravdepodobne podieľa postihnutie sakrálneho parasympatiku (boli tu preukázané Lewyho telieska) [82] aj suprasakrálna centrálna patológia. Neuropatologicky bolo doložené, že Onufovo jadro nie je u pacientov s PCh poškodené [83].
Urogenitálne poruchy
Jeden z veľmi frekventných problémov pri PCh predstavuje močová dysfunkcia. Vyskytuje sa podľa rôznych údajov u 38–71 % pacientov [84]. Môže byť spôsobená hyperaktivitou detruzoru, čo vedie k nyktúrii, urgentnému a častému močeniu až k močovej inkontinencii (hlavne u horšie mobilných pacientov). Urodynamické testovanie preukázalo zníženú kapacitu močového mechúra spolu s hyperaktivitou detruzoru ako príčinu poruchy skladovania moču u pacientov s PCh. Druhou zriedkavejšou možnosťou je hypoaktivita detruzoru, čo zas naopak rezultuje v oneskorené vyprázdnenie močového mechúra, ťažkostiam s iniciáciou močenia, oslabenému prúdu moču mužov a tlačeniu pri močení u žien (tzv. straining). Neuropatologickým korelátom týchto príznakov je pravdepodobne degenerácia vegetatívnych nervových vlákien, ktoré regulujú mikciu.
Sexuálne dysfunkcie
Až 79 % mužov a 75 % žien s PCh udáva sexuálne poruchy. U mužov sa vyskytuje najmä erektilná dysfunkcia a ťažkosti s dosiahnutím ejakulácie a orgazmu. V ženskej populácii ide hlavne o zníženie libida a problém s dosiahnutím orgazmu [57]. K hyposexualite dochádza na podklade porušenej funkcie centrálnej a postganglionárnej periférnej časti hlavne sympatikového nervového systému zapríčinenej procesom neurodegenerácie. Nedostatok sexuálnej túžby je u mužov taktiež spolu podmienený zníženou hladinou testosterónu a psychogénnymi faktormi [85]. Za primárny regulátor libida a erekcie sa považuje hypothalamus, a to najmä jeho mediálna area preoptica a paraventrikulárne jadro. Obidve tieto oblasti získavajú projekcie z dopamínergných neurónov substantia nigra. Patologické štúdie preukázali prítomnosť Lewyho patológie vo všetkých jadrách hypothalamu [86]. Pri PCh sa môžeme stretnúť aj s hypersexualitou, ktorá je považovaná za vedľajší efekt dopamínergnej liečby a radíme ju medzi poruchy kontroly impulzov [87].
Porucha termoregulácie
Približne 2/ 3 pacientov s PCh udáva problémy s termoreguláciou v zmysle zníženého, alebo podstatne častejšie chorobne zvýšeného potenia. Porucha termoregulácie je v priamej korelácii so závažnosťou iných autonómnych porúch a častejšie sa vyskytuje v off-stave alebo naopak vo fáze ťažkých dyskinéz [88]. Hyperhidróza sa najvýraznejšie prejavuje v oblasti hlavy a v hornej časti trupu. Bola vyslovená hypotéza, že takto lokalizované zvýšené potenie je kompenzatórne pri zníženom potení na končatinách [89]. Etiológia dyshidrózy môže súvisieť s poruchou funkcie hypothalamu, avšak súčasné zníženie až úplné chýbanie reflexnej kožnej odpovede môže svedčiť aj pre účasť mechanizmu postsynaptickej sympatikovej denervácie [90]. Exaktný neuroanatomický korelát tejto vegetatívnej dysfunkcie zatiaľ nebol odhalený.
Poruchy zrakových funkcií
Pacienti s diagnózou PCh sa často sťažujú na poruchy vízu, diplopiu alebo zrakové halucinácie pri inak fyziologickom oftalmologickom náleze. Príčina všetkých týchto príznakov je komplexná. Bola preukázaná prítomnosť Lewyho patológie v centrálnych oblastiach zapojených do zrakových sympatikových a parasympatikových dráh uplatňujúcich sa v riadení pupilomotoriky [91 – 93]. Rovnako je ďalej dokázané, že nedostatok dopamínu môže spôsobiť primárnu zrakovú dysfunkciu. Inervácia okolia fovea centralis je dopamínergná a histopatologickým vyšetrením neliečených pacientov s PCh bola dokázaná nižšia koncentrácia dopamínu v porovnaní s pacientami, ktorí liečení boli a ich hladina dopamínu dosahovala fyziologických hodnôt. Opisované zmeny môžu predstavovať jednu z príčin retinálnej dysfunkcie [94 – 96].
Kardiovaskulárne poruchy
Ortostatická hypotenzia
Ortostatická hypotenzia predstavuje ďalší pomerne častý NMS PCh. Jej prevalencia sa pohybuje v rozpätí 30–60 % pacientov s touto diagnózou [97]. Ortostatická hypotenzia je zadefinovaná ako pokles systolického tlaku o 20 mm Hg alebo diastolického tlaku o 10 mm Hg v priebehu 3 min trvajúceho stoja pri porovnaní s hodnotami krvného tlaku nameraného v ľahu. Vyskytuje sa spravidla v neskorších štádiách ochorenia v súvislosti s užívaním dopamínergnej medikácie. Nezriedka býva spojená aj s inými kardiovaskulárnymi abnormitami, ako sú poruchy kontraktility srdca alebo variability frekvencie srdca už počas pre-motorickej fázy PCh [97]. Vznik a rozvoj ortostatickej hypotenzie sa vysvetľuje nasledovne: strata sympatikových noradrenergných vlákien zásobujúcich srdce (sympatiková denervácia bola dokázaná scintigraficky aj histopatologicky a vyskytuje sa už vo včasných štádiách ochorenia [98,99]), ďalej extrakardiálna noradrenergná denervácia a znížená baroreflexná odpoveď. Postihnutím vyššie uvedených systémov nedochádza iba k rozvoju samotnej ortostatickej hypotenzie, ale aj postprandiálnej hypotenzie, nočnej hypertenzie a teda nezanedbateľného diurnálneho kolísania krvného tlaku. Príčinu predstavuje neurodegenerácia sympatikového nervového systému, ktorý sa zúčastňuje inervácie kardiovaskulárneho systému. Histologicky bolo preukázané zníženie počtu neurónov s prítomnosťou Lewyho teliesok v sympatikových gangliách vrátane ganglion stellatum a v sympatikových nervových vláknach inervujúcich myokard a epikard [98,100].
Nočná hypertenzia
Zistilo sa, že až 88 % pacientov s PCh nemá v noci fyziologický pokles krvného tlaku, ale naopak až u 63 % pacientov je zaznamenaný vzostup tlaku krvi nad 125/ 80. K tomuto javu dochádza rovnako u pacientov s anamnézou aj bez anamnézy ortostatickej hypotenzie, a to nezávisle na aditívnej koincidencii arteriálnej hypertenzie s antihypertenzívnou terapiou [101].
Postprandiálna hypotenzia
Postprandiálna hypotenzia je zadefinovaná ako systolický pokles tlaku krvi o 20 mm Hg alebo pokles systoly pod 90 mm Hg z pôvodnej hodnoty 100 mm Hg v priebehu 2 hod po užití potravy. Je závislá od charakteru jedla, výraznejší pokles bol dokumentovaný po požití väčšieho množstva sacharidov a najčastejšie sa vyskytuje po raňajkách a obede [102].
Kolísanie hodnôt krvného tlaku
U pacientov s PCh bolo zistené výrazné kolísanie hodnôt tlaku krvi, a to až o 100 mm Hg systolického tlaku. Pacienti s touto diagnózou pomerne často dosahujú hodnôt systoly až nad 200 mm Hg, čo môže predstavovať významný rizikový faktor rozvoja chronického hypertonického poškodenia rôznych orgánov vrátane mozgu, ale aj vzniku náhlej cievnej mozgovej príhody [103].
Depresia
Depresívna symptomatika predstavuje významný neuropsychiatrický symptóm PCh a stretávame sa s ňou až u 10 – 45 % pacientov s touto diagnózou [104]. Manifestuje sa pocitmi smútku, ľútosti, viny, výčitkami svedomia a nedostatkom sebaúcty. Depresia často predchádza samotnému rozvoju ochorenia a nie je tu žiadna korelácia so závažnosťou motorickej symptomatiky. Jedna štúdia zaznamenala, že v skupine depresívnych osôb dochádza štatisticky významne častejšie k vzniku a rozvoju PCh v porovnaní s napr. osteoartritídou alebo diabetes mellitus [105]. Aj keď majú pacienti s PCh suicidálne myšlienky, tak prípady so siahnutím si na vlastný život sú zriedkavé okrem špecifickej podskupiny pacientov, ktorým bola dopamínergná terapia úplne vysadená alebo veľmi rýchlo redukovaná po začatí stimulácie nucleus subthalamicus [106,107]. Z dôvodu prekrývania sa s časťou ostatných NMS ako aj preto, že základ depresívneho syndrómu tvorí anhedónia, nedostatok energie, znížená schopnosť koncentrácie a poruchy spánku, je niekedy depresia ťažšie odlíšiteľná od samotnej PCh, a preto aj často nedostatočne diagnostikovaná [108]. Podkladom depresie je porucha serotonínergných, limbických noradrenergných a dopamínergných neurotransmiterových systémov [109]. Dôkazom tejto hypotézy je vysoká responzibilita depresívnej symptomatiky na preparáty, ktoré zvyšujú noradrenergnú a serotonínergnú transmisiu. Locus coeruleus a nucleus raphe sú anatomické štruktúry a zároveň kmeňové monoamínergné systémy, ktoré využívajú tieto transmitery k svojej funkcii a sú považované za jednoznačný cieľ v procese neurodegenerácie [110,111].
Anxieta
Úzkostná symptomatika je veľmi bežná u pacientov s PCh a často sa prejavuje pred manifestáciou samotných motorických symptómov [112,113]. Môže sa manifestovať pod obrazom panických atakov, rôznorodých fóbií alebo aj ako generalizovaná úzkostná porucha. Jej prevalencia dosahuje 25–40 % [114], a je teda vyššia ako pri ostatných chronických humánnych diagnózach. Patologicko-anatomický podklad úzkostnej symptomatiky zatiaľ nebol s určitosťou preukázaný.
Non-motorické príznaky pokročilého štádia Parkinsonovej choroby
Veľkú skupinu NMS predstavujú neuropsychiatrické problémy, ktoré sú charakteristické pre pokročilé štádium ochorenia. Pre rozsiahlu prevalenciu neuropsychiatrických príznakov môžeme PCh považovať aj za neuropsychiatrické ochorenie. Zaraďujeme sem apatiu, psychotické prejavy, poruchy kontroly impulzov a kognitívny deficit. Neuropsychiatrické príznaky predstavujú významnú príčinu invalidity a zníženej kvality života pre postihnutých pacientov a zároveň výrazné zvýšenie nárokov na ošetrovateľsko-opatrovateľskú starostlivosť [115].
Neuropsychiatrické príznaky
Apatia
Apatia je všeobecne definovaná ako porucha motivácie a ako s NMS PCh s ňou prichádzame do styku pomerne často. Je pre ňu charakteristické zníženie pociťovania emócií, redukovanie životných aktivít a poznávania nového. Osoby s diagnózou PCh majú apatiu frekventnejšie v porovnaní s ostatnými chronickými ochoreniami, čo môže do určitej miery prejudikovať jej neurodegeneratívny pôvod [116]. Apatia je špecifický symptóm, ktorý nachádzame pri PCh spoločne s depresívnou symptomatickou, ale rovnako často aj bez nej [117]. Nezriedka sa apatia objavuje aj v súvislosti s úzkostnou problematikou, ale naopak sa zdá byť nezávislá na únave a zvýšenej spavosti [118,119]. Recentne realizovaná štúdia preukázala určitú asociáciu apatie a únavy pri PCh s depresiou a dopamínergnou depléciou v mezokortikolimbických štruktúrach ako aj s prerušením prefrontálnej osi kortex–bazálne gangliá. Z tohto dôvodu môže adekvátny manažment depresie a optimálna dopamínergná medikácia zlepšiť apatiu aj únavu pacientov s PCh [120]. Je potrebné dodať, že presný neuropatologický korelát apatie nie je doposiaľ známy.
Kognitívny deficit a demencia
Kognitívny deficit je jeden z najčastejších NMS v rámci PCh. Vyskytuje sa až v 80 % prípadov ochorenia [121]. Významne negatívne ovplyvňuje kvalitu života pacientov a súčasne zásadne zvyšuje fyzickú a psychickú záťaž ošetrovateľov ako aj ekonomické náklady súvisiace so starostlivosťou [122 – 124]. Kognitívna porucha pacientov sa pohybuje v klinickom kontinuu od nepatrnej deteriorácie exekutívnych funkcií s ľahkou kognitívnou poruchou až po významnú demenciu s brutálnym zhoršovaním výkonu vo všetkých oblastiach (aktivity denného života, správanie sa, kognícia a pamäť) [125]. Časový interval medzi začiatkom PCh a vznikom a rozvojom kognitívnej poruchy pomerne výrazne kolíše. V niektorých prípadoch sú známky demencie pozorovateľné už po niekoľkých málo rokoch ochorenia, zatiaľ čo inokedy (aj keď výnimočne) nie je ani po 20 rokoch od stanovenia diagnózy PCh kognitívna deteriorácia prítomná [126]. Pri PCh sa najčastejšie vyskytuje porucha epizodickej pamäti, zrakovo-priestorovej orientácie a verbálnej fluencie. Často sú taktiež prítomné poruchy exekutívnych funkcií a pozornosti [127]. Patomorfologický korelát kognitívnej deteriorácie pri PCh je stále pomerne rozporuplný. Niektoré štúdie preukázali spojitosť medzi množstvom Lewyho teliesok a demenciou [128,129]. Podľa Braaka et al je patologickým korelátom demencie pri PCh rozšírenie sa Lewyho teliesok do limbických (II.–IV. štádium – prechodné limbické) a kortikálnych (V. a VI. štádium – difúzne neokortikálne) štruktúr [130]. Rozporuplným sa javí byť koncept tzv. duálnej patológie u pacientov s PCh a demenciou, ktorý postuluje nevyhnutnú prítomnosť tzv. alzheimerovskej patológie. Argumentačne nevysvetľuje manifestáciu pomerne významného kognitívneho deficitu u pacientov, ktorým nebola prítomnosť alzheimerovskej patológie v mozgu post mortem potvrdená [131].
Psychotické prejavy
Psychotické symptómy sú častou komplikáciou pokročilého štádia PCh a vyskytujú sa u viac ako u 50 % pacientov s touto diagnózou [132–134]. Predstavujú jeden z najväčšmi invalidizujúcich NMS. Začínajú sa objavovať priemerne po 10 rokoch trvania ochorenia. V prípade ich skoršej manifestácie myslíme skôr na alternatívnu diagnózu, ako je Alzheimerova demencia, demencia s Lewyho telieskami alebo iné koincidentné psychiatrické ochorenie [135]. K príznakom s najväčším výskytom patria vizuálne halucinácie nasledované sluchovými halucináciami, ktoré môžu byť však aj známkou depresie. So zrakovými halucináciami sa stretávame u viac ako 40 % pacientov v pokročilom štádiu PCh [136,137]. Vo včasnom psychotickom štádiu bývajú prítomné najmä zrakové ilúzie, ktoré pacienti opisujú ako „nejasné obrazy v periférnom videní“. Rovnako často sa vyskytujú paranoidné bludy, ktorých obsahom býva podozrievanie z manželskej nevery či opustenia. Potom, ako sa psychotické prejavy prvýkrát objavia, majú tieto tendenciu stať sa perzistentnými a postupne progredovať [138 – 140]. S progresiou psychotických prejavov začínajú byť zrakové fenomény viac formované [141]. Podstatným dôsledkom psychózy je, že býva spojená s demenciou, depresívnym syndrómom, skoršou mortalitou a väčšou záťažou pre opatrovateľov a obyčajne nevyhnutnosťou umiestnenia pacienta v špecializovanom domove s dlhodobou a 24-hod nepretržitou ošetrovateľskou starostlivosťou [142 – 144]. Zatiaľ nie je známy presný patofyziologický podklad rozvoja psychotických porúch. Známe sú ale rizikové faktory, ku ktorým patrí vyšší vek, závažnosť a trvanie ochorenia a prítomnosť kognitívneho deficitu [145]. Predpokladá sa, že za rozvoj vizuálnych halucinácií je zodpovedný dolný temporálny lalok a pars reticularis substantiae nigrae. Dolný temporálny lalok je prirodzene zapojený do spracovávania zrakových podnetov súvisiacich s ľuďmi a objektmi, ktoré sú typickým obsahom halucinácií pacientov s PCh. Preukázalo sa, že lézie v mediálnej časti pars reticularis substantiae nigrae vedú k rozvoju dobre formovaných živých halucinácií podobných tým, s ktorými sa stretávame pri PCh. Z týchto dôvodov môžeme predpokladať, že dysfunkcia tejto štruktúry zohráva dôležitú úlohu v rozvoji vizuálnych halucinácií [146].
Poruchy kontroly impulzov
Poruchy kontroly impulzov (Impulse Control Disorders; ICD) charakterizuje repetitívne nutkavé správanie sa, ktoré je motivované dosiahnutím pocitov potešenia či uspokojenia a neschopnosťou odolávať impulzom, ktoré sú pre jednotlivca alebo pre jeho okolie škodlivé. Vznikajú na podklade abnormálne fungujúceho systému odmeny a motivácie, v ktorom hrá dôležitú úlohu tzv. molekula šťastia – dopamín [147]. ICD sa väčšinou manifestujú až v pokročilejších štádiách ochorenia a priraďujeme k nim patologické hráčstvo, nutkavé nakupovanie, hypersexualitu a nutkavé prejedanie sa. Ďalšími formami sú nutkavé správanie sa (punding) a nadmerné užívanie dopamínergnej medikácie označované ako dopamínový dysregulačný syndróm. V posledných rokoch boli opísané aj ďalšie typy porúch ako kleptománia [148] alebo impulzívne fajčenie [149]. Tieto poruchy správania sa nepredstavujú problém iba pre samotného pacienta, ale aj pre jeho blízke okolie (rodinné ale aj iné). Sú často zamlčované a tajené, pretože môžu byť sociálne neprijateľné, zahanbujúce alebo sú zdrojom finančnej tiesne. Pri riešení pacienta je potrebné po ich prítomnosti aktívne pátrať formou cielených otázok, pričom nato existujú prefabrikované dotazníky, ktoré pacient vypĺňa sám alebo v spolupráci s lekárom. Sami pacienti ich mnohokrát nevnímajú ako problémové, a tak zostávajú skryté, až pokiaľ na tieto neupozorní okolie [150]. S rozvojom týchto porúch býva najčastejšie dávaná do súvislosti liečba dopamínovými agonistami [150,151], ale boli taktiež opísané v súvislosti s užívaním L-DOPA [152] a v súvislosti s hlbokou mozgovou stimuláciou nucleus subthalamicus (STN-DBS) [153]. Práve naopak výsledky niekoľkých retrospektívnych štúdií poukázali na zlepšenie porúch kontroly impulzov a dopamínového dysregulačného syndrómu po terapii STN-DBS [154,155], čo bolo potvrdené aj nasledujúcimi prospektívnymi štúdiami [156,157]. Na základe aj týchto faktov došlo k prehodnoteniu zaužívaného tvrdenia, že duševné a behaviorálne poruchy sú kontraindikáciou STN-DBS a v priebehu posledných 10 rokov sú navrhované ako potenciálne nová indikácia STN-DBS pri PCh [158,159]. V minulosti zostávalo otvorenou otázkou, nakoľko ich k rozvoju dochádza iba na základe dopamínergnej terapie v spojení s individuálnou dispozíciou, alebo v ich genéze zohráva úlohu aj primárny patologický proces PCh [160]. Výsledky multicentrickej epidemiologickej prierezovej štúdie zamerané na prítomnosť ICD u PCh realizovanej v Severnej Amerike ukázali, že v skupine liečených pacientov s PCh je 25-krát vyššia pravdepodobnosť vzniku ICD ako v skupine pacientov s iným neurologickým ochorením [161]. Výskyt ICD sa neodlišoval medzi skupinou neliečených parkinsonikov a zdravými kontrolami, čo naznačuje, že primárne PCh nie je príčinou vzniku ICD. Nateraz z toho vyplýva záver, že rozvoj týchto porúch je zrejme výsledkom interakcie predispozičných faktorov a dopamínergnej medikácie [162]. Z hľadiska neuropatoanatómie považujeme ventrálnu tegmentálnu oblasť a jej projekcie do ventrálneho striata, limbického a prefrontálneho kortexu, ďalej ventrálne a dorzálne striatum a súvisiace frontostriatálne okruhy za štruktúry spojené s procesom rozvoja ICD [163].
Dopamínový dysregulačný syndróm
Dopamínový dysregulačný syndróm (DDS) pacientov s PCh bol prvýkrát opísaný v roku 2000, kedy bol označený ako „hedonistická homeostatická dysregulácia“ [164]. DDS sa rozvíja u pacientov s dlhodobou anamnézou užívania dopamínergnej medikácie. Typickým znakom je nadužívanie dopamínergnej medikácie, na základe ktorej dochádza k rozvoju ťažkých dyskinéz a najrôznejších porúch správania sa. Môže byť prítomný nekľud, psychomotorická hyperaktivita, agresivita, hypománia, dysfória, anhedónia a podráždenosť pri redukcii dávok medikácie s následnou silnou až neovládateľnou túžbou po užití ďalšej dávky dopamínergika [165]. Z ďalších porúch správania sa môže byť prítomný tzv. punding. Týmto termínom označujeme komplexné stereotypné správanie sa s intenzívnym nutkaním pre vykonávanie najrôznejších činností (napr. lepenie modelov zo zápaliek, zbieranie rôznych predmetov) [166]. Niekedy sa dáva do súvislosti s pundingom aj nebývalá kreativita týchto osôb v porovnaní s ostatnou populáciou. Prevalencia DDS sa odhaduje v rozmedzí 3,4–4,1 % [167]. K rizikovým faktorom jeho rozvoja patrí začiatok ochorenia v mladom veku, impulzivita a osobnostné rysy spojené s vyhľadávaním príjemných pocitov, anamnéza depresie, zneužívanie alkoholu a drog a porucha kontroly impulzov [168]. Jedna z teórii vzniku DDS je tzv. motivačná senzitizácia, podľa ktorej ku kompulzívnemu užívaniu liekov dochádza na základe zmien v dopamínergných projekciách viazaných na ventrálne striatum, a to konkrétne nucleus accumbens. Tieto abnormality v dopamínergnom a GABA-ergnom prenose vedú k senzitizácii a aktivácii systému odmeny viazaného na nucleus accumbens, ktoré sa označujú pojmom motivačná významnosť [169]. Presné neurodegeneratívne zmeny zodpovedné za túto dysfunkciu však neboli do súčasnosti detegované.
Iné non-motorické symptómy
Bolesť pri Parkinsonovej chorobe
S diagnózou PCh je často spojená krutá a nepoddajná bolesť, ktorú mnohí pacienti považujú za viac zaťažujúcu ako vlastné motorické postihnutie [170]. Stretávame sa s ňou až v 70 – 85 % prípadoch tohto ochorenia. Bolesť výrazne ovplyvňuje kvalitu života pacientov, je veľmi často poddiagnostikovaná (minimálne čo sa týka jej intenzity a emocionálneho doprovodu) a z toho vyplýva, že aj mnohokrát nie adekvátne liečená [171]. Bolo jednoznačne preukázané, že pacienti s PCh, ktorí trpia týmto frekventovaným NMS, sú viac depresívni a majú horšiu kvalitu života ako tí, ktorí sa s bolesťou pri diagnóze PCh nestretli [172]. V priebehu ochorenia sa môžu vyskytovať rozličné typy bolesti postihujúce rôzne časti tela. Na základe toho je obtiažne stanoviť jej klasifikáciu a presné patofyziologické mechanizmy. Pacienti s PCh majú nezávisle na veku a trvaní ochorenia redukovaný počet voľných nervových zakončení [173]. Vo včasných štádiách ochorenia bol v súvislosti s neurodegeneratívnymi zmenami postihujúcimi miechu preukázaný aj úbytok neurónov v oblasti zadných rohov miechy [174], čo môže ovplyvňovať prenos bolestivých podnetov z periférie do zodpovedajúcich oblastí CNS. Prenos nociceptívnych informácií z miechy centripetálne môže byť ďalej modifikovaný v dôsledku neurodegeneratívneho postihnutia jadier mozgového kmeňa, ktoré sú súčasťou ascendentných aj descendentných dráh modulujúcich prenos a vnímanie bolesti [175]. Už v II. štádiu podľa Braakovho stagingu bola preukázaná prítomnosť Lewyho teliesok v rostromediálnej oblongate zahrňujúca nucleus raphe magnus, nucleus gigantocellularis a rovnako locus coeruleus, čo distribučne zodpovedá pre-motorickej fáze ochorenia, kedy sú neurodegenaratívnymi zmenami postihnuté bulbus olfactorius a dolná časť mozgového kmeňa [176]. Proces degenerácie týchto štruktúr môže ovplyvniť vnímanie intenzity bolesti a môže viesť k zmenám vegetatívnych, emočných a kognitívne-vyhodnocovacích odpovedí pri spracovaní bolestivých vstupov [177]. Popri postihnutí extranigrálnych štruktúr sa na zmenách v spracovávaní bolestivých podnetov podieľa aj poškodenie samotného nigrostriatálneho systému, a to ovplyvnením laterálneho thalamu ako jedného z hlavných centier systému bolesti ako aj vplyvom dysfunkcie samotného striata. V dôsledku navodenej denervácie nigrostriatálneho systému, ktorá vedie k zvýšenej neuronálnej aktivite subthalamického jadra, vnútorného pallida a pars reticularis substantiae nigrae, dochádza k výraznej inhibícii v oblastiach laterálneho thalamu. Táto inhibícia má za následok zníženie schopnosti presnej lokalizácie bolesti, čo je podporené faktom, že mnoho pacientov s PCh nie je schopných lokalizovať bolestivé podnety [177].
Únava
Únava pri PCh môže byť vyvolaná nasledujúcimi podstatnými príčinami: centrálnym dopamínergným deficitom v limbickej oblasti, sekundárne ostatnými NMS (napr. ospalosťou), nepriaznivými účinkami užívanej farmakoterapie (špeciálne dopamínovými agonistami) a ďalšími komorbiditami [178]. Pacienti trpiaci únavou, ktorá je spôsobená jednou alebo viacerými uvedenými príčinami, zaznamenávajú výraznú únavnosť, nedostatok energie až vyčerpanosť aj v relatívnom somatickom a psychickom pokoji, alebo sa extrémne rýchlo unavia pri akejkoľvek aktivite [179]. Postupne sa pacienti stávajú menej aktívnymi a znižuje sa ich kvalita života. Ľudia s non-fluktujúcou PCh zažívajú väčšiu únavu a trpia horšou HRQoL v porovnaní s pacientmi s diabetom či staršími jedincami [180]. Jedna klinická štúdia potvrdila, že závažnosť ochorenia pacientov s PCh je priamo spojená s príznakmi depresie. Rovnako je priamo ovplyvnená únavou (zvýšením hladiny všeobecnej únavy, fyzickej únavy, zníženou aktivitou a duševnou únavou), ale nie je napr. ovplyvnená zníženou motiváciou [181]. V súčasnosti nám nie je známy neuropatologický korelát tohto symptómu.
Záver
V práci sme sa pokúsili predstaviť súčasný stav poznania o histopatologických substrátoch týchto často kvalitu života významne limitujúcich príznakov z kategórie NMS, ktoré doprevádzajú PCh. Okrem vyššie uvedeného textu sme základné informácie včlenili do prehľadnej tabuľky, ktorá snáď môže byť prospešná pri potrebe rýchlej orientácie (tab. 1). Napriek skutočnosti, že je stále viac dôkazov o prítomnosti alfa-synukleinovej patológie extranigrálne a o jej príčinnej angažovanosti v genéze pre-motorických aj neskorých NMS, sa ukazuje stále potreba rozsiahleho klinicko-patologického výskumu s cieľom spresniť korelácie medzi motorickými a NMS a ich presným vzťahom k morfologickým a funkčným patofyziologickým léziam v nervovom systéme. Rovnako je potrebné mať na pamäti, že celý rad NMS (a predovšetkým pre-motorických) príznakov pacienti sami spontánne nereferujú. Z tohto dôvodu je nevyhnutné aktívne anamnestické pátranie po týchto príznakoch, a to bez ohľadu na niektoré poučky o neprípustnosti kladenia sugestívnych otázok. Za samozrejmosť považujeme ich následný terapeutický manažment v súlade s poznatkami doby.
Table 1. Pre-motorické a non-motorické príznaky PCh a ich patologické koreláty. 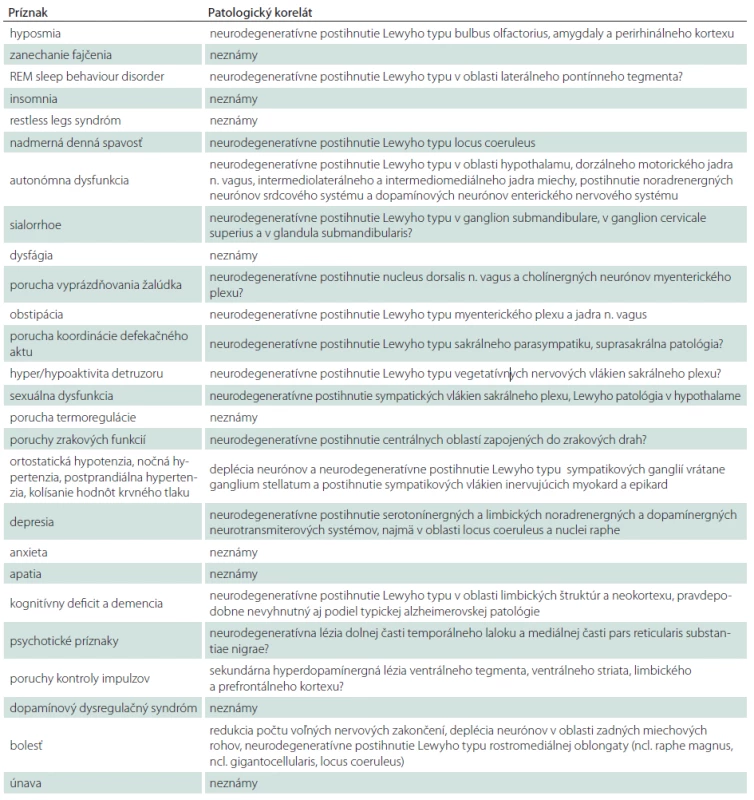
Táto práca bola podporovaná grantami: IGA MZ CR NT-14407, IGA-LF-2015-013, AZV MZ CR 15-32715A a the Institutional Support MZ CR, RVO FNOL-2015.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Sandra Kurčová
Neurologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: sandrakurcova@gmail.com
Prijaté k recenzii: 1. 10. 2015
Prijaté do tlače: 21. 12. 2015
MUDr. Sandra Kurčová
MUDr. Sandra Kurčová promovala na Jesseniovej lekárskej fakulte v Martine Univerzity Komenského v Bratislave v roku 2013. Po ukončení štúdia bola prijatá do doktorského štúdijného programu Lékařské fakulty Univerzity Palackého v Olomouci v obore Neurológia s tématom zaoberajúcim sa non-motorickými symptómami Parkinsonovej choroby v súvislosti s terapiou hlbokou mozgovou stimuláciou. Aktuálne pracuje ako lekárka Centra pro diagnostiku a léčbu neurodegenerativních onemocnění na Neurologickej klinike LF UP a FN v Olomouci.
Sources
1. Parkinson J. An essay on the shaking palsy. London: Sherwood, Neely and Jones 1817.
2. Pfeiffer RF. Non-motor symptoms in Parkinson‘s disease. Parkinsonism Relat Disord 2016;22(Suppl 1): S119 – 22. doi: 10.1016/j.parkreldis.2015.09.004.
3. Martinez-Martin P, Rodriguez-Blazquez C, Kurtis MM, et al. NMSS Validation Group. The impact of non-motor symptoms on health-related quality of life of patients with Parkinson‘s disease. Mov Disord 2011;26(3):399 – 406. doi: 10.1002/mds.23462.
4. Valkovic P, Harsany J, Hanakova M, et al. Nonmotor symptoms in early - and advanced-stage Parkinson‘s diseasepatients on dopaminergic therapy: how do they correlate with quality of life? ISRN Neurol 2014;2014 : 587302. doi: 10.1155/2014/587302.
5. Soh SE, Morris ME, McGinley JL. Determinants of health-related quality of life in Parkinson‘s disease: a systematic review. Parkinsonism Relat Disord 2011;17(1):1 – 9. doi: 10.1016/j.parkreldis.2010.08.012.
6. Shearer J, Green C, Counsell CE, et al. The impact of motor and non motor symptoms on health state values in newly diagnosed idiopathic Parkinson‘s disease. J Neurol 2012;259(3):462 – 8. doi: 10.1007/s00415-011-6202-y.
7. Gallagher DA, Lees AJ, Schrag A. What are the most important nonmotor symptoms in patients with Parkinson‘s disease and are we missing them? Mov Disord 2010;25(15):2493–500. doi: 10.1002/mds.23394.
8. Bonnet AM, Jutras MF, Czernecki V, et al. Nonmotor symptoms in Parkinson‘s disease in 2012: relevant clinical aspects. Parkinsons Dis 2012;2012 : 198316. doi: 10.1155/ 2012/198316.
9. Storch A, Schneider CB, Wolz M, P et al. Nonmotor fluctuations in Parkinson disease: severity and correlation with motor complications. Neurology 2013;80(9):800 – 9. doi: 10.1212/WNL.0b013e318285c0ed.
10. Hillen ME, Sage JI. Nonmotor fluctuations in patients with Parkinson‘s disease. Neurology 1996;47(5):1180–3.
11. Witjas T, Kaphan E, Azulay JP, et al. Nonmotor fluctuations in Parkinson‘s disease: frequent and disabling. Neurology 2002;59(3):408–13.
12. Seki M, Takahashi K, Uematsu D, et al. Clinical features and varieties of non-motor fluctuations in Parkinson‘s disease: a Japanese multicenter study. Parkinsonism Relat Disord 2013;19(1):104 – 8. doi: 10.1016/j.parkreldis.2012.08.004.
13. Picillo M, Amboni M, Erro R, et al. Gender differences in non-motor symptoms in early, drug naïve Parkinson’s disease. J Neurol 2013;260(11):2849 – 55. doi: 10.1007/s00415-013-7085-x.
14. Tofaris GK, Spillantini MG. Physiological and pathological properties of alpha-synuclein. Cell Mol Life Sci 2007;64(17):2194 – 201.
15. Hunn BH, Cragg SJ, Bolam JP, et al. Impaired intracellular trafficking defines early Parkinson‘s disease. Trends Neurosci 2015;38(3):178 – 88. doi: 10.1016/j.tins.2014.12.009.
16. Přikrylová Vranová H, Mareš J, Hluštík P, et al. Tau protein and beta-amyloid(1-42) CSF levels in different phenotypes of Parkinson‘s disease. J Neural Transm (Vienna). 2012;119(3):353 – 62. doi: 10.1007/s00702-011-0708-4.
17. Braak H, Del Tredici K, Rüb U, et al. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiol Aging 2003;24(2):197–211.
18. McKeith IG, Dickson DW, Lowe J, et al. Diagnosis and management of dementia with Lewy bodies: third report of the DLB Consortium. Neurology 2005;65(12):1863 – 72.
19. Sauerbier A, Jenner P, Todorova A, et al. Non motor subtypes and Parkinson‘s disease. Parkinsonism Relat Disord 2016;22(Suppl 1):S41 – 6. doi: 10.1016/j.parkreldis.2015.09.027.
20. Dickson DW, Fujishiro H, Orr C et al. Neuropathology of non-motor features of Parkinson disease. Parkinsonism Relat Disord 2009;15(Suppl 3):S1 – 5. doi: 10.1016/S1353-8020(09)70769-2.
21. Müller A, Abolmaali N, Hummel T, et al. Cardinal symptoms of idiopathic Parkinson disease. Akt Neurol 2003;30(4):239–43.
22. Miyamoto T. Olfactory dysfunction in Parkinson disease and REM sleep behavior disorder. Brain Nerve 2012;64(4):356–63.
23. Wenning GK, Shephard B, Hawkes C, et al. Olfactory function in atypical parkinsonian syndromes. Acta Neurol Scand 1995;91(4):274–80.
24. Katzenschlager R, Evans A, Manson A, et al. Mucuna pruriens in Parkinson‘s disease: a double-blind clinical and pharmacological study. J Neurol Neurosurg Psychiatry 2004;75(12):1672–7.
25. Ondo WG, Lai D. Olfaction testing in patients with tremor-dominant Parkinson’s disease: is this a distinct condition? Mov Disord 2005;20(4):471 – 5.
26. Chahine LM, Weintraub D, Hawkins KA, et al. Cognition in individuals at risk for Parkinson‘s: Parkinson associated risk syndrome (PARS) study findings. Mov Disord 2015;31(1):86 – 94. doi: 10.1002/mds.26373.
27. Beach TG, White CL, Hladik CL, et al. Olfactory bulbalpha-synucleinopathy has high specificity and sensitivity for Lewy body disorders. Acta Neuropathol 2009;117(2):169 – 74. doi: 10.1007/s00401-008-0450-7.
28. Nicoletti A, Pugliese P, Nicoletti G, et al. Voluptuary habits and clinical subtypes of Parkinson’s disease: the FRAGAMP case-control study. Mov Disord 2010;25(14):2387 – 94. doi: 10.1002/mds.23297.
29. Tanaka K, Miyake Y, Fukushima W, et al. Active and passive smoking and risk of Parkinson’s disease. Acta Neurol Scand 2010;122(6):377 – 82. doi: 10.1111/j.1600-0404.2010.01327.x.
30. Powers KM, Kay DM, Factor SA, et al. Combined effects of smoking, coffee, and NSAIDs on Parkinson’s disease risk. Mov Disord 2008;23(1):88 – 95.
31. Hernán MA, Takkouche B, Caamano-Isorna F, et al. A meta-analysis of coffee drinking, cigarette smoking, and the risk of Parkinson’s disease. Ann Neurol 2002;52(3):276 – 84.
32. Moccia M, Erro R, Picillo M, et al. Qutting smoking: an early non-motor feature of Parkinson’s disease? Parkinsonism Relat Disord 2015;21(3):216 – 20. doi: 10.1016/j.parkreldis.2014.12.008.
33. Lees AJ, Blackburn NA, Campbell VL. The nighttime problems of Parkinson’s disease. Clin Neuropharmacol 1988;11(6):512 – 9.
34.Chaudhuri KR. Nocturnal symptom complex in PD and its managment. Neurology 2003;61(Suppl 3):S17 – 23.
35. Garcia-Borrequero D, Larosa O, Bravo M. Parkinson’s disease and sleep. Sleep Med Rev 2003;7(2):115 – 29.
36. Boeve BF. REM sleep behavior disorder: updated review of the core features, the REM sleep behavior disorder-neurodegenerative disease association, evolving concepts, controversies and furure directions. Ann N Y Acad Sci 2010;1184 : 15 – 54. doi: 10.1111/j.1749-6632.2009.05115.x.
37. Schenck C, Mahowald MW. REM sleep behaviour disorder: clinical, developmental and neuroscicence perspectives 16 years after its formal identification in SLEEP. Sleep 2002;55 : 281 – 8.
38. Iranzo A, Molinuevo JL, Santamaria J, et al. Rapid-eye-movement sleep behaviour disorder as an early marker for a neurodegenerative disorder: a descriptive study. Lancet Neurol 2006;5(7):572 – 7.
39. Postuma RB, Gagnon JF, Vendette M, et al. Idiopathic REM sleep behaviour disorder in the transition to degenerative disease. Mov Disord 2009;24(15):2225–32. doi: 10.1002/mds.22757.
40. Grinberg LT, Rueb U, Alho AT, et al. Brainstem pathology and non-motor symptoms in PD. J Neurol Sci 2010;289(1 – 2):81 – 8. doi: 10.1016/j.jns.2009.08.021.
41. Tachibana N. Historical overview of REM sleep behavior disorder in relation to its pathophysiology. Brain Nerve 2009;61(5):558 – 68.
42. Iranzo A, Tolosa E. REM sleep behavior disorder in Parkinson’s disease. In: Chaudhuri KR, Tolosa E, Schapira A, Poewe W, eds. Non-motor symptoms of Parkinson’s disease. Oxford: Oxford Univ Press 2009 : 177 – 93.
43. Pace-Schott EF, Hobson JA. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat Rev Neurosci 2002;3(8):591–605.
44. Kim YK, Yoon IY, Kim JM, et al. The implication of nigrostriatal dopaminergic degeneration in the pathogenesis of REM sleep behavior disorder. Eur J Neurol 2010;17(3):487 – 92. doi: 10.1111/j.1468-1331.2009.02854.x.
45. Chaudhuri K, Schapira A. Non-motor symptoms of Parkinson’s disease:dopaminergic pathophysiology and treatment. Lancet Neurol 2009;8(5):464–74. doi: 10.1016/S1474-4422(09)70068-7.
46. Dhawan V, Healy DG, Pal S, et al. Sleep-related problems in Parkinson’s disease. Age Aging 2006;35(3):220–8.
47. Mitra T, Chaudhuri K. Sleep dysfunction and role of dysautonomia in Parkinson’s disease. Parkinsonism Relat Disord 2009;15(Suppl 3):S93–5.
48. Möller JC, Unger M, Stiasny-Kolster K, Oertel WH. Restless legs syndrome (RLS) and Parkinson’s disease (PD)-related disorders or different entities? J Neurol Sci 2010;289(1 – 2):135–7. doi: 10.1016/j.jns.2009.08.035.
49. Ondo WG, Vuong KD, Jankovic J. Exploring the relationship between Parkinson’s disease and restless legs syndrome. Arch Neurol 2002;59(3):421–4.
50. Garcia-Borrequero D, Odin P, Serrano C. Restless legs syndrome and Parkinson: a review of the evidence for a possible association. Neurology 2003;61(Suppl 3):49–55.
51. Odin P. Sleep-related symptoms. In: Chaudhuri KR, Martinez-Martin P, Odin P, Antonini A, eds. Handbook of Non-Motor Symptoms in Parkinson’s Disease. London: Springer Healthcare 2011 : 57–65.
52. Comella CL. Sleep disorders in Parkinson‘s disease: an overview. Mov Disord 2007;22(Suppl 17): 367–73.
53. Lim SY, Fox SH, Lang AE. Overwiev of the extranigral aspects of Parkinson’s disease. Arch Neurol 2009;66(2):167–72. doi: 10.1001/archneurol.2008.561.
54. Saper C, Chou TC, Scammell TE. The sleep switch: hypotalamic control of sleep and wakefulness. Trends Neurosci 2001;24(12):726 – 31.
55. Kaiserová M. Autonomní dysfunkce u Parkinsonovy nemoci. Postgradual Med 2015;17(1):34–40.
56. Jost WH. Autonomic dysfunctions in idiopathic Parkinson’s disease. J Neurol 2003;250(Suppl 1): l28–30.
57. Palma JA, Kaufmann H. Autonomic disorders pre-dicting Parkinson‘s disease. Parkinsonism Relat Disord 2014; 20(Suppl 1):S94 – 8. doi: 10.1016/S1353-8020(13)70024-5.
58. Benarroch EE, Schmeichel AM, Parisi JE. Involvement of the ventrolateral medulla in parkinsonism with autonomic failure. Neurology 2000;54(4):963–8.
59. Jain S. Multi-organ autonomic dysfunction in Parkinson disease. Parkinsonism Relat Disord 2011;17(2):77 – 83. doi: 10.1016/j.parkreldis.2010.08.022.
60. Sulzer D, Surmeier DJ. Neuronal vulnerability, pathogenesis, and Parkinson‘s disease. Mov Disord 2013;28(6):715 – 24. doi: 10.1002/mds.25187.
61. Cersosimo MG, Benarroch EE. Pathological correlates of gastrointestinal dysfunction in Parkinson‘s disease. Neurobiol Dis 2012;46(3):559–64. doi: 10.1016/j.nbd.2011.10.014.
62. Proulx M., Courval FP, Wiseman MA, et al. Salivary production in Parkinson‘s disease. Mov Disord 2005;20(2):204 – 7.
63. Cersosimo MG, Raina GB, Calandra CR, et al. Dry mouth: an overlooked autonomic symptom of Parkinson‘s disease. J Parkinsons Dis 2011;1(2):169 – 73. doi: 10.3233/JPD-2011-11021.
64. Nóbrega AC, Rodrigues B, Torres AC, et al. Is drooling secondary to a swallowing disorder in patients with Parkinson‘s disease? Parkinsonism Relat Disord 2008;14(3):243 – 5.
65. Del Tredici K, Hawkes CH, Ghebremedhin E, et al. Lewy pathology in the submandibular gland of individuals with incidental Lewy body disease and sporadic Parkinson‘s disease. Acta Neuropathol 2010;119(6):703 – 13. doi: 10.1007/s00401-010-0665-2.
66. Kalf JG, Da Swart BJ, Bloem BR, et al. Prevalence of oropharyngeal dysphagia in Parkinson‘s disease: a meta-analysis. Parkinsonism Relat Disord 2012;18(4):311 – 5. doi: 10.1016/j.parkreldis.2011.11.006.
67. Müller J, Wenning GK, Verny M, et al. Progression of dysarthria and dysphagia in postmortem-confirmed parkinsonian disorders. Arch Neurol 2001;58(2):259 – 64.
68. Matsumoto H, Sengoku R, Saito Y, et al. Sudden death in Parkinson‘s disease: a retrospective autopsy study. J Neurol Sci 2014;343(1 – 2):149 – 52. doi: 10.1016/j.jns.2014.05.060.
69. Tanaka Y, Kato T, Nishida H, et al. Is there a delayed gastric emptying of patients with early-stage, untreated Parkinson‘s disease? An analysis using the 13C-acetate breath test. J Neurol 2011;258(3):421 – 6. doi: 10.1007/s00415-010-5769-z.
70. Müller T, Erdmann C, Bremen D, et al. Impact of gastric emptying on levodopa pharmacokinetics in Parkinson disease patients. Clin Neuropharmacol 2006;29(2):61 – 7.
71. Doi H, Sakakibara R, Sato M, et al. Plasma levodopa peak delay and impaired gastric emptying in Parkinson‘s disease. J Neurol Sci 2012;319(1 – 2):86 – 8. doi: 10.1016/j.jns.2012.05.010.
72. Cersosimo MG, Benarroch EE. Neural control of the gastrointestinal tract: implications for Parkinson disease. Mov Disord 2008;23(8):1065 – 75.
73. Marrinan S, Emmanuel AV, Burn DJ. Delayed gastric emptying in Parkinson‘s disease. Mov Disord 2014;29(1):23 – 32. doi: 10.1002/mds.25708.
74. Abbot RD, Ross GW, Petrovitch H, et al. Bowel movement frequency in late-life and incidental Lewy bodies. Mov Disord 2007;22(11):1581 – 6.
75. Pfeiffer RF. Gastrointestinal dysfunction in Parkinson‘s disease. Parkinsonism Relat Disord 2011;17(1):10 – 5. doi: 10.1016/j.parkreldis.2010.08.003.
76. Sakakibara R, Shinotoh H, Uchiyama T, et al. Questionnaire-based assessment of pelvic organ dysfunction in Parkinson‘s disease. Auton Neurosci 2001;92(1 – 2):76 – 85.
77. Gelpi E, Navarro-Otano J, Tolosa E, et al. Multiple organ involvement by alpha-synuclein pathology in Lewy body disorders. Mov Disord 2014;29(8):1010 – 8. doi: 10.1002/mds.25776.
78. Malek N, Swallow D, Grosset KA, et al. Alpha-synuclein in peripheral tissues and body fluids as a biomarker for Parkinson‘s disease – a systematic review. Acta Neurol Scand 2014;130(2):59 – 72. doi: 10.1111/ane.12247.
79. Jost WH. Gastrointestinal dysfunction in Parkinson‘s disease. J Neurol Sci 2010;289(1 – 2):69 – 73. doi: 10.1016/j.jns.2009.08.020.
80. Mathers SE, Kempster PA, Law PJ, et al. Anal sphincter dysfunction in Parkinson‘s disease. Arch Neurol 1989;46(10):1061 – 4.
81. Sung HY, Choi MG, Kim YI, et al. Anorectal manometric dysfunctions in newly diagnosed, early-stage Parkinson‘s disease. J Clin Neurol 2012;8(3):184 – 9. doi: 10.3988/jcn.2012.8.3.184.
82. Beach TG, Adler CH, Sue LI, et al. Multi-organ distribution of phosphorylated alpha-synuclein histopathology in subjects with Lewy body disorders. Acta Neuropathol 2010;119(6):689 – 702. doi: 10.1007/s00401-010-0664-3.
83. Sakakibara R, Odaka T, Uchiyama T, et al. Colonic transit time and rectoanal videomanometry in Parkinson‘s disease. J Neurol Neurosurg Psychiatry 2003;74(2):268 – 72.
84. Sakakibaara R, Tateno F, Nagao T, et al. Bladder function of patients with Parkinson‘s disease. Int J Urol 2014;21(7):638 – 46. doi: 10.1111/iju.12421.
85. Okun MS, McDonald WM, DeLong MR. Refractory nonmotor symptoms in male patients with Parkinson disease due to testosterone deficiency: a common unrecognized comorbidity. Arch Neurol 2002;59(5):807 – 11.
86. Langston JW, Fornno LS. The hypothalamus in Parkinson disease. Ann Neurol 1978;3(2):129 – 33.
87. Möller JC, Eggert KM, Unger M, et al. Clinical risk benefit assessment of dopamine agonists. Eur J Neurol 2008;15(Suppl 2):15 – 23. doi: 10.1111/j.1468-1331.2008.02214.x.
88. Swinn L, Schraq A, Viswanathan R, et al. Sweating dysfunction in Parkinson‘s disease. Mov Disord 2003;18(12):1459 – 63.
89. Schestatsky P, Valls-Solé J, Ehlers JA, et al. Hyperhidrosis in Parkinson‘s disease. Mov Disord 2006;21(10):1744 – 8.
90. Schestatsky P, Ehlers JA, Rieder CR, et al. Evaluation of sympathetic skin response in Parkinson’s disease. Parkinsonism Relat Disord 2006;12(8):486 – 91.
91. Braak H, Ghebremedhin E, Rüb U, et al. Stages in the development of Parkinson‘s disease-related pathology. Cell Tissue Res 2004;318(1):121 – 34.
92. Jain S, Siegle GJ, GU C, et al. Autonomic insufficiency in pupillary and cardiovascular systems in Parkinson‘s disease. Parkinsonism Relat Disord 2011;17(2):119 – 22. doi: 10.1016/j.parkreldis.2010.11.005.
93. Hori N, Takamori M, Hirayama M, et al. Pupillary supersensitivity and visual disturbance in Parkinson‘s disease. Clin Auton Res 2008;18(1):20 – 7. doi: 10.1007/s10286-008-0453-4.
94. Nguyen-Legros J. Functional neuroarchitecture of the retina: Hypothesis on the dysfunction of retinal dopaminergic circuitry in Parkinson’s disease. Surg Radiol Anat 1988;10(2):137 – 44.
95. Harnois C, Di Paolo T. Decreased dopamine in the retinas of patients with Parkinson’s disease. Invest Ophtalmol Visual Sci 1990;31(11): 2473 – 5.
96. Devos D, Tir M, Maurage CA, et al. ERG and anatomical abnormalities suggesting retinopathy in dementia with Lewy bodies. Neurology 2005;65(7):1107 – 10.
97. Goldstein DS. Orthostatic hypotension as an early finding in Parkinson’s disease. Clin Auton Res 2006;16(1):46 – 54.
98. Fujishiro H, Frigerio R, Burnett M, et al. Cardiac sympathetic denervation correlates with clinical and pathologic stages of Parkinson’s disease. Mov Disord 2008;23(8):1085 – 92. doi: 10.1002/mds.21989.
99. Orimo S, Amino T, Itoh Y, et al. Cardiac sympathetic denervation precedes neuronal loss in the sympathetic ganglia in Lewy body disease. Acta Neuropathol 2005;109(6):583 – 8.
100. Orimo S, Uchihara T, Nakamura A, et al. Axonal alpha-synuclein aggregates herald centripetal degeneration of cardiac sympathetic nerve in Parkinson’s disease. Brain 2008;131(3):642 – 50.
101. Sommer S, Aral-Becher B, Jost W. Nondipping in Parkinson‘s disease. Parkinsons Dis 2011;2011 : 897586. doi: 10.4061/ 2011/897586.
102. Luciano GL, Brennan MJ, Rothberg MB. Postprandial hypotension. Am J Med 2010;123(3):281.e1 – 6. doi: 10.1016/ j.amjmed.2009.06.026.
103.Tsukamoto T, Kitano Y, Kuno S. Blood pressure fluctuation and hypertension in patients with Parkinson‘s disease. Brain Behav 2013;3(6):710 – 4. doi: 10.1002/brb3.179.
104. Burn DJ. Beyond the iron mask: towards better recognition and treatment of depression associated with Parkinson’s disease. Mov Disord 2002;17(3):445 – 54.
105. Nilsson FM, Kessig LV, Bolwig TG. Increase risk of developing Parkinson’s disease for patients with major affective disorders. Acta Psychiatr Scand 2001;104(5):380 – 6.
106. Myslobodsky M, Lalonde FM, Hicks L. Are patients with Parkinson’s disease suicidal? J Geriatr Psychiatry Neurol 2001;14(3):120 – 4.
107. Funkiewiez A, Ardouin C, Caputo E, et al. Long-term effects of bilateral subthalamic nucleus stimulation on cognitive function, mood, and behavior in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2004;75(6):834 – 9.
108. Reichmann H, Schneider C, Löhle M. Non-motor features of Parkinson’s disease: depression and dementia. Parkinsonism Relat Disord 2009;15(Suppl 3):S87 – 92. doi: 10.1016/S1353-8020(09)70789-8.
109. Remy P, Doder M, Lees A, et al. Depression in Parkinson’s disease: loss of dopamine and noradrenaline innervation in the limbic system. Brain 2005;128(6):1314 – 22.
110. Jellinger KA. Pathology of Parkinson’s disease. Changes other than the nigrostriatal pathway. Mol Chem Neuropathol 1991;14(3):153 – 97.
111. Richard IH. Anxiety disorders in Parkinson’s disease. Adv Neurol 2005;96 : 42 – 55.
112. Shiba M, Bower JH, Maragonare DM, et al. Anxiety disorders and depressive disorders preceding Parkinson’s disease: a case-control study. Mov Disord 2000;15(4):669 – 77.
113. Weisskopf MG, Chen H, Schwarzschild MA, et al. Prospective study of phobic anxiety and risk of Parkinson’s disease. Mov Disord 2003;18(6):646 – 51.
114. Park A, Stacy M. Non-motor symptoms in Parkinson’s disease. J Neurol 2009;256(Suppl 3):293 – 8.
115. Löhle M, Storch A, Reichmann H. Beyond tremor a rigidity: non-motor features of Parkinson’s disease. J Neural Transm 2009;116(11):1483 – 92. doi: 10.1007/s00702-009-0274-1.
116. Alvez G, Wentzel-Larsen T, Jansen JP. Is fatique and independant and persistent symptom in patients with Parkinson’s disease? Neurology 2004;63(10):1908 – 11.
117. Oguru M, Tachibana H, Toda K, et al. Apathy and depression in Parkinson’s disease. J Geriatr Psychiatry Neurol 2010;23(1):35 – 41. doi: 10.1177/0891988709351834.
118. Sterkstein SE, Mayberg SE, Prezioso TJ, et al. Reliability, validity, and clinical correlates of apathy in Parkinson’s disease. J Neuropsychiatry 1992;4(2):134 – 9.
119. Pluck GC, Brown RG. Apathy in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2002;73(6):636 – 42.
120. Skorvanek M, Gdovinova Z, Rosenberger J, et al. The associations between fatigue, apathy, and depression in Parkinson‘s disease. Acta Neurol Scand 2015;131(2): 80 – 7. doi: 10.1111/ane.12282.
121. Hely MA, Reid WG, Adena MA, et al. The Sydney multicenter study of Parkinson’s disease: the inevitability of dementia at 20 years. Mov Disord 2008;23(6):837 – 44. doi: 10.1002/mds.21956.
122. Winter Y, von Campenhausen S, Arend M, et al. Health-related quality of life and its determinants in Parkinson’s disease: results of an Italian cohort study. Parkinsonism Relat Disord 2011;17(4):265 – 9. doi: 10.1016/j.parkreldis.2011.01.003.
123. Vossius C, Larsen JP, Janvin C, et al. The economic impal of cognitive impairment in Parkinson’s disease. Mov Disord 2011;26(8):1541 – 4. doi: 10.1002/mds.23661.
124. Fletcher P, Leake A, Marion MH. Patients with Parkinson’s disease dementia stay in the hospital twice as long as those without dementia. Mov Disord 2011;26(5):919. doi: 10.1002/mds.23573.
125. Sampaio C, Goetz CG, Schrag A. Rating scales in Parkinson’s disease. Oxford University Press, New York 2012.
126. Aarsland D, Kvaloy JT, Andersen K, et al. The effect of age of onset of PD on risk of dementia. J Neurol 2007;254(1):38 – 45.
127. Bronnick K, Alves G, Aarsland D, et al. Verbal memory in drugnaive, newly diagnosed Parkinson’s disease. The retrieval deficit hypothesis revisited. Neuropsychology 2010;25(1):114 – 24.
128. Hurtig HI, Trojanowski JQ, Galvin J et al. Alpha-synuclein cortical Lewy bodies correlate with dementia in Parkinson’s disease. Neurology 2000;54(10):1916 – 21.
129.Aarsland D, Perry R, Brown A, et al. Neuropathology of dementia in Parkinson’s disease: a prospective, community-based study. Ann Neurol 2005;58(5):773 – 6.
130. Braak H, Rub U, Jansen Steur EN, et al. Cognitive status correlates with neuropathologic stage in Parkinson disease. Neurology 2005;64(8):1404 – 10.
131. Mayo MC, Bordelon Y. Dementia with Lewy bodies. Semin Neurol 2014;34(2):182 – 8. doi: 10.1055/s-0034-1381741.
132. Fernandez HH, Aarsland D, Fenelon G, et al. Scales to asses psychosis in Parkinson’s disease: critiques and recommendations. Mov Disord 2008;23(4):484 – 500. doi: 10.1002/mds.21875.
133. Fenelon G, Mahieux F, Huon R, et al. Hallucinations in Parkinson’s disease: prevalence, phenomenology and risk factors. Brain 2000;123(4):733 – 45.
134. Hely MA, Morris JG, Reid WG, et al. Sydney multicenter study of Parkinson’s disease: non-L-dopa-responsive problems dominate at 15 years. Mov Disord 2005;20(2):190 – 9.
135. Fenelon G. Psychosis in Parkinson’s disease: phenomenology, frequency, risk factors, and current understanding of pathophysiologic mechanisms. CNS Spectr 2008;13(Suppl 4):18 – 25.
136. Aarsland D, Larsen J, Tandber E, et al. Predictors of nursing home placement in Parkinson’s disease: a population-based, prospective study. J Am Geriatr Soc 2000;48(8):938 – 42.
137. Papapetropoulos S, Mash D. Psychotic symptoms in Parkinson’s disease. From descriptions to etiology. J Neurol 2005;252(7):753 – 64.
138. Fernandez HH, Trieschmann ME, Okun MS. Rebound psychosis: effect of discontinuation of antipsychotics in Parkinson’s disease. Mov Disord 2005;20(1):104 – 5.
139. Pollak P, Tison F, Rascol O et al. Clozapine in drug induced psychosis in Parkinson’s disease: a randomized, placebo controlled study with open follow-up. J Neurol Neurosurg Psychiatry 2004;75(5):689 – 95.
140. Factor SA, Feustel PJ, Friedman JH, et al. Longitudinal outcome of Parkinson’s disease patients with psychosis. Neurology 2003;60(11):1756 – 61.
141. Goetz CG, Fan W, Leurgans S, et al. The malignant course of “benign hallucinations” in Parkinson’s Disease. Arch Neurol 2006;63(5):713 – 6.
142. Aarsland D, Larsen JP, Karlsen K, et al. Mental symptoms in Parkinson’s disease are important contributors to caregiver distress. Int J Geriatr Psychiatry 1999;14(10):866 – 74.
143. Aarsland D, Larsen JP, Tandberg E, Laake K. Predictors of nursing home placement in Parkinson’s disease: a population based, prospective study. J Am Geriatr Soc 2000;48(8):938 – 42.
144. Goetz CG, Stebbins GT. Mortality and hallucinations in nursing home patients with advanced Parkinson’s disease. Neurology 1995;45(4):669 – 71.
145. Weintraub D, Hurtig HI. Presentation and management of psychosis in Parkinson’s disease and dementia with Lewy bodies. Am J Psychiatry 2007;164(10):1491 – 8.
146. Harding AJ, Broe GA, Halliday GM. Visual hallucinations in Lewy body disease relate to Lewy bodies in the temporal lobe. Brain 2002;125(2):391 – 403.
147. Gescheidt T, Bares M. Impulse control disorders in patients with Parkinson‘s disease. Acta Neurol Belg 2011;111(1):3 – 9.
148. Bonfanti AB, Gatto EM. Kleptomania, an unusual impulsive control disorder in Parkinson’s disease? Parkinsonism Relat Disord 2010;16(5):358 – 9. doi: 10.1016/ j.parkreldis.2010.02.004.
149. Bienfait KL, Menza M, Mark MH, et al. Impulsive smoking in a patient with Parkinson’s disease treated with dopamine agonists. J Clin Neurosci 2010;17(4):539 – 40. doi: 10.1016/j.jocn.2009.09.001.
150. Voon V, Hassan K, Zurowski M, et al. Prospective prevalence of pathological gambling and medication association in Parkinson disease. Neurology 2006;66(11):1750 – 2.
151. Weintraub D, Siderowf AD, Potenza MN, et al. Association of dopamine agonist use with impulse control disorders in Parkinson disease. Arch Neurol 2006;63(7):969 – 73.
152. Molina JA, Sáinz-Artiga MJ, Fraile A, et al. Pathologic gambling in Parkinson’s disease: a behavioral manifestation of pharmacologic treatment? Mov Disord 2000;15(5):869 – 72.
153. Smeding HM, Goudriaan AE, Foncke EM, et al. Pathological gambling after bilateral subthalamic nucleus stimulation in Parkinson disease. J Neurol Neurosurg Psychiatry 2007;78(5):517 – 9.
154. Ardouin C, Voon V, Worbe Y, et al. Pathological gambling in Parkinson’s disease improves on chronic subthalamic nucleus stimulation. Mov Disord 2006;21(11):1941 – 6.
155. Witjas T, Baunez C, Henry JM, et al. Addiction in Parkinson’s disease: impact of subthalamic nucleus deep brain stimulation. Mov Disord 2005;20(8):1052 – 5.
156. Lhommée E, Klinger H, Thobois S, et al. Subthalamic stimulation in Parkinson’s disease: restoring the balance of motivated behaviours. Brain 2012;135(5):1463 – 77. doi: 10.1093/brain/aws078.
157. Eusebio A, Witjas T, Cohen J, et al. Subthalamic nucleus stimulation and compulsive use of dopaminergic medication in Parkinson‘s disease. J Neurol Neurosurg Psychiatry 2013;84(8):868 – 74. doi: 10.1136/jnnp-2012-302387.
158. Houeto JL, Mesnage V, Mallet L, et al. Behavioural disorders, Parkinson‘s disease and subthalamic stimulation. J Neurol Neurosurg Psychiatry 2002;72(6):701 – 7.
159. Bronstein JM, Tagliati M, Alterman RL, et al. Deep brain stimulation for Parkinson disease: an expert consensus and review of key issues. Arch Neurol 2011;68(2):165. doi: 10.1001/archneurol.2010.260.
160. Voon V, Fox SH. Medication-related impulse control and repetitive behaviors in Parkinson disease. Arch Neurol 2007;64(8):1089 – 96.
161. Weintraub D, Koester J, Potenza MN, et al. Impulse control disorders in Parkinson disease: a cross-sectional study of 3,090 patients. Arch Neurol 2010;67(5):589 – 95. doi: 10.1001/archneurol.2010.65.
162. Cilia R, Cho SS, van Eimeren T, et al. Pathological gambling in patients with Parkinson’s disease is associated with fronto-striatal disconnection: a path modeling analysis. Mov Disord 2011;26(2):225 – 33. doi: 10.1002/mds.23480.
163. Everitt BJ, Robbins TW. Neural systems of reinforcement for drug addiction: from actions to habits to compulsion. Nat Neurosci 2006;8(11):1481 – 9.
164. Giovannoni G, O’Sullivan JD, Turner K, et al. Hedonistic homeostatic dysregulation in patients with Parkinson’s disease on dopamine replacement therapies. J Neurol Neurosurg Psychiatr 2000;68(4):423 – 8.
165. Evans AH, Lawrence AD, Cresswell SA, et al. Compulsive use of dopaminergic drug therapy in Parkinson’s disease: reward and anti-reward. Mov Disord 2010;25(7):867 – 76. doi: 10.1002/mds.22898.
166. Evans AH, Katzenschlager R, Paviour D, et al. Punding in Parkinson’s disease: its relation to the dopamine dysregulation syndrome. Mov Disord 2004;19(4):397 – 405.
167. Pezzella FR, Colosimo C, Vanacore N, et al. Prevalence and clinical features of hedonistic homeostatic dysregulation in Parkinson‘s disease. Mov Disord 2005;20(1):77 – 81.
168. Evans AH, Lawrence AD, Potts J, et al. Factors influencing susceptibility to compulsive dopaminergic drug use in Parkinson’s disease. Neurology 2005;65(10):1570 – 4.
169. Robinson TE, Berridge KC. The psychology and neurobiology of addiction: an incentive-sensitization view. Addiction 2000;95(Suppl 2):S91 – 117.
170. Hanagasi HA, Akat S, Gurvit H, et al. Pain is common in Parkinson’s disease. Clin Neurol Neurosurg 2010;113(1):11 – 3. doi: 10.1016/j.clineuro.2010.07.024.
171.Beiske AG, Loge JH, Rønningen A, et al. Pain in Parkinson’s disease: prevalence and characteristics. Pain 2009;141(1 – 2):173 – 7. doi: 10.1016/j.pain.2008.12.004.
172. Valkovic P, Minar M, Singliarova H, et al. Pain in Parkinson‘s disease: a cross-sectional study of its prevalence, types, and relationship to depression and quality of life. PLoS One 2015;10(8):e0136541. doi: 10.1371/ journal.pone.0136541.
173. Nolano M, Provitera V, Estraneo A, et al. Sensory deficit in Parkinson’s disease: evidence of a cutaneous denervation. Brain 2008;131(7):1903 – 11.
174. Braak H, Sastre M, Bohl JR, et al. Parkinson’s disease: lesions in dorsal horn layer I, involvement of parasympathetic and sympathetic pre - and postganglionic neurons. Acta Neuropathol 2007;113(4):421 – 9.
175. Brefel-Courbon C, Payoux P, Thalamas C, et al. Effect of levodopa on pain threshold in Parkinson’s disease: a clinical and positron emission tomography study. Mov Disord 2005;20(12):1557 – 63.
176. Gebhart GF. Descending modulation of pain. Neurosci Biobehav Rev 2004;27(8):729 – 37.
177. Scherder E, Wolters E, Polman C, et al. Pain in Parkinson’s disease and multiple sclerosis: its relation to the medial and lateral pain systems. Neurosci Biobehav Rev 2005;29(7):1047 – 56.
178. Park A, Stacy M. Non-motor symptoms in Parkinson’s disease. J Neurol 2009;256(Suppl 3):293 – 8. doi: 10.1007/s00415-009-5240-1.
179. Chaudhuri KR. Other symptoms. In: Chaudhuri KR, Martinez-Martin P, Odin P, eds. Handbook of non-motor symptoms in Parkinson’s disease. London: Springer Healthcare 2011 : 57 – 65.
180. Larsen JP, Karlsen K, Tandberg E. Clinical problems in non-fluctuating patients with Parkinson’s disease: a community based study. Mov Disord 2000;15(5):826 – 9.
181. van Dijk JP, Havlikova E, Rosenberger J, et al. Influence of disease severity on fatigue in patients with Parkinson‘s disease is mainly mediated by symptoms of depression. Eur Neurol 2013;70(3 – 4):201 – 9. doi: 10.1159/000351779.
182. Mitchell AW, Lewis SJ, Foltynie T, et al. Biomarkers and Parkinson’s disease. Brain 2004;127 : 1693–705.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 3-
All articles in this issue
- MikroRNA u cerebrovaskulárních onemocnění – od patofyziologie k potenciálním biomarkerům
- Současné možnosti in vivo protonové (1H) MR spektroskopie v diagnostice mozkového abscesu
- Korelace intenzity fluorescence s proporcionálním zastoupením maligních buněk ve tkáni při resekci glioblastomu s použitím 5-ALA
- Validační studie české verze Bostonského testu pojmenování
- Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
- Baha jako možné řešení jednostranné hluchoty
- Léčba gama nožem u algických syndromů v inervační oblasti nervus glossopharyngeus
- Schwannom nejspíše z krčního sympatiku – kazuistika
- Využití zolpidemu v neurorehabilitaci pacienta ve stavu minimálního vědomí – kazuistika
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
- Atypický parkinsonizmus a frontotemporální demence – klinické, patologické a genetické aspekty
- Pacient s homozygozitou mutácie E200K v rodine slovenského klastru genetickej formy Creutzfeldtovej-Jakobovej choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Schwannom nejspíše z krčního sympatiku – kazuistika
- Validační studie české verze Bostonského testu pojmenování
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


