-
Medical journals
- Career
Validita Montrealského kognitivního testu pro detekci mírné kognitivní poruchy u Parkinsonovy nemoci
Authors: O. Bezdíček 1; J. Michalec 2; T. Nikolai 1; H. Štěpánková 3; E. Panenková 3; P. Harsa 2; P. Havránková 1; J. Roth 1; M. Kopeček 3,4; E. Růžička 1
Authors‘ workplace: Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze 1; Psychiatrická klinika 1. LF UK a VFN v Praze 2; Psychiatrické centrum Praha 3; Klinika psychiatrie 3. LF UK v Praze 4
Published in: Cesk Slov Neurol N 2014; 77/110(1): 47-53
Category: Original Paper
Overview
Cíl:
Ověření diagnostického potenciálu krátkého testu pro měření kognitivního deficitu u mírné kognitivní poruchy u Parkinsonovy nemoci (PN).Úvod:
Syndrom mírné kognitivní poruchy představuje u Parkinsonovy nemoci (PN-MKP) stadium předcházející syndromu demence. Montrealský kognitivní test (MoCA) byl nedávno navržen jako standardní diagnostický postup pro vyšetření PN-MKP. Údaje o validitě a detekčních schopnostech testu MoCA v české verzi na populaci pacientů s PN-MKP dosud chybí.Metodika:
Soubor 80 pacientů s idiopatickou PN diagnostikovanou dle standardních kritérií byl vyšetřen dle diagnostického postupu pro PN-MKP. Třicet devět pacientů ze souboru splnilo kritéria pro PN-MKP a ti byli párováni dle věku a vzdělání k souboru 101 kontrolních osob (KS).Výsledky:
Celkové hrubé skóry MoCA se mezi skupinami PN-MKP a KS významně lišily (p = 0,006). Ze subskórů MoCA rozlišovaly Pozornost (p = 0,011) a Oddálené vybavení (p < 0,001). Optimální skríningový hraniční skór MoCA pro rozlišení PN-MKP na základě neuropsychologické baterie byl 28/29 s následujícími charakteristikami: senzitivita = 0,90; specificita = 0,32, pozitivní a negativní prediktivní hodnota = 0,57 a 0,76. Sestrojili jsme též regresní rovnici, pomocí které lze na dostatečně velkém souboru kontrolních osob (n = 268) odhadnout výkon v MoCA s přihlédnutím k vlivu věku a vzdělání.Závěr:
Ačkoli jsme nalezli skupinové rozdíly mezi pacienty s PN-MKP a KS, naše výsledky ukazují, že detekční potenciál testu MoCA je pro individuální diagnostiku PN-MKP neuspokojivý. Doporučujeme proto standardní neuropsychologickou baterii.Klíčová slova:
validita – mírná kognitivní porucha – diagnostická kritéria – Parkinsonova nemoc – Montrealský kognitivní testÚvod
Kognitivní změny u Parkinsonovy nemoci (PN) dle nejnovějších kritérií Litvanové et al (2012) a Emreho et al (2006) představují spektrum sahající od tzv. mírné kognitivní poruchy (PN-MKP) po syndrom demence (PN-D) [1,2]. PN-MKP je v těchto diagnostických kritériích považována za klinický syndrom, který: a) postihuje značnou část pacientů s PN; b) asociuje se s rostoucím věkem, trváním nemoci a tíží onemocnění; c) predikuje rozvoj PN-D, jenž se do osmi let může rozvinout až u 78 % pacientů [3–6]. PN-D je považován za jeden z možných projevů PN, jeho prevalence je dle metaanalýz cca 31,5 %, incidence cca 10 % nových případů z populace PN/jeden rok [7]. Jedná se tedy o významnou charakteristiku fenotypu tohoto onemocnění, jejíž přesná diagnostika je jedním ze základních cílů nově formulovaných kritérií PN-MKP (Příloha 1).
Příloha 1. Kritéria pro diagnózu PN-MKP [1]. ![Příloha 1. Kritéria pro diagnózu PN-MKP [1].](https://pl-master.mdcdn.cz/media/image/c1ebc6de1a45265038e3e4c8fb829152.jpg?version=1537796429)
Montrealský kognitivní test (Montreal Cognitive Assessment, MoCA, 2005) je krátký test kognitivní výkonnosti pro osoby vyššího věku. Byl sestrojen za účelem vyšetření MKP a syndromu demence u Alzheimerovy nemoci (AN) a ověřen na souboru pacientů s těmito onemocněními [8]. MoCA obsahuje sedm subskórů postihujících základní psychické funkce: 1. exekutivní funkce, 2. pojmenování, 3. pozornost, 4. řeč, 5. abstrakce, 6. oddálené vybavení, 7. orientace. V české verzi byl test ověřen u extrapyramidových poruch dvěma studiemi: pilotní studií na PN a validizační studií na Huntingtonově nemoci, které poskytly výborné výsledky ohledně diskriminačního potenciálu tohoto testu [9,10].
Test MoCA byl v r. 2012 doporučen Litvanovou et al [1] i jako oficiální skríningový nástroj (tzv. úroveň I), tj. úroveň orientačního, krátkého vyšetření, kdy není prostor pro administraci standardizované neuropsychologické baterie (tzv. úroveň II) pro diagnostiku PN-MKP. Základním cílem této studie je tedy ověřit použitelnost a detekční potenciál české verze MoCA pro standardní diagnostiku PN-MKP, úroveň I na základě zlatého standardu takového vyšetření, tj. úrovni II. Tato studie má proto dvě základní části: a) klinickou a b) validizační. Mezi základní cíle první části patří: a) stanovení diskriminačního potenciálu MoCA pro rozlišení mezi souborem PN-MKP a zdravými osobami párovanými dle věku, vzdělání; b) ověření detekčního potenciálu MoCA pro stanovení diagnózy PN-MKP (která je stanovena na základě standardizované baterie, úroveň II). Druhá část se soustředí na: a) ověření vlivu demografických proměnných na výkon v MoCA a na b) výpočet regresní rovnice, která by predikovala úroveň kognitivního výkonu v MoCA u nově vyšetřených osob. Všechny tyto informace o testu MoCA zatím v české verzi chybí.
Soubor a metodika
Soubor pacientů s PN-MKP byl vybrán v rámci komplexního neurologického vyšetření na Neurologické klinice 1. LF UK a VFN. Všichni vybraní pacienti splňovali Klinická diagnostická kritéria UK Parkinson’s Disease Society Brain Bank [11] a byli v době vyšetření v „ON“ stavu. Délka onemocnění a dávky pro kvantifikaci antiparkinsonské medikace byly doplněny z karet pacientů. Z celkového počtu 80 pacientů s PN bylo 16 pacientů léčeno pouze L-DOPA, 51 kombinací L-DOPA a agonistů dopaminu, u šesti pacientů byly k léčbě použity pouze agonisty dopaminu, sedm pacientů v době zařazení nemělo žádnou antiparkinsonskou léčbu. Celková dávka dopaminergní léčby byla vypočtena převedením dávky agonistů dopaminu na ekvivalent L-DOPA [12]. Škála UPDRS byla administrována zacvičeným neurologem před neuropsychologickým vyšetřením nebo byla ověřena z karet pacientů (tab. 1). Dále byli vyšetřeni standardizovanou baterií pro neuropsychologickou diagnostiku PN-MKP [1], která sestávala ze zkoušek: celková kognitivní výkonnost (úroveň I): Montrealský kognitivní test (MoCA) a Mattisova škála demence (MDRS), (úroveň II): 1. pozornost a pracovní paměť: Trail Making Test (TMT), Opakování čísel pozpátku z WAIS-III; 2. exekutivní funkce: Londýnská věž (TOL), verbální fluence na písmena N, K a P; 3. řeč: Podobnosti z WAIS-R a sémantická fluence (zvířata, oblečení, obchod); 4. paměť: Paměťový test učení (RAVLT), Obrázky rodiny z WMS-III; 5. vizuospaciální schopnosti: Bentonův test orientace čar (BJOL), Hodiny (CDT ve verzi Clox, tab. 2); funkční nezávislost jsme měřili Dotazníkem funkčního stavu (FAQ, sebeposouzení) a hodnotili dle percentilových norem [13]. Z celkového počtu 80 pacientů s idiopatickou PN splňovalo 39 kritéria Litvanové et al, úroveň II [1] pro zařazení do skupiny PN-MKP. Zestručněná kritéria uvádíme: kognitivní výkon pod –1 až –2 SD (nejméně ve dvou neuropsychologických testech, a to buď minimálně dvěma podprůměrnými testy v jedné kognitivní funkci, anebo jedním podprůměrným testem minimálně ve dvou různých kognitivních funkcích) a současné chybění významné funkční nezávislosti dané kognitivním deficitem.
Table 1. Základní popisné charakteristiky pacientského a kontrolního souboru. 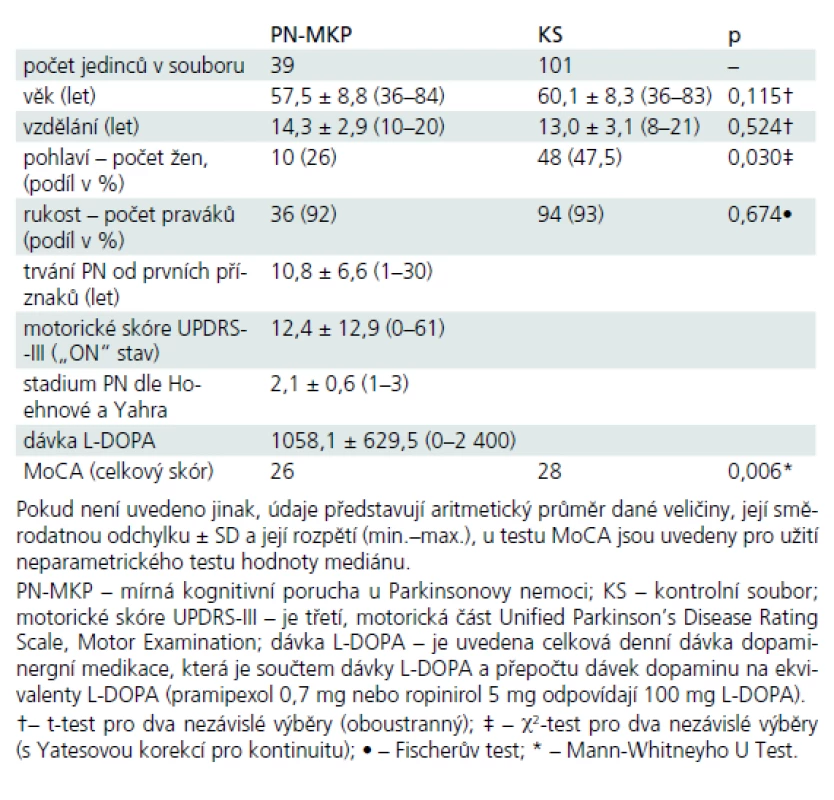
Table 2. Základní výkonové charakteristiky souboru pacientů s PN-MKP (> –1 SD na Úroveň II) dle neuropsychologické baterie (Úroveň I a Úroveň II). 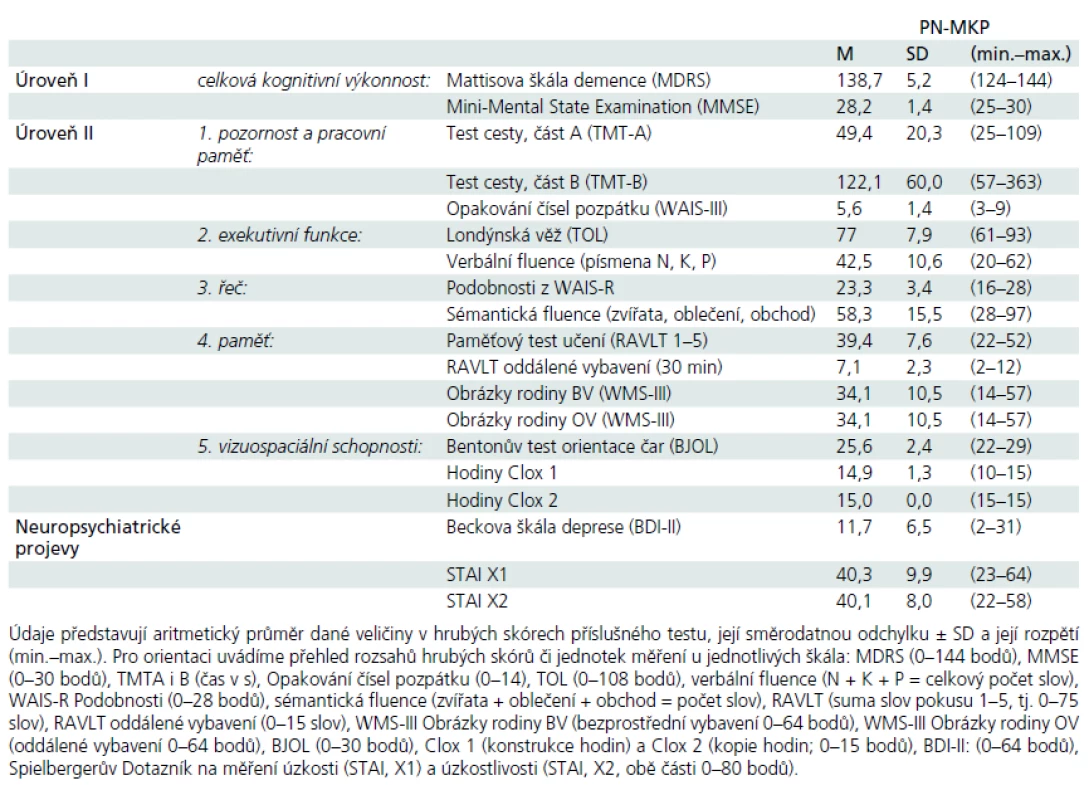
Ke skupině PN-MKP byla přiřazena kontrolní skupina se stejným věkem a vzděláním (tab. 1). Čtyřicet jedna pacientů s PN bylo z analýzy vynecháno, protože byli bez významných deficitů v kognitivní výkonnosti nebo naopak vykazovali těžší deficit v neuropsychologické baterii v kombinaci s postižením aktivit denního života (ADL). Žádný z pacientů nebyl v době vyšetření v deliriu nebo netrpěl současně PN a depresivní poruchou či jiným abnormalitami, které by zpochybňovaly diagnózu PN.
Celkový počet vyšetřených zdravých osob testem MoCA byl n = 268 (125 mužů, 143 žen; průměrný věk 62,0 ± 18,7 (19–93); průměrné vzdělání 13,9 ± 3,2 (8–28)). Všichni podstoupili anamnestické šetření a nesměli splnit vylučovací kritéria: osoby se zraněním mozku, vážným neurologickým či psychiatrickým onemocněním s vlivem na CNS, abúzem psychoaktivních látek, opakovanými anesteziemi nebo aktuálním užíváním léků či látek s vlivem na CNS. Osobám splňujícím kritéria byl administrován test MoCA v české verzi. Kontrolní soubor (KS) vznikl propojením kontrolních souborů na základě spolupráce dvou center, která se výzkumem MoCA zabývají: Psychiatrického centra Praha a Centra klinických neurověd 1. LF UK.
Sběr dat probíhal od ledna 2008 do srpna 2012. Statistická analýza výsledků byla provedena pomocí programu SPSS IBM pro Windows (Version 20, SPSS Inc., Chicago, IL, USA). Pro deskriptivní statistiku jsme užili míry: průměr, směrodatnou odchylku a variační rozpětí (minimální a maximální hodnotu), nominální proměnné jsou vyjádřeny jako poměry či procenta. Pro analýzu demografických proměnných jsme použili u věku a vzdělání t-test pro dva nezávislé výběry, u pohlaví χ2 test pro dva nezávislé výběry, u laterality horních končetin Fischerův test. Srovnání rozdílů mezi skupinami vzhledem k nenormální distribuci dat jsme ověřili neparametrickými metodami inferenční statistiky. Diskriminační potenciál MoCA k zachycení kognitivního deficitu (úrovně PN-MKP (> –1 SD na úrovni II)) u PN versus kognitivní zdraví byl hodnocen binární logistickou regresí. Byla zkonstruována ROC (Receiver Operating Characteristic) křivka, spočtena velikost oblasti pod ROC křivkou (AUC), včetně 95% CI (intervalu spolehlivosti) a pro jednotlivé hodnoty hrubého skóru MoCA spočtena senzitivita a specificita. Také byla při arbitrárně stanovené 50% prevalenci spočtena PPV (pozitivní prediktivní hodnota) a NPV (negativní prediktivní hodnota) jednotlivých hodnot hrubého skóru, ve snaze stanovit klinicky použitelný hraniční skór k diagnostice PN-MKP. Jako optimální diagnostický hraniční skór označujeme takový, který při 50% prevalenci zvyšuje post-testovou pravděpodobnost PN-MKP (> –1 SD na úrovni II) alespoň o 25 % (tj. PPV ≥ 0,75) a který má při této podmínce zároveň největší kombinovanou senzitivitu a specificitu [14,15]. Za optimální skríningový hraniční skór považujeme takový, jenž při 50% prevalenci zvyšuje post-testovou pravděpodobnost kognitivního zdraví alespoň o 25 % (tj. NPV ≥ 0,75) a který má při této podmínce zároveň největší kombinovanou senzitivitu a specificitu [14,15]. Pro výpočet očekávatelného výkonu jedince v testu MoCA jsme použili vícenásobné regresní analýzy. Odhad vnitřní konzistence MoCA jsme provedli na základě tzv. Cronbachova koeficientu alfa. Za hladinu statistické významnosti jsme zvolili α = 0,05.
Výsledky
Deskriptivní statistika
Celkový počet pacientů s diagnózou PN-MKP byl n = 39 a k nim bylo přiřazeno 101 osob dle věku a vzdělání ze souboru výše popsaných 268 subjektů (tzv. kontrolní soubor, KS). V souboru PN-MKP bylo vždy významně nižší zastoupení žen oproti KS, v lateralitě horních končetin se soubory nelišily (tab. 1).
Inferenční statistika
Pomocí Kolmogorov-Smirnovova testu jsme zjistili, že data v testu MoCA nesplňovala nároky kladené na normální rozložení ani v souboru kontrolním, ani v klinickém (všechna p < 0,001). Proto jsme použili neparametrických metod pro srovnání rozdílů mezi skupinami. Analýza rozdílů mezi skupinami: Mann-Whitneyho U test odhalil statisticky významné rozdíly v celkovém výkonu v MoCA mezi kontrolním souborem (medián (dále jen Md) = 28, n = 101) a PN-MKP (Md = 26, n = 39), U = 1 384, z = –2,76, p = 0,006, r = 0,23 (r tu označuje velikost účinku, tzv. effect size). Detailní analýza subskórů MoCA odhalila, že skupinu PN-MKP odlišuje od kontrolního souboru subskóry Pozornost, Oddálené vybavení a celkový hrubý skór MoCA (tab. 3).
Table 3. Rozdíly mezi skupinami dle jednotlivých subskórů MoCA u PN-MKP vs kontrolní osoby. 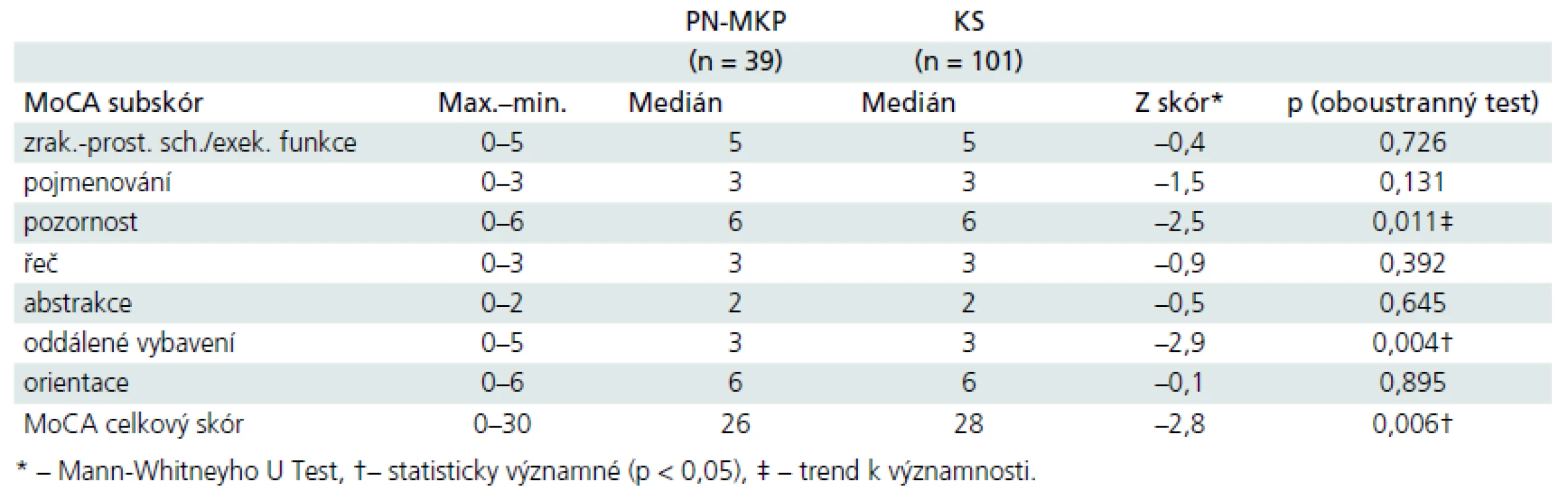
ROC analýza u PN-MKP
Diskriminační schopnost MoCA k zachycení PN-MKP vs kognitivní zdraví je názorně vidět v obr. 1, kde AUC je 0,65 (0,55–0,75). Podrobný vhled do diskriminační schopnosti jednotlivých hodnot hrubého skóru MoCA je uveden v tab. 4. Jak je patrné z obr. 1 a tab. 4, diskriminační schopnost MoCA k odlišení PN-MKP od absence kognitivního deficitu je nízká, blíží se náhodné rozlišovací schopnosti. V důsledku toho je nízká také prediktivní schopnost (PPV a NPV). Optimální diagnostický a skríningový hraniční skór je vyznačen v tab. 4.
Image 1. ROC (Receiver Operating Curve) křivka pro MoCA hrubý skór: PN-MKP vs KS. 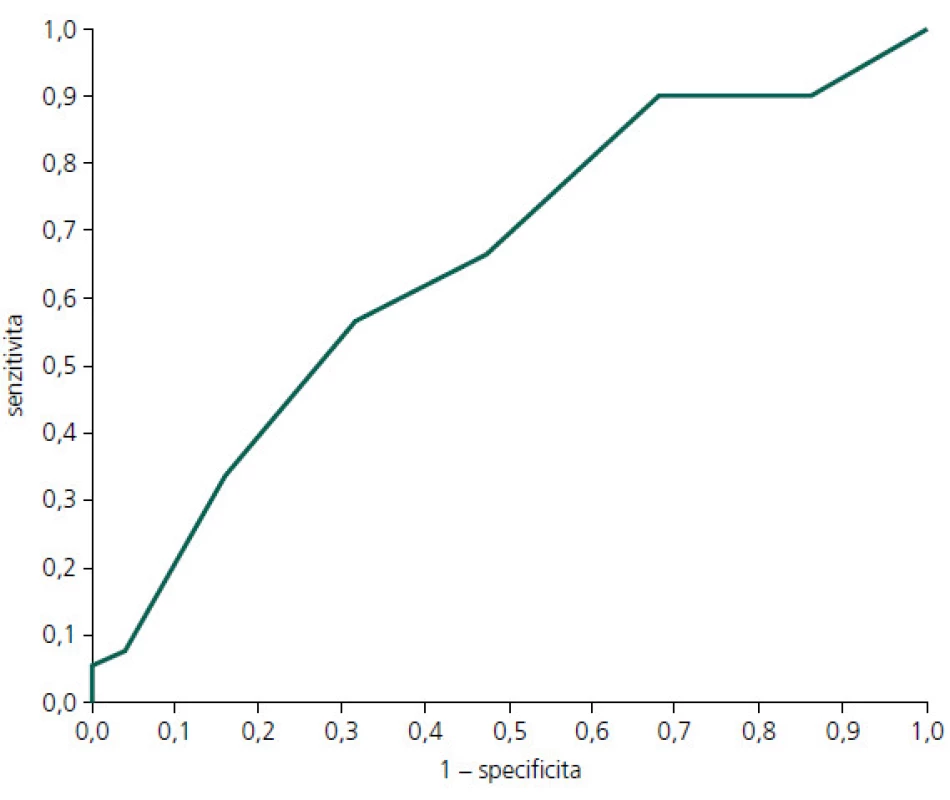
Plocha pod ROC křivou tvoří 65 % plochy grafu. Nejlepší test by předpovídal křivku sahající k levému hornímu rohu obou koordinát ROC grafu. Udával by 100% senzitivitu (žádné falešně negativní výsledky) a 100% specificitu (žádné falešně pozitivní výsledky) a plocha pod ROC křivkou by tak tvořila 100 % plochy grafu. Table 4. Diskriminační potenciál MoCA k rozlišení PN-MKP vs KS. 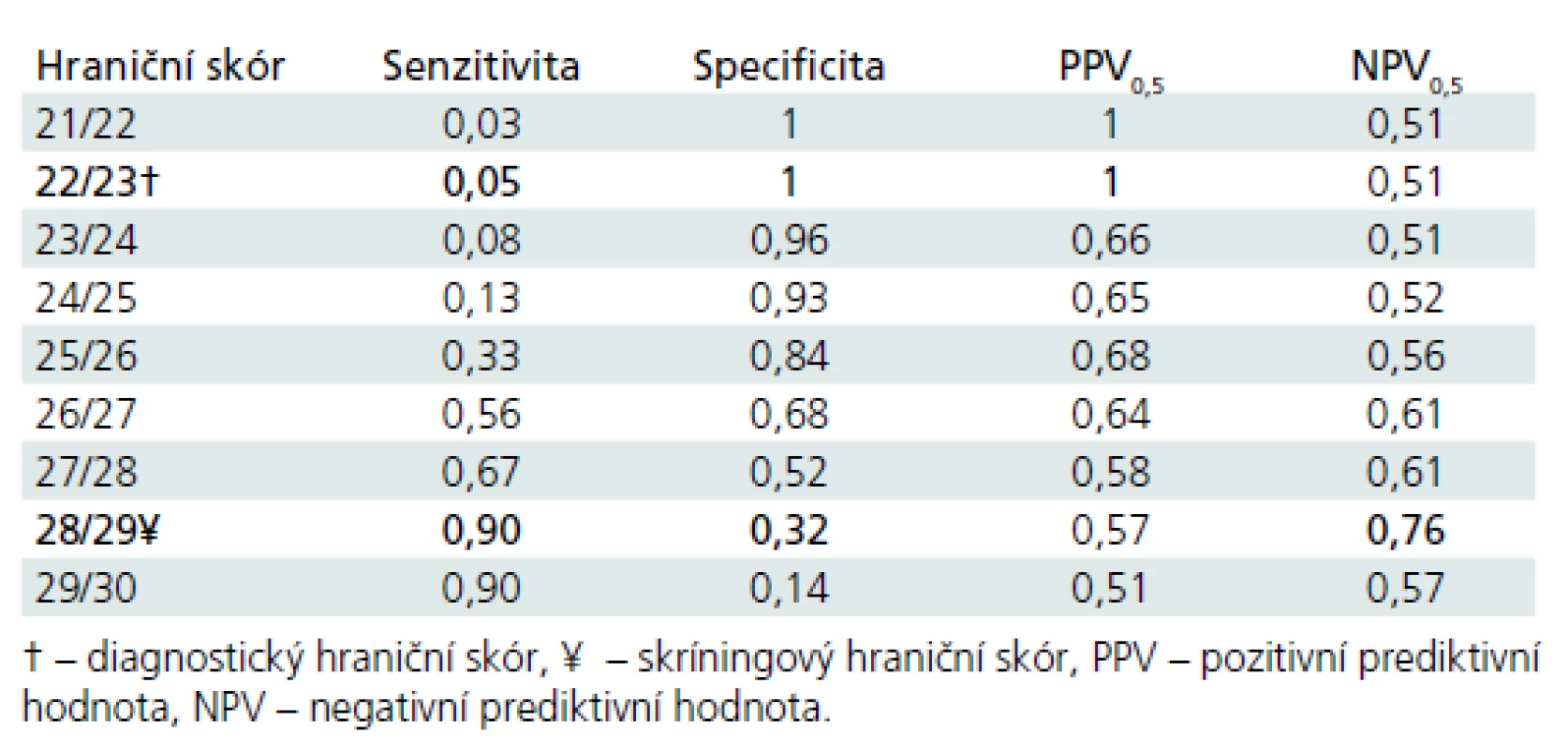
Závislost testu MoCA na věku a výpočet očekávatelného výkonu
V obr. 2 je názorně uveden vztah výkonu v MoCA a věku. Spearmanův korelační koeficient rho spočtený pro celý věkový interval od 19 do 93 let (n = 268) je roven –0,468 (p < 0,001). Z obr. 2 je patrné, že trend vztahu se liší u věkové skupiny od 19 do 49 let (n = 50), kde je vztah nesignifikantní (rho = 0,131; p = 0,364) a u věkové skupiny od 50 do 93 let (n = 218), kde je vztah věku a výkonu v MoCA negativní (rho = –0,417; p < 0,001). Vztah výkonu v MoCA a počtu let vzdělání, spočtený pro celý věkový interval od 19 do 93 let (n = 268), je rovněž signifikantní, (rho = 0,298; p < 0,001).
Image 2. Vztah výkonu v MoCA a věku v kontrolním souboru (n = 268). 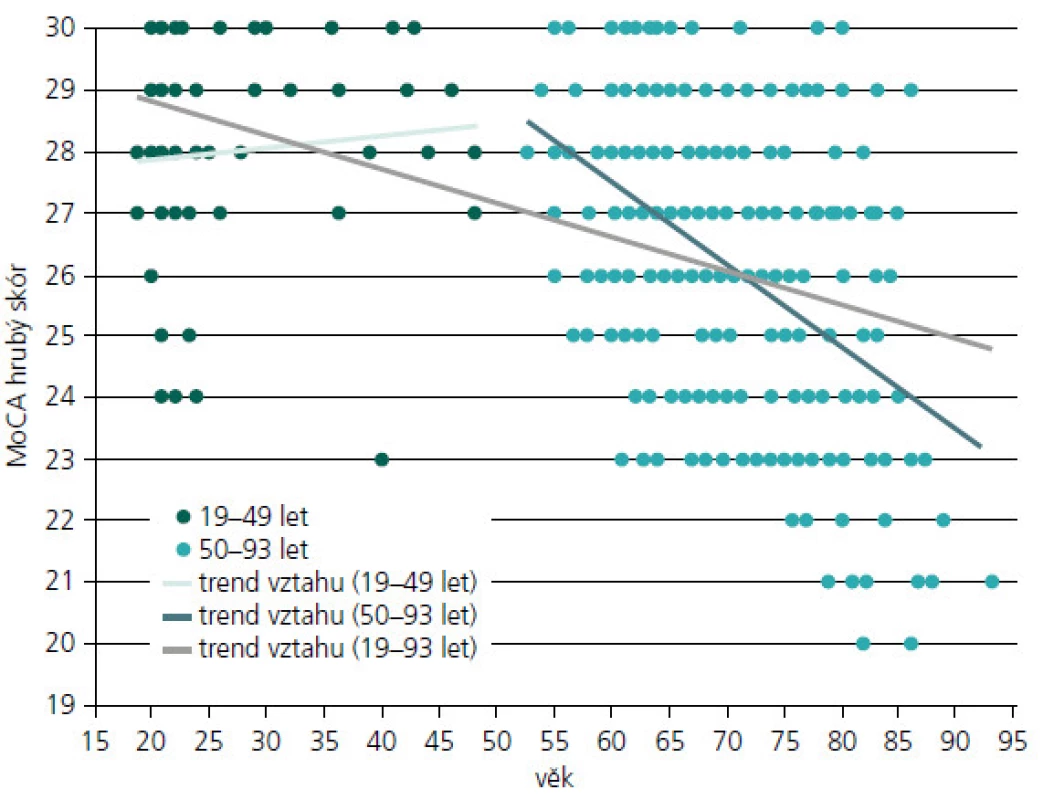
MoCA – Montrealský kognitivní test (skór 0–30). Vícenásobná regrese
Vícenásobná regresní analýza ukazuje, že věk a počet let vzdělání u lidí od 50 do 93 let společně predikují 26,4 % variability výkonu v MoCA (R = 0,514; p < 0,001). Konkrétně lze stanovit následující rovnici, na základě níž je možné pro jedince od 50 let spočítat vzhledem k věku a vzdělání očekávatelný výkon v MoCA:
očekávatelný hrubý skór MoCA = 33,483 – 0,134 × věk + 0,15 × vzdělání
Pro věkovou skupinu od 19 do 49 let obdobnou rovnici stanovit nelze, protože v tomto modelu věk a počet let vzdělání nejsou signifikantní prediktory výkonu v MoCA (R = 0,3; p = 0,109).
Reliabilita MoCA (vnitřní konzistence)
V celém souboru (kontrolním i klinickém, n = 327) činilo Cronbachovo alfa (na standardizovaných položkách) = 0,66 (95% CI 0,613–0,722), pouze v kontrolním (n = 268) = 0,61 (95% CI 0,591––0,715), pouze v klinickém (PN-MKP, n = 39) = 0,74 (95% CI 0,609–0,821).
Diskuze
Cílem této studie bylo stanovit potenciál krátké zkoušky kognitivní výkonnosti MoCA pro diskriminaci mezi skupinami KS a PN-MKP, a to jak na úrovni celých skupin (inferenční statistika), tak na úrovni jednotlivců (ROC analýza). Výsledky inferenční statistiky potvrdily významný rozdíl celkového skóru MoCA mezi oběma skupinami. Podrobnější analýza ukázala nejvýraznější skupinový rozdíl mezi PN-MKP a KS v subskóru MoCA Oddálené vybavení. To je poněkud překvapující zjištění, protože od raných fází rozvoje PN jsou obvykle nalézány především specifické kognitivní změny fronto-striatálního typu [16]. MoCA subskór Zrakově-prostorové schopnosti/Exekutivní funkce však mezi skupinami nediskriminoval (tab. 3). Tato zjištění si vysvětlujeme nedostatečným rozsahem jednotlivých úloh zařazených do MoCA (např. TMT-B) a dále způsobem skórování těchto úloh (např. preference binárních skórů oproti časovým v sekundách u TMT-B). Stručně shrnuto, tato zjištění bychom přičítali spíše skórování a konstrukci MoCA než nepřítomnosti specifických fronto-striatálních změn u PN-MKP.
V rámci hodnocení diskriminačního potenciálu MoCA k rozlišení jednotlivců s PN-MKP vs kontrolní skupiny (KS) je optimální diagnostický hraniční skór stanoven na hodnotě 22/23 bodů. Pro každého testovaného jedince, který má v MoCA 22 a méně bodů, se post-testově zvyšuje pravděpodobnost, že má PN-MKP na celých 100 %. Ve zkoumaném souboru má však 22 a méně bodů pouze 5 % pacientů s PN-MKP (senzitivita), což znamená, že jeho použitelnost v klinické praxi je nízká. V našem souboru je optimální skríningový hraniční skór stanoven na hodnotě 28/29 bodů. Ten bychom v české verzi MoCA doporučili užívat v klinické praxi pro orientační diagnostiku kognitivního deficitu u PN-MKP. V případě, že jedinec v MoCA dosáhne 29 nebo 30 bodů, výrazně se zvyšuje pravděpodobnost, že nemá PN-MKP. V KS má však 29 nebo 30 bodů pouze 32 % jedinců (specificita), což společně rovněž nečiní tento hraniční skór příliš užitečným pro klinickou praxi. Tyto výsledky podtrhují neuspokojivé vlastnosti MoCA pro diagnostiku PN-MKP na individuální úrovni. Souhrnně lze říci, že v KS má 26 a více bodů uspokojivých 84 % jedinců (specificita). Detekční potenciál MoCA je tedy pro rozlišení pacientů s PN-MKP od kontrol nízký a nedoporučili bychom jej z těchto důvodů jako jedinou zkoušku pro diagnostiku kognitivní výkonnosti u pacientů s PN-MKP (úroveň I). Náš nález je shodný s některými zahraničními studiemi, které ukazují, že detekční potenciál MoCA u PN-MKP není vysoký [15,17]. Dále výkonnost KS v české verzi MoCA se blíží spíše severoamerickým populačním studiím [18] než přísně selektovanému souboru z originální studie [8].
K výpočtu očekávatelného výkonu v MoCA bychom jako příklad vzali ženu (62 let a 12 let vzdělání) bez zatím známé diagnózy odeslanou pro podezření na kognitivní deficit a jeho ověření. V MoCA podala výkon HS = 21/30 bodů. Potřebujeme však vzhledem k jejímu vyššímu věku a střednímu vzdělání odhadnout, v kterém pásmu výkonnosti by se ve srovnání s naším KS nacházela, kdybychom vliv těchto proměnných vzali v potaz, proto: 33,483 - 0,134 × 62 + 0,15 × 12 = 24,875 + 1,8 = 26,675 ≈ 27 bodů HS v MoCA (min.–max. 0–30 bodů). Tato žena se nachází s 21 body 6 bodů pod očekávaným výkonem vzhledem k věku a vzdělání (ten by měl být na základě odhadu regresní rovnice ca. 27 bodů). Dle obrázku 2 je vidět, že nikdo z kohorty kolem 60 let z našeho KS neměl výsledek 22 bodů a horší. Její výkon bychom hodnotili jako podprůměrný vzhledem k věku a vzdělání. A to je oproti původnímu naměřenému skóru číslo, které nás zajímá přednostně u skupin s extrémními výkony. Zde původní celkový skór MoCA, vzhledem k jeho závislosti na věku a vzdělání, může být těmito faktory významně ovlivněn (zejména u osob se základním nebo velmi vysokým vzděláním, popřípadě u osob starých např. nad 75 let apod.) [19]. A proto bychom nedoporučili v těchto případech použít pouze cut-off skóry (např. < 26 bodů), jak se uvádí v originální studii MoCA [8], ale porovnat jejich výkon i dle uvedené regresní rovnice.
Odhad vnitřní konzistence (reliability škály MoCA) důležitý z hlediska přesnosti měření tímto nástrojem. Reliabilita ve smyslu vnitřní konzistence označuje míru, do jaké položky (zde subskóry MoCA) kladně a vysoce korelují, „jak drží pohromadě“ [20]. Vnitřní konzistence je vzhledem ke krátkosti škály MoCA u celého souboru zdravých osob (n = 268) v pásmu dostatečném, podobně i v KS (v obou α < 0,7), v souboru klinickém je však o něco vyšší a lze ji považovat za dobrou (α > 0,7).
Neopomeňme zmínit se o několika nedostatcích, které se nepodařilo ze studie odstranit. Za prvé náš kontrolní soubor byl složen pouze z účastníků, kteří splnili kritéria pro zařazení. Ta byla ale založena pouze na anamnéze a testu MoCA (nikoliv neuropsychologické baterii, jako tomu bylo u souboru PN-MKP), další zdravotní vyšetření nepodstoupili (např. vyšetření mozkomíšního moku, krve či zobrazení mozku). Za druhé jejich výběr byl nenáhodný. Za třetí tato studie pracovala s transverzálním vyšetřením, ani pacienti, ani kontrolní skupina nebyli sledováni po delší dobu, aby se dala postihnout progrese změn směrem k prohloubení deficitů PN-MKP. Protože neexistují česká normativní data pro neuropsychologickou baterii, použili jsme zahraniční normy [21].
Závěr
Závěrem lze říci, že tato studie prokazuje, že celkový skór a subskóry Pozornost a Oddálené vybavení české verze MoCA sice v rozdílové skupinové statistice rozlišují mezi skupinami PN-MKP a KS, ale detekční potenciál MoCA na individuální úrovni není dostatečný k tomu, abychom mohli tento test používat samostatně bez dalších testů neuropsychologické baterie pro diagnostiku kognitivního deficitu u syndromu PN-MKP. Práce na rozsáhlém kontrolním souboru z české populace dále ukázala možnost výpočtu výkonu MoCA upraveného dle věku a vzdělání pro diagnostiku kognitivního deficitu u starších osob, což podstatně zpřesňuje měrné vlastnosti české verze MoCA.
Autoři děkují Mgr. Petře Balabánové za pomoc při sběru dat.
Tento výzkum byl podpořen granty Univerzity Karlovy GAUK 251196 118410, PRVOUK-P26/LF1/4 a IGA MZ ČR NT 13145 a MŠM LH13256.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 15. 2. 2013
Přijato do tisku: 5. 9. 2013
Mgr. Ondřej Bezdíček
Neurologická klinika a Centrum klinických neurověd
1. LF UK a VFN
Kateřinská 30
128 21 Praha 2
e-mail: ondrejb@yahoo.com
Sources
1. Litvan I, Goldman JG, Tröster AI, Schmand BA, Weintraub D, Petersen RC et al. Diagnostic criteria for mild cognitive impairment in Parkinson’s disease: Movement Disorder Society Task Force guidelines. Mov Disord 2012; 27(3): 349–356.
2. Emre M, Aarsland D, Brown R, Burn DJ, Duyckaerts C, Mizuno Y et al. Clinical diagnostic criteria for dementia associated with Parkinson’s disease. Mov Disord 2007; 22(12): 1689–1707.
3. Litvan I, Aarsland D, Adler CH, Goldman JG, Kulisevsky J, Mollenhauer B et al. MDS Task Force on mild cognitive impairment in Parkinson’s disease: critical review of PD-MCI. Mov Disord 2011; 26(10): 1814–1824.
4. Hely MA, Reid WG, Adena MA, Halliday GM, Morris JG. The Sydney multicenter study of Parkinson’s disease: the inevitability of dementia at 20 years. Mov Disord 2008; 23(6): 837–844.
5. Aarsland D, Tandberg E, Larsen JP, Cummings JL. Frequency of dementia in Parkinson disease. Arch Neurol 1996; 53(6): 538–542.
6. Aarsland D, Andersen K, Larsen JP, Lolk A, Kragh-Sørensen P. Prevalence and characteristics of dementia in Parkinson disease: an 8-year prospective study. Arch Neurol 2003; 60(3): 387–392.
7. Dubois B, Burn D, Goetz C, Aarsland D, Brown RG, Broe GA et al. Diagnostic procedures for Parkinson’s disease dementia: recommendations from the movement disorder society task force. Mov Disord 2007; 22(16): 2314–2324.
8. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005; 53(4): 695–699.
9. Bezdíček O, Balabánová P, Havránková P, Roth J, Růžička E. Srovnání české verze Montrealského kognitivního testu s Mini-Mental State pro stanovení kognitivního deficitu u Parkinsonovy nemoci. Cesk Slov Neurol N 2010; 73/106(2): 150–156.
10. Bezdicek O, Majerova V, Novak M, Nikolai T, Ruzicka E, Roth J. Validity of the Montreal Cognitive Assessment in the detection of cognitive dysfunction in Huntington’s disease. Appl Neuropsychol Adult 2013; 20(1): 33–40.
11. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992; 55(3): 181–184.
12. Tomlinson CL, Stowe R, Patel S, Rick C, Gray R, Clarke CE. Systematic review of levodopa dose equivalency reporting in Parkinson’s disease. Mov Disord 2010; 25(15): 2649–2653.
13. Bezdíček O, Lukavský J, Preiss M. Validizační studie české verze dotazníku FAQ. Cesk Slov Neurol N 2011; 74/107(1): 36–42.
14. Fagan TJ. Letter: Nomogram for Bayes theorem. N Engl J Med 1975; 293(5): 257.
15. Kasten M, Bruggemann N, Schmidt A, Klein C. Validity of the MoCA and MMSE in the detection of MCI and dementia in Parkinson disease. Neurology 2010; 75(5): 478.
16. Pillon B, Boller F, Levym R, Dubois B. Cognitive deficits and dementia in Parkinson’s disease. In: Boller F, Cappa SF (eds). Handbook of neuropsychology. Aging and dementia. 2nd ed. Amsterdam: Elsevier 2001 : 311–371.
17. Hoops S, Nazem S, Siderowf AD, Duda JE, Xie SX, Stern MB et al. Validity of the MoCA and MMSE in the detection of MCI and dementia in Parkinson disease. Neurology 2009; 73(21): 1738–1745.
18. Rossetti HC, Lacritz LH, Cullum CM, Weiner MF. Normative data for the Montreal Cognitive Assessment (MoCA) in a population-based sample. Neurology 2011; 77(13): 1272–1275.
19. Crawford JR, Howell DC. Regression equations in clinical neuropsychology: an evaluation of statistical methods for comparing predicted and obtained scores. J Clin Exp Neuropsychol 1998; 20(5): 755–762.
20. Urbánek T, Denglerová D, Širůček J. Psychometrika. Měření v psychologii. Praha: Portál 2011.
21. Mitrushina M, Boone KB, Razani J, D’Elia LF. Handbook of Normative Data for Neuropsychological Assessment. 2nd ed. New York: Oxford University Press 2005.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2014 Issue 1-
All articles in this issue
- Chirurgická léčba hydrocefalu
- Možnosti pohybových aktivit u pacientů s roztroušenou sklerózou mozkomíšní
- Upozornění na klasifikační, terminologické a obsahové inovace Mezinárodní klasifikace bolestí hlavy (ICHD-3 beta) pro primární bolesti hlavy
- Je dlouhodobá disabilita u roztroušené sklerózy spojena s difuzní mozkovou patologií nezávislou na relapsech?
- Predikce pooperačního stavu u spondylogenní cervikální myelopatie
- Validita Montrealského kognitivního testu pro detekci mírné kognitivní poruchy u Parkinsonovy nemoci
- Hodnocení kvality klinických doporučených postupů České neurologické společnosti ČLS JEP
- Kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013
- Intraspinální juxtaartikulární cysty bederní páteře
- Mikrochirurgická léčba symptomatických pineálních cyst
- Česká verze Autonomic Scale for Outcomes in Parkinson’s Disease (SCOPA-AUT) – dotazníku k hodnocení přítomnosti a závažnosti příznaků autonomních dysfunkcí u pacientů s Parkinsonovou nemocí
- Význam elektromyografie v chirurgické rekonstrukci spasticity horní končetiny
- Parézy hlavových nervů a nekrotizující zánět zevního zvukovodu – dvě kazuistiky
- Úleva od neuropatické bolesti pomocí odvracení pozornosti – kazustika
- Lokální trombolýza u závažné formy trombózy mozkových žil a splavů – dvě kazuistiky
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Výsledky programu hluboké mozkové stimulace v Olomouci
- Nedostatečná antikoagulační terapie v primární prevenci kardioembolických cévních mozkových příhod – výsledky deskriptivní prevalenční studie
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mikrochirurgická léčba symptomatických pineálních cyst
- Chirurgická léčba hydrocefalu
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

