-
Medical journals
- Career
Peroperační kontrola funkce extra-intrakraniálního bypassu ultrazvukovými metodami
Authors: J. Fiedler 1,2; V. Přibáň 1,2; M. Bombic 1
Authors‘ workplace: Neurochirurgické oddělení, Nemocnice České Budějovice, a. s. 1; Neurochirurgická klinika LF MU a FN Brno 2
Published in: Cesk Slov Neurol N 2011; 74/107(1): 62-66
Category: Short Communication
Overview
Cíl:
Posouzení průchodnosti nízkoprůtokového extra-intrakraniálního bypassu pomocí mikrovaskulární dopplerovské sonografie. Určení absolutní hodnoty průtoku krve s ohledem na možnou změnu operačního postupu pomocí ultrazvukového flowmetru.Metodika:
V období VIII/2008–III/2010 jsme provedli 10 nízkoprůtokových extra-intrakraniálních bypassů v indikaci hemodynamické mozkové ischemie. K průkazu vyčerpané cerebrovaskulární rezervní kapacity byl použit transkraniální doppler a zátěžové perfuzní CT. Byla použita konvenční technika nízkoprůtokového bypassu.Výsledky:
V souboru nebyla zaznamenána třicetidenní neurologická morbidita ani mortalita. V jednom případě jsme zjistili časný asymptomatický uzávěr bypassu bez neurologických následků. Ve třech případech (3/10) přihlédnutí k výsledkům ultrazvukového flowmetru modifikovalo náš operační postup.Závěr:
Peroperační monitorování ultrazvukovým flowmetrem a mikrovaskulární dopplerovskou sonografií je jednoduchá a reprodukovatelná technika. Prokáže aktuální poruchy průtoku v bypassu při technické chybě, a tím umožní okamžitou nápravu.Klíčová slova:
revaskularizace mozku – ischemie mozku – dopplerovská sonografie – cerebrovaskulární cirkulaceÚvod
Techniku nízkoprůtokového extra-intrakraniálního mozkového bypassu zavedli Yaşargil a Donaghy roku 1967 [1,2]. Dnes je jeho hlavní indikace posílení průtoku krve mozkem při uzávěru povodí vnitřní karotidy (ACI) a průkazu vyčerpané cerebrovaskulární rezervní kapacity (CVRC) [3–5]. V této situaci může nízkoprůtokový extra-intrakraniální bypass snížit riziko recidivy iktu [3,6].
Mikrochirurgická technika extra-intrakraniálního bypassu je pokládána při dobrém laboratorním tréninku za jednoduchou. Časná průchodnost bypassu je ve zkušených rukou a na velkých souborech pacientů vysoká: 91–97 % [2,7–10]. Přesto je nezanedbatelné procento pacientů, u kterých spojka nefunguje. Obvykle při uzávěru nenastávají komplikace (zejména charakteru ischemického iktu), nicméně „zbytečnost“ operačního zákroku a zátěž pacienta jsou pro operatéra frustrující. Jakákoliv metoda, která může časně detekovat technickou chybu chirurga, je proto u této operace velice cenná.
Mikrovaskulární dopplerovská sonografie (MDS) je zavedená metoda v cerebrovaskulární chirurgii [11,12]. Vyšetření ultrazvukovým flowmetrem (transit time flow-measurement, TTFM) umožňuje peroperační stanovení průtoku zvolenou cévou v absolutních hodnotách [13]. Jeho použití je dosud omezeno na několik málo pracovišť, která se problematice bypassu věnují intenzivně. Autoři předkládají první zkušenosti s kombinovaným monitoringem MDS a TTFM se zřetelem na ovlivnění operační taktiky během extra-intrakraniálního bypassu.
Metodika
Institucionální protokol a výsledky
Od února 1998 do ledna 2010 jsme operovali 72 extra-intrakraniálních mozkových anastomóz v indikaci hemodynamického selhání mozkové cirkulace. Indikační kritéria byla následující: symptomatický uzávěr cévy potvrzený na digitální substrakční angiografii (DSA), soběstačnost pacienta (modifikované Rankinovo skóre ≤ 3), průkaz vyčerpané CVRC na transkraniálním doppleru (TCD) a zátěžovém perfuzním CT [14–19]. V případě nevyšetřitelnosti pacienta na TCD se řídíme perfuzním CT [19]. V celém souboru jsme dvakrát pozorovali časný uzávěr bypassu na DSA. Další dva pozdní uzávěry extra-intrakraniálního bypassu byly sonograficky prokázány 3. a 13. měsíc pooperačně.
V indikaci hemodynamického selhání mozkové cirkulace užíváme nízkoprůtokový (konvenční) end-to-side bypass, kdy dárcem je jedna z větví arteria temporalis superficialis (ATS) a příjemcem kortikální tepna z povodí temporální větve střední mozkové tepny. Operační technika, tak jak byla popsána Yaşargilem et al, se užívá dosud [2,20].
Hodnocený klinický soubor
Věk, typ operace, její indikace, klinika a výsledky neurologické kontroly tři měsíce po operaci jsou shrnuty v tab. 1.
Table 1. Charakteristika souboru pacientů, typ operace, její indikace, typ ischemické symptomatologie předoperačně. Výsledky třetí měsíc po operaci, vývoj kliniky a CVRC. 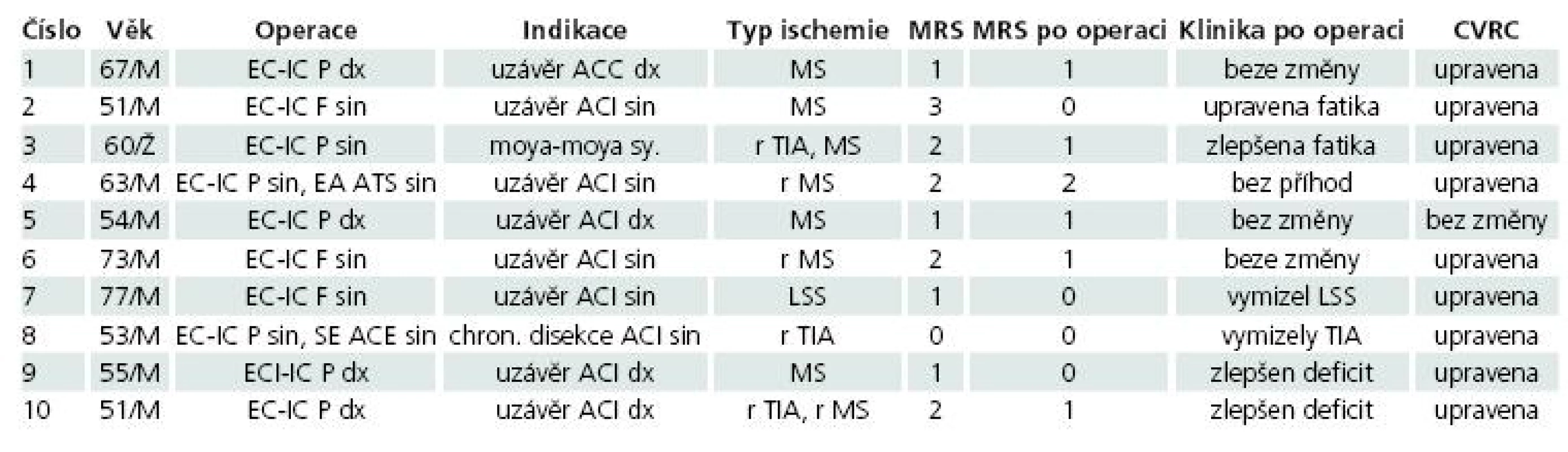
Legenda: M: muž, Ž: žena, ec-ic: extra intrakraniální mozkový bypass, ATS: a. temporalis superficialis, P: parietální větev ATS, F: frontální větev ATS, EA ATS: endarterektomie ATS, SE ACE: stumpektomie zevní karotidy, AC: a. carotis communis, ACI: a. carotis interna, ACE: a. carotis externa, MS: minor stroke, r MS: opakované MS, r TIA opakované tranzitorní ischemické ataky, LS: limb shaking syndrom, MRS: modifikovaná Rankinova škála, CVRC: cerebrovaskulární rezervní kapacita, ag: stupeň plnění na pooperační angiografii dle Schmiedeka [3] Ve skupině devíti mužů a jedné ženy operovaných v období VIII/2008–III/2010 bylo interní riziko pacientů ASA ≤ 2. Hyperkoagulační skríning prokázal u jednoho pacienta významnou elevaci faktoru VIII, u jednoho pacienta P-APC rezistenci. Všem pacientům byla od prvního kontaktu s neurologem nasazena antiagregace anopyrinem v dávce 100–200 mg denně.
Ultrazvukové vyšetření
MDS byla prováděna na přístroji MultiDop T-MDT 0920 (Compunedics Germany GmbH, Singer, Německo, 2008). Přístroj umožňuje dvoukanálové snímání velocit v kontinuálním i pulzním módu (CW/PW). Do třetího kanálu je možno připojit kapnometr k on-line kalkulaci CVRC. V případě peroperačního vyšetření pracujeme jednokanálově se sterilní 16MHz sondou pouze v pulzním módu. Kvalitativně posuzujeme tvar vlny, spektrum vlny a akustický doprovod [21]. Kvantitavní analýzu – stanovení hodnot rychlosti krevního proudu / cm × s-1/ v této indikaci nepoužíváme. Nejsme schopni zaručit stabilní úhel přiložení sondy, PW mód neumožňuje korekci úhlu snímání. Pro průkaz stenózy bypassu pomocí MDS užíváme relativní kritéria Stendela et al [22]. Výsledná informace z MDS je určení směru proudění krve (od sondy či k sondě) a závěr z kvalitativně hodnocených dat: bypass je bez komplikací, je zúžení v místě anastomózy, bypass je neprůchodný [11].
Vyšetření TTFM bylo provedeno na přístroji Transonic HT 331 (Transonic Systems, Inc., Ithaca, NY, USA). Součástí přístroje jsou perivaskulární průtokové sondy (Charbel Micro – Flow probe) pro různý kalibr cév: HQN 1,5MB, HQN 2MB a HXN 4MB. Obr. 1 ukazuje peroperační sondy pro MDS a TTFM při práci. Tělo perivaskulární sondy obsahuje dva ultrazvukové transducery, v prodloužení sondy je připojen integrovaný akustický reflektor. Céva se umístí mezi sondu a reflektor. Sonda emituje dva ultrazvukové paprsky o širokém průřezu, které jsou vůči sobě skloněny pod úhlem 45 stupňů. Do každého paprsku je zavzat celý průřez cévy, takže tranzitní čas je úměrný celkovému průtokovému objemu. TTFM pracuje na principu srovnání tranzitních časů těchto paprsků pronikajících vyšetřovanou cévou v celém průřezu. Integrací rozdílu těchto změn je určen průtok cévou v mililitrech za minutu. Hodnota takto zjištěného průtoku není závislá na úhlu přiložení, průměru cévy, hematokritu či na turbulencích v cévě [23] Přesnost metody byla stanovena in vitro [24]. Její užití v neurochirurgii spolu s popisem fyzikálního principu bylo publikováno roku 1998 [25].
Image 1. Ukázka 16MHz sondy pro MDS a 1,5MB sondy pro TTFM. 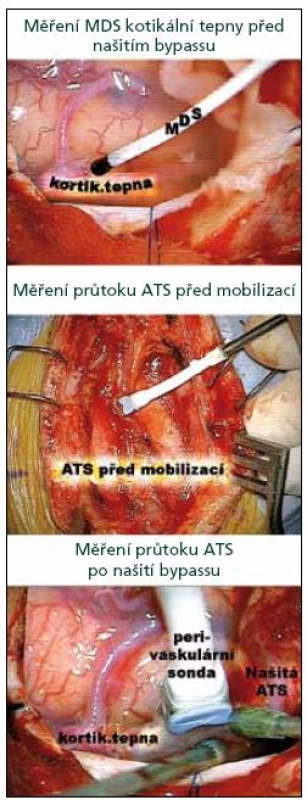
Při hodnocení extra-intrakraniálního bypassu s TTFM používáme modifikovanou metodiku, kterou popsala S. Amin--Hanjani s kolegy [26]. Hodnotíme průtok ve větvi ATS po jejím protětí a maturaci. Tato hodnota se označuje jako Cut Flow (CF) / ml × min–1/ a určuje maximální průtokový potenciál cévy. Po provedení bypassu následuje změření průtoku v temporální tepně – značíme Bypass Flow (BF) / ml × min–1/. Tato hodnota udává reálný průtok bypassem. Poměr BF/CF se označuje jako Cut Flow Index (CFI). Snížení indexu pod 0,5 se považuje za významný prediktor uzávěru bypassu [26]. Na obr. 2 je ukázka vyšetření TTFM během operace.
Image 2. Peroperační hodnoty průtoku cévou v ml/min – výstup ultrazvukového flowmetru TTFM. Význam Cut Flow a Bypass Flow je popsán v metodice ultrazvukového vyšetření. 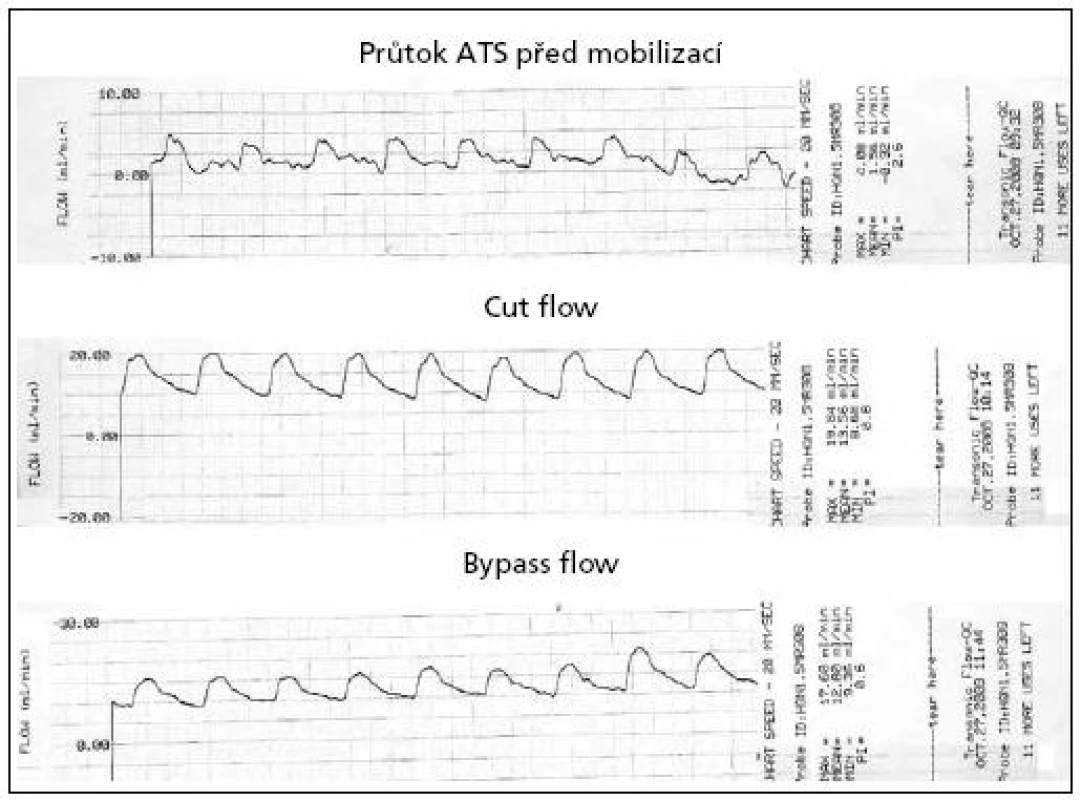
S TTFM kromě hodnoty průtoku hodnotíme index pulzatility (PI). Naměřené hodnoty jsou analogicky označeny BFPI, CFPI.
Protokol peroperačního užití MDS a TTFM je shrnut v tab. 2.
Table 2. Protokol peroperačního užití MDS a TTFM při extra-intrakraniálním bypassu. 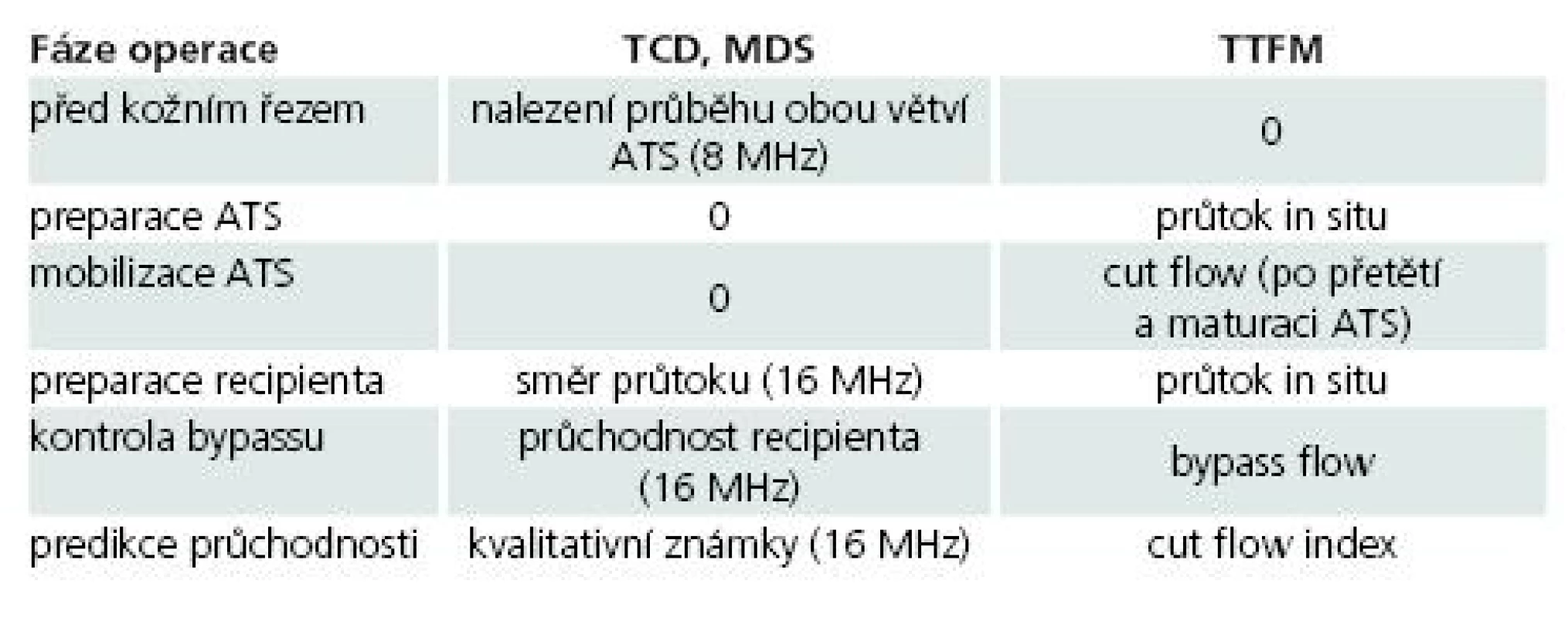
Legenda. TCD: transkraniální doppler, sonda 8 MHz; MDS: mikrovaskulární dopplerovská sonografie, sonda 16MHz; TTFM: transit time flow-measurement, ultrazvukový průtokoměr; ATS: a. temporalis superficialis; cut flow, bypass flow, cut flow index: získání hodnot těchto průtoků je popsáno v metodice Výsledky
V operovaném souboru nebyla zaznamenána třicetidenní neurologická morbidita ani mortalita. V jednom případě došlo k časnému uzávěru bypassu bez neurologických následků. CFI byl v tomto případě 0,33. Uzávěr byl asymptomatický, při neurologické kontrole třetí měsíc byla prokázána úprava CVRC. Operace byla zřejmě chybně indikována.
Výsledky všech ultrazvukových peroperačních vyšetření jsou shrnuty v tab. 3.
Table 3. Výsledky všech ultrazvukových peroperačních vyšetření. 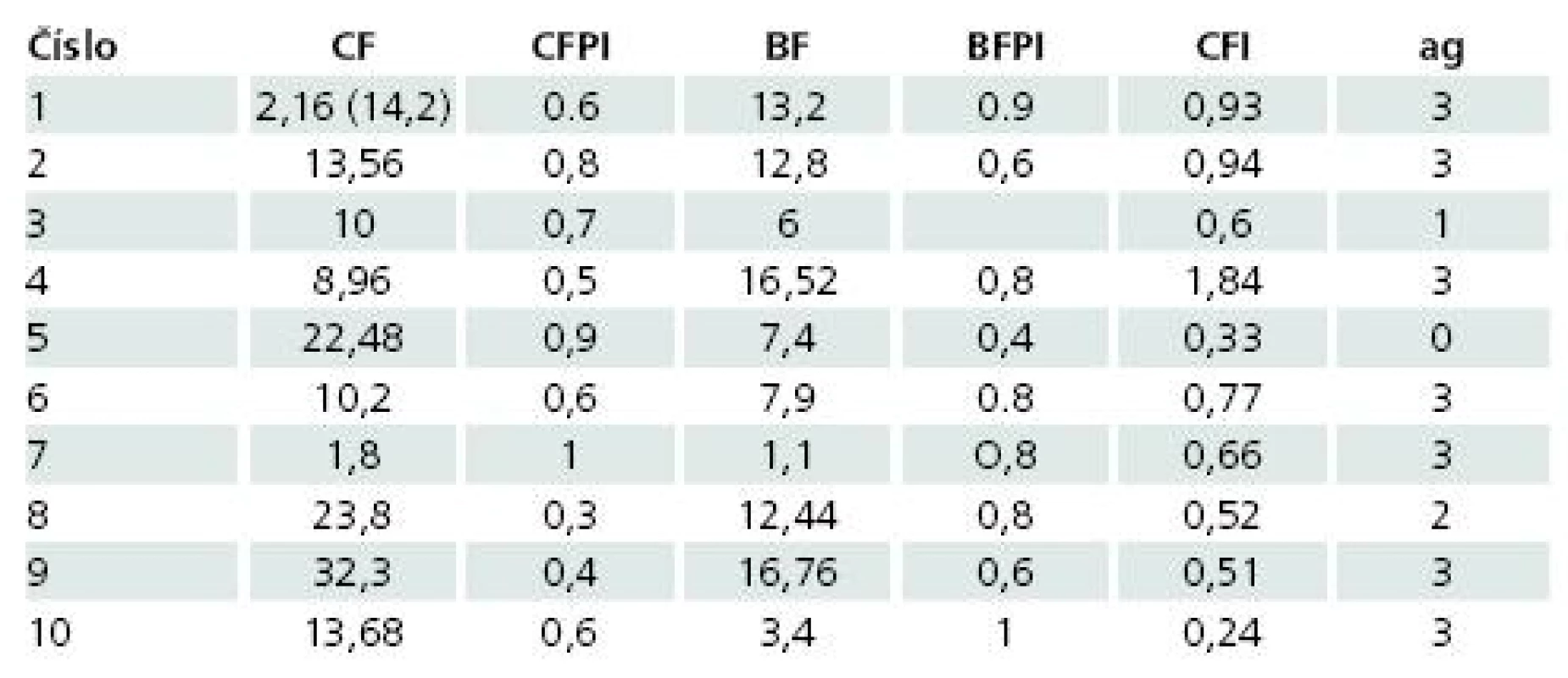
Legenda: CF: cut flow /ml × min–1/, číslo uvedené v závorce je CF po provedení endarterektomie ústí STA; CFPI: Cut Flow Goslingův index, BF: Bypass Flow /ml × min–1/, BFPI: Bypass Flow Goslingův index, CFI: Cut Flow Index, ag: pooperační DSA, plnění bypassu, stupně dle Schmiedeka [3] Změna operační taktiky na základě MDS a TTFM
Ve třech případech vedla informace z ultrazvukového vyšetření ke změně operačního postupu, z toho jednou zásadně. U pacienta č. 2, 51letého muže, měl bypass po našití průtok 12,8 ml × min–1; CFI byl 0,94. V další fázi operace byla provedena plastika tvrdé pleny, fixace kostní ploténku a sutura m. temporalis. Před sešitím podkoží při kontrole průchodnosti došlo k poklesu průtoku bypassu na 3 ml × min–1; CFI klesl na 0,22. Na základě těchto parametrů jsme se rozhodli pro revizi rány. Po povolení oteklého temporálního svalu se průtok i CFI vrátily k původním hodnotám.
V dalších dvou případech sonografické vyšetření lehce modifikovalo výkon. U pacienta č. 9, opět 51letého muže, jsme při výběru větve a. temporalis superficialis byli na základě angiografie rozhodnuti pro frontální větev. Byla lépe plněna a nebyla součástí kolateralizace uzávěru. Peroperačně jsme zaznamenali překvapivě vysoký průtok v parietální větvi, který byl vyšší než ve větvi frontální. Proto jsme parietální větev zvolili za dárce. Po protětí a maturaci parietální větve byl její průtok (CF) 32 ml × min–1. Po našití této tepny na tenkou kortikální tepnu klesl průtok bypassem (BF) 17 ml × min–1; CFI 0,51. Tento pokles byl dán gracilitou recipientní tepny. U tohoto pacienta jsme na pooperační angiografii zaznamenali 3B typ plnění bypassu.
U pacienta č. 1, 67letého muže, byl po mobilizaci parietální větve ATS extrémně nízký průtok (CF = 2,16 ml × min–1). Důvodem byla těžká ateroskleróza větve temporální tepny. Po endarterektomii ústí dárcovské tepny a další maturaci cévy se CF zlepšil. Průtok bypassem byl již kvalitní (BF = 13,2 ml × min–1). V tab. 3 je zaznamenán CF před endarterektomií ATS i po ní. U tohoto pacienta bylo prokázáno pooperační plnění 3A.
Diskuze
Průchodnost bypassu
Roku 1985 byly publikovány výsledky mezinárodní kooperativní studie [10]. Tato studie mimo jiné poskytla chirurgické výsledky, které lze označit za zlatý standard. Bylo operováno 652 pacientů. Průchodnost bypassu byla prokázána v 95 % [10].
V našem písemnictví Tovaryš prezentoval 96 pacientů s extra-intrakraniálním bypassem. Průchodnost bypassu na pooperační angiografii byla 86 % [27]. Gajdošová s Palkovičem hodnotili u 40 pacientů bypass angiograficky a elektrofyziologicky, popsali 100% průchodnost bypassu na DSA [28]. Krahulík et al dosáhli u 35 pacientů v sonografickém sledování 92% průchodnost [29]. Sameš et al u 18 pacientů prokazují 100% průchodnost bypassu na časné angiografii, třetí měsíc po operaci byl jeden bypass neprůchodný [30].
Krátkodobý uzávěr recipientní tepny na 20–40 minut při šití konvenčního bypassu není spojen s významným rizikem iktu [31]. Časný uzávěr anastomózy by mohl teoreticky vést k iktu následnou trombózou recipientní cévy či hemodynamicky. V praxi bývá uzávěr nízkoprůtokového bypassu asymptomatický. Funkce bypassu je dána průměrem přijímající a dárcovské cévy, tíží aterosklerotického postižení, poptávkou po průtoku bypassem (správná indikace), směrem našití (antidromní, syndromní) [20]. Významným technickým hendikepem konvenčního bypassu může být neadekvátně tenký kalibr recipientní cévy.
Peroperační testy průchodnosti bypassu
Je popsáno více peroperačních testů průchodnosti bypassu. Hlavním rizikovým momentem manuálního „čínského testu“ [32] je okamžik zvednutí recipientní tepny ze sulku, kdy dochází k napětí drobných perforátorů. Masáž cévy při testu je spojena s rizikem poranění intimy.
Peroperační DSA může zásadně změnit zamýšlený průběh operace extra-intrakraniálního bypassu [33]. Užití u nízkoprůtokového bypassu je popsáno pouze na třech větších souborech [34–36]. Yanaka na jejím podkladě modifikoval svůj postup u sedmi procent bypassů. Vizualizaci anastomózy peroperačně umožňuje použití dnes již široce dostupné videoangiografie s indocyaninovou zelení (near-infrared indocyanin green angiography, ICG) [37].
Peroperační ultrazvukové vyšetření
Přestože je peroperační MDS v neurochirurgii užívána přes 20 let [11,12,38], nebylo její použití popsáno na větším souboru pacientů s bypassem. Přínos TTFM při extra-intrakraniálním bypassu byl zhodnocen roku 2005 v retrospektivní analýze 51 pacienta [26].
Zde Amin–Hanjani et al popisují dvě hlavní příčiny uzávěru bypassu: indikační chyba bypassu, kdy je malá poptávka po průtoku tenkou spojkou, a technická chyba [26]. Náš protokol (tab. 2) umožňuje kombinací TTFM a MDS získat peroperační informaci o typu hrozícího problému. S výjimkou chybné indikace bypassu jej lze operativně napravit.
Kromě průtoku hodnotíme pomocí TTFM index pulzatility (PI). PI byl zaveden Goslingem et al [39] jako neinvazivní metoda stanovení periferní cévní rezistence (R). PI odvozený z rychlostí dává bohužel informaci spíše o stenóze proximálně od místa měření.
TTFM dává přesnou hodnotu průtoku během srdečního cyklu. PI se zde stanovuje z průtoku (Q): PI=(Qmax – Qmin)/Qmean, kde max, min a mean jsou hodnoty během jednoho srdečního cyklu. Tento výpočet se již více blíží Ohmovu zákonu. Změny v PI získané pomocí TTFM dávají proto více informací o potenciálním problému v cévě distálně od měření. Mozková cirkulace ve fázi hemodynamického selhání je výrazně nízkoodporová. Za této situace prokázané změny v PI po provedení anastomózy mohou vypovídat o stavu anastomózy (srovnání CFPI a BFPI). Použití hodnocení PI je zatím běžné pouze v kardiochirurgii [40].
Závěr
Měření průtoku pomocí TTFM je užitečná neinvazivní metoda, která dává absolutní hodnotu průtoku cévou. V kombinaci s MDS umožňuje peroperační detekci většiny příčin malfunkce bypassu.
MUDr. Jiří Fiedler
Neurochirurgické oddělení
Nemocnice České Budějovice, a.s.
B. Němcové 54
370 87 České Budějovice
e-mail: fiedler@nemcb.cz
Sources
1. Yaşargil MG, Krayenbuhl HA, Jacobson JH jr. Microneurosurgical arterial reconstruction. Surgery 1970; 67(1): 221–233.
2. Yaşargil MG, Yonekawa Y. Results of microsurgical extracranial-intracranial arterial bypass in the treatment of cerebral ischemia. Neurosurgery 1977; 1(1): 22–24.
3. Schmiedek P, Piepgras A, Leinsinger G, Kirsch CM, Einhaupl K. Improvement of cerebrovascular reserve capacity by EC-IC arterial bypass surgery in patients with ICA occlusion and hemodynamic cerebral ischemia. J Neurosurg 1994; 81(2): 236–244.
4. Ausman JI, Chou SN, Lee M, Klassen A. Occipital to cerebellar artery anastomosis for brainstem infarction from vertebral basilar occlusive disease. Stroke 1976; 7 : 13.
5. Amine AR, Moody RA, Meeks W. Bilateral temporal-middle cerebral artery anastomosis for Moyamoya syndrome. Surg Neurol 1977; 8(1): 3–6.
6. Garrett MC, Komotar RJ, Starke RM, Merkow MB, Otten ML, Sciacca RR et al. The efficacy of direct extracranial-intracranial bypass in the treatment of symptomatic hemodynamic failure secondary to athero-occlusive disease: a systematic review. Clin Neurol Neurosurg 2009; 111(4): 319–326.
7. Sundt TM jr, Whisnant JP, Fode NC, Piepgras DG, Houser OW. Results, complications, and follow-up of 415 bypass operations for occlusive disease of the carotid system. Mayo Clin Proc 1985; 60(4): 230–240.
8. Chater NL. Neurosurgical extracranial-intracranial bypass for stroke: with 400 cases. Neurol Res 1983; 5(2): 1–9.
9. Mendelowitsch A, Taussky P, Rem JA, Gratzl O. Clinical outcome of standard extracranial-intracranial bypass surgery in patients with symptomatic atherosclerotic occlusion of the internal carotid artery. Acta Neurochir 2004; 146(2): 95–101.
10. The EC/IC Bypass Study Group. Failure of extracranial-intracranial arterial arterial bypass to reduce the risk of ischemic stroke. Results of an international randomized trial. N Engl J Med 1985; 313(19): 1191–1200.
11. Badie B, Lee FT Jr, Pozniak MA, Strother CM. Intraoperative sonographic assessment of graft patency during extracranial-intracranial bypass. AJNR Am J Neuroradiol 2000; 21(8): 1457–1459.
12. Kramár F, Benes V, Mohapl M. Doppler scanning in aneurysm surgery. Rozhl V Chir 2001; 80(1): 9–11.
13. Amin-Hanjani S, Charbel FT. Flow-assisted surgical technique in cerebrovascular surgery. Surg Neurol 2007; 68 (Suppl 1): S4–S11.
14. Aaslid R, Eden A, Ringelstein EB et al. Transcranial Doppler sonography. Wien: Springer-Verlag 1986.
15. Markus HS, Harrison MJG. Estimation of cerebrovascular reactivity using transcranial Doppler, including the use of breath-holding as the vasodilatory stimulus. Stroke 1992; 23(5): 668–673.
16. Bishop CFR, Powell S, Insall M, Rutt D, Browse NL. The effect of internal carotid artery occlusion on middle cerebral artery blood flow at rest and response to hypercapnia. Lancet 1986; 1 : 710–712.
17. Kleiser B, Scholl D, Widder B. Assessment of cerebrovascular reactivity by Doppler CO2 and Diamox testing: which is the appropriate method? Cerebrovasc Dis 1994; 4 : 134–138.
18. Widder B, Kornhuber HH. Extra-intracranial bypass surgery in carotid artery occlusions: who benefits? Neurol Psychiat Brain Res, 1994; 2 : 126–131.
19. Hoeffner EG, Case I, Jain R, Gujar SK, Shah GV, Deveikis JP et al. Cerebral perfusion CT: Technique and clinical applications. Radiology 2004; 231(3): 632–644.
20. Vajkoczy P, Horn P, Schmiedek P. Standard STA-MCA bypass surgery in hemodynamic cerebral ischemia: indication and technique. Oper Tech Neurosurg 1999; 3(2): 106–115.
21. Arbeille P, Bouin-Pineau MH, Herault S. Accuracy of the main Doppler methods for evaluating the degree of carotid stenoses (continuous wave, pulsed wave, and color Doppler). Ultrasound Med Biol 1999; 25(1): 65–73.
22. Stendel R, Pietilä T, Al Hassan AA, Schilling A, Brock M. Intraoperative microvascular Doppler ultrasonography in cerebral aneurysm surgery. J Neurol Neurosurg Psychiatry 2000; 68(1): 29–35.
23. Drost CJ. Vessel diameter-independent volume flow measurements using ultrasound. Proc San Diego Biomed Symp 1978; 17 : 299–302.
24. Lundell A, Bergqvist D, Mattsson E, Nilsson B. Volume blood flow measurements with transit time flowmeter: An in vivo and in vitro variability and validation study. Clin Physiol 1993; 13(5): 547–557.
25. Charbel FT, Hoffman WE, Misra M, Ostergren L. Ultrasonic perivascular flow probe: Technique and application in neurosurgery. Neurol Res 1998; 20(5): 439–442.
26. Amin-Hanjani S, Du X, Mlinarevich N, Meglio G, Zhao M, Charbel F. The cut flow index: an intraoperative predictor of the success of extracranial-intracranial bypass for occlusive cerebrovascular disease. Neurosurgery 2005; 56 (Suppl 1): 75–85.
27. Tovaryš F. Zkušenosti s extra-intrakraniální arteriální anastomózou. Cesk Slov Neurol N 1983; 46/79(5): 311–315.
28. Gajdošová D, Papierniková E, Palkovič Š. Elektroencefalografická a rengenologická kontrola mikroanastomózy. Cesk Slov Neurol N 1983; 46/79(2): 120–124.
29. Krahulík D, Vaverka M, Herzig R, Hluštík P, Houdek M.Extra-intrakraniální arteriální mikroanastomóza. Cesk Slov Neurol N 2009; 72/105(2): 142–146.
30. Sameš M, Bartoš R, Vachata P, Zolal A, Cihlář F, Derner M et al. Hodnocení cerebrovaskulární rezervní kapacity po EC-IC bypassu pomocí TCD. Cesk Slov Neurol N 2009; 72/105(4): 359–363.
31. Horn P, Scharf J, Peňa-Tapia P, Vajkoczy P. Risk of intraoperative ischemia due to temporary vessel occlusion during standard extracranial-intracranial bypass surgery. J Neurosurg 2008; 108(3): 464–469.
32. Ackland DR. Tests of patency. In: Ackland DR (ed). Practice Manual for Microvascular Surgery. 2nd ed. St. Louis, Washington, D.C., Toronto: Mosby 1989 : 73–76.
33. Benes V, Netuka D, Charvát F, Mohapl M. Recanalization of Long-lasting Middle Cerebral Artery Occlusion by a Combination of Surgical and Interventional Approaches: Technical Case Report. Neurosurgery 2005; 57 (Suppl 3): 401.
34. Barrow DL, Boyer KL, Joseph GJ. Intraoperative angiography in the management of neurovascular disorders. Neurosurgery 1992; 30(2): 153–159.
35. Meguro K, Tsukada A, Matsumura A, Matsuki T, Nakada Y, Nose T. Portable digital subtraction angiography in the operating room and intensive care unit. Neurol Med Chir (Tokyo) 1991; 31(12): 768–772.
36. Yanaka K, Fujita K, Noguchi S, Matsumaru Y, Asakawa H, Anno I, et al. Intraoperative Angiographic Assessement of Graft Patency During Extracranial-Intracranial Bypass Procedures. Neurol Med Chir (Tokyo) 2003; 43(10): 509–513.
37. Woitzik J, Horn P, Vajkoczy P, Schmiedek P. Intraoperative control of extracranial-intracranial bypass patency by near-infrared incocyanine green videoangiography. J Neurosurg 2005; 102(4): 692–698.
38. Eden A. Doppler techniques and neurosurgery. Neurosurgical Rev 1984; 7(2–3): 193–197
39. Gosling RG, King DH. Arterial assessment by Doppler-shift ultrasound. Proc R Soc Med 1974; 67(1): 447–449.
40. Aleksic M, Heckenkamp J, Gawenda M, Brunkwall J.Pulsatility index determination by flowmeter measurement: a new indicator for vascular resistance? Eur Surg Res 2004; 36(6): 345–349.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery
2011 Issue 1-
All articles in this issue
- Monitoring pacientů s těžkým poraněním mozku
- Farmakologická neuroprotekce u akutní ischemické cévní mozkové příhody
- Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Validizační studie české verze dotazníku FAQ
- Resekční epileptochirurgie u pacientů s perirolandickou epilepsií
- Peroperační kontrola funkce extra-intrakraniálního bypassu ultrazvukovými metodami
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
- Extrémna hypertrofia periférnych nervových štruktúr pri CIDP – kazuistika
- Nokardiové abscesy mozku – dvě kazuistiky
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- 12-kDa FK 506-vážící protein zapojený do neuroprotektivního účinku dantrolenu v mozkové kůře potkanů po ischemicko-reperfuzním postižení
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Monitoring pacientů s těžkým poraněním mozku
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

