-
Medical journals
- Career
Metody klasické a molekulární cytogenetiky vhodné pro biodozimetrii osob s profesionální expozicí karcinogenům
Authors: Markéta Petrovová 1; Marek Svoboda 2
Authors‘ workplace: Ambulance pracovně lékařských služeb, Masarykův onkologický ústav, Brno 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2
Published in: Klin Onkol 2019; 32(4): 270-276
Category: Review
doi: https://doi.org/10.14735/amko2019270Overview
Východiska: Práce se zabývá metodami klasické a molekulární cytogenetiky vhodnými k vyšetřování cytogenetických změn u zdravotníků i jiných profesních skupin exponovaných karcinogenům. Ve zdravotnictví je biomonitoring těchto osob spolu se sledováním a hodnocením expozice chemickým látkám, cytostatikům nebo záření s karcinogenním potenciálem základem pro nastavení funkčních nápravných opatření a současně prevencí vzniku zhoubných nádorů jako nemoci z povolání.
Cíl: V přehledu jsou prezentovány principy, výhody i limity klasických cytogenetických i moderních molekulárně cytogenetických metod. Z první skupiny se jedná zejména o konvenční cytogenetickou analýzu chromozomálních aberací periferních lymfocytů osob exponovaných chemickým karcinogenům nebo vyšetřování sesterských chromatid a mikrojader po expozici ionizujícímu záření. Z novějších metod jsou uvedeny původní radioaktivní, později fluorescenční in situ hybridizace, její barevné varianty, komparativní genová hybridizace, spektrální karyotypizace, z nejnovějších mikročipové metody.
Závěr: Molekulárně cytogenetické metody umožňují zpřesnění metod používaných v biomonitoringu chemických látek i záření. Jejich přínosem je vyšší rychlost, automatizace některých procesů, vysoká citlivost, zaměření na stabilní genetické změny schopné vyvolat proces karcinogeneze a také možnost stanovení odchylek i v nedělících se buňkách. Jejich nevýhodou jsou zatím chybějící analýzy většího počtu dat z preventivních vyšetření, dosud nestanovené normy či limitní hodnoty pro exponované jednotlivce i pracovní kolektivy, stejně jako vyšší cena vyšetření.
Klíčová slova:
cytogenetická analýza – enviromentální monitoring – chromozomové aberace – konvenční cytogenetická analýza – fluorescenční in situ hybridizace – pracovní prostředí – karcinogeny
Úvod
Následkem expozice genotoxickým látkám (GTL) v pracovním prostředí může být vznik zhoubného nádoru. Pro účinnější prevenci je třeba lépe zjišťovat expozici karcinogenním látkám na pracovištích a podmínky způsobující nebo podporující vznik nádorového onemocnění. Profesionální expozice je charakteristická kontinuálním působením sledovaného rizikového faktoru v komplexní směsi s dalšími faktory na exponované pracovníky. Při poskytování zdravotních služeb jsou zdravotníci exponováni karcinogenům a mutagenům, zejména ionizujícímu záření, cytostatikům, chemickým látkám v podobě reagenčních činidel, kontrastních látek, anesteziologických plynů nebo dezinfekčních látek. Současné poznatky o souvislosti expozice na pracovišti a vznikem rakoviny zdaleka nejsou úplné. Zdrojem údajů o expozici karcinogenům na pracovišti jsou vnitrostátní rejstříky, databáze měření expozic a informační systémy evidující údaje o expozicích.
Monitorování profesionální expozice karcinogenům
Pracoviště s chemickými karcinogeny jsou pravidelně monitorována. Součástí monitoringu je sledování prostředí, identifikace mutagenní aktivity komplexních složek prostředí, monitorování biologického účinku a hodnocení biologické odpovědi lidského organizmu na působení genotoxických faktorů pracovního prostředí. Monitorování biologického účinku poskytuje informace o míře expoziční zátěže a příp. o účinnosti opatření realizovaných ke snížení expozice [1]. Ze skupinových metod hodnocení genotoxicity směřuje praxe k využití metod umožňujících co možná nejčasnější zjištění rizika. Metody, které mají výrazný preventivní potenciál, jsou shrnuty v tab. 1.
Table 1. Metody skupinového hodnocení genotoxicity. 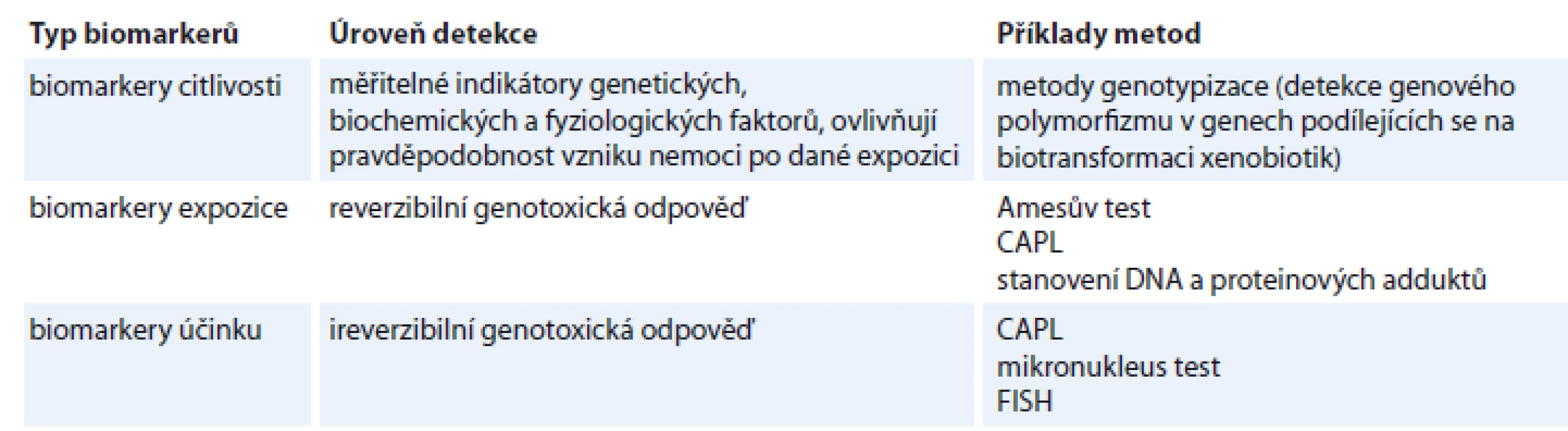
CAPL – cytogenetická analýza periferních lymfocytů, FISH – fluorescenční in situ hybridizace Typy aberací detekované biodozimetrií
Chromozomové aberace jsou všechny odchylky chromozomů, které představují změnu jejich struktury a tvaru. Ke vzniku chromozomových aberací dochází tak, že mutagenní faktor způsobí zlom, případně několik zlomů v určitém místě chromozomu, popř. chromatidy. Získané chromozomální aberace vznikají v průběhu života příslušného jedince působením mutagenních vlivů prostředí, mohou vznikat i spontánně nebo jako důsledek poruchy reparačních mechanizmů. Značná část narušení struktury DNA je pravděpodobně reparačními systémy opravena, část však zůstává neopravena a eventuální nesprávnou opravou vzniknou aberace různého typu. Působením zevních GTL vznikají hlavně strukturní chromozomové aberace jako důsledek dvouvláknových zlomů na šroubovici DNA. Dicentrické chromozomy nebo prstencové chromozomy a translokace jsou hlavními aberacemi způsobenými ionizujícím zářením. Chromatidové zlomy a chromatidové výměny jsou typické pro působení chemických látek. Stabilní chromozomové přestavby nezpůsobují ztrátu chromozomového materiálu, mohou se přenášet z buňky na buňku, kumulují se v organizmu a jsou odrazem dlouhodobé expozice GTL [2]. Ke správnému a jednotnému záznamu zjištěných odchylek slouží Mezinárodní systém cytogenetické nomenklatury (ISCN). Byla prokázána asociace mezi četností aberací a celkovou incidencí zhoubných novotvarů a také asociace mezi konkrétními typy aberací a incidencí konkrétních typů zhoubných novotvarů [3].
Základem metod hodnocení chromozomů je jejich studium v mikroskopu. Mikroskopy musí být vybaveny velmi kvalitní optikou s vysokou rozlišovací schopností. Počet sledovaných mitóz se odvíjí od závažnosti cytogenetického nálezu, v biodozimetrii u zdravých osob se provádí podrobná analýza 100–200 mitóz. Většina cytogenetických laboratoří je v současnosti vybavena počítačovou analýzou obrazu, která umožňuje rychlejší přípravu karyotypů, ukládání analyzovaných mitóz a tím i lepší dokumentaci a archivaci výsledků pro nejrůznější účely [4].
Klasické metody biodozimetrie
Patří sem zejména cytogenetická analýza periferních lymfocytů (CAPL) a mikrojaderný test, z historických metod pak stanovení výměny sesterských chromatid, stanovení dicentrů, comet assay nebo Amesův test [5].
Cytogenetická analýza periferních lymfocytů konvenční technikou
CAPL je v ČR akreditovaná standardizovaná metoda prováděná podle metodiky AHEM 1/2007. Slouží jako vratný biomarker časného genotoxického účinku, tedy v úrovni poškození, které je při včasném zjištění reponibilní, nikoliv až jako marker onemocnění. Provádí se v rámci pracovnělékařských prohlídek na pracovištích, která byla orgánem ochrany veřejného zdraví kategorizována jako riziková, a vyšetření je rozhodnutím téhož orgánu zařazeno do náplně preventivních prohlídek. Zřídka je vyšetřování poskytováno na žádost zaměstnavatele pro potřeby kategorizace práce nebo zhodnocení účinnosti provedených ochranných opatření. Prohlídky se provádějí periodicky, podle výše rizika, zpravidla v intervalu 1–2 roky. Výsledkem je individuální a současně skupinové hodnocení [6].
Metoda kvalitativně a kvantitativně analyzuje chromozomové abnormality v lidských somatických buňkách in vitro v optickém mikroskopu (obr. 1). Na lidské lymfocyty se působí mitotickým jedem kolchicinem, aby došlo ke kumulaci dělících se buněk (C-metafáze). Buňky jsou ve vhodné době zpracovány a jsou z nich připraveny mikroskopické preparáty. Preparáty jsou obarveny vhodným barvivem. Metafázické buňky jsou analyzovány z hlediska chromozomových abnormalit. Aby byla buňka započítána jako aberantní, musí u ní být nalezena alespoň některá z těchto druhů aberací – zlom, chromozomový fragment, minute, chromatidové výměny a chromozomové přestavby – dicentrický a ring chromozom, translokace. Gapy se pouze zaznamenají, do celkového hodnocení se nezapočítávají.
Image 1. Konvenční cytogenetická analýza. 
V roce 1998 byly zveřejněny hodnoty spontánní frekvence aberantních buněk podložené výsledky realizovaných rozsáhlých studií; tyto referenční hodnoty jsou používány dodnes [7]. Pro určení závislosti dávka – účinek je CAPL zatím jedinou metodou prokazující sumární karcinogenní riziko [8]. Předpokladem zvýšeného rizika vzniku nádorových onemocnění jsou opakované nálezy zvýšených hodnot chromozomových aberací. Vlivem různých translokací dochází k přeskupení onkogenů, které mohou zapříčinit vznik nových fúzních genů a v konečném důsledku tak vyústit ve vznik nádorového onemocnění. Dalším podnětem může být inaktivace některého z tumor supresorových genů, které slouží jako negativní regulátory buněčného cyklu, čímž dochází k nekontrolovatelné buněčné proliferaci a zabránění spuštění apoptózy [9].
CAPL – hodnocení výsledků
Individuální průměrné procento aberantních buněk (AB.B.) je v průběhu let konstantní. Předpokládá se, že zvýšená frekvence aberací znamená zvýšenou expozici GTL v posledních 3–4 měsících před vyšetřením. Při snížení expozice pak dochází k postupnému snižování počtu chromozomových přestaveb a zlomů až k normě. Výsledkem vyšetření konvenční cytogenetickou analýzou je zjištěné procento AB.B. Kromě hodnocení jednotlivců jsou vypracovány i postupy pro provedení skupinového testu uvedené v tab. 2. Ten je podle platné legislativy biologickým expozičním testem k hodnocení expozice GTL [10]. Při individuálním hodnocení je za rizikovou považována frekvence ≥ 5 % AB.B. Opakovaný nález takové frekvence AB.B. v rozestupu 3 měsíců znamená pro postiženého jedince zvýšené riziko vzniku nádorového onemocnění, riziko zrychleného stárnutí buněk a zvýšené riziko výskytu vrozených vad u potomků. V rámci individuálního hodnocení jsou někdy odhaleny i jiné, neočekávané individuální změny. Po zjištění vysoké expozice genotoxickým látkám je pracovníkovi doporučena úprava režimu a životosprávy, podává se 3měsíční vitaminizace. Při mimořádné preventivní prohlídce se vyšetření zopakuje. Další pracovní zařazení závisí na výsledku kontrolního odběru, v krajním případě je možné i trvalé přeřazení pracovníka mimo riziko. Současně se kontrolují hygienické podmínky na pracovišti, pracovní postupy, ochranné pomůcky, manipulace s odpady apod. Navrhují se opatření zaměřená na snížení profesní expozice GTL.
Table 2. Cytogenetická analýza periferních lymfocytů – skupinové a individuální hodnocení [10]. ![Cytogenetická analýza periferních lymfocytů – skupinové a individuální hodnocení [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6344c87c05fb917bcaf1672dce319666.png)
U skupinového hodnocení jsou limitní hodnoty rozdílné. Ve vyšetřované skupině má být nejméně 20 osob. Optimální je existence srovnatelné neexponované skupiny zaměstnanců a ideálně také obecné kontrolní skupiny ze stejné oblasti. Hodnota do 2 % AB.B. je shodná se spontánní frekvencí aberací u běžné, profesionálně neexponované populace. Hodnoty 2–4 % AB.B. svědčí o zvýšené expozici genotoxickým látkám, a je proto nutné přesně kvalitativně a kvantitativně definovat expozici a vyhledat a dále sledovat jednotlivce s vysokou expozicí GTL ve skupině. Hodnoty vyšší než 4 % AB.B. signalizují vysokou expozici GTL v prostředí.
Mikrojaderný test
Mikrojaderný test periferních lymfocytů se používá zejména pro expozice ionizujícímu záření jak v případě radiačních nehod, tak k monitoringu profesního ozáření osob. Principem je detekce malých acentrických chromozomálních fragmentů, mikrojader, které zůstanou během buněčného dělení v cytoplazmě, mimo hlavní dceřiná jádra. Mikrojádra mohou obsahovat jak celé chromozomy, tak i pouze jejich části. Test je jednoduchý, rychlý a současně dostatečně citlivý i pro nízké dávky ionizujícího záření. Výsledky se vyjadřují jako procento dvojjaderných buněk s mikrojádry nebo průměrný počet mikrojader na dvojjadernou buňku. Vzhledem k poločasu mikrojader v periferních lymfocytech může být mikrojaderný test použit jak ke stanovení dávek bezprostředně obdržených po expozici ionizujícímu záření, tak i s odstupem několika let od expozice. Řada modifikací testu zvyšuje statistickou spolehlivost výsledků a současně umožňuje detekci i podstatně nižších dávek záření [11].
Stanovení sesterských chromatid
Vysoce citlivá metoda prováděná in vitro na lidských lymfocytech byla dříve hojně používána pro posouzení mutagenity/karcinogenity environmentálních chemických látek. Rychlý test je určen pro detekci reciprokých výměn DNA mezi dvěma sesterskými chromatidami duplikovaného chromozomu. Výměny sesterských chromatid představují vzájemnou výměnu produktů replikace DNA v místech homologie. Molekulární podstata tohoto jevu stále není zcela objasněna. K vizualizaci sesterských chromatid se využívá „harlequinská“ technika založená na rozdílném zbarvení sesterských chromatid během dvou buněčných cyklů [12].
Comet assay
Jednoduchý a citlivý test je určen pro detekci jedno-a dvouřetězcových zlomů na DNA. Je využíván ve studiích oprav a poškození DNA a při hodnocení genotoxicity in vitro/in vivo. Provádí se na savčích buňkách, jeho výhodou je potřeba malého množství buněk. Metoda využívá skutečnosti, že molekula DNA s přirozeně záporným nábojem migruje v elektrickém poli směrem k anodě. Rychlost migrace DNA v elektrickém poli závisí na počtu zlomů a velikosti molekuly DNA. Buňky se zvýšeným poškozením DNA (barvení fluorescenční DNA sondou) mají zvýšenou migraci chromozomové DNA z jádra, tvarem připomíná kometu. Analýzou obrazu je určena velikost a tvar komety, těm odpovídá míra poškození DNA [2].
Stanovení četnosti dicentrických chromozomů
Četnost dicentrických chromozomů přesně sleduje dávku ozáření, proto se k biologické dozimetrii využívá kromě klasického cytogenetického vyšetření i toto vyšetření [2].
Amesův test
Test vyvinutý počátkem 70. let minulého století patří k nejrozšířenějším testům k detekci chemicky indukovaných genových mutací. Mutagenita testovaných látek se ověřuje na bakteriích. Používají se histidin auxotrofní kmeny bakterie Salmonella typhimurium. Auxotrofie je způsobena jednoduchou posunovou mutací. Kultivace probíhá na agarových plotnách. Na půdě bez histidinu kolonie nerostou. Přidáním mutagenní látky do půdy se zvyšuje výskyt zpětných mutací a vznikají kolonie bakterií, které histidin syntetizují a na půdě bez něj rostou. Porovnáním počtu kolonií s původní a zpětnou mutací lze prokázat přítomnost i velikost mutagenního účinku látky [2].
Molekulárně biologické metody v biodozimetrii
Základní metodou z této řady je fluorescenční in situ hybridizace (FISH) odvozená z původní radio in situ hybridizace (ISH). Dále srovnávací genomová hybridizace (comparative genomic hybridization – CGH), mnohobarevné karyotypování lidských chromozomů (mFISH – mBAND-SKY) a mikročipové technologie [4].
Fluorescenční in situ hybridizace
FISH s celochromozomovými sondami detekuje zejména stabilní strukturní aberace, které nejsou identifikovatelné konvenční technikou. Při použití specifických DNA sond slouží k analýze chromozomových odchylek v mitózách i v nedělících se interfázních jádrech. Existují sondy pro specifické chromozomové struktury (centromery, telomery, satelitní DNA), sondy pro jedinečné genové kopie (lokus-specifické sondy) a tzv. malovací sondy pro celé chromozomy.
Podstatou metody je hybridizace neradioaktivně značených DNA sond ke komplementárním úsekům cílové DNA chromozomů nebo interfázních buněčných jader fixovaných na mikroskopickém preparátu a následná vizualizace a analýza fluorescenčních signálů pod fluorescenčním mikroskopem [4]. Sondy jsou značeny buď přímo různými fluorochromy, nebo nepřímo, např. biotinem. U nepřímo značených sond po hybridizaci následuje detekce pomocí systému protilátek konjugovaných s různými fluorochromy. V současné době jsou používány většinou přímo značené sondy. Identifikace fluorescenčního signálu je možná přímo z fluorescenčního mikroskopu, citlivější je analýza z mikroskopu vybaveného velmi výkonnou kamerou napojenou na počítač se speciálním programem pro FISH. Citlivost metody se tak zvyšuje o několik řádů. Obraz získaný na monitoru je kvalitnější než při sledování pouhým okem v mikroskopu, navíc počítačový program dovoluje další úpravy obrazu. Počítačová analýza obrazu umožňuje kvantitativní zpracování získaných dat, měření vzdáleností jednotlivých signálů a vytváření jednoho obrazu z více záznamů (obr. 2) [4].
Image 2. Fluorescenční in situ hybridizace, vlastní výzkum (VRI Brno, projekt AZV P09-15-33968A). 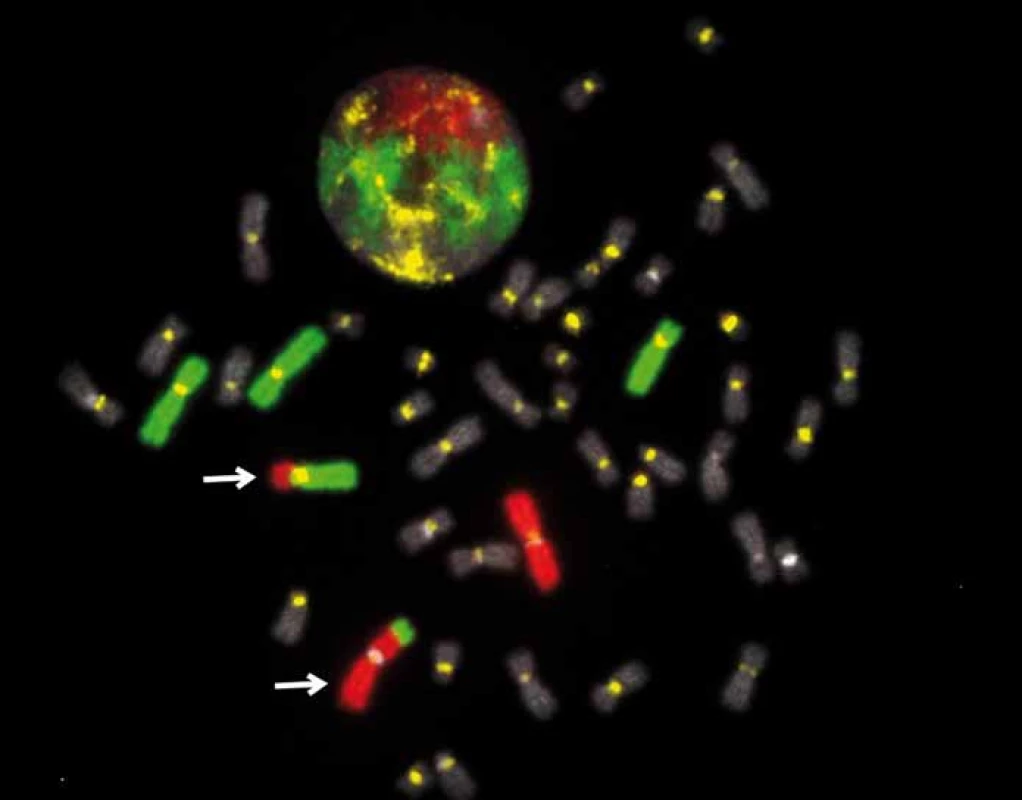
Srovnávací genomová hybridizace
CGH umožňuje detekovat a mapovat relativní počet kopií jednotlivých sekvencí mezi různými genomy. Oblasti zmnožení nebo ztráty DNA sekvencí, jako jsou delece, duplikace nebo amplifikace, jsou zvýrazněny rozdílnou barevností. CGH nelze využít u přestaveb, při kterých se nemění poměr počtu kopií sekvencí DNA. Na stejném principu jako CGH je založena metoda mikročipů a tzv. matrix CGH. Jako podklad pro hybridizaci neslouží celé mitózy, ale jednotlivé oligonukleotidy představující části DNA oblastí nebo vybraných genů roboticky natištěny na podložním skle (tzv. chip). K takto připraveným preparátům je pak připojena rozdílně značená kontrolní a sledovaná DNA. Barevná změna ukazuje přítomnost nebo nepřítomnost určitého genu nebo části chromozomu [4].
Mnohobarevné karyotypování lidských chromozomů
Varianty FISH metody využívají možnosti rozlišit barevně každý jednotlivý pár autozomů a pohlavní chromozomy.
V případě multiplex FISH jde o hybridizaci rozdílně značených malovacích sond s konkrétními chromozomy. Používá se směs DNA sond složených z velkého počtu fluorescenčně značených fragmentů jednotlivého chromozomu, k detekci slouží šest úzkopásmových filtrů. Po hybridizaci fluoreskuje celý chromozom. Signál se počítačově analyzuje a podle zjištěné intenzity se každému chromozomu přiřadí klasifikační barva. Při značení chromozom-specifických sond více než jedním fluoroforem je možné definovat celý karyotyp. Aberace jsou snadno detekovány podle počtu barevných oblastí v chromozomech – normální zobrazená buňka je jednobarevná, zatímco nádorová buňka je složená z více barev (obr. 3). Detekce složitých interchromozomových přestaveb postihne celý genom. Metoda je velmi vhodná při určování původu marker chromozomů jak v klinické, tak v nádorové cytogenetice. Nevýhody: nezjistí intrachromozomové aberace, nutnost kultivace buněk a získaní dobře pozorovatelných mitóz.
Image 3. Mnohobarevná fluorescenční in situ hybridizace. 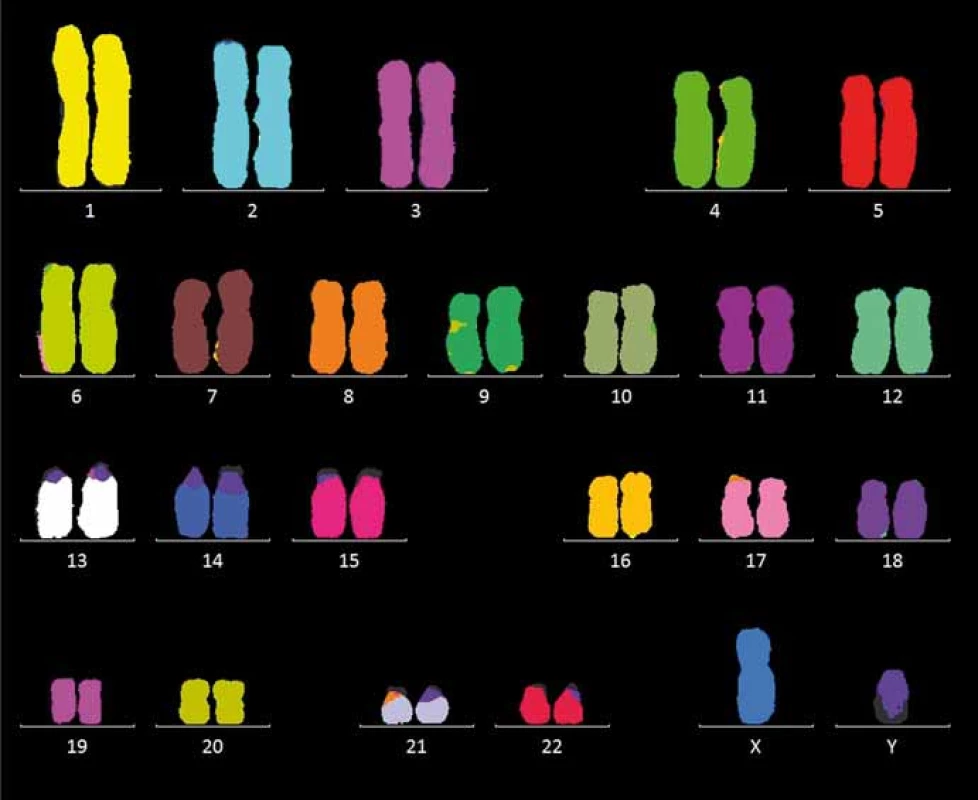
Podobně funguje také metoda mnohobarevného pruhování s vysokou rozlišovací schopností – mBAND. Využívá parciálních malovacích sond, kdy každá hybridizuje s jiným úsekem chromozomu. Chybění pruhu značí patologii. Umožňuje přesně lokalizovat místo zlomu na chromozomech, zjistit rozsah delecí nebo duplikací apod. Mnohobarevná analýza jednotlivých chromozomů se využívá v nádorové cytogenetice, při studiu komplexních změn karyotypu a při určování původu marker chromozomů. V současné době jsou dostupné sondy pro všechny autozomy a pro X chromozom. Spektrální karyotypizace je variantou mFISH – směs DNA sond složených z velkého počtu fluorescenčně značených fragmentů jednotlivého chromozomu. Po hybridizaci fluoreskuje celý chromozom. Zobrazení slouží CCD (charge-coupled device) kamera, Fourierův spektroskop a fluorescenční mikroskop. Výsledný obraz je podobný jako u mFISH, snímá se najednou, ne po filtrech.
Mikročipové technologie
Rychle se rozvíjejí také čipové technologie. Do praxe vstupují array CGH metody. Původní BAC (bacterial artificial chromosome) arrays s rozlišením kolem 1 MB jsou nahrazovány čipy s vyšším, oligonukleotidovým rozlišením. Výsledkem měření je vysoce citlivá celogenomová analýza – DNA čipy detekují změny v počtu DNA sekvencí, RNA čipy umožňují sledovat genovou expresi. Srovnání nejvhodnějších metod z obou skupin pro biodozimetrické účely je uvedeno v tab. 3.
Table 3. Srovnání nejdůležitějších biodozimetrických metod. 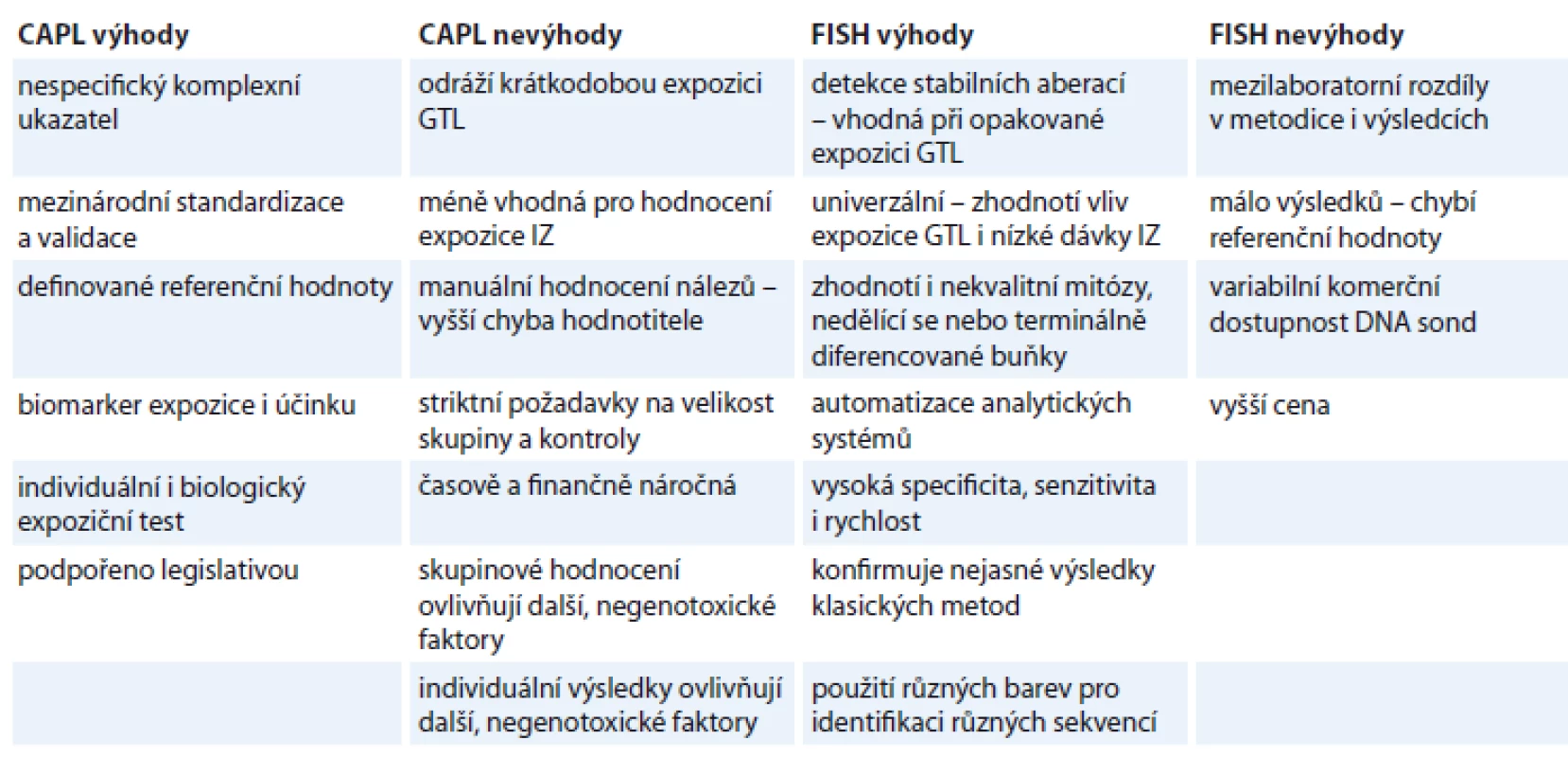
CAPL – cytogenetická analýza periferních lymfocytů, FISH – fluorescenční in situ hybridizace, GTL – genotoxické látky, IZ – ionizující záření Závěr
Změny v chromozomech vyvolané genotoxickým účinkem celého komplexu látek, které se vyskytují v pracovním prostředí nejen zdravotníků, jsou viditelnými výsledky řady biodozimetrických metod. Tyto metody umožňují detekovat míru expozice, předvídat stupeň poškození a rozhodnout o event. léčení. V některých případech výsledky CAPL byly hlavním argumentem pro prosazení zlepšení pracovních podmínek a zavedení bezpečnějších maximálních přípustných koncentrací škodlivých látek. Kromě toho byla prokázána korelace mezi zvýšenou hladinou chromozomálních aberací po expozici genotoxickým faktorům a zvýšeným rizikem rakoviny. CAPL je zatím jedinou metodou prokazující sumární karcinogenní riziko. Je užívána řadu desetiletí, v ČR byla standardizována a začleněna do legislativy k ochraně veřejného zdraví a prevenci onemocnění s profesionální expozicí, existují referenční hodnoty pro profesně exponované skupiny i běžnou populaci. Nové screeningové testy in vitro, jako je FISH, comet assay nebo mikročipové techniky, překonávají některá omezení metod konvenční cytogenetiky a molekulární genetiky. Díky své citlivosti umožňují detekovat chromozomové aberace v mitózách i v nedělících se interfázních jádrech. Zachycují stabilní aberace, které souvisejí s následnou karcinogenezí. Využití elektronové mikroskopie a automatických vyhledávacích systémů trvají kratší dobu, jsou efektivnější a tím při rutinním využívání i konkurenceschopné z finančního hlediska. Přispívají tak k efektivnější prevenci a cílené ochranné intervenci při ochraně zdraví karcinogenům exponovaných pracovníků. Je žádoucí častěji využívat jejich výhod nejenom ve výzkumných programech, ale především začleněním do každodenní praxe.
Práce byla podpořena programovým projektem Agentury pro zdravotnický výzkum ČR ZV s reg. č. P09-15-33968A za fi nančního přispění Ministerstva zdravotnictví.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Markéta Petrovová, Ph.D.
Ambulance pracovně lékařských služeb
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: marketa.petrovova@mou.cz
Obdržen: 15. 10. 2018
Přijato: 4. 7. 2019
Sources
1. Cikrt M, Málek B. Pracovní lékařství I. Hygiena práce. Praha: CIVOP 1995.
2. Komárek L, Bencko V, Mika J et al. Standardní operační postupy pro biologické monitorování genotoxických účinků faktorů prostředí. AHEM: SZÚ Praha 2003.
3. Šmerhovský Z, Landa K, Rössner P et al. Risk of cancer in an occupationally exposed cohort with increased level of chromosomal aberrations. Environ Health Perspect 2001; 109 (1): 41–45. doi: 10.1289/ehp.0110941.
4. Michalová K, Zemanová Z. Klasická a molekulární cytogenetika v klinické praxi. Klin Biochem Metab 2005; 13 (34): 63–67.
5. Mitelman, F (ed). ISCN 1995. An international system for human cytogenetic nomenclature (1995). Recommendations of the international standing committee on human cytogenetic nomenclature. New York: Karger, Basel 1994.
6. Obe G, Pfeiffer P, Savage JR et al. Chromosomal aberrations: formation, identification and distribution. Mutat Res 2002; 504 (1–2): 17–36. doi: 10.1016/s0027-5107 (02) 00076-3.
7. Rössner P, Srám RJ, Bavorová H et al. Spontaneous level of chromosomal aberrations in peripheral blood lymphocytes of control individuals of the Czech Republic population. Toxicol Lett 1998; 96–97 : 137–142.
8. Rössner P, Boffetta P, Ceppi M et al. Chromosomal aberrations in lymphocytes of healthy subjects and risk of cancer. Environ Health Perspect 2005; 113 (5): 517–520. doi: 10.1289/ehp.6925.
9. Bonassi S, Hagmar L, Strömberg U et al. Chromosomal aberrations in lymphocytes predict human cancer independently of exposure to carcinogens. European Study Group on Cytogenetic Biomarkers and Health. Cancer Res 2000; 60 (6): 1619–1625.
10. Očadlíková D, Bavorová H, Šmíd J. Metody biologického monitorování genotoxických účinků faktorů prostředí. Cytogenetická analýza periferních lymfocytů. AHEM: SZÚ Praha 2007. [online]. Dostupné z: http: //www.szu.cz/uploads/documents/knihovna_SVI/pdf/2007/full_2007_01.pdf.
11. Hayashi M. The micronucleus test – most widely used in vivo genotoxicity test. Genes Environ 2016; 38 : 18. doi: 10.1186/s41021-016-0044-x.
12. Norppa H, Bonassi S, Hansteen IL et al. Chromosomal aberrations and SCEs as a biomarker of cancer risk. Mutat Res 2006; 600 (1–2): 37–45. doi: 10.1016/j.mrfmmm.2006.05.030.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2019 Issue 4-
All articles in this issue
- Současný pohled na HPV asociované karcinomy orofaryngu a roli p16 jako surogátního markeru high-risk HPV
- Vliv mikrobiomu na vznik a vývoj kolorektálního karcinomu
- Metody klasické a molekulární cytogenetiky vhodné pro biodozimetrii osob s profesionální expozicí karcinogenům
- BMI a pravděpodobnost vzniku endometriálního adenokarcinomu u českých žen – případová studie
- The Pharmacoeconomic Analysis of Cetuximab and Panitumumab in the 1st Line Treatment of mCRC in Real Clinical Practice in the Czech Republic
- Incidencia a rizikové faktory vzniku vzdialených metastáz u pacientov s karcinómom hlavy a krku
- Onkologická kazuistika – kdy je vhodný čas na integraci paliativní péče?
- Farmakoekonomické studie a procesy HTA při hodnocení nákladů a benefitů nákladné inovativní léčby u nás i ve světě
- Aplikovat jeden cyklus nebo jednu sérii chemoterapie?
- Zemřel prof. MUDr. Josef Koutecký, DrSc., zakladatel dětské onkologie
- Onkologie v obrazech Kožní toxicita při cílené léčbě generalizovaného melanomu
- Exprese ncRNA spojené s P21 aktivovaná poškozením DNA u karcinomu močového měchýře
- Úloha radioterapie při metastázách lebky u folikulárního karcinomu štítné žlázy
- Urgentní chirurgická léčba GIST ezofago-gastrické junkce u pacienta s obrovskou hiátovou kýlou
- Proposed Strategies for Improving Adherence to Tyrosine Kinase Inhibitors in Patients with Chronic Myeloid Leukaemia
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vliv mikrobiomu na vznik a vývoj kolorektálního karcinomu
- Současný pohled na HPV asociované karcinomy orofaryngu a roli p16 jako surogátního markeru high-risk HPV
- Onkologická kazuistika – kdy je vhodný čas na integraci paliativní péče?
- Incidencia a rizikové faktory vzniku vzdialených metastáz u pacientov s karcinómom hlavy a krku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

