-
Medical journals
- Career
Současný pohled na HPV asociované karcinomy orofaryngu a roli p16 jako surogátního markeru high-risk HPV
: Dominik Gurín 1; Marek Slávik 2; Tetiana Shatokhina 1; Tomáš Kazda 2,3; Jiří Šána 3,4; Ondřej Slabý 3,4; Markéta Hermanová
: I. ústav patologie, LF MU a FN u sv. Anny v Brně 1; Klinika radiační onkologie, LF MU a Masarykův onkologický ústav, Brno 2; CEITEC – Středoevropský technologický institut, MU, Brno 3; Klinika komplexní onkologické péče, LF MU a Masarykův onkologický ústav, Brno 4
: Klin Onkol 2019; 32(4): 252-260
: Review
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2019252Východiska: Karcinomy orofaryngu asociované s lidským papilomavirem (human papillomavirus – HPV) nejen pro svou nadále vzrůstající incidenci představují významnou kapitolu v oblasti nádorů hlavy a krku. Tyto nádory oproti HPV negativním karcinomům orofaryngu disponují odlišnými epidemiologickými, klinickými i molekulárními vlastnostmi, lepší odpovědí na léčbu a prognózou. Vlivem těchto skutečností byla provedena celá řada studií, jejichž společným cílem bylo navržení adekvátního stagingového systému pro HPV asociované karcinomy orofaryngu, neboť 7. vydání American Joint Committee on Cancer nebralo v potaz unikátní biologické chování tohoto onemocnění. Výsledkem jsou zásadní změny v TNM klasifikaci karcinomů orofaryngu, které jsou nyní v závislosti na expresi surogátního markeru high-risk HPV p16 členěny na p16 pozitivní a p16 negativní.
Cíl: Cílem tohoto přehledového článku je nejen shrnutí aktuálních vědomostí o HPV asociovaných karcinomech orofaryngu s důrazem na jejich molekulární podklad a morfologii, ale také shrnutí a porovnání metod detekce viru HPV. Zároveň je diskutován prognostický význam exprese biomarkeru p16 u těchto nádorů. Součástí přehledového článku je dále představení změn ve stagingu karcinomů orofaryngu v závislosti na expresi markeru p16, vč. odůvodnění, která k těmto změnám vedla. Závěrem jsou uvedena doporučení společnosti College of American Pathologists podpořená American Society of Clinical Oncology k testování viru HPV u nádorů v oblasti hlavy a krku.
Klíčová slova:
lidský papilomavirus – p16 – karcinom orofaryngu – dlaždicobuněčný karcinom – TNM klasifikace
Úvod a incidence HPV asociovaných dlaždicobuněčných karcinomů orofaryngu
Dlaždicobuněčný karcinom hlavy a krku je celosvětově 6. nejčastější malignitou, primárně postihující dutinu ústní, orofarynx a hrtan [1]. Tento karcinom je tradičně asociován s kouřením cigaret a konzumací alkoholu. V roce 1983 byla Syrjanenem prokázána souvislost mezi karcinomem a infekcí lidským papilomavirem (human papillomavirus – HPV) [2]. V četných zemích západního světa byla popsána vzrůstající incidence dlaždicobuněčných karcinomů orofaryngu, predominantně postihujících oblast kořene jazyka a patrových tonzil, a to ve prospěch HPV pozitivních případů [3–8]. Mezi lety 1984 a 2004 došlo v USA k nárůstu HPV pozitivních dlaždicobuněčných karcinomů o 225 %, zatímco počet HPV negativních karcinomů poklesl o 50 % [9]. Oproti incidenci je však prevalence HPV asociovaných karcinomů značně variabilní, a to v závislosti na rasové příslušnosti i geografickém původu.
Virus HPV se řadí mezi neobalené DNA viry čeledi Papillomaviridae. Existuje zhruba 30 subtypů viru HPV se schopností infikovat orální či anogenitální sliznici. Tyto viry dále klasifikujeme jako low-risk nebo high-risk (HR) dle jejich biologického chování. Low-risk HPV viry (např. typ 6 nebo 11) vedou k rozvoji benigních lézí (condylomata accuminata), zatímco HR HPV viry (např. typ 16, 18 či 33) potencují maligní zvrat buněk. Zhruba 90 % karcinomů hlavy a krku asociovaných s HPV je připisováno subtypu 16 [10].
Pacienti s HPV pozitivním karcinomem orofaryngu jsou častěji mladší muži, s nižší konzumací alkoholu a kouřením cigaret – často nekuřáci, s lepší odpovědí na léčbu i lepší prognózou oproti HPV negativním karcinomům [11]. Mezi hlavní rizikové faktory patří vyšší počet sexuálních partnerů, historie orálně-genitálního a orálně-análního sexu [12].
HPV asociované karcinomy orofaryngu mají odlišné epidemiologické, klinické i molekulární vlastnosti v porovnání s karcinomy asociovanými s kouřením [13]. Vlivem těchto skutečností se určení stadia nemoci dle pravidel 7. vydání American Joint Committee on Cancer (AJCC) stalo neadekvátním, neboť nebralo v potaz unikátní biologické chování tohoto onemocnění [14].
Molekulární podklad HPV asociovaných karcinomů hlavy a krku
Patogeneze HPV asociovaných nádorů vychází z alterace funkce retinoblastomového proteinu Rb, který ve své hypofosforylované formě slouží jako regulátor buněčného cyklu, a to v přechodu z G1 fáze do S fáze vazbou transkripčního faktoru E2F [15]. Komplex E2F/Rb inhibuje transkripci celé řady genů, vč. CDKN2A kódující inhibitor cyklin-dependentních kináz (CDK) p16, lokalizovaný na chromozomu 9p21 [16]. Jakmile je buňka připravena vstoupit do S fáze buněčného cyklu, Rb je inaktivován fosforylací komplexem cyklin D/CDK4/6, čímž dojde k uvolnění E2F z vazby na Rb.
V případě infekce HR-HPV dochází k začlenění genomu viru do chromozomu hostitelských buněk a expresi onkoproteinů E6 a E7. Onkoprotein E6 vede k inaktivaci tumor supresorového genu TP53, onkoprotein E7 interaguje s komplexem E2F/Rb, vede k porušení funkce Rb a jeho degradaci [17] a k uvolnění transkripčního faktoru E2F. Výsledkem je ztráta regulace buněčného cyklu, porucha buněčné diferenciace, zvýšené riziko mutací a chromozomální nestability [12,18]. Současně dojde k přerušení inhibice transkripce genu CDKN2A a overexpresi p16, na rozdíl od konvenčních nádorů hlavy a krku, kde dochází k inaktivaci tumor supresorového genu p16 řadou mechanizmů (např. hypermetylací) [19]. Tento mechanizmus vysvětluje difuzní expresi p16 u HPV asociovaných dlaždicobuněčných karcinomů. Zvýšená exprese p16 však nastává i u jiných nádorů, kde je nedostatek Rb podmíněn odlišnými mechanizmy (např. genetickou ztrátou u malobuněčných karcinomů plic) [17].
Tumor supresorový protein p16 se podílí na kontrole buněčného cyklu na úrovni přechodu G1/S fáze. Inhibuje činnost CDK4/6 narušením vazby s cyklinem D1, který následně podléhá degradaci [20]. Cyklin D1 se podílí na opravě DNA procesem homologní rekombinace skrze protein RAD51 [21]. Downregulace cyklinu D1 skrze p16 by tedy mohla být jednou z příčin zvýšené senzitivity HPV asociovaných nádorů k radiační léčbě [22].
U nádorů hlavy a krku asociovaných s kouřením hrají hlavní roli v procesu kancerogeneze mutace tumor supresorových genů TP53, které nacházíme minoritně u HPV asociovaných nádorů [23,24]. Oproti HPV asociovaným nádorům tyto navíc zvýšeně exprimují geny asociované s hypoxií a markery nádorových kmenových buněk, které zvyšují jejich radiorezistenci [25–27]. Bylo prokázáno, že počet mutací u HPV pozitivních nádorů je poloviční oproti HPV negativním nádorům [28]. Opakovaná expozice karcinogenům však může u HPV asociovaných nádorů narušit výše uvedené molekulární mechanizmy [29].
Metody detekce viru HPV
HPV status se řadí mezi významné prognostické markery. Slouží ke stratifikaci rizik u pacientů s karcinomem orofaryngu a výběru pacientů, kteří mohou potenciálně těžit z terapeutických vakcín [30] a v budoucnu i deeskalačních terapeutických postupů, které mají sloužit ke snížení toxicity protinádorové léčby [31]. Existuje řada metod k průkazu přítomnosti viru HPV v postižené tkáni, jako např. metoda polymerázové řetězové reakce (polymerase chain reaction – PCR), in situ hybridizace (ISH) k průkazu DNA a RNA či exprese proteinu p16 za užití imunohistochemie (IHC) [32].
Metoda PCR, která slouží k průkazu integrace virové DNA do hostitelského genomu, je vysoce senzitivní, avšak současně je zatížena rizikem falešné pozitivity detekcí subtypů viru HPV, které nejsou asociovány s maligní transformací (např. vlivem kontaminace). Nevýhodou DNA ISH je nízká senzitivita při vysoké specificitě [33]. Značnou nevýhodou těchto metod je, že jsou nákladné, vyžadují moderní laboratorní zařízení i vysoce kvalifikovaný personál [15].
Vyšetření exprese proteinu p16 je široce dostupné, levné a při použití doporučované hodnoty cut-off i snadno vyhodnotitelné. Exprese p16 je nezávislá na typu HPV, a tudíž může sloužit jako surogátní marker HPV infekcí [34]. Četné studie považují expresi p16 za nejlepší prognostický marker u pacientů s dlaždicobuněčným karcinomem orofaryngu [35]. Overexprese proteinu p16 však může být vyvolána i jinými mechanizmy než infekcí virem HPV [15].
Zhruba 4–20 % dlaždicobuněčných karcinomů orofaryngu je p16 pozitivní, ale HPV negativní při užití DNA ISH [36]. Jednou z možných příčin je infekce odlišným subtypem viru HPV než HPV16, který je nejčastěji detekován pomocí ISH [29,33]. U většiny těchto nejasných případů však byla prokázána exprese virových onkogenů E6/E7 [37,38]. V minimu případů byl zjištěn opačný jev, kdy byla prokázána DNA viru HPV při negativitě proteinu p16. Jednou z vysvětlujících příčin by mohla být alterace genu CDKN2A kódující protein p16, která byla pozorována u kuřáků [39]. Při užití pouze jedné z těchto metod hrozí riziko misklasifikace u zhruba 17–19 % nádorů [40,41].
Z tohoto důvodu byly vypracovány četné diagnostické algoritmy určené nejen k průkazu přítomnosti viru HPV, ale i jeho transkripční aktivity. Metoda RNA ISH s využitím próby komplementární k E6/E7 mRNA tato kritéria splňuje [42–44] a dosahuje podobných výsledků jako real-time PCR [45]. Stanovení E6/E7 HPV-mRNA pomocí ISH nebo real-time PCR je zároveň „zlatým standardem“, protože detekuje transkripčně aktivní HPV [46].
Genotypizace HPV
Ve většině starších studií, jejichž výsledky byly publikovány v letech 2009–2014 a kde byla prokázána lepší prognóza HPV asociovaných nádorů orofaryngu, byly k detekci virové infekce využity metody ISH. U všech byla stanovena exprese proteinu p16, u některých i virová DNA [47]. Stanovení exprese p16 je zároveň nejčastější metodou aplikovanou v klinické praxi [47]. Podobně i data použitá při vytváření 8. verze TNM klasifikace klasifikovala pacienty jako HPV pozitivní jen na základě pozitivity p16 [48]. HPV16 je nejčastější subtyp viru HPV asociovaný s dlaždicobuněčným karcinomem orofaryngu [49,50]. Méně často se na vzniku karcinomu podílejí subtypy HPV18, HPV33 a HPV35. Bylo prokázáno, že genotyp HPV18 oproti HPV16 efektivněji indukuje růst keratinocytů [51], pravděpodobně poklesem apoptózy [52]. Kontrolní oblast virových onkogenů E6/E7 je u HPV18 pozitivních tumorů 10–50krát aktivnější než u HPV16 pozitivních variant [53]. Četné studie prokázaly horší přežití u pacientů s těmito genotypy oproti HPV16 pozitivním případům [49,54,55], čímž prokazují, že HPV genotypizace má cennou prognostickou hodnotu. Pacienti s jinými genotypy než HPV16 v budoucnu nemusí těžit z deeskalační léčby [56]. Skupina pacientů p16 pozitivních, ale zároveň HPV DNA negativních má signifikantně horší přežití než skupina p16 pozitivních a HPV DNA pozitivních pacientů [57]. Dle recentní metaanalýzy má ke stanovení HPV asociovaného tumoru nejvyšší specificitu kombinované stanovení p16 a HPV DNA [46]. Proto by u deeskalačních studií měly být použity k vyloučení p16 pozitivního, ale HPV negativního tumoru i alternativní metody stanovení HPV [47,58]. V běžné klinické praxi však stanovení p16 imunohistochemicky zůstává základní metodou a při dodržení doporučení, že se má jednat o silnou difuzní cytoplazmatickou a nukleární pozitivitu ve více než 70 % nádorových buněk, se jedná i o metodu dostatečně spolehlivou [36]. Tato definice zároveň patří k doporučením College of American Pathologists uvedeným níže, která jsou podpořena i společností American Society of Clinical Oncology (ASCO) [36] a definují i možnosti testování v případě nejasností pro běžnou praxi.
Morfologie HPV asociovaných karcinomů orofaryngu
HPV asociované dlaždicobuněčné karcinomy orofaryngu mají charakteristický morfologický obraz. Většina nádorů vyrůstá v oblasti tonzilárních krypt. Dysplastické změny asociované s HPV zahrnují orto-a parakeratózu, hyperplazii epitelu s nápadnou fragmentací jader (karyorhexí) a apoptózou. Dysplastický epitel oproti nepostiženému epitelu vykazuje silnou a difuzní pozitivitu pro marker p16.
Tyto nádory mají typicky bazaloidní charakter s nápadnou lymfoidní reakcí a minimální stromální reakcí. Nádorové buňky oproti konvenčním dlaždicobuněčným karcinomům neobsahují intercelulární můstky, většinou nevykazují keratinizaci a mají zvýšený N/C poměr [12]. Nádorové buňky tvořící čepy či ostrůvky jsou obvykle nápadně ohraničené, s řídkou eozinofilní cytoplazmou, s oválnými až vřetenitými jádry, často s hyperchromazií a nenápadnými jadérky. Nádory mají briskní mitotickou aktivitu i počet buněk podléhajících apoptóze. Časté jsou komedo nekrózy. Naopak zřídka u těchto nádorů nalezneme známky maturace nádorových buněk [59]. Pokud jsou známky maturace přítomny, jsou na rozdíl od HPV negativních karcinomů inverzní, neboť proliferující nádorové buňky se u HPV pozitivních nádorů nacházejí v centru čepů.
Ačkoliv by tento obraz odpovídal středně či nízce diferencovanému karcinomu, s ohledem na klinický obraz je nutno na HPV asociované dlaždicobuněčné karcinomy orofaryngu pohlížet jako na dobře diferencované nádory. Proto se grading u HPV pozitivních karcinomů nedoporučuje. Za prediktory agresivnějšího chování se považuje např. anaplazie či multinukleace [60].
Morfologické spektrum HPV asociovaných dlaždicobuněčných karcinomů zahrnuje nádory s papilárními, adenoskvamózními, lymphoepithelioma-like, sarkomatoidními či malobuněčnými rysy. Vyjma nádorů s malobuněčnými rysy, které mají agresivnější klinický průběh, mají všechny ostatní varianty shodné klinické chování s HPV pozitivním dlaždicobuněčným karcinomem obvyklé morfologie [61].
Odlišení HPV asociovaných dlaždicobuněčných karcinomů od konvenčních bazaloidních dlaždicobuněčných karcinomů s agresivnějším klinickým průběhem je poměrně obtížné. Zásadním krokem v diagnostice je tedy detekce HPV, např. užitím markeru HR HPV p16, v případě nejasnosti lze použít i doplňkový test.
Metastázy HPV asociovaných karcinomů do lymfatických uzlin si obvykle zachovávají obdobný morfologický obraz. Mnohdy však bývají cysticky transformovány a mohou klinicky imponovat jako laterální krční (branchiální) cysty. Detekce statusu HPV je tedy nezbytná k určení správné diagnózy [62].
Staging HPV asociovaných karcinomů orofaryngu
Určení stadia nemoci je jedním z klíčových aspektů léčby nádorů. Pro stanovení prognózy nemoci a nastavení optimálního terapeutického postupu je nutné pečlivé zhodnocení všech rizikových faktorů nemoci, a to na individuální úrovni. Aby systém pro určování stadií nemoci mohl být efektivní, měla by být splněna čtyři kritéria: 1) pacienti v rámci jednoho stadia mají podobné hodnoty přežití; 2) hodnoty přežití se mezi jednotlivými stadii nemoci signifikantně liší; 3) jednotlivá stadia by měla obsahovat rovnoměrné rozložení pacientů; 4) staging by měl mít prediktivní význam s ohledem k léčbě [63].
Při užití 7. vydání AJCC Cancer Staging Manual (dále jen AJCC) byli pacienti s HPV pozitivními dlaždicobuněčnými karcinomy častěji diagnostikováni ve stadiu T1–T2, s vyšším N stadiem a nižší incidencí vzdálených metastáz [64]. S ohledem na určování stagingu dle 7. vydání AJCC, který vychází z lineárního vztahu mezi vzrůstající N kategorií a horší prognózou [65], byli tito pacienti často klasifikováni ve stadiu IV. HPV pozitivní pacienti však vykazují delší přežití, a mohou být tedy ohroženi dlouhodobými následky protinádorové léčby. Sedmé vydání AJCC tudíž neadekvátně stratifikuje pacienty s HPV pozitivními dlaždicobuněčnými karcinomy s odlišným klinickým a biologickým chováním [66]. Četné studie prokázaly omezenou predikci přežití u HPV pozitivních pacientů při užití 7. vydání AJCC [67–70], zatímco přijatelné výsledky byly dosaženy u HPV negativních dlaždicobuněčných karcinomů [63,71].
Klinická stadia 8. vydání AJCC vycházejí z výsledků navržené klasifikace International Collaboration on Oropharyngeal Cancer Network for Staging (ICON-S) vedoucí k efektivní stratifikaci pacientů s HPV pozitivními dlaždicobuněčnými karcinomy v heterogenní kohortě pacientů [63,71]. Četné studie prokázaly prognostický i prediktivní význam 8. vydání AJCC ve vztahu k HPV pozitivním dlaždicobuněčným karcinomům [72,73].
Je však nutno podotknout, že v případě, kdy je status p16 negativní, či nemůže být stanoven, by se staging měl řídit dle HPV negativních dlaždicobuněčných karcinomů [61].
Změny v T klasifikaci
Klinická i patologická klasifikace primárních tumorů je u obou typů dlaždicobuněčných karcinomů velmi podobná. U HPV asociovaných dlaždicobuněčných karcinomů došlo ke sloučení kategorií T4a a T4b v jednotnou kategorii T4, neboť pacienti v těchto subkategoriích statisticky dosahovali stejného přežití [71]. Současně je eliminována kategorie Tis (karcinom in situ) z důvodu absence zřetelné bazální membrány v epitelu Waldeyerova okruhu [48] (tab. 1). V rámci HPV negativních dlaždicobuněčných karcinomů byla eliminována kategorie T0. Ta slouží pouze pro pacienty s neznámým primárním origem, jejichž metastázy do regionálních lymfatických uzlin jsou p16 pozitivní [74].
1. Klinické a patologické T kategorie, p16+ dlaždicobuněčných karcinomů orofaryngu, 8. vydání TNM klasifikace. 
TNM – klasifikace tumor-nodes-metastases Změny v N klasifikaci
Poprvé u karcinomů hlavy a krku je zaveden odlišný patologický a klinický staging [74], a to pro HPV pozitivní dlaždicobuněčné karcinomy. Ten je odrazem odlišné klinické a patologické N klasifikace dle zvoleného terapeutického postupu. V 8. vydání AJCC došlo k signifikantním změnám v N klasifikaci HPV pozitivních dlaždicobuněčných karcinomů oproti HPV negativním karcinomům vedoucí k downstagingu většiny p16+ dlaždicobuněčných karcinomů.
Klinická N klasifikace je určena pro pacienty primárně léčené radioterapií. Lymfatické uzliny uložené ipsilaterálně a menší než 6 cm v největším rozměru odpovídající původním kategoriím N1 až N2b dosahovaly stejných hodnot přežití a jsou nyní zahrnuty v kategorii N1. Pro klinicky evidentní metastázy do bilaterálních nebo kontralaterálních lymfatických uzlin menších než 6 cm v největším rozměru odpovídající kategorii N2c byla rezervována kategorie N2, neboť dosahovaly statisticky horších výsledků než pacienti s N1. Nejhoršího přežití dosahovali pacienti s lymfatickými uzlinami většími než 6 cm v největším rozměru. Pro tyto pacienty byla určena kategorie N3 [48] (tab. 2).
2. Klinické N kategorie, p16+ dlaždicobuněčných karcinomů orofaryngu, 8. vydání TNM klasifikace. 
TNM – klasifikace tumor-nodes-metastases Patologická N klasifikace je aplikována u pacientů s chirurgicky řešenými dlaždicobuněčnými karcinomy. Bylo prokázáno, že hlavní determinantou přežití je počet postižených lymfatických uzlin, nikoliv jejich velikost, lateralita či přítomnost extranodální extenze. Tato skutečnost byla potvrzena v četných studiích [75,76]. Jako pN1 jsou klasifikovány tumory s postižením 4 a méně lymfatických uzlin, jako pN2 při postižení 5 a více lymfatických uzlin. Kategorie pN3 byla z klasifikace eliminována [48,74] (tab. 3).
3. Patologické N kategorie, p16+ dlaždicobuněčných karcinomů orofaryngu, 8. vydání TNM klasifikace. 
TNM – klasifikace tumor-nodes-metastases HPV negativní dlaždicobuněčné karcinomy si zachovaly původní N klasifikaci se začleněním extranodální extenze jakožto významného negativního prognostického faktoru [74]. Lymfatické uzliny s pozitivní extranodální extenzí jsou nyní bez ohledu na jejich velikost klasifikovány jako N3b [72].
Staging HPV pozitivních dlaždicobuněčných karcinomů orofaryngu
Současný klinický staging vychází z navržené klasifikace ICON-S, která prokázala minimální rozdíl v 5letém přežití u HPV pozitivních pacientů ve stadiích I–IVA při užití 7. vydání AJCC. Pacienti T4a a T4b měli signifikantně nižší celkové přežití než pacienti T1–T3, stejně tak jako pacienti N3 v porovnání s N1–N2c.
Klinickému stadiu I odpovídají pacienti T1–T2 N0–N2b (nyní N1), klinickému stadiu II pacienti T1–T2 N2c (nyní N2) nebo T3 N0–N2c (nyní N0–N2), klinickému stadiu III odpovídají pacienti T4 s jakýmkoliv N či pacienti N3 s jakýmkoliv T. Klinické stadium IV je rezervováno pro pacienty s přítomností vzdálených metastáz bez ohledu na T či N status [71] (tab. 4).
S ohledem na patologický staging pacienti T0–T2 N0–N1 odpovídají stadiu I, T0–T2 N2 či T3–T4 N0–N1 stadiu II, T3–T4 N2 stadiu III. Stadium IV je opět určeno pouze pro pacienty s přítomností vzdálených metastáz [61] (tab. 4).
4. Klinické a patologické stadium, p16+ dlaždicobuněčných karcinomů orofaryngu, 8. vydání TNM klasifikace. 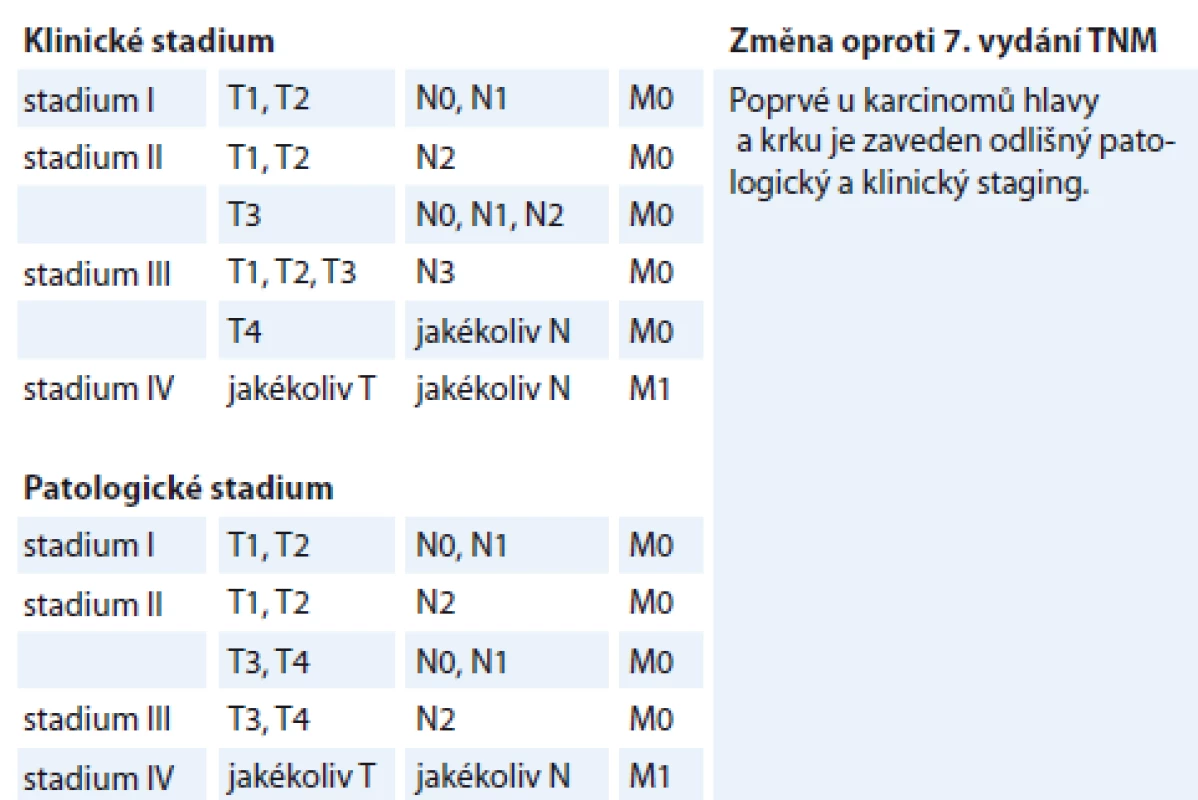
TNM – klasifikace tumor-nodes-metastases Je tedy zřejmé, že hlavní změny u HPV pozitivních dlaždicobuněčných karcinomů jsou patrné v nižších Union of Internation Cancer Control stadiích, jelikož obsahují vyšší T a N kategorie v porovnání se 7. vydáním AJCC, a stadium IV je definováno pouze přítomností vzdálených metastáz [72]. Pacienti v nižších prognostických skupinách tedy mohou těžit z deeskalační léčby [67]. U HPV negativních dlaždicobuněčných karcinomů nedošlo ke změnám v definování prognostických skupin.
Úskalí 8. vydání AJCC
Nejvýznamnějším prognostickým faktorem u dlaždicobuněčných karcinomů orofaryngu je HPV status. Četné studie dále prokázaly asociaci mezi prognózou a kouřením či věkem u pacientů s HPV asociovanými dlaždicobuněčnými karcinomy [67,72]. T status nadále přetrvává jako významný prediktor rekurence [77]. Několik dalších studií potvrdilo jako prognosticky nepříznivý faktor kouření – zejména více než 10 balíčkoroků. Naopak jako příznivý prognostický faktor se jeví přítomnost tumor infiltrujících lymfocytů [47]. S těmito faktory ovšem 8. verze TNM klasifikace zatím nepočítá. Většina HPV asociovaných karcinomů orofaryngu postihuje oblast kořene jazyka a patrových tonzil. Pacienti mimo tyto lokalizace v orofaryngu však vykazují horší prognózu [72].
Doporučení College of American Pathologists k testování viru HPV u nádorů hlavy a krku podpořené společností ASCO
College of American Pathologists vydala na základě expertních analýz a posouzení celou řadu doporučení k testování viru HPV u pacientů s karcinomem orofaryngu. Tato doporučení vycházejí z poznatků o odlišné patogenezi, morfologii, biologickém chování i efektu léčby u HPV asociovaných karcinomů a jsou velmi důležitá zejména pro běžnou klinickou praxi [78].
- I. U nově diagnostikovaných případů dlaždicobuněčného karcinomu orofaryngu by nezávisle na histologickém obraze mělo být provedeno testování na přítomnost HR-HPV, a to na tkáni primárního nádoru či metastaticky postižené regionální lymfatické uzliny v případě, kdy klinické údaje odpovídají orofaryngeálnímu origu.
- a. Prohlášení ASCO:
- I.HPV status by měl být stanoven u všech dlaždicobuněčných tumorů orofaryngu [36].
- II.Testování HR-HPV by mělo být provedeno IHC vyšetřením exprese proteinu p16 na tkáni orofaryngu. Doplňková vyšetření mohou být provedena na základě rozhodnutí patologa či ošetřujícího lékaře.
- a.Nádor by měl být považován za p16 pozitivní, pokud vykazuje nukleární a cytoplazmatickou expresi o střední až silné intenzitě min. v 70 % nádorových buněk (obr. 1). Pokud dlaždicobuněčný karcinom této cut-off hodnoty nedosahuje, je považován za p16 negativní (obr. 2).
- b.Výsledek vyšetření by patolog měl uvést ve výsledkovém protokolu.
- c. Prohlášení ASCO:
- I.Malá frakce orofaryngeálních tumorů s overexpresí p16 není podmíněna virem HPV. V případě pochybností by měla být pro zkušené patology dostupná doplňková vyšetření [36].
- II.Pokud jsou klinické znaky konzistentní s etiologií HPV, je žádoucí provést více specifické testy na přítomnost HR-HPV, a to i za situace, kdy vzorky tkání nedosahují doporučených hodnot [36].
- III.Není doporučeno rutinně testovat HR-HPV u pacientů s jiným než dlaždicobuněčným karcinomem orofaryngu.
- a. Prohlášení ASCO:
- I.Testování HPV je žádoucí u nízce diferencovaných tumorů a v případě pochybností, zda se jedná o tumor dlaždicobuněčný (např. neuroendokrinní tumor) [36].
- IV.Není doporučeno rutinně testovat HR-HPV u pacientů s karcinomem mimo orofarynx.
- V.Testování na přítomnost HR-HPV by mělo být provedeno u metastáz do lymfatických uzlin v oblasti II/III při neznámém primárním origu. Doporučeným vyšetřením je IHC detekce p16.
- a.U p16 pozitivních případů, které vykazují keratinizaci a/nebo se jedná o metastatické postižení mimo oblast II/III, by mělo provedeno doplňkové vyšetření HR-HPV.
- b. Prohlášení ASCO:
- I.V takovýchto případech IHC detekce p16 nemusí být dostačující. Další doplňková vyšetření by měla být provedena na základě uvážení patologa či ošetřujícího lékaře. ASCO doporučuje detekci HPV u dlaždicobuněčných karcinomů hlavy a krku s neznámým primárním origem nezávisle na keratinizaci [36].
- VI. Při odběru tkání z nádorů hlavy a krku metodou tenkojehlové aspirace by mělo být provedeno testování na přítomnost HR-HPV u pacientů s dlaždicobuněčným karcinomem orofaryngu, u kterých nebyl vyšetřen HPV status, u pacientů se suspektním dlaždicobuněčným karcinomem orofaryngu nebo metastatickým dlaždicobuněčným karcinomem nejasného origa.
- a. Prohlášení ASCO:
- I.Neexistují doporučení v metodologii pro testování HR-HPV u vzorků získaných metodou tenkojehlové aspirace. V případě, kdy výsledek testování HR-HPV vyjde negativní, by mělo být vyšetření provedeno na tkáňových vzorcích, jakmile jsou dostupné. Pokud patolog provádí IHC vyšetření na expresi p16 u cytologických vzorků, měl by současně ověřit kritéria (např. cut-off hodnotu) pro pozitivní výsledek [36].
- II.V takovýchto případech IHC vyšetření nemusí být dostačující. Další doplňková vyšetření by měla být provedena na základě uvážení patologa či ošetřujícího lékaře. ASCO doporučuje v případě IHC detekce p16 cut-off hodnotu 70 % u pacientů se známým dlaždicobuněčným karcinomem orofaryngu [36].
- VII.Není doporučeno rutinně testovat LR-HPV u pacientů s karcinomem hlavy a krku.
- VIII.Není doporučeno opakovat testování na HR-HPV u pacientů s lokální či regionální recidivou či u pacientů se vzdálenými metastázami, pokud byl stanoven HPV status u primárního nádoru.
- a.V případě diagnostických rozpaků, zdali se jedná o recidivu, či o nový primární dlaždicobuněčný karcinom, je možné provést test na průkaz HR-HPV.
- IX.Není doporučeno uvádět histopatologický grading ve výsledkovém protokolu.
- X.Kouření by nemělo ovlivnit strategii v testování HR-HPV.
1. p16+ dlaždicobuněčný karcinom orofaryngu – silná difuzní exprese p16 v nádorových buňkách, zvětšení 100×. 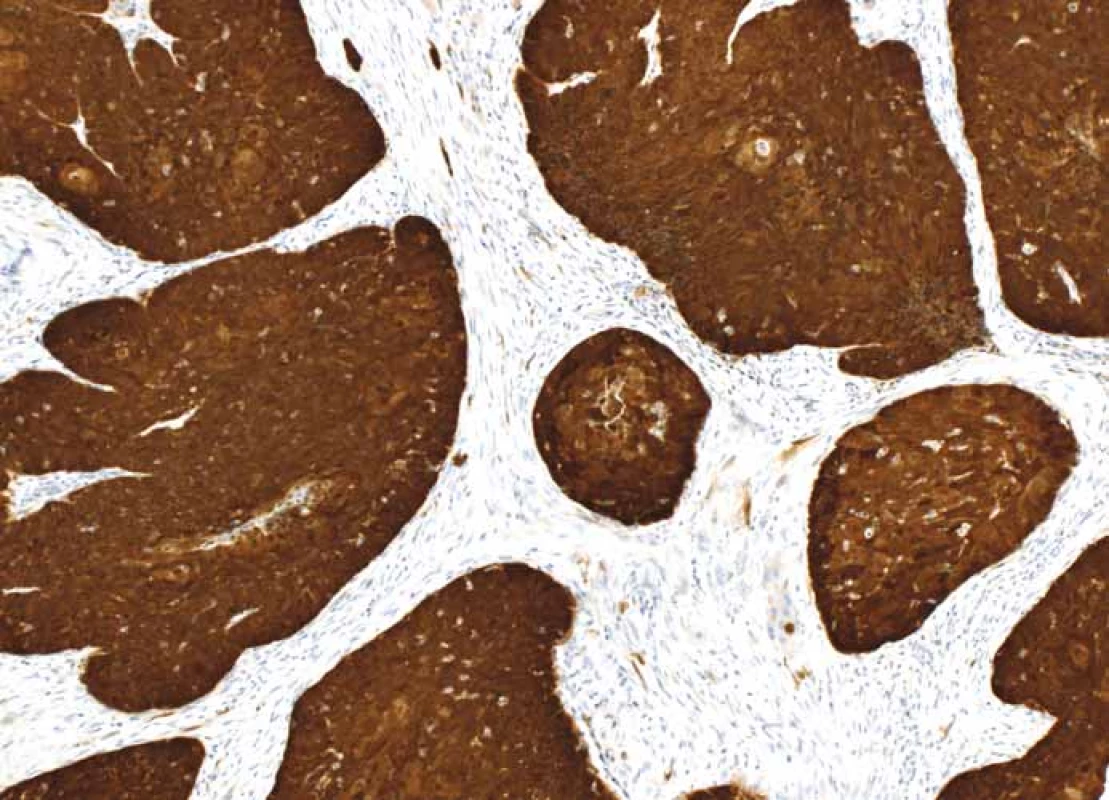
2. p16− dlaždicobuněčný karcinom orofaryngu – ložisková slabá až střední exprese v méně než 70 % nádorových buněk, zvětšení 100×. 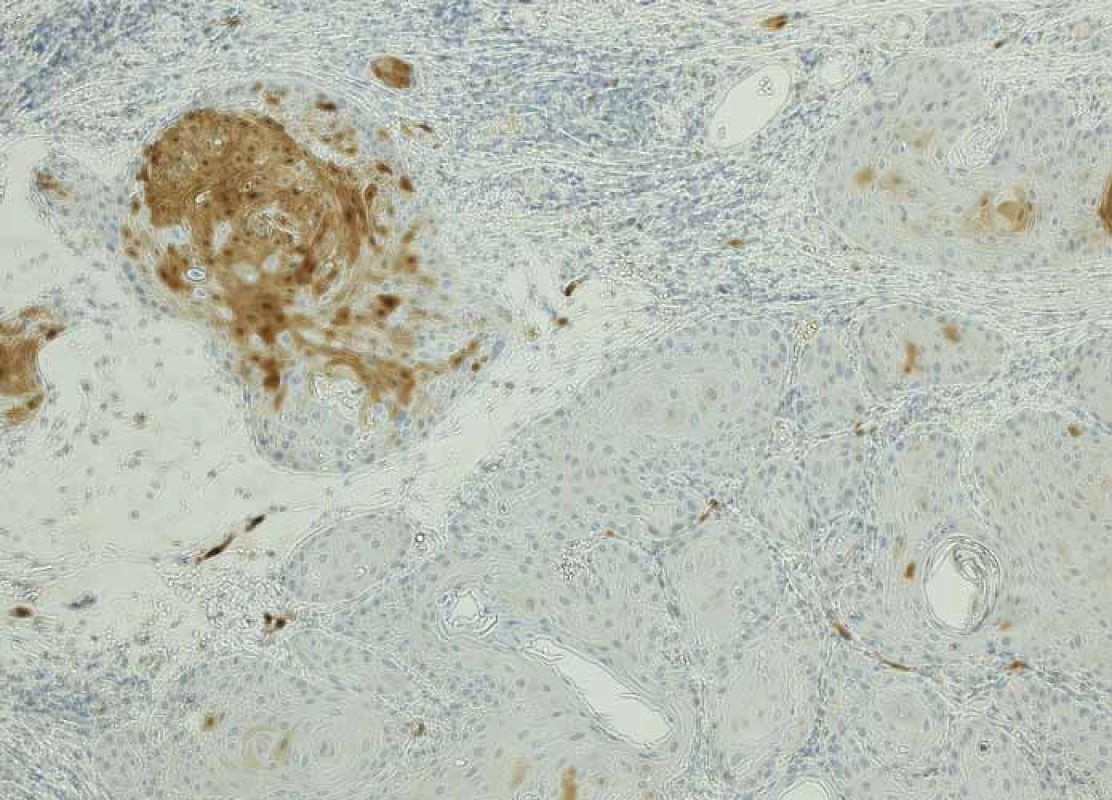
Závěr
HPV asociované karcinomy orofaryngu budou v blízké budoucnosti se svou narůstající incidencí a dobrými výsledky deeskalačních studií nadále velmi aktuálním tématem. Postupem času se bude klinická praxe na základě pozitivních výsledků klinických studií jistě měnit. Rutinní stanovení HPV asociace v případě dlaždicobuněčných, popř. nediferencovaných karcinomů orofaryngu či neznámého prima v oblasti hlavy a krku by mělo být proto v dnešní době standardem na každém pracovišti zabývajícím se léčbou těchto malignit.
Tato práce byla vypracována s grantovou podporou,Ministerstva zdravotnictví České republiky, grant č. 15-31627A. Všechna práva vyhrazena.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Dominik Gurín
I. ústav patologie
FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: gurin.dominik@gmail.com
Obdrženo: 18. 2. 2019
Přijato: 30. 5. 2019
Sources
1. Hardisson D. Molecular pathogenesis of head and neck squamous cell carcinoma. Eur Arch Otorhinolaryngol 2003; 260 (9): 502–508. doi: 10.1007/s00405-003-05 81-3.
2. Martín-Hernán F, Sánchez-Hernández JG, Cano J et al. Oral cancer, HPV infection and evidence of sexual transmission. Med Oral Patol Oral Cir Bucal 2013; 18 (3): e439–e444. doi: 1 0.4317/medoral.18419.
3. Hammarstedt L, Lindquist D, Dahlstrand H et al. Human papillomavirus as a risk factor for the increase in incidence of tonsillar cancer. Int J Cancer 2006; 119 (11): 2620–2623. doi: 10.1002/ijc.22177.
4. Sturgis EM, Cinciripini PM. Trends in head and neck cancer incidence in relation to smoking prevalence: an emerging epidemic of human papillomavirus-associated cancers? Cancer 2007; 110 (7): 1429–1435. doi: 10.1002/cncr.22963.
5. Chaturvedi AK, Engels EA, Anderson WF et al. Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. J Clin Oncol 2008; 26 (4): 612–619. doi: 10.1200/JCO.2007.14.1713.
6. Näsman A, Nordfors C, Holzhauser S et al. Incidence of human papillomavirus positive tonsillar and base of tongue carcinoma: a stabilisation of an epidemic of viral induced carcinoma? Eur J Cancer 2015; 51 (1): 55–61. doi: 10.1016/j.ejca.2014.10.016.
7. Ramquist T, Dalianis T. An epidemic of oropharyngeal squamous cell carcinoma (OSCC) due to human papillomavirus (HPV) infection and aspects of treatment and prevention. Anticancer Res 2011; 31 (5): 1515–1519.
8. Adelstein D, Gillison ML, Pfister DG et al. NCCN guidelines insights: head and neck cancers, version 2.2017. J Natl Compr Canc Netw 2017; 15 (6): 761–770. doi: 10.6004/jnccn.2017.0101.
9. Chaturvedi AK, Engels EA, Pfeiffer RM et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 2011; 29 (32): 4294–4301. doi: 10.1200/JCO.2011.36.4596.
10. Münger K, Howley PM. Human papillomavirus immortalization and transformation functions. Virus Res 2002; 89 (2): 213–228.
11. Chaturvedi AK, Anderson WF, Lortet-Tieulent J et al. Worldwide trends in incidence rates for oral cavity and oropharyngeal cancers. J Clin Oncol 2013; 31 (36): 4550–4559. doi: 10.1200/JCO.2013.50.3870.
12. Husain N, Neyaz A. Human papillomavirus associated head and neck squamous cell carcinoma: controversies and new concepts. J Oral Biol Craniofac Res 2017; 7 (3): 198–205. doi: 10.1016/j.jobcr.2017.08.003.
13. Jung AC, Briolat J, Millon R et al. Biological and clinical relevance of transcriptionally active human papillomavirus (HPV) infection in oropharynx squamous cell carcinoma. Int J Cancer 2010; 126 (8): 1882–1894. doi: 10.1002/ijc.24911.
14. Straetmans JMJAA, Olthof N, Mooren J et al. Human papillomavirus reduces the prognostic value of nodal involvement in tonsillar squamous cell carcinomas. Laryngoscope 2009; 119 (10): 1951–1957. doi: 10.1002/lary.20593.
15. El-Naggar AK, Westra WH. p16 expression as a surrogate marker for HPV-related oropharyngeal carcinoma: a guide for interpretative relevance and consistency. Head Neck 2012; 34 (4): 459–461. doi: 10.1002/hed. 21974.
16. Sellers WR, Rodgers JW, Kaelin WG. A potent transrepression domain in the retinoblastoma protein induces a cell cycle arrest when bound to E2F sites. Proc Natl Acad Sci USA 1995; 92 (25): 11544–11548. doi: 10.1073/pnas.92.25.11544.
17. Witkiewicz AK, Knudsen KE, Dicker AP et al. The meaning of p16 (ink4a) expression in tumors: functional significance, clinical associations and future developments. Cell Cycle 2011; 10 (15): 2497–2503. doi: 10.4161/cc.10.15.16776.
18. Münger K, Werness BA, Dyson N et al. Complex formation of human papillomavirus E7 proteins with the retinoblastoma tumor suppressor gene product. EMBO J 1989; 8 (13): 4099–4105.
19. Takeuchi S, Takahashi A, Motoi N et al. Intrinsic cooperation between p16INK4a and p21Waf1/Cip1 in the onset of cellular senescence and tumor suppression in vivo. Cancer Res 2010; 70 (22): 9381–9390. doi: 10.1158/0008-5472.CAN-10-0801.
20. Sherr CJ, Roberts JM. CDK inhibitors: positive and negative regulators of G1-phase progression. Genes Dev 1999; 13 (12): 1501–1512. doi: 10.1101/gad.13.12.1501.
21. Jirawatnotai S, Hu Y, Michowski W et al. A function for cyclin D1 in DNA repair uncovered by protein interactome analyses in human cancers. Nature 2011; 474 (7350): 230–234. doi: 10.1038/nature10155.
22. Dok R, Kalev P, Van Limbergen EJ et al. p16INK4a impairs homologous recombination-mediated DNA repair in human papillomavirus-positive head and neck tumors. Cancer Res 2014; 74 (6): 1739–1751. doi: 10.1158/0008-5472.CAN-13-2479.
23. van Houten VM, Snijders PJ, van Den Brekel MW et al. Biological evidence that human papillomaviruses are etiologically involved in a subgroup of head and neck squamous cell carcinomas. Int J Cancer 2001; 93 (2): 232–235. doi: 10.1002/ijc.1313.
24. Shinohara S, Kikuchi M, Tona R et al. Prognostic impact of p16 and p53 expression in oropharyngeal squamous cell carcinomas. Jpn J Clin Oncol 2014; 44 (3): 232–240. doi: 10.1093/jjco/hyt223.
25. Linge A, Lohaus F, Löck S et al. HPV status, cancer stem cell marker expression, hypoxia gene signatures and tumour volume identify good prognosis subgroups in patients with HNSCC after primary radiochemotherapy: a multicentre retrospective study of the German Cancer Consortium Radiation Oncology Group (DKTK-ROG). Radiother Onco 2016; 121 (3): 364–373. doi: 10.1016/j.radonc.2016.11.008.
26. Gurin D, Slavik M, Hermanova M et al. Prognostic impact of combined immunoprofiles in oropharyngeal squamous cell carcinoma patients with respect to AJCC 8th edition. J Oral Pathol Med 2018; 47 (9): 864–872. doi: 10.1111/jop.12772.
27. Slavik M, Shatokhina T, Sana J et al. Expression of CD44, EGFR, p16, and their mutual combinations in patients with head and neck cancer: impact on outcomes of intensity-modulated radiation therapy. Head Neck 2019; 41 (4): 940–949. doi: 10.1002/hed.25533.
28. Stransky N, Egloff AM, Tward AD et al. The mutational landscape of head and neck squamous cell carcinoma. Science 2011; 333 (6046): 1157–1160. doi: 10.1126/science.1208130.
29. Ang KK, Harris J, Wheeler R et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010; 363 (1): 24–35. doi: 10.1056/NEJMoa0912217.
30. Gildener-Leapman N, Lee J, Ferris RL. Tailored immunotherapy for HPV positive head and neck squamous cell cancer. Oral Oncol 2014; 50 (9): 780–784. doi: 10.1016/j.oraloncology.2013.09.010.
31. Mirghani H, Amen F, Blanchard P et al. Treatment de-escalation in HPV-positive oropharyngeal carcinoma: ongoing trials, critical issues and perspectives. Int J Cancer 2015; 136 (7): 1494–1503. doi: 10.1002/ijc.28847.
32. Shi W, Kato H, Perez-Ordonez B. Comparative prognostic value of HPV16 E6 mRNA compared with in situ hybridization for human oropharyngeal squamous carcinoma. J Clin Oncol 2009; 27 (36): 6213–6221. doi: 10.1200/JCO.2009.23.1670.
33. Singhi AD, Westra WH. Comparison of human papillomavirus in situ hybridization and p16 immunohistochemistry in the detection of human papillomavirus-associated head and neck cancer based on a prospective clinical experience. Cancer 2010; 116 (9): 2166–2173. doi: 10.1002/cncr.25033.
34. Smeets SJ, Hesselink AT, Speel EJ et al. A novel algorithm for reliable detection of human papillomavirus in paraffin embedded head and neck cancer specimen. Int J Cancer 2007; 121 (11): 2465–2472. doi: 10.1002/ijc.22980.
35. Sedghizadeh PP, Billington WD, Paxton D et al. Is p16-positive oropharyngeal squamous cell carcinoma associated with favorable prognosis? A systematic review and meta-analysis. Oral Oncol 2016; 54 : 15–27. doi: 10.1016/j.oraloncology.2016.01.002.
36. Fakhry C, Lacchetti C, Rooper LM et al. Human papillomavirus testing in head and neck carcinomas: ASCO Clinical Practice Guideline Endorsement of the College of American Pathologists Guideline. J Clin Oncol 2018; 36 (31): 3152–3161. doi: 10.1200/JCO.18.00684.
37. Perrone F, Gloghini A, Cortelazzi B et al. Isolating p16-positive/HPV-negative oropharyngeal cancer: an effort worth making. Am J Surg Pathol 2011; 35 (5): 774–777; author reply 777–778. doi: 10.1097/PAS.0b013e3182116 a45.
38. Ukpo OC, Flanagan JJ, Ma XJ et al. High-risk human papillomavirus E6/E7 mRNA detection by a novel in situ hybridization assay strongly correlates with p16 expression and patient outcomes in oropharyngeal squamous cell carcinoma. Am J Surg Pathol 2011; 35 (9): 1343–1350. doi: 10.1097/PAS.0b013e318220e59d.
39. Anonym. TCGA releases head and neck cancer data. Cancer Discov 2015; 5 (4): 340–341. doi: 10.1158/2159-8290.CD-NB2015-024.
40. Jordan RC, Lingen MW, Perez-Ordonez B et al. Validation of methods for oropharyngeal cancer HPV status determination in US cooperative group trials. Am J Surg Pathol 2012; 36 (7): 945–954. doi: 10.1097/PAS.0b013e318253a2d1.
41. Fonmarty D, Cherriere S, Fleury H et al. Study of the concordance between p16 immunohistochemistry and HPV-PCR genotyping for the viral diagnosis of oropharyngeal squamous cell carcinoma. Eur Ann Otorhinolaryngol Head Neck Dis 2015; 132 (3): 135–139. doi: 10.1016/j.anorl.2015.01.003.
42. Lewis J, Ukpo OC, Ma XJ et al. Transcriptionally-active high-risk human papillomavirus is rare in oral cavity and laryngeal/hypopharyngeal squamous cell carcinomas – a tissue microarray study utilizing E6/E7 mRNA in situ hybridization. Histopathology 2012; 60 (6): 982–991. doi: 10.1111/j.1365-2559.2011.04169.x.
43. Bishop JA, Ma XJ, Wang H et al. Detection of transcriptionally active high-risk HPV in patients with head and neck squamous cell carcinoma as visualized by a novel E6/E7 mRNA in situ hybridization method. Am J Surg Pathol 2012; 36 (12): 1874–1882. doi: 10.1097/PAS.0b013e318265fb2b.
44. Kerr DA, Arora KS, Mahadevan KK et al. Performance of a branch chain RNA in situ hybridization assay for the detection of high-risk human papillomavirus in head and neck squamous cell carcinoma. Am J Surg Pathol 2015; 39 (12): 1643–1652. doi: 10.1097/PAS.0000000000000516.
45. Mirghani H, Casiraghi O, Amen F et al. Diagnosis of HPV-driven head and neck cancer with a single test in routine clinical practice. Mod Pathol 2015; 28 (12): 1518–1527. doi: 10.1038/modpathol.2015.113.
46. Prigge ES, Arbyn M, von Knebel Doeberitz et al. Diagnostic accuracy of p16INK4a immunohistochemistry in oropharyngeal squamous cell carcinomas: a systematic review and meta-analysis. Int J Cancer 2017; 140 (5): 1186–1198. doi: 10.1002/ijc.30516.
47. Taberna M, Mena M, Pavón MA et al. Human papillomavirus-related oropharyngeal cancer. Ann Oncol 2017; 28 (10): 2386–2398. doi: 10.1093/annonc/mdx304.
48. Lydiatt WM, Patel SG, O’Sullivan B et al. Head and neck cancers-major changes in the American Joint Committee on cancer eighth edition cancer staging manual. CA Cancer J Clin 2017; 67 (2): 122–137. doi: 10.3322/caac.21389.
49. Goodman MT, Saraiya M, Thompson TD et al. Human papillomavirus genotype and oropharynx cancer survival in the United States of America. Eur J Cancer 2015; 51 (18): 2759–2767. doi: 10.1016/j.ejca.2015.09.005.
50. Castellsagué X, Alemany L, Quer M et al. HPV involvement in head and neck cancers: comprehensive assessment of biomarkers in 3680 patients. J Natl Cancer Inst 2016; 108 (6): djv403. doi: 10.1093/jnci/djv403.
51. Lace MJ, Anson JR, Klingelhutz AJ et al. Human papillomavirus (HPV) type 18 induces extended growth in primary human cervical, tonsillar, or foreskin keratinocytes more effectively than other high-risk mucosal HPVs. J Virol 2009; 83 (22): 11784–11794. doi: 10.1128/JVI.01370-09.
52. Arends MJ, Wyllie AH, Bird CC. Human papillomavirus type 18 is associated with less apoptosis in fibroblast tumours than human papillomavirus type 16. Br J Cancer 1995; 72 (3): 646–649. doi: 10.1038/bjc.1995.388.
53. Villa LL, Schlegel R. Differences in transformation activity between HPV-18 and HPV-16 map to the viral LCR-E6-E7 region. Virol 1991; 181 (1): 374–377. doi: 10.1016/0042-6822 (91) 90507-8.
54. Bratman SV, Bruce JP, O’Sullivan B et al. Human papillomavirus genotype association with survival in head and neck squamous cell carcinoma. JAMA Oncol 2016; 2 (6): 823–826. doi: 10.1001/jamaoncol.2015.6587.
55. Varier I, Keeley BR, Krupar R et al. Clinical characteristics and outcomes of oropharyngeal carcinoma related to high-risk non-human papillomavirus16 viral subtypes. Head Neck 2016; 38 (9): 1330–1337. doi: 10.1002/hed.24442.
56. Mazul AL, Rodriguez-Ormaza N, Taylor JM et al. Prognostic significance of non-HPV16 genotypes in oropharyngeal squamous cell carcinoma. Oral Oncol 2016; 61 : 98–103. doi: 10.1016/j.oraloncology.2016.08.019.
57. Rietbergen MM, Brakenhoff RH, Bloemena E et al. Human papillomavirus detection and comorbidity: critical issues in selection of patients with oropharyngeal cancer for treatment De-escalation trials. Ann Oncol 2013; 24 (11): 2740–2745. doi: 10.1093/annonc/mdt319.
58. Mirghani H, Blanchard P. Treatment de-escalation for HPV-driven oropharyngeal cancer: Where do we stand? Clin Transl Radiat Oncol 2017; 8 : 4–11. doi: 10.1016/j.ctro.2017.10.005.
59. Lewis JS Jr., Khan RA, Masand RP et al. Recognition of nonkeratinizing morphology in oropharyngeal squamous cell carcinoma – a prospective cohort and interobserver variability study. Histopathology 2012; 60 (3): 427–436. doi: 10.1111/j.1365-2559.2011.04092.x.
60. Lewis JS Jr., Scantlebury JB, Luo J et al. Tumor cell anaplasia and multinucleation are predictors of disease recurrence in oropharyngeal squamous cell carcinoma, including among just the human papillomavirus-related cancers. Am J Surg Pathol 2012; 36 (7): 1036–1046. doi: 10.1097/PAS.0b013e3182583678.
61. Amin MB, Edge S, Greene F et al (eds). AJCC cancer staging manual. 8th ed. Springer International Publishing 2017.
62. Goldenberg D, Begum S, Westra WH et al. Cystic lymph node metastasis in patients with head and neck cancer: an HPV-associated phenomenon. Head Neck 2008; 30 (7): 898–903. doi: 10.1002/hed.20796.
63. Malm IJ, Fan CJ, Yin LX et al. Evaluation of proposed staging systems for human papillomavirus-related oropharyngeal squamous cell carcinoma. Cancer 2017; 123 (10): 1768–1777. doi: 10.1002/cncr.30512.
64. Smitha T, Dinakaran A. Modifications and recent updates in the 8th edition of tumor node metastasis staging pertaining to oropharynx and oral cavity. J Oral Maxillofac Pathol 2018; 22 (1): 6–8. doi: 10.4103/jomfp.JOMFP_59_18.
65. Keane FK, Chen YH, Tishler RB et al. Population-based validation of the recursive partitioning analysis-based staging system for oropharyngeal cancer. Head Neck 2016; 38 (10): 1530–1538. doi: 10.1002/hed.24470.
66. Edge SB, American Joint Committee on Cancer (ed). AJCC cancer staging manual. 7th ed. New York: Springer 2010.
67. Horne ZD, Glaser SM, Vargo JA et al. Confirmation of proposed human papillomavirus risk-adapted staging according to AJCC/UICC TNM criteria for positive oropharyngeal carcinomas. Cancer 2016; 122 (13): 2021–2030. doi: 10.1002/cncr.30021.
68. Huang SH, Xu W, Waldron J et al. Refining American Joint Committee on Cancer/Union for International Cancer Control TNM stage and prognostic groups for human papillomavirus-related oropharyngeal carcinomas. J Clin Oncol 2015; 33 (8): 836–845. doi: 10.1200/JCO.2014.58.6412.
69. Mizumachi T, Homma A, Sakashita T et al. Confirmation of the eighth edition of the AJCC/UICC TNM staging system for HPV-mediated oropharyngeal cancer in Japan. International J Clin Oncol 2017; 22 (4): 682–689. doi: 10.1007/s10147-017-1107-0.
70. Ward MJ, Mellows T, Harris S et al. Staging and treatment of oropharyngeal cancer in the human papillomavirus era. Head Neck 2015; 37 (7): 1002–1013. doi: 10.1002/hed.23697.
71. O’Sullivan B, Huang SH, Su J al. Development and validation of a staging system for HPV-related oropharyngeal cancer by the International Collaboration on Oropharyngeal cancer Network for Staging (ICON-S): a multicentre cohort study. Lancet Oncol 2016; 17 (4): 440–451. doi: 10.1016/S1470-2045 (15) 00560-4.
72. Würdemann N, Wagner S, Sharma SJ et al. Prognostic impact of AJCC/UICC 8th edition New Staging rules in oropharyngeal squamous cell carcinoma. Front Oncol 2017; 7 : 129. doi: 10.3389/fonc.2017.00 129.
73. Zhan KY, Eskander A, Kang SY et al. Appraisal of the AJCC 8th edition pathologic staging modifications for HPV-positive oropharyngeal cancer, a study of the National Cancer Data Base. Oral Oncol 2017; 73 : 152–159. doi: 10.1016/j.oraloncology.2017.08.020.
74. Panwar A, Interval E, Lydiatt WM. Emergence of a novel staging system for oropharyngeal squamous cell carcinoma based on HPV status. Oncology (Williston Park) 2017; 31 (12): e33–e40.
75. Haughey BH, Sinha P, Kallogjeri D et al. Pathology-based staging for HPV-positive squamous carcinoma of the oropharynx. Oral Oncol 2016; 62 : 11–19. doi: 10.1016/j.oraloncology.2016.09.004.
76. Sinha P, Kallogjeri D, Gay H et al. High metastatic node number, not extracapsular spread or N-classification is a node-related prognosticator in transorally-resected, neck-dissected p16-positive oropharynx cancer. Oral Oncol 2015; 51 (5): 514–520. doi: 10.1016/j.oraloncology.2015.02.098.
77. Hobelmann KC, Topf MC, Bar-Ad V et al. AJCC-8ed nodal staging does not predict outcomes in surgically managed HPV-associated oropharyngeal cancer. Oral Oncol 2018; 82 : 138–143. doi: 10.1016/j.oraloncology.2018.05.016.
78. Lewis JS Jr., Beadle B, Bishop JA et al. Human papillomavirus testing in head and neck carcinomas: guideline from the College of American Pathologists. Arch Pathol Lab Med 2018; 142 (5): 559–597. doi: 10.5858/arpa.2017-0286-CP.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2019 Issue 4-
All articles in this issue
- Current Perspective on HPV-Associated Oropharyngeal Carcinomas and the Role of p16 as a Surrogate Marker of High-Risk HPV
- Role of the Microbiome in the Formation and Development of Colorectal Cancer
- Methods of Classical and Molecular Cytogenetics Suitable for Biodosimetry of Persons with Professional Exposure to Carcinogens
- BMI and Odds of Endometrial Adenocarcinoma in Czech Women – a Case Control Study
- The Pharmacoeconomic Analysis of Cetuximab and Panitumumab in the 1st Line Treatment of mCRC in Real Clinical Practice in the Czech Republic
- Incidence and Risk Factors of Distant Metastases of Head and Neck Carcinoma
- Oncology Case Report – When Is the Appropriate Time to Integrate Palliative Care?
- Farmakoekonomické studie a procesy HTA při hodnocení nákladů a benefitů nákladné inovativní léčby u nás i ve světě
- Aplikovat jeden cyklus nebo jednu sérii chemoterapie?
- Zemřel prof. MUDr. Josef Koutecký, DrSc., zakladatel dětské onkologie
- Onkologie v obrazech Kožní toxicita při cílené léčbě generalizovaného melanomu
- P21-Associated ncRNA DNA Damage-Activated Expression in Bladder Cancer
- The Role of Radiotherapy in Skull Metastasis of Thyroid Follicular Carcinoma
- Urgent Surgical Treatment of GIST of Esophago-Gastric Junction in a Patient with Giant Hiatal Hernia
- Proposed Strategies for Improving Adherence to Tyrosine Kinase Inhibitors in Patients with Chronic Myeloid Leukaemia
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Role of the Microbiome in the Formation and Development of Colorectal Cancer
- Current Perspective on HPV-Associated Oropharyngeal Carcinomas and the Role of p16 as a Surrogate Marker of High-Risk HPV
- Oncology Case Report – When Is the Appropriate Time to Integrate Palliative Care?
- Incidence and Risk Factors of Distant Metastases of Head and Neck Carcinoma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

