-
Medical journals
- Career
Nové možnosti testování chemosenzitivity u nádorových onemocnění
Authors: Sommerová Lucia; Michalová Eva; Hrstka Roman
Authors‘ workplace: RECAMO, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2018; 31(2): 117-124
Category: Review
doi: https://doi.org/10.14735/amko2018117Overview
Východiska:
Vzhledem k nezastupitelné úloze chemoterapie při léčbě nádorových onemocnění se onkologický výzkum zaměřil na zvýšení účinnosti jednotlivých léčiv a maximální zmírnění, ne-li kompletní potlačení nežádoucích účinků. Vhodná léčba je primárně volena podle základních klinicko-patologických diagnostických kritérií, jako je velikost nádoru, stupeň diferenciace a přítomnost či absence standardních markerů. Situaci však komplikuje variabilita mezi jednotlivými pacienty spolu se značnou heterogenitou vlastního nádoru. Detailní charakterizace intratumorální heterogenity a získání spolehlivějších ukazatelů účinnosti léčiv by tak mělo vést k posílení personalizované terapie. Vývoj a výběr spolehlivých modelů tudíž představuje důležitou otázku ve výzkumu zaměřeném na predikci citlivosti nádorových buněk k léčbě.Cíl:
Práce shrnuje poznatky o testovacích systémech zaměřených na stanovení citlivosti či rezistence nádorových buněk k chemoterapii a jejich zavádění do onkologické praxe od prvních dnes již historických pokusů až po současnost se snahou posoudit jejich uplatnění ve stávající klinické praxi či blízké budoucnosti. Značný důraz je kladen na porovnání 2D a 3D in vitro buněčných modelů, neboť jejich význam a popularita konstantně narůstá. Pozornost je též věnovaná systémům in vivo, které v poslední době zaznamenaly nemalý progres a jsou v rámci klinických studií testovány k predikci odpovědi na podávanou terapii.Závěr:
Práce uvádí stručný přehled testů chemosenzitivity a hodnotí význam jednotlivých testů vzhledem k jejich zapojení do rozhodovacího procesu a stratifikace pacientů s cílem predikovat klinickou odpověď konkrétních pacientů a přispět tak k rozvoji cílené personalizované terapie.Klíčová slova:
techniky tkáňových kultur – individualizovaná medicína – screening léčiv – biologické modely – nádorové buněčné linie – karcinom – cytotoxické testyÚvod
Za ideálních podmínek ošetřující lékař správně diagnostikuje onemocnění a nasadí vhodnou léčbu, která bere v potaz celkový zdravotní stav pacienta a je současně maximálně účinná, avšak pokud možno bez nežádoucích vedlejších účinků (NÚ). V případě nádorových onemocnění je situace mnohem komplikovanější, neboť rakovina je značně heterogenní onemocnění. Jinými slovy i v případě nádorů nacházejících se ve stejné tkáni nemusí být tatáž léčba vždy rovnocenně účinná. Kromě toho je stále častěji skloňován i fenomén tzv. intratumorální heterogenity. To znamená, že nádorová masa je tvořena buněčnými populacemi (klony), které se mohou významně lišit v celé řadě vlastností vč. citlivosti k podávané léčbě. Avšak i přes tato úskalí jsou usilovně vyvíjeny testovací systémy, které by umožnily účinně predikovat citlivost nádorů k dostupným léčebným modalitám a zefektivnily by tak vlastní terapeutický efekt za současného minimalizování pro organizmus mnohdy značně devastujících NÚ protinádorové léčby.
Chemoterapie představuje jednu ze základních modalit při léčbě nádorových onemocnění. Jedná se o systémovou terapii, při níž jsou podávána tzv. cytostatika, jejichž cílem je usmrtit nádorové buňky. Připravují se nejčastěji synteticky, případně se jedná o deriváty pocházející z rostlin či plísní. Cytostatika obecně zasahují do průběhu buněčného cyklu a brání dalšímu dělení buněk. Proto jsou k nim velmi citlivé právě rychle se dělící nádorové buňky, případně buňky se sníženou schopností opravovat poškozenou DNA. Je třeba si však uvědomit, že chemoterapie působí nespecificky a účinky cytostatik se manifestují i vzhledem k fyziologicky rychle se dělícím buňkám, a to je spojeno právě s řadou NÚ. Tato skutečnost je jedním z hlavních důvodů neutuchajícího výzkumného úsilí o vývoj nových, selektivnějších a současně účinnějších léků. Nemalý úspěch zaznamenaly např. inhibitory tyrozinkináz interferující s významnými onkogenními signálními dráhami [1]. Renesanci v současné době zažívá imunoterapie, která je efektivní u celého spektra nádorových onemocnění, a není tudíž omezena jen na specifické skupiny nádorů a především její účinnost je dlouhodobá [2,3]. Dalším důležitým aspektem při léčbě nádorových onemocnění je možnost predikovat účinnost jednotlivých potenciálně aplikovatelných léků a zvolit tak pro daného pacienta co možná nejvhodnější, resp. nejúčinnější léčebný režim. První oficiální snahy v tomto směru se datují již ke konci první poloviny 20. století, kdy byly vyvíjeny a zaváděny první in vitro testy [4]. Přestože se jedná o značně atraktivní aplikovaný výzkum se zjevným praktickým uplatněním, dosud nebyl vytvořen, schválen ani systematicky zaveden univerzální protokol umožňující personalizovanou predikci chemosenzitivity u nádorových onemocnění.
Cílem této práce je shrnout poznatky o testovacích systémech založených na kultivaci nádorových buněk, příp. nádorových xenotransplantátů umožňujících stanovení citlivosti/rezistence nádorových onemocnění k chemoterapii vč. snahy o jejich zavádění do onkologické praxe od prvních dnes již historických pokusů až po současnost a posoudit jejich uplatnění ve stávající klinické praxi či blízké budoucnosti.
Historie testování chemosenzitivity nádorových onemocnění
Od 50. let minulého století byly vyvíjeny přístupy umožňující testování citlivosti lidských nádorových buněk k cytostatikům v podmínkách in vitro s cílem najít jednodušší alternativu k testům aktivity tehdy dostupných účinných látek prováděným především na hlodavcích.
První pokus popsali Black a Speer v roce 1954 [5]. Inkubovali řezy nádorové tkáně s cytostatiky a pozorovali inhibici metabolické aktivity buněk pomocí tetrazoliové soli. V několika následujících desetiletích byla publikována řada studií srovnávajících na podobném principu vyvinuté in vitro testy (ať již buňky kultivované v monovrstvě, nebo tkáňové řezy) s hodnocením citlivosti orgánových kultur in vivo s obecným cílem optimalizovat in vitro testy a přiblížit se stavu in vivo. Závěry mnoha z nich však připustily, že korelace výsledků není absolutní, přičemž testy in vitro jsou zatíženy řadou negativních faktorů, které jsou evokovány izolací buněk z původního mikroprostředí [6,7] a promítají se i do hodnocení metabolické aktivity buněk kultivovaných in vitro. Z metodických, tehdy zaváděných přístupů k testování životaschopnosti nádorových buněk se ujaly především ty, které byly založené na stanovení metabolické aktivity, jako je např. měření enzymatické aktivity sukcinát dehydrogenázy [5], kyselé fosfatázy [8,9] či založené na analýze inkorporace radioaktivně značených prekurzorů 3H-uridinu/3H-thymidinu během syntézy nukleových kyselin [10–12] v krátkodobých buněčných kulturách. Další skupinu představují metody hodnotící viabilitu testovaných buněk na bázi membránové integrity pomocí selektivního barvení mrtvých buněk. Tyto však byly obecně vnímány jako přístupy produkující nepřesné výsledky a v porovnání s ostatními metodami byly hodnoceny spíše jako nevyhovující [13,14].
V roce 1977 Hamburger a Salmon [15] kultivovali nádorové buňky na měkkém agarovém médiu a ke stanovení jejich chemosenzitivity použili test nazvaný HTCA (Human Tumor Colony Assay), který je založen na selektivním růstu nádorových buněk na médiu umožňujícím vznik kolonií. Přibližně po 10–21 dnech kultivace jsou kultury ovlivněné cytostatiky a kontrolní kultura vzájemně porovnány vzhledem k počtu vytvořených kolonií, z čehož se následně vyvozuje účinek testované látky.
Kangas et al [16] a Sevin et al [17,18] navíc využili k testování chemorezistence in vitro měření hladiny adenozin trifosfátu (adenosine triphosphate – ATP) jako základního zdroje energie živých buněk, a to pomocí bioluminiscence. Izolované buňky nádoru/shluky buněk byly kultivovány na agarovém médiu a po 6–7 dnech byl ATP z buněk extrahován, přidán komplex luciferin-luciferáza a hladina bioluminiscence byla měřena luminometrem.
Nejrozšířenější metodou stanovení citlivosti nádorových buněk in vitro se však stal tetrazoliový test (MTT test) [5,19,20] vycházející z původního konceptu a postupně zdokonalovaný díky vývoji kultivačních médií a laboratorního vybavení. Izolované buňky nádoru jsou kultivovány v kultivačních deskách s médiem obsahujícím cytostatikum o různých koncentracích a přežívání buněk v tomto prostředí je hodnoceno na základě zachování jejich metabolické aktivity. Ta je hodnocena mírou schopnosti živých buněk redukovat žlutou rozpustnou tetrazoliovou sůl, MTT (3-[4,5-dimethylazol-2-yl]-2,5-diphenyl-2H-tetrazolium bromid), pomocí mitochondriálních oxidoreduktáz na nerozpustný modrý formazan [21], který je následně rozpuštěn organickým rozpouštědlem [22,23]. Absorbance barevného produktu je následně měřena fotometricky a hodnoty získané u buněk kultivovaných s testovaným cytostatikem jsou srovnány s hodnotami identické kontrolní kultury bez ovlivnění. Následně jsou sestrojeny křivky přežití a hodnocena inhibiční koncentrace (IC) nebo též efektivní koncentrace (EC) cytostatika. Tato metoda byla taktéž zavedena v Masarykově onkologickém ústavu v Brně s cílem konsekutivně testovat chemorezistenci u vzorků odebraných v rámci léčby u většiny onkologických diagnóz [24,25]. Výsledky však nebyly uspokojivé a i přes další optimalizace [26] bylo rutinní testování v roce 2009 ukončeno.
Všechny dosud jmenované přístupy představují maximálně zjednodušené metody testování chemorezistence in vitro v 2D uspořádání, a to v podstatě až na úrovni jednotlivých separovaných buněk. Na druhou stranu je však třeba si uvědomit, že ve své jednoduchosti systém pomíjí vlastnosti nádorové tkáně (komplexnost a heterogenitu) a 2D uspořádání se značně vzdaluje podmínkám in vivo, proto může docházet k nemalému zkreslení dat. Souběžně se tedy objevují první práce pokoušející se kultivovat nádorové buňky v 3D uspořádání a toto využít i k testování chemosenzitivity.
3D in vitro modely
Již na počátku 20. století popsal Carrel [27] úspěšné experimenty s tkáňovými fragmenty dlouhodobě kultivovanými v podmínkách in vitro. V 50. letech pak Leighton provedl řadu in vitro studií, při nichž nádorové buňky nebo jejich shluky byly kultivovány na pórovité matrix (sponge-matrix) s cílem lépe simulovat 3D prostředí in vivo [28,29].
Rotman et al v roce 1988 [30] získali jemnou homogenizací nádoru shluky buněk (označené jako „micro-organs“), které vystavil fluorescein-acetátu s cílem selektovat „živé“ shluky pomocí fluorescence, tzv. fluorescent cytoprinting. Ty následně imobilizoval na matrix z celulózových vláken impregnovaných kolagenem a inkuboval 5–10 dní na ocelové destičce v Petriho misce s kultivačním médiem spolu s přídavkem testovaného cytostatika. Následně byla vyvolána další fluorescence a účinek cytostatika byl hodnocen porovnáním hladin fluorescence před a po vystavení shluků cytostatiku. Vescio [31] vyvinul systém histokultury in vitro, tzv. HDRA (Histoculture Drug-response Assay), v níž byly kousky (1–2 mm) nádoru kultivovány na gelu (native-state collagen-sponge gel) odvozeném od extracelulární matrix prasečí kůže podporující 3D růst nádoru, který byl ponořen do kultivačního média s cytostatiky v kultivační misce.
V současné době existuje řada modelových systémů, které se mohou uplatnit nejen v rámci výzkumu zaměřeného na biologii nádorové buňky, ale i prakticky např. při screeningu nových léčivých přípravků. Na druhou stranu však úspěšnost potenciálních protinádorových léků, které se ukazovaly jako velmi slibné v rámci testování v in vitro 2D kultivačních systémech, bývá v klinické praxi jen okolo 5–10 % [32–34]. Využití zvířecích modelů, které obvykle představuje navazující fázi v rámci preklinického testování, je naopak finančně i časově značně náročné a navíc ani tyto modelové systémy plně neodpovídají lidské fyziologii [35].
Tato skutečnost tedy nutí k vývoji modelového systému, který by umožnil monitorovat buněčnou proliferaci a životaschopnost (viabilitu) nádorových buněk a současně co možná nejvěrněji napodoboval situaci v lidském těle. V optimálním případě by pak měl současně umožňovat i monitorování migrace a invazivity nádorových buněk do přilehlého okolí, neboť se jedná o významné parametry spojené s tvorbou metastáz, které představují jednu z hlavních příčin selhání protinádorové terapie [36]. Dalším v dnešní době stále více skloňovaným požadavkem na vhodný buněčný model je možnost analýzy angiogeneze a schopnosti interagovat, resp. uniknout imunitnímu systému organizmu, ve kterém se nádor vytvořil [3,35].
Třídimenzionální (3D) kultivační modely řadu výše zmíněných vlastností splňují a představují tak atraktivní nástavbu testování cytotoxicity i efektivnosti a bezpečnosti nových léčiv v 2D in vitro podmínkách, a v řadě aspektů dokonce překonávají experimenty na zvířecích modelech [37]. Zavedení 3D in vitro modelů tak jednoznačně vedlo k eliminaci málo účinných protinádorových léků a redukci počtu experimentů na zvířecích modelech [38–40].
3D buněčné kultury jsou pokusem o simulaci prostředí tkání, ve kterých jsou buňky mezi sebou spojeny, interagují spolu a reagují na podněty z okolí [41]. Existuje celá řada variací 3D modelů. Dnes již klasickým a nejjednodušším 3D modelem jsou tzv. multicelulární sféroidy (MCS), ve kterých se adherentní nádorové buňky shlukují do útvarů připomínajících koule. Během přípravy sféroidů je možné využít syntetické buněčné lešení nebo přirozenou schopnost buněk produkovat extracelulární matrix (ECM). Pro vytvoření MCS jsou kritické 3 etapy:
- Vazba dlouhých řetězců ECM tvořících vlákna na integriny nacházející se na buněčném povrchu, což umožní přiblížení buněk rozptýlených v suspenzi a zajistí tvorbu agregátu. Buněčné shlukování pak aktivuje expresi kadherinů.
- Kadheriny jsou následně akumulovány na buněčném povrchu.
- Dochází k vytvoření mezibuněčných homofilických vazeb kadherin-kadherin, čímž vzniká MCS [42].
Důležitým krokem k vytvoření MCS je taktéž nutnost kultivovat buňky v prostředí, kde je adhezivita mezi buňkami silnější než přilnavost buněk k substrátu. Z toho důvodu se využívají kultivační desky se speciálním nepřilnavým povrchem, případně se používá metoda visící kapky, agitační míchaní nebo elektricky/magneticky indukovaná tvorba MCS [43]. Na našem pracovišti se nejčastěji používá metoda visící kapky – buňky se nanesou v kapce na víčko kultivační nádoby a po jejím otočení vznikne kapka. Buňky zde nemají možnost přisednout k povrchu a vytvářejí MCS ve spodní části kapky na rozhraní kultivačního média a vzduchu.
Další možností přípravy 3D kultur je využití trojrozměrných polymerních lešení. Nejčastěji se používají přírodní hydrogely, jako je Matrigel (gelová směs proteinů extracelulární matrix) nebo kolagen, které současně simulují přirozené vytváření spojů mezi nádorovými buňkami a ECM, která rovněž významně ovlivňuje buněčnou signalizaci [44,45]. Společná kultivace nádorového 3D sféroidu s dalšími buňkami jiného typu (např. endoteliální buňky, fibroblasty apod.) umožňuje kopírovat vliv nádorového mikroprostředí na progresi nádorového onemocnění [46]. Oproti nádorovým buňkám majícím při kultivaci v monovrstvě na Petriho misce plochý „rozprostřený“ tvar, vykazují buňky tvořící sféroid morfologii, která mnohem věrněji kopíruje morfologii buněk uvnitř nádoru, ze kterého byly odvozeny [47]. Dále buňky kultivované v monovrstvě proliferují v podstatě rovnoměrně, zatímco vytvořením buněčného sféroidu dochází ke vzniku rozdílných zón tvořených buňkami v různých fázích buněčného cyklu, s čímž je spojena i rozdílná rychlost proliferace [48,49]. Rovněž dochází k vytvoření gradientu živin, růstových faktorů, léčiv, plynů a dalších metabolických produktů a ke změnám v pH, které charakterizují nádor in vivo. Naopak buňky v 2D modelech jsou rovnoměrně vystavené působení látek, živin, růstových faktorů a léčiv nacházejících se v kultivačním médiu (obr. 1). Napodobování této vlastnosti nádoru in vitro může mít ve svém důsledku nejen stimulační nebo inhibiční efekt na progresi nádoru, ale současně se může podílet i na účinnosti terapie a odpovědi na ni [37,50]. Navíc bylo prokázáno, že v nádorové tkáni dochází vlivem hypoxie, hladovění (z důvodu zhoršeného zásobování živinami) a sníženého pH k indukci exprese proteinů spojených s rezistencí k chemoterapii, např. MRP1 (multidrug resistance protein) nebo LRP (lung resistance-related protein) [51,52].
Image 1. Schematické zobrazení rozdílů 2D a 3D kultivačních metod. 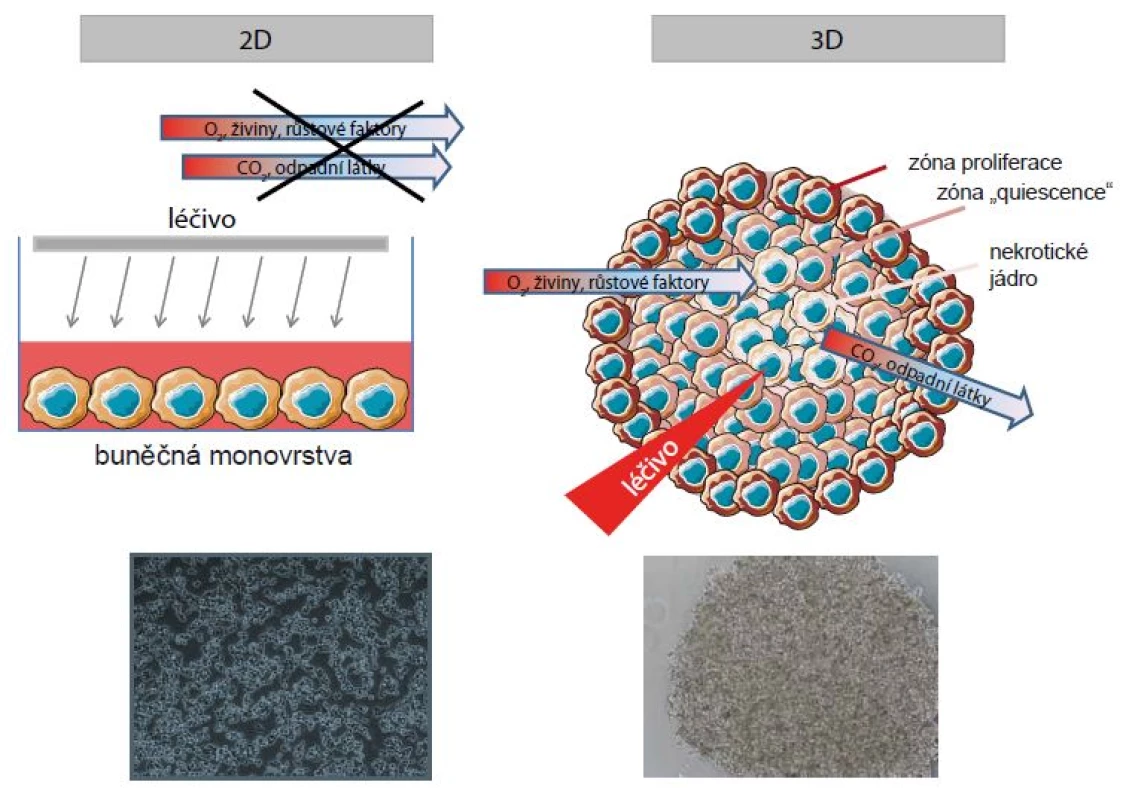
Nádorové buňky kultivované ve 2D podmínkách jsou přichyceny k plastovému podkladu, vykazují stejnou míru proliferace, jsou rovnoměrně vystavené působení látek z vnějšího prostředí a interagují se sousedními buňkami pouze malou částí svého povrchu. Naopak buňky kultivované ve 3D kultivačních podmínkách vytváří několik zón dle schopnosti proliferovat – zónu proliferace, zónu quiescence a nekrotické jádro. Takto uspořádaným nádorovým buňkám je umožněno vytvářet mezibuněčné interakce a interagovat s okolním extracelulárním matrixem (ECM). Kultivace buněčného sféroidu rovněž simuluje vytvoření gradientu léčiv, růstových faktorů, plynů a dalších produktů metabolizmu. Různá míra hypoxie a hladovění se pak promítá ve zvýšené rezistenci k podávaným léčivům. Rozdíly v intenzitě proliferace spolu s vytvořením gradientu v distribuci léčiva jsou hlavními důvody, proč jsou nádorové buňky kultivované v 3D modelu zpravidla více rezistentní k chemoterapii v porovnání s týmiž buňkami kultivovanými v monovrstvě [53–55]. Příkladem může být:
- 1. Dvojnásobné snížení citlivosti buněk melanomu kultivovaných v 3D podmínkách vzhledem k působení NPrCAP (4N-acetyl-4S-cysteaminylfenol) [56].
- 2. Snížení cytotoxického účinku paklitaxelu o 20–40 % u epiteliálních ovariálních buněk kultivovaných ve 3D modelu v porovnání s buňkami kultivovanými ve 2D podmínkách [54].
- 3. Významně snížená účinnost všech čtyř běžně používaných modalit při léčbě kolorektálního karcinomu (colorectal cancer – CRC) – melfalan, 5-fluorouracil, oxaliplatina a irinotekan – u buněčné linie HCT-116 odvozené od CRC, kultivované ve 3D sféroidech v porovnání s buňkami ve 2D kultivačním modelu, u něhož byly tytéž látky výrazně efektivnější [55].
Klíčovou úlohu při odpovědi na terapii hrají lokalizace a exprese buněčných povrchových receptorů spolu s buněčnými signálními drahami, jejichž aktivita se značně liší při porovnání 2D a 3D modelů, byť jsou tvořeny původně stejnými buňkami. To úzce souvisí se skutečností, že buňky kultivované ve 2D modelech mohou být citlivější k podávané terapii, než je tomu ve skutečnosti [57]. Současně pak může nastat i opačná situace, kdy jsou k terapii senzitivní pouze buňky kultivované v 3D modelu s tím, že in vitro 2D model poskytuje falešně negativní výsledky.
Přestože testování chemosenzitivity, resp. chemorezistence založené na troj-rozměrných kultivacích teprve vstupuje do povědomí odborné veřejnosti a většina experimentů byla provedena prozatím jen s ustavenými nádorovými buněčnými liniemi, v poslední době se stále hlasitěji o slovo hlásí příprava a praktické využití primárních buněčných linií (tzv. primokultur) získaných přímo od pacientů. Jednoznačně se jedná o krok směrem k rozvoji personalizované medicíny. Kondo et al [58] ve své studii úspěšně izolovali buňky z CRC od řady pacientů a připravili z nich 3D kultury in vitro, které věrně kopírovaly vlastnosti nádoru in vivo. Následně na 3D sféroidech analyzovali chemosenzitivitu a aktivaci signálních drah. Podařilo se jim prokázat, že odpověď na terapii 5-fluorouracilem (5-FU) je individuální. U tří pacientů byl růst sféroidů inhibován už při koncentraci 0,1 µg/ml, zatímco ve dvou případech ani koncentrace 10 µg/ml nebyla dostatečně účinná, aby docházelo k inhibici růstu sféroidů.
Vzhledem k obrovskému přínosu 3D kultur je v současné době hlavní snahou ve výzkumu nových protinádorových léků plnohodnotné začlenění trojrozměrně kultivovaných nádorových organoidů do preklinického „highthroughput“ screeningu léčiv. S tím úzce souvisí vývoj obecně platných postupů pro přípravu těchto 3D kultur, jejich management a testování citlivosti k léčbě, které musí být aplikovatelné napříč všemi světovými laboratořemi. Jednou z prvních vlaštovek by mohla být příprava uniformních reprodukovatelných sféroidů v 384 jamkovém formátu pomocí metody visící kapky. Tato metoda je plně kompatibilní s automatizovanými robotickými systémy běžně využívanými při velkokapacitním screeningu léčiv a byla nedávno úspěšně využita při testování citlivosti různých 3D kultur k 5-fluorouracilu [59].
Významným aspektem souvisejícím se zdomácněním 3D kultur v aplikovaném výzkumu zaměřeném na testování účinnosti nových nebo již dříve používaných léčiv představuje po jejich zavedení a optimalizaci také automatizace, jež by umožnila rutinní využití 3D kultur v běžné praxi při výzkumu jednotlivých nádorových onemocnění. Jako ilustrativní příklad mohou sloužit nedávno vytvořené platformy pro studium biologie nádorových kmenových buněk získaných z ascitu od pacientek s karcinomem vaječníku [60].
Nemalý význam je též kladen na vývoj metodik vedoucích k vytváření sféroidů, které by byly reprodukovatelné, snadno proveditelné a přitom cenově dostupné. Jednou z možností mohou být modifikace dříve používaných metod, např. analýza schopnosti nádorových buněk tvořit kolonie po expozici léčivu, která byla již úspěšně převedena do 3D formátu a nyní je ve stavu vývoje plně automatizovaného systému [61]. Nedávno byla publikována studie, v rámci které se podařilo připravit platformu pro jednoduché a současně kvantitativní testování chemosenzitivity buněk v 3D formátu [62]. Byla však pozorována různá míra úspěšnosti tvorby sféroidů pohybující se v rozmezí 50–99 % [63].
Hlavním přínosem testů chemosenzitivity je predikce citlivosti k plánované léčbě a s tím spojená selekce pacientů, kteří budou z léčby profitovat. Pěkným příkladem je tzv. CD-DST (Collagen gel Droplet-embedded culture Drug Sensitivity Test), který byl vyvinut již před 20 lety [64], avšak jeho přednosti v testování chemosenzitivity různých nádorů se využívají i v současnosti. CD-DST byl využit k predikci rezistence pacientů s hepatocelulárním karcinomem k standardně podávané léčbě a v související klinické studii umožnil poměrně spolehlivě stanovit, který z pacientů bude z adjuvantní chemoterapie skutečně profitovat [65,66]. Jen v roce 2017 bylo publikováno hned několik prací, které se zabývaly aplikací CD-DST u dalších malignit, jako je karcinom dutiny ústní, plic nebo nádory trávicího traktu [65,67,68].
Predikce chemosenzitivity s využitím in vivo modelů
Historicky tento přístup vychází z tzv. xenogenních (xenograftových) modelů, kdy je nádorová linie (většinou lidská) transplantována imunodeficitnímu xenogennímu příjemci. Nejčastěji se jedná o athymické Nu/Nu myši (chybí brzlík, neprodukují T buňky) nebo SCID myši (severe combined immunodeficiency disease), které nesou autozomalně recesivni mutaci SCID způsobujicí těžkou kombinovanou imunodeficienci (chybí protilátková i T buněčna imunita) a hodnocena je obvykle dynamika nádorového růstu a parametry přežití. V současnosti se při testování chemosenzitivity in vivo uplatňují zejména myší modely, které vykazují ještě vyšší stupeň imunodeficience v porovnání s klasickými xenogenními modely. Typickým příkladem je kmen NOD (non-obese diabetic) /SCID, u něhož nedochází k rozvoji diabetu, avšak myši vykazují sníženou aktivitu NK (natural killer) buněk a vrozené imunity vůbec, což až 10násobně zvyšuje toleranci vůči lidským hematopoetickým buňkám. Jiným příkladem je inbrední kmen nesoucí homozygotní mutaci IL2rg-/-(interleukin-2 receptor), která potlačuje tvorbu T a B lymfocytů a brání vzniku NK buněk. Křížením těchto dvou kmenů vznikl hybridní kmen NOD/SCID IL2rg-/-, který svými vlastnostmi umožňuje a zároveň významně zvyšuje úspěšnost uchycení a růstu nádorových buněk, a dokonce i dalších lidských tkání vč. kmenových a progenitorových buněk izolovaných z pupečníkové krve nebo kostní dřeně.
Imunodeficitní myši nesoucí lidské xenogenní nádory představují velice účinný nástroj v rámci preklinických studií zaměřených na screening potenciálních léčiv a identifikaci potenciálních terapeutických cílů. Současně mohou být i přímo využity v rámci konceptu tzv. personalizované terapie. Zjednodušeně jsou nádorové buňky/tkáně jednotlivých pacientů vneseny do vhodných imunodeficitních myší, kterým jsou následně podávány protinádorové léčebné modality s cílem vybrat co nejvhodnější lék, případně kombinaci vybraných léků.
Metodicky jsou xenogenní myší modely připravovány vnesením malého kousku nádoru nebo buněčné suspenze získané z krve pacienta či excizí nádorové tkáně. Při tomto procesu je bezpodmínečně nutná sterilita vnášené tkáně [69]. Nádorové buňky nebo kousky tkáně bývají často před vlastní injikací do myši smíchány s Matrigelem, který zefektivní růst xenogenního nádoru a přispívá k udržení původního fenotypu nádoru. Ze stejného důvodu bývají nádorové buňky často koinjikovány s dalšími buňkami, např. endoteliálními, stromálními, fibroblasty apod. V případě malého množství vstupního materiálu je nádorový materiál implantován subkutánně do omezeného počtu myší. Jakmile jsou xenogenní nádory dostatečně veliké, jsou odebrány a je z nich připravena buněčné suspenze, jež se následně aplikuje do další generace myší.
Další nemalou výhodou xenogenních myších modelů je možnost implantace nádorových buněk či tkání dvěma způsoby – ortotopicky nebo heterotopicky. Hlavními výhodami heterotopické implantace je jednoduchost a snadné monitorování růstu nádoru, přičemž v případě solidních tumorů se většinou jedná o subkutánní aplikaci, zatímco v případě krevních malignit o aplikaci intravenózní. Technicky mnohem náročnější je ortotopická implantace, při které se nádorové buňky vnášejí do stejného typu tkáně, resp. orgánu, ze kterého původně pocházejí. Tím se pro lidské nádorové buňky vytváří přívětivější okolní mikroprostředí, které mnohem věrněji simuluje vnější nádorové milieu v lidském těle. U ortotopických implantací je obvykle pozorována zvýšená incidence metastáz, čehož lze využít k predikci účinnosti léčby metastatického onemocnění, příp. k identifikaci buněčných populací, resp. molekulárních biomarkerů, které jsou s procesem vzniku metastáz asociovány [70]. Xenogenní myší model lze případně vytvořit i z cirkulujících nádorových buněk pocházejících z krve pacientů s nádorovým onemocněním. Předpokládá se, že cirkulující nádorové buňky se oddělily z primárních nádorových ložisek a volně cirkulují ve vaskulárním systému, dokud se neuhnízdí na příhodném místě a nezačnou nekontrolovaně proliferovat, aby daly vzniknout sekundárnímu ložisku – metastázi. Takto připravené modelové xenogenní systémy pak mohou sloužit nejen k testování chemosenzitivity, ale obecně i ke studiu tumorigenicity a k molekulární charakterizaci cirkulujících nádorových buněk. Zjednodušený postup přípravy xenogenních myších nádorových modelů je schematicky znázorněn na obr. 2.
Image 2. Schematické zobrazení přípravy xenogenních myších modelů. 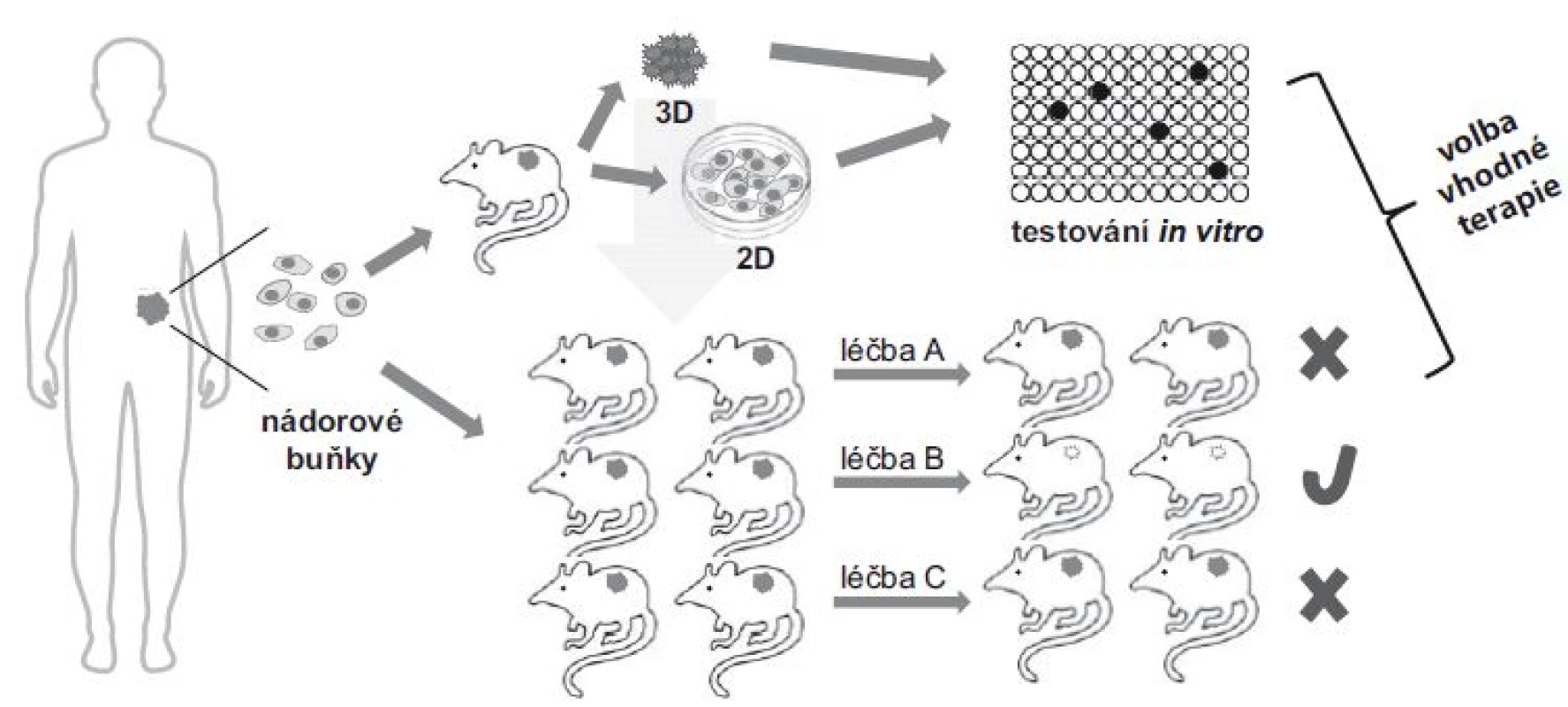
Kousky resekované nádorové tkáně mohou být přímo vneseny do imunodeficitních myší, častěji se však provádí homogenizace a získaná suspenze nádorových buněk je následně aplikována do imunodeficitních myší. Takto připravené xenogenní myší modely pak mohou sloužit buď k získání většího množství téměř identické nádorové masy vhodné pro další testování, nebo v případě dostatečného množství nádorového materiálu jsou přímo vystaveny působení příslušných chemoterapeutik s cílem monitorovat citlivost nádorových buněk k testovaným léčebným modalitám. Závěr
Vzrůstající množství nových, poměrně bezpečných protinádorových léků cílených proti specifickým signálním drahám a procesům i na subcelulární úrovni dává naději, že v drtivé většině případů bude k dispozici vhodný a dostatečně účinný lék pro daného onkologického pacienta. V současné době kurativní onkologická terapie obecně vychází především z tradičních klinicko-patologických parametrů, jako je histologický typ a rozsah (staging) nádorového onemocnění. Toto pak může být dle typu nádoru doplněno dalšími testy zaměřenými na vybrané molekulárně biologické determinanty a genetickým vyšetřením umožňujícím detekci specifických mutací. Značně atraktivní možnost pak nabízí funkční testování, při kterém jsou buňky pocházející z biopsie daného nádoru testovány ex vivo na citlivost k potenciálním léčebným modalitám, přičemž ošetřující lékař pak může na základě výsledku rozhodnout o vhodném a co možná nejúčinnějším léčebném režimu.
Na druhou stranu je však třeba si uvědomit komplexitu nádorových onemocnění, kdy se i v rámci jednoho nádoru můžeme setkat s výraznou heterogenitou a léčba aplikovaná vůči dominantnímu buněčnému klonu nemusí být vždy dostatečně účinná vzhledem k dalším minoritním buněčným populacím, které se nacházejí v rámci jednoho nádoru. Je třeba také vzít v potaz tzv. kmenové nádorové buňky, které se obecně mnohem méně dělí, a jsou tedy i mnohem méně citlivé k chemoterapii a následně mohou být příčinou recidivy onemocnění.
V podstatě nejhorší prognóza je v onkologii spojena s přítomností vzdálených metastáz, které jsou také obvykle hlavní příčinou úmrtí na onkologická onemocnění. Při tvorbě metastáz dochází k transformaci epiteliálních buněk primárního nádoru na mezenchymální buňky, které vykazují mnohem agresivnější fenotyp co do invazivity a schopnosti migrovat. Takto pozměněné buňky se mohou uvolnit do vaskulárního systému a volně cirkulovat v těle, současně se však tyto buňky nacházejí ve stavu dormance, neboť mají transientně pozastavený buněčný cyklus, což způsobuje jejich rezistenci k systémově podávaným cytostatikům. Po ukončení léčby pak může dojít k reaktivaci těchto buněk a vytvoření sekundárního nádorového ložiska.
V kontextu výše uvedeného tedy ani funkční testování prováděné komplementárně s rutinním klinicko-patologickým vyšetřením a dalšími sofistikovanými molekulárně biologickými metodami nemusí být dostatečné a jasně naznačuje potřebu nových dostupných individualizovaných přístupů umožňujících komplexní vyšetření na úrovni jednotlivých pacientů.
Práce byla podpořena projektem MŠMT – NPU I - LO1413 a GAČR 17-05838S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 21. 9. 2017
Přijato: 20. 12. 2017
doc. Mgr. Roman Hrstka, Ph.D.
RECAMO Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: hrstka@mou.cz
Sources
1. Workman P, Brunton VG, Robins DJ. Tyrosine kinase inhibitors. Semin Cancer Biol 1992; 3 (6): 369–381.
2. Scott AM, Wolchok JD, Old LJ. Antibody therapy of cancer. Nat Rev Cancer 2012; 12 (4): 278–287. doi: 10.1038/nrc3236.
3. Chen L, Han X. Anti-PD-1/PD-L1 therapy of human cancer: past, present, and future. J Clin Invest 2015; 125 (9): 3384–3391. doi: 10.1172/JCI80011.
4. Su YZ. Cancer chemosensitivity testing: Review. J Cancer Ther 2014; 5 (7): 672–679. doi: 10.4236/jct.2014.57 076.
5. Black MM, Speer FD. Further observations on the effects of cancer chemotherapeutic agents on the in vitro dehydrogenase activity of cancer tissue. J Natl Cancer Inst 1954; 14 (5): 1147–1158.
6. Kondo T, Imamura T, Ichihashi H. In vitro test for sensitivity of tumor to carcinostatic agents. Gan 1966; 57 (2): 113–121.
7. Ichihashi H, Sasaki S, Kondo T. Colorimetric estimation of succinic dehydrogenase activity by neotetrazolium chloride as a tumor sensitivity test to chemotherapeutic agents. Nagoya J Med Sci 1971; 33 (3): 247–256.
8. Imaizumi M. Study on the sensitivity test of carcinostatic agents by acid phosphatase activity. Nagoya J Med Sci 1972; 34 (4): 315–333.
9. Kondo T, Ichihashi H, Imaizumi M. Predication of the effect of carcinostatic agents on tumor-bearing host by the sensitivity test using acid phosphatase activity in vitro. Gan 1976; 67 (5): 633–639.
10. Volm M, Kaufmann M, Mattern J et al. Possibilities and limits of pre-therapeutic neoplasm sensitivity cytostatics tests under short-term conditions. Schweiz Med Wochenschr 1975; 105 (3): 74–82.
11. Volm M, Faufmann M, Mattern J et al. Sensitivity tests of tumors to cytostatic agents. I. Comparative investigations on transplanted tumors in vivo and in vitro. Z Krebsforsch Klin Onkol Cancer Res Clin Oncol 1975; 83 (2): 85–96.
12. Wiskemann A, Schussmann M, Rothmann D et al. In vitro and in vivo sensitivity of animal and human melanomas to various chemotherapeutical agents. Arch Dermatol Res 1978; 262 (3): 285–299.
13. Roper PR, Drewinko B. Comparison of in vitro methods to determine drug-induced cell lethality. Cancer Res 1976; 36 (7 PT 1): 2182–2188.
14. Weisenthal LM, Dill PL, Kurnick NB et al. Comparison of dye exclusion assays with a clonogenic assay in the determination of drug-induced cytotoxicity. Cancer Res 1983; 43 (1): 258–264.
15. Hamburger AW, Salmon SE. Primary bioassay of human tumor stem cells. Science 1977; 197 (4302): 461–463.
16. Kangas L, Grönroos M, Nieminen AL. Bioluminescence of cellular ATP: a new method for evaluating cytotoxic agents in vitro. Med Biol 1984; 62 (6): 338–343.
17. Sevin BU, Peng ZL, Perras JP et al. Application of an ATP-bioluminescence assay in human tumor chemosensitivity testing. Gynecol Oncol 1988; 31 (1): 191–204.
18. Sevin BU, Perras JP, Averette HE et al. Chemosensitivity testing in ovarian cancer. Cancer 1993; 71 (Suppl 4): 1613–1620.
19. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983; 65 (1–2): 55–63.
20. Carmichael J, De Graff W, Gazdar A et al. Evaluation of a tetrazolium-based semi-automatic colorimetric assay: Assessment of chemosensitivity testing. Cancer Research 1987; 47 (4): 936–942.
21. Slater TF. Studies on a succinate-neotetrazolium reductase system of rat liver. II. points of coupling with the respiratory chain. Biochim Biophys Acta 1963; 77 : 365–382.
22. Denizot F, Lang R. Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J Immunol Methods 1986; 89 (2): 271–277.
23. Berridge MV, Tan AS, McCoy KD et al. The biochemical and cellular basis of cell proliferation assays that use tetrazolium salts. Biochemica 1996; 4 (1): 15–19.
24. Kiss I, Žaloudík J, Vyzula R et al. Principal clinical indications for in vitro testing of chemoresistance of tumors. Klin Onkol 2000; 13 (Speciál 2): 62–64.
25. Žaloudík J, Hajduch M, Vyzula R et al. Results of chemoresistance MTT in vitro testing in lung and colorectal cacinomas nad soft-tissue sarcomas. Klin Onkol 2000; 13 (Speciál 2): 37–38.
26. Michalova E, Poprach A, Nemeckova I et al. Chemosensitivity prediction in tumor cells ex vivo-difficulties and limitations of the method. Klin Onkol 2008; 21 (3): 93–97.
27. Carrel A. On the permanent life of tissues outside of the organism. J Exp Med 1912; 15 (5): 516–528.
28. Leighton J. A sponge matrix method for tissue culture; formation of organized aggregates of cells in vitro. J Natl Cancer Inst 1951; 12 (3): 545–561.
29. Leighton J, Kline I, Belkin M et al. The similarity in histologic appearance of some human cancer and normal cell strains in sponge-matrix tissue culture. Cancer Res 1957; 17 (5): 359–363.
30. Rotman B, Teplitz C, Dickinson K et al. Individual human tumors in short-term micro-organ cultures: chemosensitivity testing by fluorescent cytoprinting. In vitro Cell Dev Biol 1988; 24 (11): 1137–1146.
31. Vescio RA, Connors KM, Kubota T et al. Correlation of histology and drug response of human tumors grown in native-state three-dimensional histoculture and in nude mice. Proc Natl Acad Sci U S A 1991; 88 (12): 5163–5166.
32. Ashworth A, Balkwill F, Bast RC et al. Opportunities and challenges in ovarian cancer research, a perspective from the 11th Ovarian cancer action/HHMT Forum, Lake Como, March 2007. Gynecol Oncol 2008; 108 (3): 652–657. doi: 10.1016/j.ygyno.2007.11.014.
33. van der Worp HB, Howells DW, Sena ES et al. Can animal models of disease reliably inform human studies? PLoS Med 2010; 7 (3): e1000245. doi: 10.1371/journal.pmed.1000245.
34. Rabacchi SA, Neve RL, Dräger UC. A positional marker for the dorsal embryonic retina is homologous to the high-affinity laminin receptor. Development 1990; 109 (3): 521–531.
35. Hait WN. Anticancer drug development: the grand challenges. Nat Rev Drug Discov 2010; 9 (4): 253–254. doi: 10.1038/nrd3144.
36. Chaffer CL, Weinberg RA. A perspective on cancer cell metastasis. Science 2011; 331 (6024): 1559–1564. doi: 10.1126/science.1203543.
37. Mehta G, Hsiao AY, Ingram M et al. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. J Control Release 2012; 164 (2): 192–204. doi: 10.1016/j.jconrel.2012.04.045.
38. Hirschhaeuser F, Menne H, Dittfeld C et al. Multicellular tumor spheroids: an underestimated tool is catching up again. J Biotechnol 2010; 148 (1): 3–15. doi: 10.1016/j.jbiotec.2010.01.012.
39. Hutmacher DW. Biomaterials offer cancer research the third dimension. Nat Mater 2010; 9 (2): 90–93. doi: 10.1038/nmat2619.
40. Hutmacher DW, Loessner D, Rizzi S et al. Can tissue engineering concepts advance tumor biology research? Trends Biotechnol 2010; 28 (3): 125–133. doi: 10.1016/ j.tibtech.2009.12.001.
41. Edmondson R, Broglie JJ, Adcock AF et al. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol 2014; 12 (4): 207–218. doi: 10.1089/adt.2014. 573.
42. Lin RZ, Chang HY. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol J 2008; 3 (9–10): 1172–1184. doi: 10.1002/biot.200700228.
43. Cui X, Hartanto Y, Zhang H. Advances in multicellular spheroids formation. J R Soc Interface 2017; 14 (127). pii: 20160877. doi: 10.1098/rsif.2016.0877.
44. Lu P, Weaver VM, Werb Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol 2012; 196 (4): 395–406. doi: 10.1083/jcb.201102147.
45. Tibbitt MW, Anseth KS. Dynamic microenvironments: the fourth dimension. Sci Transl Med 2012; 4 (160): 160ps24. doi: 10.1126/scitranslmed.3004804.
46. Bremnes RM, Dønnem T, Al-Saad S et al. The role of tumor stroma in cancer progression and prognosis: emphasis on carcinoma-associated fibroblasts and non-small cell lung cancer. J Thorac Oncol 2011; 6 (1): 209–217. doi: 10.1097/JTO.0b013e3181f8a1bd.
47. Gurski LA, Xu X, Labrada LN et al. Hyaluronan (HA) interacting proteins RHAMM and hyaluronidase impact prostate cancer cell behavior and invadopodia formation in 3D HA-based hydrogels. PLoS One 2012; 7 (11): e50075. doi: 10.1371/journal.pone.0050075.
48. Sutherland RM. Cell and environment interactions in tumor microregions: the multicell spheroid model. Science 1988; 240 (4849): 177–184.
49. LaRue KE, Khalil M, Freyer JP. Microenvironmental regulation of proliferation in multicellular spheroids is mediated through differential expression of cyclin-dependent kinase inhibitors. Cancer Res 2004; 64 (5): 1621–1631.
50. Smalley KS, Haass NK, Brafford PA et al. Multiple signaling pathways must be targeted to overcome drug resistance in cell lines derived from melanoma metastases. Mol Cancer Ther 2006; 5 (5): 1136–1144. doi: 10.1158/1535-7163.MCT-06-0084.
51. Zhu H, Luo SF, Wang J et al. Effect of environmental factors on chemoresistance of HepG2 cells by regulating hypoxia-inducible factor-1. Chin Med J (Engl) 2012; 125 (6): 1095–1103.
52. Xu X, Sabanayagam CR, Harrington DA et al. A hydrogel-based tumor model for the evaluation of nanoparticle-based cancer therapeutics. Biomaterials 2014; 35 (10): 3319–3330. doi: 10.1016/j.biomaterials.2013.12.080.
53. Fong EL, Lamhamedi-Cherradi SE, Burdett E et al. Modeling Ewing sarcoma tumors in vitro with 3D scaffolds. Proc Natl Acad Sci U S A 2013; 110 (16): 6500–6505. doi: 10.1073/pnas.1221403110.
54. Loessner D, Stok KS, Lutolf MP et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials 2010; 31 (32): 8494–8506. doi: 10.1016/j.biomaterials.2010.07.064.
55. Karlsson H, Fryknäs M, Larsson R et al. Loss of cancer drug activity in colon cancer HCT-116 cells during spheroid formation in a new 3-D spheroid cell culture system. Exp Cell Res 2012; 318 (13): 1577–1585. doi: 10.1016/j.yexcr.2012.03.026.
56. Yamamoto S, Okochi M, Jimbow K et al. Three-dimensional magnetic cell array for evaluation of anti-proliferative effects of chemo-thermo treatment on cancer spheroids. Biotechnology and Bioprocess Engineering 2015; 20 (3): 488–497. doi: 10.1007/s12257-014-0724-y.
57. dit Faute MA, Laurent L, Ploton D et al. Distinctive alterations of invasiveness, drug resistance and cell-cell organization in 3D-cultures of MCF-7, a human breast cancer cell line, and its multidrug resistant variant. Clin Exp Metastasis 2002; 19 (2): 161–168.
58. Kondo J, Endo H, Okuyama H et al. Retaining cell-cell contact enables preparation and culture of spheroids composed of pure primary cancer cells from colorectal cancer. Proc Natl Acad Sci U S A 2011; 108 (15): 6235–6240. doi: 10.1073/pnas.1015938108.
59. Tung YC, Hsiao AY, Allen SG et al. High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array. Analyst 2011; 136 (3): 473–478. doi: 10.1039/c0an00609b.
60. Raghavan S, Mehta P, Ward MR et al. Personalized medicine-based approach to model patterns of chemoresistance and tumor recurrence using ovarian cancer stem cell spheroids. Clin Cancer Res 2017; 23 (22): 6934–6945. doi: 10.1158/1078-0432.CCR-17-0133.
61. Lei KF, Kao CH, Tsang NM. High throughput and automatic colony formation assay based on impedance measurement technique. Anal Bioanal Chem 2017; 409 (12): 3271–3277. doi: 10.1007/s00216-017-0270-5.
62. Lei KF, Liu TK, Tsang NM. Towards a high throughput impedimetric screening of chemosensitivity of cancer cells suspended in hydrogel and cultured in a paper substrate. Biosens Bioelectron 2018; 100 : 355–360. doi: 10.1016/j.bios.2017.09.029.
63. Jeppesen M, Hagel G, Glenthoj A et al. Short-term spheroid culture of primary colorectal cancer cells as an in vitro model for personalizing cancer medicine. PLoS One 2017; 12 (9): e0183074. doi: 10.1371/journal.pone.0183074.
64. Kobayashi H, Tanisaka K, Doi O et al. An in vitro chemosensitivity test for solid human tumors using collagen gel droplet embedded cultures. Int J Oncol 1997; 11 (3): 449–455.
65. Hou J, Hong Z, Feng F et al. A novel chemotherapeutic sensitivity-testing system based on collagen gel droplet embedded 3D-culture methods for hepatocellular carcinoma. BMC Cancer 2017; 17 (1): 729. doi: 10.1186/s12885-017-3706-6.
66. Tanigawa N, Yamaue H, Ohyama S et al. Exploratory phase II trial in a multicenter setting to evaluate the clinical value of a chemosensitivity test in patients with gastric cancer (JACCRO-GC 04, Kubota memorial trial). Gastric Cancer 2016; 19 (2): 350–360. doi: 10.1007/s10120-015-0506-z.
67. Kanazawa Y, Yamada T, Fujita I et al. In vitro chemosensitivity test for gastric cancer specimens predicts effectiveness of oxaliplatin and 5-fluorouracil. Anticancer Res 2017; 37 (11): 6401–6405. doi: 10.21873/anticanres.12093.
68. Inoue M, Maeda H, Takeuchi Y et al. Collagen gel droplet-embedded culture drug sensitivity test for adjuvant chemotherapy after complete resection of non-small-cell lung cancer. Surg Today 2017; 48 (4): 380–387. doi: 10.1007/s00595-017-1594-7.
69. Pavía-Jiménez A, Tcheuyap VT, Brugarolas J. Establishing a human renal cell carcinoma tumorgraft platform for preclinical drug testing. Nat Protoc 2014; 9 (8): 1848–1859. doi: 10.1038/nprot.2014.108.
70. Lawson DA, Bhakta NR, Kessenbrock K et al. Single-cell analysis reveals a stem-cell program in human metastatic breast cancer cells. Nature 2015; 526 (7571): 131–135. doi: 10.1038/nature15260.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2018 Issue 2-
All articles in this issue
- Lidský papilomavirus – role v karcinogenezi cervixu a možnosti jeho detekce
- Anogenitální HPV infekce jako potenciální rizikový faktor orofaryngeálního karcinomu
- Úvod do problematiky léčby zhoubných nádorů ledvin
- Nové možnosti testování chemosenzitivity u nádorových onemocnění
- Kvalita života pacientů s častými nádory dutiny ústní léčených pooperační brachyterapií s vysokým dávkovým příkonem pro těsné nebo pozitivní okraje
- Změny v signální dráze MAPK/ERK u pacientů s histiocytózou Langerhansových buněk
- Súčasné trendy prežívania pacientov s nádorom testis – Národná populačná štúdia
- Kožné a podkožné metastázy adenokarcinómu ako dominujúca klinická manifestácia malignity neznámeho pôvodu – opis prípadu
- Diagnostická, prognostická a prediktivní imunohistochemie při maligním melanomu kůže
- Dlouhé nekódující molekuly RNA jako regulátory mitogenem aktivované proteinkinázové dráhy (MAPK) v nádorech
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kožné a podkožné metastázy adenokarcinómu ako dominujúca klinická manifestácia malignity neznámeho pôvodu – opis prípadu
- Změny v signální dráze MAPK/ERK u pacientů s histiocytózou Langerhansových buněk
- Dlouhé nekódující molekuly RNA jako regulátory mitogenem aktivované proteinkinázové dráhy (MAPK) v nádorech
- Lidský papilomavirus – role v karcinogenezi cervixu a možnosti jeho detekce
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

