-
Medical journals
- Career
Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu
Authors: S. Skaličková 1; M. Gargulák 2; M. Löffelmann 2; B. Ruttkay-Nedecký 2; M. Kepinská 3; T. Parák 1; Kizek R. 1–3
Authors‘ workplace: Ústav humánní farmakologie a toxikologie, Farmaceutická fakulta, Veterinární a farmaceutická univerzita Brno 1; Centrální laboratoře, Farmaceutická fakulta, Veterinární a farmaceutická univerzita Brno 2; Ústav biomedicínských a environmentálních analýz, Wroclaw Medical University, Wroclaw, Polsko 3
Published in: Klin Onkol 2017; 30(Supplementum1): 174-176
Category: Article
Overview
Východiska:
V popředí zájmu nanomedicíny je nanotechnologická úprava antracyklinových antibiotik, která se často využívají v protinádorové léčbě hematologických malignit a solidních nádorů. Chitosanové nanočástice získávají více pozornosti v oblasti cíleného transportu léčiv díky své stabilitě, nízké toxicitě a jednoduché přípravě. Cílem práce bylo navrhnout chitosanový nanotransportér antracyklinového antibiotika s modifikací povrchu zinkem, pro specifickou interakci s metalothioneinem (MT).Materiál a metody:
Chitosanové nanočástice s enkapsulovaným doxorubicinem byly připraveny rozpuštěním 5 g chitosanu v 3% kyselině octové a Trifenylfosfinu (TPP) (0,25 % w/v) a doxorubicinem (0,5 mg/ml). Fe2O3-NPs byly připraveny redukcí s borohydridem a amoniakem. Poté byly připraveny Fe2O3-AuNPs termální syntézou. Množství doxorubicinu a Zn2+ bylo určeno pomocí DPV.Výsledky:
V experimentu byl navržen a následně studován biofyzikálními metodami chitosanový nanotransportér antracyklinových antibiotik (CHIT-Zn-DOXO-Fe2O3-AuNPs). Uvnitř vytvořené nanometrické struktury je elektrostaticky navázán doxorubicin (o koncentraci kolem 10 µm, CHIT-DOXO). Navíc MT je molekula bohatá na cystein a díky svým volným sulfhydrylovým skupinám je schopen vázat ionty zinku. Této vlastnosti jsme se rozhodli využít v konstrukci nanotransportéru pro jeho cílené směřování k nádorové tkáni (CHIT-Zn-DOXO). V řadě našich předchozích experimentů jsme ukázali výrazné vzestupy hladiny MT ve zhoubných nádorech. MT do svých domén váže ionty těžkých kovů (přirozeně ionty zinku), a tak udržuje jejich homeostázu v organizmu. Proto jsme se v další části experimentu rozhodli sledovat schopnost modifikovaných chitosanových nanočástic (100 mg/ml, (CHIT-Zn-DOXO) vázat se k proteinu MT (magnetické zlaté nanočástice byly modifikovány MT, 100 µg/ml, Fe2O3-AuNPs). Efektivita vazby chitosanové nanočástice modifikovaná zinečnatými ionty (CHIT-Zn-DOXO) k MT (CHIT-Zn-DOXO-Fe2O3-AuNPs-MT) vzrostla o více než 30 % v porovnání s nemodifikovanou nanočásticí (CHIT-DOXO).Závěr:
Předpokládáme, že nový nanotransportér je specifický svojí biodostupností, zvýšeným vychytáváním léčiva z krevního řečiště v místě nádorové tkáně a nízkou toxicitou pro necílové tkáně.Klíčová slova:
chitosan – magnetické zlaté nanočástice – rakovina prsu – doxorubicinÚvod
V popředí zájmu nanomedicíny je nanotechnologická úprava antracyklinových antibiotik, která se často využívají v protinádorové léčbě hematologických malignit a solidních nádorů [1,2]. Nanotechnologická modifikace léčiva zlepšuje jeho zacílení primárně k nádorové buňce. Modifikované nanočástice dokáží zvýšit koncentraci protinádorového léčiva v cílovém místě bez navýšení nežádoucích účinků a také chrání léčiva před intracelulární enzymovou degradací nebo endozomální translokací. Z publikovaných prací je zřejmé, že chitosanové nanočástice získávají více pozornosti v oblasti cíleného transportu léčiv díky jejich stabilitě, nízké toxicitě a jednoduché přípravě [3]. Deacetylovaná chitosanová kostra glukosaminových jednotek má vysokou hustotu nabitých aminoskupin, které umožňují silné elektrostatické interakce s biomolekulami, přechodnými kovy (Zn, Se) a peptidy [4,5]. Bylo zjištěno, že významnou molekulou vázající těžké ionty je metalothionein a jeho hladina je u nádoru prsu také významně změněná [6–8]. Cílem práce bylo navrhnout chitosanový nanotransportér antracyklinového antibiotika s modifikací povrchu zinkem, pro specifickou interakci s metalothioneinem.
Materiál a metody
Chitosanové nanočástice s enkapsulovaným doxorubicinem byly připraveny rozpuštěním 5 g chitosanu v 3% kyselině octové a TPP (0,25 % w/v) a doxorubicinem (0,5 mg/ml). Ke stanovení doxorubicinu a Zn2+ pomocí diferenční pulzní voltametrie (DPV) byl použit AUTOLAB Analyzer (Metrohm, Švýcarsko). Stanovení probíhalo pomocí adsorptivní přenosové techniky a standardní cely se třemi elektrodami. Elektroda ze skelného uhlíku byla pracovní elektroda, Ag/AgCl/3M KCl elektroda byla referenční a platinová elektroda byla pomocná. Pro zpracování dat byl použit software NOVA (Metrohm, Švýcarsko). Analyzované vzorky byly před měřením zbaveny kyslíku probubláním argonem (99,999 %). Pro analýzu Doxo a Zn2+ byl použit acetátový pufr (0,2 M acetát sodný a 0,2 M kyselina octová) při pH 5, který byl použit jako pomocný elektrolyt. Parametry měření Doxo byly následující: počáteční potenciál –0,8 V, konečný potenciál –0,4 V, doba akumulace 120 s, krok potenciální 5 mV, modulační amplituda 25 mV, objem vzorku 10 µl, objem měřicí cely 2 ml. Parametry pro měření Zn2+: počáteční potenciál –1,2 V, konečný potenciál –0,7 V, doba akumulace 60 s, krok potenciální 5 mV, modulační amplituda 25 mV, objem vzorku 10 µl, objem měřicí cely 2 ml. Fe2O3-NPs byly připraveny redukcí s borohydridem a amoniakem. Poté byly Fe2O3-AuNPs připravené termální syntézou. Množství doxorubicinu a Zn2+ bylo určeno pomocí DPV.
Výsledky
V experimentu byl navržen a následně studován biofyzikálními metodami chitosanový nanotransportér antracyklinových antibiotik (CHIT-Zn-DOXO-Fe2O3-AuNPs) jak je ukázáno na obr. 1. Uvnitř vytvořené nanometrické struktury je elektrostaticky navázán doxorubicin (o koncentraci kolem 10 µM, CHIT-DOXO). Navíc metalothionein je molekula bohatá na cystein a díky svým volným sulfhydrylovým skupinám je schopen vázat ionty zinku. Této vlastnosti jsme se rozhodli využít v konstrukci nanotransportéru pro jeho cílené směřování k nádorové tkáni (CHIT-Zn-DOXO). V řadě našich předchozích experimentů jsme ukázali výrazné vzestupy hladiny MT ve zhoubných nádorech [9–11]. MT do svých domén váže ionty těžkých kovů (přirozeně ionty zinku), a tak udržuje jejich homeostázu v organizmu. Proto jsme se v další části experimentu rozhodli sledovat schopnost modifikovaných chitosanových nanočástic (100 mg/ml, (CHIT-Zn-DOXO) vázat se k proteinu MT (magnetické zlaté nanočástice byly modifikovány MT, 100 µg/ml, Fe2O3-AuNPs)). Efektivita vazby chitosanové nanočástice modifikovaná zinečnatými ionty (CHIT-Zn-DOXO) k MT (CHIT-Zn-DOXO-Fe2O3-AuNPs-MT) vzrostla o více jak 30 % v porovnání s nemodifikovanou nanočásticí (CHIT-DOXO). Námi navržený koncept nanotransportéru DOXO potencionálně ukazuje na jeho možné zacílení do tkání se zvýšenou hladinou MT.
Image 1. Předpokládané schéma chitosanového nanotransportéru doxorubicinu. 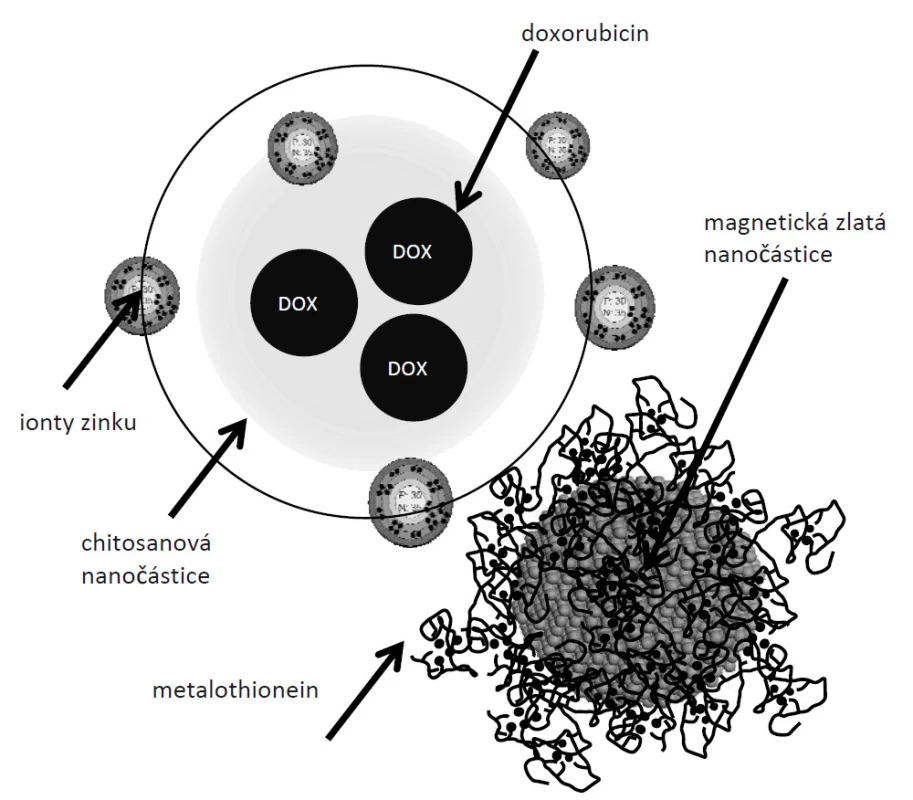
Chitosanová nanočástice s enkapsulovaným doxorubicinem je modifikována zinečnatými ionty (CHIT-Zn-DOXO). Takto připravená nanočástice je schopní interagovat s komplexem Fe2O3-AuNPs-MT přes volné SH skupiny v doménách MT. Závěr
Předpokládáme, že nový nanotransportér je specifický svojí biodostupností, zvýšeným vychytáváním léčiva z krevního řečiště v místě nádorové tkáně a nízkou toxicitou pro necílové tkáně. Z výsledků je patrné, že je nanočástice formována a ve své struktuře uzavírá doxorubicin a na povrchu jsou vázány ionty Zn2+. Získané výsledky vypovídají o formaci chitosanových nanočástic a jejich schopnosti vázat se na protein MT, který hraje důležitou roli u nádoru prsu.
Práce byla realizována za podpory projektu NANODRUGS 328/2017/FaF a The European Technology Platform for Nanomedicine.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Ing. Sylvie Skaličková, Ph.D.
Ústav humánní farmakologie a toxikologie
Farmaceutická fakulta
Veterinární a farmaceutická univerzita Brno
Palackého třída 1946/1
612 42 Brno
e-mail: sylvie.skalickova@gmail.com
Obdrženo: 6. 3. 2017
Přijato: 26. 3. 2017
Sources
1. Shi JJ, Kantoff PW, Wooster R et al. Cancer nanomedicine: progress, challenges and opportunities. Nat Rev Cancer 2017; 17 (1): 20–37. doi: 10.1038/nrc.2016.108.
2. Yaari Z, da Silva D, Zinger A et al. Theranostic barcoded nanoparticles for personalized cancer medicine. Nat Commun 2016; 7 : 13325. doi: 10.1038/ncomms13325.
3. Kamaly N, He JC, Ausiello DA et al. Nanomedicines for renal disease: current status and future applications. Nat Rev Nephrol 2016; 12 (12): 738–753. doi: 10.1038/ nrneph.2016.156.
4. Zhao HY, Lv P, Huo D et al. Doxorubicin loaded chitosan-ZnO hybrid nanospheres combining cell imaging and cancer therapy. RSC Adv 2015; 5 (74): 60549–60551.
5. Esmaeili A, Hadad NA. Preparation of ZnFe2O4-chitosan-doxorubicin hydrochloride nanoparticles and investigation of their hyperthermic heat-generating characteristics. Ceram Int 2015; 41 (6): 7529–7535.
6. Gomulkiewicz A, Jablonska K, Pula B et al. Expression of metallothionein 3 in ductal breast cancer. Int J Oncol 2016; 49 (6): 2487–2497. doi: 10.3892/ijo.2016.3759.
7. Burton C, Dan YB, Donovan A et al. Urinary metallomics as a novel biomarker discovery platform: breast cancer as a case study. Clin Chim Acta 2016; 452 : 142–148. doi: 10.1016/j.cca.2015.11.014.
8. Chandler P, Kochupurakkal BS, Alam S et al. Subtype-specific accumulation of intracellular zinc pools is associated with the malignant phenotype in breast cancer. Mol Cancer 2016; 15 : 2. doi: 10.1186/s12943-015-0486-y.
9. Gumulec J, Masarik M, Adam V et al. Serum and tissue zinc in epithelial malignancies: a meta-analysis. PLoS One 2014; 9 (6): e99790. doi: 10.1371/journal.pone.0099790.
10. Gumulec J, Raudenska M, Adam V et al. Metallothionein – immunohistochemical cancer biomarker: a meta-analysis. PLoS One 2014; 9 (1): e85346. doi: 10.1371/journal.pone.0085346.
11. Adam V, Petrlova J, Wang J et al. Zeptomole electrochemical detection of metallothioneins. PLoS One 2010; 5 (7): e11441. doi: 10.1371/journal.pone.0011441.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue Supplementum1-
All articles in this issue
- Analýza mikroRNA u epiteliálního karcinomu vaječníku
- Využití porózního hydrogelu jako 3D scaffoldu pro růst leukemických B lymfocytů
- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Diagnostický a terapeutický potenciál membránového HSP90
- Everolimus v denní klinické praxi se zaměřením na problematiku postižení sliznice dutiny ústní – zkušenost onkologického centra v průběhu roku 2016
- Stanovení DNA metylace v BRCA2 genu na elektrodových biočipech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Využití metody PLA pro detekci komplexů p53/p63/p73 in situ v nádorových buňkách a nádorové tkáni
- Význam deregulace mikroRNA v molekulární patogenezi a histologické transformaci folikulárního lymfomu
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
- Je možné pozorovat etnickou diferenci v základních krevních testech? Údaje z programu onkologické prevence v komplexním onkologickém centru v České republice
- Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu
- Fullerenový nanotransportér doxorubicinu pro cílenou interakci s mutovaným genem BRCA2
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

