-
Medical journals
- Career
Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
: E. Stuchlíková 1; M. Zahradníková 1; R. Nenutil 1,2; D. Valík 1,3; B. Vojtěšek 1; M. Novotný 1; L. Hernychová 1
: RECAMO, Masarykův onkologický ústav, Brno 1; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno 2; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 3
: Klin Onkol 2017; 30(Supplementum1): 187-190
: Article
Východiska:
Rakovina vaječníků je onkogynekologické onemocnění s nejvyšší úmrtností, téměř 80 % pacientek podlehne onemocnění do 5 let od diagnózy. Vysoká úmrtnost je způsobena především nespecifickými příznaky, diagnózou v pozdních stadiích a absencí specifického biomarkeru. V současné době jsou nejčastěji využívanými diagnostickými biomarkery membránový glykoprotein Cancer Antigen 125 (CA 125), Human Epididymal Protein 4 (HE4) a Carcinoembryonic Antigen (CAE). Žádný z těchto biomarkerů není specifický pouze pro rakovinu vaječníků, zvýšené hodnoty mohou být vyvolány i jinými onemocněními, proto se současné výzkumy zaměřují na hledání nových biomarkerů pro diagnostiku a prognostiku rakoviny vaječníků. Zajímavým klinickým materiálem se stává ascites, tekutina hromadící se v dutině břišní, která je typická pro rakovinu vaječníků a vyskytuje se téměř v 90 % případů III. a IV. stadia onemocnění.Materiál a metody:
Pro studii byly použity vzorky ascitických tekutin od pacientek s benigním a maligním nádorem vaječníků. Pro kompletní glykomickou a proteomickou analýzu bylo použito 5 µl ascitické tekutiny. Glykanové struktury byly odštěpeny z proteinů pomocí enzymu PNGáza F, proteiny byly následně štěpeny na peptidy pomocí trypsinu. Vzorky byly purifikovány a měřeny pomocí hmotnostního spektrometru.Výsledky:
Ve studii byly porovnávány glykanové a proteinové profily pacientek s benigním a maligním nádorem vaječníků. U pacientky s benigním nádorem byly zvýšeny jednodušší glykany s nízkým m/z, naopak u pacientky s maligním nádorem byly zvýšeny vyšší, komplexní glykany. U maligního nádoru bylo identifikováno 127 unikátních proteinů, především proteiny rodiny annexinů, mucinů a peroxiredoxinů.Závěr:
Práce je pilotní studií zabývající se srovnáním glykanového a proteinového složení ascitické tekutiny mezi pacientkou s benigním a maligním nádorovým onemocněním vaječníků. Na glykanové i proteinové úrovni byly patrné signifikantně významné rozdíly. Výsledky budou ověřeny na větším souboru pacientek a porovnány se sadou kontrolních vzorků.Klíčová slova:
glykomika – proteomika – ascitická tekutina – nádory vaječníkůVýchodiska
Rakovina vaječníků je šestá nejčastější příčina úmrtí na nádorová onemocnění u žen. Více než 70 % případů je diagnostikováno ve III. a IV. klinickém stadiu, kdy 5leté přežití klesá pouze na 25 % [1,2]. Onemocnění se projevuje nespecifickými příznaky, jako jsou nadýmání, poruchy trávení, bolesti hlavy, nepravidelná menstruace nebo únava. Příznaky se projevují u více než 80 % pacientek již v I. stadiu onemocnění, jsou však často zaměňovány s příznaky méně závažných chorob. Pouze 20 % případů rakoviny vaječníků je diagnostikováno v době, kdy je nádor lokalizován pouze ve vaječnících, a nejsou vytvořeny metastázy [3].
Téměř v 90 % případů II. a III. klinického stadia vzniká ascitická tekutina, která se hromadí v dutině břišní a může způsobovat bolesti a zvětšení objemu břicha nebo dýchací obtíže. Přítomnost ascitické tekutiny koreluje s rozšířením nádoru vaječníků do břišní dutiny a je asociovaná se špatnou prognózou onemocnění. U maligního nádoru se v ascitické tekutině hromadí prozánětlivé a nádor stimulující látky, které vytvářejí mikroprostředí pro vývoj nádorových buněk. Subpopulace těchto buněk vykazují fenotyp podobný rakovinným kmenovým buňkám, které způsobují zvýšenou rezistenci k léčbě a možnost šíření metastáz [4]. Tato studie se zabývá proteomickou analýzou ascitické tekutiny u benigního a maligního nádoru vaječníků. Identifikací jak proteinů, tak i glykanů přítomných v tekutinách byly zjištěny zásadní rozdíly, které by mohly v budoucnosti poskytnout zajímavé informace o stavu nádorového onemocnění a případné léčby.
Materiál a metody
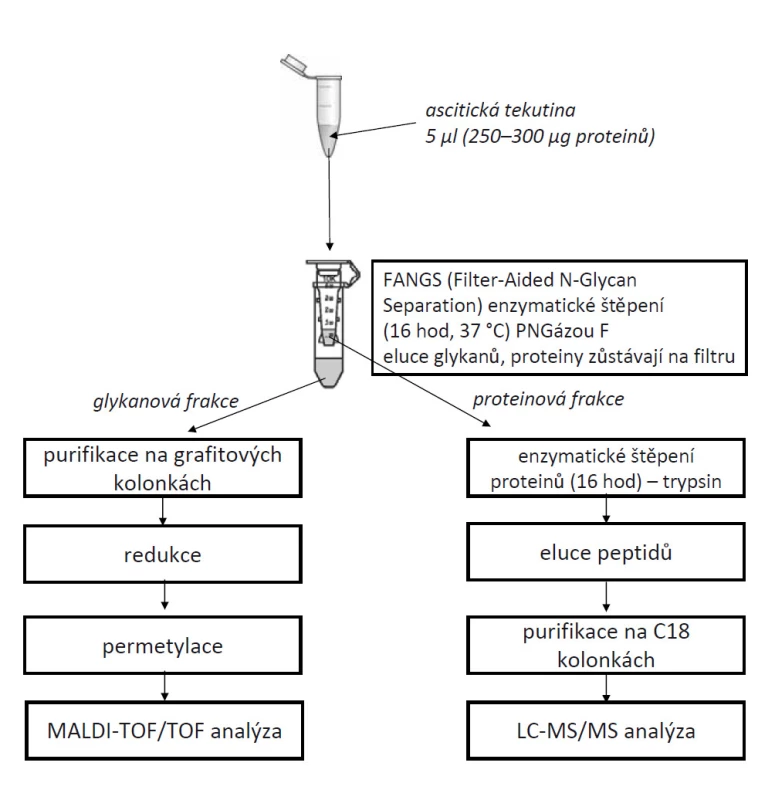
V pilotní studii byly použity vzorky ascitických tekutin od pacientek s benigním a maligním nádorem vaječníků. Pro kompletní glykomickou i proteomickou analýzu bylo použito 5 µl ascitické tekutiny. Proteiny byly denaturovány na filtru (filter-aided N-glycan separation – FANGS), redukovány pomocí 0,1 M dithiotreitolu a alkylovány 0,3 M jodacetamidem. Glykanové struktury byly z proteinů enzymaticky odštěpeny pomocí PNGázy F (odvozena z Flavobacterium meningosepticum) a po 16hodinovém štěpení při 37 °C byly eluovány z filtru. Proteiny zůstaly na filtru a byly štěpeny 16 hod při 37 °C pomocí enzymu trypsinu. Glykanová frakce byla následně purifikována na grafitových kolonkách, vzorky byly redukovány a po permetylaci byly měřeny na hmotnostním spektrometru MALDI-TOF/TOF (Applied Biosystems). Proteinová frakce byla purifikována pomocí C18 kolonek a vzorky byly měřeny na hmotnostním spektrometru Orbitrap-Elite (Thermo Fisher Scientific). Celý postup experimentu je graficky znázorněn na obr. 1.
Výsledky a diskuze
U pacientky s benigním nádorem bylo celkově identifikováno 160 proteinů, u pacientky s maligním nádorem 253 proteinů. V obou vzorcích bylo identifikováno 126 shodných proteinů. Pouze u pacientky s benigním typem nádoru bylo nalezeno 34 unikátních proteinů, které se v maligním vzorku nevyskytovaly. U pacientky s maligním nádorem bylo nalezeno 127 unikátních proteinů (obr. 2), jednalo se především o annexiny (A1, A2, A3, A4 a A10), muciny (1, 2, 5AC, 5B a 13) a peroxiredoxiny (1 a 2). Annexiny patří do rodiny proteinů schopných vázat vápník. U nádorů vaječníků dochází velmi často ke zvýšené expresi těchto proteinů. Annexiny A3 a A4 jsou zapojeny do mechanizmů vzniku rezistence na chemoterapeutickou léčbu u rakoviny vaječníků [5,6]. Rezistence na cisplatinu je provázena také zvýšenou expresí genů pro peroxiredoxin 1 a 2 [7]. Další zajímavé proteiny identifikované u pacientky s maligním nádorem byly především tetraspanin 8, cofilin 1 a anterior gradient protein 2. Souvislost mezi těmito proteiny a rakovinou vaječníků je v současnosti studována.
2. Vennův diagram zobrazující počet proteinů identifikovaných v ascitické tekutině benigního a maligního nádoru vaječníků. 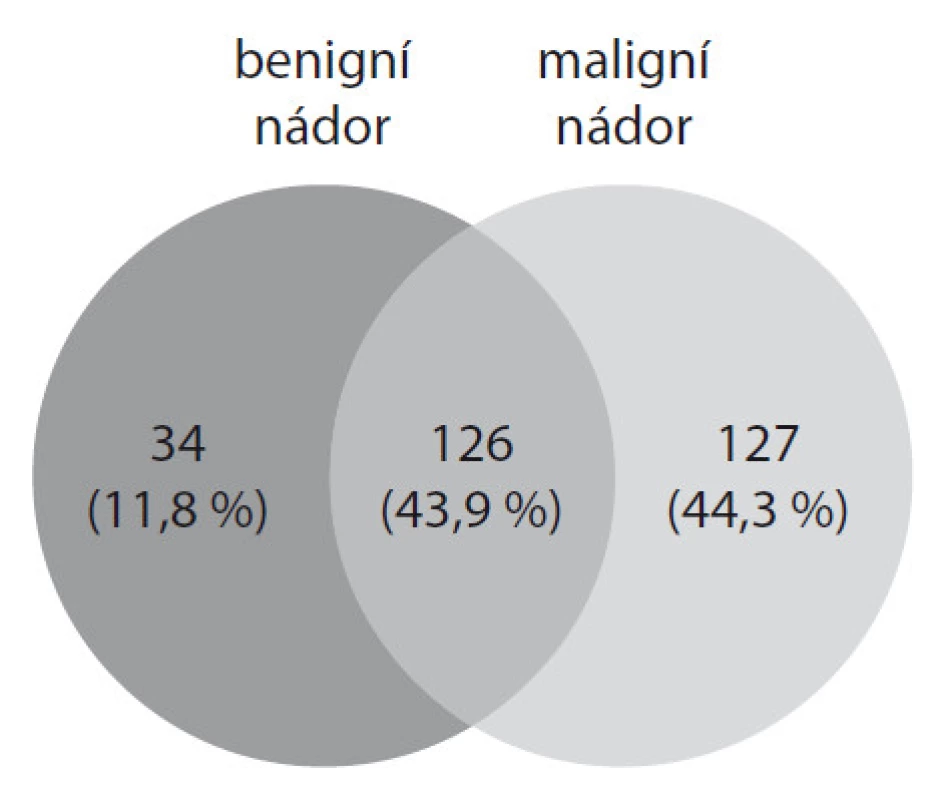
Glykanové profily pacientek s benigním a maligním nádorem byly výrazně odlišné. U pacientky s benigním typem nádoru byly signifikantně zvýšeny jednoduché glykany s nízkou hodnotou poměru hmotnosti a náboje (m/z) iontů přítomných v hmotnostním spektru. Jednalo se především o glykany s m/z 1 595,81; 1 799,91; 1 840,94 a 1 854,96; dále glykan manózového typu s m/z 2 004,01 a tři komplexní glykany 2 097,08; 2 301,18 a 3 070,56, které jsou fukosylované na základní struktuře (graf 1). Naopak u pacientky s maligním tumorem byly zvýšeny především vyšší, komplexní glykany obsahující sialové kyseliny, případně fukózu. Jedná se o glykany s m/z 3 227,63; 3 257,64 a 3 618,81 (graf 1). Také byl výrazně zvýšen glykan 2 808,41, který je typický pro imonoglobulin G.
1. Srovnání N-glykanových profilů. Srovnání relativních intenzit permetylovaných N-glykanů izolovaných z ascitických tekutin pacientek s benigním a maligním nádorem vaječníků. 
Zvýšenou expresi komplexních glykanů u pacientek s maligním nádorem vaječníků lze pozorovat nejen v ascitické tekutině, ale i v séru [2,8]. Profily benigní a maligní ascitické tekutiny významně korelují s již dříve publikovanou studií Biskupa et al [2] zabývající se srovnáním profilů sér pacientek s maligním a benigním nádorem vaječníků a sér zdravých žen. Glykanové profily zdravých sér a sér pacientek s benigním nádorem byly velmi podobné a výrazně se odlišovaly od maligního séra. Podobně jako u maligní ascitické tekutiny byla v séru zjištěna zvýšená exprese vyšších, především tří-a čtyřanténních glykanů a snížená exprese jednoduchých glykanů.
Závěr
Pilotní studie objevila zajímavé rozdíly mezi benigní a maligní ascitickou tekutinou jak na glykanové, tak na proteinové úrovni. V maligním ascitu byly zvýšeny hladiny komplexních fukosylovaných glykanů a byl identifikován téměř dvojnásobný počet unikátních proteinů vč. řady proteinů a především glykoproteinů, které se běžně vyskytují i v sérech pacientek s nádory vaječníků [9]. Získané výsledky budou validovány na větším souboru pacientek a budou porovnány se sadou kontrolních vzorků.
Poděkování
Rádi bychom poděkovali RNDr. Pavlovi Řehulkovi, Ph.D. z Fakulty vojenského zdravotnictví, Univerzity obrany v Hradci Králové za možnost měření glykanových vzorků na hmotnostním spektrometru.
Práce byla podpořena projekty MŠMT – NPU I – LO1413; MZ ČR – RVO (MOÚ, 00209805); GA ČR 16-04496S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Bc. Eliška Stuchlíková
RECAMO
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: eliskastuchlikova@seznam.cz
Obdrženo: 13. 3. 2017
Přijato: 26. 3. 2017
Sources
1. Smolle E, Taucher V, Haybaeck J. Malignant ascites in ovarian cancer and the role of targeted therapeutics. Anticancer Res 2014; 34 (4): 1553–1561.
2. Biskup K, Braicu EI, Sehouli J et al. The serum glycome to discriminate between early-stage epithelial ovarian cancer and benign ovarian diseases. Dis Markers 2014; 2014 : 238197. doi: 10.1155/2014/238197.
3. Bast RC Jr, Hennessy B, Mills GB. The biology of ovarian cancer: new opportunities for translation. Nat Rev Cancer 2009; 9 (6): 415–428. doi: 10.1038/nrc2644.
4. Ahmed N, Stenvers KL. Getting to know ovarian cancer ascites: opportunities for targeted therapy-based translational research. Front Oncol 2013; 3 : 256. doi: 10.3389/fonc.2013.00256.
5. Kim A, Enomoto T, Serada S et al. Enhanced expression of Annexin A4 in clear cell carcinoma of the ovary and its association with chemoresistance to carboplatin. Int J Cancer 2009; 125 (10): 2316–2322. doi: 10.1002/ijc.24587.
6. Yan X, Yin J, Yao H et al. Increased expression of annexin A3 is a mechanism of platinum resistance in ovarian cancer. Cancer Res 2010; 70 (4): 1616–1624. doi: 10.1158/0008-5472.CAN-09-3215.
7. Kalinina EV, Berezov TT, Shtil’ AA et al. Expression of peroxiredoxin 1, 2, 3, and 6 genes in cancer cells during drug resistance formation. Bull Exp Biol Med 2012; 153 (6): 878–881.
8. Alley WR, Vasseur JA, Goetz JA et al. N-linked glycan structures and their expressions change in the blood sera of ovarian cancer patients. J Proteome Res 2012; 11 (4): 2282–2300. doi: 10.1021/pr201070k.
9. Saldova R, Royle L, Radcliffe CM et al. Ovarian cancer is associated with changes in glycosylation in both acute-phase proteins and IgG. Glycobiology 2007; 17 (12): 1344–1356.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue Supplementum1-
All articles in this issue
- MicroRNA Analysis in Epithelial Ovarian Cancer
- Use of Porous Hydrogel as a 3D Scaffold for the Growth of Leukemic B Lymphocytes
- Ascites May Provide Useful Information for Diagnosis of Ovarian Cancer
- Diagnostic and Therapeutic Potential of Membrane HSP90
- Everolimus in Daily Clinical Practice Focusing to Oral Mucosa Damage Issues – Single Oncology Centre Experience within the Course of the Year 2016
- Analysis of DNA Methylation in BRCA2 Gene Using Electrode Biochips
- Molecular Pathology of Colorectal Cancer, Microsatellite Instability – the Detection, the Relationship to the Pathophysiology and Prognosis
- Lactate Dehydrogenase – Old Tumour Marker in the Light of Current Knowledge and Preanalytic Conditions
- Application of PLA Method for Detection of p53/p63/p73 Complexes in Situ in Tumour Cells and Tumour Tissue
- The Importance of MicroRNA Deregulation in the Molecular Pathogenesis and Histological Transformation of Follicular Lymphoma
- Circulating Myeloid Suppressor Cells and Their Role in Tumour Immunology
- Can we Observe Ethnic Difference in Basic Blood Tests? Single-institution Data from Cancer Prevention Programme in the Czech Republic
- Zinc-modified Nanotransporter for Target Drug Therapy of Breast Cancer
- Fullerene Doxorubicin Nanotransporter for Target Interaction with mutated gene BRCA2
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ascites May Provide Useful Information for Diagnosis of Ovarian Cancer
- Lactate Dehydrogenase – Old Tumour Marker in the Light of Current Knowledge and Preanalytic Conditions
- Molecular Pathology of Colorectal Cancer, Microsatellite Instability – the Detection, the Relationship to the Pathophysiology and Prognosis
- Circulating Myeloid Suppressor Cells and Their Role in Tumour Immunology
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career