-
Medical journals
- Career
Léčba histiocytózy z Langerhansových buněk kladribinem dosáhla u 9 z 10 dospělých pacientů dlouhodobé kompletní remise
Authors: Z. Adam 1; P. Szturz 1; J. Ďuraš 2; L. Pour 1; M. Krejčí 1; Z. Řehák 3; R. Koukalová 3; M. Navrátil 1; R. Hájek 1; Z. Král 1; J. Mayer 1
Authors‘ workplace: Interní hematoonkologická klinika, LF MU a FN Brno 1; Ústav klinické hematologie, FN Ostrava 2; Oddělení nukleární medicíny, centrum PET, MOÚ Brno 3
Published in: Klin Onkol 2012; 25(4): 255-261
Category: Original Articles
Overview
Východiska:
Účinnost kladribinu závisí na poměru aktivačního enzymu (deoxycytidinkinázy) a deaktivačního enzymu (5-nukleotidázy). Tento poměr je vysoký nejen v klidových lymfocytech, ale také v Langerhansových buňkách a v některých dalších histiocytárních buňkách. Proto má kladribin vysokou účinnost u pacientů s histiocytózou z Langerhansových buněk (LCH). V roce 2003 byla zveřejněna první zpráva o vynikajících výsledcích aplikace kladribinu v první léčebné linii u pacientů s multisystémovou či multifokální formou LCH. Proto na našem pracovišti používáme kladribin nejen pro dospělé nemocné s relabující formou LCH, ale také v rámci léčby první linie multifokální a multisystémové formy LCH.Soubor pacientů a metody:
Od roku 2001 jsme léčili kladribinem celkem 10 dospělých (9 mužů a 1 žena). Medián věku stanovení diagnózy je 31,5 (5–45) roku. Choroba měla u 8 pacientů formu multiorgánového postižení a u 2 pacientů formu multifokální kostní formy s agresivním průběhem. Kladribin jsme podávali v dávce 5 mg/m2/den s.c. 5 dní po sobě ve 28denních intervalech. V případě nedostatečné účinnosti jsme u dvou nemocných po třetím cyklu kladribinu v monoterapii přešli na kombinovanou léčbu kladribin 5 mg/m2/den, cyklofosfamid 150 mg/m2/den a dexametazon 20 mg/den, vše 1. až 5. den. Maximálně jsme plánovali 6 cyklů.Výsledky:
Medián podaných cyklů kladribinu byl 5 (4–6). Celkem 10 pacientů ukončilo léčbu a z nich 9 (90 %) je v kompletní remisi s mediánem sledování 26 měsíců (16–94). Pouze u jednoho pacienta byla léčba neúspěšná – nemoc progredovala do 60 dnů od ukončení léčby a vyžadovala další léčbu (CHOEP, vysokodávkovanou chemoterapii BEAM s autologní transplantací, následně léčbu revlimidem a alogenní transplantaci). Léčebnou odpověď – vymizení infiltrátu v infundibulu hypofýzy – jsme pozorovali u 2 pacientů s ložiskem LCH v infundibulu hypofýzy.Závěr:
Kladribin je vhodným lékem pro multiorgánové a multifokální formy LCH. V našem kolektivu deseti hodnocených nemocných dosáhla léčba kladribinem 90 % dlouhodobých kompletních remisí. Tři pacienti měli postižení CNS a u všech třech bylo dosaženo léčebné odpovědi.Klíčová slova:
kladribin – 2-chlorodeoxyadenosin – histiocytóza z Langerhansových buněk – diabetes insipidusÚvod
Histiocytóza z Langerhansových buněk má velmi široké spektrum projevů, od jednoho osteolytického ložiska až po generalizovanou formu nemoci postihující více orgánů. A stejně tak pestrý je průběh choroby, na jedné straně jsou případy se spontánními remisemi, na druhé straně případy s postupnou progresí nemoci vedoucí ke smrti [1]. Ale i opakované relapsy, které neohrožují život nemocného, výrazně zhoršují jeho kvalitu [2].
Pro histiocytózu z Langerhansových buněk (Langerhans Cell histiocytosis – LCH) se nepoužívá klasická TNM klasifikace (obvyklá u solidních tumorů), ale podobně jako u většiny hematologických chorob je pro vyjádření rozsahu nemoci používána specifická klasifikace vytvořená Histiocytární společností (Histiocyty Society). Dle míry postižení organizmu se rozlišující následující tři formy:
- forma solitární – pouze jedno ložisko v organizmu,
- forma multifokální – omezena pouze na jeden orgán či systém, ale s více ložisky v rámci této tkáně či orgánu,
- forma multiorgánová – postihuje více orgánů a tkání současně.
Solitární forma nemoci se léčí lokálními postupy. Multifokální a multiorgánová forma nemoci vyžaduje systémovou léčbu.
U dětí jsou jasně definovány takzvané rizikové orgány, při jejichž postižení je prognóza nemoci nepříznivá a nemoc je často rezistentní na léčbu. Těmito rizikovými orgány u dětí jsou játra, slezina, plíce a kostní dřeň. U dětí dále platí, že při postižení obratlů, kostí tváře nebo kostí přední a střední jámy lební hrozí zvýšené riziko postižení CNS, a to jak hypotalamu a hypofýzy, tak ostatního mozkového parenchymu [3].
U dospělých nemocných nebyly jednoznačně definovány orgány, při jejichž postižení by nemoc měla nepříznivý průběh. Prognostické ukazatele ověřené v pediatrických kolektivech nebyly u dospělých nemocných ověřeny pro vzácnost LCH s multiorgánovým postižením u osob starších 18 let. Nicméně i u dospělých osob s LCH platí, že multiorgánové postižení signalizuje méně příznivý průběh než postižení pouze jednoho orgánu či tkáně. Časná recidiva po léčbě signalizuje agresivní průběh choroby jak u dětí, tak u dospělých pacientů [1].
Léčebné postupy u dospělých se odvozují od zkušeností s léčbou dětských pacientů, protože u dospělých pacientů nebyla dokončena ani jedna klinická studie. Prvním úspěšným cytostatikem pro léčbu LCH byl vinblastin a svoje postavení „zlatého standardu“ pro léčbu LCH si stále udržuje. V rámci léčby první linie se klasicky kombinoval s prednisonem a případně s merkaptopurinem.
Léčba vinblastinem a kortikoidy má u dospělých pacientů četnější rizika než u dětských pacientů, a proto je vhodné ji nahradit kladribinem. Limitujícím nežádoucím účinkem vinkristinu a vinblastinu je neuropatie. Neuropatie způsobuje nejen parestezie, ale může oblenit i peristaltiku, způsobit obstipaci a ta v případě divertikulózy sigmatu může vyvolat další komplikace. Extrémní formou neuropatie, ke které může dojít při přehlédnutí varovných příznaků, je paralytický ileus. Dalším problémem při dlouhodobé léčbě vinblastinem a vinkristinem je vznik nekrózy při nechtěném úniku léčiva mimo žílu do podkoží (paravazace). Třetí nevýhodou léčby vinblastinem dle pediatrických protokolů je dlouhá doba léčby. Prednison, který se standardně podává v kombinaci s vinblastinem, může způsobit u dospělých pacientů manifestaci diabetu mellitu II. typu.
Pro léčbu rezistentních či relabujících forem LCH u dětí i u dospělých se od počátku 90. let používá kladribin. Vzhledem k velmi dobré toleranci a velmi vysoké účinnosti je od roku 2003 v zahraničí používán u dospělých jako lék první volby pro multifokální či multiorgánové formy nemoci.
Publikované zprávy popisující velmi dobrý účinek při minimu nežádoucích účinků nás vedly k tomu, že u dospělých nemocných tento lék používáme pro léčbu multifokální a multiorgánové formy LCH jak v rámci iniciální léčby, tak v rámci léčby relapsu. Efekt léčby kladribinem nastupuje rychle, je excelentně tolerována a dosažené remise jsou dlouhodobé. V následujícím textu shrnujeme naše zkušenosti s touto léčbou.
Soubor pacientů a léčba
Soubor pacientů
Léčbu kladribinem absolvovalo celkem 10 pacientů (9 mužů a 1 žena). Pouze u jednoho nemocného byla diagnóza LCH stanovena v dětství, v 5 letech, u ostatních byla diagnóza LCH stanovena v dospělosti.
Medián věku stanovení diagnózy celého souboru je 31,5 (5–45 let) roku. Medián věku stanovení diagnózy u 9 pacientů, u nichž byla choroba diagnostikována v dospělém věku, je 34 (21–45) let.
Medián věku, v němž byla zahájena léčba kladribinem, byl 33 (21–55) let.
U 2 z 10 z pacientů byl postižen pouze skelet, u ostatních 8 pacientů bylo postiženo více orgánů či tkání (multiorgánová forma LCH).
Dva pacienti z deseti měli agresivní multifokální postižení skeletu, u jednoho z nich masy LCH expandovaly z okcipitální kosti intrakraniálně a komprimovaly okcipitální lalok, což vedlo k výpadkům zrakového pole. A podobně i u druhého pacienta s agresivním multifokálním postižením se jednalo o mnohočetné postižení skeletu i s postižením obratlů, žeber a kalvy. Osm pacientů z desetičlenného léčeného kolektivu mělo multiorgánovou.
Rozsah nemoci při zahájení léčby kladribinem ukazuje tab. 1.
Table 1. Stručná charakteristika rozsahu choroby u 10 pacientů s LCH v době zahájení léčby kladribinem. 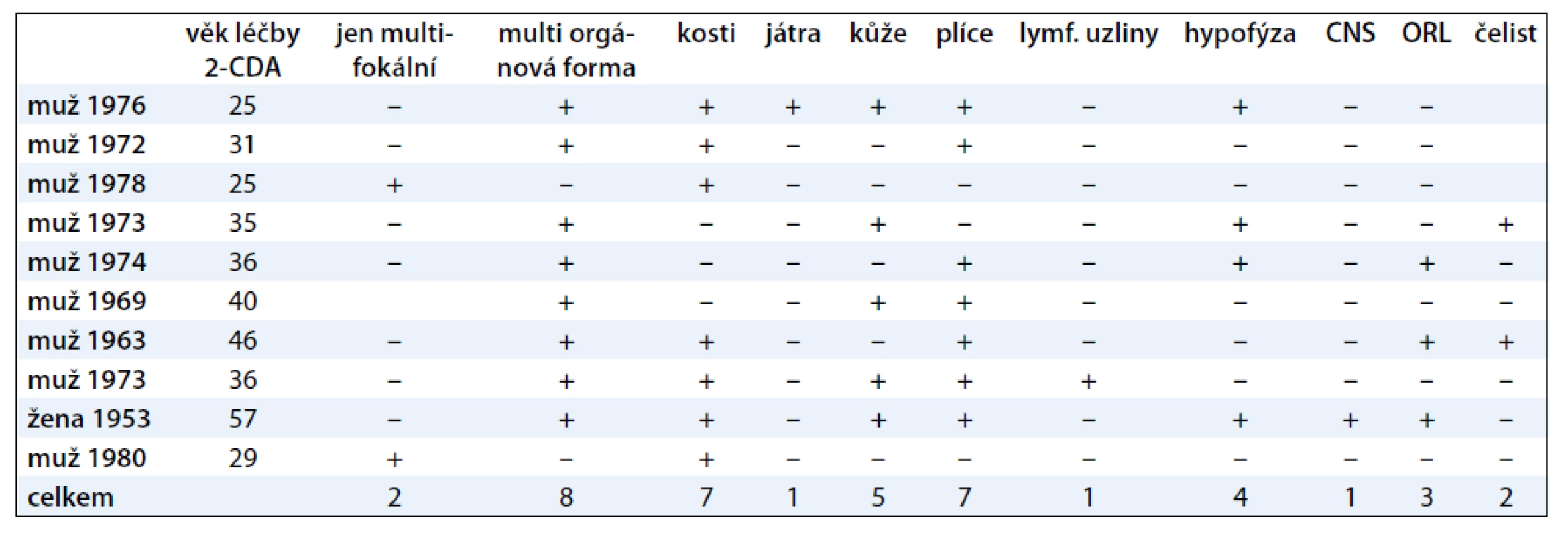
Z hlediska frekvence orgánové lokalizace bylo přítomno:
- postižení skeletu u 7 (70 %);
- postižení plic u 7 (70 %);
- postižení kůže u 5 (40 %), z toho u tří pacientů se jednalo o postižení kůže v oblasti anogenitální a u dvou v oblasti zapářkových lokalizací, axilly, třísla, pod prsy;
- postižení hypotalamo-hypofyzární osy s diabetem insipidem u 4 (40 %) pacientů;
- infiltrace v oblasti zevního ucha (otitis externa) u 3 (30 %) pacientů, v jednom případně byla tato forma zachycena v počátečním stadiu jako otitis externa, v dalších dvou případech až ve stadiu, kdy nemoc způsobila již destrukci kostních struktur spánkové kosti;
- infiltrát LCH v mozku mimo hypotalamo-hypofyzární osu u 1 (10 %) pacienta;
- intrakraniální expanze z kostního ložiska s neurologickými příznaky u 1 (10 %) pacienta;
- infiltrace jater u 1 (10 %) pacienta;
- mnohočetné postižení lymfatických uzlin u 1 (10 %) pacienta;
- postižení čelisti podobné paradentóze s vypadáním zubů u dvou pacientů bylo velmi suspektní, ale nebylo histologicky verifikováno.
Vzhledem k tomu, že tato nemoc má charakter chameleóna a u každého pacienta se manifestovala jiným způsobem, doplňujeme informace o souboru pacientů v tab. 2.
Table 2. Základní informaci o průběhu nemoci před léčbou a rozsah nemoci při zahájení léčby kladribinem. 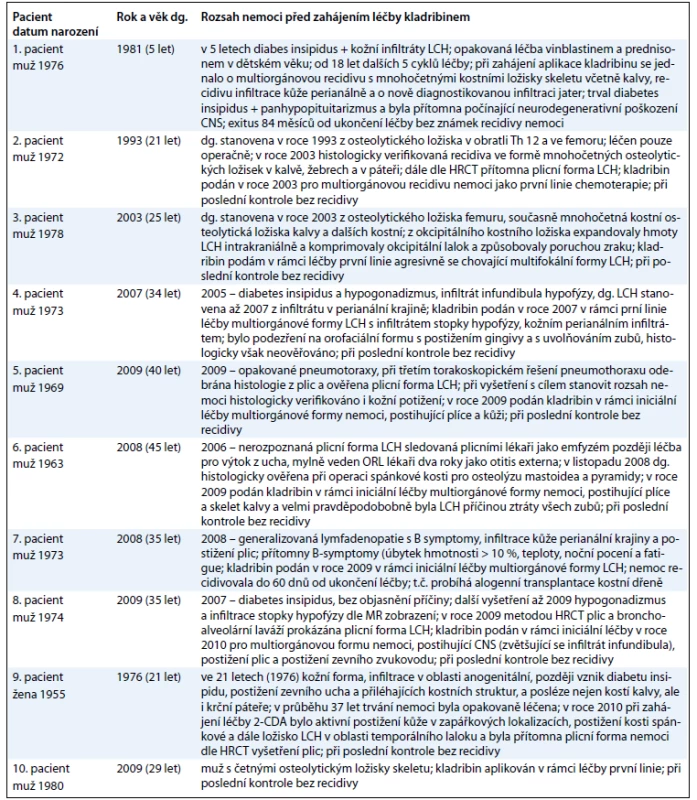
Léčba
U 8 z 10 pacientů byl kladribin použit jako chemoterapie první linie. U dvou pacientů předcházel léčbě kladribinem několik desetiletí trvající průběh nemoci s opakovanými atakami, které byly léčeny chemoterapií (vinblastin a prednison a také etoposid) a radioterapií.
Všichni uvedení pacienti byli léčeni 2-chlorodeoxyadenosinem (kladribinem) v dávce 5 mg/m2/den, 5 dní po sobě. První pacient dostal tuto léčbu ve formě nitrožilních infuzí, ostatní nemocní pak ve formě podkožních injekcí. Tyto cykly se opakovaly v měsíčních intervalech, maximálně 6krát. Medián počtu aplikovaných cyklů chemoterapie byl 5 (4–6). Vyhodnocení účinnosti léčby jsme prováděli po 2. a 3. cyklu.
Ve dvou případech, kdy nemoc vykazovala známky rychlého a velmi agresivního průběhu, jsme před aplikací kladribinu provedli sběr kmenových krvetvorných buněk, které jsme zamrazili pro pozdější případné použití. Vzhledem k tomu, že pro dospělé pacienty nebyly definovány prognostické ukazatele, záviselo rozhodnutí o provedení sběru PBSC na posouzení agresivity nemoci ošetřujícím lékařem. Přihlíželi jsme k rychlosti nástupu příznaků, masivnosti postižení, k případné extramedulární propagaci původně na kost limitované nemoci, k rozsahu multiorgánového postižení a k přítomnosti B-symptomů (= úbytek hmotnosti větší než 10 % za 6 měsíců, subfebrilie či febrilie, noční pocení).
Před sběrem kmenových buněk krvetvorby z periferní krve jsme podávali stimulační režim (cyklofosfamid 2 g/m2/den 1 s aplikací mesny, etoposid 200 mg/m2 den 1–3) a leukocytární růstový faktor G-CSF (filgrastim) v dávce 10 mikrogramů/kg/den rozdělené do dvou denních dávek od 3. dne po ukončení chemoterapie až do ukončení sběru kmenových krvetvorných buněk.
Ve dvou případech jsme ke kladribinu při nedostatečném efektu prvních 3 cyklů léčby přidali dexametazon 20 mg/den a cyklofosfamid 150 mg/m2/den, vše po dobu 3–5 dnů.
Výsledky léčby
Léčebný efekt jsme u všech pacientů hodnotili na základě výsledků PET a později PET-CT vyšetření. Prováděli jsme i další zobrazovací vyšetření (rentgenové snímky skeletu, scintigrafii skeletu, funkční plicní testy a endokrinologické testy), ale základem pro hodnocení efektu léčby byla pozitronová emisní tomografie.
Z popisovaného souboru 10 nemocných zemřel pouze 1 pacient 84 měsíců od ukončení léčby kladribinem. U pacienta sice progredovaly pozdní neurodegenerativní změny CNS, které jej invalidizovaly tak, že nebyl schopen chůze, ale při kontrolních vyšetřeních jsme neprokázali recidivu nemoci. Pacient zemřel na plicní embolii bez prokazatelné recidivy nemoci. Ostatních 9 pacientů žije s mediánem sledování 26 měsíců (16–94).
Ihned po ukončení léčby kladribinem jsme dosáhli u všech pacientů vymizení symptomů nemoci, nicméně u jednoho pacienta nemoc relabovala již po 8 týdnech od ukončení chemoterapie, takže jsme nedosáhli klinicky relevantní odpovědi. Klinicky relevantní léčebné odpovědi hodnocené jako CR, ověřené PET-CT vyšetřením, dosáhlo 9 z 10 pacientů (90 %).
Za klinicky relevantní léčebnou odpověď typu kompletní remise považujeme naprosté vymizení symptomů aktivy nemoci potvrzené negativitou PET-CT vyšetření a trvající nejméně 60 dní. Časové kritérium trvání léčebné odpovědi (trvání nejméně 60 dní od ukončení léčby) bylo nedávno zavedeno pro hodnocení léčebné odpovědi u mnohočetného myelomu a my je aplikujeme i na LCH.
Pouze u jednoho nemocného nebylo dosaženo klinicky relevantní léčebné odpovědi kladribinem, ke kterému byl od 4. cyklu přidán cyklofosfamid a dexametazon. Nemoc do 8 týdnů od ukončení 6. cyklu chemoterapie prudce relabovala, a to ve všech původních lokalizacích: lymfatických uzlinách, plicích, perianální kůži. Navíc přibylo postižení kostí, které předtím nebylo detekováno. Obnovily se B-symptomy. Jednalo se velmi aktivní formu nemoci, která vyžadovala opakované léčebné intervence a t.č. je pacient po vysokodávkované chemoterapii s alogenní transplantací kostní dřeně.
Hodnocení přechodu z monoterapie kladribinem na kombinaci kladribinu, cyklofosfamidu a dexametazonu
Pouze u dvou pacientů jsme přešli po 3 cyklech kladribinu v monoterapii na kombinaci kladribinu (5 mg/m2/den s.c., 3–5 dní po sobě) s cyklofosfamidem (150 mg/m2 celková dávka/den, 3–5 dní po sobě) a dexametazonem (20 mg/den, 3–5 dní po sobě). U prvního z nich (pacient č. 5, plicní a kožní forma) se kožní projevy po prvních třech cyklech jen částečně zmenšily, ale nevymizely, proto jsme od 4. cyklu přidali cyklofosfamid a dexametazon a aplikovali další 3 cykly této trojkombinace. Po ukončení chemoterapie kožní projevy vymizely.
U druhého z nich (pacient č. 7, uzlinová forma, B-symptomy + kožní forma+ plicní forma) jsme pozorovali po počáteční léčebné odpovědi stabilní stav bez prohlubování léčebné odpovědi po 2. a 3. cyklu kladribinu v monoterapii. Proto od 4. cyklu jsme podali kladribin ve výše uvedené kombinaci. Po této změně došlo k výraznému zmenšení uzlin, takže v době ukončení posledního cyklu dle klinického i sonografického vyšetření bychom mohli odpověď hodnotit jako kompletní remisi. Nicméně již 8. týden od ukončení chemoterapie PET-CT kontrola i klinický stav signalizovaly progresi nemoci, takže výsledek léčby hodnotíme tak, že nebylo dosaženo klinicky relevantní léčebné odpovědi.
Tolerance léčby a nežádoucí účinky
Kladribin má výrazný imunosupresivní účinek. Přesto jsme v celém souboru v průběhu léčby zaznamenali pouze jednu infekční komplikaci (pneumonii v terénu plíce postižené LCH) vyžadující hospitalizaci a 2 infekce horních dýchacích cest, které byly zvládnuty ambulantní antibiotickou léčbou.
Tolerance kladribinu podávaného v monoterapii byla velmi dobrá. Lokální aplikace kladribinu byla tolerována bez nežádoucích účinků a žádný z pacientů léčených pouze kladribinem neměl neutropenii či trombocytopenii III. či IV. stupně dle WHO klasifikace nežádoucích účinků a po ukončení léčby měli všichni pacienti normální hodnoty krevního obrazu.
V případně použití kombinace kladribinu s cyklofosfamidem a dexametazonem jsme při kontrole krevního obrazu 14 dní od ukončení léčby zaznamenali neutropenii III. stupně, která však byla dočasná a nevedla ke změně léčebného plánu. Výsledky léčby shrnuje tab. 3.
Table 3. Shrnutí výsledků léčby souboru 10 dospělých pacientů s LCH, kteří byli léčeni kladribinen. 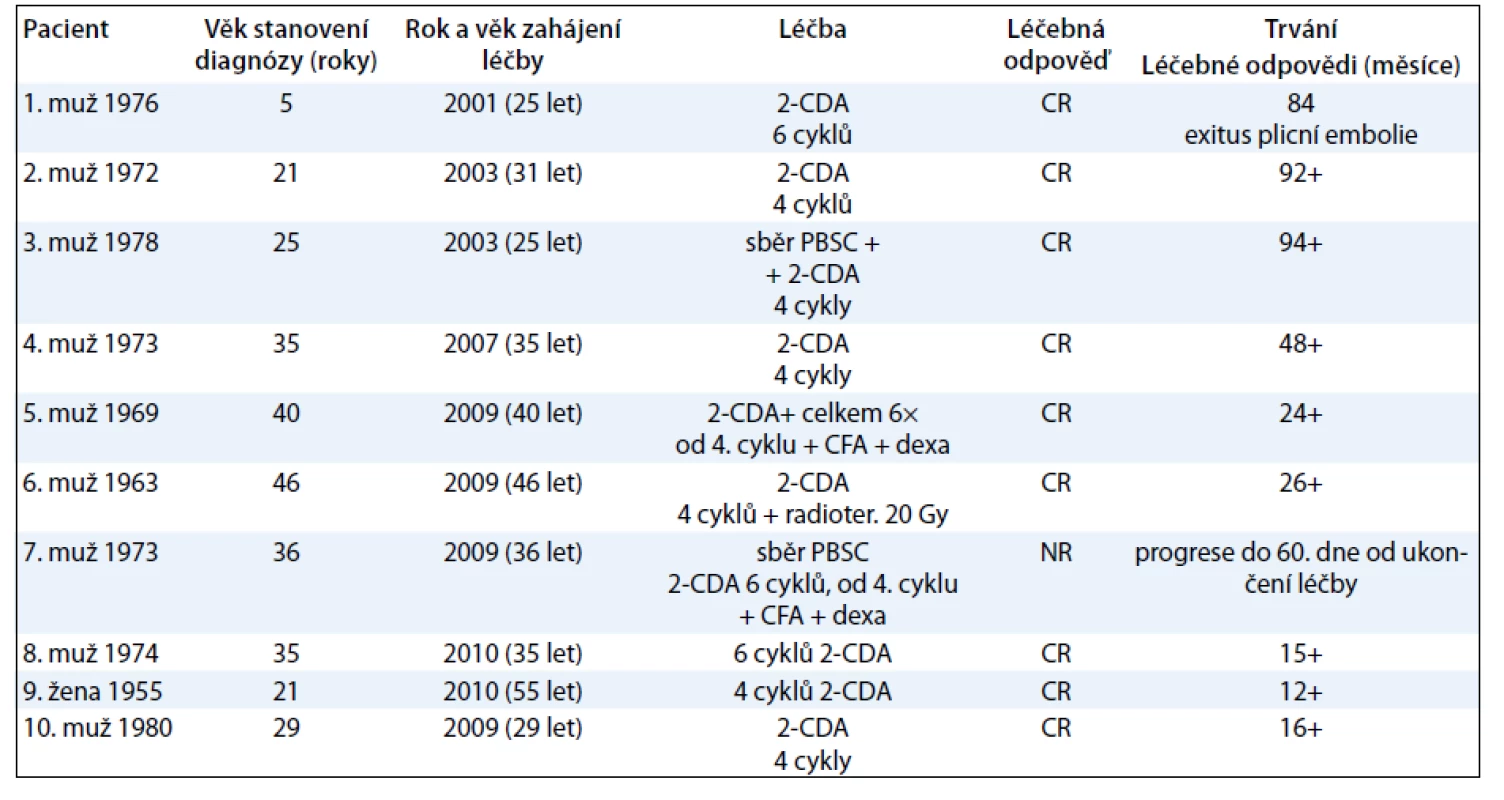
Diskuze
U dětí byla léčba LCH ověřena klinickými studiemi a z nich jsou odvozeny také léčebná doporučení pro dospělé, jejich přehled uvádí [3,10]. Klasické pediatrické léčebné protokoly jsou založeny na vinblastinu, prednisonu, merkaptopurinu. Dalšími účinnými medikamenty pro léčbu LCH jsou etoposid a metotrexát, oba však mají intenzivnější nežádoucí účinky než vinblastin, a proto vinblastinové režimy zůstávají zlatým standardem pro léčbu LCH.
Léčba dle těchto pediatrických protokolů trvá dlouho, může trvat až rok. Při jejich použití u dospělých bývá často závažným problémem neurotoxicita vinblastinu, v případě aplikace mimo žílu komplikace způsobené paravazací. Nepřehlédnutelným problémem u dospělých pacientů jsou komplikace vyvolané dlouhodobým podáváním kortikoidů (diabetes mellitus II. typu, trombózy apod.).
Experimentální testy prováděné v devadesátých letech prokázaly, že účinnost kladribinu se velmi liší tkáň od tkáně. To, zda na buňku bude mít kladribin cytotoxický efekt, závisí na poměru aktivačního enzymu (deoxycytidinkinázy) a deaktivního enzymu (5-nukleotidázy). V buňkách, kde je tento poměr vysoký, má kladribin intenzivní cytotoxický efekt. Vysoká aktivita deoxycytidinkinázy a nízká aktivita 5-nukleotidázy se vyskytuje v histiocytárních buňkách, v dendritických Langerhansových buňkách, v monocytech a také v klidových formách lymfocytů. Proto tento lék dosahuje léčebné odpovědi u nízce agresivních lymfoproliferativních chorob, ale také u chorob odvozených z dendritických histiocytů, tedy z Langerhansových buněk, a také u chorob odvozených od fagocytujících monocytů (skupina juvenilního xantogranulomu). Díky dobré průchodnosti hematocefalickou bariérou účinkuje i na infiltráty v CNS [4–10].
Od roku 1993 se objevují četné zprávy o výborné účinnosti kladribinu u LCH, obvykle ve formě popisu případu. V prvních publikovaných případech byl kladribin použit v rámci léčby druhé či vyšší linie a v roce 2003 se začal používat v rámci iniciální léčby agresivních multifokálních nebo multiorgánových forem. Vzhledem k tomu, že to je velmi vzácné onemocnění, a tedy se obtížně provádějí klinické studie, tak zkušenosti s léčbou LCH kladribinem byly publikovány ve formě popisů případů. Několik publikací o účinnosti kladribinu u dětské formy LCH pochází i od českých autorů [11,12].
V literatuře jsme našli pouze 4 publikace, které popisují zkušenosti s kladribinem u 10 a více pacientů. Jednalo se však o dětské pacienty, případně soubory obsahující jak děti, tak i dospělé [13–16].
U dospělých pacientů s LCH nelze léčbu odvozovat od randomizovaných klinických studií, protože u dospělých nebyla ani jedna studie dokončena. Studie, která měla za cíl ověřit účinek vinblastinu u dospělých, nebyla uskutečněna, snad kvůli problémům s nežádoucími účinky tohoto léku u dospělých.
Proto se léčba dospělých pacientů odvíjí od zkušeností získaných v pediatrických studiích a dále od publikovaných popisů jednotlivých případů či menších souborů dospělých nemocných.
Vysoce pozitivní zkušenosti s kladribinem u relabujících forem a známé nežádoucí účinky vinblastinu u dospělých pacientů vedly lékaře na Mayo Clinic v USA k preferenci kladribinu před vinblastinem u dospělých pacientů s LCH v rámci léčby první linie. Jejich publikace z roku 2003 jako první popisuje excelentní účinnost kladribinu aplikovaného u dospělých pacientů s LCH v rámci léčby první linie [17].
Na základě excelentních publikovaných zkušeností s kladribinem použitým pro léčbu první linie anebo pro léčbu recidivy LCH jsme přikročili k léčbě kladribinem v rámci iniciální léčby multiorgánové či multifokální formy LCH.
V našem souboru 10 pacientů bylo u 9 (90 %) dosaženo kompletní remise nemoci, pouze u jednoho pacienta, u něhož byl kladribin použit v rámci první linie, došlo k velmi časnému relapsu nemoci, takže výsledek hodnotíme jako negativní.
Kladribin je považován za nejvhodnější lék při postižení mozku LCH. Z léků, které působí na tuto nemoc, dosahuje nejvyšších intratekálních koncentrací. Proto je pro pacienty s LCH postihující CNS považován za optimální lék. Jeho účinnost potvrzují i četné popisy případů, u nichž léčba vedla k vymizení LCH ložiska v mozku [17–21]. Ottaviano et al v roce 2003 dokonce popsali reverzibilitu diabetu insipidu při časně zahájené léčbě infiltrátu v oblasti hypotalamo-hypofyzární [20]. Velmi dobrý efekt kladribinu byl popsán i u dalšího histiocytárního onemocnění postihujícího CNS, a sice u juvenilní xantogranulomatózy v CNS [22].
V našem souboru jsme postižení mozku některou z forem LCH pozorovali celkem 4krát, v jednom případě šlo o diabetes insipidus diagnostikovaný již v dětství, zde jsme v dospělosti oblast hypofýzy a hypotalamu již nevyšetřovali. U dvou našich pacientů byl v dospělosti diagnostikován diabetes insipidus s jasným patologickým infiltrátem stopky hypofýzy, který po léčbě vymizel.
Izolovaná plicní forma LCH se obvykle vyskytuje pouze u kuřáků a její průběh, pokud se podaří překonat závislost na cigaretách a ukončit kouření, bývá příznivý. V případě, že plicní postižení je součástí multiorgánového poškození, je spontánní vymizení aktivity nemoci po ukončení kouření málo pravděpodobné. Klasicky se používají kortikoidy, případně vinblastin. V literatuře však byla na více případech dokumentována účinnost kladribinu u pacientů s plicní formou postižení [23–25]. Také u našich pacientů s plicním postižením při multiorgánové formě LCH jsme pozorovali léčebnou odpověď, dokumentovanou PET-CT a HRCT vyšetřením.
Závěr
Kladribin je excelentní lék první volby pro multiorgánové formy nebo agresivní formy postihující multifokálně jeden systém. Kladribin je u těchto pacientů velmi dobře tolerován, nepozorovali jsme žádnou toxicitu III. a IV. stupně dle WHO. U některých hematologických onemocnění s infiltrací kostní dřeně byl po kladribinu popisován myelosupresivní účinek. U pacientů s Langerhansovou histiocytózou, u níž nedochází k infiltraci kostní dřeně, jsme tento nežádoucí účinek nepozorovali. V případě kombinace kladribinu s cyklofosfamidem však již může dojít k myelosupresi i u pacientů s LCH [26].
Práce byla podpořena grantem IGA ČR NT 12215-4, granty MŠMT MSM0021622434, LC06027 a granty IGA MZ NT11154, NT12130, NT12215 a NS10408.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematoonkologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: z.adam@fnbrno.cz
Obdrženo: 20. 9. 2011
Přijato: 28. 10. 2011
Sources
1. Aricò M, Girschikovsky M, Généreau T et al. Langerhans cell histiocytosis in adults. Report from the International Registry od the Histiocyte Society. Eur J Cancer 2003; 39(16): 2341–2348.
2. Haupt R, Nanduri V, Calevo MG et al. Permanent consequences in Langerhans cell histiocytosis patients: a pilot study from the Histiocyte Society-Late Effect Study Group. Pediatr Blood Cancer 2004; 42(5): 438–444.
3. Allen CE, McClain KL. Langerhans cell histiocytosis: a review of past, current and future therapies. Drugs Today 2007; 43(9): 627–643.
4. Carrera CJ, Terai C, Piro LD et al. Potent toxicity of 2-chlorodeoxyadenosine toward human monocytes in vitro and in vivo. A novel approach to immunosupressive therapy. J Clin Invest 1996; 86(5): 1480–1488.
5. Liliemark J. The clinical pharmacokinetics of cladribine. Clin Pharmacokinet 1997; 32(2): 120–131.
6. Brysin MH, Sordin EM. Cladribine: A review of its pharmacodynamics and pharmacokinetics properties and therapeutic potential in haematologic malignancies. Drugs 1993; 46(5): 872–891.
7. Liliemark J, Albertoni F, Hasan M et al. On the bioavailability of oral and subcutaneous 2-chlorodeoxadenosine in humans: alternative routes of administration. J Clin Oncol 1992; 10(10): 1514–1518.
8. Robak T, Lech-Maranda E, Korycka A et al. Purine nukleoside analogs as immunosupressive and antineoplastic agents: Mechanismus of action and clinical activity. Curr Med Chem 2006; 13(26): 3165–3189.
9. Adam Z. Hematologické choroby nízkého stupně malignity. Standardní léčebné postupy a zhodnocení účinnosti 2-chlorodeoxyadenosinu. Brno: MU Brno 1998.
10. McClain KL. Drug therapy for the treatment of Langerhans cell histiocytosis. Expert Opin Pharmacother 2005; 6(14): 2435–2441.
11. Mottl H, Ganevová M, Radvanská J et al. Treatment results of Langerhans cell histiocytosis with LSH II protocol. Cas Lek Cesk 2005; 144(11): 753–755.
12. Mottl H, Starý J, Chánová M et al. Treatment of recurrent Langerhans cell histiocytosis in children with 2-chlorodeoxyadenosine. Leuk Lymphoma 2006; 47(9): 1881–1884.
13. Saven A, Burian C. Cladribine activity in adult Langerhans-cell histiocytosis. Blood 1999; 93(12): 4125–4130.
14. Weitzman S, Wayne AS, Arceci R at al. Nucleoside analogues in the therapy of Langerhans cell histiocytosis: a survey of members of the histiocyte society and review of the literature. Med Pediatr Oncol 1999; 33(5): 476–481.
15. Imamura T, Sato T, Shiota Y et al. Outcome of pediatric patients with Langerhans cell histiocytosis treated with 2 chlorodeoxyadenosine: a nationwide survey in Japan. Int J Hematol 2010; 91(4): 646–651.
16. Weitzman S, Braier J, Donadieu J et al. 2‘-Chlorodeoxyadenosine (2-CdA) as salvage therapy for Langerhans cell histiocytosis (LCH): results of the LCH-S-98 protocol of the Histiocyte Society. Pediatr Blood Cancer 2009; 53(7): 1271–1276.
17. Pardanani A, Phyliky RL, Li CY et al. 2-Chlorodeoxyadenosine therapy for disseminated Langerhans cell histiocytosis. Mayo Clin Proc 2003; 78(3): 301–306.
18. Watts J, Files B. Langerhans cell histiocytosis: central nervous system involvement treated successfully with 2-chlorodeoxyadenosine. Pediatr Hematol Oncol 2001; 18(3): 199–204.
19. Dhall G, Finlay JL, Dunkel IJ et al. Analysis of outcome for patients with mass lesions of the central nervous system due to Langerhans cell histiocytosis treated with 2-chlorodeoxyadenosine. Pediatr Blood Cancer 2008; 50(1): 72–79.
20. Ottaviano F, Finlay JL. Diabetes insipidus and Langerhans cell histiocytosis: a case report of reversibility with 2-chlorodeoxyadenosine. J Pediatr Hematol Oncol 2003; 25(7): 575–577.
21. Stine KC, Saylors RL, Saccente S et al. Efficacy of continuous infusion 2-CDA (cladribine) in pediatric patients with Langerhans cell histiocytosis. Pediatr Blood Cancer 2004; 43(1): 81–84.
22. Rajendra B, Duncan A, Parslew R et al. Successful treatment f central nervous system juvenile xanthogranulomatosis with cladribine. Pediatr Blood Cancer 2009; 52(3): 413–415.
23. Aerni MR, Aubry MC, Myers JL et al. Complete remission of nodular pulmonary Langerhans cell histiocytosis lesions induced by 2-chlorodeoxyadenosine in a non--smoker. Respir Med 2008; 102(2): 316–319.
24. Lazor R, Etienne-Mastroianni B, Khouatra C et al. Progressive diffuse pulmonary Langerhans cell histiocytosis improved by cladribine chemotherapy. Thorax 2009; 64(3): 274–275.
25. Fichter J, Doberauer C, Seegenschmiedt H. Langerhans cell histiocytosis in adults: An interdisciplinary challenge. Dtsch Arztebl 2007; 104(34–35): A2347–A2353.
26. Robak T, Kordek R, Robak E et al. Langerhans cell histiocytosis in a patient with systemic lupus erythematosus: a clonal disease responding to treatment with cladribine, and cyclophosphamide. Leuk Lymphoma 2002; 43(10): 2041–2046.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2012 Issue 4-
All articles in this issue
- Význam mikroprostředí kostní dřeně v patogenezi mnohočetného myelomu
- CT kolonografie – přehled vývoje metodiky a indikací
- Dlouhé nekódující RNA a jejich význam u nádorových onemocnění
- Léčba histiocytózy z Langerhansových buněk kladribinem dosáhla u 9 z 10 dospělých pacientů dlouhodobé kompletní remise
- Mutace genu EGFR u pacientů s pokročilým NSCLC
- Projekt HARDROCK: parametrický sběr a analýza dat pacientů s nádory hlavy a krku na Klinice onkologické FN Ostrava – důraz na význam frakcionace a definice cílového objemu v radioterapii
- Jaký je prognostický význam molekulárně genetických faktorů u karcinomu endometria?
- Hepatocelulární karcinom – dlouhodobě léčitelné onemocnění
- Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
- Porovnávanie histologických typov primárnych a korešpondujúcich recidivujúcich bazocelulárnych karcinómov kože
- Paratestikulárny mezotelióm v mladom veku. Kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hepatocelulární karcinom – dlouhodobě léčitelné onemocnění
- Léčba nízkostupňového gliomu supratentoriální oblasti mozku po neurochirurgické subtotální resekci s projevy objemového up-gradingu
- Mutace genu EGFR u pacientů s pokročilým NSCLC
- CT kolonografie – přehled vývoje metodiky a indikací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

