-
Medical journals
- Career
Předpoklady pro preimplantační genetickou diagnostiku (PGD) u nosičů mutací v nádorových predispozičních genech
Authors: R. Hűttelová 1; Z. Kleibl 2; J. Řezáčová 3; V. Krutílková 4; L. Foretová 5; J. Novotný 6; J. Kotlas 7; Michal Zikán 8; P. Pohlreich 2
Authors‘ workplace: IVF – Institut s. r. o, Plzeň 2Ústav biochemie a experimentální onkologie 1. LF UK, Praha 3Ústav pro péči o matku a dítě, Praha 4GENNET s. r. o., Praha 5Oddělení epidemiologie a genetiky nádorů MOÚ Brno 6Institut onkologie a rehabilitace Na Pleši s. r. o. 1
Published in: Klin Onkol 2009; 22(Supplementum): 69-74
Overview
Východiska:
Nosiči zárodečných mutací v genech zodpovědných za vznik monogenně podmíněných hereditárních nádorových syndromů jsou početně malou, avšak vysoce rizikovou skupinou ohroženou vysokou pravděpodobností vzniku nádorového onemocnění, které se často vyvíjí v mladém věku. U těchto nosičů existuje 50% riziko přenosu dědičné mutace na jejich potomky. U monogenně podmíněných onemocnění preimplantační genetická diagnostika (PGD) umožňuje charakterizaci oblasti DNA obsahující patogenní mutaci i z jediné buňky odebrané v časné vývojové fázi z embrya vzniklého in vitro fertilizací (IVF). Na základě jejích výsledků lze transferovat embrya, která nenesou analyzovanou genetickou abnormalitu, a tím umožňují vývoj dítěte bez rizika přenosu patogenní alely od biologického rodiče.Cíl:
V tomto přehledném článku prezentujeme konsenzuální stanovisko společné skupiny Společnosti Lékařské genetiky a České onkologické společnosti ČLS JEP a dalších specialistů k použití PGD u monogenně podmíněných nádorových syndromů, se zaměřením na podmínky a předpoklady pro její provádění v ČR, a upozorňujeme na limity a úskalí této metody a specifika ovariální hyperstimulace u nosičů mutací v genech (BRCA1, BRCA2, p53) s možným rizikem vzniku, hormonálně dependentních karcinomů prsu a ovaria.Závěry:
Domníváme se, že PGD je metodou vhodnou pro úzkou, avšak neopominutelnou podskupinu klientů z řad nosičů mutací v genech zodpovědných za vznik hereditárních nádorových syndromů. Jedná se hlavně o osoby, které se pro IVF a PGD rozhodnou z důvodů zcela zásadních obav z přenosu patogenní vlohy na potomky, po jasném poučení o provedení a limitech metody ze strany zodpovědného multidisciplinárního týmu, který bude relevantně schopen v konkrétním případě zvážit indikace metody, vyhodnotit možná individuální rizika a metodicky správně provést vlastní analýzu.Klíčová slova:
preimplantační genetická diagnostika – dědičné nádorové syndromy – fertilizace in vitro – ovariální hyperstimulaceRecenze: Putzová M., Crha I., Kleiblová P., Martásek P., Goetz P., Baxová A., Hořínová V., Raszyková L.
Úvod
Hereditární nádorové syndromy tvoří kolem 5% případů nádorových onemocnění. Přestože se jedná o postižení malého procenta nemocných, jejich závažnost je dána vznikem nádorového onemocnění u nosičů mutací často v období rané dospělosti. Ačkoliv penetrance onemocnění nedosahuje vždy 100%, je podíl nemocných nosičů v postižených rodinách vysoký a pravděpodobnost vzniku onemocnění u nich řádově přesahuje riziko vzniku nádoru ve srovnání s běžnou populací. Obě základní charakteristiky hereditárního nádorového onemocnění – tedy časný vznik a vysoká penetrance – způsobují, že u postižených osob je nezbytné kromě vlastní onkologické léčby aplikovat i postupy týkající se dalších medicínských disciplín: klinické a molekulární biologie a genetiky, gynekologie, reprodukční medicíny, psychologie či etiky [1].
Moderní molekulárně biologické laboratorní postupy sice poskytují vyspělé nástroje v diagnostice nádorových onemocnění, ty však kontrastují s relativně omezenými možnostmi terapeutickými. V případě nosičství mutací v genech zodpovědných za vznik hereditárních nádorových syndromů spočívá těžiště specializované péče ve včasné diagnostice nebo v profylaktických chirurgických či farmakologických intervencích (viz specializované části tohoto supplementa). Přestože specializovaná dispenzární péče významně zlepšuje prognózu onemocnění, setkáváme se u některých nosičů mutací s výraznou kancerofobií, která (u některých z nich) negativně ovlivňuje i rozhodování o reprodukci. Právě pro tuto (početně pravděpodobně velmi limitovanou) skupinu nosičů mutací by současné reálné možnosti technik asistované reprodukce (Assisted Reproductive Techniques – ART), disponující in vitro fertilizací (IVF) a preimplantační genetickou diagnostikou (PGD), mohly být důležitou volbou.
Cílem in vitro fertilizace a preimplantační genetické diagnostiky u nosičů mutací monogenně podmíněných onemocnění, včetně hereditárních nádorových syndromů, je zabránění přenosu známé genové alterace do další generace. Tento cíl je umožněn kontrolou zrání oocytu a časného embryonálního vývoje s nalezením a následným transferem embryí bez hereditární mutace za účelem dosažení těhotenství ukončeného porodem zdravého dítěte [2].
První pokusy o PGD sahají do počátků 90. let [3]. V současnosti se PGD provádí u řady geneticky podmíněných onemocnění. Ve velké části případů je laboratorní diagnostická metoda založena na fluorescenční in situ hybridizaci (FISH). Tato technika umožňuje nalezení rozsáhlých změn genomu, ale pro nalezení malých genových alterací, např. bodových mutací, které jsou nejčastější příčinou poruch tumor supresorových genů u hereditárních nádorových syndromů, není vhodná. V diagnostice hereditárních nádorových syndromů tak zásadní úloha přináleží metodě, která zahrnuje amplifikaci genetického materiálu embrya pomocí polymerázové řetězové reakce (Polymerase Chain Reaction – PCR) s následnou analýzou – tzv. PCR PGD. Tato metoda byla doposud úspěšně použita v diagnostice několika nádorových syndromů (tab. 1).
Table 1. Příklady aplikace PCR PGD u hereditárních nádorových syndromů. 
Záměrem tohoto textu není vymezení pregnantních „guidelines“ pro provádění PCR PGD u nosičů mutací, ale spíše formulování praktických medicínských a laboratorních úskalí metody s ohledem na množící se zájem o problematiku PCR PGD ze strany nosičů mutací i některých medicínských institucí. Podklady článku vycházejí ze závěrů pracovního setkání, které se na téma PCR PGD u nosiček mutací v genech BRCA1 a BRCA2 uskutečnilo v roce 2006 v Praze a následných diskuzí s účastí odborníků z řady medicínských oborů.
Pro jaké pacienty – nosiče mutací –je vhodná PGD?
Užití PGD u chorob s pozdní manifestací a neúplnou penetrancí (mezi které většina syndromů hereditární nádorové predispozice patří) byla a je diskutována. V květnu 2006 schválila HFEA (UK Human Fertilization and Embryology Autority) užití PGD i pro tato „monogenně podmíněná závažná onemocnění“ [12]. Indikaci by měl hodnotit klinický genetik v součinnosti s dalšími specialisty, jako jsou onkolog, gynekolog aj. V případě sporných indikací je vhodné konzultovat výbor Společnosti lékařské genetiky ČLS JEP. U nosiček mutací v genech, které způsobují vysoká rizika nádorů prsu a gynekologických nádorů, je důležité zvážit i rizika používaných hormonálních stimulací.
PGD z pohledu pacienta
V praxi se většina našich klinických specialistů angažovaných v preventivních a diagnostických programech zaměřených na hereditární nádorová onemocnění pravděpodobně setkala s nosiči mutací uvažujícími o PGD z důvodu obav o přenos nádorové vlohy na své potomky. Informace z doposud publikovaných prací týkajících se zvažování PGD u nosičů mutací v genech zodpovědných za hereditární nádorové onemocnění naznačují, že o možnosti PGD uvažují nosiči mutací tím více, čím vyšší je penetrance jejich onemocnění. Ve studii Staton a kol (2008) zahrnující 213 nosičů mutací v genech BRCA1/2 vyjádřilo 44% dotázaných extrémní obavy a 44% časté obavy o přenos nutace na potomky. Na druhé straně pouze 13% nosičů by pravděpodobně zvažovalo PGD [13]. Podobné výsledky ukázala i studie Menon a kol (2007), ve které sice 75% z 52 dotázaných nosiček mutací v genu BRCA1/2 uvedlo, že by si přály být informovány o PGD, avšak její provedení by zvažovalo jen 37% dotázaných a pouze jedna ze sedmi žen (17%) uvažujících o budoucím těhotenství bude zvažovat možnost provedení PGD [14]. V malé studii Kastrinos a kol (2007) 19 z 20 (95%) pacientů s FAP uvedlo, že by zvážilo možnost PGD a 75% i následnou prenatální diagnostiku [15]. Ve výše uvedených studiích se jedná o osoby „uvažující“ o provedení PGD. Lze předpokládat, že skutečných „zájemců“, kteří by po obeznámení se s celou problematikou PGD tuto proceduru podstoupili, bude ještě méně. Na druhé straně, existuje skupina nosičů mutací, pro které je možnost přenosu dědičné nádorové vlohy zcela nepřijatelná a preference vlastních biologických potomků ultimativní. Tito nosiči mutací se bez možnosti PGD rozhodnou nezaložit rodinu, přestože a) pravděpodobnost přenosu mutace na potomstvo je v případě autozomálně dominantních onemocnění 50%, b) riziko nádorového onemocnění je ovlivněno pohlavím dítěte (např. v případě mutace genů BRCA1/2 u mužských potomků je zvýšeno jen mírně) a c) současný vývoj biotechnologií dává naději na zlepšení léčby nádorů vzniklých s dlouhou latencí u nosičů mutací. U těchto jednotlivců je preimplantační (ne však prenatální) diagnostika rozumným kompromisem a lze doporučit konzultaci s multidisciplinárním týmem za účelem jejího zvážení.
PGD z pohledu kliniky a úloha jednotlivých medicínských specialistů
Péče o nosiče mutací podmiňujících hereditární nádorová onemocnění vyžaduje komplexní přístup s účastí řady specialistů umožňující vyhodnocení individuálních rizik spojených s ART a i následným těhotenstvím. O možnostech a dostupnosti ART by měl být informován především onkolog, který nejčastěji zodpovídá za organizaci specializované péče o nemocné a asymptomatické nosiče mutací z rizikových rodin a má aktuální přehled o jejich zdravotním stavu. S ohledem na zdravotní stav pacienta může doporučit konzultaci specializovaného pracoviště, kde je možné podstoupit IVF s PGD.
Pro podání úvodní informace o přínosech a limitech PGD je vhodná konzultace se spolupracujícím klinickým genetikem specializovaným na oblast hereditárních nádorových syndromů.
Pacientčin gynekolog, zajišťující specializovanou gynekologickou preventivní péči (především u nosiček mutací v genech BRCA1 a BRCA2), by měl rovněž podat informace ohledně možností PGD, příp. zvážit, zda pacientka může cyklus IVF podstoupit.
Na gynekologovi IVF centra spočívá podrobná informace klientky o aplikaci IVF, zvolení a optimalizace stimulačního protokolu pro pacientku a provádění kontroly během celého cyklu.
Embryolog a molekulární genetik jsou zodpovědní za laboratorní část IVF/PGD cyklu a vlastní genetickou analýzu. Používané techniky by měl provádět zkušený odborník a průběh jednotlivých etap a analýza výsledků by měly být předem optimalizované a ověřené. Analýzy by neměl provádět pracovník bez předchozích zkušeností s technikami používanými v rámci IVF/PCR PGD cyklu.
Celý tým pečující o pacientku by měl být doplněn psychologem, který by mohl poskytnout klientce další informace pro její rozhodování.
V současnosti není PGD u žádného hereditárního syndromu rutinní záležitostí. Její provedení je závislé na dobré kooperaci týmu dobře spolupracujících klinických i laboratorních odborníků, kteří se musí (s ohledem na své specializace) shodnout na proveditelnosti PGD u konkrétního nosiče mutace. Důležitá je jejich vzájemná spolupráce a komplexní orientace v problematice.
Socioekonomické aspekty PGD
Důvodem pro PGD je zabránění přenosu závažného onemocnění z biologických rodičů na jejich potomky. Techniky asistované reprodukce a samotná PGD vyvolává v řadě zemí a společností významná etická dilemata. Existuje řada nosologických jednotek, kde aplikace PGD je racionálně nezpochybnitelná [16]. Takovýmto případem nemusí být pro každého nosičství byť prokazatelně patogenní mutace v nádorových predispozičních genech. Přesto řada autorit doporučuje využití PGD u nosičů těchto mutací zvážit [17–19]. S ohledem na to, že se jedná o relativně novou metodu, která se pravděpodobně bude dále rozvíjet především na základě tlaku ze strany klientů, lze očekávat, že diskuze o vymezení rozsahu PGD, její standardizaci, legislativním zakotvení atd. budou pokračovat.
Pragmatickým pohledem je srovnání nákladnosti provedení PCR PGD s náklady na prevenci, terapii a snížené sociální uplatnění postižených nosičů mutací, které hovoří ve prospěch PGD [19].
Praktické přístupy k PCR PGD
Ovariální stimulace a in vitro fertilizace (IVF)
Metodu IVF lze rozdělit do dvou fází: V první je nezbytné vyvolat současné dozrání více oocytů v ovariu a následně tyto oocyty z ovaria odebrat. Současně s tím se provádí také odběr spermií partnera. Druhá fáze je laboratorní, kdy v embryologické laboratoři probíhá vlastní in vitro oplození.
Cílem tzv. kontrolované ovariální hyperstimulace (Controlled Ovarian Hyperstimulation – COH) je dosáhnout dozrání většího počtu tzv. kodominantních folikulů než pouze jednoho folikulu, jak je tomu v nativním cyklu. Tím je zajištěn výsledně větší počet embryí podstupujících PGD, a tudíž i vyšší šance na nalezení „zdravého“ embrya vhodného k transferu.
V současné době se k navození COH používají zejména následující stimulační protokoly:
- krátký stimulační protokol s agonisty GnRh (gonadotropine-releazing hormone)
- dlouhý stimulační protokol (začínající buď z folikulární, nebo luteální fáze menstruačního cyklu) s agonisty GnRh
- protokol s antagonisty GnRh
Oplození získaných oocytů je provedeno mechanicky, tzv. metodou ICSI (Intracytoplasmic Sperm Injection – intracytoplazmatická injekce spermie). Při této technice je pomocí velice tenké skleněné jehly zavedena spermie partnera pacientky přímo do centra oocytu. Technika ICSI se používá z důvodu vyšší pravděpodobnosti oplození oocytů, a tedy minimalizace ztrát již na začátku procesu, a zároveň eliminuje kontaminaci DNA z dalších spermií pro budoucí genetickou analýzu. Oplozené oocyty se kultivují v médiu v inkubátorech s atmosférou 5% CO2. Pro potřeby PGD trvá kultivace embryí pět dní, kdy třetí den je u všech dostupných embryí provedena biopsie – odběr buňky embrya (viz níže). Kvalita a vývoj embryí se kontroluje každodenně. Nejpozději pátý den po oplození musejí být embrya transferována do dutiny děložní, případně zamražena.
U nádorových syndromů zahrnujících hormonálně independentní tumory lze uvažovat o využití libovolného stimulačního protokolu v závislosti na konkrétních zvyklostech IVF centra. V běžné populaci lze předpokládat, že přechodné zvýšení koncentrace estrogenů má pouze malý vliv na zvýšení rizika vzniku karcinomu prsu (~RR 1,2) [20]. Jiná je ovšem situace při COH u nosiček mutací v BRCA1, BRCA2, TP53 a dalších genech s vysokým rizikem vzniku karcinomu prsu. Volba stimulačního protokolu závisí na tom, který z partnerů je nosičem mutace. Je li nosičem patogenní hereditární mutace partner, provádí se hormonální stimulace nezatížené pacientky stejně jako u jakékoliv zdravé ženy dle doporučených postupů a zvyklostí daného IVF centra. V případě, že nosičkou mutace v genech BRCA1/2, TP53 aj. je partnerka, může být použití standardních stimulačních protokolů sporné s ohledem k hormonální závislosti karcinomů prsu a ovarií [12]. Na druhé straně je však nezbytné uvážit, že sérové koncentrace estradiolu v prvním trimestru těhotenství převyšují koncentraci nutnou pro COH. Na gynekologovi IVF centra je tedy volba vhodného stimulačního protokolu s ohledem na anamnézu pacientky a rovněž volba hormonálních preparátů a jejich dávek. Starší generace menopauzálních gonadotropinů (Fostimon, Menopur) je stále více vytlačována preparáty rekombinantního FSH (Gonal F, Puregon). Během stimulace je sledován růst folikulů a tloušťky endometria v porovnání s hladinou estradiolu v krvi. Ovulace je časována aplikací hCG (lidský choriogonadotropin). Transvaginální odběr oocytů se provádí 34–36 hod po injekci hCG pod kontrolou ultrazvuku a v krátkodobé narkóze.
Dvě studie publikované v letošním roce ukazují, že riziko vzniku hormonálně podmíněných nádorů navozených stimulačními protokoly u rizikových pacientek pravděpodobně není vysoké. Azim a kol (2008) studovali riziko použití stimulačního protokolu zahrnujícího letrozol a gonadotropiny pro navození COH u 79 pacientek s karcinomem prsu (pro zachování fertility – kryoprezervaci oocytů nebo embryí) před použitím adjuvantní chemoterapie ve srovnání s 136 pacientkami s karcinomem prsu bez COH. Dle jejich zjištění nezvyšuje použití tohoto protokolu riziko rekurence onemocnění (průměrná doba sledování u 79 žen s COH byla 23,4 měsíce po adjuvantní chemoterapii; HR = 0,56; 95% CI 0,17–1,9) [21]. Kotsoupoulos a kol (2008) sledovali účinek léčby infertility na riziko vzniku karcinomu prsu v rozsáhlé case-control studii nosiček mutací v genech BRCA1/2. Ačkoliv z celkového počtu 1 380 párů analyzovaných nosiček mutací pouze < 4% subjektů užívalo léčbu na podporu fertility a < 1% subjektů prodělalo IVF, výsledky naznačují, že tato terapie nezvyšuje riziko vzniku karcinomu prsu (OR = 1,29; CI 0,81–1,82) a autoři v závěru uvádějí, že: „…léčba inferility není u nosiček mutací v genech BRCA1/2 kontraindikována“ [22].
Provedení PCR PGD u nosičů mutací v nádorových predispozičních genech
Kromě technických omezení je důležitým předpokladem úspěchu PCR PGD i rychlost analýzy.
Zdroj a odběr genetického materiálu z embrya pro účely PCR PGD
Patrně nejrozšířenější metodou pro odběr genetického materiálu u PGD je biopsie blastomer ve stadiu, kdy embryo obsahuje 6–8 buněk (3 dny po oplození) [23]. Bezpečného následného vývoje embrya lze dosáhnout při odběru 1–2 blastomer. Pro odběr blastomer byla vypracována řada technik, které zahrnují otevření zony pellucidy mechanicky, chemicky nebo laserem [24]. Následně je blastomera odebrána tenkou skleněnou kapilárou s pomocí mikromanipulátoru (obr. 1). Transfer embrya do děložní dutiny matky je nezbytné provést do 48 hod po biopsii.
Image 1. <i>Odběr blastomey z časného embrya.</i> A – nasávání 1 blastomey uvnitř embrya do bioptické pipety, B – uvolnění blastomey z bioptické pipety do média, C – odebraná blastomea určená pro PCR PGD s patrným buněčným jádrem. 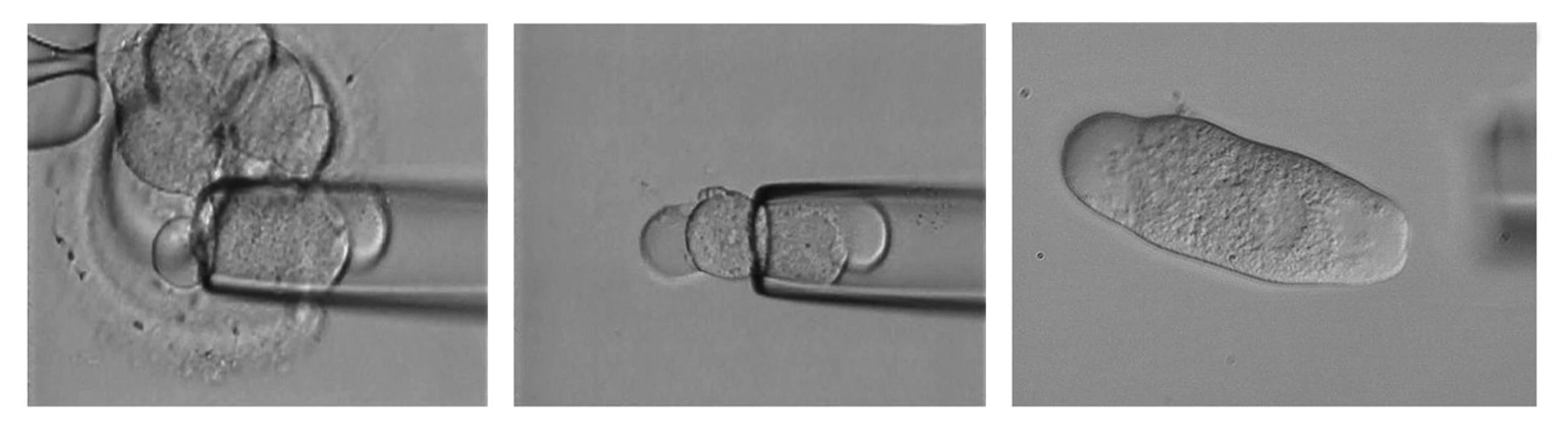
Alternativní metodou je odběr genetického materiálu pomocí biopsie polárních tělísek, která se vytvářejí v průběhu meiotického dělení před (první polární tělísko) a po (druhé polární tělísko) oplození vajíčka spermií. Genetický materiál polárních tělísek obsahuje haploidní sadu maternálních chromozomů komplementární k sadě obsažené ve vlastním oocytu. Víme li, že matka je nosičkou hereditární mutace, z vyšetření příslušného lokusu v sekundárních polárních tělíscích jsme schopni dedukovat stav sesterské alely v oocytu (tj. pro následný transfer budou vybrána pouze ta embrya, u kterých bude v polárních tělíscích pozitivně prokázána přítomnost mutace). Analýza polárního tělíska není však použitelná při PGD v případě, že nosičem mutace je otec. Situaci rovněž komplikuje možnost chromozomálních rekombinací v primárním polárním tělísku a skutečnost, že tělísko záhy po kultivaci in vitro involvuje [25,26]. Nejčastěji se biopsie polárního tělíska uplatňuje v diagnostice aneuploidií. Pro diagnostiku monogenně podmíněných onemocnění je nezbytné provést analýzu obou polárních tělísek [27].
Doposud nejméně rozšířeným přístupem je biopsie blastocysty. Při této metodě se odebírají buňky trofoektodermu v pozdějším stadiu vývoje (6. den po oplození), kdy embryo sestává z více než 100 buněk. Zásadní výhodou této techniky pro molekulární diagnostiku je odběr většího počtu buněk (10–30), což významně zvyšuje přesnost výsledku genotypizace [28]. Pro odběr buněk trofoektodermu je doporučena laserová incize zony pellucidy, po které je herniací vypuzena část buněk, jež mohou být odebrány pro vlastní vyšetření [29]. Omezení častějšího používání biopsie blastocysty představovaly technické obtíže vyplývající z nižšího počtu embryí dosahujících takto pokročilého embryonálního stadia. Rovněž je výrazně snížen časový limit pro provedení genetické analýzy. Nicméně pokroky v technikách asistované reprodukce i v genetických analýzách naznačují, že biopsie blastocyt se v blízké budoucnosti může stát nejrozšířenější metodou pro PCR PGD.
K diagnostice mutací v nádorových predispozičních genech jsou teoreticky použitelné všechny uvedené metody; jako nejméně vhodná se jeví biopsie polárních tělísek. Preference přístupu bude podléhat především výběru následných molekulárně biologických metod.
Provedení PCR PGD
Pro provedení PCR PGD existují dva přístupy. Lze uvažovat o analýze vlastního místa genové alterace nebo o provedení segregační nepřímé DNA diagnostiky na základě vyšetření polymorfních mikrosatelitových markerů dopředu charakterizovaných v rodině nosiče genové alterace a obou biologických rodičů. Oba přístupy je vhodné kombinovat.
Molekulárně biologické metody použité pro vlastní diagnostiku mutací se v principu neodlišují od klasických postupů používaných pro detekci známých alterací v genech [30]. Jejich jedinečnost však spočívá ve velmi omezeném množství genetického materiálu pro analýzu a v nezbytnosti rychlého provedení vyšetření, kdy výsledek musí být dostupný obvykle do 48 hod od odběru buněk z embrya.
Po odběru buňky z embrya je před vlastní PCR reakcí nezbytné provést analýzu blastomery, pro kterou je používána řada postupů zahrnujících fyzikální, chemické i enzymatické metody [31].
Malé množství genetického materiálu (obvykle z jedné buňky) je spojeno se specifickými riziky PCR PGD analýz: možnost kontaminace vzorku, selhání amplifikace (Amplification Failure –AF) a ztráta alelického signálu (Allelic Drop-Out –ADO) [32]. Prevence kontaminace spočívá v přísně sterilním přístupu k PCR PGD. Používaný laboratorní plastik i použité chemikálie musí být sterilní, bez přítomnosti DNáz i RNáz, a musí být určeny výhradně pro účely PCR PGD. U AF nedojde k amplifikaci vybraného amplikonu vůbec, což znamená, že v takovémto případě nelze u příslušného embrya vyhodnotit stav genotypu. Nejčastějším zdrojem AF jsou suboptimální podmínky provedení PCR reakcí. U ADO sice amplifikace proběhne, avšak amplifikovaný produkt odpovídá templátu pouze jedné z obou alel. Výsledkem pak může být falešně negativní výsledek s chybnou diagnózou. Na ADO se podílí řada příčin (degradace DNA, metoda lýzy blastomer, podmínky PCR, délka a charakter amplikonu apod.). Kritický vliv na výskyt ADO má především množství genetického materiálu reprezentované obvykle 1–2 blastomerami. Množství genetického materiálu lze navýšit dvojím způsobem: jedním z přístupů je odběr více buněk (biopsie blastocysty), druhým zařazení celogenomové amplifikace (Whole-Genome Amplification – WGA) před vlastní diagnostickou PCR [33–35]. Nevýhody WGA, spočívající v prodloužení času vyšetření a nárůstu náročnosti a ceny detekce, vyvažuje až 106násobné zvýšení množství genetického materiálu. Z důvodu ADO je doporučené do diagnostické PCR zařadit kontrolní koamplifikaci umožňující často rozlišení mezi ADO a skutečnou negativitou homozygotního (wt) vzorku [8,36]. Laboratoře s velmi dobrými výsledky PCR PGD zaznamenávají ADO přibližně v 5–15% případů [32]. Využití multiplex PCR umožňujícího amplifikaci řady amplikonů a především metody preimplantační genetické haplotypizace (PGH) zavádějící analýzu mnoha mikrosatelitních polymorfních lokusů minimalizuje chyby vznikající v důsledku ADO [37,38].
Závěr
Techniky asistované reprodukce zahrnující PGD mohou být přínosem pro specifickou část z těch nosičů mutací v genech predisponujících pro hereditární nádorové syndromy, pro které je riziko přenosu mutace na jejich potomky, plynoucí ze spontánní koncepce, z různých příčin nepřijatelné. Předpokladem pro provedení PGD je dobrá kooperace mezi pacientem a specializovaným multidisciplinárním týmem, který je schopen posoudit přínos tohoto postupu pro pacienta, jeho rizika a jeho technickou proveditelnost. Připomínáme, že v současnosti nepatří metody PCR PGD u hereditárních nádorových syndromů k rutinním metodám. V řešení je řada otázek souvisejících nejen s medicínskými a technickými aspekty, ale rovněž legislativními a etickými otázkami. Přestože se jedná o techniku ve vývoji, je již v současné době možné ji použít a rychlý pokrok v molekulární medicíně i biotechnologiích do budoucna slibuje její další významná zlepšení.
Poděkování
Rádi bychom poděkovali recenzentům za hodnotné a zasvěcené komentáře týkající se PGD a rozsáhlé skupině našich kolegů a pacientů, se kterými jsme měli možnost diskutovat o uvedené problematice z různých úhlů pohledu.
RNDr. Renáta Hüttelová
IVF – Institut s. r. o.
B. Smetany 2
301 00 Plzeň
e-mail: renata.huttelova@atlas.cz
Sources
1. Lee SJ, Schover LR, Partridge AH et al. American Society of Clinical Oncology Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol 2006; 24 : 2917–2931.
2. Macek M, Vilimova S, Potuznikova P et al. Lékařská genetika v reprodukční medicíně. Čas Lék Česk 2002; 141 : 28–34.
3. Handyside AH, Kontogianni EH, Hardy K et al. Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification. Nature 1990; 344 : 768–770.
4. Ao A, Wells D, Handyside AH et al. Preimplantation genetic diagnosis of inherited cancer: familial adenomatous polyposis coli. J Assist Reprod Genet 1998; 15 : 140–144.
5. Davis T, Song B, Cram DS. Preimplantation genetic diagnosis of familial adenomatous polyposis. Reprod Biomed Online 2006; 13 : 707–711.
6. Jasper MJ, Liebelt J, Hussey ND. Preimplantation genetic diagnosis for BRCA1 exon 13 duplication mutation using linked polymorphic markers resulting in a live birth. Prenat Diagn 2008; 28 : 292–298.
7. Spits C, De Rycke M, Van Ranst N et al. Preimplantation genetic diagnosis for neurofibromatosis type 1. Mol Hum Reprod 2005; 11 : 381–387.
8. Abou-Sleiman PM, Apessos A, Harper JC et al. First application of preimplantation genetic diagnosis to neurofibromatosis type 2 (NF2). Prenat Diagn 2002; 22 : 519–524.
9. Verlinsky Y, Rechitsky S, Verlinsky O et al. Preimplantation diagnosis for p53 tumour suppressor gene mutations. Reprod Biomed Online 2001; 2 : 102–105.
10. Sutterlin M, Sleiman PA, Onadim Z et al. Single cell detection of inherited retinoblastoma predisposition. Prenat Diagn 1999; 19 : 1231–1236.
11. Girardet A, Hamamah S, Anahory T et al. First preimplantation genetic diagnosis of hereditary retinoblastoma using informative microsatellite markers. Mol Hum Reprod 2003; 9 : 111–116.
12. Human Fertilisation and Embryology Authority (HFEA). Dostupné z http://www.hfea.gov.uk/.
13. Staton AD, Kurian AW, Cobb K et al. Cancer risk reduction and reproductive concerns in female BRCA1/2 mutation carriers. Fam Cancer 2008; 7 : 179–186.
14. Menon U, Harper J, Sharma A et al. Views of BRCA gene mutation carriers on preimplantation genetic diagnosis as a reproductive option for hereditary breast and ovarian cancer. Hum Reprod Advance Access published online on April 11, 2007. Dostupné z http://humrep.oxfordjournals.org/cgi/content/full/dem055v1.
15. Kastrinos F, Stoffel EM, Balmana J et al. Attitudes toward prenatal genetic testing in patients with familial adenomatous polyposis. Am J Gastroenterol 2007; 102 : 1284–1290.
16. Robertson JA. Extending preimplantation genetic diagnosis: the ethical debate Ethical issues in new uses of preimplantation genetic diagnosis. Hum Reprod 2003; 18 : 465–471.
17. Wagner JE. Practical and ethical issues with genetic screening. Hematology Am Soc Hematol Educ Program 2005; 498–502.
18. Kress H. Preimplantation genetic diagnosis Ethical, social and legal aspects. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2007; 50 : 157–167.
19. Simpson JL, Carson SA, Cisneros P. Preimplantation genetic diagnosis (PGD) for heritable neoplasia J Natl Cancer Inst Monogr 2005; 34 : 87–90.
20. ESHRE Capri Workshop Group. Hormones and breast cancer. Hum Reprod Update 2004; 10 : 281–293.
21. Azim AA, Costantini Ferrando M, Oktay K. Safety of Fertility Preservation by Ovarian Stimulation With Letrozole and Gonadotropins in Patients With Breast Cancer: A Prospective Controlled Study. J Clin Oncol 2008; 26 : 2630–2635.
22. Kotsopoulos J, Librach C, Lubinski J et al. Infertility, treatment of infertility, and the risk of breast cancer among women with BRCA1 and BRCA2 mutations: a case-control study. Cancer Causes and Control 2008; 19 : 1111–1119.
23. Sermon KD, Michiels A, Harton G et al. ESHRE PGD Consortium data collection VI: cycles from January to December 2003 with pregnancy follow up to October 2004. Hum Reprod 2007; 22 : 323–336.
24. Verlinsky Y, Kuliev A. Current status of preimplantation diagnosis for single gene disorders. Reprod Biomed Online 2003; 7 : 145–150.
25. Munne S, Dailey T, Sultan KM et al. The use of first polar bodies for preimplantation diagnosis of aneuploidy. Hum Reprod 1995; 10 : 1014–1020.
26. Kuliev A, Verlinsky Y. Meiotic and mitotic nondisjunction: lessons from preimplantation genetic diagnosis Hum Reprod Update 2004; 10 : 401–407.
27. Rechitsky S, Strom C, Verlinsky O et al. Accuracy of preimplantation diagnosis of single gene disorders by polar body analysis of oocytes. J Assist Reprod Genet 1999; 16 : 192–198.
28. Kokkali G, Traeger-Synodinos J, Vrettou C et al. Blastocyst biopsy versus cleavage stage biopsy and blastocyst transfer for preimplantation genetic diagnosis of beta thalassaemia: a pilot study. Hum Reprod 2007; 22 : 1403–1409.
29. Joris H, De Vos A, Janssens R et al. Comparison of the results of human embryo biopsy and outcome of PGD after zona drilling using acid Tyrode medium or a laser. Hum Reprod 2003; 18 : 1896–1902.
30. Wells D. Advances in preimplantation genetic diagnosis. Eur J Obstet Gynecol Reprod Biol 2004; 115: S97–101.
31. Tsuchiya S, Sueoka K, Matsuda N et al. The „spanning protocol“: a new DNA extraction method for efficient single cell genetic diagnosis. J Assist Reprod Genet 2005; 22 : 407–414.
32. Piyamongkol W, Bermudez MG, Harper JC et al. Detailed investigation of factors influencing amplification efficiency and allele drop-out in single cell PCR: implications for preimplantation genetic diagnosis. Mol Hum Reprod 2003; 9 : 411–420.
33. Jiao Z, Zhou C, Li J et al. Birth of healthy children after preimplantation diagnosis of beta thalassemia by whole-genome amplification. Prenat Diagn 2003; 23 : 646–651.
34. Zhang L, Cui X, Schmitt K et al. Whole genome amplification from a single cell: implications for genetic analysis. Proc Natl Acad Sci USA 1992; 89 : 5847–5851.
35. Hellani A, Coskun S, Benkhalifa M et al. Multiple displacement amplification on single cell and possible PGD applications. Mol Hum Reprod 2004; 10 : 847–852.
36. Meissner C, Bruse P, Mueller E et al. A new sensitive short pentaplex (ShoP) PCR for typing of degraded DNA. Forensic Sci Int 2006; 16 : 121–127.
37. Renwick PJ, Trussler J, Ostad-Saffari E et al. Proof of principle and first cases using preimplantation genetic haplotyping-a paradigm shift for embryo diagnosis. Reprod Biomed Online 2006; 13 : 110–119.
38. Putzová M, Pecnová L, Hulvert J et al. Preimplantační genetická diagnostika monogenně podmíněných chorob – její možnosti, úskalí a první úspěchy v České republice. Čes Slov Pediatrie 2008; 63 : 626–633.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2009 Issue Supplementum-
All articles in this issue
- Syndrom hereditárního karcinomu prsu a ovarií
- Hereditární nepolypózní kolorektální karcinom (HNPCC, Lynchův syndrom)
- Familiární adenomatózní polypóza
- Syndrom Li-Fraumeni
- Von Hippel-Lindauova choroba
- Mnohočetná endokrinní neoplazie typ 1 – syndrom MEN 1
- Mnohočetná endokrinní neoplazie typ 2 – syndrom MEN 2
- Syndrom familiárního melanomu (s dysplastickými naevy či bez nich)
- Gorlinův syndrom
- Peutz-Jeghersův syndrom
- Přehled syndromů spojených s rizikem nádorů dětského věku
- Tuberózní skleróza
- Hereditární pankreatitida
- Cowdenův syndrom
- Doporučení k provedení profylaktické operace pro snížení rizika gynekologických malignit u žen s hereditárním rizikem
- Současné vyšetřovací metody v diagnostice a sledování familiárních polypóz. Vyšetření tenkého střeva
- Limitace genetického testování v onkologii
- Předpoklady pro preimplantační genetickou diagnostiku (PGD) u nosičů mutací v nádorových predispozičních genech
- Komentář: Preimplantační genetická diagnostika
- Komentář: Možnosti asistované reprodukce při kontrole přenosu rizikových genů na děti
- Komentář: Preimplantační genetická diagnostika
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hereditární pankreatitida
- Gorlinův syndrom
- Mnohočetná endokrinní neoplazie typ 2 – syndrom MEN 2
- Mnohočetná endokrinní neoplazie typ 1 – syndrom MEN 1
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

