-
Medical journals
- Career
Chromatografická charakterizace aminokyselinových profilů vzorků moči pacientů s karcinomem prostaty
Authors: N. Cernei 1,2; Z. Heger 1,2; Š. Veselý 3; O. Zítka 1,2; V. Adam 1,2; R. Kizek 1,2
Authors‘ workplace: Ústav chemie a biochemie, Mendelova univerzita v Brně, Zemědělská 1, CZ-61 00 Brno, Česká republika 1; Středoevropský technologický institut, VUT v Brně, Technická 058/10, CZ-616 00 Brno, Česká republika 2; Urologická klinika, 2. Lékařská fakulta Univerzity Karlovy a FN V Motole, V Úvalu 84, CZ-150 06 Praha 5, Česká republika 3
Published in: Klin. Biochem. Metab., 22 (43), 2014, No. 4, p. 196-202
Overview
Cíle studie:
Cílem studie bylo vytvořit protokol pro zpracování vzorků moči pro získání aminokyselinových profilů pomocí iontově výměnné chromotografie s detekcí ve viditelném spektru (IEC/Vis) na základě tvorby komplexů aminokyselin s ninhydrinem a následné zkrácení času analýzy pro klinicky zajímavé molekuly (sarkosin či taurin), které mohou byt využity jako potenciální nádorové biomarkery.Typ studie:
MetodickáMateriál a metody:
Vzorky moči, odebrané pacientům s diagnostikovaným karcinomem prostaty (n = 500) byly shromažďovány po dobu 1 roku a uskladňovány při teplotě -80°C. Pro vlastní analýzu aminokyselinových profilů byly vzorky připraveny kyselou hydrolýzou v mikrovlnném reaktoru. Za optimalizovaných podmínek (80 W, 120°C, 25 bar, 105 min) bylo 500 µl vzorku, smíchaného s 500 µl 35% kyseliny chlorovodíkové zhydrolyzováno na výsledný produkt, který byl následně ředěn pufrem sodíkového cyklu (0,2 mol/l NaCl, 60 mmol/l C6H807, 1,5 mmol/l N3Na a 0,4 % S(CH2CH2OH)2). Po centrifugaci (25 000 g při 4°C, 20 min) byly vzorky neutralizovány (0,6 mol/l NaOH) a analyzovány iontově-výměnnou kapalinovou chromatografií s postkolonovou derivatizací ninhydrinem využívající optickou detekci při vlnových délkách λ = 440 a 570 nm. Pro detekci sarkosinu a taurinu byly vzorky připraveny odpařením 250 µl vzorku na dusíkové odparce (40 min, teplota dusíku 60°C, tlak 1 bar) a následně resuspendovány pufrem sodíkového cyklu (250 µl).Výsledky a závěr:
Analýzou aminokyselinových profilů (n = 500) bylo zjištěno, že lze docílit získání důležitých informací z neinvazivně odebraných vzorků moči. Použití dusíkové odparky redukuje manipulaci se vzorkem a zlepšuje opakovatelnost analýzy. Zkrácená analýza sarkosinu a taurinu ze vzorků odpařených na dusíkové odparce může sloužit jako metoda pro citlivou a nízkonákladovou analýzu klinických vzorků.Klíčová slova:
Iontově-výměnná chromatografie, Karcinom prostaty, Neinvazivní biomarkery, Sarkosin, Taurin.Úvod
Aminokyseliny jsou jedním ze základních metabolitů a jejich biochemické dráhy jsou úzce spojeny s fyziologickými či patologickými pochody, což z nich dělá slibné indikátory změn zdravotního stavu [1]. Jakožto důležité biomolekuly tvoří základ každé tkáně a alterace v jejich hladinách mohou indikovat rozmanité patologické stavy včetně zhoubných onemocnění či oxidativního stresu [12]. Vzhledem k potenciálu sarkosinu či taurinu jako slibných biomarkerů jsou neustále vyvíjeny nízkonákladové a citlivé metody, které by mohly být do budoucna využity pro screeningová vyšetření. Význam má především stanovení sarkosinu a taurinu v moči pro včasné odhalení možného rozvoje maligních novotvarů prostaty.
Díky svým amfolytickým vlastnostem jsou aminokyseliny často separovány pomocí iontově-výměnné kapalinové chromatografie na základě rozdílného náboje mezi aminokyselinou a stacionární fází. Jako iontoměnič je využit katex [2, 3], kde je hlavním faktorem určujícím retenci analytu jeho izoelektrický bod [4]. Separace aminokyselin je možná i na reverzně fázových kolonách, které však pro účinnou separaci nutně vyžadují předkolonovou derivatizaci separovaných analytů [5]. Separace aminokyselin je možná i na hydrofobně interakčních kolonách [6]. Možná je i separace pomocí kapilární elektroforézy, avšak ve srovnání s chromatografickými technikami bývá identifikace analytů obtížnější [7].
Pro detekci aminokyselin je u iontově výměnné separace využito postkolonové derivatizace ninhydrinem za definovaných podmínek při reakční teplotě 120°C. Ninhydrin reaguje s primární aminoskupinou a dává vzniknout purpurově zbarvenému komplexu (Ruhemannova červeň) (Obr. 1) [8]. Nejvyšší výnos derivatizační reakce byl popsán v detekčním rozmezí λ = 400 - 800 nm [2]. Další možností je fluorescenční detekce, nicméně i ta vyžaduje po separaci zařazení derivatizačního kroku [9]. Hmotnostní detekce nabízí vysokou citlivost, která je vykoupena vysokou pořizovací a provozní cenou přístroje. Problémem může být i komplexnost eluentů po separaci reálných vzorků.
Fig. 1: Overall scheme of derivatization reaction between (A) ninhydrin and (B) amino acid, resulting in (C) Ruhemann´s purple. 
Cílem této práce bylo sestavit jednoduchý protokol úpravy reálných vzorků moči pro získání aminokyselinového profilu pomocí iontově-výměnné kapalinové chromatografie s Vis detekcí. Dalším cílem byla optimalizace separačních podmínek sarkosinu a taurinu pro získání rychlé a finančně nenáročné metody pro identifikaci těchto aminokyselin.
Materiál a metody
Chemikálie
Standardy a chemikálie na přípravu pufrů byly pořízeny v 99% čistotě od firmy Sigma-Aldrich (St. Louis, MO, USA), pokud není uvedeno jinak. Methylcelosolve, ninhydrin a chlorid cínatý byly pořízeny od firmy Ingos (Praha, Česká republika).
Vzorky moči
Pro účely ověření funkčnosti optimalizovaných metod byly použity vzorky moči (n = 500). Soubor se skládal ze vzorků získaných od pacientů s karcinomem prostaty (n = 320) a vzorky kontrolní skupiny subjektů bez diagnostikovaných malignit s definovaným zdravotním stavem (n = 180). Vzorky byly získány z Fakultní nemocnice v Motole v Praze a Fakultní nemocnice u Sv. Anny v Brně a zpracovány se souhlasem etické komise (referenční číslo EK-377/13). Vzorky moči pacientů byly shromažďovány po dobu 1 roku a uskladňovány při teplotě -80°C.
Stanovení prostatického specifického antigenu (PSA)
PSA a fPSA v moči bylo analyzováno imunoenzymometrickou metodou (IEMA). Pro analýzu byl použit automatizovaný analyzátor AIA 600 II (Tosoh, Bioscience, Tokyo, Japonsko). Pro analýzu byl použit komerční kit ST AIA-PACK PSAII dle pokynů výrobce.
Příprava vzorků pro analýzu aminokyselinových profilů
Pro účely kyselé hydrolýzy v mikrovlnném reaktoru MW 3000 (Anton Paar, Graz, Rakousko) bylo odebráno 500 µl vzorku a smícháno s 500 µl 35% kyseliny chlorovodíkové. Za použití optimalizovaných mineralizačních podmínek (power: 80 W, Ramp: 15 min, Hold: 90 min, tlak: 25 bar, Rotor XF-1006) byl získán vzorek, který byl následně 10 x ředěn ředícím pufrem sodíkového cyklu (0,2 mol/l NaCl, 60 mmol/l C6H807, 1,5 mmol/l N3Na a 0,4 % S(CH2CH2OH)2). Po ředění byly vzorky centrifugovány při 25 000 g a 4°C po dobu 20 minut v mikrocentrifuze 5417R (Eppendorf, Hamburg, Německo), následovalo ředění 1 : 2 v neutralizačním roztoku (0,6 mol/l NaOH). Takto připravený vzorek byl následně analyzován pomocí IEC/Vis.
Příprava vzorků pro analýzu sarkosinu a taurinu
Vzorky moči (500 µl) byly převedeny do mikrotitrační destičky Deepwell plate 96 (Eppendorf AG, Hamburg, Germany) a odpařeny pomocí dusíkové odparky (Ultravap 96, Porvair Sciences limited, Leatherhead, Spojené Království). Odpařené vzorky byly resuspendovány pufrem sodíkového cyklu (500 µl) a analyzovány pomocí IEC/Vis.
Iontově-výměnná kapalinová chromatografie s Vis detekcí
Separace a identifikace aminokyselin byla provedena pomocí vysokoúčinné iontově-výměnné kapalinové chromatografie s Vis detekcí (IEC/Vis) na přístroji AAA-400 (Ingos, Praha, Česká republika.). Stanovení aminokyselin pomocí derivatizačního činidla ninhydrinu je jednou z nejpoužívanějších metod. Mezi přednosti této metody patří přesnost, citlivost a velké spektrum detekovaných látek v různých matricích jako jsou krev či moč. Analýzator aminokyselin není určen pro běžnou analýzu aminokyselin taurinu a sarkosinu. Vzorky moči pacientů byly shromažďované po dobu 1 roku a uskladňované při teplotě -80°C. Skleněná chromatografická kolona s vnitřním průměrem 3,7 mm a délkou 350 mm byla naplněna silným katexovým ionexem v sodíkovém cyklu s průměrnou velikostí částic 12 µm a sítěním 8 % a temperována. Objem nástřikové smyčky byl 100 µl při přesnosti nástřiku s relativní směrodatnou odchylkou (RSD) 1 %. Ninhydrin byl rozpuštěn v 75 % (v/v) metylcelosolvu a v 25 % (v/v) 4 mol/l acetátovém pufru (pH 5,5). Derivatizační činidlo bylo po celou dobu uchováno pod inertní atmosférou N2 a chlazeno. Stanovení aminokyselin probíhalo dle následujících podmínek:
- Složení mobilní fáze: pufr (A) 60 mmol/l C6H807, 20 mmol/l Na3C6H5O7, 0,2 mol/l NaCl, 1,5 mmol/l N3Na, 0,4 % S(CH2CH2OH)2, pufr (B) 50 mmol/l C6H807, 30 mmol/l Na3C6H5O7, 0,15 mol/l NaCl, 1,5 mmol/l N3Na, 0,4 % S(CH2CH2OH)2, pufr (C) 40 mmol/l C6H807, 40 mmol/l Na3C6H5O7, 0,3 mol/l NaCl, 1,5 mmol/l N3Na, 0,4 % S(CH2CH2OH)2, pufr (D) 90 mmol/l Na3C6H5O7, 0,9 mol/l NaCl, 30 mmol/l H3BO3, 1,5 mmol/l N3Na, pufr (E) 0,2 mol/l NaOH,
- Skokový gradient mobilní fáze (průběh v čase viz Tabulka 1),
- Průtok mobilní fáze 0,25 ml/min,
- UV detekce při 570 nm (440 nm pro detekci prolinu).
Table 1. Expression of gradient elution used for analyses of total amino acids profile, taurine and sarcosine. 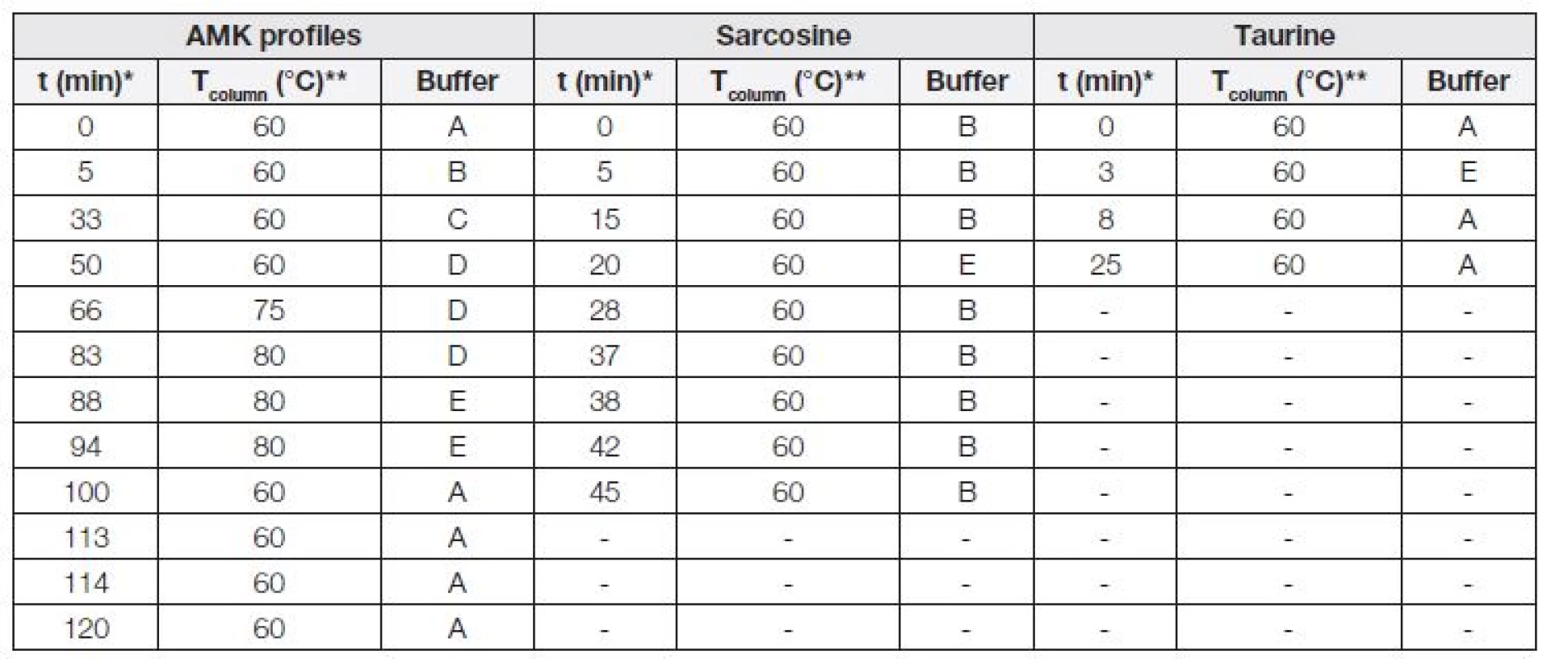
* Time of start of separation step, ** temperature of column during separation step. Popisná statistika
Statistické zpracování dat a jejich grafická interpretace byly provedeny v programech Microsoft Excel®, Microsoft Word® and Microsoft PowerPoint®. Mez detekce (3 S/N) a mez kvantifikace (10 S/N) byly vypočítány dle [10], kde N je vyjádřeno jako standardní směrodatná odchylka šumu stanoveného v oblasti signálu.
Výsledky a diskuse
Aminokyselinové profily
Stacionární fáze - katex v kombinaci se skokovým gradientem pufrů o různých pH a iontové síle nabízí vhodnou cestu pro separaci aminokyselin na základě jejich rozdílných izoelektrických bodů [11]. Z předchozích optimalizačních kroků byly získány základní analytické parametry pro 17 analyzovaných aminokyselin (Tabulka 2). Údaje v tabulce byly zaokrouhleny na jednu platnou číslici. Kalibrační křivky byly sestrojeny s použitím 10 kalibračních roztoků. Parametry LOD a LOQ byly vypočítány jako průměr pěti nezávislých analýz jako trojnásobek (LOD, 3S/N) a desetinásobek (LOQ, 10S/N) směrodatné odchylky 50 hodnot šumu (v každé analýze) v blízkosti píku analytu. Hodnoty opakovatelnosti byly stanoveny z 10 hodnot a hodnoty mezilehlé preciznosti z 25 hodnot. Kalibrační body byly proloženy přímkou, tak aby součet čtverců odchylek byl minimální. Získané parametry přímky (úsek na ose y a směrnice) byly otestovány, zda jsou statisticky významné od nuly. Bylo zjištěno, že směrnice je statisticky významná od nuly, zatímco úsek na ose y není statisticky významný. Byl sestrojen graf reziduí (závislosti velikosti reziduí na předpovídané hodnotě), který potvrdil, že zvolený regresní model je správný (body reziduí jsou rozmístěny v grafu náhodně) a nebyly odhaleny odlehlé body.
Table 2. The analytical parameters of IEC/Vis analyse for 17 basic analyzed amino acids, obtained from individual analyses of each amino acid. 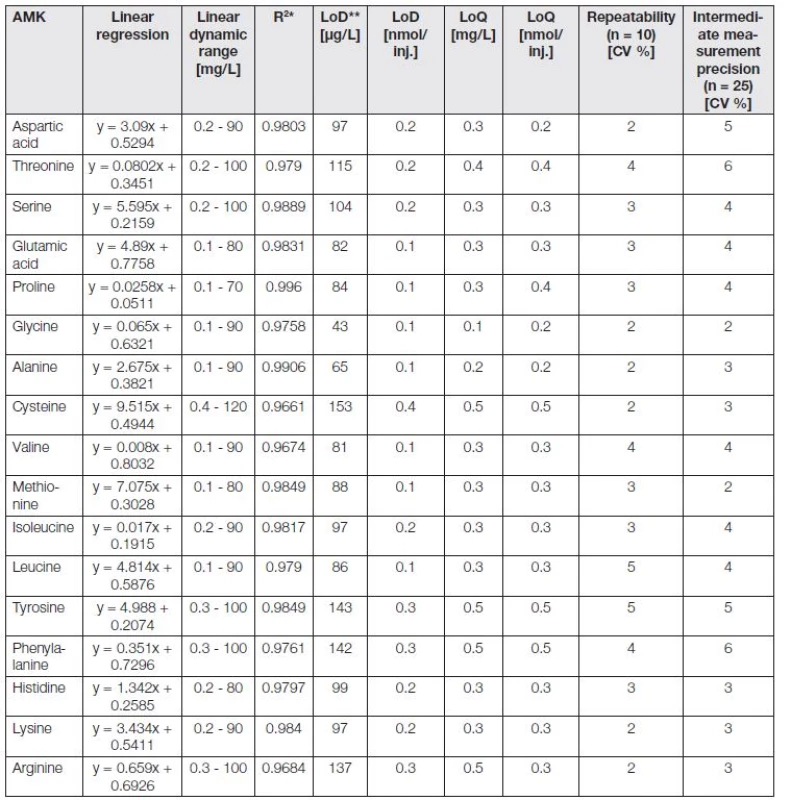
* Regression coefficients, ** limit of detection (3 S/N), *** limit of quantification (10 S/N), **** relative standard deviation, inj. - injection - 5 μL. V našem případě byla pro desintegraci peptidových vazeb a získání komplexních profilů moči zapojena kyselá hydrolýza v mikrovlnném reaktoru, která ale zásadně prodlužuje dobu celkové analýzy (doba mikrovlnné přípravy vzorku - 105 minut). Po hydrolýze je vzorek rozložen na základní aminokyseliny, z kterých je konstituován. Po kyselé hydrolýze je zásadní další ředění vzorku pomocí pufrů, stabilizující pH vzorku.
Výše zmíněným postupem byly připraveny vzorky moči, odebrané pacientům s indikovanou radikální prostatektomií. Dva vybrané chromatogramy z těchto analýz jsou znázorněny na Obr. 2. Detailnější informace (hladiny PSA a fPSA, včetně přidružených diagnóz) o pacientech jsou přiřazeny ke každému chromatogramu a pro porovnání je ukázán i vybraný chromatogram vzorku moči zdravého muže, získaný stejným postupem přípravy a analýzy.
Chromatogramy jasně ukazují na zvýšení hladiny všech aminokyselin v moči pacientů s karcinomem prostaty. Tento jev je zřejmě spojen se zvýšeným obsahem proteinů v moči, který může být důsledkem zánětlivých stavů či jiných patologií, asociovaných s nádorovými onemocněními [13]. Jako zajímavá cílová molekula se jeví především sarkosin, který jakožto neproteinogenní aminokyselina není úzce spřízněn se zvýšeným obsahem proteinů a jeho zvýšená koncentrace v matrici je dána především přítomností patologických stavů [1].
Zkrácené analýzy sarkosinu a taurinu
Sarkosin (N-methylglycin) není obsažen v proteinech, a proto není zapotřebí kyselé hydrolýzy pro jeho kvantifikaci. Díky tomu byl postup přípravy vzorků zjednodušen na pouhé odpaření 250 µl vzorku a následné resuspendování stejným objemem ředícího pufru sodíkového cyklu. Výhodou postupu je časová nenáročnost, eliminace možných chyb v přípravě často velmi cenných vzorků a šetření finančních prostředků. Při analýze sarkosinu je zásadní jeho rozlišení od hmotnostně identického alaninu (89,0932 Da) [14]. Nejčastěji používané metody - GC/MS [15] a LC/MS [16] nabízí vysokou citlivost, avšak za cenu složité předúpravy vzorku a nutnosti zapojení dobře školeného a zkušeného personálu pro obsluhu. Při zavedení dobře fungující metody jsou tyto komplikace u IEC-Vis eliminovány a finanční náklady se redukují pouze na pořizování chemikálií, potřebných k analýzám.
Stejná příprava vzorku moči byla zvolena i pro analýzu taurinu (kyselina 2-aminoethansulfonová), který ač postrádá karboxylovou skupinu, je často řazen mezi aminokyseliny [17]. Tato sulfonová kyselina je součástí většiny živočišných tkání a hraje významnou roli v mnoha fyziologicky důležitých procesech, jako je antioxidační ochrana organismu [18], inhibice neurotransmise [19] nebo stabilizace buněčných membrán [20]. Zvýšené hladiny taurinu v moči byly již dříve identifikovány u zánětlivých onemocnění střev [21], rozvoji nemoci z ozáření [22] či chronických onemocnění ledvin [23]. Použité metody, nejčastěji nukleární magnetická resonance (NMR) či kombinace kapalinové chromatografie s hmotnostní detekcí (trojitý kvadrupól nebo orbitrap) sice nabízejí vysokou citlivost, nicméně vykoupenou vysokou pořizovací a provozní cenou a značnými nároky na přípravu vzorku.
Fig. 2. Chromatograms showing total amino acid profiles of two chosen urinary samples obtained from two patients diagnosed with prostate carcinoma and one healthy individual as a control. Information belonging to each patient is inserted. Samples were subjected to acidic hydrolysis following conditions, mentioned in chapter Results and discussion and analyzed using IEC/Vis using method for determination of total amino acid profiles. <sup>*</sup> Prostatic specific antigen (ng/mL), <sup>**</sup> free prostate specific antigen (free/total PSA ratio), <sup>***</sup> clinical stage: T1c – tumor identified by needle biopsy ,<sup>****</sup> Gleason score, <sup>*****</sup> Other comorbidities. 
Z toho důvodu byly optimalizovány zkrácené IEC/Vis metody pro samostatné analýzy taurinu a sarkosinu. Jejich analytické parametry jsou znázorněny v Tabulce 3. Údaje v tabulce byly zaokrouhleny na jednu platnou číslici. Analytické parametry byly získány stejným postupem jako v Tabulce 2. Kalibrační křivky byly sestrojeny s použitím 10 kalibračních roztoků v pracovních rozsazích 7,8 – 1000 µmol/l pro sarkosin a 0,8 - 800 µmol/l pro taurin.
Table 3. The analytical parameters of shortened IEC/Vis analyses of taurine and sarcosine. 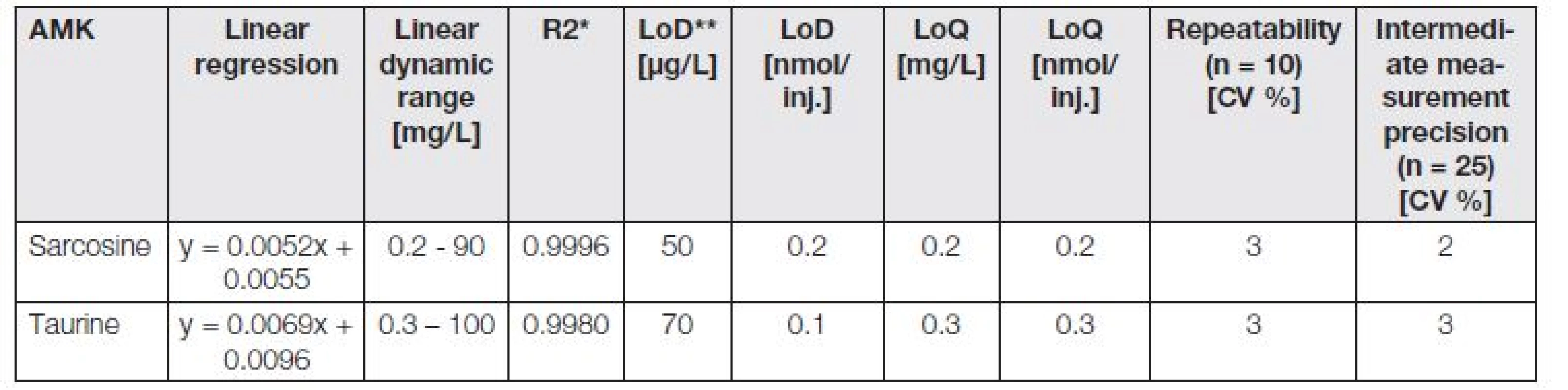
* Regression coefficients, ** limit of detection (3 S/N), *** limit of quantification (10 S/N), **** relative standard deviation, inj. - injection - 5 μL. Fig. 3. Chromatograms of taurine and sarcosine, carried out using analyses, optimized for decrease of separation time of individual analytes. Chromatograms of standards of (A) taurine (10 μg/mL) and (B) sarcosine (10 μg/mL), obtained on ionexchange chromatography with Vis detector. Inserted are shown their calibration curves (0.6 - 100 μg/mL). (C) Overlay of chromatograms of taurine and sarcosine, resulted from analysis of chosen real urinary sample, obtained by patients suffering from prostate carcinoma. 
V porovnání s délkou analýzy aminokyselinových profilů (120 minut) byla délka analýzy samotného sarkosinu zkrácena na 45 minut, kdy eluce analytu probíhala v tR = 18,76 min. U taurinu byla analýza zkrácena na 25 minut s elucí v tR = 12,10 min. Záznamy z analýz standardů (10 µg/ml) těchto biologicky významných látek jsou znázorněny na Obr. 3A (taurin) a 3B (sarkosin).
Po optimalizaci byla metoda aplikována na vzorky pacientů s adenokarcinomem prostaty a po přípravě vzorku odpařením na dusíkové odparce byly získány chromatogramy sarkosinu a taurinu znázorněné na Obr. 3C, kdy byly po přepočtu na kreatinin získány hodnoty 33 µmol/mmol kreatininu pro sarkosin a 26,5 µmol/mmol kreatininu pro taurin.
Závěr
Prostatický specifický antigen (PSA) představuje v současnosti nejdůležitější nádorový marker nádorových onemocnění prostaty, avšak patři mezi markery, kde dochází k narušení integrity tkáně. Proto jsou hledány markery, pomocí kterých by bylo možné identifikovat karcinom prostaty pouhou analýzou moči. Jednou z látek, jejichž potenciál by se mohl v diagnostice karcinomu využit je neproteinogenní aminokyselina sarkosin. Podle několika studií je sarkosin hodnocen jako výrazně lepší marker rozvíjejících se nádorů prostaty než PSA, a proto bylo cílem této práce zavedení jednoduchého testu na hladinu sarkosinu v moči pacientů s diagnostikovaným zhoubným nádorem prostaty a zdravé kontrolní skupiny. Iontově-výměnná kapalinová chromatografie s postkolonovou derivatizací ninhydrinem je spolehlivá separační technika, která je navíc relativně jednoduchá na obsluhu a díky tomu by mohly naše optimalizované separační postupy být zavedeny do rutinní praxe. Naše výsledky ukazují možnost získání komplexních informací z moči s využitím této metody. A to ať už použitím kyselé hydrolýzy vzorku a následné IEC/Vis analýzy, anebo jednoduchým odpařením až 96 vzorků současně a následnou rychlou chromatografickou analýzou taurinu a sarkosinu. Vzhledem k neustále se zvyšujícímu zájmu o sarkosin může metoda jeho neinvazivního stanovení v moči posloužit jako screeningová, nízkonákladová metoda, využitelná pro pre-bioptické testování pacientů s podezřením na přítomnost karcinomu prostaty. Stejně tak stanovení taurinu v tělesných tekutinách může poskytovat důležité informace o hladinách oxidativního stresu v organismu.
Práce byla finančně podpořena ze zdroje BR62400000. Autoři děkují Martině Staňkové za technickou asistenci.
Do redakce došlo 22. 7. 2014
Adresa pro korespondenci:
Prof. Ing. René Kizek, Ph.D.
Ústav chemie a biochemie
Mendelova univerzita v Brně
Zemědělská 1
CZ-613 00 Brno
e-mail: kizek@sci.muni.cz
Sources
1. Heger, Z., Cernei, N., Gumulec, J. et al. Determination of common urine substances as an assay for improving prostate carcinoma diagnostics. Oncol. Rep. 2014, 31, p. 1846-1854.
2. Cernei, N., Zitka, O., Ryvolova, M. et al. Spectrometric and Electrochemical Analysis of Sarcosine as a Potential Prostate Carcinoma Marker. Int. J. Electrochem. Sci. 2012, 7, p. 4286-4301.
3. Zitka, O., Cernei, N., Heger, Z. et al. Microfluidic chip coupled with modified paramagnetic particles for sarcosine isolation in urine. Electrophoresis. 2013, 34, p. 2639-2647.
4. Wilkins, M. R., Williams, K. L. Cross-species protein identification using amino acid composition, peptide mass fingerprinting, isoelectric point and molecular mass: A theoretical evaluation. J. Theor. Biol. 1997, 186, p. 7-15.
5. Fermin, B. C., Radinsky, J. A., Kratochvil, R. J. et al. Integration of rapid derivatization and gradient elution techniques for enhanced high-performance liquid chromatography analysis of key amino acids in wheat flour. J. Food Sci. 2003, 68, p. 2667-2671.
6. Zitka, O., Heger, Z., Kominkova, M. et al. Preconcentration based on paramagnetic microparticles for the separation of sarcosine using hydrophilic interaction li-quid chromatography coupled with coulometric detection. J. Sep. Sci. 2014, 37, p. 465-475.
7. Ryvolova, M., Taborsky, P., Vrabel, P. et al. Derivatization of amino acids, peptides and proteins for laser-induced fluorescence detection in capillary electrophoresis. Chem. Listy. 2006, 100, p. 191-195.
8. Fitzpatrick, W. H. Spectrophotometric determination of amino acids by the ninhydrin reaction. Science. 1949, 109, p. 469-469.
9. Yi, P., Liu, L., Mei, H. F. et al. Establishment of refe-rence range of plasma amino acids for younger Chinese children by reverse phase HPLC. J. Pediatr. Endocrinol. Metab. 2011, 24, p. 733-738.
10. Long, G. L., Winefordner, J. D. Limit of Detection A Closer Look at the IUPAC Definition. Analytical Che-mistry. 1983, 55, p. 712A-724A.
11. Szterk, A., Roszko, M. Simultaneous determination of free amino acids, L-carnosine, purine, pyrimidine, and nucleosides in meat by liquid chromatography/single quadrupole mass spectrometry. J. Liq. Chromatogr. Relat. Technol. 2014, 37, p. 664-680.
12. Cernei, N., Heger, Z., Gumulec, J. et al. Sarcosine as a Potential Prostate Cancer Biomarker-A Review. Int. J. Mol. Sci. 2013, 14, p. 13893-13908.
13. Elsberger, B., Lankston, L., McMillan, D. C. et al. Presence of tumoural C-reactive protein correlates with progressive prostate cancer. Prostate Cancer Prostatic Dis. 2011, 14, p. 122-128.
14. Chen, J., Zhang, J., Zhang, W. P. et al. Sensitive determination of the potential biomarker sarcosine for prostate cancer by LC-MS with N,N ‘-dicyclohexylcarbodiimide derivatization. J. Sep. Sci. 2014, 37, p. 14-19.
15. Sreekumar, A., Poisson, L. M., Rajendiran, T. M. et al. Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression. Nature. 2009, 457, p. 910-914.
16. Jiang, Y.Q., Cheng, X. L., Wang, C. A. et al. Quanti-tative Determination of Sarcosine and Related Compounds in Urinary Samples by Liquid Chromatography with Tandem Mass Spectrometry. Anal. Chem. 2010, 82, p. 9022-9027.
17. Sochor, J., Nejdl, L., Ruttkay-Nedecky, B. et al. Investigating the influence of taurine on thiol antioxidant status in Wistar rats with a multi-analytical approach. J. Appl. Biomed. 2014, 12, p. 97-110
18. Sinha, M., Manna, P., Sil, P. C. Taurine protects the antioxidant defense system in the erythrocytes of cadmium treated mice. BMB Rep. 2008, 41, p. 657-663
19. Olive, M. F. Interactions between taurine and ethanol in the central nervous system. Amino Acids. 2002, 23, p. 345-357
20. Marcinkiewicz, J., Kontny, E. Taurine and inflammatory diseases. Amino Acids. 2014, 46, p. 7-20
21. Dawiskiba, T., Deja, S., Mulak, A. et al. Serum and urine metabolomic fingerprinting in diagnostics of inflammatory bowel diseases. World J. Gastroenterol. 2014, 20, p. 163-174
22. Goudarzi, M., Weber, W., Mak, T. D. et al. Development of Urinary Biomarkers for Internal Exposure by Cesium-137 Using a Metabolomics Approach in Mice. Radiat. Res. 2014, 181, p. 54-64
23. Posada-Ayala, M., Zubiri, I., Martin-Lorenzo, M. et al. Identification of a urine metabolomic signature in patients with advanced-stage chronic kidney disease. Kidney Int. 2014, 85, p. 103-111
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2014 Issue 4-
All articles in this issue
- Realimentační syndrom – patobiochemie, iontové dysbalance a jejich korekce
- Harmonizace, standardizace, metrologická návaznost v roce 2014. Princip, význam, data.
- Stanovení železa a mědi v jaterní bioptické tkáni pacientů s různou jaterní patologií: diagnostický význam a vztah k sérovým parametrům železa a mědi.
- Oxidační stres u Alzheimerovy choroby a jeho důsledky
- Chromatografická charakterizace aminokyselinových profilů vzorků moči pacientů s karcinomem prostaty
- Využití proteinových biočipů v diagnostice ischemického poškození myokardu
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Realimentační syndrom – patobiochemie, iontové dysbalance a jejich korekce
- Oxidační stres u Alzheimerovy choroby a jeho důsledky
- Stanovení železa a mědi v jaterní bioptické tkáni pacientů s různou jaterní patologií: diagnostický význam a vztah k sérovým parametrům železa a mědi.
- Harmonizace, standardizace, metrologická návaznost v roce 2014. Princip, význam, data.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

