-
Medical journals
- Career
Harmonizace, standardizace, metrologická návaznost v roce 2014. Princip, význam, data.
: B. Friedecký 1,2; J. Kratochvíla 1
: SEKK spol. s r o. Pardubice 1; ÚKBD, Fakultní nemocnice, Hradec Králové 2
: Klin. Biochem. Metab., 22 (43), 2014, No. 4, p. 177-183
Harmonizace výsledků měření v klinických laboratořích je zcela nezbytná k dosažení klinické efektivity laboratorního vyšetřování, jeho finanční efektivity a k redukci rizika pacientů v diagnostických a terapeutických procesech, způsobeného chybami měření. Podstatou harmonizace je dosažení hodnot referenčních intervalů a rozhodovacích diagnostických limitů, nezávislých na použité metodě měření a na laboratoři měření provádějící. Nástrojem harmonizace výsledků je standardizace metod měření, realizovaná návazností rutinních metod na referenční postupy a materiály. Data, popisující realizaci a možnosti harmonizace jsou uvedena zejména na obecně přístupných stránkách IFCC, JCTLM, NIST, IRMM. Je pojednáno o Stockholmské deklaraci kvality standardizačních procesů, o nevhodně malé šíři standardizace, o nedostatečné úrovni její dokumentace ze strany výrobců.
Klíčová slova:
Standardizace, návaznost, harmonizace, referenční postupy, referenční materiály, výrobci diagnostik.Potřeba standardizace a harmonizace
Standardizace laboratorních vyšetření a analýz a z ní plynoucí harmonizace výsledků je výchozí podmínkou klinické efektivity, na důkazech založeného medicínského (evidence based) přístupu a v neposlední řadě ekonomické efektivity. Výsledek laboratorního vyšetření by měl být interpretován bez závislosti na metodě měření a na místě, kde (ve které laboratoři) je získán. Jinak je neekonomický (nutnost opakovaných vyšetření), klinicky neefektivní, nebo pro pacienta riskantní, protože vede k chybné nebo žádné diagnóze a terapii [1]. Podle Beastalla je standardizace první podmínkou tvorby v současnosti tolik módního výrazu „přidané hodnoty“ výsledků vyšetření v laboratorní medicíně. Je však otázkou, zda není podstatou tvorby hodnoty výsledku samotné.
Potřeba standardizace a harmonizace není zdaleka jen záležitostí laboratorní medicíny. Některé „atraktivní“ důsledky nedostatku standardizace v jiných oborech vyhledané, nebo přečtené na internetu si dovolujeme uvést:
- ztráta sondy NASA Mars Climate Orbiter v důsledku záměny metrického systému délkových měr za konvenční americký,
- německo-švýcarský most v Laufenburgu s diferencí 25 cm mezi oběma polovinami v důsledku různých standardů stanovení nadmořské výšky v obou státech,
- havárie kanadského letadla v důsledku záměny objemových jednotek při čerpání paliva (gallony vs. litry),
- vzájemné minutí dvou separátně stavěných úseků dálnice v Polsku více než o 1 km díky špatným plánům stavby u jedné ze skupin.
Principiálně stejné, ač ne zdaleka tak „atraktivní“ chyby se dějí i v klinických laboratořích celého světa denně ke škodě diagnostického procesu a zdraví lidí. Různé jednotky měření se používají zcela běžně a denně se s nimi můžeme setkat v mnoha klinických laboratořích a mnoha pracovních dokumentacích výrobců. Metrologická návaznost a standardizace měření není zdaleka na potřebné kvalitativní a kvantitativní úrovni a její nezbytnost není řadou pracovníků v laboratorní medicíně a výrobců ani dostatečně pociťována.
Potřeby soudobé lidské společnosti za současného stavu jejího rozvoje vyžadují podle nedávno uvedených prací v časopise Science přehodnocení spotřebních a produkčních (převážně globalizovaných) řetězců výroby, logistiky, spotřeby, pokud mají vést k prospěchu lidí, k ekonomice spotřeby surovin a zdrojů, k regulaci hrozící anarchie, plýtvání, nedostatku, k minimalizaci ekologických škod [2]. Jde o to přeměnit málo uspořádanou anarchickou síť v regulovaný řetězec standardizovaných procesů. Jde o zvětšené, ale v podstatě totožné pojetí, jako u laboratorní medicíny a tato snaha o řád se i slovně označuje zcela stejně jako standardizace a návaznost v laboratorní medicíně.
Pracovní skupiny IFCC a webové stránky IFCC – nástroj standardizace a zdroj dat
Kdo, a s jakou intenzitou a jakými výsledky, se zabývá standardizací měření a harmonizací výsledků měření? Odpověď můžeme hledat při sledování webových stránek IFCC (Mezinárodní federace klinické chemie a laboratorní medicíny). V současnosti je aktivních 23 pracovních skupin IFCC (WG-IFCC), zabývajících se různými aspekty standardizace. Jejich seznam je uveden na www.ifcc.org (na portálu „Scientific Activities v sekci SD Working Group – SD znamená Scientific Divisions a také v práci [3]. Nejzajímavější pracovní skupiny IFCC jsou uvedeny v Tabulce 1.
1. List of some interesting and important IFCC working groups in 2014 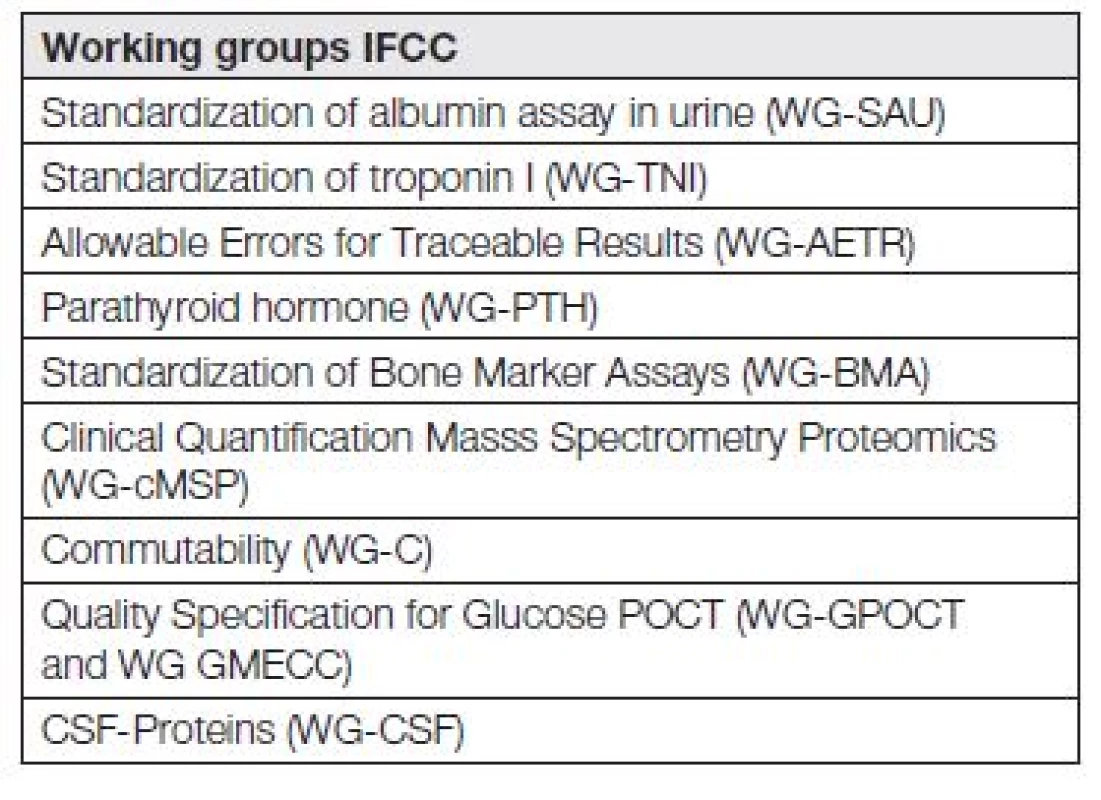
Stav standardizace, metrologické návaznosti, referenční materiály a referenční metody jsou k nalezení v obecně přístupných datových souborech na webových adresách www.ifcc.org, nebo www.bipm.org - portál JCTLM Data base. (JCTLM - Joint Committee on Traceability in Laboratory Medicine - Společná komise pro návaznost v laboratorní medicíně. Je součástí Mezinárodního úřadu pro míry a váhy v Sévres -BIPM -Bureau International des Poids et Mesures).
Na uvedeném portálu JCTLM lze snadno získat přehled o aktuálním stavu světové standardizace vyhledáním:
- analytů a matricí
- referenčních metod
- referenčních materiálů
- referenčního servisu (kalibrátory, kontrolní materiály, data a adresy referenčních laboratoří a poskytovatelů, odkaz na EHK (externí hodnocení kvality referenčních laboratoří RELA).
Informace lze precizovat a lepší přehled získat na adresách pro zdroje klíčových referenčních materiálů, včetně jejich certifikátů:
- NIST – National Institute of Standards and Technology www.nist.gov – portál Standard Reference Material – orgán USA
- IRMM Institute for Reference Material and Methods https://ec.europa.eu/jrc/irmm – portál Standard Materials – orgán EU.
Obecná recentní shrnutí o standardizaci/harmonizaci jsou obsažena v pracích [4, 5].
První uvedená práce Grega Millera a spol. klade důraz na harmonizaci všech tří fází procesu laboratorního vyšetření (preanalytická, analytická, postanalytická) a na plán činnosti nově utvořené komise pro účel harmonizace ICHCRL (International Consortium for Harmonization of Clinical Laboratory Results). Tato komise však zatím nebyla obecně podpořena zejména evropskými referenčními institucemi. Druhá uvedená práce, italská, klade důraz na dostatek informací od výrobců. Tento nedostatek, nejasnost a neúplnost odborných informací výrobců se zdá být nejslabším článkem řetězu v procesu celosvětové standardizace v laboratorní medicíně vůbec. Další důraz je položen na dostatek informací z klinických laboratoří (z verifikačních procesů) a na informace z programů externích hodnocení kvality. Vychází se přitom z názoru, že dobře prováděné programy EHK (v ideálním případě založené na referenci a metrologické návaznosti hodnot kontrolních materiálů) s dobře provedeným hodnocením výsledků měření jsou cenným, ne-li nejcennějším nástrojem sledování stavu standardizace.
Stockholmská deklarace kvality referenčních intervalů a rozhodovacích limitů
Obecné a doposud platné zásady kvality referenčních intervalů a rozhodovacích limitů a jejich naprosté závislosti na kvalitě (to jest standardizace měření a harmonizace výsledků) byly přijaty již v roce 1999 ve Stockholmu. Dohodli se na nich zástupci 27 zemí a podepsali je tehdy špičkoví experti (S. Ehrmayer, C. Fraser, P. Hyltoft Petersen, A. Kallner, G. Klee, C. Ricós, L. M. Thienpont, J. Westgard a další). Podstatou Stockholmské deklarace jsou následující zásady:
- Klinické cíle diagnózy a léčby jsou závislé na analytické kvalitě použitých metod měření
- Indikátory analytické kvality (preciznost, bias, chybu, nejistotu lze kvantifikovat pomocí biologických variabilit, nebo podle požadavků kliniků
- K dosažení jejich požadovaných hodnot mají sloužit příslušná doporučení na mezinárodní, národní a někdy i místní úrovni
- Požadavky na kvalitu metod měření mají být formulovány pomocí programů EHK a činností akreditačních orgánů
- Analytické požadavky na metody mají být odvozeny z dat EHK a z dat, publikovaných v odborné literatuře.
Je nasnadě, že tato kritéria jsou obecně nadále platná, že by se jimi měla řídit jak činnost laboratoří, tak i produkce diagnostik a analytických měřících systémů. Stejně jasné je, že hlavním nástrojem k jejich dosažení je standardizace metod a metrologická návaznost kalibrace. A neméně jasné je i to, že je dosud mnoho problémů v realizaci těchto základních kritérií i 15 let po jejich publikování [6].
Aktuální stav v pracovních skupinách IFCC pro standardizaci a metrologickou návaznost
Aktuání stav byl souhrnně uveden v speciálním čísle časopisu Clinical Chemistry and Laboratory Medicine (2013, 51, číslo 5), přístupném členům ČSKB.
Popis současného stavu referenčního systému měření albuminu v moči uvádí publikace [7]. Zatím je k dispozici ředěný referenční materiál ERM DA 470k/IFCC, zatímco podstatně vhodnější lidský purifikovaný monomerní albumin je dosud ve stavu dlouhodobého testování. Vnitřní standard, potřebný k navrhované referenční LCMS/MS metodě 25N-albumin není zatím komerčně přístupný. Referenční metoda na principu LC MS/MS, vyvinutá na Mayo Clinic, je v současnosti validována pracovníky NIST.
Věčný problém představují vhodné hodnoty tolerančních mezí při mezilaboratorních porovnáváních standardizovaných metod měření. Pracovní skupina rozeznává dva přístupy řešení problému. První na bázi biologických variabilit, druhý na bázi statistického hodnocení replikátů měření. Ale závěry jsou neurčité a konstatující potřebu zlepšit kvalitu testovacích souprav tak, aby vyhovovala klinickým požadavkům, ovšem žel opět bez náležité konkretizace například založené na požadavcích lepší kvality a metrologické návaznosti kalibrátorů. Nevyhnutelnou podmínkou objektivizace tolerančních mezí je opět standardizace a minimalizace hodnot bias, tedy potřeba „unbiased“ metod [8].
Teoretické podklady standardizace (normy ISO 17511 a ISO 18153) zůstávají stejné od roku 2003 (začaly se revidovat teprve v roce 2013), stále platí pro IVD prostředky (kity a měřící systémy), avšak důslednost a rychlost jejich aplikace jsou stále nedostatečné [9].
Velmi aktuální je činnost nově fungující pracovní skupiny, zabývající se měřením glukózy v POCT režimu. Zabývá se kvalitou měření, edukací obsluhy a indikací výsledků měření a jejich interpretací a dále spoluprací s výrobci. Aktuální (ovšem rychle se měnící profil výrobků - glukometrů) je zachycen v práci kolektivu autorů [10]. Práce je zejména zaměřena na edukaci, která by měla zabránit hrubým chybám a je také popsána kalibrace u jednotlivých přístrojů. Její údaje se velmi vhodně doplňují s daty skandinávské organizace SKUP (Scandinavian evaluation of laboratory equipment for primary health care), obecně dostupnými na webové adrese www.skup.nu.
Žádný nový vývoj nehlásila pracovní skupina pro standardizaci stanovení glykovaného hemoglobinu HbA1c. Výsledky je nadále možné navzdory riziku omylů a problémům s jednotnou interpretací vyjadřovat ve dvou jednotkách a to základní jednotky IFCC - mmol/mol a jednotky americké NGSP % [11]. Na webu www.ngsp.org je k nalezení souhrn faktorů, ovlivňujících výsledky stanovení HbA1c vlivem přítomnosti variant patologických hemoglobinů a změny doby života erytrocytů, rozpracované pro jednotlivé metody měření, používané v klinických laboratořích (data jsou z roku 2013).
Pracovní skupina pro standardizaci stanovení PTH pracuje pomalu na řešení neúnosné situace kolem srovnatelnosti výsledků. K použití je připraven pozitivně otestovaný referenční materiál IS 95/646 [12]. Dalším nezbytným prvkem standardizace je vývoj referenční metody, která využívá principu hmotnostní spektrometrie. Recentní informace o této metodologii jsou uvedeny v práci [13].
Velmi zajímavé a tématicky zcela nové je sdělení pracovní skupiny IFCC o proteomice. Shrnuje řadu základních informací o preanalytických aspektech, o postupech preanalytických úprav vzorků, vlastních zásadách všech používaných metod hmotnostní spekt-rometrie až ke kalibraci a kontrole kvality [14].
V této souvislosti je i proponovaná strategie k harmonizaci metod LC-MS/MS, které pro řadu stanovení analytů a parametrů slouží často v laboratorní medicíně jako referenční [31]. Patří mezi ně procesy:
- Přezkoumávání rozsahu harmonizace metod a měřených analytů a parametrů a definice odpovídajících cílů analytické kvality
- Určení příčin nedostatečné harmonizace
- Používání společných komutabilních a metrologicky návazných kalibrátorů k optimalizaci LC-MS/MS metod mezi jednotlivými laboratořemi
- Vytvoření společných LC-MS/MS referenčních intervalů a klinických rozhodovacích mezí
- Vytvoření doporučení a pokynů a využití osvědčených postupů pro laboratoře pracujících s LC-MS/MS a jejich klinické využití
- Účast v programech externího hodnocení kvality a průběžné prověřování harmonizace takto získaných výsledků měření.
Externí hodnocení kvality referenčních laboratoří RELA (http://www.dgkl-rfb.de:81/index.shtml), akreditovaných podle ISO 15195 nebo ISO 17025 vykazuje osmileté zkušenosti. Jsou zajímavé, a závěry z jejich výsledků by nepochybně ovlivnily i realističtější pohled na možnosti rutinních laboratoří a požadavky klinických lékařů a také by mohly pozitivně regulovat činnost organizátorů programů EHK [15]. Tabulka 2 je uvedena pro orientaci toho, s jakou rozdílnou rozšířenou nejistotou Uc jsou schopné v současnosti referenční laboratoře (v kontrolních cyklech RELA) měřit; reálná skutečnost je tedy o něco horší, než očekávaná a požadovaná (viz například stanovení kreatininu a kyseliny močové).
2. Systematic differences in expanded uncertainty Uc of reference laboratories in RELA schema for selected analytes in 2013 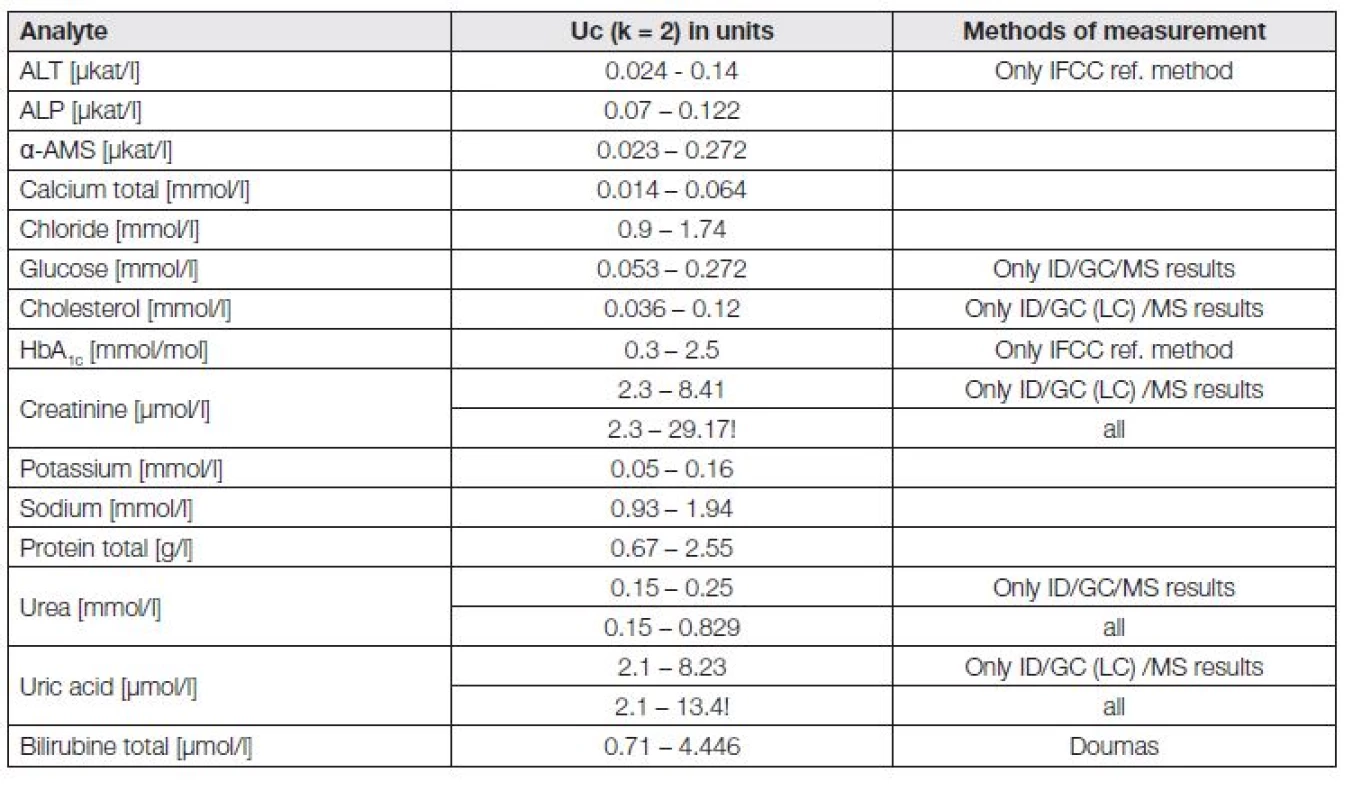
Nejcennějším výstupem standardizace je vedle srovnatelnosti výsledků měření i dosažení vysoké úrovně srovnatelnosti referenčních intervalů bez závislosti na použité metodě a laboratoři, závislých jen na vlivu věku, pohlaví a etnických faktorů. Popis postupu multicentrických studií k jejich dosažení je shrnut v práci [16].
Trvání procesu standardizace a jeho respektování výrobci
Délka trvání procesu standardizace je obvykle nepřiměřeně dlouhá. K demonstraci této skutečnosti uvádíme případy klinicky extrémně důležitých stanovení cystatinu C v séru a stanovení glykovaného hemoglobinu HbA1c v plné krvi. V případě cystatinu C uběhly mezi publikací oznámení o produkci certifikovaného referenčního materiálu ERM-DA/471/IFCC, umožňujícího standardizaci k zavedení společné kalibrace od něj odvozené u významných světových výrobců čtyři roky [17, 18]. Od publikace IFCC referenčního systému měření pro stanovení glykovaného hemoglobinu HbA1c uplynulo plných osm let k jeho všeobecnému akceptování [19, 20]. Tento celosvětový konsensus byl současně publikován také v časopisech Clinical Chemistry, Clinical Chemistry and Laboratory Medicine, Annals of Clinical Biochemistry, Diabetologia, Diabetes Research and Clinical Practice, Diabetes Medicine a Pediatric Diabetes, takže lze mluvit o opravdu celosvětovém rozšíření.
Standardizační omyly - dvě demonstrace
Enzymy jsou právem považovány za měření, kde bylo vykonáno značné a úspěšné standardizační úsilí. Nicméně případy stanovení ALP a α-AMS ukazují velké mezery standardizačního procesu, způsobené neinformovaností a nepřiměřeně nízkým zájmem výrobců.
Řada výrobců deklaruje ve svých pracovních protokolech u metod pro stanovení ALP návaznost na IFCC metodu, ačkoliv za ní chybně považuje metodu vytvořenou v roce 1983 pro teplotu inkubace 30 ˚C [21], zatímco teplotou inkubace pro referenční metody IFCC měření enzymů je již řadu let 37 ˚C. Metoda stanovení ALP je tedy řadou výrobců omylem považována za standardizovanou i v případech, kdy tomu tak není. Diference, které jsou jasně patrné ve výsledcích programů mezilaboratorního porovnávání EHK, nejsou brány v úvahu jako signál ke korekci situace, protože hodnocení probíhá po skupinách metod jednotlivých výrobců a za této situace chybí schopnost identifikace problému a motivace k jeho řešení. Když byli v roce 2013 výrobci, působící na českém trhu dotázáni malým a jednoduchým dotazníkem na složení reagencií jejich metod, odpověděli jen dva z nich.
Skutečná referenční IFCC metoda pro stanovení ALP, publikovaná v roce 2011, není zatím v širším měřítku aplikovaná při kalibraci rutinních metod, ačkoliv je dostatečně otestovaná v programu RELA již od roku 2010 [22].
Referenční postup měření alfa-amylázy dle IFCC je popsán v práci [23]. Substrátem IFCC metody je EPS - 4 nitrofenyl-maltoheptaosid. Metoda s 2-chloro-4 nitrofenyl-maltotriosidem jako alternativním substrátem byla údajně srovnatelná a návazná na IFCC metodu pokud byl použit komutabilní kalibrátor [24]. Jak je kalibrována metoda Dimension Siemens, používající na rozdíl od metod ostatních výrobců tohoto substrátu a stabilně a dlouhodobě poskytující v programu EHK SEKK významně vyšší výsledky měření (o cca 15 – 20 % již po dobu minimálně pěti let) se nelze z pracovních protokolů firmy dozvědět.
Kolik analytů je v praxi harmonizovaných?
Cílem harmonizace je srovnatelnost výsledků měření bez ohledu na použitou metodu a bez rozdílu lokalizace klinické laboratoře. Prostředkem k dosažení cíle je standardizace, zajištěná návazností kalibrace rutinní metody na referenční metodu a certifikovaný referenční materiál. Nicméně návaznost není automaticky funkční ve všech případech. Podle práce [25] je stanovení kreatininu v séru návazné jak u enzymatické, tak i u Jaffého metody (u ní po aritmetické „kompenzaci“). Opakovaně se však ukazuje, že Jaffého metody jsou příliš nespecifické a ani návaznost na referenci nevyřeší riziko systematických diferencí zejména u kritických koncentrací na hranici mezi normální a sníženou hodnotou eGFR [26].
Teprve za podmínek standardizace lze stanovit obecně platné hodnoty referenčních intervalů, závislých pouze na věku, pohlaví a etnicitě, nikoliv na metodě a laboratoři. Jen u zlomku analytů, které jsou měřeny v klinických laboratořích lze harmonizovat jejich výsledky tak, aby bylo možné získat obecně platné hodnoty referenčních intervalů. Přehledná práce o tvorbě referenčních intervalů a o všech jejich aspektech (preanalytickém výběru referenční populace, štěpení (partitioning) výsledků na skupiny podle věku a pohlaví, standardizace analytické části procesu, statistické zpracování naměřených dat) je uvedena v práci F. Cerriottiho a spol. [27].
U všeobecně známé skandinávské multicentrické studie NORIP 2000 byly stanoveny harmonizované hodnoty referenčních intervalů pouze u 25 běžných analytů a parametrů [28].
U novějších, ještě mnohem rozsáhlejších asijských a japonských multicentrických studií, provedených o asi 10 let později, dosáhl počet analytů s harmonizovanými referenčními intervaly 32, navíc i s 8 hematologickými analyty a parametry [29, 30].
Důsledky systematických chyb
Existence systematických chyb měření má závažné konsekvence:
- nedostatečnou srovnatelnost výsledků měření při použití různých metod
- diference v hodnotách referenčních intervalů a klinických rozhodovacích mezí
- nedostatečné zohlednění analytické kvality a odhadů nejistoty v lékařských doporučeních i v interpretacích výsledků měření.
Hodnocení účastníků po metodických skupinách bez ohledu na stav standardizace a kvalitu kontrolního materiálu, neujasněnost koncepce komutability (kdy se zdá, že mírou nekomutability je především potřeba hodnocených laboratoří a firem „získat certifikát“ a ne skutečný stav kvality kontrolního materiálu), působí na snahu o adekvátní kvalitní a metrologicky návaznou kalibraci demotivačně. Výsledky EHK nejsou jen kladnou a formální položkou do akreditačního portfolia laboratoří a do složek PR firem, ale nenahraditelnou složkou monitorování kvality měření, metod, výroby a obsluhy. Standardizace a kvalitní kalibrace vlastního analytického měřícího systému je při měření základních analytů séra v současnosti úkolem číslo 1, hlavně jako nezbytná podmínka efektivního a bezpečného hodnocení výsledků pacientů k účelům správné diagnostiky a terapie.
Pro budoucnost, kdy patrně do diagnosticko-terapeutických „her“ při vyšetřování laboratorních parametrů vstoupí rychlé nelaboratorní metody a elektronický přenos laboratorních dat, bude standardizace hrát roli naprosto zásadní.
Harmonizace a pracovní návody výrobců
Procesy harmonizace a standardizace v klinické laboratoři musí mít ke svému realizování spolehlivou oporu ve výrobcích testovacích souprav. Situace však není v tomto směru vůbec dobrá. Několik příkladů toto tvrzení demonstruje dostatečně.
Program firemní mezilaboratorní kontroly kvality firmy Randox RIQAS měl v roce 2013 (cyklus 48 vzorek 2) ještě 14 % účastníků, používajících k měření ALP „třetihorní“ metody s Tris pufrem (King Armstrong), nebo s dietanolaminem. 25 % účastníků označovalo své metody jako IFCC, ovšem bez bližší specifikace (IFCC dle 1983 nebo 2011?). Rozpětí průměrů stejnorodých skupin bylo 4,1-7,91 µkat/l ALP (Roche - dietanolamin).
V řadě zemí přetrvává používání kitů malých, často domácích výrobců, bez patřičné dokumentace metrologické návaznosti, používaných v heterogenních, nedostatečně validovaných analytických systémech. Výsledkem jsou enormní hodnoty bias. Příkladem jsou studie, provedené nedávno v Argentině. Bias při měření celkového Ca v séru byl v intervalu -11 % až 22 %, u albuminu dosahoval až -27 %. Při stanovení kreatininu je kromě otestovaných a mezinárodně validovaných (provedeno v NKDEP) homogenních metod globálních výrobců (Roche, Abbott, Siemens, Beckman, Ortho Vitros) v užívání celá řada kitů (v 89 % laboratoří) malých v národních měřítcích působících distributorů kitů, bez metrologické návaznosti na referenční materiál SRM 967, bez informací a specifikací pracovních kalibrátorů respektive s informacemi specifikovanými, ale zcela zastaralými. Výsledkem (opět v Argentině - z jiných zemí nejsou zřejmě ani informace) jsou hodnoty bias až +58 %. I u nás známe takové „no name“ distributory, zejména v oblasti POCT [31, 32].
Závěr
Podmínkou dosažení harmonizace výsledků je standardizace měření, založená na návaznosti rutinních metod na referenční metody a materiály.
Harmonizace výsledků měření je nezbytnou podmínkou existence relevantních hodnot referenčních intervalů a diagnostických rozhodovacích mezí.
Proces standardizace měření, podmiňující dosažení harmonizace výsledků je pomalý a zůstává omezený na malý počet analytů.
Data, potřebná k orientaci v problémech standardizace a harmonizace jsou snadno a obecně přístupná.
U již standardizovaných metod jsou často pozorovány signifikantní systematické diference, jejichž zdrojem jsou diference mezi kalibračními funkcemi u metod různých výrobců.
Výrobci nabízejí na trhu společně se standardizovanými metodami i starší, nestandardizované verze metod, čímž způsobují významný pokles efektivity harmonizace výsledků.
Podpořeno MZ ČR – RVO (FNHK, 00179906)
Do redakce došlo 10. 6. 2014
Adresa pro korespondenci
RNDr. Bedřich Friedecký, Ph.D.
SEKK s. r. o.,
Za pasáží 1609,
530 02 Pardubice
e-mail: friedecky@sekk.cz
Sources
1. Beastall, G. H. Adding value to laboratory medicine: a professional responsibility. Clin. Chem. Lab. Med., 2013, 51, p. 221-227.
2. Wible, B., Mervis, J., Wigginton, N. S. Rethinking the global supply chains. Science, June 2014, p. 1000-1003.
3. Gillery, P., Young, I. S. Progress towards standardization: an IFCC Scientific Division Perspective. Clin. Chem. Lab. Med., 2013, 51/5, p. 915-917.
4. Miller, W. G., Tate, J. R., Barth, J. H., Jones, G. R. D. Harmonization: the sample, the measurement, and the report. Ann. Lab. Med., 2014, 34, p. 187-197.
5. Braga, F., Panteghini, M. Verification of in vitro medical diagnostics (IVD) metrological traceability: Responsibilities and strategies. Clin. Chim. Acta, 2014, 432, p. 55-61.
6. Sikaris, K. Application of the Stockholm Hierarchy to Defining the Quality of Reference Intervals and Clinical Decision Limits. Clin. Biochem. Rev., 2012, 33, p. 141-148.
7. Lieske, J. C., Bondar, O., Miller, G. W., Bachmann, L. M., Narva, A. S., Itoh, Y. et al. A reference system for urinary albumin: current status. Clin. Chem. Lab. Med., 2013, 51, p. 981-990.
8. Bais, R., Armbruster, D., Jansen, R. T. P., Klee, G., Panteghini, M. et al. Defining acceptable limits for the metrological traceability of specific measurands. Clin. Chem. Lab. Med., 2013, 51, p. 973-979.
9. Siekmann, L. Metrological traceability. A concept for standardization in laboratory medicine. Clin. Chem. Lab. Med., 2013, 51, p. 953-957.
10. Tirimacco, R., Koumantakis, G., Erasmus, R., Mosca, A., Sandberg, S., Watson, I. D. et al. Glucose meters - fit for clinical purpose. Clin. Chem. Lab. Med., 2013, 51, p. 943-952.
11. Hanas, R., John, W. G. 2013 update on the worldwide standardization of the hemoglobin A1c measurement. Clin. Chem. Lab. Med., 2013, 51, p. 1041-1043.
12. Sturgeon, C. M., Sprangue, S. H., Metcalfe, W. Variation in parathyroid hormone immunoassays results - a clinical governance issue in the management of chronic kidney disease. Nephrol. Dial. Transplant., 2011, 26, p. 3440-3445.
13. Couchman, L., Taylor, D. R., Krastins, B., Lopez, M. F., Monitz, C. F. et al. LC-MS candidate reference methods for the harmonization of parathyroid hormone (PTH) measurement: a rewiew of recent developments and future considerations. Clin. Chem. Lab. Med., 2014. DOI:101515/cclm-2014-0150.
14. Lehmann, S., Hoofnagle, A., Hochstrasser, D., Brede, C., Glueckmann, M. et al. Quantitative Clinical Chemistry Proteomics (qCCP) using mass spectrometry: general characteristics and application. Clin. Chem. Lab. Med., 2013, 51, p. 919-935.
15. Kessler, A., Siekmann, L., Weykamp, C., Geilenkeuser, W. J., Dreazen, O., Middle, J., Schumann, G. External Quality Assessment Scheme for reference Laboratories - rewiews of 8 years experience. Clin. Chem. Lab. Med., 2013, 51, p. 997-1005.
16. Ozarda, Y., Ichihara, K., Barth, J. H., Klee, G. Protocol and standard operating procedures for common use in a worldwide multicenter study on reference values. Clin. Chem. Lab. Med., 2013, 51, p. 1027-1040.
17. Grubb, A., Blirup-Jensen, S., Lindstroem, V., Schmidt, C., Althaus, H., Zegers, I. First certified reference material for cystatin C in human serum ERM-DA471/IFCC. Clin. Chem. Lab. Med., 2010, 48, p. 1619-1621.
18. Grubb, A., Horio, M., Hansson, L. O., Bjoerk, J., Nyman, U., Flandin, M. et al. Generation of a new cystatin C-based estimating equation for glomerular filtration rate by use of 7 assays standardized to the international calibrator. Clin. Chem., 2014. E pub ahead print.
19. Jeppsson, J. O., Kobolt, U., Barr, J., Finke, A., Hoelzel, W., Hoshino, T. et al. Approved IFCC reference method for the measurement of HbA1c in human blood. Clin. Chem. Lab. Med., 2002, 40/1, p. 78-89.
20. Hanas, R., John, G. 2010 consensus statement on the worldwide standardization of the hemoglobin A1c measurement. Diabetes Care, 2010, 33, p. 1903-1904.
21. Tietz, N. W., Burtis, C. A., Duncan, P., Ervin, K., Petitclerc, C. J., Rinker, A. D. et al. A reference method for measurement of alkaline phosphatase activity in human serum. Clin. Chem., 1983, 29, p. 751-761.
22. Schumann, G., Klauke, R., Canallias, F., Bossert-Reuther, S., Franck, P. F. H., Gella, F. J. et al. IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37˚C. Part 9: Reference procedure for the measurement of catalytic concentration of alkaline phosphatase. Clin. Chem. Lab. Med., 2011, 49, p. 1439-1446.
23. Schumann, G., Aoki, R., Ferrero, C. A., Ehlers, G., Férard, G., Gella, F. J. et al. IFCC primary reference procedures for the measurement of catalytic concentrations of enzymes at 37 degrees C. Part 8. Reference procedure for the measurement of catalytic concentration of α-amylase. Clin. Chem. Lab. Med., 2006, 44, p. 1146-1155.
24. Canalias, F., Garcia, E., Sanchez, M. Metrological traceability of values for alpha-amylase catalytic concentration assigned to a commutable calibrator materials. Clin. Chim. Acta, 2010, 411, p. 7-12.
25. Greenberg, N., Roberts, W. L., Bachmann, L. M., Whight, E. C., Dalton, R. N. et al. Specificity characteristics of 7 cpommercial creatinine measurement procedures by enzymatic and Jaffe method principles. Clin. Chem., 2012, 58, p. 391-401
26. Hermida, F. J., Lorenzo, M. J., Perez, A., Fernandez, M., Sogastiora, O., Magadan, C. Comparison between ADVIA enzymatic creatinine method and ADVIA creatinine kinetic Jaffe method for determining creatinine. Scand. J Clin. Lab. Invest, 2014 DOI 103109/00365513. 2014. 928943.
27. Cerriotti, F., Hinzmann, R., Panteghini, M. Reference intervals: the way forward. Ann. Clin. Biochem., 2009, 46, p. 8-17.
28. Rustad, P., Felding, P., Franzson, L., Kairisto, A., Lahti, A., Martenson, A. et al. The nordic reference interval project 2000: recommmended reference intervals for 25 common biochemical properties. Scand. J Clin. Lab. Invest, 2004, 64, p. 271-284.
29. Ichihara, K., Cerriotti, F., Tam, T. H., Suyehoshi, S., Poon, P. M. K., Thong, M. L. et al. The Asian pro-ject for collaboratove derivation of reference intervals: (1) strategy and major results of standardized analytes. Clin. Chem. Lab. Med., 2013, 51, p. 1429-1442.
30. Yamamoto, Y., Hosogaya, S., Osawa, S., Ichihara, K., Onuma, T., Saito, A. et al. Nationalwide multicenter study aimed at the establishment of common reference intervals for standardized clinical laboratory tests in Japan. Clin. Chem. Lab. Med., 2013. 51, p. 1663-1672.
31. Stepman, H. C. M., Stöckl, D., Ademe, R., Sesini, S., Mazziotta, D., Thienpont, L. M. Status of serum calcium and albumin measurement in Argentina assessed in 300 representative laboratories with 20 fresh frozen single donation sera. Clin. Chem. Lab. Med., 2011, 49, p. 1829-1836.
32. Myers, G. L. Standardization of creatinine: finally achieved? 7th CIRME International Scientific Meeting 2013, Stresa Italy.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2014 Issue 4-
All articles in this issue
- Refeeding syndrome – pathobiochemistry, electrolyte dysbalances and their correction
- Harmonization, standardization, metrologic, succession in 2014. Principles, importance and data.
- Liver Iron and Copper Assessment in Bioptic Material from Patients with Different Hepatic Pathology – Diagnostic Significance and Relationship to Serum Iron and Copper Parameters
- Role of oxidative stress in Alzheimer´s disease and related consequences
- Chromatographic characterization of amino acid profiles in urinary samples of patients suffering from prostate carcinoma
- Use of the protein biochip in the diagnosis of the myocardial ischemic damage
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Refeeding syndrome – pathobiochemistry, electrolyte dysbalances and their correction
- Role of oxidative stress in Alzheimer´s disease and related consequences
- Liver Iron and Copper Assessment in Bioptic Material from Patients with Different Hepatic Pathology – Diagnostic Significance and Relationship to Serum Iron and Copper Parameters
- Harmonization, standardization, metrologic, succession in 2014. Principles, importance and data.
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

