-
Medical journals
- Career
Stopové prvky v kritických stavech. Část 1: zinek a železo
: A. Kazda; H. Brodská
: Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN Praha
: Klin. Biochem. Metab., 21 (42), 2013, No. 4, p. 197-202
Problematika metabolismu a úhrady stopových prvků u nemocných v kritických stavech se výrazně liší od jejich metabolismu a potřeby za podmínek fyziologických nebo při onemocněních méně závažných. Kriticky nemocní mohou ztrácet v běžné praxi neměřitelná množství těchto prvků sekrety ze sond, drénů, píštělí, krvácením a odběry krve. Naopak neměřitelná množství přijímají díky kontaminaci infuzí nebo formou příměsí do roztoků parenterální výživy a v albuminu i transfuzemi. Stopové prvky mají klíčový význam pro zmírnění oxidačního stresu. V souvislosti s kritickými stavy jsou nejčastěji diskutovány zinek, železo, měď a selen.
V první části našeho sdělení je pozornost věnována zinku a železu. U obou těchto prvků dochází díky interleukinům v reakci na trauma a infekci k redistribuci z plazmy do tkání. Je to chápáno jako snaha odstranit z oběhu elementy, které by podporovaly mikrobiální růst. Vzhledem k významu zinku pro proteosyntézu a železa pro erytropoézu došlo v řadě klinických pokusů ke snahám tyto prvky suplementovat. Nicméně dodnes končí jak práce experimentální, tak studie klinické i přehledy problematiky varováním před jejich zvýšenou suplementací kriticky nemocným. V práci jsou popsány i komplikace nadměrného přívodu obou prvků až intoxikace, které mohou být samy příčinami kritických stavů.Klíčová slova:
zinek, železo, trauma, systémový zánět, kritický stav.Úvod
Vlna zájmu o mikronutrienty se zvedla s rozvojem parenterální výživy, tj. od 70. let. Postupně se na trh dostala řada přípravků výživy parenterální (p. v.) a enterální (e. v.), které obsahují denní, obecně doporučované dávky stopových prvků (STP) a vitaminů. Tím je, při zjednodušeném pohledu, tato část nutriční podpory zajištěna, a tudíž není vyšetřování mikronutrientů od oddělení klinické biochemie příliš požadováno.
Realita je ale taková, že tělesné zásoby a dostupnost mikronutrientů pro potřeby metabolismu jsou u nemocných v kritických stavech často výrazně ovlivněny povahou onemocnění, jeho tíží, trváním, komplikacemi i předchozím stavem nutrice a jejím složením. Tak např. dávky zinku (Zn), nebo selenu (Se) často výrazně přesahují běžné potřeby, i když přísun prvního z nich může být problematický, jak je dále rozvedeno. Jindy jsou naopak přiváděny standardní dávky nemocným, kteří mohou mít příjem některého stopového prvku dostatečný nebo nadbytečný, jak může vznikat např. díky kontaminaci roztoků p. v. chromem.
Stopové prvky a oxidační metabolismus
Při zvýšení oxidačního stresu, k němuž v kritických stavech dochází, se zvyšují vysoce aktivní formy kyslíku s nepárovými elektrony. Nejvýznamnější volné radikály jsou superoxidový (O2. - ), perhydroxylový (.O2H) a hydroxylový (.OH). Mohou způsobit oxidační poškození, zvláště nenasycených mastných kyselin v buněčných membránách i poškození molekul DNA. Tělo má vypracovaný sofistikovaný systém, který toto potenciální nebezpečí omezuje. Ochranné mechanizmy zmírňují oxidační aktivity pomocí kompletních molekul, jako jsou vitaminy A, E, i enzymové systémy, závislé na STP a určené k likvidaci produktů oxidace.
Mezi enzymy je klíčová superoxiddismutáza (SOD). Ta mění superoxidové radikály na H2O2. V mitochondriích je závislá na manganu (Mn), v cytoplazmě na Zn a mědi (Cu). V cirkulaci má na aktivitu SOD vliv ceruloplazmin, bílkovina vázající Cu. Vzniklého H2O2 se zbavujeme oxidací glutathionu v přítomnosti glutathionperoxidázy, závislé na Se. A konečně zametačem volných radikálů je i metalothionein, bílkovina bohatá na cystein, která redukuje volné radikály sulfhydrylovými skupinami. Pro aktivitu vyžaduje Zn a Cu. Je to reaktant akutní fáze při oxidačním hypermetabolismu.
Suplementace STP v kritických stavech
Studie se nejčastěji týkají Zn, Se, Cu a železa (Fe) [1]. Při reakci akutní fáze v odpovědi na trauma nebo sepsi působí interleukiny IL-1 a IL-6 redistribuci sérového Zn a Fe. Z cirkulace se tak odstraňují elementy, podporující růst bakterií. Zn je komplexně vázán v metalothioneinu a Fe je vázáno na ferritin a laktoferrin. Naopak kuprémie po přechodném minimálním poklesu během prvního dne dále neklesá, ale už během tří, čtyř dnů naopak stoupá. Je to díky uvolňování z jater a vazbě na ceruloplazmin. Pokles selenémie se vysvětluje jeho zvýšenou potřebou na antioxidační reakce. Zatímco suplementace Zn a Fe je do současné doby považována za riskantní a suplementace Cu se doporučuje jen ve vybraných situacích (viz dále), je suplementace Se jednoznačně doporučována a diskutují se jen optimální dávky.
Problémy bilančního sledování a monitorování léčby
Těchto problémů je více:
- Efekt podání lze těžko hodnotit klinicky. Klinickému obrazu dominují příznaky základního onemocnění a efekty léčby.
- Ztráta elementů tělesnými tekutinami. Drény, gastrické aspiráty, hnis, peritoneální výpotky a hemodialyzát vedou ke ztrátám STP. Při krvácení i odběrech krve je ztráceno Fe.
- Příjem STP jako kontaminačních složek. Krevní produkty, zvláště albumin, obsahují Zn a Cu i potenciálně toxické aluminium (Al). Parenterální výživa, zvláště roztoky aminokyselin, se liší obsahem STP. Roztoky užívané pro dialýzu a peritoneální dialýzu obsahují Cr a Al.
- Efekt katabolismu. Při katabolismu svalů se jejich intracelulární složky, včetně Zn, dostávají do krve. Tak mohou být potřeby Zn v dalších tkáních po určité období kryty a externě přiváděný Zn je vylučován do moče.
- Požadavky na energii a dusík jsou v akutních stavech zvýšeny. Protože jsou mnohé STP přímo součástí struktury enzymů, nebo kofaktory enzymových aktivit, lze předpokládat přímou úměrnost mezi zvýšenými požadavky na energii, bílkoviny a STP, resp. i jejich redistribuci.
Jako ilustrace ke zmíněné problematice bilancování STP v kritických stavech může sloužit bilanční sledování Cu, Se a Zn u 11 nemocných s těžkými traumaty [2]. Autorka sledovala ztráty těchto elementů všemi výše zmíněnými cestami denně týden. Ztráty jednoduše měřitelné, tj. močí, tvořily pro Zn 25-33 % a pro Se 66-75 % z celkově ztráceného množství. Také příjem těchto STP, vypočítávaný ze známého složení přípravků podávaných cestou p. v., byl ve skutečnosti při-bližně o 25-33 % vyšší, díky jejich obsahu v nutrientech přijímaných enterálně, dodaných krevních produktech a krystaloidech.
Poznámka: jednotky a hodnoty STP jsou uváděny jednou v molárních, jindy v hmotnostních množstvích. To ztěžuje orientaci v literatuře i mezi laboratorními výsledky a např. dávkováním v definovaných nutričních přípravcích. Pro větší pohodlí čtenáře zde proto uvádíme v Tabulce 1. přepočítací faktory pro ty STP, o kterých článek jedná, a navíc jsou v textu uváděny často obojí jednotky.
1. Trace elements - conversion factors from units of mass to international units and vice versa. 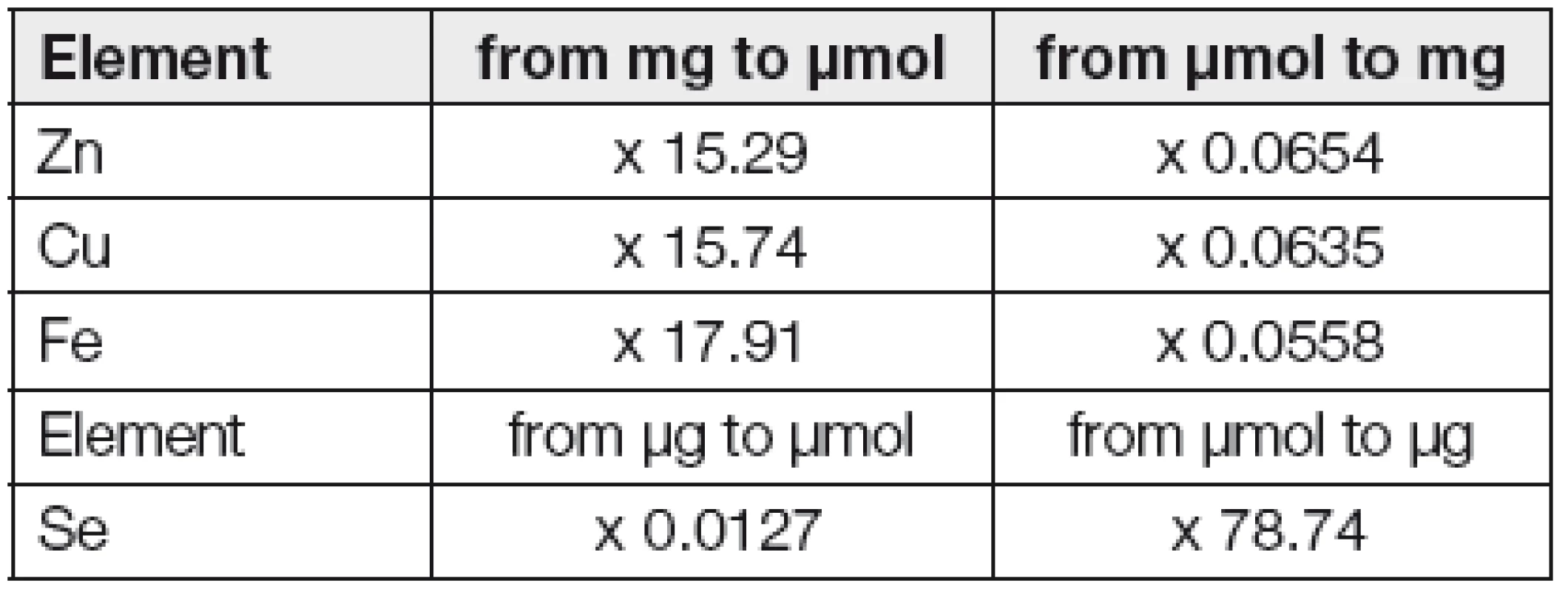
Zinek
Význam
Je složkou 250 metaloenzymů (např. laktátdehydro-genázy, alkalické fosfatázy i polymeráz DNA a RNA. Je nezbytný pro strukturu bílkovin, řídících genovou expresi a pro nukleární bílkoviny, působící jako transkripční faktory.
Laboratorní hodnoty
Sérum 11-18 µmol/l (0,72-1,18 mg/l), moč 5-10 µmol/d (0,3 -0,6 mg).
V kritických stavech
Typický je pokles hladin v séru a zvýšené vylučování močí. Jsou samozřejmě i event. ztráty dalšími tělesnými sekrety. Deficit Zn je spojen se zhoršením imunitních funkcí a se zvýšenou náchylností k infekcím.
U Zn – deplečních při zhoršené imunitě suplementace Zn zkracuje trvání infekcí a zrychluje hojení ran.
V literatuře se opakovaně setkáváme se snahou suplementovat z uvedených důvodů Zn nemocným v kritických stavech ve vyšších dávkách než je běžné. Např. bylo suplementováno 458 µmol/d (30 mg) po 3 dny úplné p. v. 21 nemocným. Bylo prokázáno významné zvýšení hladin v séru pohybujících se kolem horního referenčního rozmezí a také vylučování močí překročilo přibližně dvojnásobně referenční meze. Proti kontrolní skupině (n=23) byly však tělesné teploty po všechny 3 dny vyšší. Třetí den bylo toto zvýšení v suplementované skupině významné proti kontrolám, navíc byl zjištěn významný vztah mezi hodnotou teploty a hodnotami interleukinu-6 [3]. Ve zcela recentní klinické studii bylo dotazníkovou akcí v UK provedenou ve spolupráci s 259 jednotkami intenzivní péče (JIP) zjišťováno:
- zda je zinkémie součástí rutinního vyšetření nemocných ICU,
- zda jsou nemocní při nálezu hypozinkémie Zn suplementováni,
- pokud ano, tak jaké jsou důvody a jaká dávka je podávána.
Výsledky
Rutinní požadavky na vyšetření zinkémie má 18 % ICU, při nálezu hypozinkémie je suplementace Zn indikována v 10 % ICU. Dávkování Zn se široce liší v rozsahu 6-2064 µmol/d (0,4-135 mg). V 6 % suplementací jde o vysoké dávky 1376-2064 µmol/d (90-135 mg). Autoři studie tyto postupy důrazně kritizují s tím, že hypozinkémie jsou nesprávně interpretovány jako projevy deficitu Zn v organismu s potřebou jeho přívodu. Není důkaz o oprávněnosti vysokého přívodu Zn u nemocných JIP [4, 5].
K ilustraci nálezů parametrů Zn u kriticky nemocných uveďme vlastní zkušenosti. Sami jsme se zabývali sledováním těchto parametrů ve dvou klinických pokusech. Poprvé to bylo, díky technickému vybavení laboratoře, možné již v 70. letech [6]. Tehdy bylo sledováno 28 chirurgických nemocných opakovaně v prvních dvou týdnech po výkonu. Dále bylo 23 nemocných s komplikovaným pooperačním průběhem vyšetřováno ještě v období 3.-6. týden po výkonu. Proti kontrolní skupině, kterou tvořilo 26 dobrovolníků z řad zdravotníků a zinkémie u nich byla 14,3±2,5 µmol/l, byly hodnoty v 1. a 2. pooperačním týdnu (celkem 134 vyšetření) sníženy významně na 1 % hladině. V pooperačních dnech 1.-3. to bylo na 10,5±2,9 µmol/l, v 4.-7. dni na 12,1±2,7 µmol/l a v 2. týdnu na 11,9±2,5 µmol/l. Jen o málo vyšší byly hodnoty v 3. až 6. týdnu (celkem 79 vyšetření) 12,5±3,8 µmol/l, stále ještě významně snížené na 5% hladině. Před operací bylo vyšetřeno jen 10 osob ze sledovaného souboru. Také jejich zinkémie byly významně sníženy stejně jako u 14 neoperovaných, ale na chirurgické klinice hospitalizovaných nemocných, vždy na 1% hladině. Denní ztráty močí sledované ve stejných intervalech a se stejnou frekvencí, byly naopak proti kontrolám (6,9±3,2 µmol/d) zvýšeny ve všech sledovaných intervalech prakticky čtyřnásobně, s významností rozdílu opět na 1% hladině. Hodnoty v obsahu žaludečních sond a zejména drénů z dutiny břišní i t-drénů (počty vyšetření 28, 12 a 12), byly často vyšší než fyziologická zinkémie přesto, že šlo o osoby hypozinkemické. Tito nemocní suplementováni Zn přímo nebyli.
Zinkémii jsme sledovali i v další práci u dvou souborů nemocných. První tvořilo 18 nemocných kardiochirurgické kliniky, s vyšetřením před operací a v pooperačních dnech 1, 3 a 7. Tito nemocní byli v dobrém stavu výživy a Zn jim nebyl suplementován. Zatímco hodnota předoperační byla 13,1±2,8 µmol/l, hodnota 1. po-operační den klesla na 5,5±2,0 µmol/l, aby se v dalších dvou vyšetřeních zvyšovala. Avšak ani 7. den nedosáhla s hodnotou 9,4±2,5 µmol/l hodnot výchozích. Druhý soubor tvořilo 37 nemocných kliniky anesteziologicko-resuscitační s rozvinutou akutní fází metabolické odpovědi na trauma a v proteinové malnutrici. Průměrná suplementace Zn byla u nich 7 mg/d (107 µmol). Byli sledováni 1., 3., 5. a 7. den po přijetí. Nízké počáteční hodnoty zinkémie 8,2±2,6 µmol/l nejevily žádnou dynamiku a 7. den byly 8,7±3,3 µmol/l [7].
U 20 kriticky nemocných dětí byly 1. a 3. den hospitalizace významné poklesy zinkémie. Ta významně negativně korelovala s C-reaktivním proteinem (CRP) (p=0,01) i s interleukinem-6 (IL-6) (p=0,04). Zinkémie u nemocných se selháním 2 až 3 orgánů byla významně nižší, než se selháním orgánu jednoho (p=0,03) [8]. V jiné práci byla zinkémie sledována v multicentrické studii na 25 JIP u 551 dospělých nemocných. Hypozinkémie byla zjištěna již na začátku léčení u 95,8 % z nich. Byl trend k nepřímé závislosti mezi zinkémií a skórem SOFA, vyjadřujícím funkční poškození orgánů. Významnost ale nebyla prokázána a nebyl ani vztah k trvání ventilační podpory, délce pobytu na JIP ani k mortalitě.
Doporučený příjem
Cestou enterální výživy (e.v.) 60-230 µmol/d (4-15 mg), cestou p.v. kolem 76 µmol/d (5 mg) [1, 9, 10].
Během reakce akutní fáze je bezpečná dávka Zn pod dvojnásobkem běžně doporučované dávky i. v. Přípustné zvýšení je o 30,5-61 µmol/d (2-4 mg). Vyšší dávkování je možné až s ústupem akutní fáze. Některé přípravky enterální výživy mohou obsahovat nadstandardní množství mikronutrientů. U Zn může jít až o 460 µmol/d (30 mg). Běžně doporučované dávky p. o. jsou ale nižší. Vyšší úhrada Zn u kriticky nemocných je doporučována snad jen u popálených, kteří mají zvýšené ztráty zraněnou kůží. Při rozsahu 20-50 % popáleného tělesného povrchu je doporučováno hradit nejméně 380 µmol/d (25 mg), při rozsahu nad 50 % až 760 µmol/l (50 mg). Účelné je také hradit zvýšené ztráty střevního obsahu: na 1000 ml 185-260 µmol (12-17 mg) [2, 1, 5].
Nadměrný příjem
V souvislosti s pokusy o zvýšenou suplementaci Zn v akutních stavech, ale i s oprávněným podáváním Zn po odeznění reakce akutní fáze, je vhodné uvažovat jen o potenciálním riziku infekce nebo jejího zhoršení. Obecně je toxicita Zn nízká a k předávkování dochází vyjímečně. Je to např. při požití oxidu zinečnatého (ZnO, zinková běloba, klasická součást mastí) v množství kolem 10 g, které vede k nevolnosti až zvracení, ale život neohrožuje. Smrtelná dávka síranu zinečnatého (ZnSO4) je mezi 5 – 10 g, chloridu zinečnatého (ZnCl2) dvoj - až trojnásobná. Těžké otravy zinkem jsou popisovány při vaření a uchovávání šťávy z jablek nebo jiných ovocných šťáv a některých pokrmů v pozinkovaném nádobí. Dochází k bolestem hlavy, pocitu sevření hrudníku, nevolnosti, zvracení, krvavým průjmům. Mohou být křeče v nadbřišku a krvácení ze žaludečních erozí. úmrtí ale nehrozí. Laboratorní vyšetření při intoxikacích Zn prokazuje zpomalenou clearance glukózy a zhoršení imunitních funkcí. U polymorfonukleárních leukocytů trpí chemotaxe. Enterální přívod Zn, zvýšený nad 760 µmol/d (50mg), vede k deficitu Cu v organismu. K němu dochází tím, že se zvýší množství metalothioneinu v enterocytech. Ten váže sice Zn, ale ještě více Cu. Vzniklý deficit Cu v organismu vede k neutropenii a k mikrocytární hypochromní anemii, která nereaguje na přívod Fe. Ačkoli je jedním ze základních cílů suplementace Zn urychlit hojení ran, jeho nadměrný přívod je paradoxně zhorší. Důvod: bez dostupnosti Cu vázne funkce lysyloxidázy, enzymu potřebného pro vznik příčných vazeb kolagenu, a tím pro odolnost tkáně na tah.
Dramatické akutní (ale i chronické) otravy mohou vzniknout při vdechování par nebo prachu kovového Zn u slévačů kovů. Do 4 – 28 hodin po expozici se objevuje kovová chuť v ústech, dráždivý kašel, bolesti svalů a hlavy, zvracení, třesavka, ospalost a do 10 – 12 hodin vysoká horečka. Laboratorně je proteinurie, glykosurie, leukocytóza. Předpokládá se, že Zn vytváří komplexy s bílkovinami v alveolech i v plazmě [11, 12, 13].
Železo
Význam
Jako součást hemoglobinu a myoglobinu je nezbytné pro přenos kyslíku. Je složkou řady metaloenzymů, hlavně dehydrogenáz (v mozku, kosterních svalech), podílí se na kognitivních funkcích a na imunitě (je obsaženo v T-buňkách).
Laboratorní hodnoty
Sérum 11-18 µmol/l (0,6-1,0 mg/l), moč 5 -10 µmol/d (0,3 -0,6 mg).
V kritických stavech
Pokles siderémie inhibuje růst bakterií, zvýšení siderémie je naopak spojováno s rizikem bakteriémie a zhoršuje chemotaktické a fagocytární vlastnosti neutrofilů. Klesá fyziologická recyklace Fe, při které je po rozpadu erytrocytů uvolněné Fe znovu po pasáži přes transferin reutilizováno při syntéze hemoglobinu, resp. erytroblastů. Siderémie klesá pod 9 µmol/l pro snižující se obsah železa v plazmě. Hlavním mediátorem sekvestrace Fe z oběhu je u těchto nemocných zřejmě hepcidin. Je to základní regulační hormon metabolizmu Fe, objevený v r. 2000. Hepcidin brání jednak absorpci Fe ve střevech blokací Fe transportujících kanálů a jednak podporuje jeho vychytávání enterocyty, makrofágy a hepatocyty a v nich vazbu ve ferritinu. Cirkulující cytokiny IL-1, IL-6 a faktor nekrotizující tumory (TNF-alfa) rovněž tvorbu ferritinu zvyšují. Dále se degradací neutrofilů z nich uvolňuje bílkovina apolaktoferrin, z něhož po navázání 2 atomů Fe vzniká laktoferrin. Ten je vychytáván retikuloendoteliálním systémem v játrech. Tím vším množství Fe snadno mobilizovatelného pro erytropoézu klesá. Vyvíjí se tzv. funkční deficit železa (FID). Deficit je spojen s únavou, nižší odolností k infekci, anémií, suchou kůží. Deficit má 25-35 % hemodialyzovaných (ztráty dialýzou, zhoršená střevní resorpce).
Anemičtí nemocní se SIRS mohou mít normální zásoby Fe, ale jeho nedostatek pro krvetvorbu. FID je definován přítomností nad 10 % hypochromních erytrocytů. Tuto definici splňuje při přijetí na JIP 35 % nemocných. Délka pobytu na JIP je při průkazu FID významně delší. FID se může vyvíjet i při léčbě rekombinantním lidským erytropoetinem (rHuEPO). Randomizované klinické práce s podáním rHuEPO kriticky nemocným dávají zatím nejasné výsledky. Rozsáhlá studie heterogenních skupin anemických nemocných na ICU neprokázala po léčbě rHuEPO snížení potřeby transfuzí ani vliv na mortalitu [14]. Podobně jako u Zn, je i v problematice Fe neustále hledáno řešení jeho nedostatku v kritických stavech. Bylo zjištěno, že v kombinaci s přívodem Fe p. o. snižuje přívod rHuEPO potřebu transfuzí u nemocných na JIP. Je to prospěšné pro dialyzované nemocné, upravuje se hematopoéza u dlouhodobých zánětlivých stavů (M. Crohn, revmatoidní artritis). Nicméně rozsáhlá studie EPIBACTAL na 988 hemodialyzovaných nemocných s chronickým renálním selháním prokázala, že vysoký přívod léčebně podávaného Fe je spojen s rizikem bakteriémie. Zvýšení ferritinu > 500 µg/l u chronicky dialyzovaných je významným rizikovým faktorem infekce. Anémie, přetrvávající po propuštění z JIP souvisejí s chronickým zánětem, který je provázen výše uvedenou blokací erytropoézy [15, 16, 17].
Později bylo publikováno více prací, při nichž bylo v klinických pokusech suplementováno Fe intenzivně léčeným pacientům. Tak např. jeho i. v. přívod 27 chirurgickým nemocným nevedl k častější bakteriémii proti kontrolám [18].
V další práci byl sledován soubor 863 nemocných po kardiopulmonálním bypassu. Ti z nich, kteří byli anemičtí, dostávali dle potřeby erytropoetin + Fe i. v. nebo transfúze. Nebyl rozdíl v počtu infekčních komplikací mezi suplementovanými Fe a ostatními [19]. Nedávno bylo referováno o úspěšné úpravě anémie u septických myší i. v. přívodem Fe. Autoři ale varují před rutinním užíváním Fe u kriticky nemocných do doby, než jeho oprávněnost prokáží dostatečné klinické pokusy. Recentní přehledy problematiky anémie u kriticky nemocných končí dosud tím, že rutinní suplementaci Fe nelze zatím pro nebezpečí infekce doporučit [20]. V souladu s teorií účelového „zametání“ Fe a s vývojem funkčního deficitu Fe je i práce věnovaná suplementaci Fe v perioperačním období [21]. V randomizované klinické studii bylo třem skupinám kardiochirurgických nemocných podáno 1x před operací a 2x v prvních pooperačních dnech celkem 300 mg Fe3+ i. v. (n=54), 315 mg p. o. (n=53), nebo placebo (n=52). Průměry předoperačních hodnot hemoglobinu (Hb) byly ve všech třech skupinách těsně před výkonem mezi 126 – 128 g/l. Na konci operace to bylo mezi 105 – 107 g/l, při ukončení hospitalizace mezi 110 -111 g/l a za měsíc potom mezi 123 – 127 g/l. Hodnoty se mezi skupinami tak málo lišily, že není nutné je uvádět podrobněji. Stejně tak nebyly rozdíly ani v potřebě transfuzí. Významné rozdíly vznikly jen v hladinách ferritinu. Zatímco předoperačně byl ve všech skupinách v referenčních mezích, 10. den po výkonu byly jeho hodnoty 1325±495 ng/ml(skupina Fe3+ i. v.), 541±471 ng/ml (Fe3+ p. o.) a 485±331 (placebo). Ještě za měsíc byly hodnoty v i. v. suplementované skupině 610±387 ng/ml, zatímco ve zbývajících dvou se vrátily do hodnot fyziologických. Autoři studii uzavřeli s tím, že z hlediska snahy o úpravu anémie a snížení potřeby transfúzí se suplementace Fe ukázala neúčinná a je třeba hledat jiné způsoby k dosažení těchto cílů.
Doporučený příjem
Běžně je to cestou p. o. muži 140-160 µmol/d (8-9 mg), u žen před menopauzou 280 µmol/d (16 mg). Pro příjem cestou p. v. je doporučováno 20 µmol/d (1,2 mg) [9, 10].
Přes více klinických pokusů se suplementací Fe nemocným v kritických stavech uvádějících, že počet infekčních komplikací se proti kontrolní skupině nezvýšil, přívod Fe nelze těmto nemocným v současné době doporučit. Výjimkou je přívod nutnými transfúzemi. Navíc, jeho příjem v perioperačním období nemusí anémii upravovat. Problematický je také přívod erytropoetinu, na který je běžná odpověď zvýšení počtu erytrocytů u kriticky nemocných oslabena.
Nadměrný příjem
Předávkování představuje komplikaci chronické transfuzní léčby. Každá jednotka erymasy obsahuje asi 250 mg Fe. Po přívodu 10-15 těchto jednotek vzniká nadbytek Fe v játrech, srdci, kůži i endokrinních orgánech. Kontinuální transfuzní léčba bez chelace může vést k fatální dysfunkci jater a myokardu. Chelace Fe není ani jednoduchá ani laciná.
K příznakům intoxikace dochází, když koncentrace plazmatického Fe překračuje jeho vazebnou kapacitu a dochází k cirkulaci jeho nevázané formy. Fyziologická absorpce je saturována množstvím 5 mg/d a děje se pomocí transportního systému, závislého na spotřebě energie. Při vyšším obsahu Fe ve střevě dochází k pasivní absorpci. Vrcholné plazmatické koncentrace jsou dosahovány za 2-4 hodiny po požití. Stejně tak jako při výše popsané regulaci siderémie během SIRS i zde se uplatňuje hepcidin. Jeho sekrece je regulována zpětnou vazbou v závislosti na výši siderémie. Jeho koncentrace v plazmě se zvyšuje za několik hodin po příjmu toxické dávky Fe. Omezuje příjem fyziologickým transportním systémem ve střevě, nemůže ale ovlivnit zmíněnou pasivní absorpci Fe. Do jaké míry se může uplatnit, záleží jak na množství zkonzumovaného Fe, tak na užitém přípravku. Pokud jde o lék s pomalým uvolňováním ve střevě, lze předpokládat, že pozitivní vliv hepcidinu bude výraznější. Vyšetřování hepcidinu provádějí jen specializované laboratoře.
Intoxikace Fe se stává obecnější příčinou suicidálních pokusů. V pediatrické praxi je příčinou otrav neúmyslných. Tyto hrozí zejména, když těhotná žena, suplementovaná přípravkem Fe, nechá tyto léky v místech dostupných dětem, které již má. Ty je často považují za sladkosti a snědí. Podíl dětí, které po neúmyslné otravě umírají, se pohybuje mezi 8 % až 25 %. Bez ohledu, zda jde o suicidium nebo požití neúmyslné, hrozí vývoj kritického stavu. Proto jeho vývoj popíšeme podrobněji. Intoxikace probíhá klasicky v pěti fázích, které se ovšem mohou v individuálních případech různě překrývat nebo se nemusí všechny vyvinout. Tyto fáze jsou následující:
- Gastrointestinální: do 30 minut až 6 hodin po požití. Dochází k bolestem žaludku, nevolnosti až zvracení, průjmu. Jsou to následky toxického vlivu Fe na sliznice.
- Klidová: 2 – 8 hodin po intoxikaci, je to přechodné období mezi odezníváním gastrointestinálních potíží a nástupem systémové toxicity.
- Šok: 2 – 48 hodin po požití vzniká hypotenze, tachykardie, křeče, koma, metabolická acidóza, koagulopatie a renální selhání. V tuto fázi může ale přejít přímo už fáze první, pokud byly zvracení a průjmy drastické a vedly k těžké ztrátě cirkulujícího objemu tekutin.
- Hepatotoxicita: 12-48 hodin po požití.
- Střevní obstrukce: 1-7 týdnů. Je vyvolána vznikem střevních striktur při hojení poškozené sliznice duodena a jejuna [17, 22].
Do redakce došlo 12. 7. 2013
Adresa pro korespondenci:
prof. MUDr. Antonín Kazda, DrSc.
ULBLD 1. LF UK a VFN
Kateřinská 32
121 08 Praha 2
e-mail: kazda@vfn.cz
Sources
1. Hardy, Y. G., Mendenez, A. M., Pharm, B. et al. Trace element supplementation in parenteral nutrition: Pharmacy, posology, and monitoring guidance. Nutrition, 2009, 25, p. 1073-1084.
2. Berger, M. M., Cavadini, C., Chiolero, R., et al. Copper, selenium, and zinc status and balances after major trauma. J Trauma Injury Infection Crit. Care, 1996, 40 (1), p. 103-109
3. Braunschweig, C. L. Parenteral zinc supplementation in human adults during the acute phase response. J Nutr., 1997, 127 (7), p. 70-74.
4. Heyland, D. K., Jones, N., Cvijanovich, N. Z. et al. Zinc supplementation in critically ill patients: a key pharmaconutrient? J Parent. Enter. Nutr., 2008, 32 (5), p. 509-519.
5. Duncan, A., Dean, P., Simm, M., et al. Zinc supplementation in intensive care: results of a UK survey. J Crit. Care, 2012(27), p. 102.e1-102.e6.
6. Kazda, A., Dvořáková, S., Štěpánová, I. et al. Sledování hodnot zinku u chirurgických nemocných. Čas. lék. čes., 1976, 115(18), p. 543-548.
7. Kazda, A., Brodská, H., Valenta, J. Problematika a sledování suplementace zinku a selenu v intenzivní péči. Klin. bioch. metab., 2004, 3, p.184-189.
8. Cvianovich, N. Z., King, J. C., Flori, H. R. et al. Zinc homeostasis in pediatric critical illness. Pediatr. Crit. Care Med., 2009, 10 (1), p. 29-34.
9. Shenkin, A. Trace elements and vitamins in parenteral and enteral nutrition. In: Sobotka, L. (ed.). Basics in clinical nutrition, Praha: Galén, 2000, p. 62-71.
10. Shenkin, A. Micronutrients. Physiologic function and deficiency states of trace elements. In Sobotka, L. (ed.). Basics in clinical nutrition, Praha: Galén, 2011, p. 53-59. a 140-145.
11. Moeschlin, S. Vergiftungen durch anorganische Stoffe. In Moeschlin, S.et al. Vergiftungen. Stuttgart: Thieme 1986, p. 181-182.
12. Vávrová, J., Pechová, A., Wilhelm, Z. et al. Vitaminy a stopové prvky. Pardubice: ČLS JEP a SEKK 2007, 156 s.
13. Kazda, A. Mikronutrienty. In Kazda, A. et al. Kritické stavy, metabolická a laboratorní problematika. Praha: Galén 2012, p. 81-118.
14. Piagnerelli, M., Vincent J.-L. The use of erythropoiesis-stimulating agents in the intensive care unit. Crit. Care Clin., 2012, 28, p. 345-362.
15. Vyoral, D., Petrák, J. Hepcidin: a direct link between iron metabolism and immunity. Intern. J Bioch. Cell Biol., 2005, 37, p. 1768-1733.
16. Hoen, B., Paul-Dauphin, A., Kessler, M. Intravenous iron administration does not significantly increase the risk of bacteremia in chronic hemodialysis patients. Clin. Nephrol., 2002, 57, p. 457-461.
17. Simonse, E., Valk-Swinkels, C. G. H., vant´t Veer, N. E. et al. Iron autointoxication in a 16-year-old girl. Ann. Clin. Biochem., 2013, 50, p. 76-79.
18. Swoboda, S. M., Lipsett, P. A. Intravenous iron as a risk factor for bacteremia in the surgical intensive care unit patient. Surg. Infect. (Larchmt.), 2005, 6, p. 158.
19. Torres, S., Kuo, Y. H., Morris, K. et al. Intravenous iron following cardiac surgery does not increase infection rate. Surg. Infect. (Larchmt.), 2006, 7, p. 361-366.
20. Hayden, S. J., Albert, T. J., Watkins, T. R. et al. Anemia in critical illness. Am. J. Respir. Crit. Care Med., 2012, 10 (185), p. 1049-1057.
21. Garrido-Martín, P., Nassar-Nansur, M. I., de le Llana-Cucrós, R., et al. The effect of intravenous and oral iron administration on perioperative anaemia and transfusion requirements in patients undergoing elective cardiac surgery: a randomized clinical trial. Interactive CardioVascular and Thoracic Surg., 2012, 15, p. 1013-1018.
22. Chang, T. P., Rangan, C. Iron poisioning: a literature – based review of epidemiology, diagnosis and management. Pediatr. Emerg. Care, 2011, 27, p. 978 – 985.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2013 Issue 4-
All articles in this issue
- New generation of hs cardiac troponins and diagnosis of acute coronar syndrome - minireview
- Trace elements in critical states. Part 1: zinc and iron
- Trace elements in critical states. Part 2: copper and selenium
- Hypercholesterolemia in pregnancy - pathobiochemical and pathophysiological implication for atherosclerosis and evaluation in metabolic surgery
- Haemolysis influence on the determination of total and direct bilirubin
- Cerebrospinal fluid analysis in the diagnosis of subarachnoid hemorrhage
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Haemolysis influence on the determination of total and direct bilirubin
- Cerebrospinal fluid analysis in the diagnosis of subarachnoid hemorrhage
- Trace elements in critical states. Part 1: zinc and iron
- Trace elements in critical states. Part 2: copper and selenium
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

