-
Medical journals
- Career
Stanovení sérových markerů v diferenciální diagnostice časného karcinomu prostaty (pilotní studie)
Authors: R. Fuchsová 1; O. Topolčan 1; J. Klečka 2; J. Vrzalová 1; M. Hora 2; R. Kučera 1; O. Dolejšová 2; O. Hes 3
Authors‘ workplace: Laboratoř imunochemické diagnostiky, FN a LF v Plzni, Univerzita Karlova v Praze 1; Urologická klinika, Fakultní nemocnice v Plzni 2; Šiklův patologicko-anatomický ústav, FN a LF v Plzni, Univerzita Karlova v Praze 3
Published in: Klin. Biochem. Metab., 21 (42), 2013, No. 1, p. 21-24
Overview
Cíl studie:
Sledování sérových hladin markerů karcinomu prostaty PSA, %freePSA, [-2]proPSA a výpočet PHI v časné diagnostice karcinomu prostaty.Typ studie:
Pilotní studieMateriál a metody:
V imunoanalytické laboratoři Fakultní nemocnice Plzeň (FN) byla vyšetřena séra 76 pacientů Urologické kliniky FN s podezřením na karcinom prostaty a indikovaných k biopsii prostaty pod ultrasonografickou kontrolou (TRUS). U všech pacientů byla stanovena hladina celkového PSA, a pokud byla mezi 0 – 30 µg/l, bylo doplněno stanovení hladin freePSA, [-2]proPSA, vypočítán poměr %freePSA a Prostate Health Index (PHI). Stanovení sledovaných biomarkerů se prováděla chemiluminiscenční metodou na přístroji DxI 800 (Beckman Coulter, USA). Pro veškeré statistické výpočty byl použit statistický software SAS verze 9.2.Výsledky:
Nalezli jsme statisticky signifikantně zvýšené hladiny [-2]proPSA a PHI u pacientů s histologicky potvrzeným karcinomem prostaty oproti pacientům s benigní hyperplazií prostaty ([-2]proPSA medián 14 vs. 27 ng/l, PHI medián 35 vs. 77). Naopak u celkového PSA a %freePSA jsme statisticky významné rozdíly v hladinách nenalezli (mediány tPSA 7,1 vs. 7,7 µg/l a %freePSA 16 vs. 11,4 %).Závěr:
Pro zpřesnění diferenciální diagnostiky benigní hyperplazie se zdá být stanovení [-2]proPSA a vypočtení indexu PHI velkým přínosem.Klíčová slova:
PSA, [-2]proPSA , PHI, index zdravé prostaty, karcinom prostaty, biopsie, benigní hyperplazie prostaty.Úvod
V současné době existují dva důvody, proč se prakticky přestal provádět celoplošný screening karcinomu prostaty pomocí PSA. Prvním důvodem je, že na sjezdu Americké onkologické společnosti v roce 2011 (ASCO 2011) bylo konstatováno, že pomocí PSA a fPSA nelze odhadnout agresivitu nádorového procesu, a dochází tím ke zbytečnému zahájení léčby i v případech, kde není vůbec indikována (overtherapy). Druhým důvodem je jeho nízká specificita. Tu sice zlepšuje kombinování s % fPSA (nejčastěji používané v České republice) nebo v zahraničí často používanou velocitou a densitou PSA nebo využití na věk adjustovaných referenčních hodnot [1, 2]. Nízká specificita PSA vede k nadměrnému počtu biopsií prostaty – čili k „over diagnostice“ [3]. Hledají se neustále nové markery pro zpřesnění diferenciální diagnostiky [4]. V naší pilotní studii jsme se snažili zjistit, zda stanovení [-2]proPSA (isoformy volného PSA) je schopno pomoci řešit problém „over diagnostiky“.
Materiál a metody
V období od listopadu 2010 do dubna 2012 bylo v imunoanalytické laboratoři FN Plzeň vyšetřeno 76 sér pacientů urologické kliniky s podezřením na karcinom prostaty, u nichž byla provedena TRUS biopsie. Krev byla odebírana z kubitální žíly do odběrových zkumavek VACUETTE®, (Greiner Bio-One, Rakousko). Sérum bylo odděleno centrifugací při 1 700 × g po dobu 10 minut a vzorky byly buď okamžitě zpracovány, nebo – pokud je nebylo možno zpracovat do 3 hodin – byly uchovávány až do doby stanovení při teplotě -20 °C. U všech nemocných bylo vyšetřeno celkové PSA (tPSA), a pokud bylo v rozmezí 0-30 µg/l, bylo doplněno o vyšetření freePSA (fPSA) a [-2]proPSA. Měli jsme ve všech případech k dispozici výsledek palpačního vyšetření prostaty, sonografii a objem prostaty, výsledek biopsie prostaty a byla známa medikace před a v době odběru krevního vzorku, tedy obdobně jako v podobných zahraničních pracích [5,6]. Všechny výše uvedené markery byly stanoveny chemiluminiscenční metodou na přístroji DxI 800 (Beckman Coulter, USA) a vypočteny %freePSA podle vzorce (freePSA/tPSA) x 100 a index PHI=([-2]proPSA /freePSA)x√tPSA. Hodnoty CV se pohybovaly pro [-2]proPSA v rozmezí 3,9-5,6 %, fPSA 6,8-9,9 % a tPSA 6,9-7,5 % (podle použité kontrolní hladiny).
Podle výsledků biopsie prostaty byli nemocní rozděleni do dvou skupin, a to na 50 nemocných s benigní hypertrofií prostaty (negative) a 26 nemocných s karcinomem prostaty (positive). Průměrný věk byl 68 let (49 – 82 let). Za použití statistického softwaru SAS verze 9.2. byla provedena deskriptivní analýza, a vzhledem k nerovnoměrnému počtu pacientů v obou skupinách byla namísto standardního t-testu použita metoda generalizovaných lineárních modelů (GLM) pro porovnání dvou skupin s testovou statistikou F. V box-whisker plotech jsou uváděny hodnoty testové statistiky F a příslušné p-hodnoty (v grafech uváděné jako Prob > F).
Výsledky
Grafy s boxploty stanovovaných markerů pro skupiny benigní a maligní tPSA (obr. 1), [-2]proPSA (obr. 2), %freePSA (obr. 3) a PHI (obr. 4):
Fig.1. Boxplot for tPSA (μg/l) benign and malignant group 
Fig. 2. Boxplot for [-2]proPSA (ng/l) benign and malignant group ![Fig. 2. Boxplot for [-2]proPSA (ng/l) benign and malignant group](https://pl-master.mdcdn.cz/media/image/142076ddb03bbccff6c7c6335d2cefd3.jpg?version=1537792530)
Fig. 3. Boxplot for %freePSA (μg/l) benign and malignant group 
Fig. 4. Boxplot for PHI benign and malignant group 
Z grafů vyplývá, že jsme nalezli signifikantní rozdíly mezi skupinami benigních lézí (negative) a maligních lézí (positive) hladin isoenzymu [-2]proPSA a indexu PHI ([-2]proPSA medián 14 vs. 27 ng/l, p> 0,0022, PHI median 35 vs. 77 p>0,0001 ), a naopak nebyly přítomny signifikantní rozdíly mezi hladinami tPSA a %freePSA (medián tPSA 7,1 vs. 7,7 µg/l a %freePSA 16 vs.11,4 %).
Diskuze
Zahraniční autoři do svých souborů zahrnuli pacienty s celkovým PSA 4-10 µg/l, která je považována za oblast hraničních hodnot (šedé zóny) tPSA [7]. Nás ale zajímalo, zda by bylo možné zabránit opakovaně negativním biopsiím u pacientů s tPSA i nad 10 µg/l. Na základě zkušeností z běžné urologické praxe, kdy i u pacientů s tPSA mezi 10 a 30 µg/l existují pacienti s opakovanými negativními biopsiemi, jsme se rozhodli provádět stanovení [-2]proPSA u všech nemocných s celkovým PSA do 30 µg/l. Ve skupině benigních lézí mělo 9 pacientů z padesáti tPSA nad 10 µg/l, a dokonce 3 pacienti nad 20 µg/l.
Naše zjištění nesignifikantních rozdílů v hladinách celkového PSA a %fPSA mezi benigní a maligní skupinou podporují klinickou zkušenost, že tyto markery nepostačují pro svou nízkou specificitu k diferenciální diagnostice mezi BHP a CA prostaty. Provedli jsme tedy analýzu našich pacientů podle standardně vyšetřovaných parametrů (tPSA a %freePSA) versus PHI a hodnotili, zda [-2]proPSA umožní zabránit provedení biopsií. Použili jsme cut-off pro %freePSA hodnotu 20% (nad 20 = benigní léze) a cut-off pro PHI 40 (nad 40 = maligní léze).
Z Tabulky 1 vyplývá, že celkem 34 biopsií (tj. 45 %) ze skupiny indikované na základě patologických hodnot %fPSA bylo negativních, a přitom negativních bio-psií na základě patologického PHI by bylo pouze 14 (tj. 18 %). Zde je třeba vzít také v úvahu, že obecně udávaný počet falešně negativních prvních biopsií je kolem 25 % [8].
Table 1. Analysis of result of biopsy according to positivity of markers 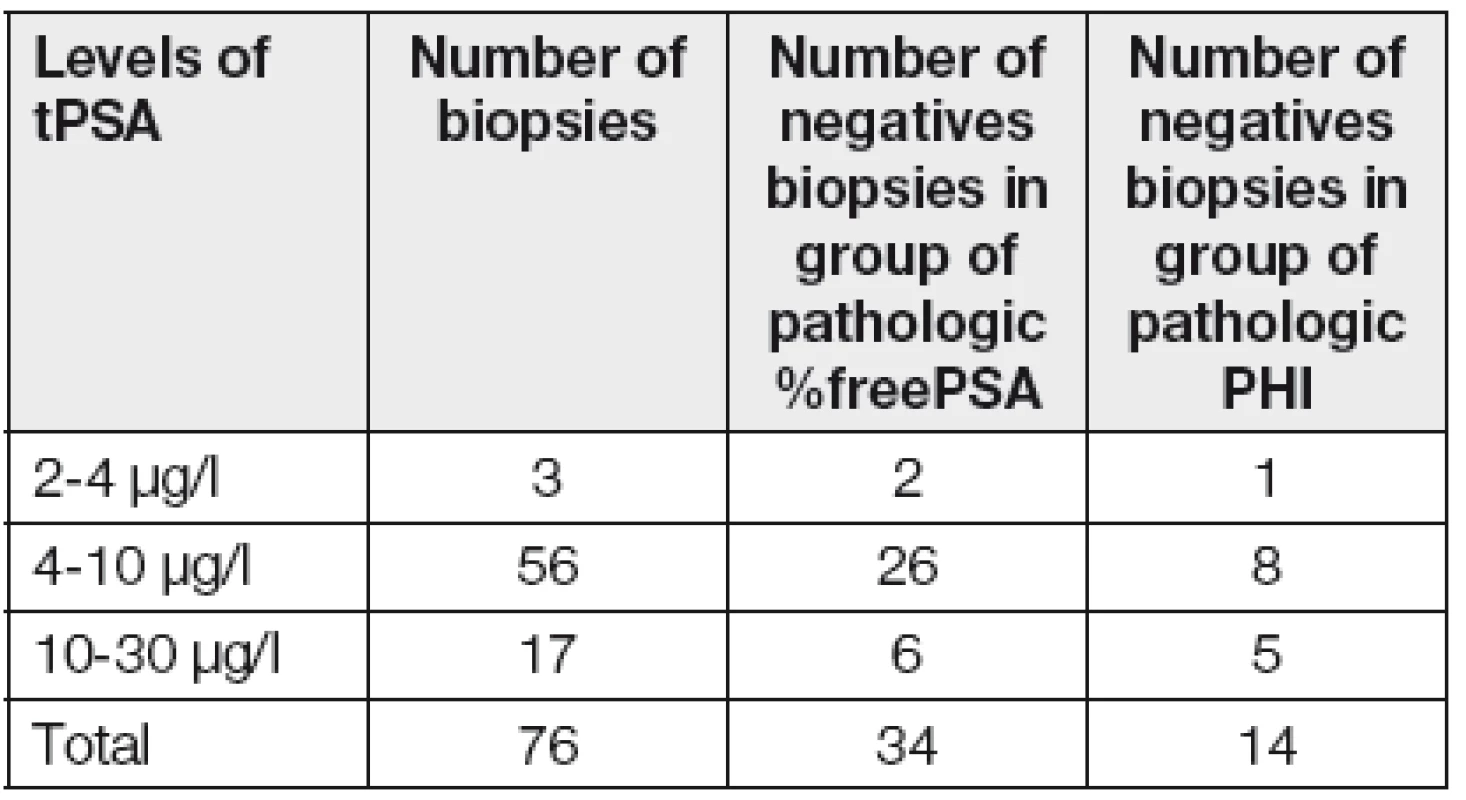
Pokud by se urolog rozhodoval o biopsii na základě standardně prováděné kombinace markerů (tPSA a %free PSA), pak u celkem 7 karcinomů (Tabulka 2) se %freePSA pohybovalo v rozmezí referenčního intervalu (20 až 32 %), a naopak všechny diagnostikované karcinomy měly hodnotu PHI nad 40.
Table 2. Summary of number of patients with positive biopsies with the negativity of the marker (%fPSA and PHI) 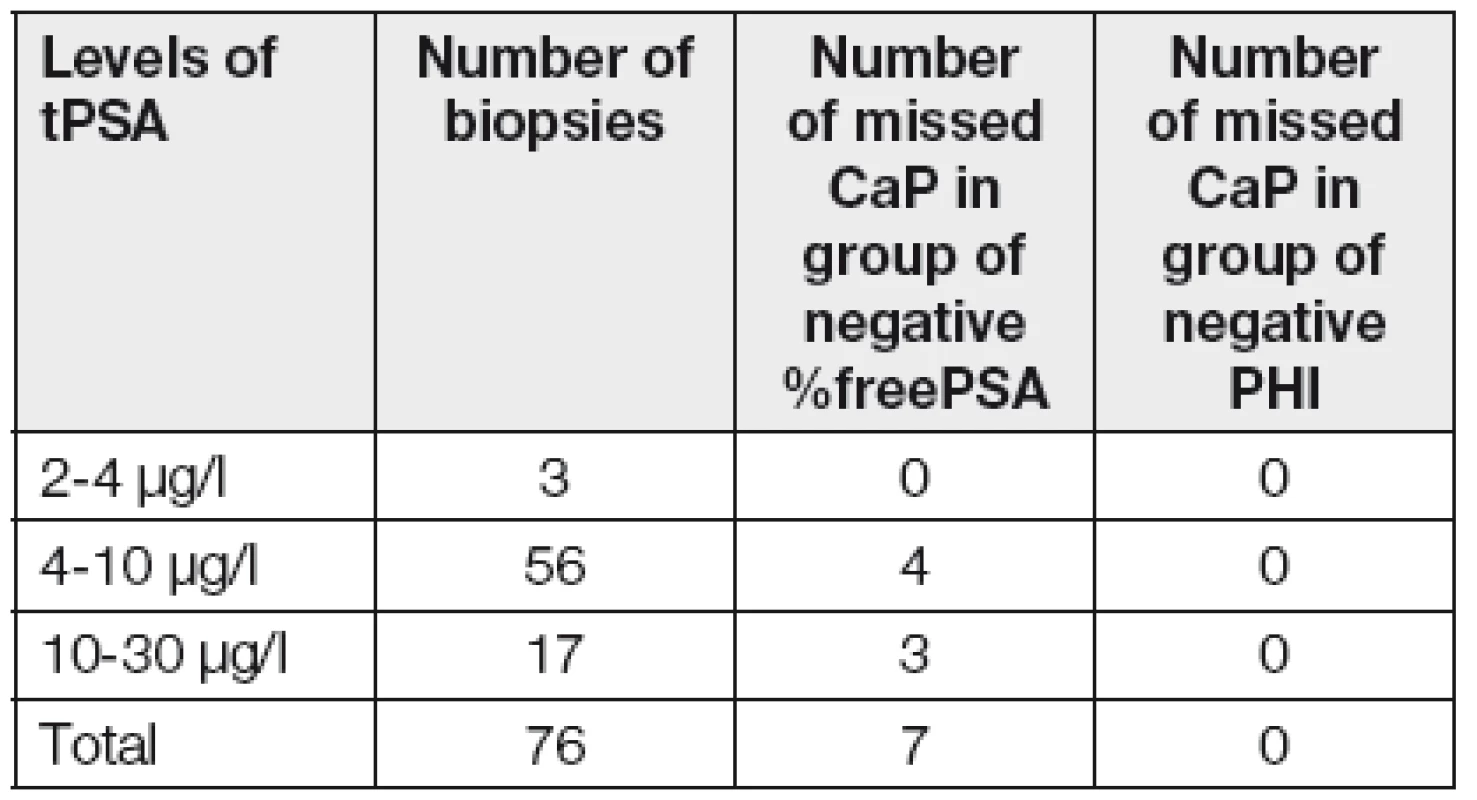
Ve srovnání s literaturou, kde autoři uvádějí zpřesnění indikace k biopsii prostřednictvím výpočtu %freePSA [9, 10], pak v našem souboru přispívá tento výpočet jen velmi omezeně. Silná statistická významnost absolutních hodnot indexu PHI i samotného [-2]proPSA potvrzují, že tyto markery by mohly velmi výrazně pomoci urologovi v jeho rozhodování o provedení biopsie, případně rebiopsie. Toto se ukázalo při úvahách o eventuálních nadbytečných biopsiích. Zabránění provádění zbytečných biopsií by mělo dopady zcela jistě nejen zdravotnické a psychologické, ale nepochybně i ekonomické. Náklady na diagnostiku pomocí těchto markerů představují částku cca 700 Kč, naproti tomu náklady na provedení jedné biopsie dosahují výše cca 5 000 Kč.
Závěr
Naše výsledky svědčí o tom, že stanovení [-2]proPSA a výpočet indexu PHI umožnuje zvýšit spolehlivost diferenciální diagnostiky karcinomu prostaty a současně, pokud ověříme naše pilotní zkušenosti na rozsáhlejší studii, povede ke snížení počtu prováděných biopsií.
Tato studie byla podpořena z projektu Ministerstva zdravotnictví České republiky Institucionální podpora na dlouhodobý koncepční rozvoj výzkumné organizace 00669806 – FN Plzeň.
Do redakce došlo 22. 11. 2012
Adresa pro korespondenci:
MUDr. Radka Fuchsová
FN Plzeň
Laboratoř imunochemické diagnostiky, Oddělení nukleární medicíny
Dr. E. Beneše 13
305 99 Plzeň
e-mail: fuchsovar@fnplzen.cz
Sources
1. Shariat, S. F., et al. Tumor Markers in Prostate Cancer I: Blood-Based Markers. Acta Oncologica (Stockholm, Sweden), 2011, vol. 50 Suppl 1, s. 61-75, ISSN 1651-226X, 0284-186X.
2. Makarov, D. V., et al. Biomarkers for Prostate Cancer. Annual Review of Medicine, 2009, vol. 60, s. 139-151, ISSN 1545-326X, 0066-4219.
3. Heijnsdijk, E. A., et al. Overdetection, Overtreatment and Costs in Prostate-Specific Antigen Screening for Prostate Cancer. British Journal of Cancer, 2009, vol. 101, no. 11, s. 1833-1838, ISSN 1532-1827, 0007-0920.
4. Klečka, J. et al. Nádorové markery karcinomu prostaty. Ces. Urol., 2008, 12(3), s. 173-185.
5. Catalona, W. J., et al. A Multicenter Study of [-2]Pro-Prostate Specific Antigen Combined with Prostate Specific Antigen and Free Prostate Specific Antigen for Prostate Cancer Detection in the 2.0 to 10.0 ng/ml Prostate Specific Antigen Range. The Journal of Urology, 2011, vol. 185, no. 5, s. 1650-1655, ISSN 1527-3792, 0022-5347.
6. Sokoll, L. J., et al. A Prospective, Multicenter, National Cancer Institute Early Detection Research Network Study of [-2]proPSA: Improving Prostate Cancer Detection and Correlating with Cancer Aggressiveness. Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology, 2010, vol. 19, no. 5, s. 1193-1200, ISSN 1538-7755, 1055-9965.
7. Khan, M. A., et al. Evaluation of Proprostate Specific Antigen for Early Detection of Prostate Cancer in Men with a Total Prostate Specific Antigen Range of 4.0 to 10.0 ng/ml. The Journal of Urology, 2003, vol. 170, no. 3, s. 723-726, ISSN 0022-5347, 0022-5347.
8. Roehl, K. A.; Antenor, J. A.; Catalona, W. J. Serial Biopsy Results in Prostate Cancer Screening Study. The Journal of Urology, 2002, vol. 167, no. 6, s. 2435-2439, ISSN 0022-5347, 0022-5347.
9. Catalona, W. J., et al. Use of the Percentage of Free Prostate-Specific Antigen to Enhance Differentiation of Prostate Cancer from Benign Prostatic Disease: A Prospective Multicenter Clinical Trial. JAMA: The Journal of the American Medical Association, 1998, vol. 279, no. 19, s. 1542-1547, ISSN 0098-7484, 0098-7484.
10. Mikolajczyk, S. D., et al. Free Prostate-Specific Antigen in Serum is Becoming More Complex. Urology, 2002, vol. 59, no. 6, s. 797-802, ISSN 1527-9995, 0090-4295.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2013 Issue 1-
All articles in this issue
- Buněčnost likvoru, energetické poměry v likvorovém kompartmentu a intenzita zánětlivé odpovědi v centrálním nervovém systému
- Význam a možnosti vyšetřování metabolismu mozku pomocí mikrodialýzy v neurointenzivní péči
- Stanovení sérových markerů v diferenciální diagnostice časného karcinomu prostaty (pilotní studie)
- Nové regulační hormony mateřského mléka
- Prevalence míry snížení glomelurální filtrace u pacientů s monoklonální gamapatií neurčeného významu
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam a možnosti vyšetřování metabolismu mozku pomocí mikrodialýzy v neurointenzivní péči
- Buněčnost likvoru, energetické poměry v likvorovém kompartmentu a intenzita zánětlivé odpovědi v centrálním nervovém systému
- Stanovení sérových markerů v diferenciální diagnostice časného karcinomu prostaty (pilotní studie)
- Nové regulační hormony mateřského mléka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

