-
Medical journals
- Career
Význam a možnosti vyšetřování metabolismu mozku pomocí mikrodialýzy v neurointenzivní péči
: A. Hejčl 1,7,8,9; P. Kelbich 3,4,5; M. Bolcha 1; J. Procházka 2; E. Hušková 2; J. Peruthová 4,6; M. Sameš 1
: Neurochirurgická klinika Univerzity J. E. Purkyně, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z. 1; Oddělení intenzivní medicíny, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z. 2; Oddělení klinické biochemie, Krajská zdravotní, a. s. - Masarykova nemocnice v Ústí nad Labem, o. z. 3; Oddělení klinické biochemie, hematologie a imunologie Nemocnice Kadaň s. r. o. 4; Ústav klinické imunologie a alergologie, Lékařská fakulta v Hradci Králové, Univerzita Karlova v Praze 5; Fakulta chemicko-technologická, Univerzita Pardubice 6; Centrum klinického výzkumu ICRC, Brno 7; Ústav experimentální medicíny AVČR, v. v. i., Praha 8; Neurochirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Ústřední vojenské nemocnice v Praze 9
: Klin. Biochem. Metab., 21 (42), 2013, No. 1, p. 13-20
Cíle studie:
1. Seznámení biochemické obce s využitím mikrodialýzy v neurochirurgii, resp. v neurointenzivní péči. 2. Představení hypotézy o kreatinfosfátu coby alternativním zdroji energie pro mozkovou tkáň.Typ studie:
Přehledná práceMateriál a metody:
Sběr vzorků extracelulární tekutiny umožňuje ve standardním protokolu vyšetřit metabolity glukózového metabolismu s cílem včasného záchytu rozvíjející se ischemie mozku. Mikrodialýzu využíváme převážně u pacientů po kraniocerebrálním poranění či subarachnoidálním krvácení z prasklé mozkové výdutě. Nicméně v odebraných vzorcích je možno vyšetřit rozsáhlou škálu dalších metabolitů a biologicky aktivních látek a rozšířit tak naše poznání o procesech probíhajících v mozku.Výsledky:
Shrnujeme poznatky o mikrodialýze v neurointenzivní péči neurochirurgických pacientů, možnosti vlivu na aktuální terapii stejně jako význam prediktivní. V naší experimentální práci se zaměřujeme na metabolismus kreatinfosfátu, který dle našich prvních pozorování může být klíčovou energetickou alternativou kyslíkového metabolismu, jak demonstrujeme na dvou kazuistikách.Závěr:
Mikrodialýza nabízí možnost přímé, průběžné monitorace metabolismu mozku v běžné klinické praxi. Standardní diagnostiku lze rozšířit o spektrum dalších metabolitů a biologicky aktivních látek. Dle našich prvních pozorování může být kreatinfosfát významným alternativním zdrojem energie pro mozek.Klíčová slova:
mikrodialýza, neurointenzivní péče, metabolismus mozku, metabolismus glukózy, kreatinfosfátový systém.Úvod
Pro léčbu a monitoraci stavu mozku za různých patologických situací je v neurointenzivní péči zásadní znát stav mozkové tkáně. V současné době máme k dispozici kombinaci neurologického vyšetření, zobrazovacích vyšetření, vyšetření mozkomíšního moku a u pacientů v bezvědomí měření intrakraniálního tlaku (ICP = intracranial pressure). Novou modalitou, která umožňuje vyšetřování metabolismu mozku je mikrodialýza [1]. Pomocí mikrodialyzačního katétru implantovaného v mozku (obr. 1 A, B) získáváme vzorky extracelulární tekutiny (ECT), ve kterých následně vyšetřujeme parametry metabolismu glukózy a koncentrace glycerolu. V získaném materiálu lze dále vyšetřit velké množství dalších metabolitů a biologicky aktivních látek, což nabízí ohromný potenciál pro studium mozku jak v laboratorních, tak i v běžných klinických podmínkách. V první části našeho sdělení předkládáme základní údaje o mikrodialýze z pohledu neurochirurgie a neurointenzivní péče [2 - 4]. V druhé části pak prezentujeme vlastní úvahu o možném významu kreatinfosfátového systému při krátkodobé insuficienci kyslíkového metabolismu v mozku.
Mikrodialýza
Mikrodialýza byla od 60. let 20. století vyvíjena ve Švédsku prof. Urbanem Ungerstedtem. Profesor Ungerstedt zkoumal cévy v řezech nervové tkáně a vyvinul katétry, které napodobují funkci cév v nervové tkáni a pomocí difúze zajišťují výměnu mezi proplachovým roztokem a ECT (obr. 1 A). Primárně byla tato metoda testována v nervové tkáni, nicméně dnes je využívána pro vyšetřování prakticky všech ostatních biologických tkání. V našem sdělení se však budeme zabývat pouze jejím využitím v problematice centrálního nervového systému (CNS) neurochirurgických a „neurointenzivistických“ pacientů.
Principem mikrodialýzy (obr. 1 A) je dvojitě dutý katétr promývaný perfúzním roztokem na bázi Ringerova roztoku. Katétrem teče konstantní rychlostí perfúzní roztok. Vnější semipermeabilní membrána umožňuje výměnu metabolitů, resp. „sběr“ metabolitů z extracelulární tekutiny tkáně. Vnitřní membránou pak takto „obohacený“ roztok odtéká do mikroampulky, ze které je odebírán k následné analýze.
Fig. 1: Microdialysis in neurointensive care 1A. The principle of a microdialysis probe (right), mimicking a brain blood vessels (left). The semi-permeable membrane of the microdialysis probe allows for diffusion of metabolites into the probe, being delivered via the perfusion fluid into a microvial, which is then analyzed. Glucose and oxygen are delivered to the brain. In case of ischemia, the concentration of glucose decreases, while the concentrations of lactate and pyruvate increase. More severe ischemia results in cellular membranes degradation, resulting in increased glycerol. 1B. A CT scan of a patient with acute subdural hematoma associated with contusion in the right frontal lobe and implanted ICP, tissue oxymetry and microdialysis probes (inside the white circle). 1C. Multimodal monitoring at the intensive care unit (ICU). A patient with two sets of probes implanted in frontal lobes. In detail: A patient with an implanted microdialysis probe at the Neuro-ICU. Microdialysis pump propels the perfusion fluid, and later it is collected in microvials, which are analyzed every 60 minutes. 
Průběh „sběru“ ECT je závislý na několika faktorech. Dva z těchto faktorů můžeme do určité míry ovlivnit. Za prvé je to rychlost toku perfúzního roztoku. Ta je dána rychlostí perfúzní pumpy. Standardně se prodávají a užívají mikrodialyzační pumpy s průtokem 0,3 µl/min. Tato rychlost umožňuje získat přibližně 70 % reálných koncentrací analyzovaných látek v ECT. Jsou k dispozici i pumpy s průtokem 1,0 µl/min pro vyšetřování krátkodobých pochodů (např. rozvoj ischemizace nervové tkáně při dočasném klipu aneuryzmatu, což je většinou událost několika málo minut apod.). Pro běžnou praxi ale není nutné přepočítávat koncentrace metabolitů na reálné hodnoty, neboť nás spíše zajímají jejich vývojové trendy.
Dalším důležitým parametrem je propustnost semipermeabilní membrány. K dispozici máme standardní katétry o propustnosti 20 kDa. Vzhledem k metabolitům, které jsou standardně vyšetřovány (glukóza, pyruvát, laktát, glycerol), je tato hodnota naprosto dostačující. Pro vyšetřování proteinů jsou k dispozici katétry o velikosti 100 kDa.
Průběžné stanovení koncentrací glukózy v ECT se provádí metodou s glukózooxidázou a peroxidázou, pyruvátu metodou s pyruvátoxidázou a peroxidázou, laktátu metodou s laktátoxidázou a peroxidázou a glycerolu v ECT metodou s glycerolkinázou, glycerolfosfát-oxidázou a peroxidázou na spektrofotometru, který je součástí analyzátoru CMA 600 Microdialysis či ISCUSflex (CMA Microdialysis AB, Kista, Švédsko).
Naše hlavní pozornost je věnována analýze parametrů energetického metabolismu glukózy, tedy koncentracím glukózy, pyruvátu a laktátu v ECT. Glukóza je dominujícím energetickým substrátem pro tkáň CNS, pyruvát je významný meziprodukt energetického metabolismu a laktát produkt anaerobního metabolismu. Podstatné je sledování případného rozvoje anaerobního metabolismu v mozku. S jeho zvyšujícím se rozsahem dochází ke snížení produkce energie v podobě adenosintrifosfátu (ATP). Tento pokles je do jisté míry eliminován hyperglykolýzou a zvýšením metabolického obratu. Při nedostatečné oxygenaci mozku tak dochází ke snížení koncentrace glukózy a zároveň ke zvýšení koncentrací pyruvátu a laktátu v ECT. Dalším ze standardně vyšetřovaných parametrů je degradační produkt lipidů glycerol, coby marker tkáňové destrukce. Jeho zvýšená koncentrace v ECT je spolehlivou indikací zvýšeného rozpadu buněk při nekróze, např. na podkladě těžké ischémie či traumatu mozku. Posledním běžně vyšetřovaným metabolitem je glutamát. Z hlediska funkce mozku se jedná o excitační aminokyselinu, jejíž hladina se zvyšuje u rozvíjející se či probíhající ischémie. Glutamát je tak velmi dobrým indikátorem ischémie u pacientů se subarachnoidálním krvácením (SAK) [5,6] a využívá se ho především v diagnostice vazospazmů. Navíc má značný prediktivní význam, neboť jeho zvýšená koncentrace koreluje se špatným klinickým výsledkem těchto pacientů [7]. Jak již bylo uvedeno výše, získání vzorku extracelulární tekutiny CNS umožňuje provést vyšetření množství dalších parametrů, čímž získáváme velký prostor pro experimentální studium mozku v klinice i v základním výzkumu. Vždyť počet publikací týkajících se mikrodialýzy je dnes již přes 13 000!
Využití mikrodialýzy u pacientů v neurointenzivní péči
Cerebrovaskulární problematika
Mikrodialýza je nejčastěji využívána u pacientů se subarachnoidálním krvácením, méně u pacientů s intracerebrálním hematomem či po iktu (obr. 1 B, C). Nejčastější využití je u pacientů se subarachnoidálním krvácením na podkladě ruptury intrakraniálního aneuryzmatu. Po ruptuře aneuryzmatu dochází dle různých studií ve 30-70 % případů k rozvoji vazospazmů. Klinický projev vazospazmů je nazýván pozdní ischemický neurologický deficit (DIND – delayed ischemic neurological deficit); ten lze pozorovat u 15-20 % pacientů. Následkem je pak rozvoj iktu či úmrtí. Mikrodialýza se využívá právě k monitoraci tkáně ohrožené vazospazmy. Dle konsenzu z roku 2004 se doporučuje zavést katétr mikrodialýzy do povodí mateřské tepny aneuryzmatu, tedy do oblasti s nejvyšším rizikem rozvoje vazospazmů [8]. Skjøth-Rasmussen et al. [9] sledovali u 42 pacientů se SAK parametry mikrodialýzy (poměr laktát/pyruvát – LP poměr, poměr laktát/glukóza – LG poměr, koncentrace glycerolu). Za indikátory ischémie mozkové byly považovány: elevace LP poměru a LG poměru o 20 % následované zvýšením koncentrace glycerolu o více než 20 % v průběhu 24 hodin. U 17 pacientů z 18 s rozvojem DIND autoři zjistili, že došlo k elevaci LP a LG poměrů více jak 20 hodin a k elevaci koncentrace glycerolu 7 hodin před rozvojem klinických změn. Podle této studie tedy mikrodialýza nabízí možnost časné diagnózy rozvoje klinických vazospazmů, což lze využít v časném zahájení preventivních a terapeutických opatření (intenzifikace tzv. „2H“ terapie - hypertenze a hypervolémie). Specificita rozvoje DIND podle mikrodialýzy je 89 % a senzitivita 82 %. Unterberg et al. porovnávali specificitu mikrodialýzy, transkraniální dopplerometrie (TCD) a digitální substrakční angiografie (DSA) v diagnostice DIND. Jako definici sekundární neurologické deteriorace podle mikrodialýzy považovali hodnoty laktátu > 4 mmol/l a glutamátu > 3 µmol/l po dobu nejméně 6 hodin. Ve studii ukazují, že mikrodialýza má v porovnání s ostatními standardně užívanými diagnostickými metodami nejvyšší pozitivní prediktivní hodnotu pro rozvoj DIND u pacientů se SAK při ruptuře aneuryzmatu [10].
Jinou skupinou jsou pacienti se spontánním intracerebrálním hematomem (ICH). Miller et al. po odsátí intracerebrálního hematomu implantovali katétr mikrodialýzy do přilehlé tkáně. Zjistili zvýšené koncentrace glutamátu v ECT a normální hodnoty LP poměru v okolní tkáni. Tyto výsledky ukazují, že intracerebrální hematomy nejsou obklopeny tkaní se známkami ischemické penumbry, ale spíše oblastí hyperexcitační aktivity [11]. Na druhou stranu monitorace metabolismu tkáně v okolí hematomu může pomoci v nastavení např. správného perfúzního tlaku mozku u pacientů se spontánním ICH [12].
Neurotraumatologická problematika
Pacienti s neurotraumaty jsou ohroženi rozvojem ischémie mozku. Důvodů může být několik, například pacienti s intrakraniální hypertenzí jsou ohroženi nedostatečnou perfúzí mozku. Nárůst intrakraniálního tlaku často souvisí s progresí patofyziologických procesů, tzn. edému mozku, prokrvácení kontúze, progrese krvácení apod. Při diagnostice postižení pacientů, kteří jsou v bezvědomí a kontinuálně analgosedováni, zjistíme změny až dle nárůstu ICP, jehož sledování je standardem péče. Monitorace metabolických změn by ale mohla zrychlit diagnostiku patologických změn. Tuto tézi podporují některé publikované výsledky. Belli et al zjistili, že patologická elevace LP poměru (nad 25) v 89 % předpověděla elevaci intrakraniálního tlaku nad 20 mmHg [13]. Adamides et al. ve studii na 14 pacientech s těžkým poraněním mozku s monitorováním ICP a tkáňového metabolismu dospěli ke zjištění, že nárůst koncentrací tkáňového laktátu, poměru laktát/pyruvát a glycerolu o více než 2 hodiny předcházely elevacím ICP [14]. Z dosavadních studií se tak v tomto ohledu zdá být nejzásadnějším ukazatelem LP poměr.
Pokud se týká vztahu mezi tkáňovým metabolismem a klinickým vývojem, existuje několik prací, jejichž výsledky však nejsou zcela jednoznačné. Li et al. [15] zjistili korelaci vyšších koncentrací glycerolu se špatným klinickým vývojem. Podobně i Peerdemann et al. [16] zjistili 100 % prediktivní hodnotu špatného klinického stavu pacientů, pokud se v průběhu jejich monitorace objevila elevace koncentrace glycerolu v ECT nad 150 µmol/l. Na druhou stranu ale Clausen et al. korelaci mezi koncentracemi extracelulárního glycerolu mozku a výsledným klinickým stavem pacientů nenašli [17]. V rámci naší vlastní studie jsme zjistili korelaci mezi patologicky vysokou koncentrací glycerolu a LP poměru v perilezionální oblasti s úmrtím pacientů po těžkém kraniocerebrálním poranění. Naopak u koncentrací glukózy v ECT jsme významnou prediktivní hodnotu nezjistili [18]. Nejednotnost výsledků může souviset s tím, že mikrodialýza jako lokální metoda dokáže detekovat změny pouze v nejbližším okolí implantovaného katétru. Je proto vždy důležité identifikovat, z které části mozku je vyšetřovaná ECT získána (obr. 1 B).
Kreatinin coby neuromarker?
Mikrodialýza je tedy velmi dobrým nástrojem sledování metabolismu tkáně v podstatě „přenášeného téměř v reálném čase“. Oblastí, na kterou jsme se zaměřili na našich pracovištích je alternativní substituce energetických potřeb mozku kreatinfosfátovým systémem při krátkodobé insuficienci kyslíkového metabolismu. V tkáních s vysokým energetickým obratem, jako je pruhované svalstvo a zřejmě též mozek, slouží kreatinfosfátový systém coby zdroj energie [19]. Tato energie je kumulována v kreatinfosfátu vznikajícím za katalytického působení kreatinfosfokinázy (CK) fosforylací kreatinu. K jejímu uvolnění pak dochází neenzymatickou defosforylací kreatinfosfátu za produkce odpadního kreatininu. A právě analyticky dostupný kreatinin nás velmi zajímá coby ukazatel poskytování energie kreatinfosfátovým systémem v mozku.
Kreatin se syntetizuje převážně v játrech či slinivce břišní [20] a existují literární zmínky o jeho produkci přímo v mozku [21]. Experimentálně bylo prokázáno, že astrocyty jej dokáží syntetizovat z glycinu přidaného do kultivačního média [22]. Syntéza probíhá ve 2 krocích, které jsou katalyzovány L-argininglycinamidinotransferázou (AGAT) a S-adenosylmethioninguanidinacetát N-metyltransferázou (GAMT). Ubiquitérní mitochondriální CK se selektivně nachází v mitochondriích neuronů, zatímco mozkově specifická CK se nachází v astrocytech a inhibičních neuronech. Jak astrocyty, tak i inhibiční neurony jsou značně odolné proti akutní ztrátě energie [23]. GAMT je převážně obsažena v gliích, zvláště v oligodendrocytech a olfaktoriálních gliálních elementech a relativně často také v astrocytech [19]. Neuronální axony spotřebovávají ohromné množství energie k udržení iontových gradientů přes axolemu, propagaci akčních potenciálů a transportu molekul do vzdálených míst. Z tohoto důvodu je pro správné fungování kreatinfosfátového systému vztah mezi gliemi a neurony zásadní.
Vedle zmíněné intrathekální syntézy je ale kreatin též aktivně transportován do mozku přes hematoencefalickou bariéru pomocí Na a Cl-dependentního transportního systému (CRT) [24].
Naše hypotéza
Pro udržení vysokého stupně uspořádanosti mozkové tkáně je potřeba stálých dodávek velkého množství energie. Ty jsou zajištěny především aerobní přeměnou glukózy. Vedle toho je synapsemi využíván též energetický potenciál laktátu.
Předpokládáme, že existuje energetická alternativa pro krytí energetických potřeb mozku při krátkodobých výpadcích dodávek kyslíku. Její úlohu pravděpodobně plní kreatinfosfátový systém. Tuto úvahu podporují především zmíněná intrathekální syntéza kreatinu, existence transportního systému pro kreatin na hematoencefalické barieře (SLC6A8) a také existence mozkového isoenzymu kreatinfosfokinázy (CK-BB).
S použitím mikrodialýzy jsme u 6 pacientů (5 mužů a 1 žena) analyzovali hladiny kreatininu v ECT mozku. Sedovaní a ventilovaní pacienti měli implantovaný katétr mikrodialýzy a parenchymové čidlo k měření intrakraniálního tlaku a tkáňové oxymetrie. Hodnoty ICP a tkáňové oxymetrie byly registrovány kontinuálně, vzorky mikrodialýzy byly odebírány po 60 minutách. Po analýze standardně vyšetřovaných parametrů v ECT (koncentrace glukózy, laktátu, pyruvátu a glycerolu) byly zbytky vzorků slity po 12 či 24 hodinách (v závislosti na množství zbytkových vzorků) a použity k měření koncentrací glukózy enzymatickou metodou s hexokinázou, laktátu enzymatickou metodou s laktátoxidázou a peroxidázou a kreatininu metodou Jaffé na biochemickém analyzátoru Architect, fy Abbott Laboratories.
Pro hodnocení energetických poměrů v mozkovém parenchymu jsme použili výpočty koeficientu energetické bilance (KEB), doposud používaného pro sledování rozsahu anaerobního metabolismu v likvorovém kompartmentu [25 - 29].
Během našich pozorování jsme zaregistrovali častý nárůst koncentrací kreatininu v ECT po epizodách závažných poruch metabolismu mozkové tkáně s nápadnými poklesy hodnot KEB či známkami tkáňové hypoxie prokázanými tkáňovou oxymetrií.
Tuto situaci ilustrujeme na 2 kazuistikách:
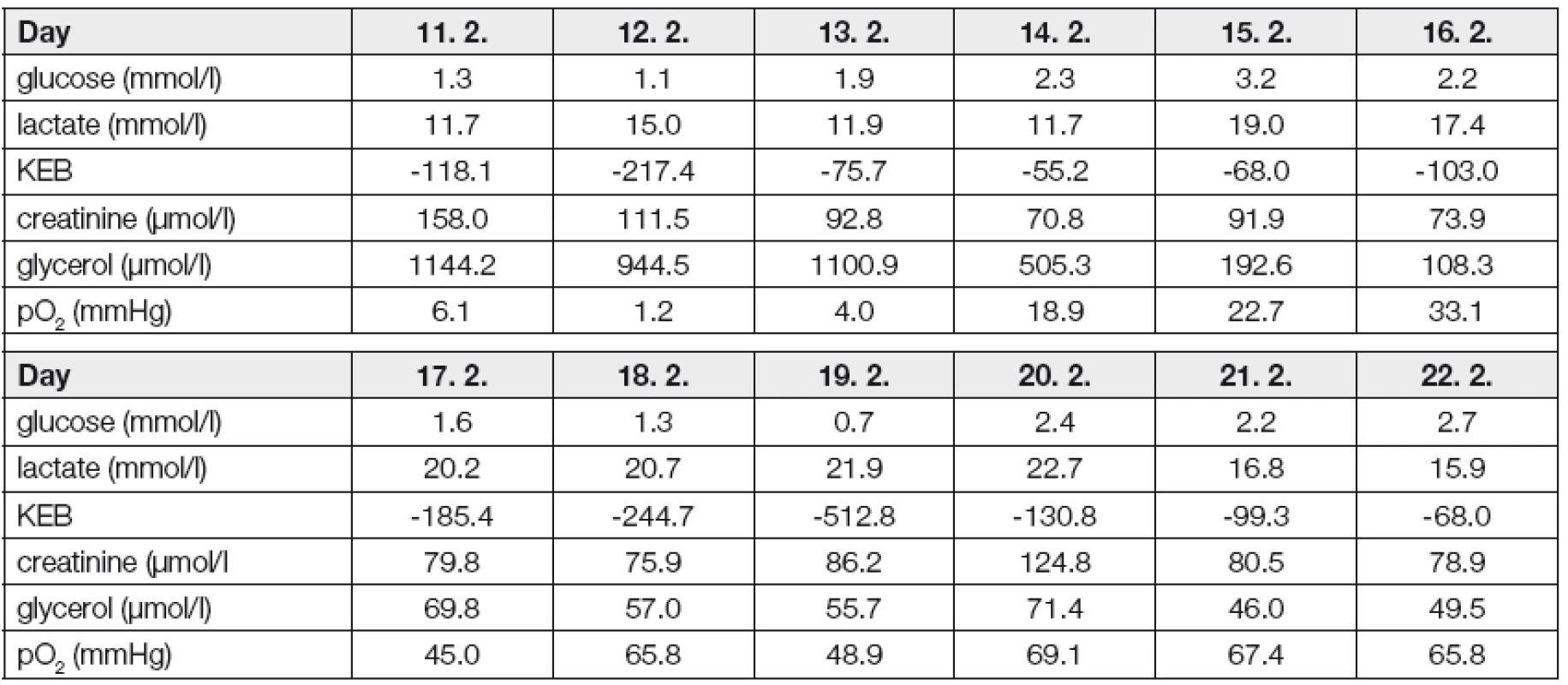
Kazuistika 1 (obr. 2, Tabulka 1)
Fig. 2 : Brain metabolism, brain tissue oxymetry, and creatinine concentrations in a Case 1 patient. The graph represents trends of the monitored parameters, while the real concentrations are in the Table below. 
70letý pacient byl přijat do nemocnice pro kruté bolesti hlavy s následnou poruchou vědomí na akutním příjmu, která rychle progredovala (Hunt-Hess 5). Pacient byl zaintubován. Dle CT a CT angiografie mozku bylo zjištěno subarachnoidální krvácení s objemným intracerebrálním hematomem v pravém frontálním laloku při ruptuře aneuryzmatu přední komunikující artérie (Fisher 4). Pacient byl akutně operován, aneuryzma bylo uzavřeno klipem a většina hematomu byla odsáta. Následně byl sledován na jednotce intenzivní péče. Čtvrtý pooperační den došlo ke zhoršení jeho stavu. Vzhledem k progresi rychlostí průtoku krve dle trans-kraniální dopplerometrie byla 6. pooperační den provedena intraarteriální aplikace vazospasmolytik (milrinon i.a., 20 mg po dobu 30 min) a implantace čidla multimodální monitorace (čidlo intrakraniálního tlaku, tkáňové oxymetrie a mikrodialýzy). Intrakraniální tlak byl patologicky vysoký, proto jsme přistoupili k bifrontální dekompresivní kraniektomii.
Metabolismus mozku byl tedy sledován od 6. dne po vzniku SAK. Hned při prvních vyšetřeních ECT v době od 19.00 do 24.00 hod. dne 11. 2. 2011 pozorujeme nápadně zvýšenou koncentraci kreatininu. Tento jev si vysvětlujeme „výpadky“ kyslíkového metabolismu v mozku v těsně předcházejícím období, během něhož jsme registrovali vazospazmy a před provedením dekompresivní kraniektomie rovněž vysoký intrakraniální tlak. Předpokládáme, že nedostatečná produkce energie následkem zhoršené oxygenace mozku byla substituována defosforylací kreatinfosfátu vedoucí k nadprodukci kreatininu.
Dne 12. 2. dosahuje pO2 v mozku svého minima. Tomu odpovídá též náhlé zvýšení rozsahu anaerobního metabolismu v extracelulárním prostředí mozku vyjádřené nápadným snížením hodnoty KEB. Následně ale k nárůstu koncentrace kreatininu v ECT nedochází. V souvislosti s pozorovaným jevem zvažujeme, že v krátkém období, navíc energeticky insuficientním, nedošlo k deponování využitelného energetického potenciálu do kreatinfosfátu. Další „výpadek“ kyslíkového metabolismu v mozku tak zůstal bez alternativní energetické saturace kreatinfosfátovým systémem, což vedlo k dalšímu poškození tkáně mozkového parenchymu, čemuž odpovídá nápadný nárůst koncentrace glycerolu dne 13. 2.
V období od 13. 2. do 18. 2. se zvyšuje okysličení mozku. Současný pozvolný pokles hodnot KEB sledujících zvyšující se rozsah anaerobního metabolismu v extracelulárním prostředí mozku přičítáme posttraumatickému reparačnímu zánětlivému procesu v této lokalitě. Ostatně tomu odpovídá též uspokojivě se snižující koncentrace glycerolu v ECT. V tomto energeticky příznivém období jsou vhodné podmínky pro regeneraci kreatinfosfátového systému.
Dne 19. 2. dochází ke zhoršení okysličení mozku a k náhlému výraznému zvýšení anaerobního metabolismu v jeho extracelulárním prostředí. Jenomže v tomto případě je již „výpadek“ kyslíkového metabolismu úspěšně substituován uvolněním energie z kreatinfosfátu, o čemž svědčí nápadné zvýšení koncentrace odpadního kreatininu v ECT dne 20. 2. Že i přes dočasnou insuficienci kyslíkového metabolismu dokázal kreatinfosfátový systém alternativně saturovat vysoké energetické potřeby mozku a zabránit tak porušení jeho integrity, svědčí přetrvávající nízké koncentrace glycerolu v ECT.
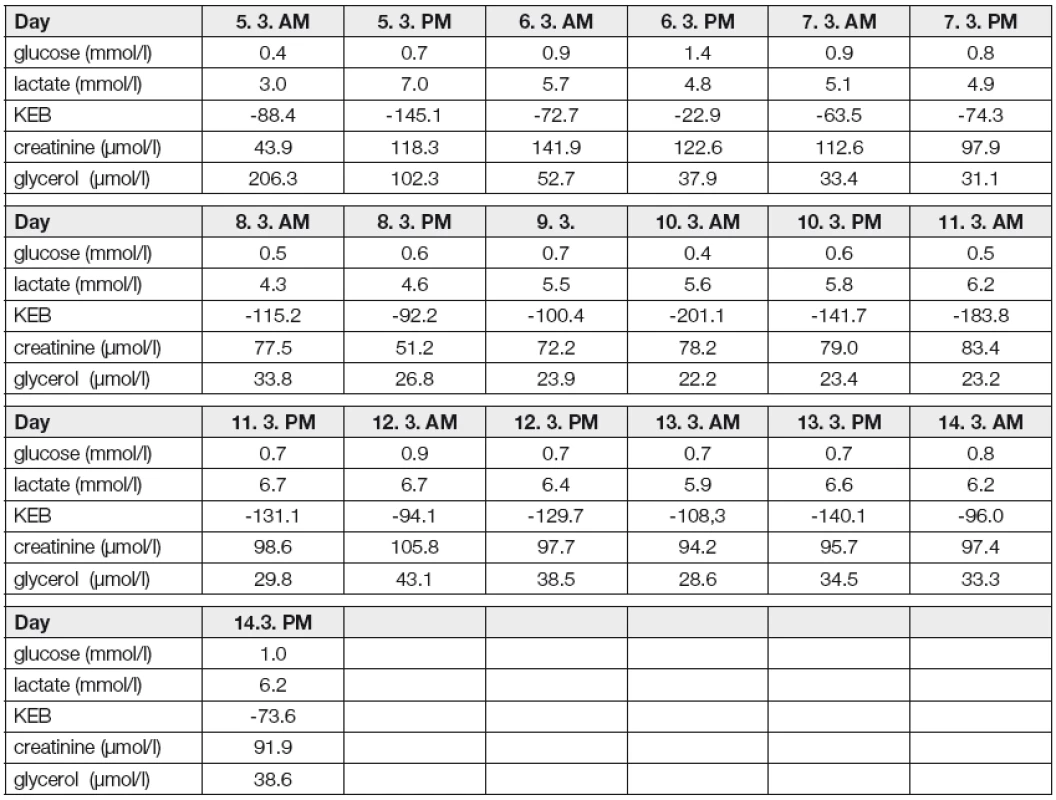
Kazuistika 2 (obr. 3, Tabulka 2)
Fig. 3 : Brain metabolism monitoring in a Case 2 patient, four days after SAH. The graph represents trends of the monitored parameters, while the real concentrations are in the Table below. 
57letá pacientka byla akutně operována pro rupturu aneuryzmatu střední mozkové tepny. Při operaci byl částečně evakuován intracerebrální hematom v pravém temporálním laloku. Pro přetrvávající edém na podkladě zbytkového hematomu byla 4. den po SAK provedena dekompresivní kraniektomie. Pro rozvoj vazospazmů proximálních úseků pravé střední a přední mozkové tepny (M1 a A1 dx) byla 8. a 11. den aplikována intraarteriálně spasmolytika (milrinon 0,25 mg/min, celková dávka 8 mg).
Metabolismus mozku byl tedy monitorován od 4. dne po SAK. Dne 5. 3. odpoledne zaznamenáváme zhoršení kyslíkového metabolismu mozku vyjádřené snížením hodnoty KEB (tkáňová oxymetrie mozku nebyla u této pacientky monitorována). Ještě v průběhu této epizody se zvyšuje koncentrace kreatininu v ECT s kulminací v dopoledních hodinách následujícího dne. Popsaný obraz jsme vyhodnotili jako vykrytí dočasné kyslíkové insuficience v mozku defosforylací kreatinfosfátu. Úvahu, že díky energetické substituci kreatinfosfátovým systémem nedošlo k poškození tkáně mozku, podporuje příznivý trend v podobě nadále se snižující koncentrace glycerolu v ECT.
Další dvě po sobě jdoucí epizody zhoršení kyslíkového metabolismu pozorujeme 10. 3. a 11. 3. v dopoledních hodinách v podobě snížených hodnot KEB. Opět následuje zvýšení koncentrace kreatininu v ECT kulminující 12. 3. dopoledne, což vyhodnocujeme jako projev energetické substituce kyslíkové insuficience v mozku defosforylací kreatinfosfátu. Jisté zvýšení koncentrace glycerolu v ECT 12. 3. dopoledne nasvědčuje tomu, že se tato událost neobešla zcela bez nepříznivého dopadu na mozkovou tkáň. Rychlá normalizace stavu však zřejmě znamená pouze malý rozsah poškození, pravděpodobně díky neuroprotektivnímu efektu kreatinfosfátového systému.
Diskuze
Mikrodialýza se v neurointenzivní péči využívá od 90. let 20. století. Jejímu razantnějšímu rozšíření zatím brání často nejednoznačný terapeutický algoritmus v závislosti na obtížné interpretaci výsledků měření a také finanční náročnost jejího pořízení a následného provozu. Na druhou stranu tato metoda umožňuje přímý pohled na energetický metabolismus mozkové tkáně v místě implantace čidel a podle některých studií nabízí možnost včasného varování, např. při rozvoji vazospazmů či před nárůstem intrakraniálního tlaku. V porovnání s mikrodialýzou je jiná obdobná metoda, tkáňová oxymetrie mozku (např. systém Licox, Integra Neurosciensces, Plainsboro, NJ, USA), přímočařejší a jednodušší. Zatímco tkáňová oxymetrie informuje pouze o dodávce kyslíku mozkové tkáni, mikrodialýza podává informaci o efektivitě využití kyslíku mozkovou tkání. V naší praxi neurointenzivní péče používáme kombinace obou systémů.
Druhým zajímavým aspektem mikrodialýzy je využití experimentální, jak na úrovni laboratorní, tak i klinické. Díky tomu, že získáváme vzácnou extracelulární tekutinu CNS, můžeme tuto podrobit analýze různých metabolitů a biologicky aktivních látek. My jsme se na našich pracovištích zaměřili na vyšetřování energetických poměrů v CNS; mimo jiné také proto, že s nimi máme velice dobrou zkušenost při vyšetřovaní mozkomíšního moku.
Úvahy o vícezdrojovém energetickém zásobení CNS nás dovedly k zakomponování alternativního energetického systému do monitorace procesů v mozkovém pa-renchymu. Tím je dočasná kumulace energie v podobě kreatinfosfátu a její uvolnění při zvýšených energetických nárocích mozku, příp. při výpadku kyslíkového metabolismu. Z našich dosavadních pozorování, jejichž příkladem jsou uvedené kazuistiky, pak vyplývá, že samotný dočasný výpadek kyslíkového metabolismu nemusí pro mozek znamenat ireverzibilní poškození, pokud je zároveň dostatečně zregenerovaný kreatinfosfátový systém. Nepříznivá situace nastává teprve v případě po sobě následujících výpadků kyslíkového metabolismu, kdy není umožněna kumulace energie v podobě kreatinfosfátu.
Naše představa je taková, že je do mozku dodáván, případně intrathékálně syntetizován, kreatin. V období hojnosti je energie kumulována v podobě kreatinfosfátu vzniklého fosforylací kreatinu za katalytického působení CK-BB. V období energetické nedostatečnosti (hypoxie mozku) dochází k neenzymatické defosforylaci kreatinfosfátu na kreatinin spřažené s fosforylací ADP na ATP. Tímto způsobem je tedy nouzově kryta energetická insuficience, čímž se zvyšuje naděje na zachování integrity mozkového parenchymu. Naše dosavadní měření tuto tezi podporují. Na příkladech jsme ukázali souvislost mezi poklesem KEB a následným „vzedmutím alternativního energetického okruhu“ rezultujícího v elevaci koncentrací kreatininu v ECT. Nicméně je nutné toto verifikovat na daleko větším souboru pacientů, případně též cestou experimentálních laboratorních studií na zvířecích modelech.
Závěr
Mikrodialýza je unikátní metoda umožňující v neurointenzivní péči vyšetřování extracelulární tekutiny mozku, a tím pádem především monitorování jeho energetického metabolismu. Využívá se dominantně v neurotraumatologii a v cévní neurochirurgii. Některé dosavadní výsledky představují optimistickou vizi časné detekce sekundárního poranění a ischemizace mozku s možností pohotové, a tudíž účinnější terapeutické intervence. Obecně lze konstatovat, že mikrodialýza umožňuje vyšetřování celé škály rozličných metabolitů a biologicky aktivních látek v tkáních, čímž lze považovat spektrum jejího využití za téměř neomezené.
Všeobecně přijatým faktem je nezbytnost kyslíkového metabolismu pro zachování integrity mozkového parenchymu. V rámci multimodální monitorace mozku je proto této problematice věnována velká pozornost. Ta sleduje především odhalování konstelací výsledných hodnot sledovaných parametrů vedoucích k nevratnému poškození tkáně CNS, objektivizovanému zvýšenými koncentracemi glycerolu jakožto markeru tkáňové destrukce v extracelulární tekutině mozku. Výsledky našeho vlastního pozorování nás pak vedou k přesvědčení, že vliv výkyvů kyslíkového metabolismu na mozkovou tkáň je nesporný, nikoliv ale výhradní.
Práce byla podpořena grantem IGA MZČR NT13883/4-2012 a projektem „PRVOUK“ P37/10 Univerzity Karlovy v Praze, Lékařské fakulty v Hradci Králové.
Do redakce došlo 22.10. 2012
Adresa pro korespondenci
MUDr. Aleš Hejčl, Ph.D.
Neurochirurgická klinika Univerzity Jana Evangelisty Purkyně
Masarykova nemocnice
Sociální péče 12A
401 13 Ústí nad Labem
e-mail: ales.hejcl@gmail.com
Sources
1. Hejčl, A., Bartoš, R., Humhej, I., et al. Dekompresivní kraniektomie v léčbě posttraumatického edému mozku a přínos nových monitorovacích metod. Cas. Lek. Cesk., 2007, 146, s. 307-312.
2. Hejčl, A., Bolcha, M., Procházka, J., Sameš, M. Multimodální monitorace u pacientů s těžkým poraněním mozku a subarachnoidálním krvácením. Cesk. Slov. Neurol. N., 2009, 72(105), s. 383-387.
3. Hejčl, A., Sameš, M. Mikrodialýza v neurochirurgii. Cesk. Slov. Neurol. N., 2009, 72(105), s. 511-517.
4. Hejčl, A., Krýsl, D., Kuliha, M., Marusič, P., Školoudík, D., Tomek, A. Kompletní přehled neuromonitorace. In: Tomek, A., (ed). Neurointenzivní péče. Praha: Mladá fronta, 2012, s. 87-102.
5. Nilsson, O. G., Brandt, L., Ungerstedt, U., Saveland, H. Bedside detection of brain ischemia using intracerebral microdialysis: subarachnoid hemorrhage and delayed ischemic deterioration. Neurosurgery, 1999, 45, s. 1176-1184.
6. Sarrafzadeh, A. S., Sakowitz, O. W., Kiening, K. L., Benndorf, G., Lanksch, W. R., Unterberg, A. W. Bedside microdialysis: a tool to monitor cerebral metabolism in subarachnoid hemorrhage patients? Crit. Care Med., 2002, 30, s. 1062-1070.
7. Sarrafzadeh, A., Haux, D., Sakowitz, O., et al. Acute focal neurological deficits in aneurysmal subarachnoid hemorrhage: relation of clinical course, CT findings, and metabolite abnormalities monitored with bedside microdialysis. Stroke, 2003, 34, s. 1382-1388.
8. Bellander, B. M., Cantais, E., Enblad, P., et al. Consensus meeting on microdialysis in neurointensive care. Intensive Care Med., 2004, 30, 12, s. 2166-2169.
9. Skjoth-Rasmussen, J., Schulz, M., Kristensen, S. R., Bjerre, P. Delayed neurological deficits detected by an ischemic pattern in the extracellular cerebral metabolites in patients with aneurysmal subarachnoid hemorrhage. J Neurosurg., 2004, 100, s. 8-15.
10. Unterberg, A. W., Sakowitz, O. W., Sarrafzadeh, A. S., Benndorf, G., Lanksch, W. R. Role of bedside microdialysis in the diagnosis of cerebral vasospasm following aneurysmal subarachnoid hemorrhage. J Neurosurg., 2001, 94, s. 740-749.
11. Miller, C. M., Vespa, P. M., McArthur, D. L., Hirt, D., Etchepare, M. Frameless stereotactic aspiration and thrombolysis of deep intracerebral hemorrhage is associated with reduced levels of extracellular cerebral glutamate and unchanged lactate pyruvate ratios. Neurocrit. Care, 2007, 6, s. 22-9.
12. Ko, S. B., Choi, H. A., Parikh, G., et al. Multimodality monitoring for cerebral perfusion pressure optimization in comatose patients with intracerebral hemorrhage. Stroke, 2011, 42, s. 3087-3092.
13. Belli, A., Sen, J., Petzold, A., Russo, S., Kitchen, N., Smith, M. Metabolic failure precedes intracranial pressure rises in traumatic brain injury: a microdialysis study. Acta Neurochir (Wien)., 2008, 150, s. 461-469.
14. Adamides, A. A., Rosenfeldt, F.L., Winter, C. D., et al. Brain tissue lactate elevations predict episodes of intracranial hypertension in patients with traumatic brain injury. J. Am. Coll. Surg., 2009, 209, s. 531-539.
15. Li, A. L., Zhi, D. S., Wang, Q., Huang, H. L. Extracellular glycerol in patients with severe traumatic brain injury. Chin. J. Traumatol., 2008, 11, s. 84-88.
16. Peerdeman, S. M., Girbes, A. R., Polderman, K. H., Vandertop, W. P. Changes in cerebral interstitial gly-cerol concentration in head-injured patients; correlation with secondary events. Intensive Care Med., 2003, 29, s. 1825-1828.
17. Clausen, T., Alves, O. L., Reinert, M., Doppenberg, E., Zauner, A., Bullock, R. Association between elevated brain tissue glycerol levels and poor outcome following severe traumatic brain injury. J Neurosurg., 2005, 103, s. 233-238.
18. Hejčl, A., Bolcha, M., Procházka, J., Hušková, E., Sameš, M. Elevated intracranial pressure, low cerebral perfusion pressure, and impaired brain metabolism correlate with fatal outcome after severe brain injury. J Neurol. Surg. A Cent. Eur. Neurosurg., 2012; 73, s. 10-17.
19. Wyss, M., Kaddurah-Daouk, R. Creatine and creatinine metabolism. Physiol. Rev., 2000, 80, s. 1107-1213.
20. Walker, J. B. Creatine: biosynthesis, regulation, and function. Adv Enzymol Relat. Areas Mol. Biol., 1979, 50, s. 177-242.
21. Defalco, A. J., Davies, R. K. The synthesis of creatine by the brain of the intact rat. J Neurochem., 1961, 7, s. 308-312.
22. Dringen, R., Verleysdonk, S., Hamprecht, B., Willker, W., Leibfritz, D., Brand, A. Metabolism of glycine in primary astroglial cells: synthesis of creatine, serine, and glutathione. J Neurochem., 1998, 70, s. 835-840.
23. Tachikawa, M., Fukaya, M., Terasaki, T., Ohtsuki, S., Watanabe, M. Distinct cellular expressions of creatine synthetic enzyme GAMT and creatine kinases uCK-Mi and CK-B suggest a novel neuron-glial relationship for brain energy homeostasis. Eur. J Neurosci., 2004, 20, s. 144-160.
24. Ohtsuki, S., Tachikawa, M., Takanaga, H., et al. The blood-brain barrier creatine transporter is a major pathway for supplying creatine to the brain. J Cereb. Blood Flow Metab., 2002, 22, s. 1327-1335.
25. Kelbich, P., Slavík, S., Jasanská, J., et al. Hodnocení energetických poměrů v likvorovém kompartmentu pomocí vyšetřování vybraných parametrů metabolismu glukosy v CSF. Klin. Biochem. Metab., 1998, 6 (27), s. 213-225.
26. Kelbich, P., Koudelková, M., Machová, H., et al. Význam urgentního vyšetření mozkomíšního moku pro včasnou diagnostiku neuroinfekcí. Klin. Mikrobiol. Infekc. Lek., 2007, 13, s. 9-20.
27. Kelbich, P., Adam, P., Sobek, O. et al. Základní vyšetření likvoru v diagnostice postižení centrálního nervového systému. Neurol pro praxi, 2009, 10, s. 285-289.
28. Kelbich, P., Procházka, J., Sameš, M., et al. Principy a zvláštnosti neurochirurgické a neurointenzivistické likvorologie (1. část: Úvod do problematiky). Klin. Biochem. Metab., 2011, 19(40), s. 223-228.
29. Kelbich, P., Hejčl, A., Procházka, J., Hanuljaková, E., Peruthová, J., Špička, J. Cytologie a energetika jako důležité atributy vyšetření likvoru. Klin. Biochem. Metab., 2012, 20(41), s. 17-24.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2013 Issue 1-
All articles in this issue
- Number of cells in the cerebrospinal fluid, energy relations in the cerebrospinal fluid compartment and intensity of inflammatory response in the central nervous system
- Significance and possibilities to examine brain metabolism in neurointensive care by microdialysis
- Changes in serum levels of markers in early detection of prostate cancer (pilot study)
- New regulation hormones of the breast milk
- The prevalence of decreased glomerular filtration rate in patients with monoclonal gammopathy of undetermined significance
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Significance and possibilities to examine brain metabolism in neurointensive care by microdialysis
- Number of cells in the cerebrospinal fluid, energy relations in the cerebrospinal fluid compartment and intensity of inflammatory response in the central nervous system
- Changes in serum levels of markers in early detection of prostate cancer (pilot study)
- New regulation hormones of the breast milk
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career