-
Medical journals
- Career
Kardiotoxicita – základní pojmy a mechanizmy
Authors: R. Pudil
Authors‘ workplace: I. interní kardioangiologická klinika LF UK a FN Hradec Králové
Published in: Kardiol Rev Int Med 2017, 19(1): 7-10
Overview
Kardiotoxicita představuje velmi vážný nežádoucí efekt terapie nádorových onemocnění. Manifestuje se širokým spektrem klinických příznaků: srdečním selháním, postižením koronárních tepen, postižením chlopní, arytmií, změnami QT, arteriální hypertenzí, tromboembolizmem, onemocněním periferních tepen, cévními mozkovými příhodami, plicní hypertenzí a postižením peri/ myokardu. Přehled podává základní informace o mechanizmech kardiotoxicity a možnosti jejich detekce (EKG, echokardiografie, magnetická rezonance a biomarkery).
Klíčová slova:
kardiotoxicita – dysfunkce myokardu – arytmie – elektrokardiogram – echokardiografie – kardiomarkeryÚvod
Pojem kardiotoxicita zahrnuje široké spektrum nežádoucích účinků protinádorové terapie na kardiovaskulární systém (KVS). Mezi hlavní projevy kardiotoxicity protinádorové léčby patří: srdeční selhání (SS), postižení koronárních tepen, postižení chlopní, arytmie, změny QT, arteriální hypertenze, tromboembolizmus, onemocnění periferních tepen, cévní mozkové příhody (CMP), plicní hypertenze a postižení peri/ myokardu [1]. Přehled klinické manifestace kardiotoxicity a látek, které ji vyvolávají, podává tab. 1.
Table 1. Klinické projevy kardiotoxicity různých druhů protinádorové terapie. 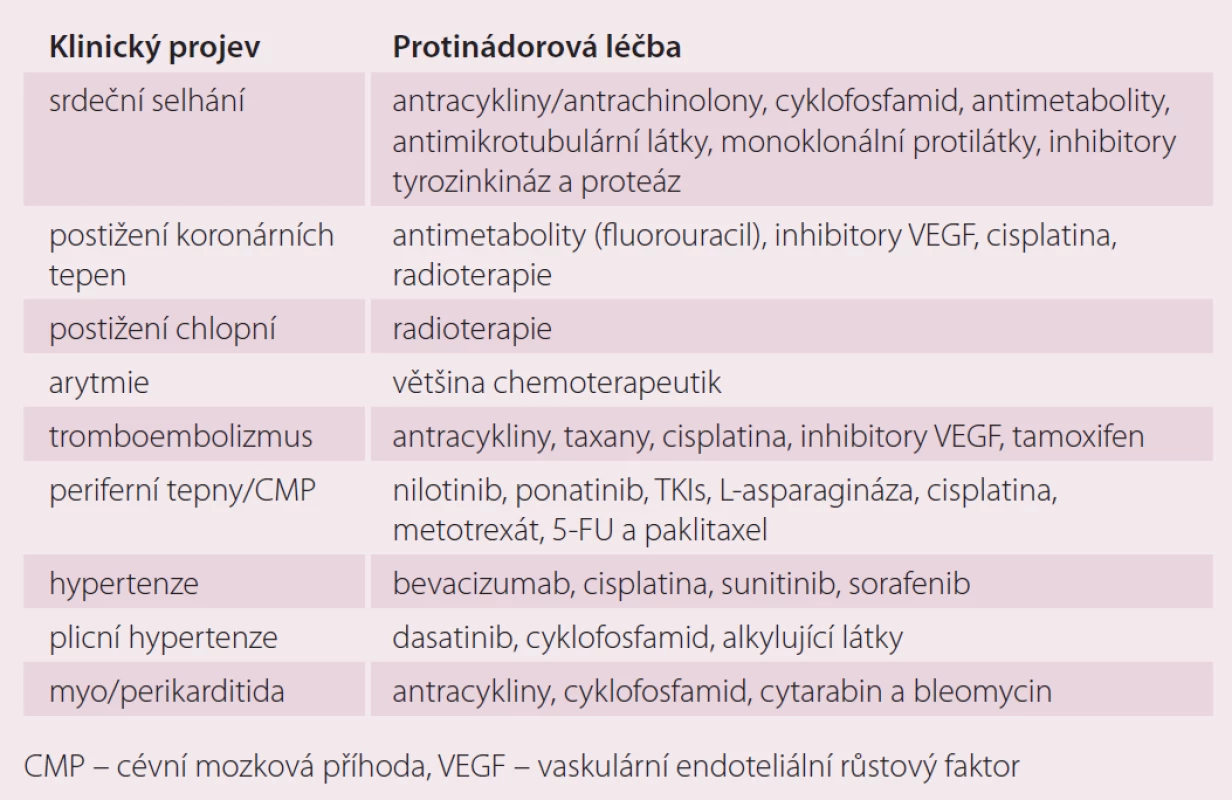
Upraveno dle [1]. Význam kardiotoxicity narůstá v důsledku řady faktorů:
- protinádorová terapie má potenciál poškodit KVS,
- roste počet pacientů, kteří jsou léčeni pro onkologická onemocnění,
- narůstá počet nemocných, kteří mají určitý rizikový profil pro vznik KV onemocnění a absolvují protinádorovou terapii (hypertonici, diabetici, starší nemocní, pacienti s dalším onemocněním KVS),
- delší přežití léčených nemocných umožňuje manifestaci pozdních projevů kardiotoxicity.
Typy a mechanizmy kardiotoxicity
V minulosti se používala klasifikace vycházející ze dvou typů kardiotoxicity podle typu látky, rozsahu strukturálních změn myocytu, které vedly k rozvoji SS, a reverzibility těchto účinků [2].
Podle této klasifikace byl vytvořen koncept dvou typů kardiotoxicity:
- Typ I – zpravidla ireverzibilní, který vznikl v důsledku těžkých strukturálních změn myocytů, tíže postižení byla závislá na dávce, modelovými léčivy byly antracykliny.
- Typ II – zpravidla reverzibilní, nebyl provázen významnými strukturálními změnami, velikost dávky neměla velký význam, modelovým léčivem byl trastuzumab.
S postupem doby se ukázalo, že tato klasifikace neodpovídá klinické praxi: pacienti byli velmi často léčeni léky obou skupin, dále terapie samotným trastuzumabem vedla v některých případech k ireverzibilnímu poškození myokardu, který byl provázen vzestupem hladiny troponinů a ultrastrukturálními změnami myocytů. V neposlední řadě se významně rozšířilo spektrum protinádorových léčiv, které mohou negativně působit na ostatní části KVS a u nichž doposud není zcela objasněn mechanizmus jejich kardiotoxického působení. Proto je vhodné pochopit biologický mechanizmus působení protinádorové léčby, jejich klinickou manifestaci, zachytit iniciální projevy kardiotoxity a zabránit jejich progresi.
Mechanizmy vzniku kardiotoxických projevů protinádorových léčiv
Antracykliny
Antracykliny (např. doxoribicin, daunorubicin, epirubicin, idarubicin) patří doposud mezi vysoce účinné protinádorové léky v terapii řady solidních i hematologických tumorů. Jejich podání vede k ovlivnění jaderné DNA (interkalací), produkci kyslíkových radikálů a inhibici topoizomerázy II. Vazba antracyklinů na DNA myocytu a ovlivnění topoizomerázy II beta je pravděpodobně hlavním stimulem, který vede k poruše funkce a zániku kardiomyocytu [2 – 4]. Dřívější studie prokázaly závislost na dosažení kumulativní dávky (200 mg/ m2 pro vznik poruchy diastolické funkce, 400 – 600 mg/ m2 pro vznik systolické dysfunkce). Mezi nejvýznamnější faktory, které usnadňují vznik kardiotoxických projevů, patří: předcházející/ současná terapie ostatními protinádorovými léčivy (cyklofosfamid, paklitaxel a trastuzumab) a iradiace mediastina. Projevy akutní toxicity jsou relativně vzácné (< 1 % léčených), četnější jsou projevy subakutní (1,6 – 2,1 %) a chronické pozdní toxicity (1,6 – 5 %), které jsou zpravidla již ireverzibilní.
Alkylační látky
Alkylační látky (cyklofosfamid, ifosfamid, melfalan) inhibují transkripci DNA, a tím vedou k poruše syntézy řady proteinů. Projevy kardiotoxicity mohou být relativně časté (např. po terapii cyklofosfamidem dochází k rozvoji dysfukce levé komory u 7 – 28 % léčených pacientů). Předpokládá se, že vznik selhání je dependentní na dávce cyklofosmamidu (≥ 150 mg/ kg a 1,5 g/ m2/ 24 hod) a vyskytuje se krátce po jejich podání [5 – 7]. Porucha funkce levé komory byla častěji pozorována po dosažení dávky 12,5 g/ m2 ifosmamidu. Tyto látky se mohou podílet na rozvoji plicní hypertenze (především cyklofosfamid) a vzniku myo/ perikarditidy.
Antimikrotubulární (anticytoskeletální) látky
Mezi tyto látky patří taxany (paklitaxel, docetaxel), které se váží na struktury mikrotubulů, a zastavují tak dělení buněk. Taxany také zasahují do metabolizmu antracyklinů, a mohou tak potencovat riziko vzniku rozvoje SS [8,9]. Určitou prevencí rozvoje kardiotoxicity může být zpomalení podávání infuze a především dostatečný interval od podání antracyklinů.
Kardiotoxicita látek ovlivňujících HER2 receptory
Cílená terapie HER2 receptoru (receptoru 2 pro lidský epidermální růstový faktor) monoklonálními protilátkami (např. trastuzumab, rituximab, bevacizumab) znamenala významný pokrok v terapii řady onkologických onemocnění, především nádorů prsu. Mezi látky, které ovlivňují HER2 receptory, patří některé malé molekuly inhibitorů tyrozinkázy, např. lapatinib, který současně ovlivňuje receptory pro epidermální růstový faktor [10].
Předpokládá se, že hlavním mechanizmem rozvoje kardiotoxicity je vazba molekuly léku (např. trastuzumabu) na HER2 receptor myocytů. Podle dosavadních znalostí má HER2 receptor protektivní roli – ovlivňuje adaptaci kardiomyocytů na stres. Blokáda receptoru trastuzumabem vede k oslabení adaptability myocytu na stres, poruchu jeho funkce, která může vést až k jeho zániku. Projevem kardiotoxicity je pak klinicky asymptomatický nebo symptomatický pokles ejekční frakce levé komory [11]. Tyto poruchy mohou být reverzibilní (po přerušení terapie). Výskyt projevů kardiotoxicity při terapii těmito látkami se pohybuje od 1,7 do 20,1 %. Zvyšuje se v případě současného použití atracyklinů nebo některých dalších látek (lapatinib a podobně).
Inhibitory VEGF
Mezi inhibitory VEGF (vaskulárního endoteliálního růstového faktoru) patří monoklonální protilátky a malé molekuly inhibitorů tyrozinkinázy (např. sunitinib, sorafenib). Tyto látky inhibují VEGF mediovanou angiogenezi, přičemž malé molekuly inhibitorů tyrozinkinázy jsou nespecifickými inhibitory a jejich nežádoucí působení je vysvětlováno blokádou řady dalších kináz, které vedou k manifestaci kardiotoxicity (symptomatická a asymptomatická dysfunkce myokardu, ischemie myokardu, hypertenze a další). Např. sunitinib může vést k poklesu funkce levé komory až v 10 %, který po ukončení léčby často odezní [12,13]. Spektrum příznaků projevu kardiotoxicity u monoklonálních protilátek zahrnuje také možnost vzniku arytmií (cetuximab, rituximab), hypotenze (rituximab, alemtuzumab) či hypertenze (bevacizumab).
Radioterapie
Poškození myokardu a ostatních částí KVS se zpravidla manifestuje až s delší latencí po ukončení léčby (řada měsíců, zpravidla však let). Radioterapie vede k makro - i mikrovaskulárnímu poškození, dysfunkci endotelu, poškození chlopní, akceleraci aterosklerotických a fibrotických změn a k poškození perikardu. Vzácně se snížení ejekční frakce a SS může objevit časně v důsledku akutní myokarditidy, avšak častěji dochází k pozvolné fibrotizaci myokardu a perikardu, které ústí v chronické SS (CHSS) nebo do klinického obrazu restriktivní kardiomyopatie. Tyto změny jsou častější při současné terapii antracykliny. Iradiace mediastina je spojena s nárůstem výskytu ischemické choroby srdeční (ICHS) a akutních koronárních syndromů.
Typy kardiotoxicity podle manifestace v čase
Podle manifestace projevů kardiotoxicity v čase lze rozdělit projevy kardiotoxicity na:
- akutní typ – postihuje méně než 1 % pacientů a objeví se během/ po podání preparátu (projevem je SS, arytmie, myo/perikarditida, akutní koronární syndrom),
- subakutní/ chronický typ – postihuje do 2,5 % léčených a projevuje se měsíce až rok, mezi symptomy dominuje poškození myokardu (symptomatická či asymptomatická dysfunkce myokardu), postižení perikardu,
- pozdní typ – postihuje až 5 % léčených, manifestuje se za delší dobu od ukončení terapie, nejčastější manifestací je CHSS, fibróza perikardu a další.
Možnosti diagnostiky projevů kardiotoxicity
Mezi základní metody diagnostiky dysfunkce myokardu patří především zobrazovací metody (echokardiografie, magnetická rezonance, CT vyšetření, v minulosti to byly radionuklidové metody), dále vyšetření kardiomarkerů (troponiny, natriuretické peptidy) a elektrokardiogram.
Elektrokardiogram (12svodové EKG) patří mezi základní vstupní vyšetření nemocných podstupujících potenciálně kardiotoxickou terapii. Abnormální vstupní EKG pomáhá identifikovat nemocné, kteří jsou v potenciálním riziku rozvoje KV nežádoucích účinků protinádorové terapie. V průběhu protinádorové terapie má EKG nezastupitelný význam při hodnocení projevů ischemie (antimetabolity (fluorouracil), inhibitory VEGF, cisplatina, radioterapie) a arytmií (většina cytostatik). Vzhledem k tomu, že protinádorová léčba a některá léčiva či podpůrná terapie může vést k prodloužení QTc intervalu, je doporučena jeho monitorace během léčby [14].
Echokardiografie je metodou volby pro průkaz KV komplikací protinádorové terapie. Umožňuje diagnostikovat řadu komplikací: prokázat asymptomatickou i symptomatickou dysfunkci myokardu, umožňuje posoudit rozvoj lokálních poruch kinetiky levé komory, prokázat postižení perikardu se vznikem výpotku, rozvoj plicní hypertenze či postižení srdečních chlopní. Za průkaz rozvoje dysfunkce myokardu se považuje pokles ejekční frakce levé komory o více než 10 % od spodního limitu normy (zde byl stanoven na 50 %) od vstupního vyšetření, který přetrvává. Ejekční frakce by měla být stanovena metodou podle Simpsona a kontrolní vyšetření by mělo být opět provedeno v odstupu několika týdnů. Některé práce ukázaly, že poklesu systolické funkce myokardu levé komory srdeční předcházejí poruchy diastolické funkce myokardu. V této oblasti má zásadní význam hodnocení transmitrálního průtoku pomocí pulzního dopplerovského vyšetření v kombinaci s hodnocením tkáňového pulzně dopplerovského vyšetření mitrálního anulu [15,16]. Ačkoli je možné sledovat také změny globálního longitudinálního strainu levé komory (GLS), kde může být pokles alespoň o 15 % projevem kardiotoxicity, nebyla tato metoda jednoznačně přijata pro běžnou praxi pro řadu faktorů, které ji mohou ovlivnit (např. sledování musí být provedeno na stejném přístroji, vyšetřitelnost nemocného) [1].
Radionuklidové metody (MUG) jsou nyní na ústupu a jsou nahrazeny echokardiografií. V případě špatné zobrazitelnosti může pomoci magnetická rezonance, která poskytne údaje o funkci srdečních oddílů, navíc poskytne údaje o strukturálních změnách myokardu.
Velký potenciál přináší stanovení kardiálních markerů, kdy vzestup troponinu či hladin natriuretických peptidů (BNP a NT-proBNP) mohou identifikovat rizikové nemocné a nemocné s iniciálními subklinickými formami kardiotoxicity.
Bylo prokázáno, že nárůst hladiny srdečních troponinů (T a I) v průběhu protinádorové terapie (antracykliny, radioterapie, trastuzumab) významně koreluje s rozvojem poruchy funkce myokardu [17,18]. Podobně bylo prokázáno, že vzestup hodnot natriuretických peptidů je spojen s nastupující poruchou funkce levé komory srdeční [19].
Závěr
Projevy kardiotoxicity patří mezi nejvýznamnější nežádoucí účinky protinádorové léčby na KVS. Její klinické manifestace jsou velmi různé a vycházejí ze širokého spektra postižení KVS, které zahrnuje strukturální změny myokardu vedoucí k jeho dysfunkci, vzniku širokého spektra arytmií, poškození koronárních tepen manifestující se projevy ischemie myokardu, poškození periferních tepen a tepen zásobujících centrální nervový systém, tromboembolizmus, poškození myo/perikardu, arteriální hypertenzi, plicní hypertenzi a další. Vznik těchto projevů může vést k významnému snížení kvality života nemocných a v některých případech k ohrožení na životě. Vzhledem k tomu, že je možné rozvoji projevů kardiotoxicity a jejím následkům zabránit (změna schématu protinádorové léčby, terapie arytmií, terapie jejich projevů), vzrůstá potřeba diagnostiky jejich velmi časných projevů [20,21].
Práce byla podpořena výzkumným projektem PROGRES Q40/ 03.
Doručeno do redakce: 11. 2. 2017
Přijato po recenzi: 23. 2. 2017
prof. MUDr. Radek Pudil, Ph.D.
www.fnhk.cz
pudilr@lfhk.cuni.cz
Sources
1. Zamorano JL, Lancellotti P, Rodriguez Muñoz D et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. Eur Heart J 2016; 37(36): 2768 – 2801.
2. Bloom MW, Hamo CE, Cardinale D et al. Cancer therapy-related cardiac dysfunction and heart failure: Part 1: definitions, pathophysiology, risk factors, and imaging. Circ Heart Fail 2016; 9(1): e002661. doi: 10.1161/ CIRCHEARTFAILURE.115.002661.
3. Tewey KM, Rowe TC, Yang L et al. Adriamycin-induced DNA damage mediated by mammalian DNA topoisomerase II. Science 1984; 226(4673): 466 – 468.
4. Vejpongsa P, Yeh ET. Topoisomerase 2beta: a promising molecular target for primary prevention of anthracycline-induced cardiotoxicity. Clin Pharmacol Ther 2014; 95(1): 45 – 52. doi: 10.1038/ clpt.2013.201.
5. Gershwin ME, Goetzl EJ, Steinberg AD. Cyclophosphamide: use in practice. Ann Intern Med 1974; 80(4): 531 – 540.
6. Braverman AC, Antin JH, Plappert MT et al. Cyclophosphamide cardiotoxicity in bone marrow transplantation: a prospective evaluation of new dosing regimens. J Clin Oncol 1991; 9(7): 1215 – 1223.
7. Quezado ZM, Wilson WH, Cunnion RE et al. High-dose ifosfamide is associated with severe, reversible cardiac dysfunction. Ann Intern Med 1993; 118(1): 31 – 36.
8. Field JJ, Kanakkanthara A, Miller JH. Microtubule-targeting agents are clinically successful due to both mitotic and interphase impairment of microtubule function. Bioorg Med Chemi 2014; 22(18): 5050 – 5059. doi: 10.1016/ j.bmc.2014.02.035.
9. Giordano SH, Booser DJ, Murray JL et al. A detailed evaluation of cardiac toxicity: a phase II study of doxorubicin and one - or three-hour-infusion paclitaxel in patients with metastatic breast cancer. Clin Cancer Res 2002; 8(11): 3360 – 3368.
10. Pritchard KI, Shepherd LE, O'Malley FP et al. HER2 and responsiveness of breast cancer to adjuvant chemotherapy. N Engl J Med 2006; 354(20): 2103 – 2111.
11. Piccart-Gebhart MJ, Procter M, Leyland-Jones Bet al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Eng J Med 2005; 353(16): 1659 – 1672.
12. Krop IE, Suter TM, Dang CT et al. Feasibility and cardiac safety of trastuzumab emtansine after anthracyclinebased chemotherapy as (neo)adjuvant therapy for human epidermal growth factor receptor 2positive early-stage breast cancer. J Clin Oncol 2015; 33(10): 1136 – 1142. doi: 10.1200/ JCO.2014.58.7782.
13. Ferrara N. Role of vascular endothelial growth factor in regulation of physiological angiogenesis. Am J Physiol Cell Physiol 2001; 280(6): 1358 – 1366.
14. Pudil R, Horacek JM, Horackova J et al. Anthracycline therapy can induce very early increase in QT dispersion and QTc prolongation. Leuk Res 2008; 32(6): 998 – 999.
15. Dorup I, Levitt G, Sullivan I et al. Prospective longitudinal assessment of late anthracycline cardiotoxicity after childhood cancer: the role of diastolic function. Heart 2004; 90(10): 1214 – 1216.
16. Pudil R, Horacek JM, Strasova A et al. Monitoring of the very early changes of left ventricular diastolic function with acute leucemia treated with anthracyclines. Exp Oncol 2008; 30(2): 160 – 162.
17. Cardinale D, Sandri MT, Colombo A et al. Prognostic value of troponin I in cardiac risk stratification of cancer patients undergoing high-dose chemotherapy. Circulation 2004; 109(22): 2749 – 2754.
18. Cardinale D, Sandri MT, Martinoni A et al. Left ventricular dysfunction predicted by early troponin I release after high-dose chemotherapy. J Am Coll Cardiol 2000; 36(2): 517 – 522.
19. Horacek JM, Pudil R, Jebavy L et al. Assessment of anthracycline induced cardiotoxicity with biochemical markers. Exp Oncol 2007; 29(4): 309 – 313.
20. Kongbundansuk S, Hundley WG. Noninvasive imaging of cardiovascular injury related to the treatment of cancer. JACC Cardiovasc Imaging 2014; 7(8): 824 – 838. doi: 10.1016/ j.jcmg.2014.06.007.
21. Yeh ET, Vejpongsa P. Subclinical cardiotoxicity associated with cancer therapy: early detection and future directions. J Am Coll Cardiol 2015; 65(23): 2523 – 2525. doi: 10.1016/ j.jacc.2015.04.012.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2017 Issue 1-
All articles in this issue
- Kardiotoxicita – současná doporučení
- Kardiotoxicita u hematoonkologických pacientov
- Rivaroxaban – farmakologický profil
- Edoxaban – farmakologický profil
- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Moderní antitrombotická léčba po AKS – využíváme ji dostatečně?
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Betablokátory v registru chronického srdečního selhání FAR NHL
- Kardiotoxicita – základní pojmy a mechanizmy
- Kardiotoxicita protinádorových léčiv v experimentu
- Problematika kardiotoxicity primární léčby pacientek s karcinomem ovaria
- Pozdní následky kardiotoxicity
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
- COSYREL – lék pro pacienty s ischemickou chorobou srdeční a srdečním selháním
- Rivaroxaban – farmakologický profil
- Pozdní následky kardiotoxicity
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

