-
Medical journals
- Career
Diuretika a antagonisté mineralokortikoidních receptorů v terapii chronického srdečního selhání se sníženou ejekční frakcí levé komory
: G. Mairgani 1; F. Málek 2
: Odděleni Interna I, Nemocnice Teplice, Krajská zdravotní, a. s. 1; Kardiocentrum, Nemocnice Na Homolce, Praha 2
: Kardiol Rev Int Med 2017, 19(1): 51-54
Diuretika patří mezi nejstarší léky pro terapii srdečního selhání. Jejich hlavní úlohou je odstranění příznaků systémové a plicní kongesce. V léčbě srdečního selhání se používají především kličková diuretika pro jejich silnější diuretický efekt. U některých nemocných je nutná kombinace kličkových a thiazidových diuretik. Antagonisté mineralokortikoidních receptorů mají slabý diuretický účinek, jejich hlavní význam spočívá v potlačení nepříznivých následků sekundárního hyperaldosteronizmu, který provází zejména pokročilejší stadia srdečního selhání. Důkazy máme pro spironolakton a eplerenon, tyto léky příznivě ovlivňují mortalitu a morbiditu pacientů se srdečním selháním, a tím i průběh onemocnění.
Klíčová slova:
srdeční selhání – diuretika – antagonisté mineralokortikoidních receptorůÚvod
Diuretika patří do první linie léčby symptomatického srdečního selhání (SS) s klinickými známkami plicní nebo systémové kongesce ke zlepšení symptomů [1]. Jsou nedílnou součástí algoritmu léčby zejména pacientů se SS a sníženou ejekční frakcí levé komory (EF LK) (schéma 1). Účinnost diuretik na snížení mortality a morbidity nebyla v randomizovaných klinických studiích testována. Informace o prospěšnosti diuretik u SS tak vycházejí z metaanalýz menších studií. Jedna metanalýza 14 menších studií zahrnujících 525 pacientů testovala dopad diuretické terapie na snížení mortality a morbidity [2]. U sedmi studií se jednalo o placebem kontrolované studie, u dalších sedmi byla účinnost diuretika srovnávána s jiným lékem: inhibitorem enzymu konvertujícího angiotenzin (ACEI) nebo s digoxinem. Mortalitní data byla dostupná ve třech placebem kontrolovaných studiích (202 pacienti), mortalita byla při diuretické terapii nižší než na placebu (poměr rizik OR 0,24; p = 0,02). Rovněž riziko hospitalizace pro SS bylo nižší při diuretické terapii ve dvou studiích (169 pacientů; OR 0,07; p = 0,01). Ve srovnávacích studiích zlepšila diuretika oproti jiné léčbě toleranci zátěže. Další metaanalýza zahrnující 18 studií a 928 pacientů zahrnovala jak placebem kontrolované, tak srovnávací randomizované studie [3]. Podobně jako v předchozí metanalýze ve třech placebem kontrolovaných studiích s 221 pacientem byla mortalita při diuretické terapii nižší (OR 0,25; p = 0,03). Riziko hospitalizace bylo ve čtyřech studiích s 448 pacienty při diuretické terapii rovněž sníženo (OR 0,31; p = 0,001). V šesti srovnávacích studiích diuretika zlepšila toleranci zátěže a snížila riziko zhoršení průběhu onemocnění (OR 0,37; p = 0,007). Ve výše uvedených metaanalýzách byla v rámci diuretické terapie hodnocena léčba: jakýmkoli diuretikem, furosemidem, hydrochlorthiazidem, amiloridem a spironolaktonem.
Schéma 1. Algoritmus léčby pacienta se symptomatickým srdečním selháním se sníženou ejekční frakcí. 
HFrEF – srdeční selhání se sníženou ejekční frakcí, ACEI – inhibitor angiotenzin konvertujícího enzymu, MRA – antagonista mineralokortikoidních receptorů, EF – ejekční frakce, ARNI – inhibitor neutrální endopeptidázy neprilysinu, QRS komplex – stah komorové svalovíny srdce, SF – srdeční frekvence, CRT – srdeční resynchronizační léčba, LVAD – levostranná srdeční podpora, ICD – implantabilní kardioverter-defi brilátor, VT/VF – arytmie Klinická farmakologie a mechanizmus účinku diuretik
Znalost farmakologických vlastností diuretik je pro léčbu SS nezbytná. Kličková diuretika inhibují kotransport sodíku a draslíku ve vzestupné části Henleho kličky. Blokují tak reabsorpci sodíku, a tím i vody. V případě poklesu glomerulární filtrace se k vazbě na transporter dostane méně látky. Mezi hlavní představitele kličkových diuretik patří furosemid, dále torasemid, bumetamid a kyselina etakrynová. V našich podmínkách se používá prakticky jen furosemid, jehož absorpce je po perorálním podání velmi variabilní. Thiazidová diuretika jsou užívána především pro léčbu arteriální hypertenze, ale mohou být použita i v indikaci SS. Blokují absorpci sodíku a vody na úrovni distálního tubulu. Antagonisté mineralokortikoidních receptorů (MRA) spironolakton a eplerenon blokují receptor pro aldosteron na úrovni sběrného kanálku v kůře. Částečně přímo snižují absorpci sodíku a vody. Jejich diuretický účinek je slabý a mají pomalý nástup účinku. Amilorid a triamteren řadíme mezi draslík šetřící diuretika, která neovlivňují receptory pro aldosteron. Amilorid ovlivňuje amiloridový sodíkový kanál, snižuje jeho aktivitu s následným snížením resorpce sodíku. Snížení koncentrace sodíku uvnitř buňky snižuje aktivitu Na+K+ATPázy s následným snížením transportu draslíku z okolní extracelulární tekutiny do buněk a sníženým průnikem draslíku kaliovým kanálem. Vliv kaliumretenčních diuretik na močové vylučování sodíku je menší než u furosemidu a thiazidů. Jejich vliv na vylučování draslíku je klinicky velmi důležitý. Tato diuretika jsou důležitá z hlediska užití sekvenční inhibice resorpce natria. Malé změny v intenzitě transportu natria ve sběrných kanálcích se mohou projevit významnými změnami v močovém vylučování sodíku [4]. Za rozvoj plicního a periferního otoku je odpovědná nadměrná neurohormonální aktivace zejéma systému renin-angiotenzin-aldosteron (RAAS). Ta je spouštěna poklesem srdečního výdeje u SS se snížením perfuze ledvin. Dochází k retenci sodíku a vody se zvýšením objemu a tlaku v kapacitních cévách. Zvýšení hydrostatického tlaku vede k přesunu tekutiny do tkání vč. tkáně plicní. Akutní zvýšení plnicího tlaku levé komory, ke kterému dochází typicky u akutní dekompenzace SS, vede k přímému zvýšení tlaku v levé síni a edému plic. Diuretika snižují intravaskulární objem a pokles centrálního žilního tlaku, plnicích tlaků levé i pravé komory a tlaku v plicních cévách. Intrapulmonální tekutina se vrací do cirkulace, zmenšuje se objem levé komory a stoupá srdeční výdej.
MRA a draslík šetřící diuretika
Účinnost MRA spironolaktonu a eplerenonu v léčbě chronického SS (CHSS) byla testována ve dvou zásadních randomizovaných klinických placebem kontrolovaných studiích: RALES a EMPHASIS. Oba léky byly testovány v dávkách, které mají pouze malý diuretický efekt. Primární účinek je tedy dán blokádou receptoru aldosteronu. Cílem studie RALES bylo zjistit, zda podávání neselektivního antagonisty aldosteronu spironolaktonu povede u pacientů s CHSS a pokročilými symptomy NYHA III a IV ke snížení rizika úmrtí a hospitalizace pro zhoršení SS. Z celkového počtu 1 663 pacientů bylo 822 nemocných randomizováno k 25 mg spironolaktonu denně a 841 pacientů bylo randomizováno k placebu. Pacienti dostávali kličkové diuretikum (100 %), ACEI (> 90 %) a většinou také digoxin (> 70 %). Studie byla publikována v roce 1999 (plán studie v roce 1996), proto nás nepřekvapuje malé procento pacientů, kteří byli léčeni betablokátorem: 10 % v placebové a 11 % v aktivně léčené skupině. Studie byla přerušena pro příznivý efekt spironolaktonu. Během průměrné doby sledování 24 měsíců došlo ke snížení rizika úmrtí o 30 % (relativní riziko 0,70; p < 0,001), a to jak úmrtí na zhoršení SS, tak i úmrtí na náhlou srdeční smrt. Léčba spironolaktonem byla spojena i se snížením rizika hospitalizace pro zhoršení SS o 35 % (relativní riziko 0,65; p < 0,001). Došlo i ke zlepšení symptomů podle NYHA na terapii spironolaktonem. Aktivní léčba byla zatížena častější frekvencí gynekomastie nebo bolestí prsou u mužů (10 % u spironolaktonu a 1 % na placebu; p < 0,001). Nebyl rozdíl ve výskytu významné hyperkalemie mezi oběma skupinami [5]. Cílem studie EMPHASIS bylo zjistit, zda povede přidání selektivního inhibitoru aldosteronu eplerenonu v dávce 50 mg ke standardní terapii SS u pacientů s CHSS, s EF LK ≤ 35 % a mírnými symptomy (NYHA II) ke snížení rizika úmrtí z kardiovaskulárních (KV) příčin a hospitalizace pro SS. Studie byla předčasně ukončena po průměrné době sledování 21 měsíců pro pozitivní vliv eplerenonu. Primární sledovaný ukazatel: úmrtí z KV příčin a hospitalizace pro SS byly sníženy po eplerenonu o 37 % (RR 0,63; p < 0,001), bylo významně sníženo riziko úmrtí (RR 0,76; p = 0,008) a riziko hospitalizace pro SS. Vyšší koncentrace draslíku nad 5,5 byla častější po terapii eplerenonem. Nebyl rozdíl v dopadu léčby na renální funkce a nebyl rozdíl v počtu pacientů, kteří pro nežádoucí účinky léčbu ukončili. Tato studie byla publikována v roce 2011 a pěkně dokumentuje vývoj poznatků o efektu farmakoterapie u pacientů se SS. Ve studii EMPHASIS mělo ACEI, ARB (antagonisté AT1 receptrou angiotenzinu II) nebo jejich kombinaci > 90 % pacientů, více než 85 % pacientů dostávalo betablokátor a pouze 26 % dostávalo digoxin. Eplerenon/ placebo byl podáván v úvodní dávce 25 mg denně s titrací dávky do 50 mg denně po 4 týdnech. Dávku 50 mg užívalo 60,2 % pacientů ve skupině s eplerenonem a 65,3 % pacientů na placebu. Průměrná denní dávka eplerenonu byla 39,1 mg a 40,8 mg v placebové skupině. Podávání eplerenonu bylo hodnoceno jako bezpečné, eplerenon také významně více snížil systolický krevní tlak průměrně o 2,5 mm Hg [6]. Amilorid se podává prakticky pouze ve fixní kombinaci s thiazidovými diuretiky v léčbě arteriální hypertenze. Je zajímavé, že amilorid byl také testován u pacientů se SS. Některé menší práce ukázaly, že přidáním amiloridu v dávce 5 mg u pacientů s CHSS léčených ACEI a kličkovým diuretikem došlo ve srovnání s placebem k příznivému mírnému vzestupu koncentrace draslíku, zkrácení QT intervalu a snížení výskytu komorových extrasystol [7]. Amilorid na rozdíl od spironolaktonu však nezlepšil parametry endoteliální funkce. V jiné menší studii vedlo podávání amiloridu u pacientů s CHSS léčených digoxinem na rozdíl od placeba ke snížení plnicích tlaků levé komory při zátěži [8]. Podávání draslík šetřicích diuretik a MRA může být výhodné u pacientů se sklonem k hypokalemii po kličkovém diuretiku. Mohou zvýšit diurézu u pacientů s rezistencí na běžnou dávku diuretik.
Dávky diuretik u SS
Dávkování diuretik je vždy individuální, základem léčby jsou u SS kličková diuretika. Diuretická terapie u pokročilejších stadií SS musí být vždy provázena restrikcí příjmu tekutin. Úvodní obvyklá dávka furosemidu pro pacienta s CHSS a s klinickými známkami kongesce je 20–40 mg denně. U některých nemocných může být dávka furosemidu i dávkou udržovací. U pokročilého SS u nemocných s těžkou systolickou dysfunkcí levé komory jsou udržovací dávky furosemidu obvykle vyšší.Thiazidová a thiazidům podobná diuretika je výhodné kombinovat s diuretiky kličkovými v případech horší diuretické odpovědi na monoterapii. U pacientů s horší diuretickou odpovědí i na zvyšující se dávky furosemidu je doporučováno použít thiazidové diuretikum 20–30 min před podáním kličkového diuretika. Úvodní dávka MRA je obvykle 12,5 mg spironolaktonu a 25 mg eplerenonu a obvyklá denní dávka je 50 mg spironolaktonu i eplerenonu. Zajímavé jsou dávky MRA u pacientů, kteří netolerují ACEI nebo ARB. Podle aktuálních doporučení pro diagnostiku a léčbu SS (ESC 2016) by měla být u těchto nemocných úvodní i udržovací dávka MRA mnohem vyšší (tab. 1). Cílovou dávkou je pro spironolakton a eplerenon 100–200 mg denně. Přestože chybí důkazy o zlepšení prognózy při použití vysokých dávek MRA, jsou klinické situace, ve kterých je podávání vysokých dávek MRA nezbytné. Je známo, že CHSS je zejména v pokročilém stadiu spojeno se sekundárním hyperaldosteronizmem. Nadměrná produkce aldosteronu je dána zvýšenou aktivací systému renin-angiotenzin. Navzdory blokádě RAAS pomocí ACEI nebo ARB dochází ke stimulaci syntézy aldosteronu v kůře nadledvin jinými cestami, kromě angiotenzinu II je produkce aldosteronu přímo stimulována i katecholaminy. Nejsilnějším stimulátorem syntézy aldosteronu je ovšem angiotenzin II, jeho zvýšená aktivita může být navzdory terapii inhibitory ACE vysvětlena tím, že část produkce angiotenzinu II je nezávislá na ose renin-angiotenzin (tzv. chymázové cesty syntézy angiotenzinu II). Další příčinou hyperaldosteronizmu u CHSS je snížení jeho degradace při zhoršení metabolických jaterních funkcí. Pokles metabolických jaterních funkcí u CHSS je vysvětlován jak kongescí, tak hypoperfuzí jater. Pokud pacient např. z důvodu hypotenze nebo progresivní poruchy ledvinných funkcí netoleruje ACEI nebo ARB, jsou na místě vysoké dávky MRA s cílem potlačit nepříznivé následky hyperaldosteronizmu (hypokalemie, retence sodíku a vody, myofibróza, indukce apoptózy atd.) [9].
1. Obvyklé dávky diuretik u SS. 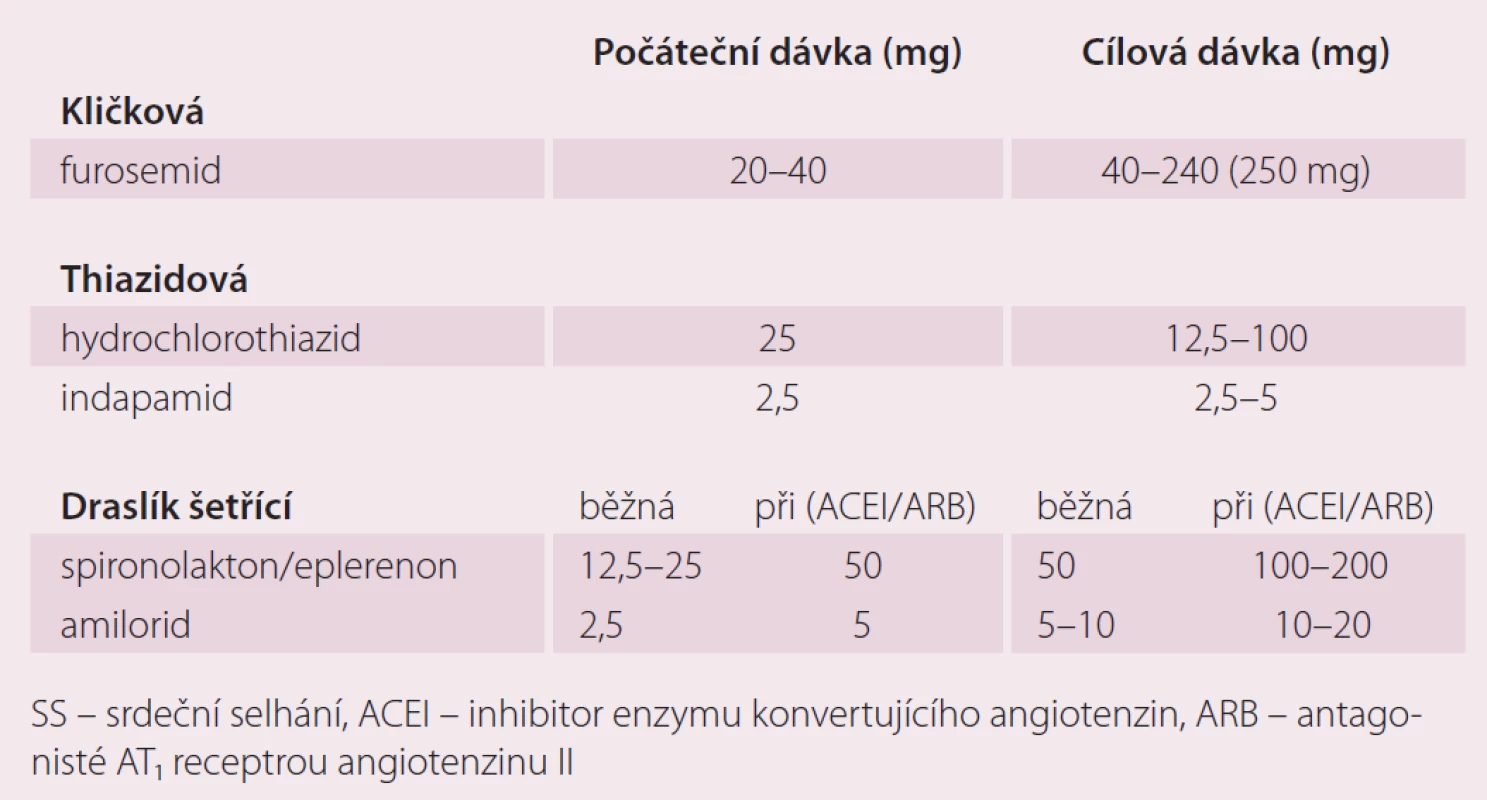
Hlavním nežádoucím účinkem spironolaktonu jako neselektivního MRA je gynekomastie, bolesti prsou a impotence u mužů a bolesti prsou a poruchy menstruačního cyklu u fertilních žen. Ve studii RALES byl výskyt gynekomastie v aktivně léčené skupině až 10 %. V těchto případech je nutné uvažovat o použití selektivního MRA eplerenonu.
Indikace pro eplerenon
Eplerenon je na základě výsledků EMPHASIS indikován ke standardní terapii s cílem snížit riziko úmrtí z KV příčin a riziko hospitalizace pacientů s CHSS třídy NYHA II a se systolickou dysfunkcí levé komory (EF LK ≤ 30 %).
Další indikace vychází z výsledku studie EPHESUS ke standardní terapii ke snížení rizika KV mortality a morbidity u stabilizovaných pacientů s dysfunkcí levé komory (EF LK < 40 %) a s klinickými známkami SS po nedávno prodělaném infarktu myokardu (IM) [10]. Eplerenon má zvýšenou úhradu při výskytu závažných nežádoucích účinků při léčbě spironolaktonem (gynekomastie a impotence u mužů, poruchy menstruace a bolesti prsů u žen). Obvyklá úvodní dávka je 25 mg denně a terapeutická 50 mg denně. Jak ukazují aktuální doporučení pro diagnostiku a léčbu SS, je v některých případech nutné zvážit použití vyšších dávek. To platí zejména pro stavy, kdy pacienti netolerují nebo mají kontraindikace pro podávání dalších blokátorů RAAS (inhibitory ACE nebo sartanu). Při léčbě eplerenonem je nutná monitorace kalemie a renálních funkcí. Kontraindikací pro zahájení léčby je hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku, koncentrace draslíku v séru > 5,0 mmol/ l, renální insuficience s odhadovanou glomerulární filtrací (eGRF) < 30 ml/ min/ 1,73 m2, jaterní insuficience (třída C podle Child-Pugha), současné podávání draslík šetřicích diuretik a doplňků stravy obsahující draslík, současné podávání silných inhibitorů enzymu CYP3A4 (např. itrakonazol, ketokonazol, ritonavir, klarithromycin). Kontraindikaci pro eplerenon představuje také kombinace inhibitoru ACE a ARB.
Závěr
Diuretika patří k základním lékům pro terapii CHSS se sníženou EF LK. Ovlivňují především kvalitu života korekcí symptomů, které jsou způsobeny plicní nebo systémovou kongescí. Nejefektivnější jsou kličková diuretika, u pokročilých stadií SS je výhodná kombinace s thiazidovými diuretiky. Antagonisté mineralokortikoidních receptorů mají slabý diuretický efekt, jejich hlavní účinek spočívá v blokádě aldosteronu. Tyto léky mají důkazy pro snížení morbidity a mortality v kombinaci se standardní léčbou SS, tím jednoznačně modifikují průběh onemocnění. Nejvíce důkazů máme pro spironolakton pro pacienty s pokročilým CHSS NYHA III a IV a pro eplerenon pro pacienty s CHSS a s méně pokročilými symptomy, ale s těžkou dysfunkcí levé komory s EF LK ≤ 30 %, a dále pro pacienty se SS a dysfunkcí levé komory (EF LK < 40 %) po IM. U některých nemocných je nutné použití vyšších dávek MRA k dosažení stabilizace pacientů.
Podpořeno MZ ČR – RVO (Nemocnice Na Homolce – NNH, 00023884), IG160502.
Doručeno do redakce: 23. 1. 2017
Přijato po recenzi: 7. 2. 2017
doc. MUDr. Filip Málek, Ph.D., MBA
www.homolka.cz
filip.malek@homolka.cz
Sources
1. Špinar J, Hradec J, Špinarová L et al. Souhrn Doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Cor Vasa 2016; 58(5): e530–e568.
2. Faris R, Flather MD, Purcell H et al. Diuretics fort heart failure. Cochrane Database Sys Rev 2006; 1: CD003838.
3. Faris R, Flather MD, Purcell H et al. Current evidence supporting the role of diuretik in heart failure: a metaanalysis of randomised controlled trials. Int J Cardiol 2002; 82(2): 149–158.
4. Volz EM, Felker GM. How to use diuretics in heart failure. Curr Treat Options Cardiovasc Med 2009; 11(6): 426–432.
5. Pitt B, Zannad F, Remme WJ et al. The effect of spironolactone on morbidity and mortality in patients with severe heart silure. N Engl J Med 1999; 341(10): 709–717.
6. Zannad F, McMurray JJ, Krum H et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011; 364(1): 11–21. doi: 10.1056/ NEJMoa1009492.
7. Farquharson CA, Struthers AD. Increasing plasma potassium with amiloride shortens the QT interval and reduces ventricular extrasystoles but does not change endothelial function or heart rate variability in chronic heart failure. Heart 2002; 88(5): 475–480.
8. Cheitlin MD, Byrd R, Benowitz N et al. Amiloride improves hemodynamics in patients with chronic congestive heart failure treated with chronic digoxin and diuretics. Cardiovasc Drugs Ther 1991; 5(4): 719–725.
9. Málek F, Špaček R. Blokáda receptoru aldosteronu v terapii chronického srdečního selhání. Cor Vasa 2002; 44(1): 32–36.
10. Pitt B, Remme W, Zannad F et al. Eplerenone, a selective aldosteron blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348(14): 1309–1321.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2017 Issue 1-
All articles in this issue
- Cardiotoxicity – current guidelines
- Cardiotoxicity in haemato-oncological patients
- Rivaroxaban – pharmacological profile
- Edoxaban – pharmacological profile
- Diuretics and mineralocorticoid receptor antagonists in the therapy of chronic heart failure with reduced left ventricular ejection fraction
- Modern antithrombotic treatment after ACS – do we use it adequately?
- COSYREL – a drug for patients with coronary artery disease and heart failure
- Beta-blockers in chronic heart failure as recorded in the FAR NHL registr
- Cardiotoxicity – basic terms and mechanisms
- Cardiotoxicity of anti-cancer drugs in experimental settings
- Cardiotoxicity of anticancer treatment in patients with ovarian cancer
- Late consequences of cardiotoxicity
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diuretics and mineralocorticoid receptor antagonists in the therapy of chronic heart failure with reduced left ventricular ejection fraction
- COSYREL – a drug for patients with coronary artery disease and heart failure
- Rivaroxaban – pharmacological profile
- Late consequences of cardiotoxicity
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

