-
Medical journals
- Career
Vrozené srdeční vady s plicní hypertenzí
: T. Zatočil; A. Nečasová; T. Brychta
: Ambulance vrozených srdečních vad v dospělosti, Interní kardiologická klinika, FN Brno-Bohunice
: Kardiol Rev Int Med 2009, 11(4): 174-177
: Sympozium
Vrozené srdeční vady s plicní hypertenzí představují malou a přitom heterogenní skupinu s nejvýraznějšími symptomy a nejhorší dlouhodobou prognózou ze všech vad. Díky rozvoji kardiologie a kardiochirurgie a samozřejmě prenatální diagnostiky těchto pacientů nebude přibývat. Předpokladem vzniku plicní hypertenze je přítomnost levopravého zkratu. Plicní hypertenze vzniká častěji u zkratů umístěných za trikuspidální chlopní, díky velkému tlakovému spádu mezi systémovým a plicním oběhem v těchto lokalizacích. Při vyrovnání tlaků v systémovém a plicním oběhu dochází k otočení zkratu, objevení se cyanózy – rozvíjí se Eisenmengerův syndrom. Komplikace jsou velmi časté, společným jmenovatelem je hypoxie, v pokročilé fázi můžeme hovořit o multisystémovém onemocnění. Léčba je symptomatická, u každého léku je třeba zvážit dopad na vybalancovanou hemodynamiku, přínosem je moderní léčba plicní hypertenze, pro terminální pacienty připadá do úvahy kombinovaná transplantace srdce a plic. Vzhledem ke komplexnosti problematiky tito pacienti patří do specializovaných center.
Klíčová slova:
vrozené srdeční vady – plicní hypertenze – Eisenmengerův syndrom – levopravý zkratÚvod
Vrozené srdeční vady (VSV), u nichž se vyvine plicní hypertenze (PH), mají ze všech VSV, se kterými se setkáváme v dospělosti, obecně nejvýraznější symptomy a nejhorší dlouhodobou prognózu [1]. Plicní hypertenze a z ní vyplývající komplikace je přitom důsledkem přirozeného vývoje VSV s levopravým zkratem. Pokud zkrat není řešen do dvou let po narození, vyšší průtok plicním řečištěm vede k ireverzibilní přestavbě a fixování PH. Potom již není možné zkratovou vadu radikálně řešit.
V době, kdy nebylo v možnostech kardiochirurgie a intervenční kardiologie tyto zkratové, ale i jiné významné VSV řešit, dožívali se dospělosti jen nositelé hemodynamicky málo významné vady, u nichž nebyla nutná korekce a z hemodynamicky významných častěji právě jen zkratové vady. Dospělosti se dožívalo jen kolem 20% všech pacientů s VSV. U neoperovaných významných zkratů vznikala PH a tito pacienti umírali na komplikace v časné dospělosti. Pohled na cyanotického pacienta v kardiologické ambulanci tehdy nebyl nijak zvlášť vzácný.
S rozvojem moderních metod diagnostiky (včetně prenatální) a léčby, zejména s rozvojem kardiochirurgie, se situace naštěstí dramaticky zlepšila. Dnes se dá dokonce říct, že je v možnostech moderní medicíny, aby pacienti s VSV s PH vůbec nepřibývali, protože jde o vady vesměs řešitelné. Stále však dožívají pacienti, kteří se narodili v nesprávný čas nebo nebyli operováni z jiných důvodů. I tak je pohled na cyanotického pacienta v kardiologické ambulanci dnes naštěstí výjimečný. Z dřívějších údajů víme, že PH se v přirozeném vývoji u VSV vyskytovala asi v 30% všech VSV [2], o současné prevalenci máme jen mlhavé tušení. Pro většinu kardiologů jde o epizodické případy, ve specializovaných centrech pro VSV se zřejmě naopak tito nejhorší pacienti koncentrují na úkor těch méně symptomatických, takže jejich poměr ze všech VSV je zde spíše nadhodnocen. V současnosti se odhady pohybují většinou pod 5% všech VSV [3]. V naší ambulanci pro VSV v dospělosti ve FN Brno Bohunice představují VSV s PH 2,6% všech sledovaných VSV (z toho ti nejtěžší – s Eisenmengerovým syndromem – zastupují 1%). V budoucnosti musí být naším cílem prevalence 0%.
Přestože tato skupina pacientů je poměrně malá a přitom velmi heterogenní, zaslouží si naši pozornost. Nejen proto, že jde většinou o poměrně mladé lidi, ale také proto, že se v současnosti přece jen objevují možnosti, jak jim pomoci. Hlavně však existuje spousta možností, jak těmto pacientům nechtěně uškodit, protože jejich hemodynamika je unikátní a vzorce osvědčených medicínských postupů u nich často vedou k opačným než očekávaným blahodárným efektům.
Patofyziologie
Podkladem k vývoji PH je existence levopravého zkratu, tzn. přítomnosti komunikace mezi systémovým a plicním oběhem. Krev teče komunikací podle tlakového spádu, tedy zpravidla zleva doprava (ze systémového do plicního oběhu). Ne u každé zkratové VSV se však vyvine PH, i když se ponechá po druhém roku života. Rozhodující faktory pro vývoj PH jsou zejména: 1. velikost zkratu (defektu), 2. umístění zkratu, 3. interindividuální variabilita.
- Velikost zkratu: Z prosté logiky věci vyplývá, že větším defektem proteče větší zkratový objem. Jinými slovy velikost defektu je přímo úměrná velikosti objemového přetížení, které přitéká navíc do plicního oběhu.
- Umístění zkratu: Je zásadní v tom, že na něm záleží, pod jakým tlakovým spádem je krev zkratem hnána. Pokud je zkrat mezi systémovým a plicním oběhem před trojcípou chlopní, je tlakový spád relativně malý (anomální návrat plicních žil, defekt síňového septa). Naopak pokud je za trojcípou chlopní (defekt komorového septa, otevřená tepenná dučej) nebo je zkratová vada komplexní jako kompletní AV kanál, společný arteriální truncus (jednokomorové srdce), je tlakový spád velký. K objemovému přetížení se pak přidává významné tlakové přetížení, které vede řádově rychleji k PH.
- Interindividuální variabilita: Často jsme v klinické praxi překvapeni, že u daného zkratu je, nebo naopak není PH v rozporu s naší opakovanou zkušeností. Lze předpokládat podíl kandidátních genů idiopatické plicní arteriální hypertenze (iPAH) nebo naopak neznámých genů, které chrání proti vývoji PH, důležitá jsou i přidružená onemocnění apod.
Souhrnně se tedy dá říci, že není zkrat jako zkrat a riziko vývoje PH u různých zkratových VSV je různé (tab. 1 a 2), nehledě na to, že je různé i u různých pacientů [4].
1. Zkratové VSV, které mohou vést k PH [4]. ![Zkratové VSV, které mohou vést k PH [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9148cf730a8c45b846532583e6740443.png)
2. Riziko vzniku PH u některých VSV [3]. ![Riziko vzniku PH u některých VSV [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fbb40aa33ddf24a9a8cb404aba68e53e.png)
Jakmile zvýšení plicního průtoku překročí určitou (individuální) mez, dojde k přestavbě plicního řečiště, zpočátku reverzibilní, ale pokud zvýšený plicní průtok trvá, dojde k ireverzibilní přestavbě plicního řečiště. Tento děj je identický jako u iPAH (hypertrofie medie, intimální proliferace, fibróza a nakonec plexiformní léze a nekrotizující arteritida [5] a vede k postupnému vzestupu plicní vaskulární rezistence (PVR) a PH. Extrémní formou PH u VSV je Eisenmengerův syndrom, ke kterému dojde tehdy, pokud se tlak v plicním a systémovém řečišti vyrovná a zkrat se (aspoň v některých fázích srdečního cyklu) otočí na pravolevý. Neokysličená krev z plicní cirkulace pak míří do systémové, což vede k desaturaci a cyanóze (tab. 3).
Klinický obraz a diagnóza
Zásadním symptomem, na nějž se ptáme, je stupeň námahové dušnosti. V anamnéze dále cíleně pátráme po synkopách, palpitacích, hemoptýze a jiných krvácivých komplikacích. V objektivním nálezu bývá poslechový nález, dle typu VSV, při PH přibývá typicky systolický šelest z trikuspidální regurgitace a akcentace druhé ozvy nad plicnicí a následný diastolický šelest tamtéž. V případě složky pravolevého zkratu (Eisenmengerův syndrom) se objevuje centrální cyanóza, paličkovité prsty a nehty hodinových sklíček. Cíleně pátráme po projevech pravostranné kongesce (otoky, hepatomegalie, zvětšená jugula), které zpravidla bývají známkami vyčerpání rezerv, jež udržují nutnou hypercirkulaci. Kongesce je vždy známkou nepříznivé prognózy. Stanovení diagnózy nebývá obtížné, většinou se daří už na základě základního klinického vyšetření doplněného echokardiografickým vyšetřením srdce. Nález dokresluje RTG snímek hrudníku (zejména známky PH, tj. zvětšení kmene a větví plicnice a pravé komory (PK), zmnožení periferní plicní cévní kresby) a EKG (osa doprava, P pulmonale, hypertrofie PK). K upřesnění diagnózy někdy pomohou CT, MRI srdce (morfologie vady, známky a diferenciální diagnostika PH, zobrazení velkých hrudních cév). Katetrizace většinou pro potvrzení diagnózy není nezbytná, je ale důležitá ke stanovení stupně a event. reverzibility PH a k vedení léčby.
Komplikace
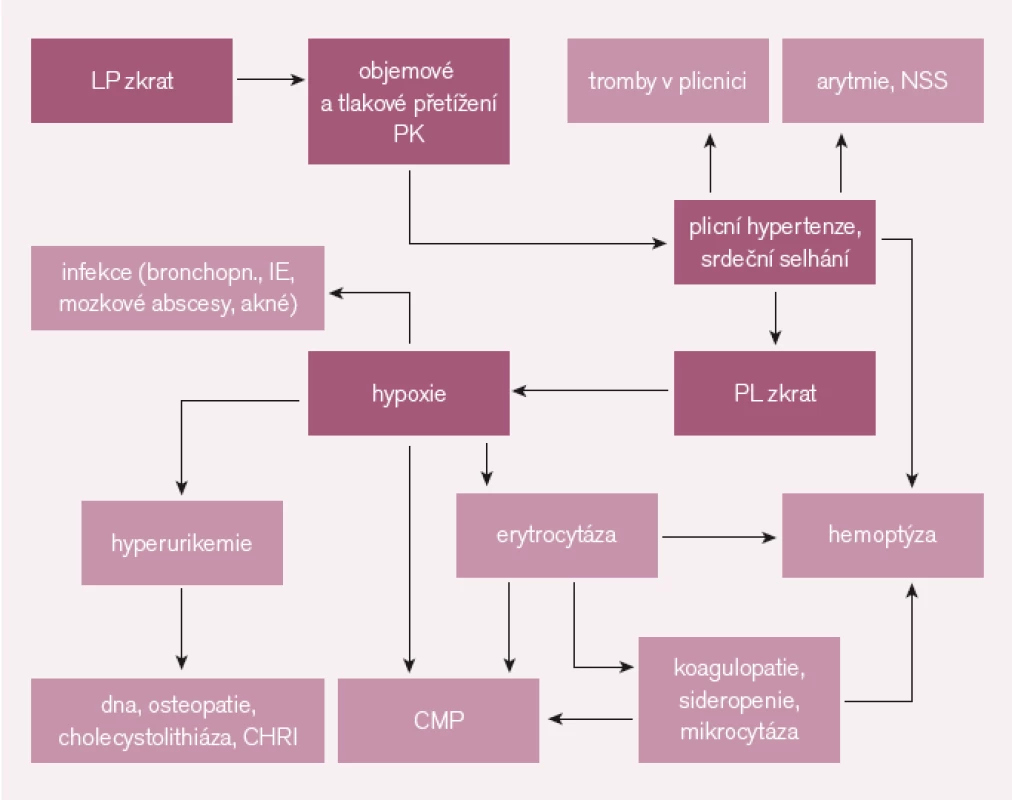
VSV s PH není jen nemoc oběhu, pokročilé stadium znamená vždy multiorgánové postižení [2–3], společným hlavním viníkem je orgánová hypoxie (patogenetické mechanizmy) (obr. 1).
Těžší hypoxie v kostní dřeni vede k sekundární erytrocytóze, ta může mít za následek hyperviskózní syndrom. Časté jsou trombózy (CMP), výrazná stimulace krvetvorby vede později k sideropenii a tvorbě mikrocytů, což dále zhoršuje reologické vlastnosti krve. Časté je i naopak krvácení – hemoptýza. K tomu přispívá i častá koagulopatie (vyšší INR a aPTT, abnormita destiček). V důsledku krevních změn i zvýšeného metabolizmu krevních elementů může být glomeruloskleróza s eventuálním renálním selháním, cholecystolitiáza, dna, hypertrofická osteopatie.
Plicní hypertenze společně s koagulopatií a trombocytopatií vedou k častým trombózám in situ v plicní cirkulaci, která dále zhoršuje hemodynamické poměry. Velmi časté jsou supraventrikulární i komorové arytmie, častá je náhlá srdeční smrt.
Časté jsou i mozkové příhody. Četné mikrotromby snadno proniknou do mozkové cirkulace (paradoxní embolizace), zvlášť snadno vznikají v síních při častých supraventrikulárních tachykardiích. Kromě obvyklých rizikových faktorů riziko CMP zvyšuje mikrocytóza a venepunkce [6]!
Často se setkáváme s infekčními komplikacemi, hypoxie znamená nižší odolnost a vyšší vnímavost tkání a orgánů k infektům. Infekce obecně mají těžší průběh, pacienti mají vysoké riziko infekční endokarditidy, mozkových abscesů (infekt se snadno hematogenně šíří do hypoxií méně odolného mozku, obchází přitom plíce s velkou fagocytární schopností pro patogeny). Hypoxie kůže vede k častému akné.
Prognóza
VSV s PH mají obecně nejhorší prognózu ze všech VSV, se kterými se v dospělosti setkáváme. Pacienti mají nízkou kvalitu života, četné komplikace, nicméně střednědobá prognóza quod vitae ve srovnání s podobně symptomatickými kardiaky (např. se systolickým selháním levé komory (LK) po infarktech myokardu či s dilatující kardiomyopatií) nebo onkologickými onemocněními je lepší. Je lepší než u pacientů s PH z jiných příčin než VSV. Po manifestaci Eisenmengerova syndromu 10 let přežívá 80% a 25 let stále 42% pacientů. Samozřejmě, že prognóza se liší dle typu vady, tak například pětileté přežití po manifestaci Eisenmengerova syndromu u defektu komorového septa je 91%, u otevřené tepenné dučeje 67%, u společné komory pak jen 34% [3].
Příčinou smrti je ve 30% náhlá srdeční smrt, v 11% hemoptýza, v 35% další komplikace spojené s těhotenstvím, nekardiálními operacemi, CMP, infekční endokarditidou, mozkovými abscesy aj. Jen asi 24% tak umírá na terminální kongestivní srdeční selhání, které představuje jakýsi přirozený konec nemoci, a více než ¾ na komplikace [2–3]!
Nejčastěji pacienti s VSV s PH umírají v třetím a čtvrtém deceniu, výjimku představuje PH na podkladě defektů síňového septa, která se často manifestuje velmi pozdě, nezřídka v sedmém deceniu.
Léčba
V této oblasti medicíny platí snad více než jinde „Primum non nocere!“ Jen málo medicínských postupů může příznivě ovlivnit VSV s PH, naproti tomu celá řada postupů může mít přímé fatální následky. Přesto se právě u VSV s PH setkáváme velmi často s nebezpečnou polypragmazií, která představuje zřejmě jakési zrcadlo naší terapeutické bezradnosti. Právě pacienti s VSV s PH často umírají v souvislosti s plánovanou hospitalizací. Podstatu následujícího odstavce o léčbě proto bude představovat vyjmenování rizikových situací. Naopak přístupy zlepšující stav pacientů budou poněkud v pozadí, bohužel tak jako v reálné praxi [2–3,7].
K pacientovi s VSV s PH musíme přistupovat jako k vybalancovanému hemodynamickému stavu, musíme stále mít na vědomí existenci zkratu a to, že směr a velikost zkratového proudění závisí na náplni a tlaku na obou stranách spojitých nádob, tj. na poměrech v systémové a plicní cirkulaci. Tedy jakékoliv vlivy, které ovlivňují stav systémové a plicní cirkulace, můžou dramaticky vychýlit křehkou rovnováhu. Nebezpečí představuje především snížení systémového tlaku nebo snížení cirkulujícího systémového volumu, kdy se může tok zkratem obrátit (nebo zvýšit podíl pravolevého zkratu) s následnou desaturací, prohloubením cyanózy s event. rizikem synkopy a náhlé srdeční smrti.
Nežádoucí systémová vazodilatace je společným projevem mnoha běžných životních situací i terapeutických projevů. Ze stejných důvodů tak nedoporučujeme větší fyzickou zátěž, horkou lázeň a saunu, těhotenství (nejvyšší mortalita a morbidita ze všech kardiaků!), potenciálně nebezpečné jsou všechny léky s vazodilatačním účinkem (ACEi, Ca antagonisté, anestetika).
Samozřejmě z důvodů nebezpečí dalšího zvýšení plicní hypertenze s akutním pravostranným selháním se pacienti musí vyhnout hypoxii aj. vazokonstrikčním látkám pro plicní oběh. Zakazujeme návštěvu vyšších nadmořských výšek, lety letadlem bývají bezproblémové.
Pacienti jsou ve vysokém riziku infekční endokarditidy, nebezpečný průběh u nich mívají i běžné infekty. Proto se doporučuje očkování proti chřipce, pneumokokům, důsledná sanace všech infektů a prevence infekční endokarditidy (v kategorii „vysoké riziko“).
Existence pravolevého zkratu představuje možnost paradoxní embolizace, nebezpečné jsou mimo jiné vzduchové embolizace, minimalizujeme proto i. v. vstupy, používáme vzduchových filtrů, při nutnosti stimulace volíme epikardiální přístup.
Erytrocytóza u VSV s PH bývala dříve ovlivňována častými venepunkcemi. Dnes máme data o tom, že opakované venepunkce sice mají akutní efekt na hyperviskózní syndrom, hemoptýzu a zátěžovou toleranci, ale za cenu akutního i dlouhodobého vysokého rizika cévních mozkových příhod, a proto se nedoporučují. V případě hyperviskózního syndromu se dává přednost hemodiluci (podání volumu), až při selhání při hemoglobinu nad 200g/l a hematokritu nad 0,65 se může provést venepunkce, vždy s podáním náhradního volumu a dle stavu železa se substitucí sideropenie v zabránění vzniku mikrocytů. Na erytrocytózu u VSV s PH je v současnosti pohlíženo jako na sekundární adaptační děj, který má svůj pozitivní význam, všechny zásahy do něj mají proto jen velmi krátké trvání, což jej ostře vymezuje proti erytrocytóze u polycytemia vera.
Antikoagulační léčba může mít příznivý efekt v tom, že snižuje riziko trombóz in situ v plicnicovém řečišti, ale za cenu velkého zvýšení krvácení (při koagulopatii, erytrocytóze). Doporučuje se proto jen u přídatného dalšího rizika (trombembolické nemoci, existenci trombů in situ, fibrilací síní).
Z ostatních léků musíme být obezřetní s hypotenzivy a diuretiky – systémová hypotenze a hypovolemie vede ke zvětšení pravolevého zkratu. Vhodná je proto vyrovnaná bilance tekutin. Diuretika mají svůj (malý) význam až v terminálních stadiích při projevech pravostranné kongesce. Z antiarytmik přichází do úvahy amiodaron a digitalis, amiodaron však u těchto pacientů obzvláště často vede k tyreotoxikóze. Nevhodné jsou i nesteroidní antiflogistika, v léčbě častých dnavých záchvatů upřednostňujeme kolchicin.
Specifická léčba PH má svůj efekt i u VSV s PH, proto se pacienti s VSV s PH v posledních letech stali novou cílovou skupinou v této nákladné léčbě. Data existují u NO, epoprostenolu, sildenafilu a bosentanu, do dnešní doby má však pouze bosentan za sebou úspěšnou randomizovanou placebem kontrolovanou studii na populaci VSV s PH (BREATHE-5). V této čtyřměsíční studii došlo na bosentanu k signifikantnímu zlepšení zátěžové tolerance (6 MWT, NYHA) a zlepšení hemodynamiky (pokles PVR a PH) [8]. Ke zlepšení došlo i u těch, kteří byli předtím na placebu, v otevřeném pokračování studie (BREATHE-5-OLE). Bosentan je dnes indikován ve stadiu NYHA III.
Specifická léčba PH v současnosti bohužel většinou není tak účinná, abychom po „předléčení“ mohli uvažovat o radikálním řešení vady, a to ani v kombinaci. Za řešitelné se považují VSV s PVR < 4 W.j., biopsie na stanovení reverzibility PH se dnes neprovádí, provádí se farmakologické vazodilatační testy při katetrizaci. U hraničních stavů je potřeba na možnost radikálního řešení myslet, protože úspěšná realizace znamená dramatické zlepšení prognózy!
Teoretickým definitivním řešením VSV s PH je kombinovaná transplantace srdce a plic (nebo transplantace plíce/plic se současnou korekcí VSV). Může nabídnout především zlepšení kvality života, třeba i s úplnou normalizací zátěžové tolerance. Bohužel, v současnosti je medián přežití pět let, což teoreticky při relativně lepší střednědobé prognóze většiny pacientů s VSV s PH vyhrazuje tuto metodu jen pro terminální pacienty. Zde narážíme na problém, jak terminální pacienty poznat. Nositelé VSV s PH žijí často velmi dlouho s neměnnou, byť velmi nízkou kvalitou života a výraznou symptomatologií a jejich preterminální zhoršení bývá často předzvěstí velmi brzkého konce. Dalším problémem je to, že při nedostatku dárců jsou upřednostňováni pro transplantaci plic pacienti s primárně plicním onemocněním před VSV, protože na větších souborech jim lze prokazatelně relativně více zlepšit prognózu. Výrazně symptomatický pacient (NYHA IV) by měl být s otázkou kombinované transplantace konzultován.
Závěr
VSV s PAH představují v současnosti malou, heterogenní a přitom velmi mladou populaci se špatnou prognózou a nízkou kvalitou života. Vzhledem k velmi závažným potenciálním komplikacím léčby bychom jakoukoliv terapii měli pečlivě zvažovat, velmi opatrně a jen v případě naprosté nutnosti přistupovat k chirurgickým zákrokům a pacientkám vysvětlit, jak velké nebezpečí hrozí v případě těhotenství. Z těchto všech důvodů a vzhledem ke komplexnosti potíží a komplikací, obtížným možnostem případné léčby, které vycházejí s podrobné kardiologické diagnostiky včetně katetrizace, by všichni tito pacienti měli být dispenzarizováni v centru se zkušenostmi s komplexními VSV. Sami jsme se v nedávné době přesvědčili, že pod diagnózou neřešitelné VSV s PH se může ve skutečnosti skrývat pacient s potenciálně řešitelnou vadou s plicní hypoperfuzí.
Doručeno do redakce 29. 9. 2009
Přijato po recenzi 19. 10. 2009
MUDr. Tomáš Zatočil
doc. MUDr. Anna Nečasová, CSc.
MUDr. Tomáš Brychta
Ambulance vrozených srdečních vad v dospělosti,
Interní kardiologická klinika, FN Brno-Bohunice
tzatocil@fnbrno.cz
Sources
1. Diller GP, Dimopoulos K, Okonko D et al. Exercise intolerance in adult congenital heart disease: comparative severity, correlates, and prognostic implication. Circulation 2005; 112 : 828–835.
2. Diller GP, Gatzoulis MA. Pulmonary vascular disease in adults with congenital heart disease. Circulation 2007; 115(8): 1039–1050.
3. Beghetti M, Barst RJ, Naeije R et al. Pulmonary Arterial Hypertension Related to Congenital Heart Disease. Munich: Elsevier GmbH 2006 : 1–228
4. Simonneau G, Galié N, Rubin LJ et al. Clinical classification of pulmorary hypertension. J Am Coll Cardiol 2004; 43 : 5S–12S.
5. Celermajer DS, Cullen S, Deanfield JE. Impairment of endotelium-dependent pulmonary artery relaxation in children with congenital heart disease and abnormal pulmonary hemodynamics. Circulation 1993; 87 : 440–446.
6. Ammash N, Warnes CA. Cerebrovascular events in adult patients with cyanotic congenital heart disease. J Am Coll Cardiol 1996; 28 : 768–772.
7. ESC Guidelines on management of Grown-Up Congenital Heart Disease. European Heart J 2003; 24 : 1035–1084.
8. Galié N, Beghetti M, Gatzoulis MA et al. Bosentan Randomized Trial of Endothelial Antagonist Therapy-5 (BREATHE-5) Investigators. Bosentan therapy in patients with Eisenmenger syndrome: a multicenter, double blind, randomized, placebo-controlled study. Circulation 2006; 114 : 48–54.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2009 Issue 4-
All articles in this issue
- Pulmonary arterial hypertension
- Pulmonary embolism
- Congenital heart defects with pulmonary hypertension
- Pulmonary Hypertension in Patients with Chronic Obstructive Pulmonary Disease
- Pleural effusion – aetiology and diagnostics
- Treatment of diabetes with respect to cardiovascular risk
- The future of dyslipidemia therapy
- Who preaches water and drinks wine – Cardiovascular risk in a medical population in a project
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pleural effusion – aetiology and diagnostics
- Pulmonary embolism
- Congenital heart defects with pulmonary hypertension
- Pulmonary Hypertension in Patients with Chronic Obstructive Pulmonary Disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career