-
Medical journals
- Career
Plicní embolizace
: I. Hofírek
: I. interní kardioangiologická klinika FN u sv. Anny v Brně
: Kardiol Rev Int Med 2009, 11(4): 170-173
: Sympozium
Článek se věnuje plicní embolizaci jako součásti trombembolické nemoci, která je významným medicínským i sociálně‑ekonomickým problémem. Připomíná základní epidemiologická a patofyziologická data trombembolické plicní embolizace. Shrnuje rizikové faktory a klinický obraz onemocnění, názory na používání diagnostických metod. Vybírá podstatné, dle literární a zejména klinické praxe. Vedle anamnézy a klinického stavu jsou to echokardiografické vyšetření a CT angiografie plicnice. Laboratorní vyšetření (například stanovení D‑dimeru a troponinu) jsou jen pomocnými prognostickými testy. Poukazuje na odlišnosti v chápání termínů masivní plicní embolizace z hlediska popisu CT a klinického stavu a na některé obtížnosti diagnostiky a terapie u pacientů s chronickou obstrukční plicní chorobou a u těhotných. Komentuje léčebné postupy, jako jsou léčba heparinem a trombolýza, a diskutované přístupy, trombektomie nebo endovaskulární techniky.
Klíčová slova:
plicní embolizace – masivní plicní embolizace – trombolýzaÚvod
Plicní embolizace je definována jako uzávěr tepenné části plicního řečiště, který může být různého rozsahu. Nejčastěji bývá způsobena vmetením krevního trombu z žilního řečiště, ale může to také být tukovou tkání, vzduchem, plodovou vodou, nádorovými a trombotickými hmotami i cizím tělesem.
Největším zdrojem plicních embolizací jsou žíly dolních končetin a pánevního řečiště. Z nich jsou nejvýznamnějším zdrojem (ve > 85 až 90%) proximální hluboké žíly končetiny (podkolenní a stehenní žíly) a pánevní žíly, méně často jsou to samotné bércové žíly (ty bývají zdrojem spíše pro paradoxní embolizace) a velká saféna, zvláště při insuficienci safeno femorálního spojení. Dalšími zdroji plicní embolizace mohou být obě duté žíly, podkličkové a jugulární žíly a žíly horních končetin. Raritně se mohou zdrojem plicní embolizace stát různé venózní malformace většího rozsahu [1–2].
Dále se článek zabývá trombembolickou plicní embolizací.
Hluboká žilní trombóza a plicní embolizace spolu neoddělitelně tvoří trombembolickou nemoc (venózní trombembolizmus – VTE).
Pravděpodobnost plicní embolizace (PE) různého rozsahu (od klinicky nepatrných příhod až po smrtelné události) se u proximálních hlubokých žilních trombóz (deep vein thrombosis – DVT) odhaduje na 20–65%. Distální hluboké žilní trombózy (postižení samotných bércových hlubokých žil) a v určitých případech také povrchová tromboflebitida velké safény v jejím průběhu na stehně a v místě spojení se stehenní žílou (safeno femorální junkce – SFJ) jsou zatíženy komplikací PE ve 2–10% případů, a to obzvláště při postižení kmenů v. tibialis posterior. Plicní embolizace může být první známkou probíhající DVT [3–4].
Přesná incidence venózního tromboembolizmu (VTE) není přesně známa, ale podle různých šetření se odhaduje na asi kolem 90 tis. případů na 100 tis. osob ročně! Uváděné hodnoty a metodiky zjišťování se dost liší. Pravděpodobně se na tomto stavu podepisuje různorodá metodika šetření a fakt, že značná část případů plicní embolizace a zejména hluboké žilní trombózy uniká klinické pozornosti. Odhady incidence DVT se velmi různí a obtížně stanovují. Předpokládá se incidence kolem 100–500, dokonce až tisíce případů/100 tis. osob/rok. Incidence PE se uvádí kolem 100–180 případů na 100 tis. osob/rok. Skutečné množství, podobně jako u DVT, bude pravděpodobně podstatně vyšší. Hluboká žilní trombóza je pravděpodobně třikrát častější než plicní embolizace [1,4–7]. Postižení žil v horní části těla (jugulární nebo podkličkové žíly) je relativně časté u hospitalizovaných pacientů, zejména u osob se závažnými stavy. V různých studiích byla pozorována plicní embolizace asi u 5–36% pacientů s trombózami v horní části těla, které na rozdíl PE u případů s trombózami v hlubokém žilním systému dolních končetin byly méně závažné [8]. Venózní trombembolizmus je významný socio-ekonomický problém. Dle dat části zemí Evropské unie se přímé náklady na terapii venózního trombembolizmu pohybují více než 1 mil. eur na 100 tis. obyvatel a rok. Přítomnost trombembolické nemoci násobně zvyšuje náklady na léčení jednotlivých pacientů. Rozvoj posttrombotického syndromu ještě navýší roční náklady u trombembolické nomoci asi o ¼ [1,9].
Předpokládá se, že klinicky významné jsou pouze 2–5% všech příhod plicní embolizace.
V mnoha (až přes 50%) případech manifestní PE nejsou přítomné příznaky DVT a mohou být negativní i neinvazivní vyšetření (např. duplexní sonografie). Plicní embolizace nejčastěji probíhá asymptomaticky (malé emboly) nebo pod přechodným krátkodobým obrazem dušnosti a tachypnoe bez příznaků „chřipkového“ charakteru či s nimi. Plicní infarkt s pleurální bolestí, často doprovázený hemoptýzou a pleurálním výpotkem, se objevuje pouze u části pacientů s PE (do periferních segmentárních větví). Obvykle u pacientů s chronickým plicním onemocněním či městnavou srdeční slabostí, protože fyziologická plicní cirkulace chrání před rozvojem nekrózy. Rozsáhlé plicní embolizace jsou příčinou kardiogenního šoku až náhlé smrti. Asi 8–13% pacientů s diagnostikovanou PE umírá v prvních dvou hodinách onemocnění. Autoptické studie nacházely až v 35% případů smrt na PE izolovanou bércovou (distální) DVT. Přibližně třetina pacientů s prodělanou PE (malou či velkou) umírá následně na recidivu onemocnění. Patofyziologické pochody při PE přibližuje tab. 1 [1,4,10].
1. Následky plicní embolizace. 
Na rozvoji venózního trombembolizmu se podílí celá řada rizikových faktorů (tab. 2).
2. Rizikové faktory obecně související s rozvojem DVT. 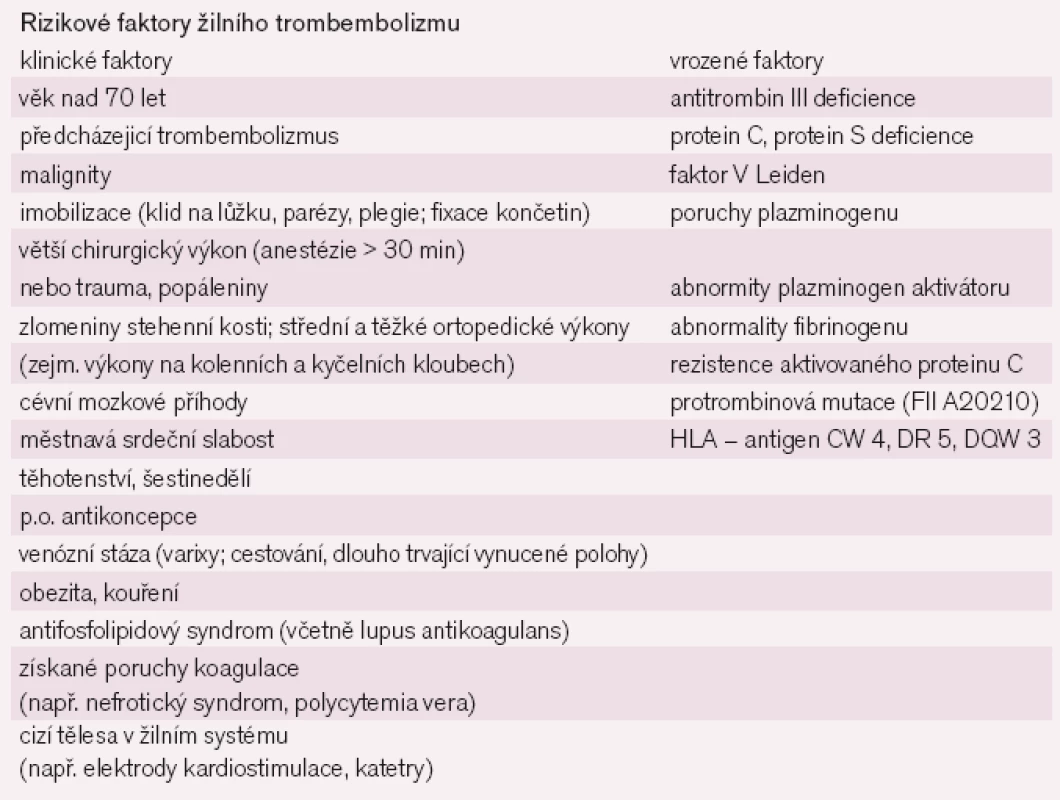
Klinicky pravděpodobně nejvýraznějším rizikovým faktorem je přítomnost maligního onemocnění. Významným faktorem podílejícím se na rozvoji VTE jsou trombofilní stavy. Samotná hospitalizace je rizikovým faktorem, například u pacientů hospitalizovaných týden a déle na interních odděleních se popisuje výskyt VTE v 10–13%. Častější výskyt je u pacientů s plicním onemocněním (až 18–22%). Ještě častější výskyt VTE je popisován na jednotkách metabolické intenzivní péče, po chirurgických, urologických, gynekologických a ortopedických výkonech. U těhotných vyššího věku (> 35 let) jsou PE častější než u mladších. U těhotných jsou rizikem i hypovolemie a v šestinedělí infekce. Perorální antikoncepce s sebou přináší zvýšení rizika rozvoje trombembolické choroby, preparáty vyšších generací přinášejí riziko vyšší [1,3–4,11]. Plicní embolizace se umí dobře maskovat pod různými klinickými obrazy. Kompletní diagnostika trombembolické nemoci a jejích příčin, zejména PE, nadneseně může připomínat v některých případech skládání puzzle, kdy máme složit velký obraz, ale máme jen několik kousků a pokud nám pár z nich k sobě přináleží, neznamená to, že již známe celý obraz. I v době moderních diagnostických metod je správná logická anamnéza významným počinem pro rozhodování. Informovat se na případné rizikové stavy je nezbytností. Klinické příznaky PE jsou nespecifické a jejich přítomnost je mnohdy individuální.
Klinický obraz plicní embolizace se projevuje nejčastěji dušností, většinou náhlou nebo rychle se rozvíjející, tachypnoí (DF > 16/min), někdy povrchním dýcháním, již méně často bolestí na hrudníku, pleurální bolestí, akcentací II. ozvy srdečními, sinusovou tachykardií a tachyarytmií (supraventrikulární tachykardie, fibrilace a flutter síní, komorové extrasystoly), synkopálními stavy, někdy spojenými s izometrickou námahou. Mnohdy jen anxiozitou, neklidem, kašlem, mírnou hemoptýzou, případně celkovou slabostí a malátností, pocením, teplotami, suchým pokašláváním, horečkami („chřipkovými“ příznaky), dokonce nočním pocením. Otoky dolních končetin, klinické příznaky hluboké žilní trombózy bývají pozorovány jen u asi třetiny pacientů s plicní embolizací [1,3–4].
Z instrumentárních a laboratorních vyšetření jsou pro diagnostiku PE nejpřínosnější ventilačně perfuzní plicní scan a spirální CT angiografie plicnice (CT vyšetření s kontrastem) a ultrazvukové vyšetření srdce.
V akutní situaci je vedle anamnézy, klinického vyšetření nejpraktičtější echokardiografické vyšetření včetně posouzení funkce pravé komory a tlaku v plicnici. Echokardiografie má v běžné klinické praxi pro svoji dostupnost a poměrnou jednoduchost nezastupitelný význam. Známky dysfunkce pravé komory (dilatace pravé komory, paradoxní pohyb mezikomorové přepážky) plicní hypertenze upozorňují na možnost významné plicní embolizace.
Zlatým standardem se stala CT angiografie plicnice (CTPA), ovšem prováděná a hodnocená zkušeným personálem na technicky vybavených přístrojích, např. nejméně 12detektorových. Hodnotící personál, samotné provedení a vyšetřovací technika může výsledek vyšetření významně jak pozitivně, tak negativně ovlivnit.
Pokud je dostupný, je ventilačně perfuzní plicní scan (V/Q scan), který má vysokou senzitivitu a specificitu v diagnostice PE, obě přes 90–95%, nadále přínosným vyšetřením v diagnostice plicní embolizace.
Duplexní sonografie žilního systému nemá v případě jasné diagnózy plicní embolizace větší význam a většinou není třeba se jejím prováděním zdržovat [1,3,1–13].
Význam termínu masivní plicní embolizace v hodnocení CT angiografie plicnice má rozdílný význam oproti klinickému chápání. Pro zobrazovací metodu jde pouze o popis zobrazení. Pro klinickou praxi je masivní plicní embolizace, definovaná jako plicní embolizace se systolickým arteriálním krevním tlakem < 90 mmHg nebo doprovázená šokovým stavem [1,14].
Z laboratorních vyšetření nejsou pro diagnostiku plicní embolizace doposud známé žádné specifické testy. Pouze pomocný význam pro hodnocení plicních embolizací má vyšetření D dimeru, troponinu a natriuretického peptidu (brain natriuretic peptide – BNP). V akutní medicíně se využívají především první dva.
Stanovení D dimeru má v diagnostice plicní embolizace spíše jen negativní předpovědní význam. Pozitivní D dimer (> 500 µg/l; dle věku > 200 až 500 µg/l) neznamená jen aktivní trombotický stav, protože se objevuje i při zánětech a sepsích, v těhotenství, při neoplaziích, větších traumatech, onemocněních ledvin. S věkem jeho fyziologická hladina stoupá. Velmi vysoké hladiny (např. > 5 000 µg/l) jsou pozorovatelné při fibrinolytických procesech, ale také u některých neoplastických stavů. Nízké (negativní, < 500 µg/l) hladiny D dimeru mohou s vysokou pravděpodobností vylučovat přítomnost aktivního trombotického procesu. Neplatí to však beze zbytku a můžeme plicní trombembolii pozorovat i v případech nízkých hladin D dimeru.
Náhlé zvýšení tlaku v plicnici může vyvolat ischemii myokardu až srdeční infarkt (obvykle pravé komory). Srdeční troponin (cTnT) se může využít pro odhad rizika nemocných s akutní plicní embolizací. Zvýšení srdečního troponinu (cTnT > 0,1 µg/l) při PE je odrazem srdeční ischemie až nekrózy a masivní PE a představuje podstatně zvýšené riziko smrti. Nachází se přibližně asi u 10–50% pacientů s plicní embolizací. Srdeční troponin a natriuretický peptid (BNP) jsou marginální pro diagnostiku plicní embolizace, ale mohou sloužit v odhadu prognózy pacientů (pacienti s vysokým troponinem mají při PE prognózu horší) a snad i při spolurozhodování o vhodných léčebných postupech [1–2,15–17].
V klinické praxi je možné se setkávat s případy, které vyžadují individuální přístup a přinášejí obtíže v rozhodování.
Například u pacientů s chronickou obstrukční plicní chorobou s jejím akutním zhoršením je diagnostika případné plicní embolizace nebo její diferenciální diagnóza obtížná. Využití echokardiografického vyšetření nebo stanovení D dimeru může selhávat. V takovýchto případech se nejvýznamněji uplatňuje CT angiografie plicnice (CTPA). Podobně tomu může být u pacientů s chronickou trombembolickou chorobou [18–19].
Obtížnosti v diagnostice a terapii se objevují také například u těhotných, kde se přednostně uplatňují vyšetření ultrazvukem, echokardiografie a duplexní sonografie žilního systému [20].
Existuje několik schémat na klinickou klasifikaci plicní embolizace (PE). Praktické se jeví definování plicní embolizace jako: masivní plicní embolizace se systémovou hypotenzí (systémový systolický arteriální krevní tlak SAP < 90 mmHg), střední nebo velká plicní embolizace s dysfunkcí pravé komory dle echokardiografického vyšetření bez systémové hypotenze (s normálním systémovým systolickým krevním tlakem, ≥ 90 mmHg), střední nebo malá plicní embolizace s normálním systémovým systolickým krevním tlakem a normální funkcí pravé komory. Prognóza pacientů s masivní plicní embolizací je jednoznačně horší než u ostatních skupin. U pacientů s masivní embolizací jsou nalézány významné autoptické nálezy podstatně častěji než u pacientů bez masivní plicní embolizace (SAP > 90 mmHg) [1–4,14].
Tato klasifikace plicní embolizace napomáhá i pro rozhodování k terapii. Terapie malé a střední nebo v lehčích případech velké plicní embolizace spočívá obvykle v aplikaci nefrakcionovaného heparinu (unfractionated heparin – UFH) i. v. bolus 5 000–10 000 j, nebo 70–80 j/kg hmotnosti. Následuje i. v. infuze UFH v dávce, která prodlouží aktivovaný parciální tromboplastinový čas (aPTT) 2–3násobně, obvykle kolem 1 250 (1 000–1 500) j/hod. Stejně je možné v léčení používat podkožní aplikace nízkomolekulárních heparinů (low molecular weight heparins – LMWH) v dávce 1mg/kg po 12 hod nebo odpovídající dávce v jednotkách antifaktor Xa, cca 100 až 175 IU/kg (dle typu LMWH) při normálních ledvinných funkcích. Nebo podávání fondaparinuxu v dávce 7,5mg podkožně po 24 hod u osob o hmotnosti 50–100kg. Při postižení funkce ledvin je třeba dávky LMWH a fondaparinuxu příslušně redukovat.
Kvalitní stupňovaná (vyšší tlak distálně, nižší proximálně) komprese dolních končetin je nezbytnou součástí terapie.
Trombolýza není indikována u pacientů s plicní embolizací s normálním systémovým arteriálním systolickým tlakem bez známek dysfunkce pravé komory.
Trombolýza (TL) je indikována u masivní embolizace se systémovou arteriální hypotenzí a při pravostranné srdeční dysfunkci. Podle praktických zkušeností se doporučuje i. v. systémové podávání tkáňového plazminogen aktivátoru (tPA) obvykle v dávce 100mg aplikované během dvou hodin. Možné je i podávání tPA v dávce 0,6mg/kg maximálně celkem 50mg i. v. infuzí během 15 min a popřípadě dávku při nelepšení klinického stavu po 30 min opakovat. Podle starších doporučení je možné podat i 1,5m. j. streptokinázy během 45 min, ovšem s riziky menší účinnosti a častějších vedlejších účinků.
Po TL se popisuje větší rozsah reperfundovaných oblastí plic než po HT. Trombolýzu je možné u plicní embolizace podat přibližně do 24 hod od vzniku příznaků, v případech refrakterních na dosavadní heparinovou léčbu a významné PE je možné podání TL až do 5–7 dnů od vzniku onemocnění. Místní podání trombolýzy (lokální TL) není při plicní embolizaci výhodnější oproti i. v. systémové aplikaci.
U pacientů s plicní embolizací s dysfunkcí pravé komory, ale normálním systémovým arteriálním systolickým tlakem (SAP ≥ 90 mmHg) se k použití trombolýzy přistupuje přísně individuálně s řádným zvážením rizik krvácení, rozhodně není doporučována jako standardní postup.
Trombolytická terapie nemění krátkodobou mortalitu na plicní embolizaci ani nemá podstatnější vliv na recidivu onemocnění. Je doprovázena častějšími většími krvácivými komplikacemi (nejčastěji zůstává jejich zdroj nenalezen, jinak se objevují v oblasti trávicího traktu a retroperitoneálně).
U těhotných je systémová trombolýza alteplázou jen výjimečně použitelná a s vysokým rizikem nejméně ztráty plodu, jistou možností je lokální katetrové podávání za přísné kontroly dávkování a hemokoagulačních parametrů.
Na endovaskulární postupy (léčba PE pomocí katetrů) jsou rozporné názory, většinou však nebývají velkým přínosem a je nutnost doplňovat je trombolýzou. Chirurgický výkon (Trendelenburgova operace) je rezervován pro masivní fulminantní PE. Výkony jsou zatíženy vysokou mortalitou (10–30%) a nutností urgentního provedení, přežije li pacient prvních 60–120 min po vzniku PE, má vysokou pravděpodobnost přežití příhody. Aplikace kaválních filtrů nemá v léčení plicní embolizace žádný význam [1–4,14,21].
Práce byla vypracována v rámci Výzkumného záměru MŠMT – MSM0021622402.
Doručeno do redakce 12. 10. 2009
Přijato po recenzi 17. 10. 2009
MUDr. Ivo Hofírek
I. interní kardioangiologická klinika
FN U sv. Anny v Brně
ivo.hofirek@fnusa.cz
Sources
1. Goldhaber SZ. Deep venous thrombosis and pulmonary embolism. In: Fauci AS, Braunwald E, Kasper DL et al (eds). Harrison’s Principles of internal medicine. 17th ed. New York: McGraw-Hill 2008 : 1651–1655.
2. Penka M. Plicní embolie. In: Dítě P et al (eds). Vnitřní lékařství. 2. vyd. Praha: Galén 2007 : 103–106.
3. Widimský J, Malý J et al. Akutní plicní embolie a žilní trombóza. Praha: Triton 2002 : 51.
4. Tapson VF. Acute pulmonary embolism. N Engl J Med 2008; 358 : 1037–1052.
5. Geerts WH, Bergqvist D, Pineo GF et al. Prevention of venous thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. 8th ed. Chest 2008; 133: S381–S453.
6. Silverstein MD, Heit JA, Mohr DN et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25‑year population‑based study. Arch Intern Med 1998; 158 : 585–593.
7. Anderson FA jr, Wheeler HB, Goldberg RJ et al. A population‑based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT Study. Arch Intern Med 1991; 151 : 933–938.
8. Major KM, Bulic S, Rowe VL et al. Internal Jugular, Subclavian, and Axillary Deep Venous Thrombosis and the Risk of Pulmonary Embolism. Vascular 2008; 16 : 73–79.
9. MacDougall DA, Feliu AL, Boccuzzi SJ et al. Economic burden of deep-vein thrombosis, pulmonary embolism, and post‑thrombotic syndrome. Am J Health Syst Pharm 2006; 63: S5–S15.
10. Riedel M. Choroby plicního oběhu. 1. vyd. Praha: Galén 2000 : 131–149.
11. James AH, Jamison MG, Brancazio LR et al. Venous thromboembolism during pregnancy and the postpartum period: incidence, risk factors, and mortality. Am J Obstet Gynecol 2006; 194 : 1311–1315.
12. MacKenzie JD, Nazario-Larrieu J, Cai T et al. Reduced‑dose CT: Effect on reader evaluation in detection of pulmonary embolism. Am J Roentgenol 2007; 189 : 1371–1379.
13. Anderson DR, Barnes DC. Computerized Tomographic Pulmonary Angiography Versus Ventilation Perfusion Lung Scanning for the Diagnosis of Pulmonary Embolism. Curr Opin Pulm Med 2009; 15 : 425–429.
14. Kucher N, Rossi E, De Rosa M et al. Massive pulmonary embolism. Circulation 2006; 113 : 577–582.
15. Corwin MT, Donohoo JH, Partridge R et al. Do Emergency Physicians Use Serum D‑dimer Effectively to Determine the Need for CT when Evaluating Patients for Pulmonary Embolism? Review of 5,344 Consecutive Patients. Am J Roentgenol 2009; 192 : 1319–1323.
16. Janata K, Holzer M, Laggner AN et al. Cardiac troponin T in the severity assessment of patients with pulmonary embolism: cohort study. BMJ 2003; 326 : 312–313.
17. Kline JA, Zeitouni R, Marchick MR et al. Comparison of 8 biomarkers for prediction of right ventricular hypokinesis 6 months after submassive pulmonary embolism. Am Heart J 2008; 156 : 308–314.
18. Rutschmann OT, Cornuz J, Poletti PA et al. Should Pulmonary Embolism be Suspected in Exacerbation of Chronic Obstructive Pulmonary Disease? Thorax 2007; 62 : 121–125.
19. Tillie-Leblond I, Marquette CH, Perez T et al. Pulmonary embolism in patients with unexplained exacerbation of chronic obstructive pulmonary disease: prevalence and risk factors. Ann Intern Med 2006; 144 : 390–396.
20. Colman-Brochu S. Deep vein thrombosis in pregnancy. MCN Am J Matern Child Nurs 2004; 29 : 186–192.
21. Krishnamurthy P, Martin CB, Kay HH et al. Catheter-directed thrombolysis for thromboembolic disease during pregnancy: a viable option. J Matern Fetal Med 1999; 8 : 24–27.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2009 Issue 4-
All articles in this issue
- Pulmonary arterial hypertension
- Pulmonary embolism
- Congenital heart defects with pulmonary hypertension
- Pulmonary Hypertension in Patients with Chronic Obstructive Pulmonary Disease
- Pleural effusion – aetiology and diagnostics
- Treatment of diabetes with respect to cardiovascular risk
- The future of dyslipidemia therapy
- Who preaches water and drinks wine – Cardiovascular risk in a medical population in a project
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pleural effusion – aetiology and diagnostics
- Pulmonary embolism
- Congenital heart defects with pulmonary hypertension
- Pulmonary Hypertension in Patients with Chronic Obstructive Pulmonary Disease
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

