-
Medical journals
- Career
Význam dvourozměrné (2D) echokardiografie v diagnostice hypertrofické kardiomyopatie
Authors: J. Veselka
Authors‘ workplace: 2. LF UK a FN V Motole, Praha ; Kardiologická klinika
Published in: Kardiol Rev Int Med 2006, 8(1-2): 52-55
Category: Editorial
Overview
Echokardiografie má v diagnostice hypertrofické kardiomyopatie (HCM) zcela zásadní postavení. Všechna ostatní vyšetření kromě magnetické rezonance mají pouze pomocný charakter a diagnóza je zpravidla postavena na přítomnosti hypertrofie levé komory (LK) postihující především interventrikulárním septum (IVS) a přední stěnu, menší LK s vysokou ejekční frakcí, dopplerovských známek poruchy diastolické funkce LK a nitrokomorovém gradientu, který se vyskytuje asi u 1/4 pacientů. Za typický považujeme nález asymetrické septální hypertrofie s maximální tloušťkou stěny LK přesahující 12 mm a s poměrem tloušťky IVS a volné stěny přesahující 1,3. Při použití poměru 1,5 se dále ještě zvyšuje specificita vyšetření. Je nutné zdůraznit, že echokardiografická kritéria musí být dávána do kontextu s klinickým vyšetřením a že výskyt pouhé hypertrofie LK nebo nitrokomorové obstrukce nesplňuje diagnostická kritéria HCM. Srdeční morfologii můžeme v klinické praxi nejlépe popsat pomocí echokardiografie a lze předpokládat, že v blízké budoucnosti i pomocí magnetické rezonance srdce, která má ještě lepší předpoklady k přesnějšímu stanovení diagnózy HCM.
Klíčová slova:
hypertrofická kardiomyopatie – echokardiografie – obstrukceHypertrofie levé komory
Diagnózu hypertrofické kardiomyopatie (hypertrophic cardiomyopathy - HCM) stanovujeme v klinické praxi nejčastěji na základě 2rozměrného (2D) echokardiografického vyšetření. Hlavním sledovaným parametrem je hypertrofie levé komory (LK). Při vyloučení přítomnosti hypertenze a aortální stenózy je nejpravděpodobnější příčinou hypertrofie právě HCM. Hypertrofie bývá typicky asymetrická a postihuje především interventrikulární septum (IVS) a přední stěnu LK. Za typický považujeme nález asymetrické septální hypertrofie s maximální tloušťkou stěny LK přesahující 12 mm (obvykle však nad 15 mm) a s poměrem tloušťky IVS a volné stěny přesahující 1,3. Při použití poměru 1,5 se dále ještě zvyšuje specificita vyšetření. Většina diagnostikovaných pacientů má však maximální tloušťku stěny LK ještě výraznější a ve většině souborů se její průměr pohybuje v hodnotách kolem 20 mm (obr. 1). Při jakémkoliv stanovování arbitrárních hranic pro stanovení diagnózy HCM si však musíme uvědomit značnou heterogenitu tohoto onemocnění. Díky tomu existují pacienti s HCM, u nichž nenacházíme dokonce žádné zesílení stěny LK, které by se pohybovalo v konvenčně stanovených patologických hodnotách (nad 12 mm). Tyto nálezy jsou vzácné, avšak např. pro mutace troponinu T jsou typické. Na druhou stranu existuje přibližně 5-10 % nemocných s tloušťkou stěny LK přesahující 30 mm; tato hodnota má svůj klinický význam, protože byl prokázán vztah mezi maximální tloušťkou stěny LK a rizikem náhlé smrti, které je právě při dosažení hodnoty 30 mm velmi vysoké. Z klinického hlediska je navíc významné, že většina nejrizikovějších pacientů je jen minimálně symptomatická nebo zcela asymptomatická [1]. Výsledky výše uvedené americké studie později relativizovala studie britská, která ukázala na možné vysoké riziko nemocných s malou hypertrofií LK a význam dalších rizikových faktorů náhlé smrti [2]. Velice zajímavá polská studie ukázala zvýšené riziko náhlé smrti u nemocných s malou dutinou LK a silným IVS [3].
Image 1. Transtorakální echokardiografie, dlouhá osa parasternálně. Je přítomna asymetrická hypertrofie IVS. 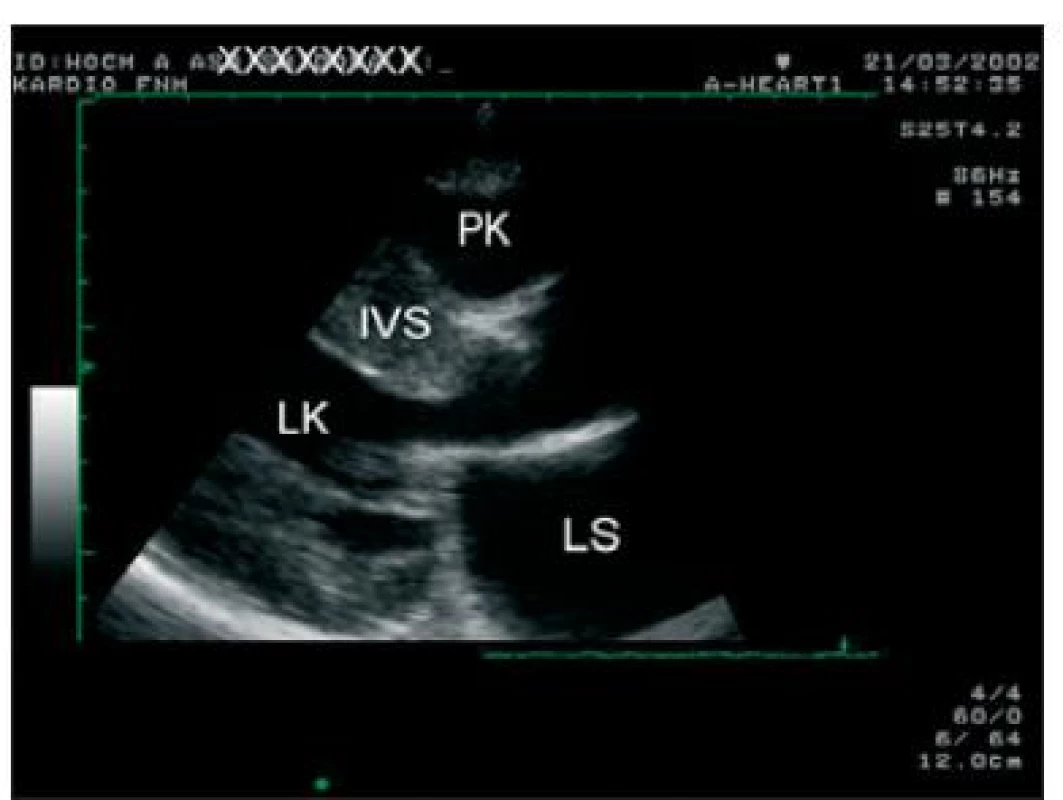
Slabinou všech analýz týkajících se tloušťky stěny LK je však zaměření na maximální hodnotu tloušťky stěny. Tento postup tedy nereflektuje masu postiženého myokardu a zaměřuje se pouze na určitý, nejvíce zesílený segment LK. Toto zjednodušení sice přináší určitou jednotnost do hodnocení nálezů a umožňuje jednoduše provádět retrospektivní analýzy nebo multicentrické studie nezatěžující provoz echokardiografických laboratoří, avšak již z podstaty věci je metodicky nepřesný a senzitivita pro takto stanovovanou diagnózu HCM u dospělé populace se pohybuje pouze kolem 60 % [4]. Nízkou senzitivitu může do jisté míry zapříčinit omezená vyšetřitelnost některých pacientů, přičemž tento problém by mohl být zcela vyřešen častějším používáním MRI v klinické praxi. Mimoto však platí, že u některých typů HCM dochází k rozvoji hypertrofie až v pozdějším věku.
V Charronově práci byla senzitivita jednoduchého echokardiografického kritéria postaveného pouze na maximální tloušťce stěny v jediném segmentu 43% ve věkové skupině 18-29 let, 68% ve skupině 30-49 let a 83% ve skupině nad 50 let.
V recentní studii Forissiera et al [5] byla senzitivita echokardiografického vyšetření založeného na kritériu tloušťky stěny nad 13 mm ve věkové skupině nad 50 let dokonce jen 54%.
Maximální hodnota tloušťky LK má i další význam ve vztahu k rozvoji srdečního selhání. Maron et al recentně prokázali pomocí multivariantní analýzy, že existuje parabolický vztah mezi příznaky srdečního selhání a maximální hodnotou tloušťky stěny LK. Nezávisle na řadě ostatních zvažovaných faktorů je tedy z hlediska vzniku srdečního selhání nejvíce ohrožena skupina nemocných s maximální tloušťkou stěny LK 20-24 mm (27 % pacientů v této skupině mělo srdeční selhání ve třídě NYHA III-IV) a nejméně jsou ohroženi nemocní s okrajovými hodnotami pod 15 mm a nad 30 mm [6]. Obě výše uvedené studie se dobře doplňují a vyplývá z nich zajímavý fakt, že nemocní s vysokou hodnotou maximální tloušťky stěny LK nebývají symptomatičtí (nemají známky srdečního selhání), avšak z hlediska náhlé smrti jsou velmi ohroženi.
Řada autorů se v minulosti pokusila o klinickou klasifikaci HCM podle distribuce a rozsahu hypertrofie LK. Všemožné a dle mého názoru dost uměle stanovované typy HCM zpravidla vyjadřovaly, které segmenty LK jsou při echokardiografickém vyšetření zesíleny a autoři většinou i přidávali informaci, jak často se tento typ HCM v jejich souboru vyskytuje. Toto dělení na základě pouhé morfologie LK nemá většího klinického opodstatnění, pokud daný přístup nereflektuje kvantifikaci hypertrofie. Za zmínku stojí, že ze všech různých typů se nejčastěji vyskytuje postižení anteroseptálních segmentů. Pravá komora (PK) bývá u HCM rovněž do určité míry postižena a většina pacientů vykazuje zesílení její volné stěny.
V mezinárodní literatuře se nejčastěji používá klasifikace dle Marona (tab. 1). Díky dlouholeté klinické i výzkumné činnosti prof. Gregora na poli HCM se v Čechách často používá i jím navržené dělení (tab. 2). Toto dělení autor doporučuje ještě doplnit o další parametry, které dobře definují celkový rozsah hypertrofie LK, a tak se vyhnout výše zmíněným limitacím při používání jednoduchého parametru maximální tloušťky stěny LK. Můžeme tak ještě stanovit parametr střední tloušťky myokardu, který se vypočítá jako aritmetický průměr tloušťky myokardu v 10 segmentech LK, nebo rozsah hypertrofie, která se stanovuje jako počet segmentů, v nichž tloušťka stěny přesáhne 15 mm, násobený číslem 10. V tomto případě tedy jde o procentuální vyjádření počtu segmentů LK se zesílením stěny nad 15 mm [7].
Table 1. Maronova klasifikace HCM dle distribuce hypertrofie LK. 
Table 2. Gregorova klasifikace HCM dle distribuce hypertrofie LK. 
Recentně byla publikována i velmi zajímavá práce, která ukázala zvýšenou senzitivitu (při udržení vysoké specificity blížící se 100 %) stanovení diagnózy HCM při použití echokardiografické kvantifikace hypertrofie LK na základě měření tloušťky stěny v 8 jednotlivých segmentech LK s následnou adjustací výsledku pro věk, pohlaví a povrch těla. Zlepšení senzitivity stanovení diagnózy přináší toto 2D left ventricle hypertrophy score především u mladých dospělých, u nichž došlo k jejímu signifikantnímu zvýšení (67 vs 53 %; p < 0,03) [5]. Stanovení rozsahu hypertrofie může tedy přinést zvýšenou senzitivitu při stanovení diagnózy HCM, což může být v klinické praxi významné především ve skupině dosud „zdravých nositelů“ patologického genotypu, u kterých ještě nejsou přítomny ani patologické elektrokardiografické změny. Takto postižení dospělí lidé by měli být častěji kontrolováni, protože pravděpodobnost rozvoje hypertrofie s typickým nálezem pro HCM je vysoká. Ke stanovení diagnózy u individuí s pozitivním genotypem a ještě negativním fenotypem může zásadně přispět tkáňová dopplerovská echokardiografie, další rozbor by však přesáhl možný rozsah tohoto textu.
HCM s apikálním postižením
Klinicky zajímavou a v Čechách neobvyklou formu onemocnění představuje HCM s apikálním postižením. V tomto případě je přítomno zesílení apikálních a někdy částečně i středních segmentů LK, jejíž dutina v oblasti hrotu během systoly prakticky obliteruje. Při echokardiografickém vyšetření může někdy dojít k přehlédnutí tohoto postižení, a to v případech, v nichž není zóna blízká ultrazvukové sondě dobře vyšetřitelná. Zvýšení senzitivity i specificity echokardiografického vyšetření může přinést intravenózní aplikace echokontrastní látky, případně ještě v kombinaci s 3D-echokardiografií [8]. Větší výskyt této formy HCM je popisován v Japonsku a zásadní klinickou informací je fakt, že tito nemocní mají zpravidla velmi dobrou prognózu. Výjimku tvoří skupina pacientů, kteří mají apikální formu HCM spojenou s trvalou a úplnou obliterací apikální části dutiny LK. Tito nemocní tvoří asi jen 10-20 % všech pacientů s apikální formou HCM [9,10] a dochází u nich k postupnému rozvoji apikálního aneuryzmatu LK (obr. 2). Patofyziologickým mechanizmem je patrně vysoký tlak v apikální části dutiny LK přetrvávající během celého srdečního cyklu, který se přenáší intramurálně a brání dostatečné perfuzi apikálních segmentů LK; trvalá apikální ischemie vede k nekróze a rozvoji apikálního aneuryzmatu [10]. Prognóza této skupiny pacientů je nejistá, zvláště pak při časté asociaci s prodlouženým QT-intervalem na EKG. Pacienti nemající úplnou obliteraci hrotu LK, vykazují sice zátěžovou ischemii v oblasti hrotu LK, avšak k rozvoji aneuryzmatu u nich nedochází. Diferenciálně diagnosticky může být obtížné odlišit nemocné s apikální formou HCM a vytvořeným hrotovým aneuryzmatem LK od nemocných s midventrikulární obstrukcí [11].
Image 2. Transtorakální echokardiografie, 4dutinová projekce. Je přítomno menší aneuryzma (šipky) v hrotu LK. 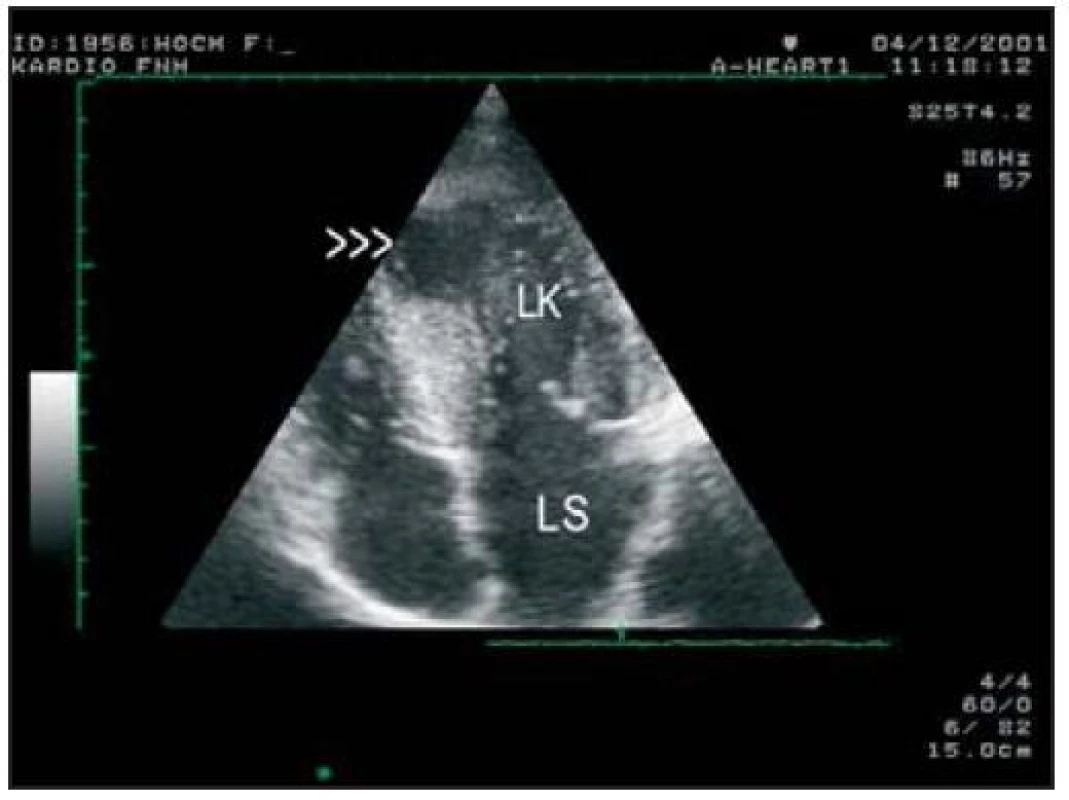
Velikost, tvar a funkce levé komory
Typickým nálezem při echokardiografickém vyšetření je nezvětšená dutina LK mající diastolický průměr obvykle 40-45 mm a přesahující jen sporadicky 50 mm. Pacienti s rozměrem LK nad 50 mm se častěji nachází v terminální fázi onemocnění charakterizované dilatací LK, progresivním zhoršením její systolické funkce a zeslabením jejích stěn.
Thaman et al publikovali nedávno na základě multivariantní analýzy echokardiografických parametrů dlouhodobě sledovaného souboru pacientů, že velikost LK při iniciálním vyšetření je ve vztahu k budoucí progresi systolické dysfunkce LK. Nutno podotknout, že senzitivita, specificita i prediktivní hodnoty velikosti LK pro progresi systolické dysfunkce byly velmi nízké [12].
Tvar LK se u nemocných s HCM liší v závislosti na jejich věku. Tento fakt byl prokázán řadou studií a recentně dal vzniknout teorii postupné a dlouhotrvající remodelace LK při HCM. Pro mladé pacienty je typická menší LK s těžce hypertrofickým IVS, které se vyklenuje do dutiny LK, takže při vyšetření v apikálních projekcích má dutina LK do určité míry naznačen banánovitý, někdy až štěrbinovitý tvar. Podle zajímavé polské studie Dimitrowa et al má tento tvar LK spolu v kombinaci s poměrem IVS k průměru LK > 0,5 vztah k vyššímu riziku náhlé smrti [3]. Naopak pro pacienty ve věku nad 60 let je typická nezmenšená dutina LK s hypertrofií IVS lokalizovanou pouze do oblasti bazálního septa (hypertrophy with proximal bulge někdy nazývané septum sigmoideum). Pro tuto skupinu seniorů je současně typická změna úhlu, ve kterém odstupuje aorta z LK; aorta se posunuje více doprava dopředu, a tím se zužuje LVOT. Obvyklý je současný nález lehké obstrukce (někdy jen zátěžové) v oblasti zúženého LVOT [13]. Dalším nálezem typickým pro seniory je přítomnost kalcifikací v mitrálním anulu. Rozsáhlejší kalcifikace se mohou podílet jednak na vzniku mitrální regurgitace nezávislé na obstrukci (centrální, nevelký regurgitační proud dosahující přibližně do poloviny LS) a dále na lehkém vysunutí mitrální chlopně dopředu s následným zúžením LVOT.
Mnohotvárnost LK je však pro HCM typická, a proto má výše popsané rozdělení spíše jen didaktický význam. Zásadní odchylky ve tvaru LK mohou způsobovat hypertrofické papilární svaly, které dávají LK tvar přesýpacích hodin. Navíc jsou u HCM obvyklé nejrůznější abnormality ve tvaru i umístění papilárních svalů, které v některých případech inzerují přímo do cípů mitrální chlopně bez interpozice šlašinek, a dávají tak vzniknout mitrální regurgitaci i různým typům nitrokomorové obstrukce.
Abnormality ve tvaru PK jsou pravděpodobně rovněž věkově závislé, jako je tomu u LK. U mladších pacientů se častěji nachází ovoidní tvar PK, pro starší nemocné je typický spíše protáhlý „banánovitý“ tvar PK. V apikální 4dutinové projekci se u mladších pacientů zdá, jakoby hrot PK byl zcela vyplněn svalovinou přecházející do ní z IVS [14].
U většiny pacientů s HCM nacházíme EFLK v „supranormálních“ hodnotách a výjimkou nejsou ani hodnoty přesahující 90 % při téměř úplné obliteraci dutiny LK v systole. Pouze malá část neselektovaných pacientů má sníženou hodnotu EFLK nebo podobného parametru systolické funkce – frakčního zkrácení. V recentní práci Thamana et al identifikovali při prvním vyšetření souboru 1 080 pacientů s HCM pouze 2,4 % pacientů se sníženým frakčním zkrácením [12]. Z klinického hlediska se ukázalo jako důležité, že tato malá podskupina pacientů měla při dalším sledování nepříznivou prognózu se zvýšeným nebezpečím dilatace LK, zeslabení jejích stěn a vyšším výskytem srdečního selhání a synkop.
Poruchy kinetiky LK nacházíme při klidovém i zátěžovém vyšetření častěji v segmentech LK s výraznou hypertrofií, takže typickým nálezem je lehce hypokinetické, výrazně hypertrofické IVS [15]. Poruchu systolické i diastolické funkce LK vyjádřenou indexem myokardiální výkonnosti (Tei-indexem) popsaly u pacientů s HCM 2 práce [16,17].
Nitrokomorová obstrukce
HCM může být z klinického i hemodynamického hlediska rozdělena na formu s obstrukcí a bez obstrukce. HOCM představuje 25-40 % všech případů HCM. Za patologickou obstrukci označujeme stav, při kterém naměříme vyšší nitrokomorový gradient než 30 mm Hg. Nitrokomorová obstrukce se může vyskytovat ve 2 etážích, a to v oblasti výtokového traktu levé komory (left ventricular outflow tract - LVOT) nebo ve středních segmentech LK, tedy midventrikulárně. Midventrikulární obstrukce je přibližně 10krát méně častá než obstrukce subaortální (v LVOT) a přibližně v polovině případů je se subaortální obstrukcí ještě spojená. V takovém případě mají pacienti obstrukci ve 2 etážích LK.
Popisy nálezu nitrokomorové obstrukce při použití 1D-echokardiografie již patří minulosti, nicméně ještě v současné době se při omezené vyšetřitelnosti pacienta můžeme orientovat podle systolického přiblížení předního cípu mitrální chlopně a subvalvulárního aparátu (konkrétně šlašinek jdoucích k přednímu cípu) k proximálnímu segmentu IVS (tab. 3, obr. 3). V některých případech dokonce nalézáme pomocí 1rozměrného vyšetření kontakt mezi šlašinkami a IVS, a to nejčastěji v období střední systoly („midsystolicky“) (obr. 4).
Table 3. Kvantifikace dopředného pohybu mitrální chlopně dle 1D-echokardiografie. 
Image 3. Transezofageální echokardiografie, zoom na oblast výtokového traktu LK. Je přítomen dopředný pohyb předního cípu mitrální chlopně (šipky), který zcela obturuje výtokový trakt LK v období střední systoly. 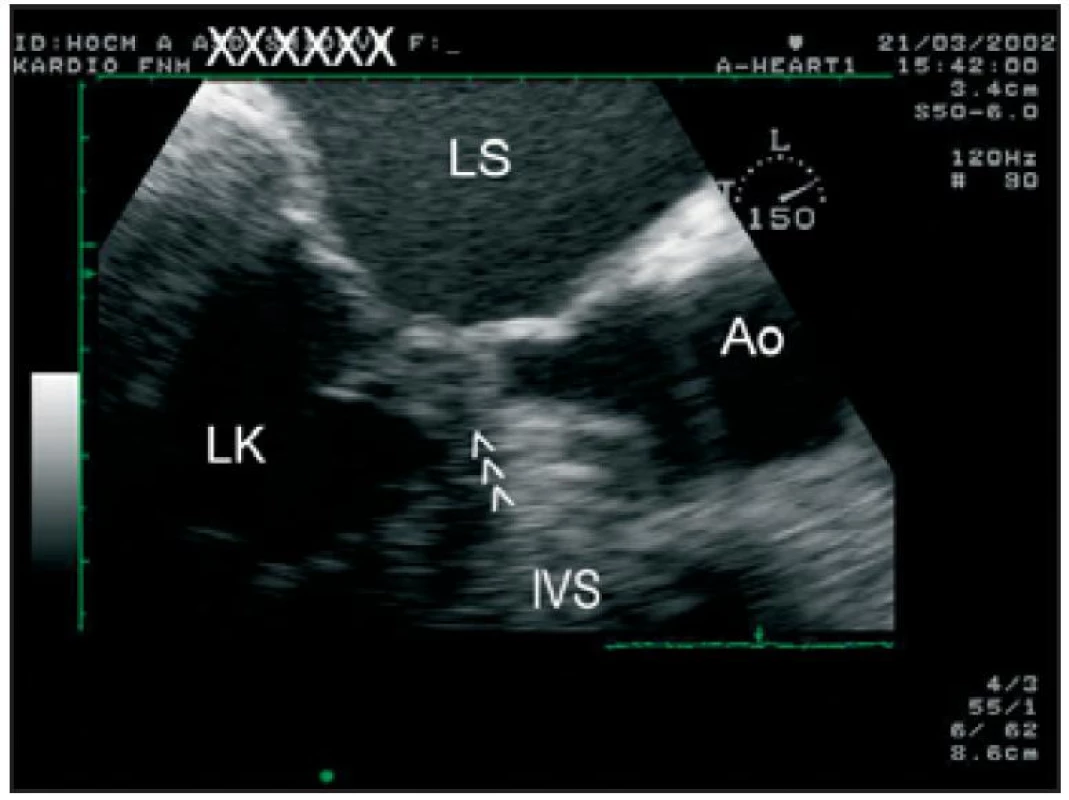
Image 4. Transtorakální echokardiografie, modifikovaná 4dutinová projekce. Šipky ukazují midventrikulární obstrukci rozdělující LK na oblast apikální a část výtokovou. 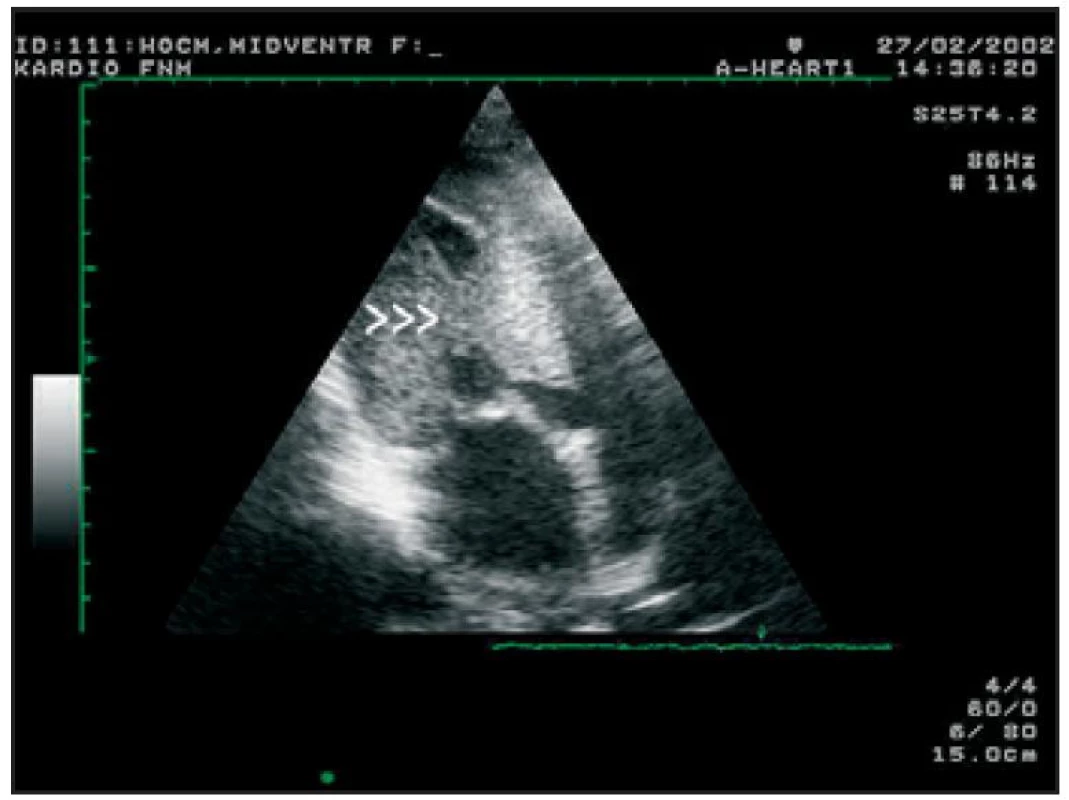
Zásadním diagnostickým pokrokem bylo zavedení 2D-echokardiografického vyšetření spolu s dopplerovskými metodami. Díky nim jsme odhalili základní patofyziologické mechanizmy vzniku obstrukce a současně bylo možno popsat morfologické předpoklady k jejímu vzniku:
- Jednoduchý princip patofyziologie vzniku subaortální obstrukce říká, že„není obstrukce bez hypertrofie“. Současně platí, že pokud zkoumáme rozsah hypertrofie LK, tak pacienti s vyšší celkovou hmotností LK mají častěji nitrokomorovou obstrukci [18].
- Dalším předpokladem je prodloužení cípů mitrální chlopně, které navíc nekoaptují standardním způsobem pouze v oblasti svých volných konců, ale často již proximálněji [19].
- Celý mitrální aparát je vysunut směrem dopředu k IVS, s čímž souvisí i posun obou papilárních svalů dopředu a částečně i jeden k druhému. Díky tomu se snižuje napětí šlašinek, které by za normálních okolností měly být nataženy mezi předním cípem mitrální chlopně a papilárními svaly. Ochablé šlašinky spolu s částí předního cípu mitrální chlopně se tak za výše popsaných předpokladů mohou v systole částečně nasunout do LVOT, kde způsobují obstrukci. Pro tento jejich dopředný pohyb se vžil termín „systolic anterior motion – SAM“.
V časné a především ve střední části systoly dochází k přiblížení šlašinek jdoucích k přednímu cípu mitrální chlopně k bazálnímu segmentu IVS. Tento dopředný pohyb je nazýván SAM. Jeho kvantifikace je obtížná a závisí především na tom, zda se rozhodneme pro kvantifikaci morfologickou, jejímž vyjádřením je vzájemný vztah mitrálního aparátu (šlašinek a předního cípu mitralis) a IVS, nebo kvantifikaci hemodynamickou, kterou můžeme vyjádřit vzniklým nitrokomorovém gradientem. Historická kvantifikace dle 1D-echokardiografie nemá v dnešní klinické praxi příliš velký význam, avšak do určité míry popisuje morfologii vzájemného vztahu šlašinek a IVS. Lepší představu o rozsahu dopředného pohybu mitrálního aparátu si uděláme pomocí 2D-echokardiografie. Nejlepší projekcí pro zobrazení SAM je parasternální dlouhá osa, která se používá i pro kvantifikaci při 1D-echokardiografii. Samotné zúžení LVOT včetně přesného načasování celého procesu se nejlépe zobrazí v parasternální krátké ose. Jestliže dochází k úplnému kontaktu mitrálního aparátu s IVS, pak v místě tohoto kontaktu můžeme někdy na endokardu septa nalézt fibrotické zesílení.
Morfologie méně časté midventrikulární obstrukce se kvantifikuje obtížněji a neexistuje pro ni žádná jednoduchá a klinická použitelná klasifikace. Ve většině případů se snažíme popsat, zda je obstrukce patrná již z 2D-echokardiografického vyšetření a které struktury se na ní podílejí.
U pacientů ve věku nad 60 let nacházíme zpravidla menší celkový rozsah hypertrofie LK, ovoidní tvar LK a zesílení stěn LK je lokalizováno obvykle pouze do oblasti bazálních segmentů IVS. Subvalvulární aparát není tak redundantní jako je tomu u mladších pacientů a rovněž dopředný pohyb mitrálního aparátu není tak výrazný. Úplný midsystolický kontakt předního cípu mitrální chlopně s IVS lze nalézt pouze výjimečně, stejně tak jako výraznější zaúhlení ve tvaru předního cípu mitrální chlopně se septálním směřováním distální poloviny předního cípu ve 2. polovině systoly. Pokud dochází k midventrikulárnímu kontaktu mezi předním cípem mitrální chlopně a IVS, pak se septa zpravidla nedotýká konec cípu, jako je tomu u mladších pacientů, ale přechod mezi jeho střední a distální třetinou. Pro tento typ obstrukce jsou obvyklé menší, doprovodné, centrálně směřující, mitrální regurgitace. Zásadní klinickou konsekvencí je rychlý a spolehlivý ústup obstrukce po provedení alkoholové septální ablace [20].
Výskyt obstrukce v dutině PK není častý a odhaduje se přibližně na 10 % z pacientů s HCM. Asi u poloviny z těchto pacientů je navíc přítomna obstrukce i v LK. Obstrukce v PK se nejčastěji nachází ve výtokovém traktu, ale může být umístěna i apikálně či midventrikulárně. Současně je obvykle je obvykle přítomna hypertrofie volné stěny PK [21].
Závěr
Ačkoliv má 2D-echokardiografie při stanovení diagnózy HCM řadu slabin, přesto se jedná o náš nejčastější diagnostický nástroj u tohoto onemocnění. Je pravděpodobné, že v blízké budoucnosti aspoň částečně přebere její význam vyšetření srdce pomocí magnetické rezonance doplněné zřejmě 3D-echokardiografickým vyšetřením.
Doručeno do redakce 13. 11. 05
Přijato k otištění po recenzi 15. 1. 06
doc. MUDr. Josef Veselka, CSc., FESC, FSCAI
Kardiologická klinika 2. LF UK a FN v Motole, Praha
Sources
1.Spirito P, Bellone P, Harris KM et al. Magnitude of left ventricular hypertrophy predicts the risk of sudden death in hypertrophic cardiomyopathy. N Engl J Med 2000; 342 : 1778-1785.
2.Elliot PM. Relation between severity of left ventricular hypertrophy and prognosis in patients with hypertrophic cardiomyopathy. Lancet 2001; 357 : 420-424.
3.Dimitrow PP, Dubiel JS. Echocardiographic risk factors predisposing to sudden cardiac death in hypertrophic cardiomyopathy. Heart 2005; 91 : 93-94.
4.Charron P, Dubourg O, Desnos M et al. Diagnostic value of electrocardiography and echocardiography for familial hypertrophic cardiomyopathy in a genotyped adult population. Circulation 1997; 96 : 214-219.
5.Forissier JF, Charron P, Tezenas du Montcel T et al. Diagnostic accuracy of a 2D left ventricle hypertrophy score for familial hypertrophic cardiomyopathy. Eur Heart J 2005; 26 : 1882-1826.
6.Maron MS, Zenovich A, Casey SA et al. Significance and relation between magnitude of left ventricular hypertrophy and heart failure symptoms in hypertrophic cardiomyopathy. Am J Cardiol 2005; 95 : 1329-1233.
7.Gregor P, Veselka J. Hypertrofická kardiomyopatie. In: Aschermann M (ed). Kardiologie. Praha: Galén 2004.
8.Frans EE, Nanda NC, Patel V et al. Live three-dimensional transthoracic contrast echocardiographic assessment of apical hypertrophic cardiomyopathy. Echocardiography 2005; 22 : 686-689.
9.Eriksson MJ, Sonneberg B, Woo A et al. Long-term outcome in patients with apical hypertrophic cardiomyopathy. J Am Coll Cardiol 2002; 39 : 638-645.
10.Matsubara K, Nakamura T, Kuribayashi T et al. Sustained cavity obliteration and apical aneurysm formation in apical hypertrophic cardiomyopathy. J Am Coll Cardiol 2003; 42 : 288-95.
11.Wigle ED, Sasson Z, Henderson MA et al. Hypertrophic cardiomyopathy. The importace of the site and the extent of hypertrophy: a review. Prog Cardiovasc Dis 1985; 28 : 1-83.
12.Thaman R, Gimeno JR, Murphy RT et al. Prevalence and clinical significance of systolic impairment in hypertrophic cardiomyopathy. Heart 2005; 91 : 920-925.
13.Dalldorf FG, Willis PW IV. Angled aorta („sigmoid septum“) as a cause of hypertrophic subaortic stenosis. Hum Pathol 1985; 16 : 457-462.
14.Lever HM, Karam RF, Currie PJ, Healy P. Hypertrophic cardiomyopathy in the elderly. Distinctions from the young based on cardiac shape. Circulation 1989; 79 : 580-589.
15.Okeie K, Shimizu M, Yoshio H et al. Left ventricular systolic dysfunction dutiny exercise and dobutamine stress in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 2000; 36 : 856-863.
16.Okawa M, Kitaoka H, Matsumura Y et al. Functional assessment by myocardial performance index (Tei index) correlates with plasma brain natriuretic peptide concentration in patients with hypertrophic cardiomyopathy. Circ J 2005; 69 : 951-957.
17.Veselka J, Procházková Š, Duchoňová R et al. Effects of alcohol septal ablation for hypertrophic obstructive cardiomyopathy on Doppler Tei index: a midterm follow-up. Echocardiography 2005; 22 : 105-110.
18.Rakowski H, Fulop J, Wigle ED. The role of echocardiography in the assessment of hypertrophic cardiomyopathy. Postgrad Med J 1986; 62 : 557-561.
19.Klues HG, Roberts WC, Maron BJ. Morphologic determinants of echocardiographic patterns of mitral systolic anterior motion in obstructive hypertrophic cardiomyopathy. Circulation 1993; 87 : 1570-1579.
20.Veselka J, Duchoňová R, Procházková Š et al. Alcohol septal ablation for obstructive hypertrophic cardiomyopathy: slower hemodynamic improvement and septum thickness reduction in younger patiens. Am J Cardiol 2005; 95(Suppl A): 67-68.
21.Shimizu M, Hawai K, Kokota Y, Yokoyama M. Echocardiographic assessment of right ventricular obstruction in hypertrophic cardiomyopathy. Circ J 2003; 67 : 855-860.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2006 Issue 1-2-
All articles in this issue
- Buněčná léčba v kardiologii: přehled aktuálních dat za rok 2005
- Náhlá srdeční smrt: jak jí předcházet
- Skupiny nemocných s akutním infarktem myokardu se zvýšeným rizikem nebo vyžadující specifický léčebný a diagnostický přístup
- Akutní infarkt myokardu u mladých pacientů: etiologie , rizikové faktory, genetika
- Domácí měření krevního tlaku
- Hypertenze u dětí a adolescentů
- Nefarmakologická léčba arteriální hypertenze
- Zánětlivé a virové kardiomyopatie
- Význam dvourozměrné (2D) echokardiografie v diagnostice hypertrofické kardiomyopatie
- Diagnostické možnosti u postižení periferních tepen.
- Akutní aortální regurgitace v podmínkách Nigerie: kazuistika
- Čtyřcípá aortální chlopeň – vzácný echokardiografický nález: kazuistika
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypertenze u dětí a adolescentů
- Diagnostické možnosti u postižení periferních tepen.
- Náhlá srdeční smrt: jak jí předcházet
- Nefarmakologická léčba arteriální hypertenze
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

