-
Medical journals
- Career
Význam mikroRNA v patofyziologii aterosklerózy a jejich možné klinické využití
Authors: Jan Novák 1,2; Miroslav Souček 1
Authors‘ workplace: II. interní klinika LF MU a FN U sv. Anny v Brně 1; Fyziologický ústav LF MU, Brno 2
Published in: AtheroRev 2016; 1(3): 144-150
Category: Reviews
Overview
Ateroskleróza a její klinické manifestace (např. infarkt myokardu, či cévní mozková příhoda) v rozvinutých zemích stále představují vedoucí příčinu úmrtí. Během posledních dekád se naše znalosti o vzniku aterosklerózy výrazně posunuly kupředu: byly popsány klíčové molekuly a signální kaskády, které se tohoto komplexního procesu účastní, a to umožnilo vývoj efektivních terapeutických postupů, které dokážou zmírnit dopady aterosklerózy na zdraví jedince. Objev nekódujících RNA (ncRNA), které se podílejí na regulaci genové exprese a účastní se takřka všech procesů v našem těle, přináší další úroveň komplexnosti, nabízí nový náhled na regulaci jednotlivých procesů a v neposlední řadě i nové postupy využitelné v diagnostice či v terapii aterosklerózy. Tento přehledný referát předkládá základní informace o funkci mikroRNA, jedné ze skupin ncRNA, a následně se zaměřuje na jejich zapojení do patogeneze aterosklerózy. V poslední části textu podává přehled možného využití cirkulujících mikroRNA v diagnostice aterosklerózy a na výsledcích animálních a pilotních humánních studií demonstruje i možný terapeutický potenciál, který se v těchto malých molekulách skrývá.
Klíčová slova:
cirkulující mikroRNA – diagnostika aterosklerózy – ncRNA – terapie aterosklerózyÚvod – ateroskleróza jako komplexní proces
Ateroskleróza představuje chronické komplexní onemocnění, během kterého dochází k ukládání lipidů do cévní stěny, jejímu chronickému zánětu a přestavbě, čímž dochází k změnám v krevním toku, ischemii tkání a orgánů a v případě akutního uzávěru cévy pak k urgentním stavům, které bezprostředně ohrožují život pacienta [1,2]. Klíčový význam v rozvoji aterosklerózy má cholesterol, který je v cirkulaci pro svou lipofilní povahu přenášen v lipoproteinových částicích. Odsun cholesterolu z periferních tkání do jater zajišťují lipoproteiny o vysoké hustotě (high density lipoproteins – HDL), dodávku do periferie pak lipoproteiny o nízké hustotě (low density lipoproteins – LDL) [1,2]. Oba procesy jsou za normálních okolností v rovnováze. Dojde-li ovšem k narušení cholesterolové homeostázy ve prospěch akumulace cholesterolu v periferních tkáních (např. cévách), je podpořen proces aterosklerózy. Laboratorně pozorujeme zvýšení hladin LDL-cholesterolu (LDL-C), či snížení hladin HDL-cholesterolu (HDL-C).
Narušení cholesterolové homeostázy pak spolu s lokálními změnami toku krve představují první kroky několikastupňového procesu vzniku aterosklerotického plátu. V místech změněného toku (zejména v bifurkacích) dochází k endotelové dysfunkci, endotel je více propustný a jeho buňky začínají vystavovat receptory, které usnadňují přestup bílých krvinek do cévní stěny a je aktivována signální kaskáda nukleárního faktoru kappa B (NFκB) [1–3]. Postupně vznikající zánět vede k alteraci v hladinách cytokinů, další změny toku se pak odrážejí na změně genové exprese nejen v endotelových, ale následně i hladkosvalových buňkách cévní stěny [4]. Hladkosvalové buňky přecházejí ze svého klidového kontraktilního fenopytu (nezbytného pro normální funkci cévy) do fenotypu proliferačního, dochází k remodelaci cévní stěny a dalšímu zrání aterosklerotických plátů [5].
mikroRNA (miRNA, miR), molekuly jež představí další odstavec, jsou zapojeny do všech výše zmíněných procesů. Dle osnovy nadnesené v tomto úvodu bude o zapojení vybraných miRNA do procesu aterosklerózy pojednáno v dalších odstavcích.
Nekódující RNA, mikroRNA a jejich funkce
Jedním z dlouho platných principů molekulární biologie je předpoklad, že deoxyribonukleová kyselina (deoxyribonucleic acid – DNA) slouží jako matrice pro vznik přenašečové ribonukleové kyseliny (messenger ribonucleic acid – RNA) a struktura mRNA je klíčem pro vznik bílkovin. mRNA jsou proto označovány jako kódující RNA, neboť ve své struktuře kódují strukturu bílkovin, které v buňkách plní řadu strukturálních a výkonných funkcí. Aby výše uvedený proces mohl úspěšně probíhat, je zapotřebí řada již desítky let známých nekódujících RNA – z nich uveďme např. ribosomální RNA (rRNA) nebo transferovou RNA (tRNA), které jsou nezbytné pro vznik ribosomů nebo pro přenos aminokyselin v průběhu proteosyntézy, ale žádné proteiny přitom nekódují [6].
Studie z posledních let využívající moderní molekulárně-biologické metody, které umožňují studium celého genomu a transkriptomu, tj. obsahu všech přepisovaných (transkribovaných) RNA v buňce, však ukazují, že zhruba dvě třetiny genomu jsou aktivně přepisovány a proteiny-kódující RNA přitom představují pouze cca 2 % z toho množství [7,8]. Zbývající molekuly RNA jsou označovány jako nekódující RNA (non-coding RNA – ncRNA) a dle jejich délky jsou rozdělovány na dvě základní skupiny – dlouhé nekódující RNA (long noncoding RNA – lncRNA) a malé nekódující RNA (small noncoding RNAs – sncRNA). sncRNA se obecně účastní regulace genové exprese a dle jejich specifických funkcí se poté dělí do celé řady podskupin (obr. 1A) [6,9].
Obr. 1A-D. Základní údaje o mikroRNA A: Základní dogma molekulární biologie vychází z modelu genové exprese probíhající od DNA k RNA do proteinu (střední část obrázku). Kromě RNA, které kódují proteiny, existuje i celá skupina nekódujících RNA, které se zapojují do regulace genové exprese na různých úrovních. Tyto RNA nekódují žádné proteiny a dle délky (hranicí bývá uváděna délka 200 nukleotidů) je dělíme na dlouhé nekódující RNA (lncRNA) a malé nekódující RNA (sncRNA). Jednotlivé skupiny sncRNA se dále dělí dle funkce, obrázek uvádí současně známé skupiny sncRNA. B: mikroRNA zajišťují negativní posttranskripční regulaci genové exprese. Nejprve se naváží na doprovodné argonautové proteiny (nejčastěji Ago-2), čímž vytvoří tzv. miRNA-indukovaný tlumící komplex (miRNA induced silencing complex – miRISC). miRISC se poté váže na cílovou mRNA dle pravidel komplementarity (jednotlivé nukleotidové báze mezi miRNA a mRNA se spojují) a tato vazba buď vyvolá degradaci cílové mRNA nebo zablokuje tuto mRNA pro translaci do bílkovin. V obou případech dojde ke snížení hladin bílkoviny, kterou daná mRNA kóduje. C: Komplexnost regulace pomocí mikroRNA je dána jejich funkční abundancí – jedna miRNA často cílí na více mRNA a jedna molekula mRNA může být cílem řady různých miRNA. miR-33, nezbytná pro metabolizmus cholesterolu, mastných kyselin a glukózy cílí na více než 10 různých mRNA a jednou z nich je i mRNA kódující přenašečový protein ABCA1 (přenašeč zajišťující transport holesterolu z buněk do lipoproteinových částic o vysoké hustotě), který je zároveň cílem více než 10 dalších známých miRNA. D: Extracelulární (též cirkulující) mikroRNA nacházíme v extracelulárním prostoru (krvi, moči, potu, slinách, intersticiální tekutině apod). Do tohoto prostoru jsou aktivně secernovány nebo se do něj uvolňují vlivem nekrózy/apoptózy buněk. V extracelulárním prostoru jsou vysoce stabilní, což je zajištěno tím, že: • jsou v komplexu s RNA-vazebnými proteiny (např. argonautový protein Ago-2) • jsou uschovány do apoptotických tělísek • jsou uloženy v exosomech/membránových váčcích • jsou ukryty v jádře lipoproteinových částic o vysoké (HDL) a nízké (LDL) hustotě 
ABCA1 – ATP–binding cassette transporter A1 ABCG1 – ATP–binding cassette transporter G1 ABCB11 – ATP–binding cassette, sub-family B member 11 FASN – fatty acid synthase NFYH – nuclear transcription factor Y CPT1A – carnitine palmitoyltransferase 1A CROT – carnitine O-octaniltransferase AMPK – AMP–activated protein kinase GPC-6 – glucose-6-phosphatase PCK1 – phosphoenolpyruvate carboxykinase IRS-2 – insulin receptor substrate 2 mikroRNA (miRNA, miR) představují jednu ze skupin sncRNA – jedná se o krátké, přibližně 22 nukleotidů dlouhé úseky jednovláknové RNA, které negativně regulují genovou expresi na podkladě interference s cílovými mRNA, tj. těmi RNA, které kódují vznik bílkovin [10]. Dle všeobecně platného pravidla komplementarity (tj. že adenin se váže s uracilem a guanin se váže s cytosinem; A-U, C-G) se miRNA v komplexu s pomocnými proteiny vážou do specifických oblastí mRNA a svou vazbou vyvolají buď degradaci této mRNA, nebo zabrání překladu mRNA do bílkoviny – oba popisované mechanizmy způsobí, že proces genové exprese je zpomalen/zastaven a dojde ke snížení hladin bílkoviny, kterou cílová mRNA kódovala (obr. 1B).
Regulace pomocí miRNA je vysoce komplexní – jedna miRNA často cílí na více různých mRNA (mnohdy zapojených do jedné metabolické či signální kaskády) a jedna mRNA může být cílem pro více různých miRNA (obr. 1C), jako příklad vybrána miR-33 a přenašečový protein ABCA1 (ATP-binding cassette transporter A1), o jejichž významu bude pojednáno dále [11]. miRNA tímto způsobem působí jako citlivé regulátory genové exprese a narušení jejich hladin, popisované u řady onemocnění včetně aterosklerózy, má pak širokosáhlé dopady na řadu buněčných procesů. Může např. vyústit v urychlení proliferace (množení) či diferenciace (vyzrávání) buněk, může zcela změnit buněčný fenotyp, či může snížit expresi vybraných receptorů na povrchu buněk; v kontextu aterosklerózy se zmíněné procesy uplatní např. při vzniku aterosklerotického plátu, v remodelaci cévní stěny či regulaci metabolizmu lipoproteinů [11].
Posledním důležitým aspektem týkajícím se funkce miRNA je skutečnost, že miRNA nejsou limitovány ve své působnosti pouze na buňky, v nichž vznikají – buňky jsou schopny miRNA aktivně uvolňovat (ať již do malých membránových váčků, např. exosomů, nebo do pro aterosklerózu tak nezbytných lipoproteinových částic; obr. 1D) a předávat si je tak mezi sebou ve smyslu parakrinní či endokrinní komunikace [12]. miRNA vzniklá v játrech či v bílé krvince se tak např. může dostat do endotelových buněk, ovlivnit jejich genovou expresi, a tím urychlit či zpomalit proces aterosklerózy.
Pro možné klinické využití miRNA jsou pak důležitá zejména následující dvě fakta:
- hladiny miRNA jsme schopni ovlivnit s využitím uměle syntetizovaných molekul, což přináší nové terapeutické možnosti [13]
- miRNA vyskytující se v extracelulárním prostoru (krvi, plazmě, moči, slinách…) je možné vyizolovat a stanovit jejich hladiny (které se mění v přítomnosti nemoci, nebo při odpovědi na léčbu), což přináší nové diagnostické možnosti [12]
mikroRNA v patofyziologii aterosklerózy
mikroRNA a metabolizmus cholesterolu a lipoproteinů
SREBPs (sterol regulatory element binding proteins) představují již řadu let známé transkripční faktory, které přímo aktivují/inhibují expresi různých enzymů a signálních molekul zapojených do lipidového metabolizmu [14]. Při syntéze SREBPs vznikají i dvě miRNA, konkrétně miR-33a a miR-33b [15], které jsou uloženy v intronech genů pro SREBPs a podobně jako SREBPs i tyto dvě miRNA cílí na mRNA, které jsou přímo zapojeny do efluxu cholesterolu z jater/periferních tkání do nascentních HDL (např. transportér ABCA1 [15]), nebo které jsou důležité pro exkreci cholesterolu z jater do žluči (např. transportér ABCB11 [16]) a stejně tak cílí na řadu enzymů zapojených do syntézy mastných kyselin (např. CROT, FASN a další cíle), obr. 1C [11,15]. Byla již provedena řada studií na myších [17] i primátech [18], které ukazují, že blokádou miR-33 je možné zvýšit hladiny cirkulujícího HDL o 40–50%, aniž by HDL ztratilo své protizánětlivé vlastnosti a zároveň dochází ke zmenšení aterosklerotických plátů u pokusných zvířat [17,18]. Tyto efekty jsou pravděpodobně dány zvýšením exprese ABCA1 (a tím zvýšenou tvorbou HDL a vyšším „odsunem“ cholesterolu z periferie do jater), zvýšením exprese ABCB11 (a tím zvýšenou exkrecí cholesterolu do žluči) a v neposlední řadě recentní studie ukazují i na vliv blokády miR-33 na chování makrofágů a regulačních T-lymfocytů, které mají vlivem blokády miR-33 ateroprotektivní vlastnosti [19].
Kromě miR-33, která nepochybně představuje jeden z důležitých posttrankripčních uzlů regulujících metabolizmus cholesterolu, existují i další podobné miRNA; např. miR-27a přímo reguluje expresi transkripčních faktorů SREBP (a tím nepřímo miR-33 a všech jejích cílů) [20], je zapojena do syntézy apolipoproteinu B100 (apoB100) a má více než 9 dalších cílů přímo zapojených do metabolizmu cholesterolu [21]. Další miRNA (miR-223) tlumí expresi klíčového enzymu cholesterolové syntézy hydroxymethylglutaryl–koenzymA syntetázy a dále přímo snižuje hladiny scavangerového receptoru typu 1 třídy B (SRB1), který je nezbytný pro vychytávání HDL-částic [22]. miR-30c reguluje expresi genu MTTP (microsomal triglyceride transfer protein), jež je nezbytný pro loading lipidů do nascentního apoB, a tak i pro vznik částic o velmi nízké hustotě (very low density lipoproteins – VLDL) [23]. Recentní studie pak ukazují na význam miR-148a, která snižuje hladiny receptoru pro LDL (LDLR) a její blokáda pomocí specifických antagonistů způsobuje zvýšení clearance LDL v játrech [24].
Poslední zajímavostí, kterou v kontextu metabolizmu lipoproteinů a miRNA uvádíme, je i fakt, že zmiňovaná miR-223 je jednou z miRNA, které působí i mimo místo svého vzniku v jaterních buňkách – je také uschována v lipoproteinových částicích HDL (v LDL-frakci jsou její hladiny mnohem nižší) a z HDL dochází k jejímu transportu do endotelových buněk (ve kterých se tato miRNA za fyziologických okolností vůbec nevyskytuje) [25]. V endotelových buňkách pak miR-223 přímo snižuje expresi intracelulární adhezivní molekuly typu 1 (intracellular adhesion molecule 1 – ICAM-1), receptoru, který zajišťuje vazbu bílých krvinek na endotel a jejich přestup do cévní stěny – transfer miR-223 mezi HDL a endotelovými buňkami tak částečně vysvětluje dlouho známé anti-aterogenní působení HDL-molekul [25].
mikroRNA ovlivňující vznik a progresi aterosklerózy
Kromě miR-223 předávané do endotelových buněk z HDL regulují expresi ICAM-1, či E-selektinů miR-222, nebo miR-31 [26,27]. Pro endotelové buňky vysoce specifická miR-126 zase cílí na cévní adhezní molekulu (vascular cell adhesion molecule 1 – VCAM1) [28]. Terapeutické ovlivnění těchto miRNA by v budoucnu mohlo zabránit diapedéze leukocytů do cévní stěny, a tím utlumit aterosklerózu v jednom z jejích klíčových prvních kroků.
Jiné miRNA se podílejí na regulaci endoteliální zánětlivé odpovědi – v této hraje klíčovou roli signální dráha NFκB a např. miR-146a nebo miR-181b jsou jejími přímými inhibitory [29,30]. Intravenózní podání miR-181b pokusným zvířatům dokonce tlumí endoteliální zánětlivou odpověď a zmenšuje aterosklerotické léze, a tento efekt přitom není odvislý od změn v lipidovém spektru pokusných zvířat [29].
Krom zánětu se na rozvoji a progresi aterosklerózy dále podílejí změny v toku krve – v predilekčních místech cévního řečiště (bifurkace, zúžení) či na místech již vzniklých aterosklerotických plátů se laminární proudění (l-flow) mění v proudění turbulentní (tzv. d-flow, z angl. disturbed flow) [2]. Hladiny výše zmíněné miR-126 (konkrétně její varianty miR-126–5p) se vlivem d-flow snižují, čímž endotel přichází o její ateroprotektivní vlastnosti; podobně i artificiálně navozená blokáda této miRNA u pokusných zvířat, u nichž byly uměle navozeny endotelové léze, způsobila, že se tyto léze mnohem hůře hojily [31]. Hladiny celé řada dalších miRNA (např. miR-92a, miR-155, miR-663 a další) jsou tzv. „flow-dependentní“, tj. mění se s kvalitou proudění krve [4]. Krevní tok však neovlivňuje jen expresi miRNA v buňkách, ale ovlivňuje i obsah extracelulárních membránových váčků, které buňky produkují – laminární proudění způsobuje, že je již zmíněná miR-126 ve větší míře transportována z endotelových buněk do membránových váčků, které se tak dostávají do hladkosvalových buněk cévní stěny a udržují jejich kontraktilní fenotyp [31]. Podobně laminární proudění vede k uvolnění miR-143 a miR-145 do extracelulárních váčků, což má rovněž ateroprotektivní vlastnosti [32] – u myší deficientních pro miR-143/145 je kontraktilní funkce hladkosvalových buněk narušena, pokusná zvířata mají nižší tlak než kontrolní skupina a mnohem méně reagují na podání vazopresorů [33]. Navození zvýšené exprese miR-145 pomocí lentivirového vektoru naopak vede k zmenšení aterosklerotických lézí a k četným změnám jejich kvality – hromadí se v nich méně makrofágů, pláty mají menší nekrotické jádro a pevnější fibrinovou čepičku (a obecně vyšší obsah kolagenu) než pláty kontrolní skupiny [34].
Využití mikroRNA v diagnostice aterosklerózy a jejích komplikací
Cirkulující miRNA, tedy miRNA nacházející se v extracelulárním prostoru – plné krvi, plazmě, séru, ale i moči, slinách, potu, či mateřském mléce – byly poprvé popsány v roce 2008 [35]. Některé z těchto miRNA jsou do extracelulárního prostoru aktivně uvolňovány (jak bylo popsáno výše např. pro miR-126, miR-143/145, či miR-223), jiné se do oběhu dostávají např. při nekróze buněk (např. miR-499 při infarktu myokardu [36]). S ohledem na skutečnost, že některé miRNA vykazují tzv. tkáňovou/orgánovou specificitu (tj. jejich exprese v dané tkáni je 20krát vyšší než exprese v ostatních tkáních [37]), je pak možné vybrané miRNA teoreticky využít jako biomarkery poškození různých orgánů [38]. Možné využití miRNA jako diagnostických či prognostických markerů aterosklerózy a s aterosklerózou asociovaných nemocí ukazuje obr. 2 [2,39–41].
Image 1. mikroRNA jako biomarkery aterosklerózy Cirkulující mikroRNA je možné využít k diagnostice aterosklerózy a jejích manifestací – ať již cévní mozkové příhody, ischemické choroby srdeční, infarktu myokardu, či ischemické choroby dolních končetin. Na obrázku jsou uvedeny jen vybrané mikroRNA, jejich plný výčet není z kapacitních důvodů možný. Je patrné, že některé miRNA jsou u všech podob aterosklerózy alterovány vždy – tyto pak pravděpodobně odrážejí přítomnost aterosklerózy jako takové. Jiné miRNA, např. miR-499, se v krvi běžně nevyskytují a dostávají se do ní až při nekróze buněk. Protože hladiny miRNA se mění vlivem medikace a různých komorbidit či rizikových faktorů (např. vlivem kouření), identifikace těch nejvíce specifických i senzitivních miRNA, které budou odrážet pouze přítomnost konkrétní nemoci a nic jiného, zůstává výzvou pro další výzkumníky v této oblasti. 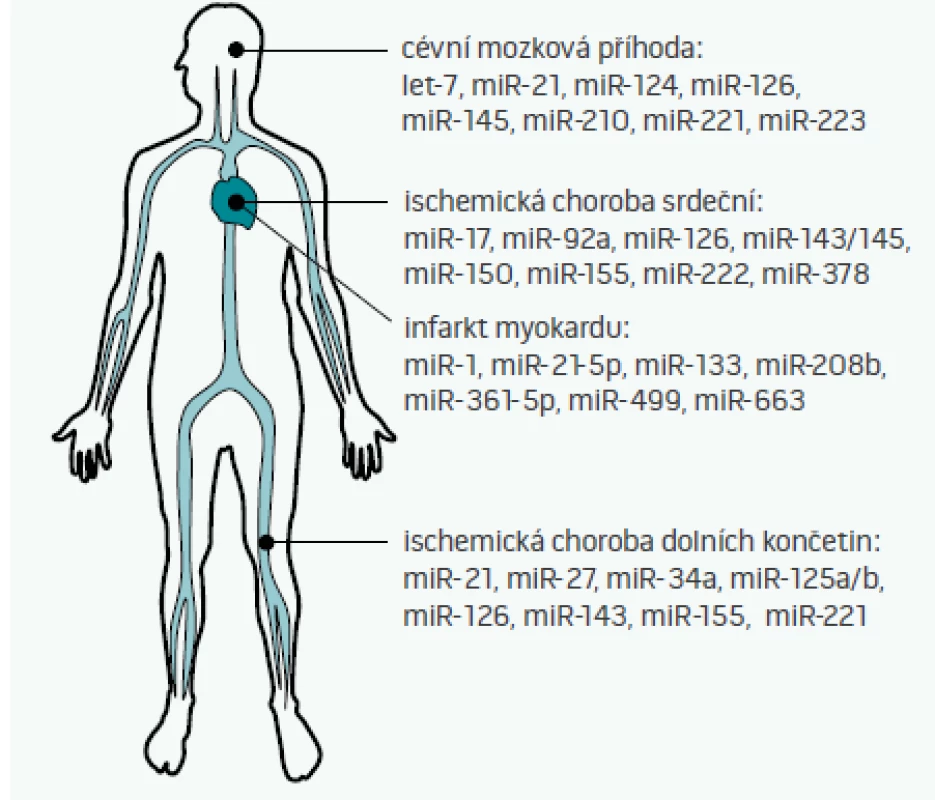
Studie věnující se diagnostice nemocí pomocí miRNA jsou nyní ve svých začátcích – většina studií je nyní limitována svým rozsahem (zejména malou velikostí vzorku), ale také volbou kontrolní vzorku (často jako kontrolní skupina vystupují zdraví jedinci, nikoliv pacienti s podobnými klinickými obtížemi). Velkým problémem pro porovnávání jednotlivých studií je i nedostatečná standardizace postupů mezi jednotlivými laboratořemi, problém ve stanovení hladin miRNA může nastat i v případě, že byl pacient před odběrem vzorků zaléčen heparinem, který inhibuje polymerázovou řetězovou reakci (PCR), která se využívá při stanovení hladin miRNA. Další nevýhodou stanovení miRNA oproti běžně užívaným biomarkerům je v současnosti i rychlost stanovení (trvají většinou několik hodin oproti desítkám minut u běžně užívaných biomarkerů). Zda se miRNA jako diagnostické markery v budoucnu uplatní, se tedy bude odvíjet od toho, zda budou tyto technické překážky odstraněny a zda nové miRNA-biomarkery přinesou nové informace (např. o pacientově prognóze), které současné biomarkery neposkytují [39].
Využití mikroRNA v terapii aterosklerózy?
Principy terapeutického ovlivnění miRNA jsou v podstatě dvojí: je-li některá z miRNA vlivem nemoci snížena, je naším cílem její hladiny substituovat (navýšit); jsou-li hladiny některé miRNA naopak zvýšeny, je cílem tyto hladiny snížit, ev. danou miRNA vyblokovat [13]. V animálních studiích jsou s výhodou využívány oba postupy, což nám blíže umožňuje pochopit význam jednotlivých miRNA u různých nemocí – příklady takového ovlivnění byly uvedeny výše např. pro miR-33, či miR-181a, jejichž modulace vedla k útlumu tvorby aterosklerotických plátů a regresi aterosklerózy. Na lidských subjektech jsme se zatím setkali v kontextu aterosklerózy a nekódujících RNA se dvěma léčivy – miravirsenem [42]a mipomersenem [43]. Miravirsen je oligonukleotid namířený přímo proti miR-122, což je jaterně specifická miRNA která udržuje expresi řady jaterně specifických genů. Zároveň je však nezbytná pro efektivní replikaci viru hepatitidy C a její blokádou pomocí miravirsenu se podařilo snížit virovou nálož u infikovaných osob a u části z nich nebyla virová RNA vůbec identifikovatelná; jako vedlejší výstup této studie bylo pozorováno snížení hladin cholesterolu u pokusných osob [42]. Mipomersen je pak oligonukleotid přímo namířený proti apoB (nejedná se tedy o přímou blokádu některé z miRNA, ale o využití jejich mechanizmu účinku), který snižuje hladiny LDL a dle recentních dat i výskyt kardiovaskulárních příhod u pacientů s familiární hypercholesterolemií [43].
Závěr
Nekódující RNA představují velice rozsáhlou skupinu molekul, jejichž pravý význam začínáme v posledních dvou až třech desetiletích postupně odkrývat. miRNA díky své všudypřítomnosti a velkému množství intra - i extracelulárních funkcí patří k jedné z nejatraktivnějších podskupin malých nekódujících RNA, které by v budoucnu mohly sloužit jako univerzální diagnostické sérové markery pro řadu různých nemocí, včetně aterosklerózy a jejích komplikací, ale také jako nové léčebné prostředky. Nelze očekávat, že během pár let miRNA nahradí běžně užívané markery (jako např. troponiny), nebo že v lékárnách najdeme infuze s miRNA-inhibitory, které okamžitě zvrátí počínající aterosklerózu nebo normalizují hladiny cholesterolu. Je také možné, že miRNA přestavují pouze „slepou větev“ výzkumu a za několik let, či desetiletí se objeví nové atraktivnější a bezpečnější molekuly. V současné době však miRNA představují nepochybně zajímavou skupinu molekul, která si zaslouží další zkoumání, a až další výzkum pak odhalí, jaký je jejich pravý klinický potenciál.
Práce vznikla v rámci projektu „Kardiovaskulární systém: od modelu přes terapii k prevenci“(MUNI/A/1365/2015) z prostředků na specifickývysokoškolský výzkum, kterou poskytlo MŠMT ČR v roce 2016.
MUDr. Jan Novák
jan.novak@fnusa.cz
II. interní klinika LF MU a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 12. 9. 2016
Přijato po recenzi 26. 9. 2016
Sources
1. Hansson GK, Libby P, Tabas I. Inflammation and plaque vulnerability. J Intern Med 2015; 278(5): 483–493. Dostupné z DOI: <http://dx.doi.org/10.1111/joim.12406>.
2. Feinberg MW, Moore KJ. MicroRNA Regulation of Atherosclerosis. Circ Res 2016; 118(4): 703–720. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.115.306300>.
3. Sun X, Sit A, Feinberg MW. Role of miR-181 family in regulating vascular inflammation and immunity. Trends Cardiovasc Med 2014; 24(3): 105–112. Dostupné z DOI: <http://dx.doi.org/10.1016/j.tcm.2013.09.002>.
4. Kumar S, Kim CW, Simmons RD et al. Role of flow-sensitive microRNAs in endothelial dysfunction and atherosclerosis: mechanosensitive athero-miRs. Arterioscler Thromb Vasc Biol 2014; 34(10): 2206–2216. Dostupné z DOI: <http://dx.doi.org/10.1161/ATVBAHA.114.303425>.
5. Davis-Dusenbery BN, Chan MC, Reno KE et al. down-regulation of Kruppel-like factor-4 (KLF4) by microRNA-143/145 is critical for modulation of vascular smooth muscle cell phenotype by transforming growth factor-beta and bone morphogenetic protein 4. J Biol Chem 2011; 286(32): 28097–28110. Dostupné z DOI: <http://dx.doi.org/10.1074/jbc.M111.236950>.
6. Taft RJ, Pang KC, Mercer TR et al. Non-coding RNAs: regulators of disease. J Pathol 2010; 220(2): 126–139. Dostupné z DOI: <http://dx.doi.org/10.1002/path.2638>.
7. Mattick JS. Non-coding RNAs: the architects of eukaryotic complexity. EMBO Rep 2001; 2(11): 986–991.
8. Djebali S, Davis CA, Merkel A et al. Landscape of transcription in human cells. Nature 2012; 489(7414): 101–108. Dostupné z DOI: <http://dx.doi.org/10.1038/nature11233>.
9. Hombach S, Kretz M. Non-coding RNAs: Classification, Biology and Functioning. Adv Exp Med Biol 2016; 937 : 3–17. Dostupné z DOI: <http://dx.doi.org/10.1007/978–3-319–42059–2_1>.
10. Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell 2004; 116(2): 281–297.
11. Novák J, Olejníčková V, Tkáčová N et al. Mechanistic Role of MicroRNAs in Coupling Lipid Metabolism and Atherosclerosis. Adv Exp Med Biol 2015; 887 : 79–100. Dostupné z DOI: <http://dx.doi.org10.1007/978–3-319–22380–3_5>. Erratum in Adv Exp Med Biol 2015; 888: E1-E2.
12. Creemers EE, Tijsen AJ, Pinto YM. Circulating MicroRNAs Novel Biomarkers and Extracellular Communicators in Cardiovascular Disease? Circ Res 2012; 110(3): 483–495. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.111.247452>.
13. van Rooij E, Olson EN. MicroRNA therapeutics for cardiovascular disease: opportunities and obstacles. Nat Rev Drug Discov 2012; 11(11): 860–872. Dostupné z DOI: <http://dx.doi.org/10.1038/nrd3864>.
14. Eberlé D, Hegarty B, Bossard P et al. SREBP transcription factors: master regulators of lipid homeostasis. Biochimie 2004; 86(11): 839–848.
15. Najafi-Shoushtari SH, Kristo F, Li Y et al. MicroRNA-33 and the SREBP host genes cooperate to control cholesterol homeostasis. Science 2010; 328(5985): 1566–1569. Dostupné z DOI: <http://dx.doi.org/10.1126/science.1189123>.
16. Allen RM, Marquart TJ, Albert CJ, et al. miR-33 controls the expression of biliary transporters, and mediates statin - and diet-induced hepatotoxicity. EMBO Mol Med 2012; 4(9): 882–895. Dostupné z DOI: <http://dx.doi.org/10.1002/emmm.201201228>.
17. Rayner KJ, Sheedy FJ, Esau CC et al. Antagonism of miR-33 in mice promotes reverse cholesterol transport and regression of atherosclerosis. J Clin Invest 2011; 121(7): 2921–2931. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI57275>.
18. Rayner KJ, Esau CC, Hussain FN et al. Inhibition of miR-33a/b in non-human primates raises plasma HDL and lowers VLDL triglycerides. Nature 2011; 478(7369): 404–407. Dostupné z DOI: <http://dx.doi.org/10.1038/nature10486>.
19. Ouimet M, Ediriweera HN, Gundra UM et al. MicroRNA-33-dependent regulation of macrophage metabolism directs immune cell polarization in atherosclerosis. J Clin Invest 2015; 125(12): 4334–4348. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI81676>.
20. Shirasaki T, Honda M, Shimakami T et al. MicroRNA-27a regulates lipid metabolism and inhibits hepatitis C virus replication in human hepatoma cells. J Virol 2013; 87(9): 5270–5286. Dostupné z DOI: <http://dx.doi.org/10.1128/JVI.03022–12>.
21. Vickers KC, Shoucri BM, Levin MG et al. MicroRNA-27b is a regulatory hub in lipid metabolism and is altered in dyslipidemia. Hepatol Baltim Md 2013; 57(2): 533–542. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.25846>.
22. Vickers KC, Landstreet SR, Levin MG et al. MicroRNA-223 coordinates cholesterol homeostasis. Proc Natl Acad Sci U S A 2014; 111(40): 14518–14523. Dostupné z DOI: <http://dx.doi.org/10.1073/pnas.1215767111>.
23. Soh J, Iqbal J, Queiroz J et al. MicroRNA-30c reduces hyperlipidemia and atherosclerosis in mice by decreasing lipid synthesis and lipoprotein secretion. Nat Med 2013; 19(7): 892–900. Dostupné z DOI: <http://dx.doi.org/10.1038/nm.3200>.
24. Goedeke L, Rotllan N, Canfrán-Duque A et al. MicroRNA-148a regulates LDL receptor and ABCA1 expression to control circulating lipoprotein levels. Nat Med 2015; 21(11): 1280–1289. Dostupné z DOI: <http://dx.doi.org/10.1038/nm.3949>.
25. Tabet F, Vickers KC, Cuesta Torres LF et al. HDL-transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nat Commun 2014; 5 : 3292. Dostupné z DOI: <http://dx.doi.org/10.1038/ncomms4292>.
26. Suárez Y, Wang C, Manes TD et al. Cutting edge: TNF-induced microRNAs regulate TNF-induced expression of E-selectin and intercellular adhesion molecule-1 on human endothelial cells: feedback control of inflammation. J Immunol 2010; 184(1): 21–25. Dostupné z DOI: <http://dx.doi.org/10.4049/jimmunol.0902369>.
27. Jansen F, Yang X, Baumann K et al. Endothelial microparticles reduce ICAM-1 expression in a microRNA-222-dependent mechanism. J Cell Mol Med 2015; 19(9): 2202–2214. Dostupné z DOI: <http://dx.doi.org/10.1111/jcmm.12607>.
28. Harris TA, Yamakuchi M, Ferlito M et al. MicroRNA-126 regulates endothelial expression of vascular cell adhesion molecule 1. Proc Natl Acad Sci U S A 2008; 105(5): 1516–1521. Dostupné z DOI: <http://dx.doi.org/10.1073/pnas.0707493105>.
29. Sun X, He S, Wara AKM et al. Systemic delivery of microRNA-181b inhibits nuclear factor-κB activation, vascular inflammation, and atherosclerosis in apolipoprotein E-deficient mice. Circ Res 2014; 114(1): 32–40. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.113.302089>.
30. Cheng HS, Sivachandran N, Lau A et al. MicroRNA-146 represses endothelial activation by inhibiting pro-inflammatory pathways. EMBO Mol Med 2013; 5(7): 1017–1034. Dostupné z DOI: <http://dx.doi.org/10.1002/emmm.201202318>.
31. Zhou J, Li Y-S, Nguyen P et al. Regulation of vascular smooth muscle cell turnover by endothelial cell-secreted microRNA-126: role of shear stress. Circ Res 2013; 113(1): 40–51. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.113.280883>.
32. Hergenreider E, Heydt S, Tréguer K et al. Atheroprotective communication between endothelial cells and smooth muscle cells through miRNAs. Nat Cell Biol 2012; 14(3): 249–256. Dostupné z DOI: <http://dx.doi.org/10.1038/ncb2441>.
33. Boettger T, Beetz N, Kostin S et al. Acquisition of the contractile phenotype by murine arterial smooth muscle cells depends on the Mir143/145 gene cluster. J Clin Invest 2009; 119(9): 2634–2647. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI38864>.
34. Lovren F, Pan Y, Quan A et al. MicroRNA-145 targeted therapy reduces atherosclerosis. Circulation 2012; 126(11 Suppl 1): S81–S90.
35. Chen X, Ba Y, Ma L et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res 2008; 18(10): 997–1006. Dostupné z DOI: <http://dx.doi.org/10.1038/cr.2008.282>.
36. Xin Y, Yang C, Han Z. Circulating miR-499 as a potential biomarker for acute myocardial infarction. Ann Transl Med 2016; 4(7): 135. Dostupné z DOI: <http://dx.doi.org/10.21037/atm.2016.03.40>.
37. Lee EJ, Baek M, Gusev Y et al. Systematic evaluation of microRNA processing patterns in tissues, cell lines, and tumors. RNA 2008; 14(1): 35–42.
38. Heggermont WA, Heymans S. MicroRNAs Are Involved in End-Organ Damage During Hypertension. Hypertension 2012; 60(5): 1088–1093. Dostupné z DOI: <http://dx.doi.org/10.1161/HYPERTENSIONAHA.111.187104>.
39. Navickas R, Gal D, Laucevičius A et al. Identifying circulating microRNAs as biomarkers of cardiovascular disease: a systematic review. Cardiovasc Res 2016; 111(4): 322–337. Dostupné z DOI: <http://dx.doi.org/10.1093/cvr/cvw174>.
40. Zhang J-Y, Gong Y-L, Li C-J et al. Circulating MiRNA biomarkers serve as a fingerprint for diabetic atherosclerosis. Am J Transl Res 2016; 8(6): 2650–2658.
41. Volný O, Kašičková L, Coufalová D et al. microRNAs in Cerebrovascular Disease. Adv Exp Med Biol 2015; 888 : 155–195. Dostupné z DOI: <http://dx.doi.org/10.1007/978–3-319–22671–2_9>.
42. Janssen HLA, Reesink HW, Lawitz EJ et al. Treatment of HCV infection by targeting microRNA. N Engl J Med 2013; 368(18): 1685–1694. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa120902>.
43. Duell PB, Santos RD, Kirwan BA et al. Long-term mipomersen treatment is associated with a reduction in cardiovascular events in patients with familial hypercholesterolemia. J Clin Lipidol 2016; 10(4): 1011–1021. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacl.2016.04.013>.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adults
Article was published inAthero Review

2016 Issue 3-
All articles in this issue
- Aterogénna dyslipidémia – nový cieľ v kardiovaskulárnej prevencii
- Periférne artériové ochorenie dolných končatín a dyslipidémia
- Význam mikroRNA v patofyziologii aterosklerózy a jejich možné klinické využití
- Inhibítory proproteín konvertázy subtilizín/kexín typ 9 (PCSK9)
- Jaké máme další možnosti snížit krevní tlak bez užití antihypertenziva
- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Vysoká prevalence kardiovaskulárních rizikových faktorů a neuspokojivá kontrola hladin LDL-cholesterolu v populaci 40letých mužů a 50letých žen v České republice
- Je možné zlepšiť primárnu prevenciu ischemickej choroby srdca? A akým spôsobom?
- Od dyslipidemie k ischemické chorobě srdeční a zpět
- Athero Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Aterogénna dyslipidémia – nový cieľ v kardiovaskulárnej prevencii
- Jaké máme další možnosti snížit krevní tlak bez užití antihypertenziva
- Periférne artériové ochorenie dolných končatín a dyslipidémia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




