-
Medical journals
- Career
Alarminy a jejich role v perioperační medicíně
Authors: J. Máca
Authors‘ workplace: Katedra intenzivní medicíny a forenzních oborů, Lékařská fakulta, Ostravská univerzita v Ostravě ; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava-Poruba
Published in: Anest. intenziv. Med., 27, 2016, č. 2, s. 98-106
Category: Intensive Care Medicine - Review Article
Overview
Alarminy jsou látky proteinové povahy, které se za normálního stavu nacházejí v buňkách a plní zde svou fyziologickou funkci. V současné době je již identifikována celá řada alarminů, z nichž k nejvíce zkoumaným patří high-mobility group box 1, heat-shock proteiny, proteiny S100A, mitochondriální DNA a formylované formy tripeptidu methionin-leucin-fenylalanin. V patologickém stavu se tyto látky uvolňují, popř. jsou aktivně vylučovány extracelulárně, kde hrají důležitou roli v procesu aktivace vrozeného imunitního systému. Role alarminů byla v posledních desetiletích zkoumána v rámci patofyziologie některých chronických onemocnění, ale existuje i řada prací, které se zabývají vztahem alarminů k akutním zánětlivým stavům, jako např. k syndromu systémové zánětlivé odpovědi infekční i neinfekční etiologie. Rozsáhlý chirurgický výkon by pravděpodobně také mohl vést k vyplavení alarminů z poškozených tkání. Stanovení hladiny alarminů by v těchto případech mohlo vést k lepšímu pochopení patofyziologie chirurgického traumatu, zpřesnit jeho monitorování a zlepšit stanovení klinické prognózy pacientů. Tento fakt ale doposud extenzivně zkoumán nebyl.
Klíčová slova:
alarminy – chirurgický výkon – imunitní odpověď – sterilní zánětÚVOD DO PROBLEMATIKY
Základní funkcí imunitního systému je rozpoznání patologických signálů, které vznikají při poškození tkání na lokální nebo systémové úrovni. Jde o situaci, kdy hrozí narušení homeostázy organismu. Pro imunocyty je takto signalizováno „nebezpečí“, popř. „poškození“. Inzult, který je schopen vyvolat imunologickou reakci, může mít infekční (mikrobiální) i neinfekční (mechanický a fyzikální) původ. Následně je pak signál přenášen, zpracován a vzniká humorální a buněčná odpověď vrozené imunity, a pokud je to nezbytné i adaptivní imunity. Rozpoznávání a hodnocení zevních signálů je důležitou vlastností živých organismů (včetně rostlin). Jde o ontogeneticky velice konzervativní procesy, které jsou důležité pro typ výsledné reakce. Ta může na jednu stranu vést ke snaze o eliminaci vyvolávajícího podnětu, anebo na druhé straně ke vzniku imunologické tolerance. V posledních desetiletích se mění náhled na některé aspekty procesu aktivace vrozené imunity. V minulosti dlouho, téměř dogmaticky platilo pravidlo, které rozlišovalo rozpoznávání tělu vlastních a tělu cizích molekul (self/non-self – SNS) s následnou příslušnou imunitní odpovědí. Tento názor byl postulován v polovině 20. století a autoři Burnet a Medawar byli za něj oceněni Nobelovou cenou. V posledních desetiletích se do popředí postupně propracovává nový koncept, formulovaný v 90. letech Polly Matzingerovou, která klade důraz na rozlišování mezi nebezpečnými nebo bezpečnými signály, tzv. danger model (DM). Tato teorie je schopna lépe vysvětlit řadu situací, kdy vrozená imunita toleruje tělu cizí antigeny (tolerance bakteriémie při čištění zubů, novorozenecká tolerance mateřského mléka s novými imunogenními bílkovinami, tolerance plodu těhotné matky s polovinou antigenních struktur otce apod.), a naopak situace, kdy dochází k intoleranci tělu vlastních buněk a tkání (autoimunita), které by podle prvotní SNS teorie měly být bez problému tolerovány. V literatuře je často citován výrok Polly Matzingerové z New York Times v roce 1998: „Představte si komunitu, ve které policie akceptuje kohokoliv, koho zná od základní školy, a zabije každého nového imigranta a turistu. To je SNS model. V DM jsou imigranti a turisti tolerováni, dokud nezačnou rozbíjet okna. V té chvíli policie zakročí a eliminuje je. V podstatě je vcelku jedno, jestli okna rozbíjí cizinci nebo členové vlastní komunity“ [1].
Matzingerová společně se Seongem šli ještě dále a ve svých publikacích tvrdí, že charakter (tzv. effector class) a intenzita imunitní reakce nezávisí na povaze vlastního patologického signálu, ale především na typu tkáně, kde se proces odehrává [2], a také, že buňky vrozené imunity rozpoznávají jako nebezpečné primárně signály v podobě hydrofobních částí makromolekul jednotlivých ligandů [3].
Původní nomenklatura patologických signálů rozlišovala dvě základní skupiny:
- tzv. pathogen-associated molecular patterns (PAMPs), spojené především z invadujícími mikroorganismy;
- damage/danger-associated molecular patterns (DAMPs), které byly dávány do souvislosti s neinfekčním poškozením.
V posledních letech se klasifikace mění a jako DAMPs jsou označovány všechny signály nebezpečí, tzn. především PAMPs a recentněji i tzv. alarminy, které se uvolňují z buněk při neinfekčním/sterilním poškození tkáně [4, 5]. Signální molekuly infekční etiologie, které ovšem nemusí nutně vést k zánětlivé reakci, jsou označovány jako tzv. microbial-associated molecular patterns (MAMPs). Z dalších signálních molekul lze jmenovat i matrikiny (signální molekuly vznikající při degradaci molekul extracelulární matrix) a tzv. resistution-associated molecular patterns (RAMPs), které se také do jisté míry týkají nebezpečí a mají také svoji důležitou fyziologickou imunoregulační roli v zajištění inflamatorní rovnováhy, např. glucose regulated protein 78 (GRP78), αB-crystallin a HSP27 [6]. Mírně stranou stojí pak tzv. nanoparticle-associated molecular patterns (NAMPs), které mohou být jak endogenního původu (např. ribozomy), tak i látky exogenní povahy (např. virové vektory) [7]. Schematicky je vztah těchto skupin orientačně zobrazen na obrázku 1.
Image 1. Signální molekuly – terminologie, vztah a efekt 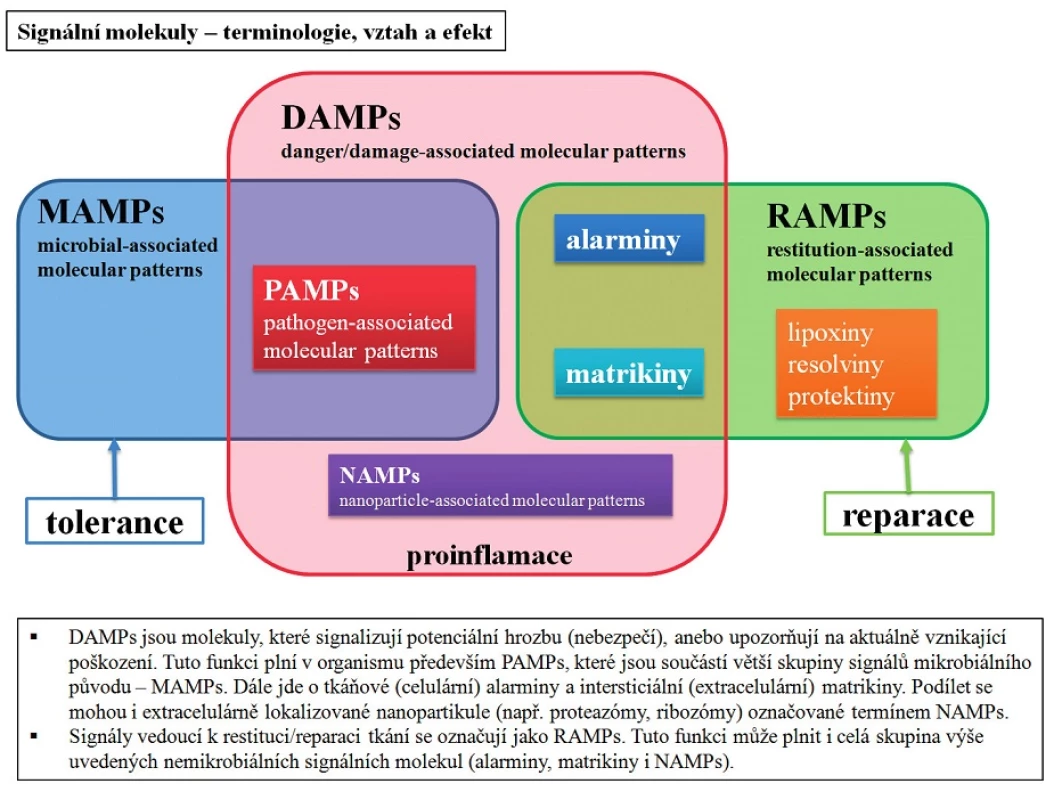
Terminologicky se tedy v současné době preferuje termín DAMPs, jako zastřešující označení pro obě základní skupiny signalizačních molekul:
- PAMPs
- alarminy.
Tento text je primárně zaměřen na charakteristiku neinfekčních signálů – alarminů.
CHARAKTERISTIKA ALARMINŮ – TERMINOLOGIE
Alarminy jsou molekulární stimuly neinfekční povahy vyplavované při poškození tkání se schopností modulovat imunitní odpověď. Ovlivňují nejen funkci antigen-prezentujících buněk (např. monocyty/makrofágy a dendritické buňky), ale i eozinofilů, žírných buněk a neutrofilních granulocytů. Mohou vyvolat zánět buďto přímo (alarminy), nebo jako kofaktory (ko-alarminy), anebo jako chaperony (funkčně pomocné molekulární struktury pro antigeny infekčního původu). Z funkčního hlediska DAMPs vytváří několik typů signálů:
- a) chemotaktické („najdi“),
- b) fagocytární („sněz“),
- c) imunostimulační („aktivuj“),
- d) imunosupresivní („toleruj“),
- e) reparační („obnov“) [8].
Bylo popsáno několik látek, které mohou být považovány za alarminy: high-mobility group box 1 (HMGB1), heat-shock proteiny (HSP), rodina proteinů S100A, mitochondriální alarminy (mtDNA, fMLP), extracelulární ATP apod. Mírně stranou stojí již zmíněné látky původně extracelulární lokalizace, které po své „aktivaci“, tzn. změnou své konformace vlivem zevních podnětů, mohou také vyvolat imunologickou reakci, např. tzv. matrikiny (heparan sulfát, fragmenty kyseliny hyaluronové apod.) [9], dále krystaly kyseliny močové, fibrinogen apod.
SIGNALIZACE NEBEZPEČÍ
Alarminy realizují svoji signalizační funkci přes stejné membránové molekuly na povrchu cílových buněk jako PAMPs, tzv. pattern recognition receptors (PRRs) – obrázek 2.
Image 2. Schéma transdukce infekčního a neinfekčního signálu 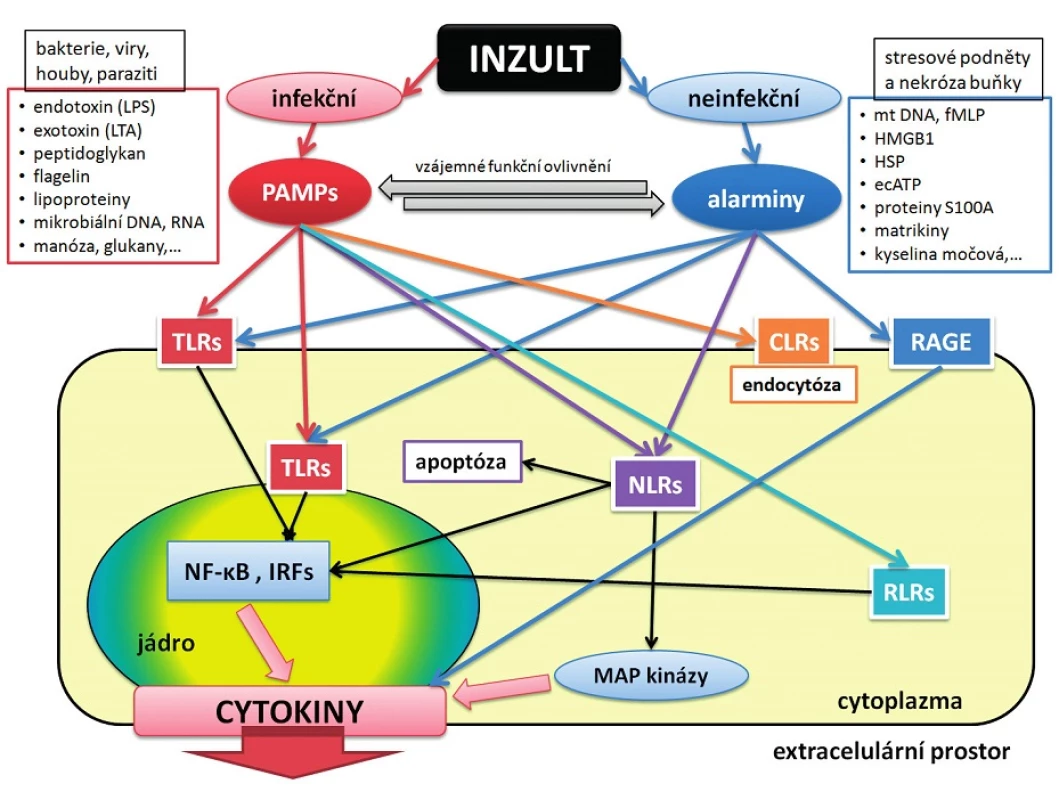
CLRs – C-type lektin receptors, DNA – deoxyribonucleic acid, ecATP – extracelular adenosin triphosphate, HMGB1 – high mobility group box 1, HSP – heat-shock protein, IRFs – interferon- regulatory factor, LPS – lipopolysacharide, LTA – lipoteichooic acid, MAP – mitogen-activated proteinkinase, mtDNA – mitochondrial DNA, NF-κB – nuclear factor kappa B, NLRs – NOD-like receptors, PAMPs – patogen-associated molecular patterns, RAGE – receptor for advanced glycation endproducts, RLRs – RIG-1 like receptors, RNA – ribonucleic acid, TLR – toll-like receptors, fMLP – N-formyl-methionyl-leucine-phenylalanine Existuje celá řada popsaných PRRs s různou lokalizací a funkcí, mezi nimiž z pohledu výzkumu dominují toll-like receptory (TLRs), které patří k vývojově velmi starým a konzervativním systémům. Jsou lokalizovány nejen na povrchu buněk, ale také intracelulárně. Výsledkem jejich stimulace je zvýšení produkce cytokinů cestou aktivace nukleárního faktoru kappa B a aktivace některých intracelulárních proteinkináz. Z dalších PRRs lze vyjmenovat např.:
- a) cytoplazmatické NOD-like receptory (NLRs) podílející se na regulaci procesů zánětu a apoptózy. NLRs rozpoznávají mikrobiální antigeny (např. peptidoglykan, bakteriální DNA, toxiny apod.) i některé alarminy (extracelulární ATP, krystaly kyseliny močové apod.);
- b) RIG-1-like receptory (RLRs), což jsou intracelulární senzory určené zejména pro rozpoznání virové RNA a DNA;
- c) C-type lektinové receptory (CLRs) lokalizované v povrchové membráně imunocytů, které mají převážně endocytickou funkci (tj. destrukce patogenů v endozomech), ale mohou se účastnit i signalizace;
- d) receptory pro tzv. advanced glycation endproducts (RAGE), což jsou transmembránové receptory imunoglobulinové povahy. Jejich ligandem jsou některé alarminy, např. HMGB1, S100A, S100B, S100P, a některé další bílkoviny jako: amyloid-β-protein, AGE (advanced glycation endproducts) u pacientů s diabetes mellitus. RAGE má i svoji solubilní formu s-RAGE, která je považována za funkčního antagonistu RAGE.
STRUČNÁ CHARAKTERISTIKA VYBRANÝCH SKUPIN ALARMINŮ
Naprostá převaha vědeckých prací, které slouží jako zdroj informací o fyziologické intracelulární funkci alarminů a zároveň jejich předpokládané extracelulární roli v rámci modulace imunitního systému, je experimentální povahy a byly realizované zejména in vitro na animálních modelech.
HMGB1 (high mobility group box 1) je ubikvitérní chromozomální protein, lokalizovaný v jádru buňky v těsném funkčním kontaktu s chromatinem (tzv. nuclear/chromatin-associated protein). Jeho základní rolí je pomoc při replikaci, transkripci, rekombinaci a reparaci jaderné DNA, a dále slouží k indukci buněčné migrace a diferenciace [10]. Po jeho vyplavení do systémové cirkulace má proinflamatorní efekt: po stimulaci infekčními antigeny imunitních buněk významně zvyšuje/potencuje jejich cytokinovou produkci. Jde o suspektně aditivní funkci (chaperon) při rozpoznávání některých bakteriálních produktů na něj přímo navázaných, např. lipopolysacharidu (LPS). Má význam i v expresi různých adhezivních molekul na povrchu endoteliálních buněk (ICAM-1, VCAM-1) a hraje roli také v integraci zánětlivé odpovědi a tkáňové reparaci. Podání HGMB1 intravenózně i intratracheálně vedlo k proinflamatorní odpovědi a k rozvoji akutního plicního poškození (ALI), které bylo charakterizované nahromaděním neutrofilních granulocytů v plicním parenchymu, rozvoji plicního edému, elevací plicní produkce cytokinů (IL-1β, TNF-α) a chemokinů pro neutrofilní granulocyty (macrophage-inflammatory protein-2) [11]. HMGB1 je rozpoznáván buňkami, které exprimují na svém povrchu TLR 2 a 4, a RAGE. HMGB1 byl v posledních letech extenzivně studován u akutních i chronických zánětlivých onemocnění [12–14]. Někteří autoři ale význam HMGB1 jako cytokinu v posledních letech spíše zpochybňují. Důvodem je absence proinflamatorní aktivity vysoce purifikovaných preparátů HMGB1 při zachovalé biologické aktivitě [10].
HSPs (heat shock proteins), jmenovitě HSP 60, 70, 90 a gp96 (glykoprotein, forma HSP 90, která se vyskytuje převážně v endoplazmatickém retikulu) jsou ubikvitérní proteiny (cytoplazma, jádro, mitochondrie). HSPs jsou primárně cytoplazmatické molekuly, které se váží na nascentní polypeptidové řetězce, chrání je proti chybnému prostorovému poskládání (angl. misfolding) a podporují jejich náležité konformační změny [15]. Jejich hlavní role je ochrana buňky proti nepříznivým vnějším vlivům, např. mechanickému, chemickému, ale především termickému stresu [16]. HSPs fungují, podobně jako HMGB1, jako kofaktory interakce mezi PAMPs (mikrobiální produkty – LPS, flagelin, lipopolypetidy apod.) a imunokompetentními buňkami. Jejich vlastní proinflamatorní aktivita byla ovšem také zpochybněna a jejich role u čistě neinfekčního SIRS tedy není zcela jasná [10, 16]. Signalizace HSP je převážně cestou TLR 2 a TLR 4.
Mitochondriální alarminy jsou molekulární struktury, které svým efektem nejlépe odpovídají definici endogenního nebezpečného signálu. Jedním z nich je mitochondriální DNA (mtDNA), která byla detekována extracelulárně u pacientů po traumatu. Dalším je tzv. formylovaný peptid Met--Leu-Phe (N-formyl-methionyl-leucin-fenylalanin – fMLP), který působí stimulačně na neutrofilní granulocyty. V experimentu bylo prokázáno, že aplikace mitochondriálních alarminů dokáže vyvolat plicní poškození podobné syndromu akutní dechové tísně (acute respiratory distress syndrome – ARDS. MtDNA signalizuje přes TLR 9, fMLP přes formyl peptide receptor (FPR1) [17, 18].
Extracelulární ATP (ecATP) působí také jako signál nebezpečí zejména lokálně v místě poškození. V nízkých extracelulárních koncentracích má ecATP funkci chemoatraktanu a ko-alarminu. který potencuje inflamatorní odpověď (transkripční aktivace pro-IL-1β a proIL-18 genů) na některé bakteriální produkty (LPS). Ve vyšších koncentracích ecATP blokuje syntézu proinflamatorních cytokinů [19].
S100A proteiny jsou molekuly proteinové povahy, které váží Ca2+ do své struktury dvou tzv. EF-hand motivů, které jsou spojeny centrálním můstkem. EF-hand motiv se skládá z dvou helixů propojených obloukem s Ca2+ afinitou. Název celé skupiny byl odvozen od 100% rozpustnosti v amoniu sulfátu [19]. V této rodině je známo více než 20 proteinů.
Proteiny S100A se nachází převážně v buňkách myeloidní řady, např. S100A8 (calgranulin A, myeloid-related protein 8, MRP8) a S100A9 (calgranulin B, MRP14) v granulocytech, monocytech a časných stadiích diferenciace makrofágů [20]. Za normálního stavu se podílejí na mnoha fyziologických buněčných funkcích (transkripce, homeostáza kalcia, proteinové fosforylaci, funkci cytoskeletu, růstu a diferenciaci buněk apod.). Při zánětu lze expresi těchto proteinů vysledovat i v epiteliálních buňkách a keratinocytech [21]. S100A12 (calgranulin C, extracelular newly indentified RAGE binding protein, EN-RAGE) se vyskytuje především v granulocytech [22, 23]. Sekrece S100A je realizována převážně aktivně, cestou mimo klasickou cestu přes Golgiho aparát. Tato cesta je typická pro řadu alarminů, jejichž primární rolí je podíl na udržování intracelulární homeostázy a které se za patologických podmínek stanou zdrojem aktivačních signálů pro vrozený imunitní systém [24]. Fyziologická funkce S100A proteinů spočívá v regulaci intracelulárního transportu a funkce Ca2+. Kromě toho některé S100A váží i atomy zinku a mědi. Extracelulární funkce je zaměřena na antibakteriální a antiparazitární imunitu. Jsou zvýšeně produkovány v místě zánětu a jejich hladina koreluje s mírou inflamace [24–26]. Někteří zástupci této rodiny, zejména subtyp A (A8, A9, A12), jsou považovány za potenciální alarminy jejich interakcí s TLR4 a RAGE [20].
VÝSLEDEK SIGNALIZACE ALARMINŮ – BUNĚČNÁ REAKCE
Rozpoznání signálu a jeho další intracelulární přenos obvykle vede k několika typům buněčné odpovědi:
- k produkci cytokinů, chemokinů a interferonů (iniciace, propagace a modulace/regulace zánětu);
- k degranulaci (např. u neutrofilních granulocytů) s vyplavením různých enzymů (např. neutrofilní elastázy), reaktivních kyslíkových a dusíkových sloučenin (ROS, RNS), eikosanoidů apod.;
- k fagocytóze patogenu (zejména bakteriální etiologie) a prezentaci jeho antigenů buňkám adaptivní imunity (např. CD4+ T lymfocyty);
- k chemotaxi (pohyb buňky směrem po koncentračním gradientu daného mediátoru);
- k apoptóze – zastavení produkce proteinů, indukovaných např. při virové infekci, a následné programované smrti buňky;
- k hibernaci organel (mitochondrie).
Jak probíhá proces rozhodování, k jakému typu reakce dojde, prozatím není zcela objasněno. Svou roli může hrát typ signálu (např. různé typy PAMPs vyvolávající různý typ reakce), různá lokalizace a typ receptoru (PRRs), různé kombinace signálů (např. PAMPs + alarmin, PAMPs + matrikin), typ buňky realizující odpověď, vliv lokálních mikroprostředí a cytoarchitektoniky apod.
Za rizikovou situaci je považována dysregulace inflamatorní odpovědi, která následuje po nadměrném či protrahovaném inzultu, která může vést až ke vzniku tzv. syndromu systémové zánětlivé odpovědi (angl. systemic inflamatory response syndrome – SIRS) [27, 28] a následně k rozvoji multiorgánového selhávání (angl. multiple-organ dysfunction syndrome – MODS, respektive multiple organ failure – MOF) – obrázek 3.
Image 3. Zjednodušené schéma rozvoje sepse SIRS, MODS po inzultech infekční i neinfekční etiologie 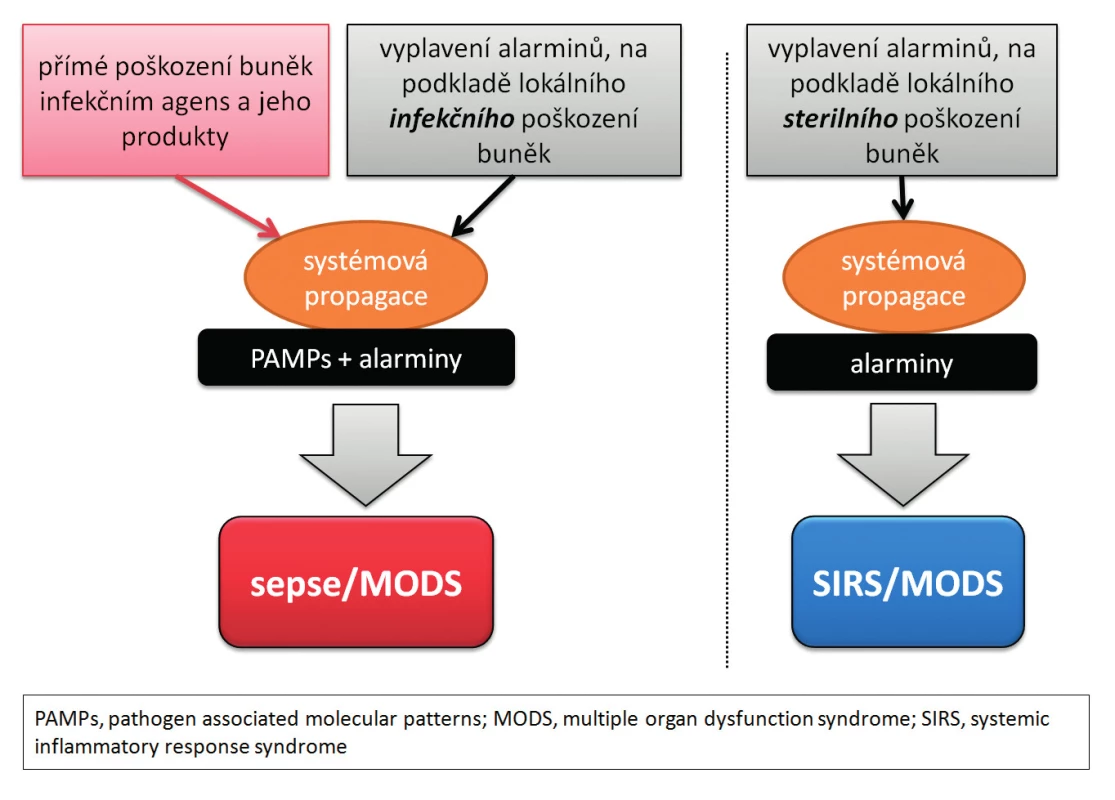
METODIKA VÝBĚRU ČLÁNKŮ
Problematika alarminů v perioperační medicíně není doposud extenzivně zkoumaná. Systematickým vyhledáváním v databázi Web of Science poskytla kombinace výrazů “alarmin” AND “major surgery” pouze 3 odkazy, z nichž 2 byly nerelevantní z důvodu toho, že se přímo netýkaly chirurgické péče. Pro vyhledávání bylo proto použito kombinace termínů “damage-associated molecular patterns” AND “surgery”, která poskytla 23 výsledků. Databáze Medline/Pubmed poskyla pro termíny „alarmin“ AND „major surgery“ jen 18 výsledků a pro kombinace „damage-associated molecular pattern“ AND „major surgery“ jen 21 výsledků. Po vyřazení duplicit bylo tedy nalezeno celkem 53 článků, které souvisely s problematikou alarminů v rámci chirurgické perioperační péče. Seznam získané literatury prošel dvojitým čtením a následným vyřazením irelevantních článků (chyběla souvislost alarminů a chirurgických výkonů), výsledkem bylo 8 článků přímo souvisejících se zkoumanou problematikou. Analýzou literárních odkazů z těchto článků byla doplněna řada další literatury, především přehledových článků zabývající se problematikou konkrétních alarminů (S100A8, S100A12, HMGB1, HSP70). Vývojový diagram (angl. flow-chart) selekce relevantních článků pro rešeršní práci – obrázek 4.
Image 4. Vývojový diagram selekce článků 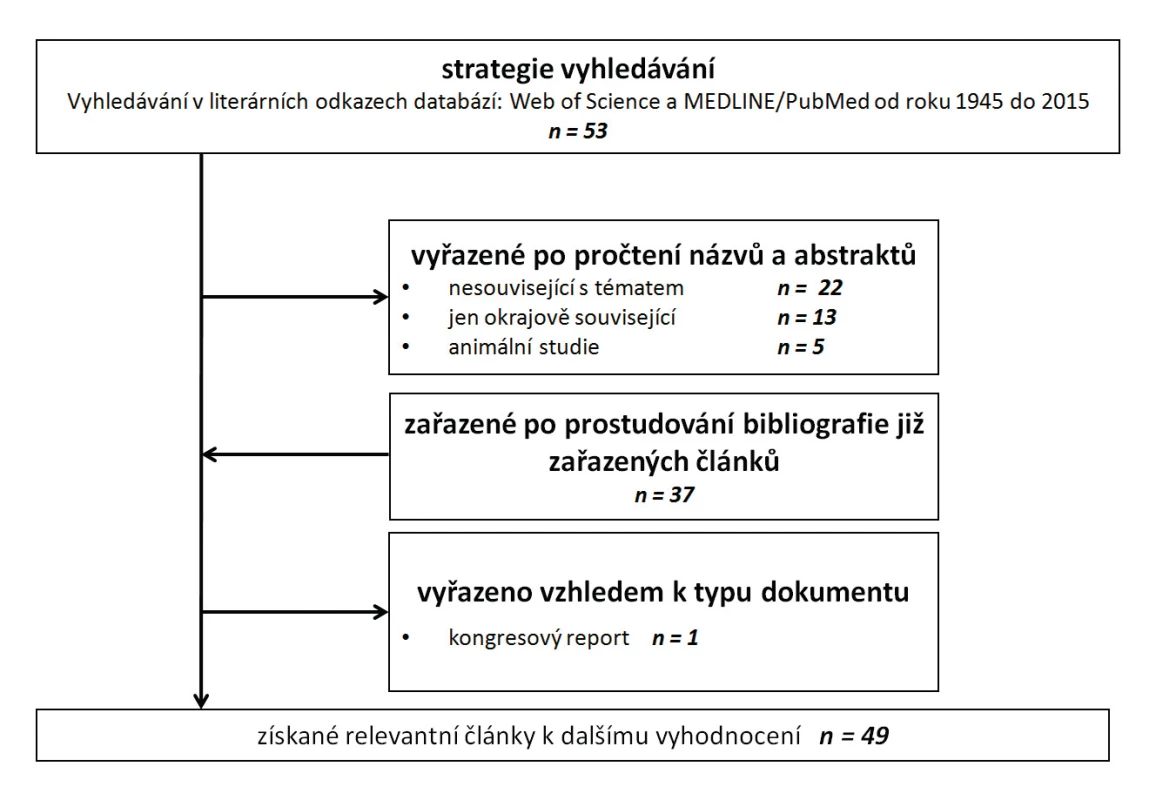
ROLE ALARMINŮ V PERIOPERAČNÍ MEDICÍNĚ
Zvyšující se počet rozsáhlých operačních výkonů je považován v posledních letech za velký problém zdravotní péče [29–31]. Klíčové faktory asociované se zvýšeným rizikem nepříznivého klinického výsledků pacientů zahrnují: pokročilý věk, komorbidity, rozsah a akutnost výkonu [32, 33]. Každý rok se celosvětově provede až 234 miliónů rozsáhlých operačních výkonů. To odpovídá cca 1000 úmrtí a 4000 závažných komplikací každou hodinu. Je odhadováno, že téměř 50 % z těchto nežádoucích událostí lze předejít [34]. Typickým představitelem vysoce rizikového výkonu jsou gastrointestinální resekce [29].
Rozsáhlé chirurgické výkony jsou spojeny s přímým mechanickým poškozením tkání, lokálním krvácením, prolongovanou ischémií spojenou s hypoxemickým buněčným stresem a ischemicko-reperfuzním poškozením [18, 34–36]. Tyto stavy mohou negativně ovlivnit odpověď vrozené i adaptivní imunity (posun Th1→Th2) na lokální i systémové úrovni [37–39]. Jak již bylo zmíněno výše, pokud je patologický inzult nadhraniční a/nebo prolongovaný, imunologická dysregulace může negativně ovlivnit klinický výsledek pacienta, např. v podobě zvýšeného rizika pooperačních infekčních komplikací, porušeného hojení ran, orgánové dysfunkce, prodloužené doby hospitalizace, zvýšené smrtnosti (pozn. anglicky označované jako mortalita), pokles kognitivních funkcí v dlouhodobějším časovém horizontu atd. [37, 40–43].
Existuje řada fyziologických a laboratorních parametrů, které odrážejí závažnost pooperačního inflamatorního stavu (dechová frekvence, tepová frekvence, tělesná teplota, počet leukocytů a diferenciální rozpočet leukocytů, C-reaktivní protein (CRP), interleukin 6 (IL-6) a albumin [44]. Jejich výpovědní hodnota je ale omezená. Dále nemáme k dispozici obecně akceptované biomarkery efektivně hodnotící míru (stupeň) chirurgického inzultu. Takovéto biomarkery by mohly pomoci například k:
- lepšímu porozumění patofyziologie chirurgického poranění,
- zefektivnění monitorování efektu pooperačních terapeutických intervencí a
- predikci možných komplikací a dlouhodobého (long-term) klinického výsledku pacientů.
DAMPs jsou skupinou molekul, jejichž uvolnění je způsobeno celou řadou neinfekčních a infekčních inzultů [3, 11, 20, 45]. Alarminy reprezentují endogenní podskupinu DAMPs a s největší pravděpodobností jsou vyplavovány také po chirurgickém inzultu (prozatím nepublikovaná data autora).
DISKUSE A SHRNUTÍ
Alarminy jsou významnou součástí aktivace imunitního systému v případech neinfekčního (sterilního) poškození a účastní se i signalizace při infekčních onemocněních. Jejich primárním smyslem je upozornit na potenciální nebo již existující nebezpečí poškození tkání a společně s ostatními obrannými mechanismy (neuro-humorálních obranných systémů) iniciovat fyziologické procesy. Jejich role se uplatňuje jako součást složitého komplexu fyziologicko-patofyziologických procesů, vedoucích k odstranění patologického stavu, a tím k opětovnému nastolení homeostázy organismu a zajištění jeho optimální funkce a přežití.
V současné době je možné stanovit sérovou hladinu celé řady alarminů a většina z nich byla extenzivně zkoumána v posledních desetiletích, a to jak z pohledu patofyziologie různých onemocnění, tak i jako potenciální klinické biomarkery a cíle terapeutických intervencí.
Specifikem skupiny alarminů je jejich značná heterogenita, zejména z hlediska lokalizace v buňce, vlastní molekulární struktury, ale také primární fyziologické funkce. Jsou popsány cytoplazmatické alarminy (např. proteiny S100A, HSPs), proteiny nacházející se v jádře buněk (HMGB1) a mitochondriální molekuly (mtDNS, fMLP). Funkci „alarmu“ pro imunocyty mohou navíc plnit i produkty intermediárního metabolismu (např. extracelulárně vyplavené molekuly ATP), ale i primárně extracelulárně lokalizované molekuly, u nichž dojde k narušení jejich normální molekulární struktury vlivem patologického procesu, tzv. matrikiny. Dalším typickým rysem alarminů je to, že se za normálního stavu nachází pouze v buňkách a mimo buňku se prakticky nevyskytují. Jejich zvýšená detekce extracelulárně, respektive v séru, je tedy známkou různých patologických stavů, např. chronického zánětlivého stavu [24], probíhajícího nádorového onemocnění [47], potraumatického stavu [43] apod. V rámci akutních zánětlivých stavů (jako např. SIRS a sepse) jejich role prozatím extenzivně zkoumána nebyla.
Problémem zůstávají nejasnosti stran uvolňování alarminů z buněk. Původní myšlenka, že alarminy se uvolňují jen z buňky poškozené nebo nekrotické, byla poupravena vzhledem k tomu, že některé alarminy mohou být i aktivně secernovány buňkami po jejich aktivaci (např. aktivované granulocyty vylučují HMGB1) [12]. Dalším problémem jsou nejasnosti kolem extracelulární funkce alarminů. Bylo prokázáno, že vysoce purifikované preparáty HMGB1 a HSPs vykazují v podstatě jen minimální biologickou aktivitu [10] a fungují pravděpodobně především jako kofaktory nebo chaperony pro jiné molekuly (převážně mikrobiálního původu, např. LPS). To značně narušuje celý koncept jejich samostatného významu pro stimulaci imunitního systému. Někteří autoři dokonce poukazují na možnost aktivní sekrece některých „typických“ alarminů (S100A8/9 a S100A12) po stimulaci infekčním agens [prozatím nepublikovaná data, osobní komunikace, Holub 2015].
Rozsáhlý chirurgický výkon je obvykle definován jako výkon s očekávanou dobou trvání více než 2 hodiny, nebo očekávanou krevní ztrátou více než 500 ml [48]. Takovýto inzult je v naprosté většině případů zdrojem akutního neinfekčního systémového zánětu (SIRS), popř. až ve formě závažné imunoregulační dysbalance [31, 34, 37, 41, 42]. Je to především v případě jeho nadhraniční intezity, protrahovaného působení, nebo kombinace obojího. Vlastní výkon totiž v mnoha případech nevede jen k žádoucímu odstranění patologického stavu (např. k evakuaci abscesu, odstranění nádorového ložiska, sutuře krvácející cévy), ale je také často zdrojem poškození okolní zdravé tkáně. Základní snahou chirurga by tedy měla být optimalizace výkonu ve smyslu zajištění minimální invazivity výkonu, provedení úkonů v co nejkratší době, s minimálním lokálním poškozením a co nejmenší krevní ztrátou. Jednoznačná doporučení pro aplikaci poznatků týkající se hladin jednotlivých alarminů v humánní medicíně prozatím chybí.
Cílem péče v časném pooperačním období tedy zatím zůstává časná identifikace rizikových faktorů, především zjevně či skrytě probíhajících patologických procesů (např. tkáňová hypoperfuze, šok), a rychle a razantně na ně terapeuticky reagovat. Tím je možné docílit adekvátní a časné stabilizace klinického stavu a zajištění rychlé a efektivní reparace poškozených tkání spojené s nižším výskytem pooperačních komplikací a zlepšením klinického výsledku pacientů.
Pokud by se podařilo prokázat, že sérové hladiny vybraných alarminů odráží míru chirurgického traumatu a/nebo hrají prognostickou roli v predikci jeho vlivu na klinický výsledek, mohlo by to vést ke zlepšení a zpřesnění perioperační diagnostiky. Vyšetřování alarminů by pak mělo šanci stát se součástí standardní péče o pacienty po chirurgických výkonech.
Použité zkratky
ACCP – American College of Chest Physicians
ALI – Acute Lung Injury
APACHE – Acute Physiology and Chronic Health Evaluation
ARDS – Acute Respiratory Distress Syndrome
ATP – adenosine triphosphate
CLRs – C-type lectin receptors
CRP – C-reactive protein/C reaktivní protein
CSIM – Czech Society of Intensive Care Medicine/Česká společnost intenzivní medicíny
DAMPs – damage/danger-associated molecular patterns
DM – danger model
ecATP – extracellular adenosine triphosphate
ELISA – enzyme-linked immunosorbentassay
fMLP – formylated Met-Leu-Phe
FN – fakultní nemocnice
GIT – gastrointestinal tract/gastrointestinální trakt
GRP78 – glucose regulated protein 78
HMGB1 – high mobility group box 1
HSP 70 – heat shock protein 70
ICAM – intercellular adhesive molecule
IL-6 – interleukin 6
JIP – jednota intenzivní péče
LPS – lipopolysaccharide
MAMPs – microbial-associated molecular patterns
MODS – multi-organ dysfunction syndrome
MOF – multi-organ failure
mtDNA – mitochondrial deoxyribonucleic acid
NAMPs – nanoparticle-associated molecular patterns
NF-κB – nuclear factor kappa B
NLRs – NOD-like receptors
PAMPs – pathogen-associated molecular patterns
PRRs – pattern recognition receptors
RAMPs – restitution-associated molecular pattern
RNS – reactive nitrogen species
ROS – reactive oxygen species
RLRs – RIG-1 like receptors
SCCM – Society of Critical Care Medicine
SIRS – systemic inflammatory response syndrome
SNS – self/nonself
RAGE – receptor for advanced glycation end-products
TLRs – toll-like receptors
VCAM – vascular cell adhesion molecule
Do redakce došlo dne 29. 9. 2015.
Do tisku přijato dne 7. 12. 2015.
Adresa pro korespondenci:
MUDr. Jan Máca
KARIM Fakultní nemocnice Ostrava-Poruba
17. listopadu 1790
708 52 Ostrava-Poruba
email: jan.maca@fno.cz
Sources
1. Matzinger, P. The danger model: a renewed sense of self. Science, 2002, 296, p. 301–305.
2. Matzinger, P., Kamala, T. Tissue-based class control: the other side of tolerance. Nat. Rev. Immunol., 2011, 11, p. 221–230.
3. Seong, S. Y., Matzinger, P. Hydrophobicity: an ancient damage-associated molecular pattern that initiates innate immune responses. Nat. Rev. Immunol., 2004, 4, p. 469–478.
4. Bianchi, M. E. DAMPs, PAMPs and alarmins: all we need to know about danger. J. Leukoc. Biol., 2007, 81, p. 1–5.
5. Chan, J. K., Roth, J., Oppenheim, J. J., Tracey, K. J., Vogl, T., Feldmann, M., Horwood, N., Nanchahal, J. Alarmins: awaiting a clinical response. J. Clin. Invest., 2012, 122, p. 2711–2719.
6. Shields, A. M., Panayi, G. S., Corrigall, V. M. Resolution-associated molecular patterns (RAMP): RAMParts defending immunological homeostasis? Clin. Exp. Immunol., 2011, 165, 3, p. 292–300.
7. Fadeel, B. Clear and present danger? Engineered nanoparticles and the immune system. Swiss Med. Wkly, 2012, 142:w13609.
8. Krysko, D. V., Agostinis, P., Krysko, O., Garg, A. D., Bachert, C., Lambrecht, B. N., Vandenabeele, P. Emerging role of damage-associated molecular patterns derived from mitochondria in inflammation. Trends Immunol., 2001, 32, p. 157–164.
9. Rocco, P. R., Dos Santos, C., Pelosi, P. Lung parenchyma remodeling in acute respiratory distress syndrome. Minerva Anestesiol., 2009, 75, 12, p. 730–740.
10. Tsan, M. F. Heat shock protein and high mobility group box 1 protein lack cytokine function. J. Leukoc. Biol., 2011, 89, p. 847–853.
11. Lotze, M. T., Deisseroth, A., Rubartelli, A. FOCiS on damage associated molecular pattern molecules. Clin Immunol 2007; 124 : 1-4
12. Lotze, M. T., Tracey, K. J. High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal. Nat. Rev. Immunol., 2005, 5, p. 331–342.
13. Yanai, Ban T., Taniguchi, T. High-mobility group box family of proteins: ligand and sensor for innate immunity. Trends Immunol., 2012, 33, p. 633–640.
14. Cohen, M. J., Brohi, K., Calfee, C. S., Rahn, P., Chesebro, B. B., Christiaans, S. C., Carles, M., Howard, M., Pittet, J. F. Early release of high mobility group box nuclear protein 1 after severe trauma in humans: role of injury severity and tissue hypoperfusion. Crit. Care, 2009, 13, 6, R174.
15. Hartl, F. U., Hayer-Hartl, M. Molecular chaperones in the cytosol: from nascent chain to folded prtein. Science, 2002, 295, p. 1852–1858.
16. Caderwood, S. K., Mambula, S. S., Gray, P. J. Jr. Exracellular heat shock proteins in cell signaling and immunity. Ann. N. Y. Acad. Sci., 2007, 1113, s. 28–39.
17. McIlroy, D. J., Bigland, M., White, A. E., Hardy, B. M., Lott, N., Smith, D. W., Balogh, Z. J. Cell necrosis-independent sustained mitochondrial and nuclear DNA release following trauma surgery. J. Trauma Acute Care Surg., 2015, 78, p. 282–288.
18. Pugin, J. How tissue injury alarms the immune system and causes inflammatory response syndrome. Ann. Intensive Care, 2012, 2, 27.
19. Heizmann, C. W., Fritz, G., Schafer, B. W. S100 proteins: structure, functions and pathology. Front. Biosci., 2002, 7, p. 1356–1368.
20. Foell, D., Wittkowski, H., Vogl, T., Roth, J. S100 proteins expressed in phagocytes: a novel group of damage-associated molecular pattern molecules. J. Leukoc. Biol., 2007, 81, p. 28–37.
21. Frosch, M., Metze, D., Foell, D., Vogl, T., Sorg, C., Sunderkötter, C., Roth, J. Early activation of cutaneous vessels and epithelial cells is characteristic of acute systemic onset juvenile idiopathic arthritis. Exp. Dermatol., 2005, 14, 4, p. 259–265.
22. Vogl, T., Pröpper, C., Hartmann, M., Strey, A., Strupat, K., van den Bos, C., Sorg, C., Roth, J. S100A12 is expressed exclusively by granulocytes and acts independently from MRP8 and MRP14. J. Biol. Chem., 1999, 274, p. 25291–25296.
23. Pietzch, J., Hoppmann, S. Human S100A12: a novel key player in inflammation? Amino Acids, 2009, 36, p. 381–389.
24. Foell, D., Roth, J. Proinflammatory S100 proteins in arthritis and autoimmune disease. Arthritis Rheum., 2004, 50, p. 3762–3771.
25. Meijer, B., Gearry, R. B., Day, A. S. The role of S100A12 as a systemic marker of inflammation. Int. J. Inflam., 2012, 907078.
26. Shrikrishna, G., Panneerselvam, K., Westphal, V., Abraham, V., Varki, A., Freeze, H. H. Two proteins modulating transendothelial migration of leukocytes recognize novel carboxylated glycans on endothelial cells. J. Immunol., 2001, 166, p. 4678–4688.
27. NeSmith, E. G., Weinrich, S. P., Andrews, J. O., Medeiros, R. S., Hawkins, M. L., Weinrich, M. Systemic inflammatory response syndrome score and race as predictors of length of stay in the intensive care unit. Am. J. Crit. Care, 2009, 18, p. 339–346.
28. Baue, A. E., Durham, R., Faist, E. Systemic inflammatory response syndrome (SIRS), multiple organ dysfunction syndrome (MODS), multiple organ failure (MOF): are we winning the battle? Shock, 1998, 10, p. 79–89.
29. Jakobson, T., Karjagin, J., Vipp, L., Padar, M., Parik, A. H., Starkopf, L., Kern, H., Tammik, O., Starkopf, J. Postoperative complications and mortality after major gastrointestinal surgery. Medicina (Kaunas), 2014, 50, p. 111–117.
30. Khuri, S. F., Henderson, W. G., DePalma, R. G., Mosca, C., Healey, N. A., Kumbhani, D. J. Participants in the VA National Surgical Quality Improvement Program. Determinants of long-term survival after major surgery and the adverse effect of postoperative complications. Ann. Surg., 2005, 242, p. 326–341.
31. Barie, P. S., Hydo, L. J. Epidemiology of multiple organ dysfunction syndrome in critical surgical illness. Surg. Infect. (Larchmt), 2000, 1, p. 173–185.
32. Pearse, R. M., Harrison, D. A., James, P., Watson, D., Hinds, C., Rhodes, A., Grounds, R. M., Bennett, E. D. Identification and characterisation of the high-risk surgical population in the United Kingdom. Crit. Care, 2006, 10:R81.
33. Jhanji, S., Thomas, B., Ely, A., Watson, D., Hinds, C. J., Pearse, R. M. Mortality and utilisation of critical care resources amongst high-risk surgical patients in a large NHS trust. Anaesthesia, 2008, 63, p. 695–700.
34. Dobson, G. P. Addressing the Global Burden of Trauma in Major Surgery. Front. Surg., 2015, 3, 2 : 43.
35. van Golen, R. F., Reiniers, M. J., Olthof, P. B., van Gulik, T. M., Heger, M. Sterile inflammation in hepatic ischemia/reperfusion injury: present concepts and potential therapeutics. J. Gastroenterol. Hepatol., 2013, 28, p. 394–400.
36. van Golen, R. F., van Gulik, T. M., Heger, M. The sterile immune response during hepatic ischemia/reperfusion. Cytokine Growth Factor Rev., 2012, 23, p. 69–84.
37. Marik, P. E., Flemmer, M. The immune response to surgery and trauma: implications for treatment. J. Trauma Acute Care Surg., 2012, 73, p. 801–808.
38. Gentle, L. F., Cuenca, A. G., Efron, P. A., Ang, D., Bihorac, A., McKinley, B. A., Moldawer, L. L., Moore, F. A. Persistent inflammation and immunosuppression: A common syndrome and new horizon for surgical intensive care. J. Trauma Acute Care Surg., 2012, 72, p. 1491–501.
39. Reinhardt, R., Pohlmann, S., Kleinertz, H., Hepner-Schefczyk, M., Paul, A., Flohé, S. B. Invasive Surgery Impairs the Regulatory Function of Human CD56 bright Natural Killer Cells in Response to Staphylococcus aureus. Suppression of Interferon-γ Synthesis. PLoS One, 2015, 10:e0130155.
40. Terrando, N., Brzezinski, M., Degos, V., Eriksson, L. I., Kramer, J. H., Leung, J. M., Miller, B. L., Seeley, W. W., Vacas, S., Weiner, M. W., Yaffe, K., Young, W. L., Xie, Z., Maze, M. Perioperative cognitive decline in the aging population. Mayo Clin Proc., 2011, 86, p. 885–893.
41. Cui, P., Fang, X. Pathogenesis of infection in surgical patients. Curr. Opin. Crit. Care, 2015, 21, p. 343–350
42. Islam, N., Whitehouse, M., Mehendale, S., Hall, M., Tierney, J., O’Connell, E., Blom, A., Bannister, G., Hinde, J., Ceredig, R., Bradley, B. A. Post-traumatic immunosuppression is reversed by anti-coagulated salvaged blood transfusion: deductions from studying immune status after knee arthroplasty. Clin. Exp. Immunol., 2014, 177, p. 509–520.
43. Kimura, F., Shimizu, H., Yoshidome H, Ohtsuka M, Miyazaki M. Immunosuppression following surgical and traumatic injury. Surg Today, 2010, 40, p. 793–808.
44. Bone, R. C., Balk, R. A., Cerra, F. B., Dellinger, R. P., Fein, A. M., Knaus, W. A., Schein, R. M., Sibbald, W. J. American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit. Care Med., 1992, 20, p. 864–874.
45. Kaczmarek, A., Vendenabeele, P., Krysko, D. V. Necroptosis: The release of damage-associated molecular patterns and its physiological relevance. Immunity, 2013, 38, p. 209–223.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2016 Issue 2-
All articles in this issue
- Maligní hypertermie
- Úloha antitrombínu a tromboelastometrie v manažmente počínajúcej diseminovanej intravaskulárnej koagulopatie po peripartálnej hysterektómii
- Současný pohled na kaudální epidurální blokády u dětí a jejich komplikace
- Poruchy spánku u pacientů v perioperačním období a intenzivní péči
- Alarminy a jejich role v perioperační medicíně
- Tekutinová terapie v intenzivní péči*
- Praktická doporučení pro prevenci, diagnostiku a léčbu respirační deprese vzniklé v souvislosti s neuroaxiálně podanými opioidy
- Projekt Spireta
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Maligní hypertermie
- Současný pohled na kaudální epidurální blokády u dětí a jejich komplikace
- Tekutinová terapie v intenzivní péči*
- Poruchy spánku u pacientů v perioperačním období a intenzivní péči
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

