-
Medical journals
- Career
Anesteziologický management během operace těhotné s akutní aortální disekcí
Authors: Leitgeb Marián; Šmrha Radim; Tesařík Richard; Zmeko Dušan
Authors‘ workplace: ARO a RES KCH, Nemocnice České Budějovice, a. s.
Published in: Anest. intenziv. Med., 25, 2014, č. 5, s. 348-354
Category: Anaesthesiology - Case Reports
Overview
Akutní disekce aorty je život ohrožující stav s vysokou mortalitou. Jedním z mnoha rizikových faktorů tohoto onemocnění je i fyziologické těhotenství. Nutné je včasné stanovení diagnózy a adekvátní terapie podle potřeb obou organismů. Kazuistika popisuje případ těhotné v 33. týdnu těhotenství s disekcí typu A a postup během celkové anestezie. V první době byl proveden císařský řez k vybavení plodu, poté výkon na ascendentní aortě.
Klíčová slova:
aorta – aortální disekce – anestezie – těhotenstvíÚVOD
Disekce aorty (DA) je život ohrožující stav, jehož mortalita je velmi vysoká. Bez léčby umírá během prvních dvou dnů po vzniku potíží přes 50 % nemocných, během dvou týdnů až 80 % [1].
K náhlému úmrtí dochází nejčastěji pod obrazem hemoragického šoku při ruptuře aorty. Aortální disekce je vzácnou, ale možnou komplikací během fyziologických změn ženského těla v průběhu těhotenství. Incidence je malá, jeden případ na 250 000 těhotných.
Celá polovina DA u žen do 40 let je spojena s těhotenstvím [2]. Nejčastěji se onemocnění manifestuje ve třetím trimestru, peripartálně či v brzké době po porodu. Tato kazuistika popisuje případ 25leté druhorodičky ve 33. týdnu těhotenství s akutně vzniklou disekcí typu A, která urgentně podstoupila císařský řez s navazujícím výkonem na ascendentní aortě.
KAZUISTIKA
Zdravá 25letá tercigravida, sekundipara ve 33. týdnu těhotenství přišla ve večerních hodinách na spádovou interní ambulanci pro bolest na hrudi trvající 10 hodin. Bolest byla píchavá, lokalizovaná za hrudní kostí s propagací mezi lopatky a zhoršující se při nádechu. Pociťovala nespecifické dechové obtíže. Během vyšetření měla pravidelnou srdeční akci 75/min s krevním tlakem 100/50 mm Hg. Interní lékař vyloučil plicní embolii i ischemickou chorobu srdeční a s analgetiky ji propustil domů.
Druhý den ráno pacientka při přetrvávajících obtížích znovu vyhledala lékaře, který zjistil šelest v prekordiu a provedenou transtorakální echokardiografií (TTE) vyslovil podezření na DA. Převoz do spádového kardiocentra proběhl cestou zdravotnické záchranné služby s lékařem, během transportu byla oběhově stabilní a bez farmakoterapie.
Při příjezdu do kardiocentra se pacientka cítila subjektivně bez obtíží. Anamnesticky negovala všechny rizikové faktory, při výšce 165 cm vážila 84 kg. Krevní tlak měla v normě s klidnou tepovou frekvencí, nebyly žádné známky krvácení či poruch prokrvení. EKG i laboratoř bez patologií. Měření krevního tlaku na horních končetinách vykazovalo odchylku, na levé končetině 75/50 mm Hg, respektive 100/50 mm Hg na pravé. Podle TTE popsána normální velikost i tloušťka srdečních oddílů s dobrou kinetikou levé komory srdeční (LKS), ejekční frakce 68 %. Aortální chlopeň jemná, třícípá, symetrická s regurgitací II. stupně asymetrickým jetem. Ascendentní aorta dilatována na 39 mm, zde viditelná disekce od pravého koronárního sinu s propagací až do descendentní aorty, typ A podle Stanfordské klasifikace. Entry ani reentry se nepodařilo zachytit a pravé i nepravé lumen vykazovalo dobrý průtok. Oblouk a descendentní aorta měly již normální šíři 30 mm.
S tímto nálezem kardiolog kontaktoval kardiochirurga, anesteziologa, gynekologa-porodníka a následně i neonatologa. Vzhledem ke gestačnímu stáří a zralosti dítěte jsme zvolili následující postup – nejdříve ukončit těhotenství císařským řezem (SC) v celkové anestezii a následně navázat výkonem na ascendentní aortě. S pacientkou byla konzultována eventuální nutnost hysterektomie pro hrozící, život ohrožující krvácení během plné heparinizace na mimotělním oběhu (MO). Pacientka hysterektomii odmítla. Souhlasila s ní pouze v případě přímého ohrožení života. Podán ranitidin 50 mg i. v. jako profylaxe aspirace kyselého žaludečního obsahu. Předoperační hemoglobin 115 g/l, hematokrit 33 %, trombocyty 243 x 109/l, Quick 94 %, INR 1,04, aPTT 27,7 s, trombinový čas 16,9 s, fibrinogen 5,3 g/l, antitrombin 97 %, D-dimery 598 µg/l. Na transfuzní stanici jsme deponovali krevní deriváty v množství osmi EBRD (erytrocyty bez buffy coatu resuspendované a deleu-kotizované) a dvou TBD (trombocyty z plné krve deleukotizované).
Před úvodem do celkové anestezie byly na operačním sále s mimotělním oběhem připraveny všechny týmy – gynekologický, neonatologický a kardiochirurgický. Přítomnost kardiochirurga i perfuzionisty je nutná od samého počátku kombinovaného výkonu pro případ náhle vzniklé komplikace. Pacientku jsme nepremedikovali s ohledem na plod, polohována s náklonem na levý bok. Poslední příjem per os byl předchozí den, v den operace pouze trochu pila. Přes lehkou anxietu velmi dobře spolupracovala. Periferní žilní kanyla (PŽK) 20G zajištěna ze spádu. Zprovozněn invazivní tlak na pravé i levé radiální tepně, kde na obou naměřen skoro stejný střední arteriální tlak (MAP) 70–80 mm Hg s malým rozdílem v systole do 15 mm Hg. Tepová frekvence do 100/min. Podán midazolam 1 mg i. v. ke zmírnění diskomfortu. V lokální anestezii kanylován centrální žilní katétr do v. jugularis interna l. dx. quattro a zaveden permanentní močový katétr s termistorem. Spuštěno monitorování NIRS (near-infrared spectroscopy) frontálních laloků mozku a hloubky anestezie metodou BIS (bispectral index).
Po dostatečné preoxygenaci pacientka uvedena do celkové anestezie podáním thiopentalu 400 mg, atracuria 60 mg a remifentanilu kontinuálně v minimální dávce podle tlaku a odpovědi na bolest do 0,1 µg/kg/min. Ventilace maskou směsí čistého kyslíku a sevofluranu v koncentraci 0,8 % do intubace nekomplikovaná, držen Sellickův hmat. Intubace s bolusovým podáním remifentanilu 100 µg frakcionovaně proběhla bez vegetativní reakce za důsledné kontroly tlaku. Po dvou minutách od kožního řezu vybaven živý plod mužského pohlaví via sectio Geppert, předán do péče neonatologů. Apgar skóre 9-10-10, porodní hmotnost 2 060 g. Podána uterotonika podle přání gynekologa, tj. oxytocin 10 IU a methylergometrin 0,4 mg bolusově. Pokračováno v balancované anestezii, prohloubena analgezie. Sufentanil bolusově, remifentanil a atracurium kontinuálně. Na závěr zaveden gynekologem do dělohy Bakriho balonek k minimalizaci krvácení a jeho dobré kontrole (obr. 1). Délka výkonu 50 minut. Gynekolog doporučil podat při pokračujícím krvácení z dělohy pomalu i. v. carboprost 250 µg. Ztráty během císařského řezu byly 500 ml.
Image 1. Bakriho balonek (BB) v děloze, CT 
Před zahájením druhé fáze operace byl zajištěn zavaděč do v. jugularis interna l. sin. 8F a další PŽK 16G. Byla zavedena sonda pro transezofageální echo (TEE) a znovu vyšetřena ascendentní aorta a aortální chlopeň (obr. 2, 3). Podle protokolu našeho oddělení bylo podáno pět gramů kyseliny tranexamové. Po přerouškování byla provedena náhrada ascendentní aorty protézou Gelweave No. 26. Během výkonu zchlazena na 33 °C, heparinizace pro MO v celkové dávce 50 000 IU s antitrombinem III 500 IU podle aktivovaného koagulačního času. Délka MO byla 101 minut, svorka 60 minut. Díky dobrým anatomickým podmínkám proběhlo našití distální anastomózy bez cirkulační zástavy na příčné svorce. Krevní ztráta byla od konce SC do spuštění MO 1030 ml, z toho 430 ml z děložní dutiny a 600 ml ze sternotomické rány. Během plné heparinizace zavedeným Bakriho balonkem 500 ml. Do ukončení MO podáno osm transfuzních jednotek (TU) EBRD, 1930 ml, a stejný počet FFP (čerstvá mrazená plazma), 1 630 ml. Sestup z MO proběhl bez komplikací, bez nutnosti inotropní podpory a s dávkou noradrenalinu nepřesahující 0,1 µg/kg/min. Podán protamin 60 000 IU, kontrolní ACT bylo 160 s, proto přidáno dalších 25 000 IU protaminu. Na kontrolním TEE potvrzena dobrá funkce komor, ejekční frakce LKS 70 % se známkami relativní hypovolémie a dobrou funkcí jemné aortální chlopně. Korekcí sinotubulárního rozměru byla aortální chlopeň bez regurgitace.
Image 2. Disekce typu A v ascendentní aortě, dlouhá osa, TEE 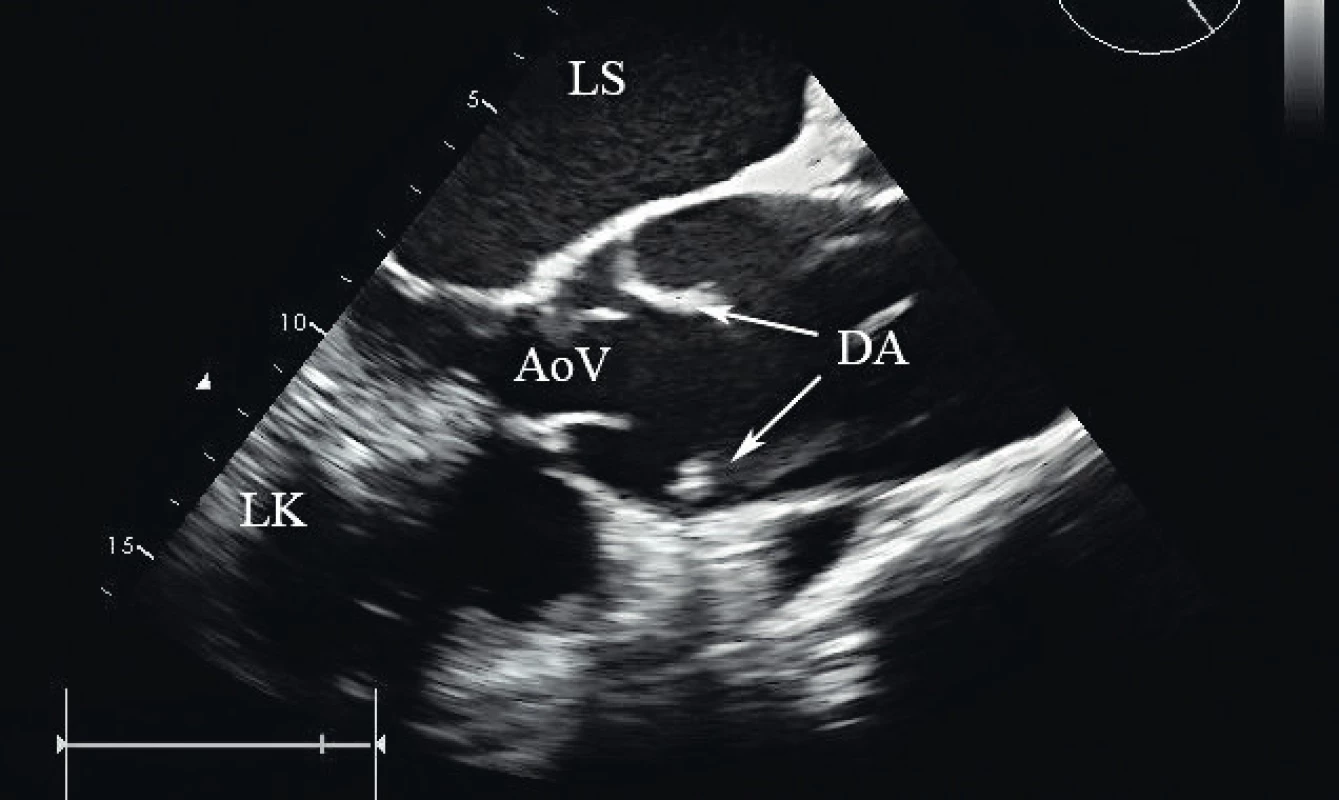
(LS – levá síň, LK – levá komora, AoV – aortální chlopeň, DA – disekce aorty) Image 3. Disekce typu A v ascendentní aortě, krátká osa, TEE 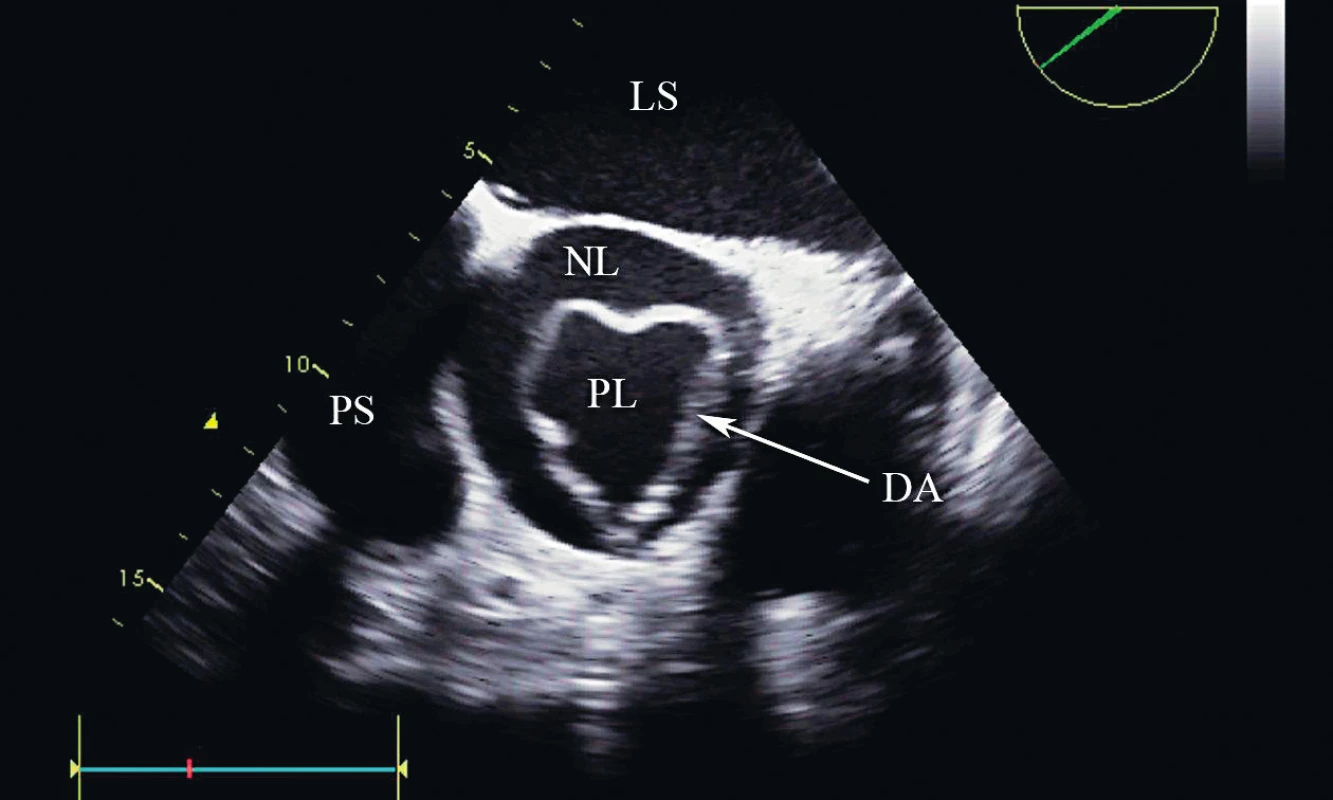
(LS – levá síň, PS – pravá síň, DA – disekce aorty, NL – nepravé lumen, PL – pravé lumen) Během sušení rány došlo k nárůstu difuzních krevních ztrát, k rozvoji hematurie a odhadované ztráty v období po MO dosáhly 1 200 ml. Odeslána laboratorní kontrola krevního obrazu i koagulace, hemoglobin 100 g/l, hematokrit 28 %, trombocyty 102 x 109/l, Quick 61 %, INR 1,41, aPTT 31,2 s, trombinový čas 17,5 s, fibrinogen 2,3 g/l, D-dimery 7020 µg/l. Pro pokračující krvácení podány další čtyři TU EBRD 1 060 ml, dvě TU FFP 440 ml, dva trombonáplavy 10 TU 580 ml, Prothromplex 1200 IU, gram kyseliny tranexamové a celkem dvě dávky karboprostu i. v. v pomalé infuzi v odstupech jedné hodiny. Krvácení z rány poté ustalo a dovolilo definitivní uzavření sternotomie. Délka kardiochirurgického výkonu 280 minut. Celý výkon proběhl bez výraznějších výkyvů v NIRS.
Pacientka byla převezena stabilní na resuscitační pooperační jednotku s minimální katecholaminovou podporou noradrenalinu v dávce 0,05 µg/kg/min. Krevní ztráty na resuscitační stanici dosáhly během prvních 24 hodin 1 400 ml (z děložní dutiny Bakriho balonkem 110 ml, z břišních drénů 970 ml, z hrudních drénů 320 ml). Podáno dalších šest TU FFP, čtyři TU EBRD a jednorázově uterotonika. Následující den provedeno CT hrudníku a břicha pro suspekci na hemoperitoneum s uspokojivým nálezem. Bakriho balonek extrahován za 20 hodin od zavedení a pacientka extubována za dobrých parametrů 23 hodin po operaci.
Celková operační i pooperační krevní ztráta činila 4 865 ml, z toho na OS 3 230 ml a na pooperační jednotce 1 635 ml. Pouze z dělohy po SC byla krevní ztráta 1 550 ml. Celkem podáno 36 krevních derivátů (44 TU), erytrocytů 3 979 ml, čerstvé mražené plazmy 3 765 ml, trombocytů 580 ml a dva koncentráty koagulačních faktorů. Poměr erymas ku mrazeným plazmám tedy vychází přibližně 1 : 1.
Další průběh byl bez život ohrožujících komplikací, v laboratoři pouze lehká hyperbilirubinémie a oboustranně drobné pohrudniční výpotky řešené konzervativně. Pátý pooperační den přeložena na standardní oddělení, osmý den propuštěna i s dítětem v dobrém stavu domů.
První pooperační kontroly byly provedeny s uspokojivým nálezem včetně TTE. Za čtyři měsíce od propuštění pacientka přišla na ambulanci kardiochirurgie s rezistencí v jugulu nad sternotomickou jizvou. Incizí byl evakuován „hnisavý“ sekret a nasazena antibiotika. Ze stěrů nebyl prokázán bakteriální infekt. Provedené CT hrudníku zobrazilo 8 mm široký lem kolem neoaorty (obr. 4). Po vyloučení infekčního původu byly nasazeny kortikoidy pro podezření na imunitní reakci. Za dalších 11 měsíců bylo rozhodnuto o revizi. Byla provedena resekce pseudomembrány a toileta kolem cévní protézy. Vyšetřeními byl definitivně vyloučen bakteriální původ. Uzavřeno jako imunitní reakce na použité materiály, susp. na biolepidlo. Během následujících kontrol postupně vysazeny kortikoidy. Nyní po 24 měsících od výkonu se nemocná i dítě těší dobrému zdraví.
Image 4. Lem kolem neoaorty (LnA), CT 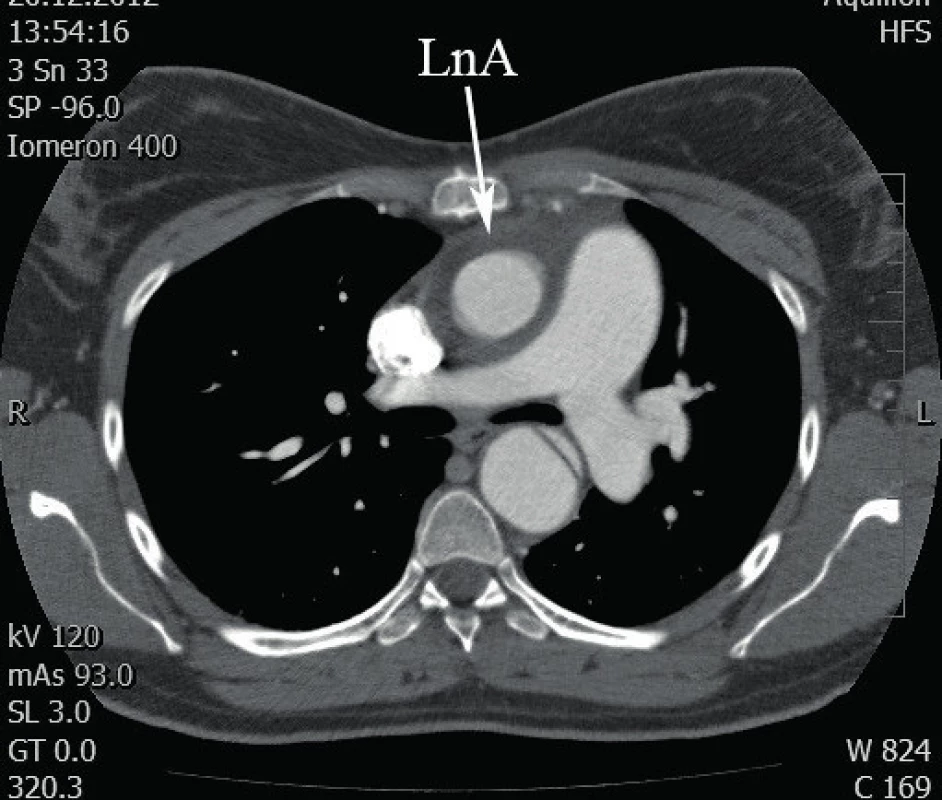
DISKUSE
Aortální disekce (DA) je potenciálně maligní onemocnění. Mezi vrozené rizikové faktory patří poruchy pojivové tkáně (Marfanův syndrom, Ehlers-Danlosův syndrom, Turnerův syndrom aj.), bikuspidální aortální chlopeň (7–14 % DA, riziko 5–18krát vyšší), koarktace aorty atd. Nejčastějším získaným rizikovým faktorem vzniku DA je hypertenze (u 72–80 % případů), dále ateroskleróza, autoimunitní vaskulitidy (Takayasuova arteritida, obrovskobuněčná arteriitida), endokrinní onemocnění, aortitida (bakteriální, mykotická, luetická), revmatoidní artritida, abúzus drog (amfetamin, kokain), trauma, iatrogenní poškození atd. [3].
Z časového hlediska považujeme DA za akutní do dvou týdnů od vzniku potíží a po této době za chronickou. Existuje více klasifikací DA, ale dnes je nejvíce používanou klasifikace Stanfordská. Ta rozlišuje typ A, kdy je postižena ascendentní aorta bez zohlednění dalšího rozsahu, a typ B, kdy je postižena aorta descendentní.
Netraumatická disekce aorty žen mladších 40 let je v polovině případů spojena s těhotenstvím [2]. Potíže začínají nejčastěji ve třetím trimestru s vrcholem ve 32. týdnu či peripartálně. Během třetího trimestru těhotenství dochází k mnoha fyziologickým změnám ženského těla, zvyšuje se srdeční frekvence, tepový objem, srdeční výdej, roste tloušťka stěny levé komory i velikost celého srdce. Hormonální změny těhotné mají vliv na pevnost a elasticitu aortální stěny [4]. Proto i fyziologické těhotenství je rizikovým faktorem pro vznik aortální disekce [5]. Tyto fyziologické změny provázejí všechny těhotné ženy, ale aortální disekce postihne pouze 4 z milionu těhotných za rok [6]. U poloviny těchto žen je v přímé souvislosti s Marfanovým syndromem. Orientačně lze dovodit, že při počtu 106 000 porodů za rok 2012 v celé ČR [7] je četnost DA u těhotné dva případy za pět let. Incidence DA v celé populaci je mnohonásobně vyšší, a to 20–30 případů na milion obyvatel a rok. Bohužel prvních 48 hodin od vzniku příznaků roste přednemocniční mortalita o 1–2 % každou hodinu [8]. U mladých nemocných do 40 let je během prvních 24 hodin 20–30 % [9].
Disekce typu B je v těhotenství méně častá (22 %) a léčba spočívá především v důsledné kontrole tlaku s odloženým výkonem. Z antihypertenziv jsou lékem volby betablokátory, přestože mohou mít vliv na plod (bradykardie, hypoglykémie, zpomalení růstu). Dříve doporučovaný nitroprusid sodný není v této době dostupný, navíc hrozila intoxikace dítěte thiokyanátem. Zdá se, že použítí hydralazinu nebo labetalolu splňuje podmínky bezpečného podání u těhotné ke kontrole tlaku [10]. Cílová hodnota srdeční frekvence je do70/min. a systolického tlaku 100–120 mm Hg [11]. V případě krvácení nebo při poruše prokrvení je intervence nutná okamžitě. Urgentní operace s sebou nese vysoké riziko pro dítě [2]. Typ A je četnější (78 %) a vyžaduje urgentní chirurgickou léčbu. Ruptura aorty, respektive entry bývá v 89 % případů do 2 cm od aortální chlopně [12]. V literatuře je popisováno následující doporučení. Do 28. týdne těhotenství ponechat plod in utero a provést pouze kardiochirurgický výkon. Od 32. týdne je vhodné nejdříve provést císařský řez s navazující operací aorty [13]. V mezidobí je rozhodnutí individuální podle viability dítěte.
Je nutné myslet na to, že mortalita těhotné matky ve spojitosti s kardiochirurgickým výkonem je 2,9–14,3 %, plodu 9,5–29 % [14]. Toto vysoké číslo je především dáno urgentností operace, kterou podstupují, a významně se neliší od mortality netěhotných žen [15]. Samotný výkon na mimotělním oběhu podle studií nezvyšuje významně riziko pro matku ani pro dítě [16]. Je-li výkon prováděn s dítětem in utero, musíme držet normotermii a hematokrit minimálně 25 %. Během mimotělního oběhu musí být držen vyšší krevní tlak a vyšší průtok [13]. Musíme také věnovat pozornost vhodné poloze matky k dobrému návratu krve z dolní duté žíly. Doporučovaný perfuzní index je 3,0 l/m2/min [17, 18]. Měli bychom minimalizovat použití vazopresorů i betablokátorů s ohledem na dítě. Pokud potřebujeme zvýšit tlak, nejvhodněji se jeví fenylefrin, u nás analog efedrin, v pomalé infuzi [19]. Je nutné myslet na možné komplikace podání hyperkalemické kardioplegie a snažit se je minimalizovat. Kardiotokografické monitorování je nezbytné během výkonu a následujících 48 hodin po něm. Na změny srdeční frekvence plodu a kontrakce dělohy musíme okamžitě reagovat. Je prospěšné kontinuální sonografické sledování plodu nejlépe per vaginam [18].
Obtíže naší pacientky byly typické. Měla píchavou bolest za hrudní kostí s propagací do zad. Bolest provází 87 % disekcí aorty, v 70 % se jedná o bolesti na hrudi, v 20 % bolesti zad a v 6 % břicha [12]. Byly zachyceny rozdílné tlaky na horních končetinách, ale bez známek ischemie končetin či orgánů, splanchniku, ledvin atd. U 10–15 % pacientů se mohou objevit poruchy prokrvení a kinetiky myokardu při disekci častěji pravé koronární tepny [20]. Naše pacientka měla EKG bez ischemických změn. Negativita D-dimerů v žádném případě nevylučuje akutní aortální disekci a naopak zvýšené D-dimery u těhotných bývají běžné. Byl zjištěn diastolický šelest nad aortální chlopní při nově vzniklé aortální regurgitaci, která se vyskytuje u disekcí ascendentní aorty až v 37 % [12]. Nakonec právě šelest vedl k určení diagnózy pomocí ultrazvuku. Přesto byla diagnóza stanovena za více než 24 hodin od počátku obtíží. K chybné prvotní diagnóze dochází až v 85 % případů [21].
Definitivní diagnóza musí být potvrzena dalšími vyšetřeními. V úvahu připadá ultrazvukové vyšetření srdce a velkých cév, CT hrudníku s eventuálním podáním kontrastní látky, angiografie a MR. Dostupnost MR vyšetření je malá, navíc pro stresovanou rodičku trvá vyšetření dlouho a v nevhodné poloze. CT je u těhotné ženy spojeno především s vysokou radiační zátěží a rizikovým i. v. podáním kontrastní látky, ale moderní CT přístroje mají skoro 100% senzitivitu a 98–99% specificitu [22]. Angiografie může být nezbytná k přesné diagnóze u disekce typu B. Pro typ A bývá dostatečné a nejsnáze dostupné ultrazvukové vyšetření, kde ale TTE vyžaduje jistou zkušenost k dosažení slušné senzitivity, senzitivita TTE 59–83% a specificita 63–93% [23]. TEE má oproti TTE vysokou senzitivitu i specificitu, čímž je ekvivalentní k CT vyšetření [24].
Důvodem nestandardního úvodu do CA byla nutnost důsledné kontroly vegetativní reakce na intubaci a kožní řez. Náhlý vzestup krevního tlaku, srdeční frekvence a srdečního výdeje by mohl vést k fatální komplikaci. Byla proto upřednostněna stabilita matky, eventuální útlum plodu byl připraven řešit přítomný neonatolog. Pro naše potřeby byl nejvhodnějším opiátem remifentanil, který je velmi potentním analgetikem a pro svůj ultrakrátký účinek je lehce řiditelný. Jako relaxans bylo použito nedepolarizující atracurium, výhodnějším mohlo být rocuronium ve vysoké dávce 1 mg/kg pro svůj rychlejší nástup účinku.
Po vybavení plodu je nutné nastolit dostatečný tonus dělohy s uzavřením jejích krvácejících cév. V našem případě jsme použili ihned po vybavení plodu kombinaci bolusového oxytocinu a methyl-ergometrinu. Po konzultaci s porodníkem jsme dále podávali podle potřeby karboprost 250 µg. Velmi potentním uterotonikem je karbetocin, který by byl v našem případě vhodný. V dostupné literatuře je informace o kontinuálním podávání oxytocinu od vybavení plodu až do druhého pooperačního dne [25].
Krevní ztráty během operace nebyly malé, ale v podobných kazuistikách detailněji uvedeny nejsou a porovnání je obtížné. Množství raných ploch (dvoudutinový výkon, kanylační vstupy pro MO) v kombinaci s plnou heparinizací vyžaduje neustálou peroperační pozornost anesteziologa. Vzhledem k velikosti ztráty by bylo vhodné použít rekuperátor krve, bohužel jsme ho neměli k dispozici.
Ve starší literatuře byla často prováděna hysterektomie před přistoupením k výkonu na aortě. Skoro všechny tyto případy ale byly prezentovány u žen s Marfanovým syndromem [26]. Mnoho článků o pacientkách bez významné vrozené vady či nějakého jasného predisponujícího faktoru není, ale postupně přibývají. Je to samozřejmě dáno velmi malou incidencí tohoto onemocnění. V recentnějších kazuistikách hysterektomie standardně prováděny nejsou.
Hysterektomie by měla být individuálně zvážena a s pacientkou prodiskutována. Obzvláště proto, že další těhotenství jí nebude doporučováno. Krevní ztráta může být fatální. V našem případě jsme se pokusili omezit krvácení Bakriho balonkem, které se ukázalo jako funkční. Samozřejmostí je podávání uterotonik podle potřeby. I přesto byl gynekolog připraven kdykoliv provést hysterektomii, pokud by krvácení bylo nezvladatelné. Dávka aktivovaného rekombinantního koagulačního faktoru VII byla připravena k podání. Nakonec ho nebylo potřeba.
Hysterektomie není nutná a lze i bez ní zvládnout tento náročný výkon při plné heparinizaci na mimotělním oběhu. Délka mimotělního oběhu bude ale velmi limitní. Pokud nebude výkon zvládnutelný v kratším či středně dlouhém čase, může být hysterektomie nutností.
Naše pacientka neměla v osobní ani rodinné anamnéze vrozenou vadu pojiva. Vyšetření tkáně aortální stěny nic takového neprokázalo. Sérologie na syfilis byla negativní a během těhotenství neměla zaznamenánu hypertenzi. Pravidelně chodila na kontroly ke svému gynekologovi.
Z uvedeného jasně vyplývá, jak nezastupitelnou úlohu během příprav k výkonu, operace i pooperační péče včetně komunikace a organizace všech účastných týmů má právě anesteziolog-intenzivista. Jen on zná práci a potřeby všech jednotlivých specialistů a je schopen je uvést do celkové problematiky peroperační i pooperační anesteziologicko-intenzivistické péče a podle toho s nimi optimalizovat průběh náročné kombinované terapie.
ZÁVĚR
Literatura není bohatá na kazuistiky těhotných, které nemají Marfanův syndrom. Důležité je, že přestože bývá klinický obraz u těhotných žen s disekcí aorty typický, často dochází k chybné diagnóze postavené na insuficientním fyzikálním vyšetření a přehlédnutí drobného nálezu, který by ke správné diagnóze navedl. Mortalita matky a dítěte s časem nebezpečně roste, proto je včasná a správná diagnóza kruciální pro prognózu těhotné i dítěte. Dostupnost ultrazvukových metod, které mají vysokou senzitivitu i specificitu, je v dnešní době dobrá. Všechny medicínské obory a výkony jsou a budou provázeny právě touto vyšetřovací metodou, a proto ji musíme i my v nemalé míře dobře ovládat. Ultrazvukové vyšetření minimálně zatěžuje těhotnou ženu, je dostupné, rychlé a levné. Máme-li diagnostikovánu akutní disekci u těhotné, musíme ji rychle a šetrně transportovat na specializované pracoviště za důsledné kontroly tlaku a oběhu. Další postup se odvíjí od gestačního stáří dítěte.
Zde více než jako fráze platí, jak nutná je kvalitní multidisciplinární spolupráce při záchraně dvou lidských životů.
Do redakce došlo dne 6. 3. 2014.
Do tisku přijato dne 4. 7. 2014.
Adresa pro korespondenci:
MUDr. Marian Leitgeb
Budovatelská 915
374 01 Trhové Sviny
e-mail: MLeitgeb@post.cz
Sources
1. Pitt, M. P., Bonser, R. S. The natural history of thoracic aortic aneurysm disease: an overview. Journal of Cardiac Surgery, 1997, 12, p. 270–278.
2. Zeebregts, C. J., Schepens, M. A., Hameeteman, T. M., Morshuis, W. J., Rivière, A. B. Acute Aortic Dissection Complicating Pregnancy. The Annals of Thoracic Surgery, 1997, 64, p. 1345–1348.
3. Vejvoda, J., Alan, D., Ošťádal, P. Disekce aorty. Intervenční a akutní kardiologie, 2005, 4, p. 159–165.
4. Manallo-Estrekka, P., Barker, A. E. Histopathologic findings in human aortic media assosiated with pregnancy. Archives of Pathology, 1967, 83, p. 336–341.
5. Wilson, S. K., Hutchins, G. M. Aortic dissection aneu-rysms: causative factors in 204 subjects. Archives of Pathology & Laboratory Medicine, 1982, 106, p. 175–180.
6. Thalmann, M., Sodeck, G. H., Domanovits, H., Grassberger, M., Loewe, C. H., Grimm, M., Czerny, M. Acute type A aortic dissection and pregnancy: A population-based study. European Journal of Cardio-thoracic Surgery, 2011, 39, p. 159–163.
7. ÚZIS ČR: Rodička a novorozenec 2012 [online]. Praha. Ústav zdravotnických informací a statistiky ČR, 2013 [cit. 2013-12-18]. Dostupné z WWW: http://www.uzis.cz/system/files/rodnov2012.pdf. ISBN 978-80-7472-087-1.
8. Thalmann, M., Sodeck, G. H., Domanovits, H. et al. Acute type A aortic dissection and pregnancy: A population-based study. European Journal of Cardiothoracic surgery, 2011, 39, p. 159–163.
9. Pineault, J., Ouimet, D., Pichette, V., Vallee, M. A case of an aortic dissection in a young adult: A refresher of the literature of this “great masquerader“. International Journal of General Medicine, 2011, 4, p. 889–893.
10. Vigil-De Gracia, P., Lasso, M., Ruiz, E., Vega-Malek, J. C., de Mena, F. T., López, J. C. Severe hypertension in pregnancy: hydralazin or labetalol: A randomized clinical trial. European Journal of Obstetrics and Gynecology and Reproductive Biology, 2006, 128, p. 157–162.
11. Morse, B. C., Boland, B. N., Morse, J. N., Jones, Y. R., Simpson, J. P., Appleby, D. A., Davis, B. R., Taylor, S. M. DeBakey Type II Aortic Dissection: A Rare Catastrophic Complication of Pregnancy. The American Surgeon, 2014, 80, 3, p. 79–81.
12. Yuan, S. M. Aortic dissection during pregnancy: a difficult clinical scenario. Clinical Cardiology, 2013, 36, 10, p. 576–584.
13. Shihata, M., Pretorius, V., MacArthur, R. Cardiac general repair of an acute type A aortic dissection combined with an emergency cesarean section in a pregnant woman. Interactive CardioVascular and Thoracic Surgery, 2008, 7, p. 938–940.
14. Sepehripour, A. H., Lo, T. T., Shipolini, A. R., McCormack, D. J. Can pregnant women be safely placed on cardiopulmonary bypass? Interactive CardioVascular and Thoracic Surgery, 2012, 15, p. 1063–1071.
15. Regitz-Zagrosek, V., Blomstrom, L. C., Borghi, C. et al. ESC guidelines on the management of cardiovascular diseases during pregnancy of the European Society of Cardiology. European Heart Journal, 2011, 32, p. 3147–3197.
16. Zitnik, R. S., Brandenburg, R. O., Sheldon, R., Wallace, R. B. Pregnancy and open heart surgery. Circulation, 1969, 39, 40, 1, p. 257–262.
17. Becker, R. M. Intracardiac surgery in pregnant women. The Annals of Thoracic Surgery, 1983, 36, p. 453–458.
18. Pomini, F., Mercogliano, D., Cavalletti, C., Caruso, A., Pomi-ni, P. Cardiopulmonary bypass in pregnancy. The Annals of Thoracic Surgery, 1996, 61, p. 259–268.
19. Reitman, E., Flood, P. Anaesthetic considerations for non-obstetric surgery during pregnancy. British Journal of Anaesthesia, 2011, 107 (S1), p. 72–78.
20. Horszczaruk, G. J., Roik, M. F., Kochman, J. et al. Aortic dis-section involving ostium of right coronary artery as the reason of myocardial infarction. European Heart Journal, 2006, 27, p. 518.
21. Mészáros, I., Mórocz, J., Szlávi, J. et al. Epidemiology and clinicopathology of aortic dissection. A population-based longitudinal study over 27 years. CHEST Journal, 2000, 117, p. 1271–1278.
22. Shiga, T., Wajima, Z., Apfel, C. C., Inoue, T., Ohe, Y. Diagnostic Accuracy of Transesophageal Echocardiography, Helical Computed Tomography, and Magnetic Resonance Imaging for Suspected Thoracic Aortic Dissection: Systematic Review and Meta-analysis. Archives of Internal Medicine, 2006, 166, 13, p. 1350–1356.
23. Meredith, E. L., Masani, N. D. Echocardiography in the emergency assessment of acute aortic syndromes. European Journal of Echocardiography, 2009, 10, p. 31–39.
24. Hiratzka, L. F., Bakris, G. L., Beckman, J. A., Bersin, R. M., Carr, V. F., Casey, D. E., Eagle, K. A., Hermann, L. K., Isselbacher, E. M., Kazerooni, E. A. et al. Guidelines for the Diagnosis and Management of Patients with Thoracic Aortic Disease. Journal of the American College of Cardiology, 2010, 55, 14, p. 27–129.
25. Ham, S. Emergency repair of Arotic Dissection in a 37-week parturient. AANA Journal, 2010, 78, p. 63–68.
26. Haas, S., Trepte, C., Rybczynski, M., Somville, T., Treede, H., Reuter, D. A. Type A aortic dissection during late pregnancy in a patient with Marfan syndrome. Canadian Journal of Anaesthesia, 2011, 58, p. 1024–1028.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2014 Issue 5-
All articles in this issue
- Intoxikace theofylinem – kazuistika a přehled literatury
- Nová perorální přímá antikoagulancia (NOAC) – jak řešit možné problémy s vyšetřením koagulace
- Opožděná manifestace traumatické ruptury bránice – kazuistika
- Transkraniální dopplerovská a barevná duplexní sonografie v intenzivní medicíně
- Vzájemná funkční závislost srdečních komor – i nejlepší sousedská spolupráce může selhat
- Doporučený postup diagnostiky a léčby srdeční tamponády
- Doporučený postup analgezie a sedace dospělých pacientů v intenzivní péči
- Náhrada nemajetkové újmy na zdraví podle nového občanského zákoníku
- Časná poporodní anestezie z pohledu studie OBAAMA-CZ– prospektivní observační studie
- Anesteziologický management během operace těhotné s akutní aortální disekcí
- Perioperační management císařského řezu u rodičky s Marfanovým syndromem – kazuistika a systematický přehled literatury
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nová perorální přímá antikoagulancia (NOAC) – jak řešit možné problémy s vyšetřením koagulace
- Intoxikace theofylinem – kazuistika a přehled literatury
- Doporučený postup analgezie a sedace dospělých pacientů v intenzivní péči
- Doporučený postup diagnostiky a léčby srdeční tamponády
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

