-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Inzulinová pumpa u diabetu 2. typu: léčba zaměřená na B-buňku
Insulin pump in type 2 diabetes: B-cell focused treatment
Type 2 diabetes is a disorder characterized by insulin resistance and progressive deterioration of B-cell insulin secretion. B-cell protective strategies for lowering glucolipotoxicity by rapid achievement of normoglycemia using exogenous insulin improve their function and prolong diabetes remission. Insulin pump is an effective treatment method in newly diagnosed diabetes, where even short-term pump therapy is B-cell protective. Combination therapy with insulin pump and antidiabetics targeting the incretin system acts in synergy to protect the B-cell. While the positive effect of insulin pump is apparent even a year after stopping the therapy, the effect of incretins lasts only while on the medication. Short-term insulin treatment, especially delivered by insulin pump, is an effective method of B-cell protection in recent type 2 diabetes.
Key words:
B-cell function – diabetes mellitus – insulin pump – insulin resistance – type 2 diabetes
Autoři: Klára Picková; Zdeněk Rušavý
Působiště autorů: I. interní klinika LF UK a FN Plzeň
Vyšlo v časopise: Vnitř Lék 2017; 63(6): 441-445
Kategorie: Přehledné referáty
Souhrn
Diabetes mellitus 2. typu je onemocnění charakterizované inzulinovou rezistencí a progresivní deteriorací sekrece inzulinu B-buňkami. Ochrana B-buněk snížením glukolipotoxicity rychlým dosažením normoglykemie pomocí exogenního inzulinu zlepšuje jejich funkci a prodlužuje remisi diabetu. Inzulinová pumpa je efektivní metodou léčby u nově diagnostikovaného diabetu, u kterého i krátkodobá léčba působí protektivně na B-buňky. Kombinační terapie inzulinovou pumpou a léky ovlivňujícími inkretinový systém působí synergicky na protekci B-buňky. Zatímco pozitivní efekt inzulinové pumpy přetrvává i rok po ukončení terapie, efekt inkretinů přetrvává pouze po dobu jejich užívání. Krátkodobá léčba inzulinem, nejlépe s použitím inzulinové pumpy, je efektivní technologická metoda protekce B-buněk u recentních diabetiků 2. typu.
Klíčová slova:
B-buňka – diabetes mellitus – diabetes mellitus 2. typu – inzulinová pumpa – inzulinová rezistenceÚvod
Diabetes mellitus 2. typu (DM2T ) je metabolické onemocnění, jehož rozvoj je podmíněn dysfunkcí B-buňky a přítomností inzulinové rezistence [1]. Přirozený průběh DM2T je charakterizován progresivním zhoršováním v čase, k němuž přispívají genetické, metabolické a terapeutické faktory. Poškození B-buněk pohání řada patofyziologických dějů, které se vzájemně potencují. Mezi nejvíce prozkoumané noxy patří glukotoxicita, lipotoxicita a zánět. Konečným stavem všech tří je hyperglykemie, jejíž přítomnost dále poškozuje B-buňku a pohání začarovaný kruh diabetogenního metabolického nastavení organizmu. Na poškození se podílí oxidační stres, stres endoplazmatického retikula, hypoxie a prozánětlivé cytokiny, které indukují apoptózu, autofagii, dediferenciaci buněk či zabraňují jejich proliferaci.
Poškození B-buněk u DM2T
Chronicky zvýšená hladina glykemie vede k oxidačnímu stresu, jehož reaktivní formy kyslíku zpětně poškozují B-buňku. Glukotoxicita je přítomna již měsíce či roky před manifestací DM2T [2], dlouhotrvající hyperglykemie přesto často uniká diagnóze. Mezi molekulární mechanizmy glukotoxického poškození patří tvorba reaktivních forem kyslíku (ROS – reactive oxygen species), hexosaminová cesta metabolizace glukózy, tvorba konečných produktů pokročilé glykace (AGEs – advanced glycation end products), aktivace proteinkinázy C (PKC) a rozvoj zánětu s depozicemi amyloidu v Langerhansových ostrůvcích [3]. V hodnotách do 10 mmol/l B-buňky responzivně produkují inzulin – na hyperglykemii reagují produkcí inzulinu. Při vyšších glykemiích funkční kapacita B-buněk klesá, klesá tolerance glukózy a B-buňky jsou hyperglykemií poškozovány.
Vedle glukotoxicity se v progresi DM2T uplatňuje i škodlivý metabolický efekt lipidů, označovaný jako lipotoxicita. Ta je spojena s obezitou a inzulinovou rezistencí. Jejich přítomnost společně indukuje stres endoplazmatického retikula, přispívá k mitochondriální dysfunkci a pro-apoptotickými signály vede ke zvýšené degradaci proinzulinu [4]. Spolu s reaktivními formami kyslíku tvoří hybné síly stojící za apoptózou mitochondrií vedoucí k funkčnímu poškození B-buněk. Toxické působení nadměrného množství glukózy a lipidů je souhrnně označováno jako glukolipotoxicita [5,6].
Třetím významným negativně působícím faktorem je inflamace ostrůvků, která se objevuje již v počátcích DM2T [7]. Prozánětlivými mechanizmy podílejícími se na rozvoji zánětu spojeného s časnou dysfunkcí B-buněk jsou zvýšený příjem kalorií, dysfunkce tukové tkáně s hypertrofií adipocytů a dysfunkce imunitního systému. Post-mortem analýzy pankreatů osob s DM2T odhalily zvýšené množství makrofágů a NK buněk (přirození zabíječi – natural killer cells), jejichž podoba připomíná zánětlivý proces vyskytující se u diabetu 1. typu, ačkoliv u DM2T je etiopatogenetický scénář odlišný a postrádá autoimunitní složku typickou pro diabetes 1. typu, u kterého je ostrůvkový zánět podmíněn autoimunitně. U DM2T je zánět primárně asociován s glukolipotoxicitou. Konečný stav poškození B-buněk je však u obou typů diabetu podobný, ačkoliv zánětlivý proces B-buňky začíná z různých příčin a využívá rozdílné mechanizmy. Všechny příčiny selhání B-buňky v odpovědi na stimulaci glukózou vedou k rozvoji hyperglykemie. Ta amplifikuje poškození Langerhansových ostrůvků a zejména B-buněk, které následně ztrácejí schopnost tvořit inzulin. Tento pohled dal základ konceptu nové klasifikace diabetes mellitus zaměřené na B-buňku, který v roce 2016 představil Schwartz [8].
Léčba inzulinem u DM2T a ochrana B-buňky
Glukotoxicita a další patofyziologické procesy u DM2T vedou k progresivní ztrátě masy B-buněk [9,10] a k rychlé deterioraci jejich funkce [11]. Léčba inzulinem dokáže velmi rychle nastolit normoglykemii a zastavit tak působení glukolipotoxicity. Žádné jiné z dalších současně používaných perorálních či injekčních antidiabetik nedokáže tak rychle upravit glukolipotoxicitu jako inzulin, který je u pacientů s DM2T schopen normalizovat glykemie nalačno i postprandiální glykemie během jednoho týdne [12].
Podle současných guidelines je možnost zahájit léčbu inzulinem doporučena při hladině glykovaného hemoglobinu > 53 mmol/mol po 6 měsících terapie metforminem [13]. Naprostá většina diabetologů však léčbu inzulinem zahajuje mnohem později. Typický průběh léčby DM2T je iniciální zlepšení po zaléčení při záchytu choroby, následné opakované zhoršování a zlepšování kompenzace při úpravě či intenzifikaci farmakoterapie. Pacient při neuspokojivé kompenzaci obvykle dospěje k inzulinoterapii až po 6–7 letech trvání diabetu [14], při průměrném glykovaném hemoglobinu 75 mmol/mol. Rezistence k zahájení léčby inzulinem leží na straně lékaře i pacienta. Pro lékaře to znamená více práce s edukací a obavu z rizika rozvoje hypoglykemií, pro pacienta nutnost léčby inzulinem pomyslně představuje vlastní selhání a obavy z významného životního omezení. Plným odůvodněním časné inzulinoterapie u DM2T je rychlá úprava glukolipotoxicity. Časné zahájení léčby inzulinem je kromě normalizace glykemického profilu spojeno s dalšími benefity. Zlepšuje se funkce B-buňky, mimo jiné právě díky snížení glukolipotoxicity. Dochází ke zlepšení inzulinové rezistence. Upravuje se lipidový profil a zvyšuje se pacientova kvalita života – i přes to, že si musí aplikovat lék injekčně.
Příznivý efekt časné, i krátkodobé léčby inzulinem u nově diagnostikovaných pacientů s DM2T na délku remise diabetu ukázala čínská studie [12], v níž bylo 382 pacientů s recentně zachyceným DM2T randomizováno do skupin s infuzní subkutánní inzulinovou pumpou (CSII – continuous subcutaneous insulin infusion), s intenzivní inzulinovou léčbou (MDI – multiple daily injections) či s perorálními antidiabetiky (PAD). Pacienti byli léčeni tak dlouho, dokud nebylo dosaženo normoglykemie po dobu 2 týdnů. Následně byli sledováni pouze na režimových opatřeních. Na léčbě inzulinovou pumpou dosáhlo normoglykemie 97 % pacientů za 4 dny, na MDI 95 % pacientů za 6 dní a na PAD pouze 84 % pacientů za průměrných 9 dní. U pacientů s inzulinovou léčbou došlo ke zlepšení akutní fáze sekrece inzulinu. Po roce sledování byla inzulinová odpověď udržena i ve skupinách v úvodu léčených inzulinem, ovšem nikoliv u skupiny s PAD. V remisi po roce bez léčby zůstalo 51,1 % pacientů na CSII, 44,9 % na MDI a pouze 26,7 % na PAD. Z toho lze usuzovat, že užitá PAD (v této studii byl užit dle vstupního BMI a reakci na léčbu gliklazid, metformin či jejich kombinace) nepůsobí na rozdíl od inzulinu protektivně na sekreční schopnost B-buňky.
Studie Zenga et al porovnávala efekt léčby CSII či pouze bazálním inzulinem na kompenzaci DM2T a funkci B-buněk. Oba režimy byly z hlediska zlepšení funkce B-buněk i lačné glykemie srovnatelné, skupina pacientů aplikujících bazální inzulin měla nižší celkovou dávku inzulinu a jednodušší aplikační režim [15]. Léčba inzulinem v režimu pouze bazálního inzulinu se z tohoto pohledu nabízí jako srovnatelně efektivní, snazší a levnější varianta časné inzulinoterapie u DM2T. Je důležité identifikovat pacienty, kteří budou z časné léčby inzulinem nejpravděpodobněji profitovat. Retnakaran a Zinman rozdělili faktory předpovídající nastolení dlouhodobé euglykemie při léčbě inzulinem do 3 kategorií [16]: faktory vyskytující se vstupně, faktory objevující se během léčby inzulinem a faktory post-terapeutické. Vstupní faktory předpovídající dobrou odpověď na inzulinoterapii jsou lepší glykemická kontrola, vyšší BMI, vyšší inzulinemie a kratší doba trvání diabetu.
Léčba inzulinovou pumpou u DM2T
Inzulinová pumpa nepatří mezi běžné metody léčby DM2T. Stále častěji se však objevují práce, které dokádají její efektivitu u těchto pacientů. Léčba CSII sama o sobě zvyšuje u pacientů s DM2T kvalitu života a spokojenost s léčbou [17]. Dalším faktorem asociovaným s úspěchem terapie je pacientův přístup k diabetu – pacienti s pozitivním přístupem k nemoci udrží remisi po krátkodobé terapii CSII déle než pacienti s nízkým skóre pozitivního vnímání diabetu. Tento faktor může být významně ovlivněn systematickou edukací, která je pro pacienta léčeného CSII, byť i krátkodobě, neopominutelná.
Stěžejní prací podporující využití inzulinové pumpy u DM2T je studie OPT2MISE [18]. Jedná se o randomizovanou open-label kontrolovanou studii, jejímž primárním cílem bylo snížení glykemie a HbA1c u pacientů s déletrvajícím DM2T. Po 15 týdnech léčby klesl HbA1c z 75 na 63 mmol/mol, výsledek byl statisticky významně odlišný od vývoje pacientů na MDI režimu. Po 27 týdnech trvání studie byli pacienti na léčbě MDI převedeni na CSII léčbu a během krátké doby došlo ke zlepšení glykemické kontroly i u nich. Podle studie OPT2MISE je dobrá kompenzace diabetu závislá nejen na podávané látce (inzulin), ale zejména na režimu její aplikace (inzulinová pumpa). Studie OPT2MISE, podobně jako ostatní studie, však sledovala pouze tradiční cíle kompenzace (HbA1c, tělesná hmotnost, hypoglykemie) a nehodnotila samotnou funkci B-buněk.
Léčba CSII může být úspěšná i u pacientů s již nějakou dobu trvajícím DM2T. Choi et al ukázali, že za 30 měsíců léčby CSII dosáhne více než 50 % neoptimálně kompenzovaných pacientů s DM2T HbA1c 48 mmol/mol či nižší [19]. U pacientů s DM2T dochází na terapii CSII k významnějšímu zlepšení HbA1c než u pacientů s diabetem 1. typu, u nichž je hlavní limitací dobré kompenzace frekvence výskytu hypoglykemií. Inzulinová pumpa je léčebnou možností pacientů s DM2T jakkoliv dlouhého trvání nemoci, kdy může pomoci předejít či zvrátit progresivní deterioraci kompenzace.
Kombinační terapie k podpoře B-buňky
U DM2T jen zřídkakdy stačí k dobré kompenzaci monoterapie. Z patofyziologického hlediska je zajímavý koncept kombinace CSII s léky působící na GLP1 systém (GLP – glucagon-like peptide), ať již agonisty GLP1 receptoru či DPP4 inhibitory (DPP – dipeptidyl peptidáza). CSII pomáhá restaurovat funkci B-buněk, které jsou tak více responzivní na podání gliptinů. Větší výkonnost B-buněk ve smyslu schopnosti secernovat dostatečné množství prandiálního inzulinu následně snižuje potřebu exogenního inzulinu.
Studie LIBRA testovala koncept léčby agonistou GLP1 receptoru liraglutidem po úvodní 4týdenní léčbě inzulinovou pumpou u pacientů s krátce trvajícím DM2T. Zlepšení funkce B-buněk navozené inzulinem bylo u pacientů léčených nadále liraglutidem uchováno po celou dobu užívání medikace, 2 týdny po ukončení léčby byl však efekt liraglutidu ztracen [20]. Příznivé výsledky byly pozorovány i u placebem kontrolované studie sledující efekt kombinační léčby CSII + liraglutidem. Při úvodní léčbě CSII dostávala aktivní skupina 0,6 mg liraglutidu a po 2týdenní periodě normoglykemií byla léčba CSII ukončena a skupina pokračovala 12týdenní léčbou 1,2 mg liraglutidu. Liraglutid urychlil nastolení euglykemie v úvodní fázi a zlepšil akutní fázi inzulinové odpovědi. V aktivní větvi byl i trend k nižšímu HbA1c na konci studie. Stejně jako u předchozí studie, i zde došlo velmi krátce po ukončení podávání liraglutidu ke zhoršení funkce B-buněk a zvýšení glykemie nalačno [21]. Podobné výsledky byly pozorovány i u podávání exenatidu, jehož podávání souběžně s CSII během týdenní hospitalizace dokázalo i při zvýšené glykemické variabilitě zlepšit funkci B-buněk u špatně kompenzovaných pacientů s DM2T [22].
Několik prací ukázalo, že sitagliptin v kombinaci s CSII vede k lepší kompenzaci DM2T u nově diagnostikovaných pacientů než CSII samotná. Na kombinační, byť jen krátkodobé, léčbě CSII + sitagliptin dochází ke zlepšení glykemie nalačno, glykemické variability, zvýšení citlivosti na inzulin a zvýšení hladin C-peptidu po stimulaci glukózou [23–25].
Závěr
Klasické parametry kompenzace diabetu, jako je HbA1c, nedokáží postihnout dlouhodobý stav B-buněk a teprve ve chvíli, kdy je jejich funkční kapacita nevratně ztracena, se tento nedostatek projeví na vzestupu HbA1c. Glykovaný hemoglobin jako ukazatel dlouhodobé kompenzace diabetu neříká mnoho o funkci B-buněk a o tom, zda v těle člověka s DM2T neprobíhá akcelerace procesu ničení B-buněk a jejich reziduální funkce. Glykovaný hemoglobin tak ukazuje pouze retrospektivní kompenzaci, ovšem nedokáže predikovat vývoj kompenzace diabetu do budoucna. Doplňující metody, jako posouzení průběhu glykemické křivky spolu s objektivní kvantifikací masy a funkce B-buněk by dokázaly lépe klinicky posoudit funkční stav pacienta s DM2T.
V dosud provedených studiích, jejichž cílem byla ochrana B-buňky s pomocí krátkodobé léčby inzulinovou pumpou, samotné či v kombinaci s léky ovlivňujícími inkretinový systém, bylo k posouzení funkce B-buněk použito hodnocení první fáze inzulinové sekrece po stimulaci glukózou, míra glykemické remise po 1 roce od zahájení studie (počet pacientů bez nutnosti medikace či intenzifikace léčby) a indexy charakterizující glukózovou homeostázu a inzulinovou rezistenci, jako např. HOMA-B, HOMA-IR, ISSI-2 či PI/IRI. Glykovaný hemoglobin, přestože byl v některých studiích sledován jako parametr kompenzace diabetu, nebyl vyhodnocen jako vhodný ukazatel samotné funkce B-buněk (tab).
Tab. 1. Přehled studií sledujících intenzifikovaný inzulinový režim (CSII či MDI) ev. v kombinaci s inkretinovou léčbou (DPP4 inhibitory, agonisté GLP1 receptoru) v léčbě DM2T 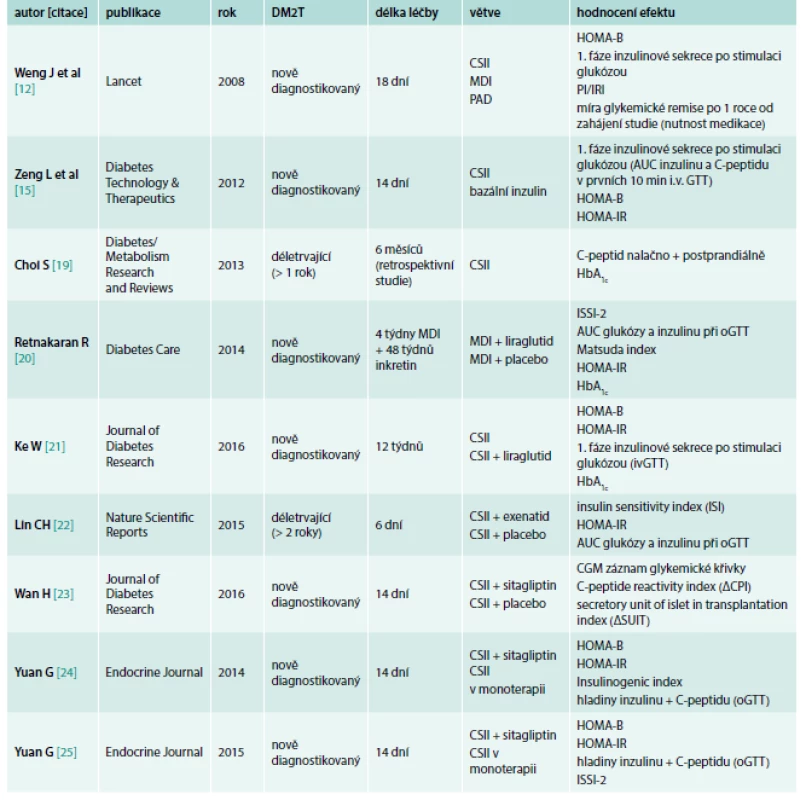
U nově diagnostikovaných, ale i déle léčených pacientů s DM2T by měla být prioritou nejen dobrá kompenzace diabetu, ale zejména ochrana B-buňky. Zatímco k ochraně B-buňky je dobrá glykemická kontrola nezbytná, k dosažení dobrých glykemií bývají někdy používány léky, které samotnou B-buňku vyčerpávají. Inzulinoterapie patří mezi nejefektivnější metody léčby DM2T a její využití na samotném začátku nemoci může snížit glukotoxicitu, lipotoxicitu a systémový zánět a pomoci zregenerovat B-buňky. Zejména intenzifikovaný inzulinový režim ve formě CSII, i krátkodobě aplikovaný, vede k ochraně B-buňky a předpovídá dobrou kompenzaci v prvních letech trvání diabetu. Inzulinová pumpa je nástrojem ke zlepšení metabolické kontroly, ale jen velmi vzácně je využívána jako nástroj prevence selhání B-buňky. Na tomto konceptu je založená myšlenka využití technologií u DM2T k ochraně B-buněk. Řada prací ukázala, že i krátkodobá terapie inzulinem a zejména inzulinovou pumpou u DM2T může pomoci navrátit a udržet remisi i déle než rok po diagnóze. Kombinační terapie, především s antidiabetiky působícími na GLP1 systém, pomáhá optimalizovat metabolické nastavení DM2T při inzulinoterapii. Nastolení normoglykemie ochraňuje a restauruje B-buňky a jejich schopnost reagovat na výkyvy hladiny krevního cukru produkcí inzulinu.
MUDr. Klára Picková
carbohydrated@gmail.com
I. interní klinika LF UK a FN Plzeň
www.fnplzen.cz
Doručeno do redakce 23. 4. 2017
Přijato po recenzi 19. 6. 2017
Zdroje
1. Reznik Y Continuous subcutaneous insulin infusion (CSII) using an external insulin pump for the treatment of type 2 diabetes. Diabetes Metab 2010; 36(6 Pt 1): 415–421. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabet.2010.08.002>.
2. Tabak AG, Jokela M, Akbaraly TN et al. Trajectories of glycaemia, insulin sensitivity, and insulin secretion before diagnosis of type 2 diabetes: an analysis from the Whitehall II study. Lancet 2009; 373(9682): 2215–2221. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(09)60619-X>.
3. Bensellam M, Laybutt DR, Jonas JC. The molecular mechanisms of pancreatic β-cell glucotoxicity: Recent findings and future research directions. Mol Cell Endocrinol 2012; 364(1–2):1–27. Dostupné z DOI: <http://dx.doi.org/10.1016/j.mce.2012.08.003>.
4. Back SH, Kaufman RJ. Endoplasmic Reticulum Stress and Type 2 Diabetes. Annu Rev Biochem 2012; 81 : 767–793. Dostupné z DOI: <http://dx.doi.org/10.1146/annurev-biochem-072909–095555>.
5. Poitout V, Robertson RP. Glucolipotoxicity: Fuel Excess and β-Cell Dysfunction. Endocr Rev 2008; 29(3): 351–366. Dostupné z DOI: <https://doi.org/10.1210/er.2007–0023>.
6. Poitout V, Amyot J, Semache M et al. Glucolipotoxicity of the pancreatic beta cell. Biochim Biophys Acta 2010;1801(3): 289–298. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bbalip.2009.08.006>.
7. Marzban L. New Insights Into the Mechanisms of Islet Inflammation in Type 2 Diabetes: Figure 1. Diabetes [online] 2015; 64(4): 1094–1096. Dostupné z DOI: <http://dx.doi.org/10.2337/db14–1903>.
8. Schwartz SS, Epstein S, Corkey BE et al. The Time Is Right for a New Classification System for Diabetes: Rationale and Implications of the β-Cell–Centric Classification Schema. Diabetes Care [online] 2016; 39(2): 179–186. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15–1585>.
9. Matveyenko AV, Butler PC. Relationship between β-cell mass and diabetes onset. Diabetes Obes Metab 2008 Nov;10 Suppl 4 : 23–31. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1463–1326.2008.00939.x>.
10. Meier JJ, Bonadona RC. Role of Reduced-Cell Mass Versus Impaired-Cell Function in the Pathogenesis of Type 2 Diabetes. Diabetes Care 2013; 36(Suppl2): S113-S119. Dostupné z DOI: <http://dx.doi.org/10.2337/dcS13–2008>.
11. Defronzo RA, Eldor R, Abdul-Ghani M. Pathophysiologic Approach to Therapy in Patients With Newly Diagnosed Type 2 Diabetes. Diabetes Care 2013; 36(Suppl 2): S127-S138. Dostupné z DOI: <http://dx.doi.org/10.2337/dcS13–2011>.
12. Weng J, Yanbing LI, Wen XU et al. Effect of intensive insulin therapy on β-cell function and glycaemic control in patients with newly diagnosed type 2 diabetes: a multicentre randomised parallel-group trial. Lancet 2008; 371(9626): 1753–1760. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(08)60762-X>.
13. Škrha J. Doporučený postup péče o diabetes mellitus 2. typu. DMEV 2016; 19(2): 48–56.
14. Khunti K, Wolden ML, Thorsted BL et al. Clinical Inertia in People With Type 2 Diabetes: A retrospective cohort study of more than 80,000 people. Diabetes Care 2013; 36(11): 3411–3417. Dostupné z DOI: <http://dx.doi.org/10.2337/dc13–0331>.
15. Zeng L, Lu H, Deng H et al. Noninferiority Effects on Glycemic Control and β-Cell Function Improvement in Newly Diagnosed Type 2 Diabetes Patients: Basal Insulin Monotherapy Versus Continuous Subcutaneous Insulin Infusion Treatment. Diabetes Technol Ther 2012; 14(1): 35–42. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2011.0123>.
16. Retnakaran R, Zinman B. Short-term intensified insulin treatment in type 2 diabetes: long-term effects on β-cell function. Diabetes Obes Metab 2012; 14(Suppl 3): S161–S166. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1463–1326.2012.01658.x>.
17. Reznik Y, Cohen O. Insulin Pump for Type 2 Diabetes: Use and misuse of continuous subcutaneous insulin infusion in type 2 diabetes. Diabetes Care 2013; 36(Suppl 2): S219-S225. Dostupné z DOI: <http://dx.doi.org/10.2337/dcS13–2027>.
18. Reznik Y, Cohen O, Aronson R et al. Insulin pump treatment compared with multiple daily injections for treatment of type 2 diabetes (OpT2mise): a randomised open-label controlled trial. Lancet 2014; 384(9950): 1265–1272. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(14)61037–0>.
19. Choi SB, Lee JH, Kim S et al. Improvement of β-cell function after achievement of optimal glycaemic control via long-term continuous subcutaneous insulin infusion therapy in non-newly diagnosed type 2 diabetic patients with suboptimal glycaemic control. Diabetes Metab Res Rev 2013; 29(6): 473–482. Dostupné z DOI: <http://dx.doi.org/10.1002/dmrr.2416>.
20. Retnakaran R, Kramer CK, Choi H et al. Liraglutide and the Preservation of Pancreatic β-Cell Function in Early Type 2 Diabetes: The LIBRA Trial. Diabetes Care 2014; 37(12): 3270–3278. Dostupné z DOI: <http://dx.doi.org/10.2337/dc14–0893>.
21. Ke W, Liu L, Liu J et al. Effects of Liraglutide Combined with Short-Term Continuous subcutaneous Insulin Infusion on Glycemic Control and Beta Cell Function in Patients with Newly Diagnosed Type 2 Diabetes Mellitus: A Pilot Study. J Diabetes Res 2016; 2016 : 6839735. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/6839735>.
22. Lin CH, Hsieh SH, Sun JH et al. Glucose Variability and β - Cell Response by GLP-1 Analogue added-on CSII for Patients with Poorly Controlled Type 2 Diabetes. Sci Rep 2015; 5 : 16968. Dostupné z DOI: <http://dx.doi.org/10.1038/srep16968>.
23. Wan H, Zhao D, Shen J et al. Comparison of the Effects of Continuous Subcutaneous Insulin Infusion and Add-On Therapy with Sitagliptin in Patients with Newly Diagnosed Type 2 Diabetes Mellitus. J Diabetes Res 2016; 2016 : 9849328. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/9849328>.
24. Yuan G, Jia J, Zhang C et al. Safety and efficacy of sitagliptin in combination with transient continuous subcutaneous insulin infusion (CSII) therapy in patients with newly diagnosed type 2 diabetes. Endocr J 2014; 61(5): 513–521. Dostupné z WWW: <https://www.jstage.jst.go.jp/article/endocrj/61/5/61_EJ13–0483/_pdf>.
25. Yuan G, Hu H, Wang S et al. Improvement of β-cell function ameliorated glycemic variability in patients with newly diagnosed type 2 diabetes after short-term continuous subcutaneous insulin infusion or in combination with sitagliptin treatment: a randomized control trial. Endocr J 2015; 62(9): 817–834. Dostupné z DOI: <http://dx.doi.org/10.1507/endocrj.EJ15–0160>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Screening potomků osob s časnou manifestací ICHS – editorial
- Je konečně na řadě primární prevence kardiovaskulárních onemocnění? – editorial
- Význam metabolitů vitaminu D a správnost jejich stanovení – editorial
- Testikulární lymfomy – editorial
- Trombóza a malignita – editorial
- Prediktory kvality života u českých pacientek po léčbě karcinomu prsu se zaměřením na dovednosti zvládání zátěže
- Rizikové faktory kardiovaskulárních onemocnění u potomků nemocných po časném infarktu myokardu
- Úskalia stanovenia vitamínu D
- Klinická štúdia FOURIER
- Primární testikulární lymfomy
- Rivaroxaban u rizikových pacientů
- Dva pohľady na venózny tromboembolizmus u onkologických pacientov
- Inzulinová pumpa u diabetu 2. typu: léčba zaměřená na B-buňku
- Kardiovaskulární mortalita u diabetu
-
Účinnost a bezpečnost dabigatranu při podávání dle SPC a evropských doporučení
Komentář k článku Patient outcomes using the European label for dabigatran - Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Primární testikulární lymfomy
- Inzulinová pumpa u diabetu 2. typu: léčba zaměřená na B-buňku
- Úskalia stanovenia vitamínu D
- Dva pohľady na venózny tromboembolizmus u onkologických pacientov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



