-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
To salt or not to salt in kidney diseases? Not more than quantum satis!
The salt intake in former Czechoslovakia is twice as high as recommended 5 g/24 hours, which corresponds to 85 mmol//24 hours of sodium in the urine. In the population, the systemic blood pressure level correlates with a urinary excretion of sodium/24 hours. On the other hand, limited salt intake decreases blood pressure in salt-sensitive hypertensive patients. Albuminuria also positively correlates with a salt intake in the population. In patients with renal disease, a diet with low salt content suppresses proteinuria, and, in contrast, proteinuria is elevated with increased salt intake. The positive influence of the decreased salt intake on the progression of renal insufficiency was confirmed in many experimental studies. However, in humans, this finding was not unequivocally established in control randomized studies. The high salt intake worsens metabolic acidosis in patients with renal insufficiency. Salt is detrimental to the kidneys either by increased systemic and intraglomerular blood pressures or by pressure independent mechanisms of the tissue injury, which are mediated by a higher sodium concentration. The present knowledge concerning the relationship between sodium intake and extracellular fluid volume probably will be modified in light of new discoveries about the osmotically inactive sodium. The public enlightenment and medical application of these new findings related to harmful effects on an inappropriate salt intake in treatment of the kidney disease and in other fields of medicine is strongly desirable.
Key words:
salt – sodium – nephropathy – progression – acid base balance
Autoři: K. Matoušovic 1; Ľ. Podracká 2
Působiště autorů: Interní klinika 2. lékařské fakulty UK a FN Motol Praha, přednosta prof. MUDr. Milan Kvapil, CSc., MBA 1; I. klinika detí a dorastu UPJŠ LF a DFN Košice, Slovenská republika, prednostka prof. MUDr. Ľudmila Podracká, CSc. 2
Vyšlo v časopise: Vnitř Lék 2012; 58(7 a 8): 66-70
Kategorie: 80. narozeniny prof. MUDr. Miroslava Mydlíka, DrSc.
Souhrn
Příjem soli v bývalém Československu dvojnásobně převyšuje doporučovaných 5 g/24 hod, což odpovídá 85 mmol/24 hod natria v moči. Úroveň krevního tlaku v populaci přímo koreluje s množstvím natria vyloučeného do moči/24 hod a omezení příjmu soli sníží krevní tlak u části hypertoniků. S příjmem soli v populaci také přímo koreluje albuminurie. Omezení soli v dietě u pacientů s onemocněním ledvin proteinurii sníží a naopak při zvýšeném příjmu proteinurie stoupá. Pozitivní vliv sníženého příjmu soli na postup renální nedostatečnosti byl potvrzen řadou experimentálních studií, u člověka však dosud nebyl tento efekt jednoznačně potvrzen randomizovanými studiemi. Vysoký příjem soli prohlubuje metabolickou acidózu u pacientů s renální insuficiencí. Sůl poškozuje ledviny jednak mechanizmem vyššího systémového krevního tlaku a zvýšeného tlaku uvnitř glomerulárních kapilár, jednak přímým poškozením tkáně, zejména cév, zprostředkovaným vyšší koncentrací natria. Názory na vztah mezi příjmem natria a objemem extracelulární tekutiny bude třeba upřesnit ve světle nových poznatků o osmoticky neaktivním natriu. Osvětová činnost a medicínské uplatnění nových znalostí o škodlivosti nadměrného příjmu soli při léčbě ledvinových chorob i v jiných oblastech lékařství je velmi žádoucí.
Klíčová slova:
sůl – natrium – nefropatie – progrese – acidobazická rovnováhaHistorické poznámky
Kuchyňská sůl, chlorid sodný (NaCl, Mr 58,443), jako součást potravy, provází život člověka po dlouhá tisíciletí. Slané, spolu se sladkým, hořkým a kyselým patří mezi základní chuťové vjemy a sůl jako produkt je známa člověku již více než 8 000 let. Sehrála významnou roli v historii lidstva nejen z hlediska vývojového, ale i společenského. Byla součástí darů v egyptských hrobkách, činila část odměny vojákům armád (odtud „salary“) a často se cituje i to, že snaha o zrušení tzv. solné daně byla jedním z motivů vzpoury Indů proti anglické nadvládě, která začala jako tzv. Dandy March pod vedením Mahátma Gandího (12. 3. 1930).
Denní příjem
Z hlediska biologického je pozoruhodné, jak spolu s fylogenezí člověka narůstá spotřeba soli v potravě. Naši předkové, kteří se živili sběrem (asi před 107 roky) požívali jen zlomek gramu za den, spotřeba poněkud stoupla (asi na 1 g), když se živili lovem (asi před 106 roky) a významně vzrostla poté, co byly objeveny konzervační schopnosti soli (již ve starověkém Egyptě). Další vzestup příjmu nastal v posledních desetiletích v souvislosti se zvýšenou konzumací průmyslově vyráběných potravin, kdy se bez ohledu na poznatky o škodlivosti nadměrného příjmu soli využívá jejích konzervačních vlastností k prodloužení trvanlivosti výrobků, což nepochybně a zřejmě významně zvyšuje výskyt srdečních a jiných onemocnění.
V našich podmínkách činí příjem soli asi 2násobek doporučeného množství, tedy 10–12 g/den. Jelikož 1 g soli obsahuje 17,1 mmol natria a 17,1 mmol chloru, odpovídá to 3,9 g natria a 6,1 g chloru. Je-li člověk při tomto příjmu v iontové a vodní rovnováze, vyloučí do moči 170 (až 200) mmol natria za 24 hod. Jelikož se naprostá většina natria vylučuje močí, odpovídá, za předpokladu rovnovážné bilance, vyloučené množství dennímu příjmu a většina bilančních studií o soli je založena na tomto principu.
Je nepochybné, že člověk přijímá v potravě více soli, než potřebuje [1]. Fyziologická potřeba je 10–20 mmol/24 hod, v mnoha částech světa však denní příjem překračuje 200 mmol/24 hod. Nadměrné množství soli požívají i děti a podle jedné studie činil příjem natria u dětí starších 5 let více než 100 mmol/24 hod a stoupal s věkem [1]. Minimální doporučené množství soli pro děti do 1 roku života je 0,6 g/24 hod a pro 2–6leté 0,8 g/24 hod. Existuje shoda v tom, že doporučené množství soli v potravě u zdravého dospělého člověka by mělo být 5–6 g/den, což odpovídá 85–92 mmol natria [2].
Natrium a extracelulární tekutina
Klasické nazírání na vztah mezi koncentrací natria a objemem extracelulární tekutiny (ECT) je založeno na představě, že objem ECT je determinován množstvím natria přítomného v ECT, tedy že akumulace natria vede nevyhnutelně ke zvětšení objemu ECT. Důsledkem je mj. vzestup minutového srdečního výdeje a vzestup krevního tlaku. Podle Guytonovy teorie („pressure-natriuresis theory“) [3] je dalším krokem zvýšená natriuréza, čímž se postupně znormalizuje objem ECT a také krevní tlak. Je-li tato rovnováha porušena, fixuje se vazokonstrikce, potřebná k vzestupu natriurézy, a rozvíjí se hypertenze. Novější studie však ukázaly, že akumulace natria v organizmu není nutně spojena se zvýšením objemu ECT [4]. Zjistilo se totiž, že rezervoár osmoticky neaktivního natria je lokalizován zejména v podkoží, kde proteoglykany a glykosaminoglykany jsou schopny vázat natrium a tím anulovat jeho osmotickou aktivitu. Toto osmoticky neaktivní natrium umožňuje organizmu reagovat na změny jeho přísunu tím, že při zvýšeném příjmu se sem ukládá a při nedostatečném příjmu se odtud uvolňuje, aniž se mění objem ECT [5–8]. To se jeví jako užitečný mechanizmus umožňující zvládnout neadekvátní nálož soli, která je nám předkládána zejména v průmyslově vyráběných potravinách. Zdá se ovšem, že kapacita tohoto zásobníku osmoticky neaktivního natria může být překročena a rozvíjí se reakce, které vedou k regresivním změnám v podkoží a jiných tkáních a v konečném výsledku ke sklerotizaci tkáně. Alespoň jednou z příčin těchto změn je novotvorba lymfatických cév a influx leukocytů s následnou tvorbou zánětotvorných látek, jako např. VEGF C (vascular endothelial growth factor C). Obdobný proces se může rozvinout i v ledvinách či v myokardu.
Vylučování natria ledvinami
Při normální glomerulární filtraci (2 ml/s) a sérové hladině natria 140 mmol/l se každou vteřinu odfiltrují do primární moči 3 mmol natria, tj. asi 25 000 mmol/24 hod. Toto množství odpovídá asi 1,5 kg soli (roční spotřeba soli je asi 4 kg). Denní množství požité soli činí asi 10 g/den (170 mmol/den). Za předpokladu rovnovážného stavu mezi příjmem a výdejem se celé odfiltrované množství, s výjimkou množství přijatého v potravě (170 mmol/24 hod), v tubulech vstřebá. Frakční exkrece natria je tedy při normální glomerulární filtraci méně než 1 %. Z odfiltrovaného množství se 60 % resorbuje v proximálním tubulu, 30 % v ascendentním raménku Henleovy kličky, 7 % v distálním stočeném kanálku a 2–3 % ve sběrném kanálku. Vyloučí se tedy méně než 1 %. Navzdory tomu, že se v distálním tubulu resorbuje poměrně malý podíl z odfiltrovaného množství natria, je tato část nefronu rozhodující pro regulaci jeho metabolizmu.
Sůl a acidobazická rovnováha
Experimentálně bylo zjištěno, že u potkanů s redukovaným parenchymem ledvin a progredující renální insuficiencí je nižší příjem soli spojen se zvýšenou hladinou sérového bikarbonátu [9]. Vysvětlení je zřejmé z obr. 1. Přidáme-li do ECT fyziologický roztok, nezmění to elektroneutralitu, ale koncentrace HCO3– poklesne. Je to tím, že se zvětšil objem ECT, a proto se HCO3– (i další ionty) „naředil“. K podobné změně dochází po požití soli. V tomto případě se vstřebá Na+ a Cl– v poměru 1 : 1, stoupne osmolalita ECT a z intracelulární tekutiny (ICT) se do ECT přesouvá voda až do té doby, než se osmolality obou kompartmentů vyrovnají. Opět tedy poklesne koncentrace HCO3– a vnitřní prostředí se okyselí. Roztok soli je tudíž z hlediska ECT kyselý a p.o. přísun soli či infuze fyziologického anebo jinak koncentrovaného roztoku soli vnitřní prostředí acidifikuje (obr. 1). Schematicky např. po přidání 20 mmol soli na litr ECT s normální koncentrací Na+ a Cl– (tedy 140, resp. 100 mmol/l) by stoupla koncentrace Na+ na 160 mmol/l a koncentrace Cl– na 120 mmol/l, tedy poměr Na+ : Cl– by byl 1,6 : 1,2 a nikoli fyziologických 1,4 : 1 (bude to ovšem spojeno s přesunem vody mezi ECT do ICT). Aby bylo dosaženo fyziologického stavu, tj. poměru 1,4 : 1, musí ledviny zvýšit vylučování Cl–, což musí být spojeno s vyššími nároky na acidifikaci moči, především na syntézu amoniaku. Pokud nálož chloridového aniontu překročí acidifikační schopnost ledvin, což nastane např. při snížené funkci ledvin, rozvine či prohloubí se metabolická hyperchloremická acidóza. Aby bylo dosaženo „fyziologického“ poměru mezi příjmem Na+ : Cl– v dietě, bylo by třeba ke každému 1 g NaCl přidat 0,6 g NaHCO3. Takto lze pochopit doporučení známá už v době Thomase Addise, tedy „solit“ NaCl : NaHCO3 v poměru 0,65 : 0,35, tedy používat „sůl“ složenou ze 2/3 NaCl a z 1/3 NaHCO3 (případně jinou natriovou sůl s metabolizovatelným aniontem). Tato strategie se běžně používá ke korekci metabolické acidózy u pacientů se selháním ledvin. Také v experimentu u krys s progredující renální insuficiencí bylo prokázáno, že restrikce soli příznivě ovlivnila hladinu bikarbonátu [9,10].
Obr. 1. Levá část ukazuje normální složení extracelulární tekutiny. 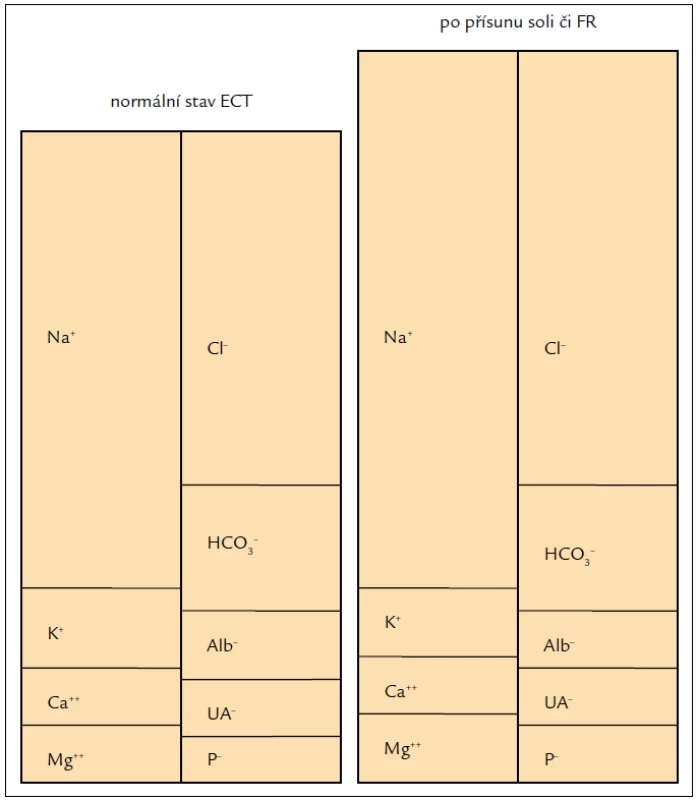
Pravá část zobrazuje stav po přísunu soli či fyziologického roztoku. Důsledkem je zvětšení objemu extracelulární tekutiny při nezměněném celkovém obsahu bikarbonátu (do doby ekvilibrace), který je tedy naředěn ve větším objemu, a tudíž jeho koncentrace poklesne. K nastolení nové rovnováhy musí ledviny vyloučit relativně větší množství chloridu než natria, a proto je fyziologický roztok (i sůl) z hlediska extracelulární tekutiny kyselý. Sůl a krevní tlak
Úroveň krevního tlaku, stejně jako proteinurie, koreluje s rychlostí poklesu ledvinové funkce, a proto je korekce hypertenze základním léčebným opatřením u ledvinových chorob. Je dobře známo, že u člověka příjem soli pozitivně koreluje se systémovým krevním tlakem [11,38] a že při sníženém příjmu soli se krevní tlak u pacientů s esenciální a renoparenchymatózní hypertenzí a u léčených náhradou funkce ledvin sníží [12,13]. Analýza 4 souhrnných prací a 2 randomizovaných kontrolních studií ukázala, že snížení příjmu soli až po dobu 12 měsíců bylo spojeno s poklesem TK o 3,6–8,0/1,9–2,8 mm Hg [12]. Ve studii INTERSALT byla nalezena pozitivní korelace mezi UVNa+/24 hod a systolickým TK, dále mezi poměrem UVNa+/UVK+/24 hod a systolickým TK a inverzní korelace mezi UVK+/24 hod a systolickým TK. Tyto korelace s diastolickým TK byly méně významné [11]. Tím bylo doloženo, že ve vztahu k úrovni TK je důležitý nejen příjem natria v potravě, ale také poměr mezi příjmem natria a kalia [14]. Přímý vztah mezi příjmem soli a krevním tlakem platí i u dětí, a to i v dlouhodobé perspektivě. Děti, které měly v prvních 6 měsících života omezený příjem soli, měly po dalších 15 letech krevní tlak o 6,6/2,2 mm Hg nižší než ty s běžnou dietou [15]. Také u dětí se při sníženém příjmu jak systolický, tak diastolický krevní tlak snížily [16,17].
Biologické účinky soli na krevním tlaku nezávislé
Je známo, že vysoký příjem soli zvyšuje fyziologické působení angiotenzinu II a aldosteronu na neepitelové tkáně, jako jsou srdce a cévy [18–20]. Naopak, účinek blokády RAAS je vysokým příjmem soli tlumen. To má význam z hlediska výše intraglomerulární hypertenze, hyperfiltrace a filtrační frakce a jejich medikamentózního ovlivnění v klinice [21,22]. Poznatky o vlivu soli na aktivitu RAAS mohou být jedním z vysvětlení, proč byl nezávisle na úrovni TK popsán vztah mezi příjmem soli a mortalitou na centrální mozkovou příhodu, hypertrofií levé komory srdeční a naopak ústup hypertrofie levé komory při sníženém příjmu soli [23]. Potlačení účinku blokády RAAS solí je důležité i z nefrologického hlediska, protože tyto léky kromě TK snižují i proteinurii. Se zvýšeným příjmem soli se také aktivuje gen pro TGFβ a snižuje se tvorba NO v cévách s následným ovlivněním plasticity a funkce cév [24]. Kromě toho sůl v důsledku zvýšení ECT zvyšuje tvorbu tzv. endogenních kardiotonických steroidů, které inhibují Na+-K+-ATPázu a mají inotropní účinek. Dále se také aktivují buněčné signální systémy s řadou nežádoucích účinků zprostředkovaných jak zvýšeným TK, tak na tlaku nezávislými účinky. Výsledkem jsou nežádoucí změny funkce cév i celých orgánů [25]. Vysoké natrium též zvyšuje produkci ADMA a tvorbu reaktivních radikálů kyslíku přímým ovlivněním NADPH oxidázy [26].
Sůl a proteinurie
Proteinurie je jedním ze základních indikátorů aktivity a progrese ledvinových chorob. Již její nejnižší stupeň, tedy mikroalbuminurie (30–300 mg/24 hod), znamená poškození ledvin diabetem i jinými chorobami. V pozdějším průběhu mikroalbuminurie přechází do zjevné proteinurie (> 0,3 g/24 hod), jejíž výše koreluje s rychlostí progrese a jejíž snížení je jedním z hlavních cílů symptomatické léčby chorob ledvin (např. inhibitory ACE). Nabízí se proto otázka, jak příjem soli ovlivňuje proteinurii. Výsledky většiny studií a jejich metaanalýzy se shodují v názoru, že snížení příjmu soli je spojeno s poklesem proteinurie a naopak [21,22,27–32]. U pacientů s proteinurií větší než 3 g/24 hod a glomerulární filtrací vyšší než 30 ml/min činil příjem soli postupně 50, 200 a opět 50 mmol/24 hod (což odpovídá 3 a 12 g soli/24 hod) při současné léčbě lizinoprilem. Proteinurie při dietě s nižším příjmem soli poklesla [28]. Při stejném omezení soli a současném podávání diltiazemu mikroalbuminurie poklesla také [27]. Snížení proteinurie po omezení soli individuálně kolísá a je závislé na reakci krevního tlaku na příjem soli. U hypertoniků reagujících poklesem krevního tlaku na snížený příjem soli, ale nikoli u rezistentních na sůl, se po zvýšení příjmu Na+ ze 100 na 200 mmol/den proteinurie zvýšila [33]. Také u diabetiků 2. typu, kteří reagovali úrovní krevního tlaku na příjem soli, se (mikro)albuminurie při redukci soli snížila [34,35]. Reakce albuminurie na příjem soli závisí také na stupni obezity. V populaci koreluje albuminurie s UVNa+ a je tím vyšší, čím je vyšší BMI [36]. Je také rizikovým faktorem pro budoucí rozvoj renální insuficience [37].
Sůl a funkce ledvin
Vliv příjmu soli na dlouhodobý vývoj ledvinové funkce zatím není přesvědčivě doložen [30] navzdory řadě experimentálních i klinických studií, které tento názor podporují [22,23,29,38–42]. Jedním z důvodů je rozdílná a často nízká kvalita publikovaných studií. Rychlost úbytku funkce u chronických ledvinových chorob lze graficky vyjádřit vztahem převrácené hodnoty kreatininu proti času. Bez ohledu na typ postižení ledvin je tento vztah lineární. U pacientů s glomerulonefritidou a diabetickou nefropatií se při sníženém příjmu soli sklon této přímky zmírnil. Zároveň byl prokázán vztah mezi množstvím vyloučeného natria do moči a výší proteinurie. Tyto závislosti však nebyly prokázány u pacientů s nefrosklerózou [29]. Rozvoj selhání ledvin podle studie REIN (Ramipril Efficacy in Nephropathy) kvantitativně závisel na množství natria vyloučeného do moči. Z 500 pacientů s chronickou nefropatií, sledovaných více než 4,25 roků a léčených Ramiprilem 5 mg/den, jich 92 dospělo do terminálního selhání ledvin. Ve skupinách s odpadem natria do moči méně než 100, 100–200 a více než 200 mmol/24 hod byla incidence rozvoje chronického selhání ledvin 6,1, 7,9 a 18,2 případů na 100 pacientských roků (p < 0,001) [20].
Zpomalení rozvoje renálního selhání při sníženém příjmu soli však přesvědčivě dokazují studie u různých typů experimentálně vyvolaného postižení ledvin (adriamycinová nefropatie, redukce parenchymu ledvin). Sami jsme ukázali, že restrikce příjmu soli zpomalila rozvoj ablační nefropatie u potkanů s 5/6 nefrektomií (obr. 2). Potkani s omezeným příjmem soli měli nižší krevní tlak, nižší kreatinin, menší hypertrofii reziduálního parenchymu ledvin a morfometricky nižší stupeň glomerulární sklerózy [43].
Obr. 2. Dieta s nízkým obsahem soli zpomalila rozvoj ledvinové nedostatečnosti z hlediska funkčního i morfologického u AVN Wistar potkanů. 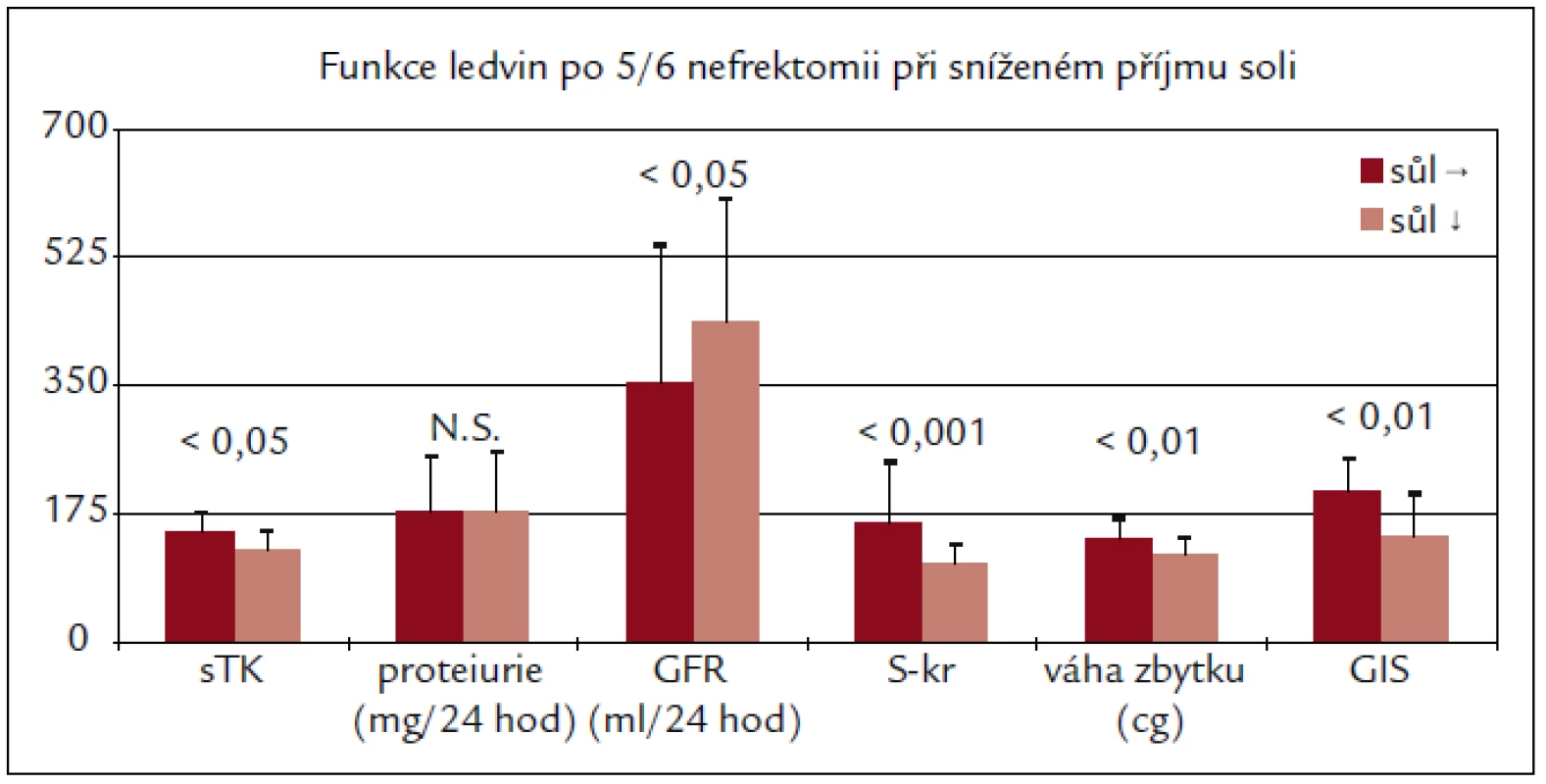
sTK – systolický krevní tlak, GIS – index glomerulární sklerózy měřený morfometricky.
Sůl a dialýza
Restrikce příjmu soli je významným dietetickým opatřením také u dialyzovaných pacientů [44]. Již v roce 1962 byl zaveden koncept tzv. „suché váhy“, formulovaný Scribnerem, který ukázal, že snížený příjem soli v dietě či nižší koncentrace v dialyzačním roztoku snižuje krevní tlak. Mezidialyzační přírůstky váhy jsou také rizikovým faktorem mortality u těchto pacientů [45]. Ukázalo se rovněž, že snížení soli na 5 g/24 hod u hypertoniků léčených dialýzou vedlo ke snížení krevního tlaku po několika měsících natolik, že bylo možno vynechat antihypertenzní léky [46]. Tento tzv. „lag phenomenon“ je vysvětlován postupným poklesem celkové periferní rezistence, která je v období hypertenze zvýšena v důsledku zánětu, zprostředkovaného zvýšenou aktivitou MAPK (mitogen activated protein kinase) a asymetrického dimetylargininu (ADMA). Původním stimulem může být vysoká koncentrace osmoticky neaktivního natria [26,47].
Závěr
Je až překvapivé, jak málo pozornosti je ve studiích věnovaných ovlivnění progrese chronické renální insuficience zaměřeno na vliv soli. Přitom se stále množí doklady o tom, že zvýšený příjem soli negativně ovlivňuje funkci ledvin, srdce a také životní prognózu. Významnou roli v tomto ohledu hraje zvýšený krevní tlak a výše proteinurie, ale též mechanizmy na krevním tlaku a na RASS nezávislé. Osvětová činnost a uplatnění nových znalostí o škodlivosti nadměrného příjmu soli při léčbě ledvinových chorob a v jiných oblastech lékařství je velmi žádoucí, i když v masovém měřítku těžko uskutečnitelná.
Poděkování
Práce byla podpořena granty IGA NT 11081, VZ MSM 0021620819, VEGA 1/0715/11 a projektem MZ 00064208.
prof. MUDr. Karel Matoušovic, DrSc.
www.fnmotol.cz
e-mail: kmatousovic@hotmail.com
Doručeno do redakce: 22. 5. 2012
Zdroje
1. Brown IJ, Tzoulaki I, Candeias V et al. Salt intakes around the world: implications for public health. Int J Epidemiol 2009; 38 : 791–813.
2. WHO/FAO. Diet, nutrition and the prevention of chronic diseases. World Health Organ Tech Rep Ser 2003; 916: i–viii, 1–149.
3. Guyton AC. Abnormal renal function and autoregulation in essential hypertension. Hypertension 1991; 18 (5 Suppl): III49–III53.
4. Heer M, Baisch F, Kropp J et al. High dietary sodium chloride consumption may not induce body fluid retention in humans. Am J Physiol Renal Physiol 2000; 278: F585–F595.
5. Titze J, Shakibaei M, Schaffhuber et al. Glycosaminoglycan polymerization may enable osmoticaly inactive Na+ storage in the skin. Am J Pysiol Heart Circ Physiol 2004; 287: H203–H208.
6. Titze J, Ritz E. Salt and its effect on blood pressure and target organ damage: new pieces in an old puzzle. J Nephrol 2009; 22 : 177–189.
7. Rabelink TJ, Rotmans JI. Salt is getting under our skin. Nephrol Dial Transplant 2009; 24 : 3282–3283.
8. Schafflhuber M, Volpi N, Dahlmann A et al. Mobilization of osmotically inactive Na+ by growth and by dietary salt restriction in rats. Am J Physiol Renal Physiol 2007; 292: F1490–F1500.
9. Espinel CH. The influence of salt intake on the metabolic acidosis of chronic renal failure. J Clin Invest 1975; 56 : 286–291.
10. Kraut JA, Madias NE. Consequences and therapy of the metabolic acidosis of chronic kidney disease. Pediatr Nephrol 2011; 26 : 19–28.
11. Stamler J, Rose G, Elliott P et al. Findings of the International Cooperative INTERSALT Study. Hypertension 1991; 17 (Suppl 1): I9–I15.
12. Matyas E, Jeitler K, Horvath K et al. Benefit assessment of salt reduction in patients with hypertension: systematic overview. J Hypertens 2011; 29 : 821–828.
13. Ritz E. Salt and hypertension. Nephrology (Carlton) 2010; 15 (Suppl 2): 49–52.
14. Ying WZ, Aaron K, Wang PX et al. Potassium inhibits dietary salt-induced transforming growth factor-beta production. Hypertension 2009; 54 : 1159–1163.
15. Geleijnse JM, Hofman A, Witteman JC et al. Long-term effects of neonatal sodium restriction on blood pressure. Hypertension 1997; 29 : 913–917.
16. Cooper R, Liu K. Correlation between salt intake, blood pressure and family history of hypertension. Am J Clin Nutr 1980; 33 : 2218–2220.
17. Simmons-Morton DG, Obarzanek E. Diet and blood pressure in children and adolescent. Pediatr Nephrol 1997; 11 : 244–249.
18. Rocha R, Funder JW. The pathophysiology of aldosterone in the cardiovascular system. Ann NY Acad Sci 2002; 970 : 89–100.
19. Joffe HV, Adler GK. Effect of aldosterone and mineralocorticoid receptor blockade on vascular inflammation. Heart Fail Rev 2005; 10 : 31–37.
20. Vegter S, Perna A, Postma MJ et al. Sodium intake, ACE inhibition, and progression to ESRD. J Am Soc Nephrol 2012; 23 : 165–173.
21. Boero R, Pignataro A, Quarello F. Salt intake and kidney disease. J Nephrol 2002; 15 : 225–229.
22. Krikken JA, Laverman GD, Navis G. Benefits of dietary sodium restriction in the management of chronic kidney disease. Curr Opin Nephrol Hypertens 2009; 18 : 531–538.
23. Antonios TF, MacGregor GA. Salt – more adverse effects. Lancet 1996; 348 : 250–251.
24. Sanders PW. Vascular consequences of dietary salt intake. Am J Physiol Renal Physiol 2009; 297: F237–F243.
25. Puschett JB, Agunanne E, Uddin MN. Emerging role of the bufadienolides in cardiovascular and kidney diseases. Am J Kidney Dis 2010; 56 : 359–370.
26. Shaldon S, Vienken J. Salt, the neglected silent killer. Semin Dial 2009; 22 : 264–266.
27. Bakris GL, Weir MR. Salt intake and reductions in arterial pressure and proteinuria. Is there a direct link? Am J Hypertens 1996; 9 : 200S–206S.
28. Cianciaruso B, Bellizzi V, Minutolo R et al. Salt intake and renal outcome in patients with progressive renal disease. Miner Electrolyte Metab 1998; 24 : 296–301.
29. Kuriyama S, Tomonari H, Ohtsuaka H et al. Salt intake and the progression of chronic renal diseases. Nippon Jinzo Gakkai Shi 2003; 45 : 751–758.
30. Jones-Burton C, Mishra SI, Fink JC et al. An in-depth review of the evidence linking dietary salt intake and progression of chronic kidney disease. Am J Nephrol 2006; 26 : 268–275.
31. Ritz E, Dikow R, Morath C et al. Salt – a potential “uremic toxin”? Blood Purif 2006; 24 : 63–66.
32. Amaha M, Ohashi Y, Sakai K et al. Salt intake and the progression of renal failure in patients with chronic kidney disease. Nihon Jinzo Gakkai Shi 2010; 52 : 952–958.
33. Weir MR, Dengel DR, Behrens MT et al. Salt-induced increases in systolic blood pressure affect renal hemodynamics and proteinuria. Hypertension 1995; 25 : 1339–1344.
34. Suckling RJ, He FJ, MacGregor GA. Altered dietary salt intake for preventing and treating diabetic kidney disease. Cochran Database Syst Review 2010; 8: CD006763.
35. Imanishi M, Yoshioka K, Okumura M et al. Sodium sensitivity related to albuminuria appearing before hypertension in type 2 diabetic patients. Diabetes Care 2001; 24 : 111–116.
36. Verhave JC, Hillege HL, Burgerhof JG et al. PREVEND Study Group Sodium intake affects urinary albumin excretion especially in overweight subjects. J Intern Med 2004; 256 : 324–330.
37. Verhave JC, Gansevoort RT, Hillege HL et al. PREVEND Study Group. An elevated urinary albumin excretion predicts de novo development of renal function impairment in the general population. Kidney Int Suppl 2004; 92: S18–S21.
38. Dickinson BD, Havas S. Council on Science and Public Health, American Medical Association. Reducing the population burden of cardiovascular disease by reducing sodium intake – a report of the Council on Science and Public Health. Arch Intern Med 2007; 167 : 1460–1468.
39. Ritz E, Koleganova N, Piecha G. Role of sodium intake in the progression of chronic kidney disease. J Ren Nutr 2009; 19 : 61–62.
40. Ritz E, Mehls O. Salt restriction in kidney disease – a missed therapeutic opportunity? Pediatr Nephrol 2009; 24 : 9–17.
41. Sanders PW. Salt intake, endothelial cell signaling, and progression of kidney disease. Hypertension 2004; 43 : 142–146.
42. Sanders PW. Effect of salt intake on progression of chronic kidney disease. Curr Opin Nephrol Hypertens 2006; 15 : 54–60.
43. Matoušovic K, Štekláčová A, Bohdanecká M et al. I mírně snížený obsah soli v dietě zpomalí progresi ledvinové nedostatečnosti u potkanů po 5/6 nefrektomii. Lék Obzor 2010; 59 : 512–513.
44. Charra B, Chazot C. The neglect of sodium restriction in dialysis patients: a short review. Hemodial Int 2003; 7 : 342–347.
45. Szczech LA, Reddan DN, Klassen PS et al. Interactions between dialysis-related volume exposures, nutritional surrogates and mortality among ESRD patients. Nephrol Dial Transplant 2003; 18 : 1585–1591.
46. Shaldon S, Vienken J. Beyond the current paradigm: recent advances in the understanding of sodium handling. An introduction. Semin Dial 2009; 22 : 252.
47. Twardovski ZJ. Sodium, hypertension, and an explanation of the “lag phenomenon” in hemodialysis patients. Hemodial Int 2008; 12 : 412–425.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 7 a 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Jubilant prof. Miroslav Penka, CSc.
- Profesor Miroslav Penka – jeden z běžců Maratónu pro hemofilii
- CZEMP – děcko prof. Penky
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Získaná hemofilie A
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- K životnímu jubileu prof. MUDr. Miroslava Součka, CSc.
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Trojkombinační léčba chronické hepatitidy C
- Chronický zánět a metabolický syndrom
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Významné životné jubileum profesora MUDr. Miroslava Mydlíka, DrSc.
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



