-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
Sodium concentration in dialysate – an important but neglected parameter in haemodialysis of patients with chronic renal failure
Sodium ion with its accompanying anions plays the major role in osmolality of body fluids changes of which determine overall fluid balance in health given on one side by water intake and on the other side by its excretion via kidneys. In renal failure, control of the excess fluid removal is taken over by dialysis but control of water intake via thirst induced by changes in osmolality remains functional. Sodium balance is thus of utmost importance. It consists of two components – dietary salt intake and sodium balance during haemodialysis (HD). Choice of sodium concentration in dialysis solution (CDNa) and its difference from plasma sodium (CPNa) may thus significantly influence water intake during the interdialytic period. And despite of rather wide interindividual scatter in CPNa, majority of dialysis centres still uses the same CDNa value for all patients and their dietary counselling stresses the need of restriction in fluid intake only. The article analyzes possible impact (benefits) of the two principal approaches to CDNa manipulation – its individualisation with the value being kept constant during the whole HD session and use of sodium profiling (changing CDNa during the course of HD). Based on literary data and on own measurements, CDNa individualisation appears far more beneficial in the long-term perspective. Contemporary off-line sodium profiling, regardless of how sophisticated control algorithm is used brings in the risk of positive sodium balance with all negative effects associated with it. Restriction of salt intake should be stressed in dietary counselling instead of mere fluid restriction.
Key words:
haemodialysis – sodium concentration – sodium balance – weight gains – individualization – sodium profiling
Autoři: F. Lopot 1,2; F. Švára 1,3; V. Polakovič 1,3
Působiště autorů: Interní oddělení Strahov VFN Praha, přednosta prim. MUDr. Vladimír Polakovič, MBA 1; Ústav biofyziky a informatiky 1. lékařské fakulty UK Praha, přednosta prof. MUDr. RNDr. Jiří Beneš, CSc. 2; Klinika nefrologie 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Vladimír Tesař, DrSc., MBA 3
Vyšlo v časopise: Vnitř Lék 2012; 58(7 a 8): 60-65
Kategorie: 80. narozeniny prof. MUDr. Miroslava Mydlíka, DrSc.
Souhrn
Sodíkový iont je spolu se svými doprovodnými anionty určujícím faktorem osmolality tělesných tekutin, jejíž změny řídí ve zdraví celkovou tekutinovou bilanci, danou na jedné straně příjmem vody v dietě a na straně druhé jejím vylučováním ledvinami. Při selhání ledvin je odstraňování vody převzato dialýzou, ale mechanizmus řízení příjmu tekutin změnami osmolarity je i v této situaci zachován a sodíková bilance má proto zásadní význam. Ona sama je přitom určována jak příjmem soli v dietě, tak sodíkovou bilancí při hemodialýze (HD). Volba koncentrace sodíku v dialyzačním roztoku (CDNa), resp. její rozdíl proti koncentraci plazmatické (CPNa) proto může výrazně ovlivnit příjem tekutin v mezidialyzační době. A přesto, že je znám značný interindividuální rozptyl hodnot CPNa, používá většina dialyzačních pracovišť pro všechny pacienty stejnou hodnotu CDNa a v rámci dietního poradenství pacientům doporučuje pouze omezení příjmu tekutin. Článek analyzuje možné přínosy dvou základních způsobů manipulace s CDNa – její individualizace při konstantní hodnotě během celé HD a použití sodíkového profilu (proměnné CDNa během jedné HD). Na základě literárních údajů i vlastních měření dochází k závěru, že individualizace konstantní CDNa je z dlouhodobého hlediska výrazně výhodnější. Současné „off-line“ profilování CDNa bez ohledu na sofistikovanost řídícího algoritmu s sebou přináší riziko pozitivní bilance sodíku a s ním spojené negativní dopady. V dietních doporučeních by měl být dáván důraz na omezení příjmu soli místo pouhého doporučování omezit příjem tekutin.
Klíčová slova:
hemodialýza – koncentrace sodíku – sodíková bilance – váhové přírůstky – individualizace – profilováníÚvod
Volba, resp. řízení koncentrace sodíku při hemodialýze (HD), má 2 aspekty: tím základnějším, ale dosud značně opomíjeným, je, nebo by měl být, jejich příspěvek k zajištění sodíkové homeostázy, která je ve zdraví zajišťována převážně ledvinami. Neadekvátní přístup se většinou projeví až v době mezi dialýzami jako žízeň a s ní spojené velké mezidialyzační váhové přírůstky (MVP), jež z dlouhodobého hlediska negativně ovlivňují stav a funkci kardiovaskulárního aparátu a patrně se přímo podílejí i na zvýšené mortalitě z kardiovaskulárních příčin. Analýza mortality v jednotlivých dnech týdne [1] ukázala, že v den po nejdelší, zpravidla 3denní mezidialyzační pauze (např. v pondělí při dialýzách v pondělí, ve středu a v pátek), kdy jsou pacienti nejvíce převodněni a změny koncentrace elektrolytů dosahují svého maxima, je počet úmrtí z kardiovaskulárních příčin výrazně vyšší než v ostatních dnech v týdnu. Druhý aspekt je dán možností využít manipulace s koncentrací sodíku v tělesných tekutinách k potlačení nebo zmírnění některých symptomů, často se projevujících při dialýze (křeče, bolesti hlavy, hypotenze). Ty souvisejí zejména se zvyšující se účinností HD, svádějící ke zkracování doby dialýzy, která ale má za následek zvyšující se potřebnou rychlost ultrafiltrace. V tomto smyslu vlastně představuje manipulace s koncentrací sodíku pouze berličku ke snazšímu zvládání problémů, které se u méně účinné nebo delší HD prakticky nevyskytují. A přestože oba zmíněné aspekty byly řadou autorů podrobně zpracovány [2–6], výstupy těchto prací jsou v dialyzační praxi prakticky ignorovány – koncentrace sodíku v dialyzačním roztoku je stejná pro všechny pacienty a jako základní dietní opatření je doporučována restrikce příjmu tekutin. Tento článek má poskytnout přehled o stávajícím stavu problematiky sodíkové bilance při hemodialýze a tam, kde je to možné, být i návodem k praktické aplikaci.
Sodíková hemeostáza a řízení tekutinové bilance ve zdraví a při selhání ledvin
Ve zdraví je konstantní osmolalita tělesných tekutin výsledkem regulace příjmu vody prostřednictvím pocitů žízně a jejím vylučováním ledvinami. Osmolalita sama je dána především koncentrací sodíku a jeho doprovodných aniontů [7]. Relativně velký rozptyl normálních hodnot plazmatické koncentrace sodíku (CPNa) u zdravých jedinců (135–145 mmol/l) napovídá, že tento parametr může být individuálně odlišný. Pocity žízně vyvolá už změna osmolarity o pouhé 2 mosm/l [8]. Při renální insuficienci se uvádí, že retence sodíku i vody je většinou proporcionální, a CPNa tak zůstává v mezích normy [9]. Při renálním selhání vypadne z větší části nebo úplně možnost regulace osmolarity tělesných tekutin vylučováním osmoticky aktivních katabolitů (urea) a elektrolytů ledvinami a musí být nahrazena dialýzou. Regulace příjmu tekutin (bezsolutové vody) prostřednictvím pocitů žízně v závislosti na nárůstu osmolarity, ale zůstává i za těchto podmínek zachována. Někdy se žízeň dialyzovaných pacientů vyvolaná nárůstem osmolarity a následnými signály z osmoreceptorů v hypothalamu označuje jako žízeň „osmometrická“, na rozdíl od méně časté žízně „volumetrické“, vyvolávané vysokou izoosmotickou ultrafiltrací, kdy baroreceptory v srdečních síních signalizují snížený srdeční návrat [10]. „Osmometrická“ žízeň je úměrná především příjmu soli v mezidialyzační době, ale také sodíkové bilanci při vlastní HD. Dialyzovaným pacientům je pak zpravidla důrazně doporučováno zdržet se nadměrného příjmu tekutin, resp. navrhována různá opatření, jak alespoň částečně obejít případné pocity žízně (zvlhčování dutiny ústní kousky ledu, používání menších nápojových skleniček apod.). Otázka možnosti neadekvátní sodíkové bilance a v důsledku ní navozovaných intenzivních pocitů žízně, jakkoli důležitá pro adekvátní dialyzační léčbu, je často ponechávána stranou, patrně kvůli tomu, že sledování příjmu tekutin a tekutinové bilance je výrazně jednodušší, než vyhodnocování bilance sodíku.
Vzhledem k výše popsané úzké souvislosti tekutinové bilance s bilancí sodíkovou představuje volba CDNa, resp. manipulace s její hodnotou během HD účinnou možnost ovlivňování nežádoucích dopadů neadekvátní nebo neadekvátně řízené tekutinové bilance. V praxi může mít využití CDNa v zásadě dvě podoby – individualizace CDNa s její konstantní hodnotou během celé HD a použití tzv. sodíkového profilu, při kterém se hodnota CDNa během dialýzy výrazně mění.
Individualizace koncentrace sodíku v dialyzačním roztoku, koncept sodíkového „setpointu“
Metoda individualizace CDNa, jejímž cílem je snížení příjmu vody v mezidialyzační době, je založena na předpokladu existence individuální a v čase stálé hodnoty CPNa, jakéhosi individuálního sodíkového „setpointu“. Existenci individuálního „setpointu“ pro celkové množství sodíku navrhl patrně první Hollenberg [11]. Bonventre et al [12] sice jeho teorii napadli s poukazem na to, že nemůžou vysvětlit řadu známých jevů (při zvýšení příjmu sodíku se zvýší tělesná hmotnost a toto zvýšení přetrvává, dokud není příjem sodíku snížen; příjem izotonické tekutiny nevede k okamžitému nástupu diurézy, zatímco příjem hypotonické tekutiny ano), ale zřejmě si neuvědomili, že ve své kritice vlastně snáší důkazy pro existenci „setpointu“ sodíkové koncentrace v plazmě, se kterou pacient přichází na každou HD (CPNapre). Existenci takového „setpointu“ následně potvrdila řada prací, v nichž byla zjišťována odezva pacienta na různou hodnotu CDNa za účelem zcela jiným než ověření stálosti CPNapre [13–15]. Při nich byla shledána žádná nebo jen malá změna CPNapre, přestože se postdialyzační CPNa v důsledku rozdílných hodnot CDNa často výrazně lišila. Rovněž jedna z nedávných prací, při které bylo monitorováno přes 360 pacientů po dobu 6 měsíců [10], ukázala značně široké rozmezí hodnot CPNapre – od 128 do 144 mmol/l, které ale vykazovaly vysokou stálost u jedince. Celý soubor měl téměř normální rozložení s mediánem kolem 137 mmol/l (obr. 1) s poněkud rychleji klesající pravou části charakteristiky. Stejný tvar rozložení CPNapre v neselektivní skupině pacientů lze nalézt i v dalších pracích [16,17]. Při obvykle používaných hodnotách CDNa kolem 140 mmol/l nebo vyšších tak bude sodíková bilance (při odpočtu isonatremické ultrafiltrace) u většiny pacientů pozitivní.
Obr. 1. Histogram průměrných predialyzačních hodnot CPNa u 369 dialyzovaných pacientů fakultní nemocnice v Leedsu. 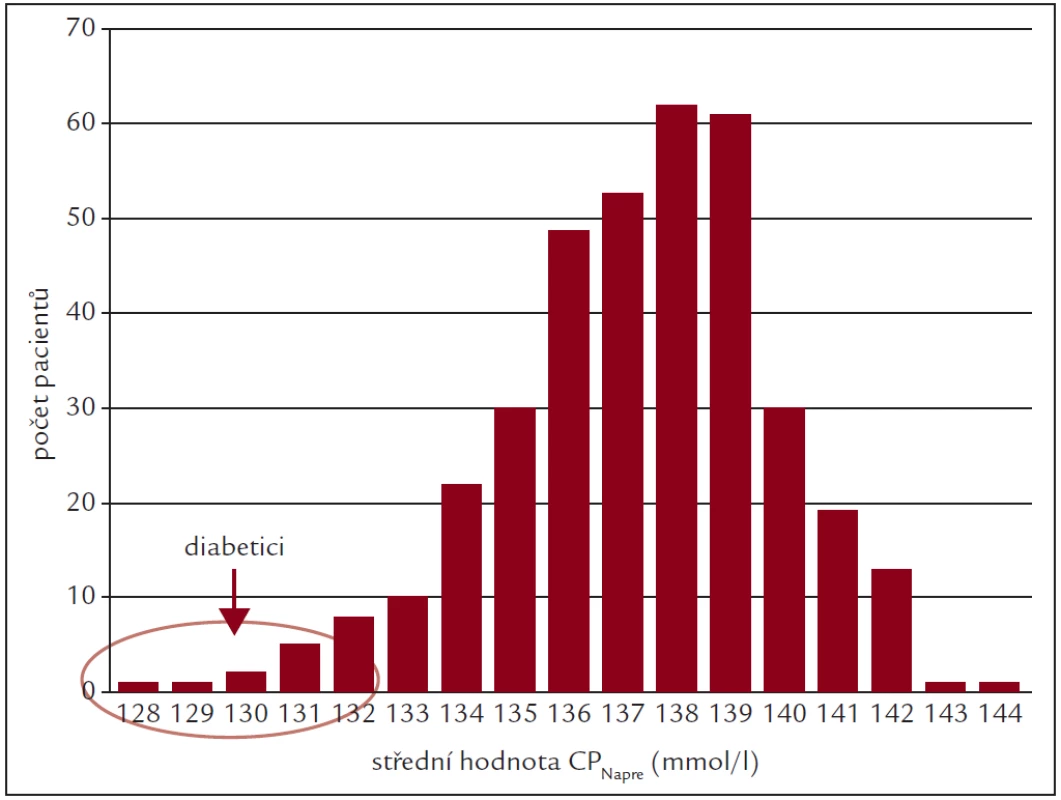
Upraveno podle [10]. My jsme si existenci individuálního sodíkového „setpointu“ ověřovali vlastním měřením v minulosti jinak – srovnávali jsme variaci CPNapre u jedince po dobu několika týdnů s rozptylem jednorázového měření ve skupině [18]. Zatímco směrodatná odchylka (SD) průměrné hodnoty CPNapre u jedince v čase byla pouhých 1,3 mmol/l, SD ve skupině byla více než 2násobná. Většina prací, které pracují s představou „setpointu“, sice uvádí osmotický „setpoint“, ale následně již pracují jenom s koncentrací sodíku. U dialyzovaných pacientů ale přispívají výraznou měrou k plazmatické osmolalitě, resp. jejím změnám v mezidialyzační době, i značné změny koncentrace urey a malou měrou i koncentrace draslíku. Protože nárůst koncentrací obou těchto látek je u pacientů dialyzovaných v obvyklém režimu tří dialýz týdně vždy vyšší po 3denní mezidialyzační pauze než po následujících 2 2denních pauzách, ověřovali jsme si na malé skupině pacientů, zda je úměrně tomu nižší jejich CPNapre po oné 3denní pauze. Výsledky (dosud nepublikováno) nebyly příliš průkazné, u pondělních CPNapre byla sice obecná tendence k mírně nižším hodnotám ve srovnání s hodnotami před středeční a páteční dialýzou, ale rozdíl byl u většiny pacientů menší než 1,5 mmol/l a nebyl statisticky významný. Nezdá se proto, že by při volbě CDNa bylo třeba zohledňovat, o kterou dialýzu v týdnu se jedná.
Má-li být individualizací CDNa dosaženo snížení MVP, je namístě otázka, jak se vhodné hodnoty individuální hodnoty CDNa dobrat a jak velké snížení MVP lze očekávat. Teoreticky lze optimální CDNa stanovit na základě požadavku izonatremického průběhu dialýzy, čímž se rozumí nulový difuzní transport sodíku z dialyzačního roztoku do plazmy. Vzhledem k podmínce Gibbsovy-Donnanovy rovnováhy na membráně dialyzátoru lze přibližně odhadnout, že hodnota izonatremická CDNa bude o 1–2 mmol/l vyšší než pacientův individuální sodíkový „set-point“, reprezentovaný hodnotou CPNapre. Některé práce [19] doporučují pro vyšší spolehlivost používat průměrnou hodnotu CPNapre za určitý časový interval. Protože vzhledem k obvyklému rozsahu hodnot CPNapre (obr. 1) a obvyklému rozsahu běžně používaných hodnot CDNa bude při individualizaci CDNa u většiny pacientů hodnota CDNa snižována, lze optimální CDNa hledat i zkusmo postupným snižováním CDNa po dobu několika týdnů, až do nástupu příznaků již negativní sodíkové bilance (křeče, hypotenze). Naše vlastní zkušenosti i literární údaje ale ukazují, že u většiny pacientů lze CDNa postupně snížit o 3–5 mmol, aniž k takovým nežádoucím projevům dojde. Určitým vodítkem při manipulaci s CDNa mohou být intradialyzační změny hodnoty CPNa, indikované současnými HD přístroji jako vedlejší produkt on-line měření Kt/V na bázi iontové dialyzance (systém OCM v přístrojích Fresenius nebo systém Diascan u přístrojů Gambro) – ta by při HD samozřejmě neměla výrazně růst. Při úpravách CDNa podle hodnot CPNa indikovaných dialyzačním přístrojem je ale třeba zohlednit relativně velký rozdíl v hodnotě CPNa měřené na běžném analyzátoru a indikované dialyzačním přístrojem (obr. 2). Korelace mezi hodnotami CPNa stanovenými oběma způsoby je sice velmi silná, ale hodnoty indikované dialyzačním přístrojem jsou vždy výrazně vyšší. Snižování CDNa, ať již zkusmé nebo cílené, na předem teoreticky stanovenou hodnotu, vycházející z delšího sledování hodnot CPNapre u konkrétního pacienta, musí být v každém případě postupné, o 1–2 mmol/l za týden.
Obr. 2. Korelace mezi hodnotami CPNa stanovenými z měření „iontové dialyzance“ na dialyzačním přístroji (CPNa-ID) s hodnotami stanovenými ve vzorku plazmy iontově selektivním analyzátorem Ionometer Fresenius (CPNa-ISE). 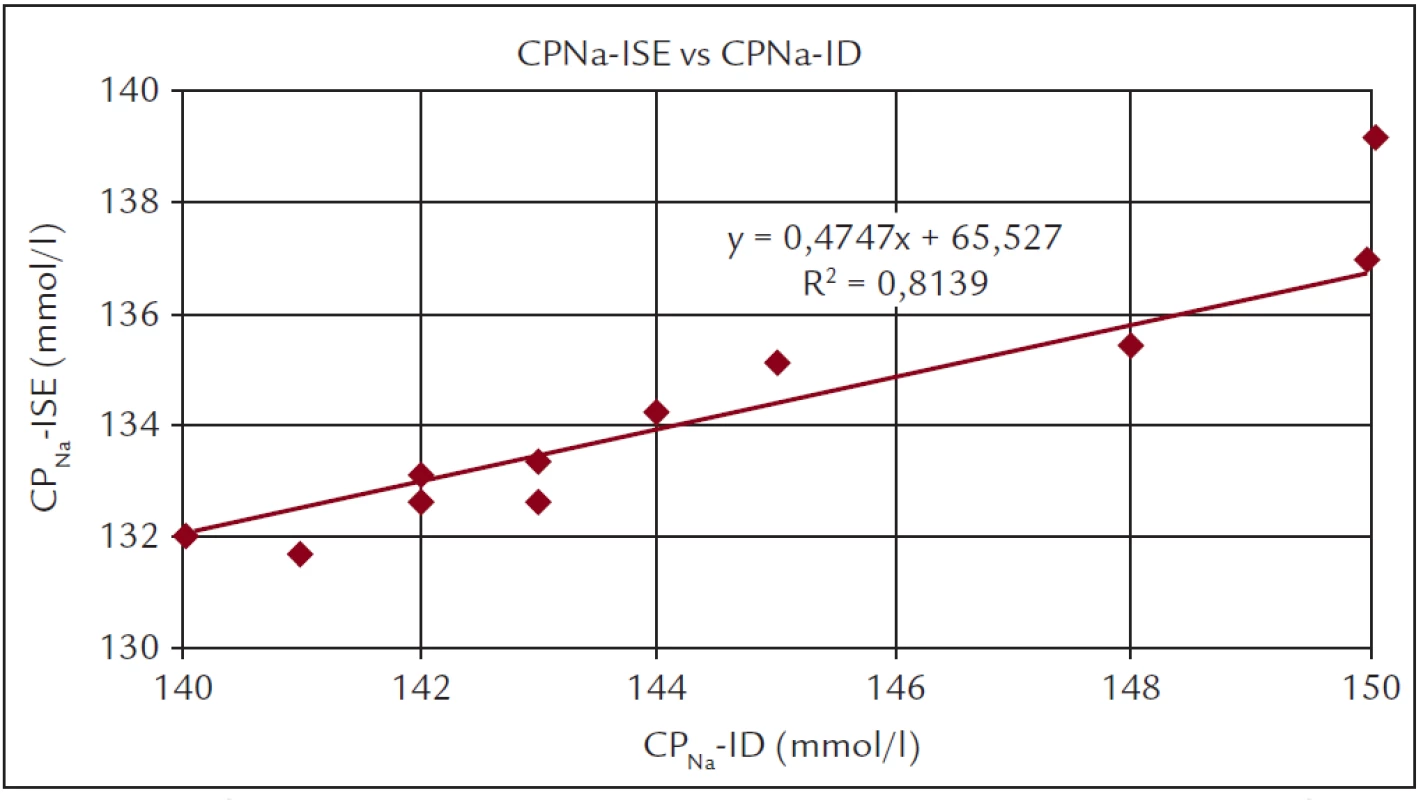
Vzorek byl odebrán ve stejné době, s měřením iontové dialyzance (měřeno na dialyzačním středisku Praha-Strahov). Pokud jde o očekávatelnou velikost poklesu MVP se snižováním CDNa, lze za předpokladu osmolarity tělesných tekutin kolem 300 mosm/l odhadnout, že snížení CDNa o 3 mmol/l povede u průměrně velkého pacienta (při nezměněném příjmu soli v mezidialyzační době) ke snížení MVP o 0,3–0,4 kg [10]. Reálnost tohoto odhadu potvrzují i literární údaje z prací, které postupné snižování CDNa prakticky aplikovaly [14,17,19,20].
Profilování koncentrace sodíku v dialyzátu
Profilování CDNa se může na první pohled jevit jen jako pokročilejší podoba individualizace CDNa. Ve skutečnosti se ale jedná o principiálně odlišnou techniku, jejímž cílem je zabránit při dialýze přestupu vody z ECV do ICV v důsledku rychlého oddialyzovávání urey z extracelulární tekutiny během 1. části dialýzy, které vyvolává její hypotonicitu vůči tekutině intracelulární. Na rozdíl od individualizace konstantní CDNa, která má minimalizovat sodíkovou zátěž a díky takto dosažené minimalizaci MVP co nejvíce redukovat dlouhodobé nepříznivé dopady cyklického kolísání převodnění na kardiovaskulární aparát, je profilování CDNa zaměřeno na redukci akutních intradialyzačních problémů vyvolávaných nepřiměřeně vysokou rychlostí ultrafiltrace. Sodíková zátěž je při nich naopak alespoň po část dialýzy úmyslně vyvolávána s cílem kompenzovat přísunem vody z intracelulárního prostoru redukci objemu intersticiální tekutiny a z ní rezultující pokles plazmatického refilu při rychlé UF a pokles krevního objemu, a tak zabránit nárůstu rizika hypotenze z hypovolemie. Fyziologické rozvahy, na kterých je profilování CDNa založeno, nejsou nikterak nové. Ogden [21] již koncem 70. let minulého století ukázal, že zvýšením CDNa lze kompenzovat pokles osmolality plazmy a že toto zvýšení redukuje výskyt komplikací během HD. O dva roky později van Stone et al prokázali možnost cíleného přesunu vody z intracelulárního prostoru do prostoru extracelulárního použitím vyšší CDNa [22] a ve stejném roce publikovali Gotch et al svůj jednokomorový model kinetiky sodíku [23]. Ten byl v „off-line“ podobě použit v prvním šířeji využívaném modulu pro profilování CDNa, který začala pod označením CMS08 vyrábět firma Fresenius v polovině 80. let minulého století jako doplněk ke svému dialyzačnímu přístroji 2008. Obdobný model Petitclerka et al z 1. poloviny 80. let minulého století [24] se začal používat v přístrojích firmy Hospal a kombinoval s profilováním CDNa profilování rychlosti ultrafiltrace (UFR). Když ve 2. polovině 80. let minulého století Heineken et al [25] ukázali, že propustnost buněčné stěny pro přestup vody mezi ICV a ECV, vyvolávaná osmotickým gradientem mezi oběma prostory, je relativně malá (průměrná zjištěná hodnota „celotělového ultrafiltračního koeficientu mezi intra - a extracelulárním prostorem“ byla kolem 0,14 ml/min/mm Hg, tedy zlomek ultrafiltračního koeficientu běžného low-flux dialyzátoru), bylo jasné, že kinetické modely budou muset být složitější, mají-li být dostatečně věrné.
Profilování CDNa, jak ho dnes umožňují dialyzační přístroje, má v zásadě dvě podoby: v té jednodušší podobě je průběh CDNa během HD zadáván off-line předem, bez znalosti předdialyzační hodnoty CPNa dialyzovaného pacienta. Prakticky se to provádí buď zkusmo prostým zadáním hodnot CDNa v určitých časových intervalech, nebo volbou typového profilu z několika možností, uložených v paměti přístroje. Do této skupiny lze zařadit i sofistikovanější systémy profilování CDNa pracující s některým z vytvořených modelů, které ale rovněž neberou v úvahu pacientovu CPNapre. Některé jsou dokonce označovany jako „sodium neutral“, a navozují tak falešnou představu o izonatremičnosti HD s takovým profilem. Ve skutečnosti se ale ona „sodíková neutrálnost“ vztahuje k nějaké rovněž předem a bez ohledu na pacientovu CPNapre zadávané střední hodnotě CDNa celého profilu.
Teprve v posledních několika letech se objevily systémy pro „on-line“ profilování CDNa, které buď zohledňují pacientovu CPNapre nebo z vodivosti dialyzačního roztoku na vstupu a výstupu dialyzátoru vyhodnocují sodíkovou bilanci dané HD a umožňují dosažení její předem definované hodnoty.
Celkem lze v literatuře nalézt mnoho desítek prací o aplikaci sodíkových profilů, zejména u pacientů se sklonem k hypotenzi. Tvar profilu CDNa je zpravidla klesající, a to buď lineárně, schodovitě nebo exponenciálně. Výjimkou je oscilující profil, kde se CDNa mění v krátkých, jen několik málo desítek minut trvajících intervalech mezi extrémně nízkou a extrémně vysokou hodnotou – tzv. „cell cash dialysis“ [26]. Pokud jde o výsledky použití těchto profilů, představuje dosud nepřekonanou práci metaanalýza Stillera et al [27], která pokryla kolem 20 do té doby publikovaných článků. Většina z nich sice dokládala zlepšení hemodynamické stability, ale jednalo se jen o krátkodobé studie. Navíc v nadpoloviční většině z nich byla doložena pozitivní sodíková bilance při dialýze a v důsledku toho i mírný nárůst MVP. Naprosto stejná zjištění lze nalézt i v řadě dalších i novějších prací [28–32]. Vyšší hemodynamickou stabilitu při použití profilu CDNa lze přičíst nižší redukci cirkulujícího krevního objemu (BV), který byl v některých pracích měřen, a nižší redukce oproti HD s konstantní CDNa byla skutečně zjištěna [28,33]. Nižší redukce BV lze ovšem při dané velikosti ultrafiltrace dosáhnout i jen použitím klesajícího profilu UFR, který žádné riziko zvyšování sodíkové nálože nemá. Odstranění pozitivní sodíkové bilance (difuzní přestup sodíku z dialyzačního roztoku do plazmy) jako základního problému profilování sodíku lze očekávat až od profilovacích systémů s „on-line“ měřením CPNa a/nebo on-line řízením sodíkové bilance. Není bez zajímavosti, že první systém pro on-line vyhodnocování sodíkové bilance byl navržen a zkonstruován již před více než 20 lety (systém Ionoflow, Fresenius AG), prošel i klinickými zkouškami, ale nikdy se nedostal do výroby [34]. První nové práce s obdobnými systémy jsou ale konečně na světě a některé dokonce dokládají možnost vhodným řízením sodíkové bilance dosáhnout snížení MVP [35].
Při posuzování rizika pozitivní sodíkové bilance při HD s profilováním CDNa na základě měření postdialyzační CPNa je třeba upozornit na nedávnou práci Titzeho [36]. Podle ní může při rychlé difuzi sodíku z dialyzačního roztoku do plazmy, typické pro první část dialýzy s profilováním CDNa, docházet k ukládání sodíku v osmoticky neaktivní podobě v kožní tkáni, které výrazně sníží dynamiku nárůstu CPNa. Následně se ale tento sodík bude v mezidialyzační době opět uvolňovat a přispívat k pocitům žízně. Jakkoli se jedná o teorii novou, dosud řádně neprokázanou, stojí za zmínku, že o osmoticky neaktivním ukládání sodíku se zmiňuje už uváděná práce Edelmana et al z roku 1958 [7], byť v jiných tkáních, než uvádí Titze.
Srovnání možného přínosu individualizace CDNa a profilování CDNa pro zlepšení tekutinové bilance, resp. potlačení negativních dopadů příliš vysokých MVP vyznívá zatím jednoznačně ve prospěch jednodušší individualizace. Obě metody mají stejný základní cíl – potlačit na minimum výskyt nežádoucích symptomů spojených s neadekvátní tekutinovou bilancí nebo jejím nevhodným řízením. Ale profilování CDNa tak činí v krátkodobém horizontu jedné HD za cenu rizika zhoršení těchto problémů v horizontu dlouhodobém. Není proto nijak překvapivé, že v dokumentu EBPG o hemodynamické nestabilitě [37] se u pacientů se sklonem k oběhové nestabilitě rutinní používání sodíkových profilů nedoporučuje (Guideline 3.2.1), a to právě kvůli riziku žízně, vyšších MVP a hypertenze. Individualizace CDNa naproti tomu upravuje sodíkovou bilanci při HD postupně a k redukci případných problémů vede výrazně pomaleji než profilování sodíku, zato s dlouhodobě příznivou perspektivou.
Sodíková a tekutinová bilance a dietní doporučení u dialyzovaných pacientů
I když zůstává dosti otázek souvisejících s řízením sodíkové bilance pomocí manipulace s CDNa otevřených – závislost hodnot CPNa a CDNa na metodě stanovení (starší plamenná fotometrie, novější měření iontově selektivním analyzátorem), příspěvek náboje dialyzační membrány k hodnotě Gibbsova--Donnanova koeficientu pro stanovení vhodné hodnoty CDNa z hodnoty predialyzační CPNa, která by zajistila izonatremičnost HD, směna draslíku za sodík na rozhraní intra - a extracelulárního prostoru během HD a další –, jeví se ve světle všech zmiňovaných prací nadřazenost sodíkové bilance bilanci tekutinové jako neoddiskutovatelná.
To by se samozřejmě mělo odrážet i v důrazu, který bude kladen na omezení příjmu soli v dietních doporučeních dialyzovaným pacientům. Toto omezení by mělo být vždy primární [10,38], omezení příjmu tekutin má až sekundární charakter. Existují dokonce práce již staršího data [39] prokazující, že restrikce příjmu soli vede sama o sobě ke snížení příjmu tekutin v mezidialyzační době a tím i k nižším MVP, aniž je pacientovi restrikce příjmu tekutin explicitně doporučována.
Souvislost velikosti MVP s nárůstem CPNa během HD nebo s rostoucí hodnotou (CDNa – CPNapre) zdokumentovala řada prací [17,40,41]. Při vyhodnocování korelace mezi sodíkovou bilancí při dialýze je ale třeba si uvědomit, že nelze očekávat naprosto jednoznačný výsledek s velmi malým rozptylem hodnot kolem korelační přímky. Důvodem je skutečnost, že intradialyzační bilance sodíku je jen částí celkové sodíkové bilance. Její druhá část připadá na příjem soli během mezidialyzační doby, který se v závislosti na dietních zvyklostech pacienta pohybuje mezi 5–10 g NaCl/den (tj. asi 150–300 mmol sodíku za celý mezidialyzační interval). S ohledem na možnost ukládání části sodíku přešlého z dialyzačního roztoku do plazmy během HD do tkání v osmoticky neaktivní podobě [36] bude také vhodnější sodíkovou bilanci při HD stanovit ze změny CDNa při průchodu dialyzátorem než např. výše zmíněným způsobem z hodnot CPNa na začátku a na konci HD.
S odlišným charakterem závislosti MVP na sodíkové bilanci je třeba počítat u diabetiků. V Ramdeenově studii [42] připadala na příjem soli pouze 1/2 příjmu bezsolutové vody za celý mezidialyzační interval. V práci [6] je pro přepočet zvýšené koncentrace glukózy na koncentraci sodíku uvedena hodnota 1,6 mmol Na/l na každých 100 mg/l nárůstu koncentrace glukózy nad normál. Na skutečnost, že nižší (CPNapre) se vyskytuje převážně u diabetiků (dolní část levého ramena histogramu na obr. 1), upozorňuje i Lindley [10].
Shrnutí a závěry
Značné množství publikovaných prací dokládá relativně nízké kolísání CPNapre u jedince v čase oproti její variabilitě ve skupině. To je jasný důkaz existence relativně stálého individuálního „setpointu“ plazmatické koncentrace sodíku, resp. osmolarity v čase. Obdobně lze považovat za prokázanou i úzkou souvislost koncentrace sodíku v dialyzačním roztoku (CDNa), resp. dialýzou navozených změn CPNa s velikostí mezidialyzačních váhových přírůstků. Obojí pak jasně ukazuje na potřebu a přínosnost individualizace CDNa.
Individualizovat lze na předem stanovenou hodnotu (průměrná hodnota CPNapre za dobu několika dialýz, navýšená o asi 2 mmol/l, zohledňující Gibbsův-Donnanův jev na membráně dialyzátoru) nebo zkusmo (snižování CDNa až do nástupu nežádoucích příznaků typu hypotenze či křečí). V každém případě však musí být snižování CDNa pozvolné (1–2 mmol/l za obvyklý týdenní cyklus 3 HD).
Profilování CDNa, jakkoli může pomoci zvýšit hemodynamickou stabilitu při jedné konkrétní HD, nelze obecně doporučit, a to kvůli riziku sodíkové zátěže, jejíž důsledky se projeví zvýšenou žízní během mezidialyzační doby, případně až zhoršením podmínek při následující HD. To platí v zásadě pro všechny existující systémy profilování s „off-line“ řízením profilu, ať jsou založeny na manuálně zadaném tvaru profilu CDNa nebo profilu stanoveném na základě sofistikovaného modelu kinetiky sodíku a vody. Zásadní změnu lze tady očekávat až po zavedení kontinuálního vyhodnocování sodíkové bilance z CDNa na vstupu a výstupu dialyzátoru.
Žádoucí je rovněž změna v dietním poradenství, poskytovaném dialyzovaným pacientům. To by mělo klást důraz v první řadě na restrikci příjmu soli, cílená restrikce příjmu tekutin je až druhotná a podle některých prací dokonce zbytečná.
Pro jasnější interpretaci a srovnávání nálezů v jednotlivých publikovaných pracích citelně chybí jasné vztahy mezi výsledky měření CDNa a CPNa prováděných různými metodami a kvantifikace vlivu materiálu membrány (povrchového náboje) a hodnoty celkové plazmatické koncentrace bílkovin na hodnotu CDNa, která by zajistila izonatremický průběh HD. Na řádné ověření zatím také čekají první práce Titzeho o možnosti, podmínkách a dynamice ukládání sodíku v osmoticky neaktivní podobě.
doc. Ing. František Lopot, CSc.
www.vfn.cz
e-mail: f.lopot@vfn.cz
Doručeno do redakce: 22. 5. 2012
Zdroje
1. Bleyer AJ, Russell GB, Satko SG. Sudden and cardiac death rates in hemodialyis patients. Kidney Int 1999; 55 : 1553–1559.
2. Morel K, Hassell D, Kooman JP et al. Ionic mass balance and blood volume preservation during a high, standard, and individualized dialysate sodium concentration. Nephrol Dial Transplant 2002; 17 : 1453–1469.
3. Santos SFF, Peixoto AJ. Revisiting the dialysate sodium prescription as a tool for better blood pressure and interdialytic weight gain management in hemodialysis patients. Clin J Am Soc Nephrol 2008; 3 : 522–530.
4. Santos SFF, Peixoto AJ. Sodium balance and maintenance hemodialysis. Semin Dial 2010; 23 : 549–555.
5. Lomonte C, Basile C. Do not forget to individualize dialysate sodium prescription. Nephrol Dial Transplant 2011; 26 : 1126–1128.
6. Peixoto AJ, Santos SFF. How should the predialysis plasma sodium be interpreted in hemodialysis patients? Semin Dial 2011; 24 : 409–411.
7. Edelman IS, Leibman J, O’Meara MP et al. Interrelation between serum sodium concentration, serum osmolarity and total exchangeable sodium, total exchangeable potassium and total body water. J Clin Invest 1958; 37 : 1236–1256.
8. Workeneh B, Balakumaran A, Bichet DG et al. The dilemma of diagnosing the cause of hypernatremia: drinking habits vs. diabetes insipidus. Nephrol Dial Transplant 2004; 19 : 3165–3167.
9. Schűck O, Tesař V, Teplan V. Klinická nefrologie. Praha: Medprint 1995.
10. Lindley E. Reducing sodium intake in hemodialysis patients. Semin Dial 2009; 22 : 260–263.
11. Hollenberg N. Surfeit, deficit and the set point for sodium homeostasis. Kidney Int 1982; 21 : 883–884.
12. Bonventre JV, Leaf A. Sodium homeostasis, steady states without a set point. Kidney Int 1982; 21 : 880–883.
13. Raja R, Po CL. Plasma refilling during hemodialysis with decreasing ultrafiltration. ASAIO J 1994; 40: M423–M425.
14. De Paula FM, Peixoto AJ, Pinto LV et al. Clinical consequences of an individualized dialysate sodium prescription in hemodialysis patients. Kidney Int 2004; 66 : 1232–1238.
15. Mendoza JM, Byes LY, Sun S et al. Effect of lowering dialysate sodium concentration o interdialytic weight gain and blood pressure in patients undergoing thrice-weekly in-center nocturnal hemodialysis: a quality improvement study. Am J Kidney Dis 2011; 58 : 956–963.
16. Flanigan MJ. Sodium. Semin Dial 2008; 21 : 226–229.
17. Hecking M, Kainz A, Herner H et al. Sodium Setpoint and sodium gradient: influence on plasma sodium change and weight gain. Am J Nephrol 2011; 33 : 39–48.
18. Lopot F, Bláha J, Kotyk P. Řízení koncentrace sodíku při hemodialýze, závěrečná zpráva projektu IGA MZ ČR, č. 1025-3. Praha 1995.
19. Arramreddy R, Sun SJ, Munoz-Mendoza J et al. Individualized reduction in dialysate sodium in conventional hemodialysis. Hemodial Int 2012; doi: 10.1111/j.1542-4758.2012.00701.x.
20. Lambie SH, Taal MW, Fluck RJ et al. On-line conductivity monitoring: validation and usefulness in a clinical trial of reduced dialysate conductivity. ASAIO J 2005; 51 : 70–76.
21. Ogden DA. A double blind crossover comparison of high and low sodium dialysis. Proc Dial Transp Forum 1978; 8 : 157–165.
22. Van Stone JC, Bauer J, Carey J. The effect of dialysate sodium concentration on body fluid distribution during hemodialysis. Trans Am Soc Artif Internal Organs 1980; 26 : 383–386.
23. Gotch FA, Lam MA, Prowitt M et al. Preliminary clinical results with sodium volume modeling of hemodialysis therapy. Proc Dial Transpl Forum 1980; 10 : 12–16.
24. Petitclerc T, Man NK, Funck-Brentano H. Sodium modeling during hemodialysis: a new approach. Artif Organs 1984; 8 : 418–422.
25. Heineken FG, Evans MC, Keen ML et al. Intercompartmental fluid Shift in hemodialysis patients. Biotechnology Progress 1987; 3 : 69–73.
26. Maeda K, Kawaguchi S, Kobayashi S et al. Cell-wash dialysis. Trans Am Soc Artif Internal Organs 1980; 26 : 213–218.
27. Stiller S, Bonnie-Schorn E, Grassmann A et al. A critical review of sodium profilig for hemodialysis. Semin Dial 2001; 14 : 337–347.
28. Coli L, Bonomini M, La Manna G et al. Clinical use of profiled hemodialysis. Artif Organs 1998; 22 : 724–730.
29. Levin A, Goldstein MB. The benefits and side effects of ramped hypertonic sodium in dialysate. J Am Soc Nephrol 1996; 7 : 242–246.
30. Santoro A, Mancini E, Paolini F et al. Blood volume regulation during hemodialysis. Am J Kidney Dis 1998; 32 : 739–748.
31. Steward IJ, Henrich WJ. Is there any role for sodium modeling in the preventiv of intradialytic hypotension in patients with large interdialytic fluid gains? Semin Dial 2011; 24 : 422–423.
32. Song JH, Lee SW, Suh CK et al. Time-averaged concentration of dialysate sodium relates with sodium load and interdialytic weight gain during sodium-profiling hemodialysis. Am J Kidney Dis 2002; 40 : 291–301.
33. Lopot F. Clinical Use of Continuous Blood Volume Monitoring. EDTNA-ERCA J 1996; 22 : 9–14.
34. Gotch F, Evans M, Metzner K et al. An On-line Monitor of Dialyzer Na and K Flux in Hemodialysis. ASAIO Trans 1990; 36 : 359-361.
35. Manlucu J, Gallo K, Heidenheim PA et al. Lowering post-dialysis plasma sodium (conductivity) to increase sodium removal in volume expanded hemodialysis patients: a pilot study using a biofeedback software system. Am J Kidney Dis 2010; 56 : 69.
36. Titze J. Water-free Na+ retention: interaction with hypertension and tissue hydration. Blood Purif 2008; 26 : 95–99.
37. EBPG guideline on haemodynamic stability. Nephrol Dial Transplant 2007; 22 (Suppl 2): 22–44.
38. Shaldon S, Vienken J. Beyond the current paradigm: recent advances in the understanding of sodium handling. Semin Dial 2009; 22 : 252.
39. Rupp JW, Stone RA, Gunning BE. Sodium vs. sodium-fluid restriction in hemodialysis: control of weight gains and blood pressures. Am J Clin Nutr 1978; 31 : 1952–1955.
40. Keen ML, Gotch FA. The association of the sodium „setpoint“ to interdialytic weight gain and blood pressure in hemodialysis patients. Int J Artif Organs 2007; 30 : 971–979.
41. Mendoza JM, Sun S, Chertow GM et al. Dialysate sodium and sodium gradient in maintenance hemodialysis: a neglected sodium restriction approach? Nephrol Dial Transplant 2011; 26 : 1281–1287.
42. Ramdeen GR, Tzamaloukas AH, Malhotra D et al. Estimates of interdialytic sodium and water intake based on the balance principle, differences between nondiabetic and diabetic subjects on hemodialysis. ASAIO J 1998; 44 : 812–817.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo 7 a 8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Jubilant prof. Miroslav Penka, CSc.
- Profesor Miroslav Penka – jeden z běžců Maratónu pro hemofilii
- CZEMP – děcko prof. Penky
- Profylaxe a léčba antifosfolipidového syndromu – současné možnosti, úskalí a perspektivy do budoucna
- Změny kalcium-fosfátového metabolizmu při chronických nefropatiích
- Terapeutický přístup ke krvácení v souvislosti se „starými“ a „novými“ antikoagulans
- Možnosti diagnostiky heparinem indukované trombocytopenie v České republice
- Pokrok v oblasti mnohočetného myelomu a vývoj souvisejícího laboratorního zázemí
- Jak v ambulantní péči neprošvihnout rozvíjející se kritické poruchy hemostázy
- Frekvence nových trombofilních mutací antitrombinu (SERPINC1) (IVS +141G>A), glykoproteinu GPVI (Ser219Pro) a cytochromu CYP4V2 (Lys259Gln) u zdravých osob středního věku v oblasti středních Čech
- Megakaryopoéza a geneze destiček
- Získaná hemofilie A
- Současné možnosti diagnostiky a léčby myelomové kostní nemoci v klinické praxi
- Vysokodávková léčba a přípravné režimy před transplantací krvetvorných buněk
- Refeeding syndrom u mladého pacienta s anxiózně-depresivní poruchou
- K životnímu jubileu prof. MUDr. Miroslava Součka, CSc.
- Detekce KRAS a jeho mutace v biopsii pokročilého kolorektálního karcinomu při koloskopii
- Syndróm nepokojných nôh u dialyzovaných pacientov
- Tuhosť aorty zvyšuje centrálny aortový tlak u pacientov s hypertenziou
- Jak definovat osoby s vysokým rizikem pankreatického karcinomu
- Veľkosť LDL lipoproteínových partikúl u pacientov s náhlou mozgovocievnou príhodou
- Trojkombinační léčba chronické hepatitidy C
- Chronický zánět a metabolický syndrom
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Fixní kombinace v léčbě hypertenze
- Farmakoterapie hypertenze po transplantaci srdce
- Snížení srdeční frekvence u srdečního selhání: změny funkce levé komory a kvalita života v podstudiích SHIFT
- Antagonisty aldosterónu v liečbe chronického srdcového zlyhávania
- Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby
- Antiaterogénny účinok HDL subpopulácií u jedincov s novodiagnostikovanou končatinovocievnou artériovou chorobou
- Konečné stadium chronického onemocnění ledvin a metabolická acidóza
- Chronické ochorenie obličiek a vápniková homeostáza bunky
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
- Koncentrace sodíku v dialyzačním roztoku – důležitý, ale opomíjený parametr hemodialýzy u nemocných s chronickým selháním ledvin
- Solit nebo nesolit při ledvinových chorobách? Ne více než quantum satis!
- Oxidačný stres a antioxidačné systémy u hemodialyzovaných chorých
- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Významné životné jubileum profesora MUDr. Miroslava Mydlíka, DrSc.
- Vzťah mikroalbuminúrie a obezity u zdravých mladistvých – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kontrastová nefropatie a možnosti její prevence
- Farmakogenetické aspekty liečby orálnymi antidiabetikami
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Infarkt myokardu v mladom veku – naše výsledky a skúsenosti
- Požadavky na předoperační vyšetření z pohledu anesteziologa
- Megakaryopoéza a geneze destiček
- Ischemické a neischemické příčiny elevace ST segmentu u pacientů s bolestí na hrudi: Systematický přehled literatury
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



