-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Jak klinicky interpretovat výsledky TP53 analýz u chronické lymfocytární leukemie v kontextu dostupných terapeutických režimů
How to clinically interpret the results of TP53 analyses in chronic lymphocytic leukaemia in the context of available therapeutic regimens
TP53 gene mutations represent the most important adverse prognostic and predictive factor in patients with chronic lymphocytic leukaemia (CLL) and contribute to an overall worse disease course and risk of early relapse or resistance to chemoimmunotherapy. Results to date suggest that first-line chemoimmunotherapy (FCR) results in clonal selection of TP53 aberrant cells, which has an adverse effect on disease prognosis. Recent studies investigating the clonal evolution of TP53 mutations under BCR and Bcl-2 inhibitor therapy do not suggest a similar trend. Next-generation sequencing (NGS) methods are being increasingly used in the clinical diagnosis of TP53 aberrations, achieving sensitivity of allelic frequency detection below 10% compared to standard Sanger sequencing. In recent years, the focus of CLL research has been on TP53 gene mutations with allelic frequencies below 10% and their clinical significance. In the following review article, we summarize the results published so far on the clonal evolution of TP53 gene mutations under different therapeutic regimens, especially with respect to mutations with an allelic frequency < 10% and their clinical interpretation.
Keywords:
chronic lymphocytic leukemia – TP53 mutations – clonal evolution – FCR – BRC and Bcl-2 inhibitors
Autoři: B. Kunt Vonková 2; Š. Pavlová 1,2; J. Malčíková 1,2; K. Pál 2; Y. Brychtová 1; A. Panovská 1; Š. Pospíšilová 1,2; M. Doubek 1,2
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut, MU, Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. 2, p. 117-123.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd2023prolekare.cz11Souhrn
Mutace v genu TP53 představují nejdůležitější nepříznivý prognostický a prediktivní faktor u pacientů s chronickou lymfocytární leukemií (CLL) a přispívají k celkově horšímu průběhu onemocnění a riziku časného relapsu či rezistenci na podávanou chemoimunoterapii. Z dosavadních výsledků vyplývá, že při léčbě chemoimunoterapií (fludarabin, cyklofosfamid a rituximab – FCR) v první linii dochází ke klonální selekci TP53 aberantních buněk, což má nepříznivý vliv na prognózu onemocnění. Recentní studie zabývající se klonální evolucí mutací v genu TP53 pod vlivem terapie BCR a Bcl-2 inhibitorovými léčivy podobný trend nenaznačují. V klinické diagnostice aberací TP53 se čím dál více využívá metody sekvenování nové generace (NGS), které dosahují citlivosti detekce alelické frekvence pod 10 % oproti standardně zavedenému Sangerovu sekvenování. V posledních letech se pozornost výzkumu CLL upíná zejména k mutacím v genu TP53 s alelickou frekvencí pod 10 % a jejich klinickou významnost. V následujícím přehledovém článku shrnujeme doposud publikované výsledky klonální evoluce mutací v genu TP53 pod vlivem různým terapeutických režimů zejména s ohledem na mutace s alelickou četností < 10 % a jejich klinickou interpretaci.
Klíčová slova:
chronická lymfocytární leukemie – mutace TP53 – klonální evoluce – FCR – BRC a Bcl-2 inhibitory
ÚVOD
Chronická lymfocytární leukemie (CLL) je chronické lymfoproliferativní onemocnění charakterizované klonální proliferací maligně transformovaných maturovaných B-lymfocytů a jejich akumulací v periferní krvi, kostní dřeni, lymfatických uzlinách, slezině či dalších orgánech.
CLL je leukemie s nejvyšší incidencí a prevalencí v západním světě. Jedná se o onemocnění, u něhož je molekulárně-genetické vyšetření rutinní součástí diagnostického a léčebného algoritmu nezbytného k zvolení vhodného typu terapie pro konkrétního pacienta. Diagnostická kritéria jsou založena na analýze periferní krve, případně kostní dřeně, proto není nutné provádět invazivní výkony typu biopsie uzlin, které jsou pro pacienta více zatěžující. Biologický materiál je proto snadno dostupný jak pro diagnostiku i sledování vývoje onemocnění a odpovědi na léčbu, tak pro analýzu prediktivních markerů pro zvolení vhodné cílené terapie. V neposlední řadě neinvazivní odběr nádorových buněk usnadňuje i výzkum, který v posledním desetiletí vedl k značnému rozšíření léčebných možností. I přes výše uvedené výhody a stále se zdokonalující cílenou terapii významně prodlužující život pacientů však CLL zůstává nevyléčitelným onemocněním.
VÝZNAM DEFEKTŮ V GENU TP53 U PACIENTŮ S CLL PŘI LÉČBĚ CHEMOIMUNOTERAPIÍ A CÍLENÝMI LÁTKAMI
Defekty genu TP53 společně s nemutovaným IGHV a komplexními změnami karyotypu v současnosti představují nejsilnější negativní prognostické znaky tohoto onemocnění [1,2].
Produkt genu TP53, protein p53, koordinuje celou řadu mechanizmů spojených s odpovědí na buněčný stres a poškození DNA, zejména regulaci buněčného cyklu a spuštění apoptózy. Pro svou zcela zásadní roli v udržování stability genomu bývá p53 označován jako „strážce genomu“. Gen TP53 patří mezi nádorové supresory, jeho inaktivace akceleruje maligní transformaci. Vzhledem k tomu, že poškození DNA je klíčovým mechanizmem klasické chemoterapie, zhoršují defekty genu TP53 odpověď nádoru na chemoterapii. Selekční tlak vyvolaný chemoterapií navíc podporuje přežití nádorových buněk s nefunkčním p53 a jejich klonální expanzi v relapsu onemocnění.
Aberace TP53 se vyskytují u 5–12 % doposud neléčených pacientů s CLL a jejich incidence signifikantně narůstá pod vlivem chemoimunoterapie (CHIT). U pokročilého, refrakterního či transformovaného onemocnění lze aberace TP53 zachytit u 40–60 % pacientů. U více než poloviny případů se jedná o společný výskyt mutace TP53 a delece genového lokusu [del (17p) ], zatímco samostatný výskyt těchto aberací je pozorován méně často. Samostatná mutace TP53, kterou není možné detekovat vyšetřením FISH (fluorescenční in situ hybridizace), je pozorována u 20–40 % pacientů, zatímco samostatná del (17p) je vzácnější a vyskytuje se u 5–30 % pacientů s TP53 defekty, a to v závislosti na vyšetřované kohortě [3,4].
V současné době je doporučováno vyšetření aberací TP53 vždy před zahájením nové linie terapie. European Society for Medical Oncology (ESMO) doporučuje nejdříve vyšetření přítomnosti delece lokusu 17p13 metodou FISH a poté dovyšetření mutačního stavu TP53 až v případě negativního výsledku FISH [5]. Zároveň mají být vyšetření provedena v co nejkratším časovém intervalu před zahájením každé nové linie terapie. Tato posloupnost vyšetření je sice finančně racionální, avšak vzhledem k časové náročnosti obou vyšetření v řádech týdnů mnohdy obtížně uskutečnitelná v souladu s požadavkem na vyšetření co nejblíže zahájení terapie. Naopak dle doporučení European Research Initiative on CLL (ERIC) a International Workshop on CLL (iwCLL) je zejména z výše uvedeného důvodu vhodné provést vyšetření FISH i mutačního stavu TP53 zároveň [6–8]. Záleží tedy na finančních a časových možnostech pracoviště, jak bude v případě vyšetření TP53 aberací postupovat.
Prognóza pacientů s defekty TP53 byla ještě donedávna považována za velmi nepříznivou, a i přes velkou snahu o zavedení alternativních léčebných postupů nevedlo úsilí lékařů k prodloužení přežití pacientů. Významné zlepšení přineslo až zavedení nových léčiv cílících na dráhy klíčové pro proliferaci a přežití CLL buněk – dráhu B-buněčného receptoru (inhibitory BTK a PI3Kd) a antiapoptotický protein bcl-2. Předpokládá se, že mechanizmus účinku těchto léčiv je nezávislý na dráze p53. Data ze studií sledujících vliv defektů TP53 na léčbu inhibitory skutečně ukázala výborné výsledky léčby, a to i pro pacienty, jimž byla terapie podána po několika předcházejících liniích CHIT, kdy již byli často nositeli dalších aberací a/či komplexního karyotypu [9–11]. Z dosavadních výsledků nicméně také vyplývá, že prodloužení přežití při terapii inhibitory je ovlivněno řadou dalších faktorů. OS nepřímo úměrně koreluje s celkovým počtem předcházejících linií léčeb a některá data také naznačují variabilitu délky PFS v závislosti na režimu podávání léčiva [12]. Z výsledků klinických studií hodnotících účinnost inhibitorů BTK vyplývá, že by tato terapie mohla při podávání v první linii překonat negativní vliv TP53 defektů: výsledky dlouhodobého sledování pacientů léčených kontinuálně podávaným ibrutinibem (studie A041202) publikované ve formě ASH abstraktu ukázaly, že PFS pacientů s TP53 aberacemi je srovnatelné s pacienty s TP53wt (wild-type) [13]. U pacientů léčených kontinuálním podáváním BTK inhibitoru akalabrutinib (s obinutuzumabem a bez) ve studii ELEVATE-TN obdobně nebyl zaznamenán signifikantní rozdíl v PFS mezi pacienty s a bez TP53 defektu [14]. Nutno poznamenat, že srovnání bylo prováděno v časovém horizontu 48 měsíců a není vyloučeno, že by se případný rozdíl mohl projevit i později. Možnosti cílené léčby u pacientů s TP53 defekty dokládají výsledky 3. fáze studie SEQUOIA, kde v nerandomizované kohortě pacientů s del (17p) léčené zanubrutinibem v monoterapii první linie (rameno C) bylo dosaženo obdobného PFS a OS v 24 měsících jako u pacientů bez del (17p) (rameno A): PFS 88,9 % vs. 85,5% a 93,6 % vs 94,3%, respektive. Přímé statistické porovnání obou skupin není bohužel dispozici, ale i tak data ukazují excelentní výsledky u takto rizikové skupiny pacientů. Oproti tomu při časově omezené léčbě první linie kombinací obinutuzumab (6 cyklů) – venetoclax (12 cyklů) ve studii CLL14 pacienti s TP53 aberacemi relabovali dříve než pacienti bez těchto aberací [15]. Tito pacienti však dosahovali kompletních remisí a negativity minimální zbytkové choroby srovnatelně s pacienty bez TP53 defektů. Proto autoři předkládají úvahu, že zkrácené PFS lze pravděpodobně přičítat spíše rychlejší obnově populace buněk s TP53 defekty nežli jejich primární rezistenci vůči venetoclaxu. Jelikož však dosud nemáme k dispozici údaje o vlivu TP53 defektů na trvání PFS při kontinuálním podávání venetoclaxu, nelze v současnosti rozhodnout, do jaké míry je délka trvání remise u pacientů s TP53 defekty ovlivněna typem podávaného léčiva či délkou terapie. V tomto ohledu bude třeba dalších studií, které snad povedou k optimalizaci léčebných algoritmů pro tuto rizikovou skupinu pacientů.
MUTACE TP53 POD 10 % VAF PŘI LÉČBĚ CHEMOTERAPEUTICKÝMI REŽIMY
Interpretace mutačního stavu TP53 je v současnosti vázána především na arbitrárně stanovenou hranici 10 % alelické frekvence (variant allele frequency – VAF) dle Sangerova sekvenování, neboť i současně platná doporučení jsou založena zejména na výsledcích velkých studií využívajících pro identifikaci mutací právě Sangerovo sekvenování [4,6,16,17].
S rozvojem technologických možností došlo přibližně od roku 2013 k výraznému rozšíření možností sekvenování nové generace (NGS) a limit detekce se díky těmto metodám posunul hluboko pod 10 % VAF (v některých studiích až k 0,1% VAF) [12,18–20]. Pozornost se stále častěji začala obracet ke klinickému významu malých TP53-mutovaných klonů u pacientů s CLL.
Při detekci těchto tzv. minoritních mutací (pod 10 % VAF) je pro správnou interpretaci nálezu nezbytné brát v úvahu celkový obraz onemocnění. Zcela klíčové je vztahovat podíl CLL buněk k celkové lymfocytóze či k jejich distribuci, která může být převážně v periferní krvi nebo naopak v uzlinách v případě SLL či relapsu do uzlin. Ne zřídka se tak můžeme setkat s nepřesným stanovením; pokud bychom detekovali malou populaci nízkofrekvenčních klonů v krvi při převážně uzlinovém postižení, mohli bychom mylně přehlédnout dominantní zastoupení v celkové nádorové populaci. V takovém případě bychom mohli dokonce nalézt i výsledek zcela falešně negativní. Vezmeme-li např. současnou hranici pro reportování mutace 10 % VAF, pak v kontextu různého zastoupení nádorových buněk v analyzovaném vzorku a statusu druhé alely může tento výsledek znamenat zcela jinou velikost TP53-defektního klonu (obr. 1).
Obr. 1. Podíl nádorových buněk nesoucích TP53 aberace při výsledku sekvenování nové generace ≈10 % VAF v závislosti na proporci nádorových buněk ve vzorku a stavu druhé alely. (A) Poškození jedné alely mutací. Druhá alela může být intaktní nebo vyřazena nezávislou mutací. (B) Kombinace mutace jedné alely a delece druhé alely detekované pomocí FISH (VAF = 11,1 %). (C) Obě alely mutované mechanizmem zdvojení mutované alely cnLOH. 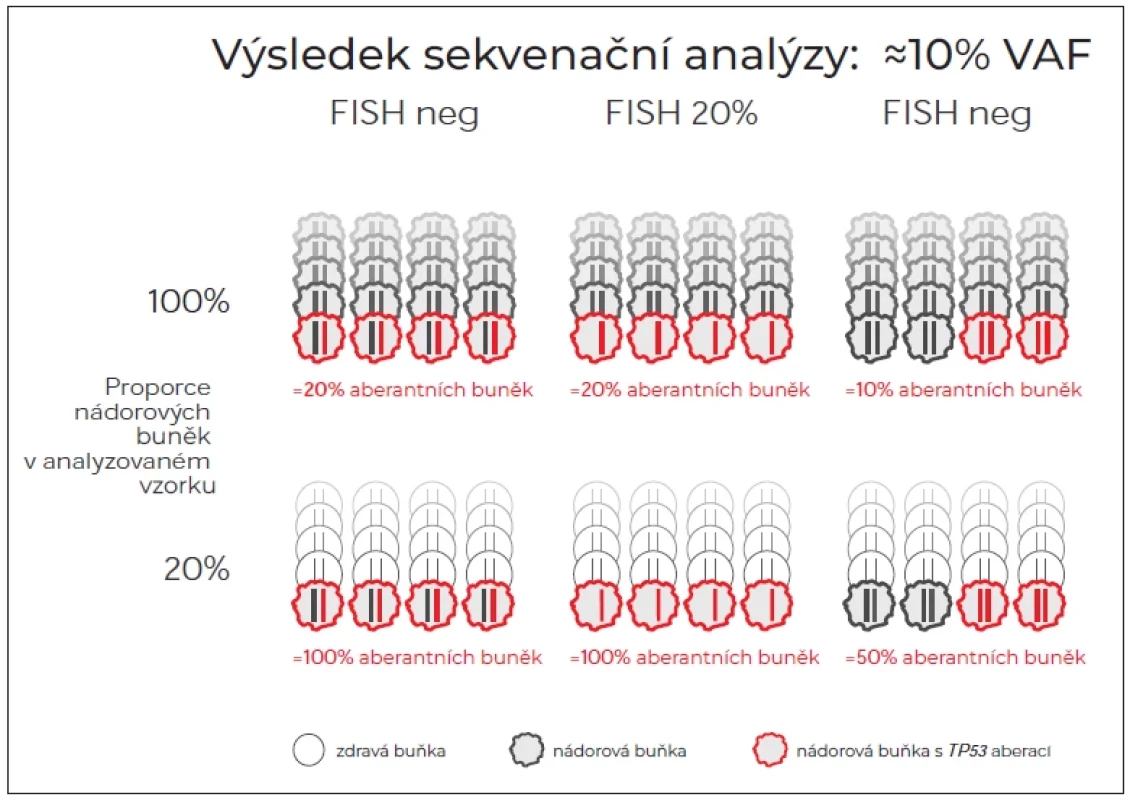
cnLOH – copy neutral loss of heterozygosity; FISH – fl uorescenční in situ hybridizace; VAF – alelická frekvence Při studiu prací, které se věnují vlivu minoritních mutací TP53 na přežití pacientů, je třeba brát ohled na to, ve které fázi onemocnění byli pacienti vyšetřováni (tab. 1). První data zabývající se klinickým dopadem minoritních mutací TP53 na celkové přežití byla získána na souborech pacientů vyšetřených v době diagnózy či v brzkých stádiích onemocnění [18,19]. Tyto publikace ukazovaly vliv na celkové přežití srovnatelný s výskytem mutací TP53 > 10 % [18,19]. Pozdější práce z dánského pracoviště vliv na přežití nepotvrdila [20]. Nejnovější velká italská studie znovu ukázala významně zkrácené celkové přežití pacientů nesoucí mutace TP53 < 10 % VAF. Nicméně při srovnání jednotlivých skupin je patrný trend naznačující delší OS pacientů s TP53 < 10 % oproti pacientům s TP53 > 10 % [21]. Možnou příčinou nejednotných výsledků je heterogenita kohort vyšetřovaných při diagnóze, zejména variabilní podíl dlouhodobě neléčených pacientů s převážně mutovaným IGHV; u těchto pacientů by dle současných doporučení nebylo vyšetření TP53 ani indikováno.
Další provedené studie se proto zaměřily na odběr vzorků od pacientů s aktivní CLL před zahájením první linie CHIT. Výsledná data těchto velkých studií a pilotní data od pacientů před terapií z výše zmiňovaných publikací se již jednoznačně shodovala na vlivu minoritních klonů TP53 na zkrácení OS v porovnání s pacienty bez TP53 mutací [12,18,20–22]. Při podrobnějším pohledu na data založená na větších kohortách pacientů se ovšem ukazuje, že prognóza pacientů s minoritními TP53-mutovanými klony je spíše střední, s mediánem OS mezi pacienty s mutacemi nad 10 % VAF a pacienty bez mutace TP53 (tab. 1) [12,21,22].
Tab. 1. Přehled a charakteristika studií zabývající se klinickým dopadem TP53 mutací vč. minoritních mutací při léčbě chemoimunoterapií. Statisticky významné rozdíly jsou znázorněny tučně. 
Některé z výše zmíněných studií analyzovaly dopad minoritních TP53 mutací nejen na OS, ale i na PFS po 1. linii CHIT [12,21,22]. Ani tyto výsledky nebyly zcela konzistentní, nicméně některé z nich ukazovaly, že vliv minoritních mutací TP53 na PFS již není tak jednoznačný a doba remise není signifikantně zkrácena oproti pacientům bez mutace [12,22]. Vysvětlením tohoto pozorování může být nutnost expanze TP53 mutovaného klonu pod vlivem CHIT k jeho klinické manifestaci.
TP53 MUTACE POD 10 % VAF PŘI POUŽITÍ INHIBITORŮ
S nástupem cílené léčby pro pacienty s TP53 defekty vyvstala také nově otázka klinického vlivu minoritních mutací v kontextu nových léčebných postupů. Tato otázka v současnosti představuje velmi aktuální téma CLL výzkumu, avšak pro recentnost a technickou náročnost vyšetřování těchto minoritních mutací jsou data z léčby inhibitory prozatím velice omezená. Výsledky dosud publikovaných prací jsou limitované zejména nejednotnou kohortou pacientů, často velmi výrazně předléčených mnoha liniemi terapie, a podáním různých druhů inhibitorů vč. jejich kombinací [12,23].
Práce publikovaná v letošním roce se zabývala vlivem alelické četnosti mutací TP53 na odpověď na léčbu inhibitory v první linii i na celkové přežití (BTK inhibitor ± venetoclax ± mAb). Autoři nepozorovali signifikantní rozdíl v PFS i OS po 4 letech sledování mezi pacienty s nízkofrekvenčními (VAF 1–10 %) a vysokofrekvenčními (VAF ≥ 10 %) variantami TP53 [23]. Tato studie však měla celou řadu omezení, zejména pak chybějící klíčové srovnání s kohortou pacientů s wtTP53, nevyvážené zastoupení konkrétních terapeutických režimů mezi kohortami, či nepřesně popsanou metodiku testování mutačního stavu TP53 napříč kohortou. Přežití relabovaných pacientů s minoritními TP53 mutacemi léčených inhibitory v České republice jsme se snažili analyzovat i v rámci naší práce a nepozorovali jsme významný rozdíl napříč kohortami pacientů s různou mutační náloží. Nicméně náš soubor byl složen z pacientů léčených různými inhibitorovými režimy a v různém stadiu předléčenosti, a proto z těchto výsledků nelze vyvozovat jednoznačné závěry [12].
KLONÁLNÍ EVOLUCE MINORITNÍCH TP53 MUTACÍ
Zatímco vliv minoritních TP53 mutací na léčebnou odpověď a přežití pacientů je stále diskutován, vliv CHIT na expanzi klonů nesoucích TP53 defekty byl nejen opakovaně publikován, ale je také jednoznačně viditelný v rutinní klinické praxi [4,12,18,24–26]. Konkrétní případy expanze TP53 defektů po CHIT jsou pozorovány zejména díky rozšiřujícímu se využití NGS se spolehlivým detekčním limitem okolo 5 % VAF v rutinních laboratorních provozech. V naší nedávno publikované studii byla na souboru více než 50 pacientů vstupujících do 1. léčby potvrzena klonální selekce již dříve existujících subklonů nesoucích TP53 aberace pod vlivem CHIT, zejména FCR (fludarabin, cyklofosfamid a rituximab) režimu [12]. V kontextu cílené terapie novými režimy s inhibitory však byla expanze TP53 mutovaných klonů pozorována jen ojediněle (graf 1). V souladu s dalšími nedávnými studiemi bylo pozorováno heterogenní chování minoritních TP53 klonů pod vlivem terapie inhibitory s převažujícími nevýznamnými změnami oběma směry [27,28]. Jen ve zcela ojedinělých případech byl pozorován klonální nárůst i při terapii inhibitory, zde je však nutné brát v potaz celkový biologický obraz takovýchto případů, např. výskyt přidružených „driver“ BTK mutací. Z těchto pozorování vyplývá, že na rozdíl od léčby chemoimunoterapií již TP53 mutace při terapii inhibitory není „driver“ mutací [12].
Graf 1. Změny velikosti minoritních mutací po léčbě různými terapeutickými režimy (medián, dolní a horní kvartil). Při terapii FCR v první i druhé linii dochází k nárůstu VAF TP53 mutací přibližně 10násobně, oproti stavu před léčbou. Při terapii R/R pacientů inhibitorovou léčbou nebyl tento nárůst VAF pozorován. Převzato a upraveno [12]. ![Změny velikosti minoritních mutací po léčbě různými terapeutickými
režimy (medián, dolní a horní kvartil). Při terapii FCR v první i druhé linii
dochází k nárůstu VAF TP53 mutací přibližně 10násobně, oproti stavu před
léčbou. Při terapii R/R pacientů inhibitorovou léčbou nebyl tento nárůst VAF
pozorován. Převzato a upraveno [12].](https://pl-master.mdcdn.cz/media/image_pdf/f8b16ea669e57ff06a4ef638b80b7268.png?version=1687019299)
FCR – chemoimunutorepie (fl udarabin, cyklofosfamid a rituximab); R/R – relabované/refrakterní; VAF – alelická frekvence SHRNUTÍ A NÁVRH PŘIPRAVOVANÝCH DOPORUČENÍ
Co tedy vyplývá ze současných poznatků o chování minoritních TP53 mutací během léčby různými terapeutickými režimy? Studie jasně dokazují vysoké riziko klonální expanze minoritních TP53 mutací pod vlivem FCR režimu, což vede ke zkrácení celkového přežití pacientů. Je čím dál více zřejmé, že cílená léčba inhibitory takovouto expanzi TP53 mutovaných klonů neakceleruje. V klinické praxi je pro nález minoritních TP53 mutací stále v platnosti doporučení ERIC, tedy při VAF 5–10 % je možné klinicky reportovat pouze s poznámkou o nejasném klinickém významu. U TP53 mutací s VAF < 5 % se pro jejich dosavadní nejasnou klinickou významnost a vysoké riziko falešně negativních a falešně pozitivních výsledků reportování prozatím nedoporučuje [6,8]. Nicméně s ohledem na přesvědčivé výsledky dosud publikovaných studií, zavádění spolehlivých NGS metod do rutinní praxe a na již delší dobu probíhající odbornou diskuzi na mezinárodní úrovni se uvedená doporučení stávají zastaralými a v současné době se připravuje jejich aktualizace. Mezinárodní panel odborníků pro CLL se nyní spíše přiklání k názoru reportovat všechny varianty mutací TP53, a to bez ohledu na jejich VAF. Toto stanovisko je samozřejmě založeno na předpokladu, že v laboratoři je zavedena spolehlivě validovaná NGS metoda a pracoviště se pravidelně účastní externích kontrol kvality (TP53 ERIC certifikace, GenQA Chronic Lymphocytic Leukaemia (CLL) TP53 mutation analysis). Přestože se NGS stává preferovanou technologií, je při jeho nedostupnosti stále možné využít Sangerovo sekvenování. Bez ohledu na použitou metodu detekce zůstává stále v platnosti, že zodpovědnost za správný laboratorní výsledek (technologicky i interpretačně) nese laboratoř, zatímco za klinickou aplikaci výsledku pro zvolení příslušné léčby zodpovídá ošetřující lékař (obr. 2). Pro správnou volbu terapie by měl lékař mít k dispozici kompletní informace o pacientovi, tedy i o přítomnosti minoritního TP53-mutovaného klonu. Při posuzování velikosti postiženého klonu je navíc třeba brát v úvahu nejen velikost mutace udávané jako VAF, ale i proporci nádorové populace a použitou metodu separace (obr. 1). Výsledná informace by pak měla být uvažována v kontextu dostupných terapeutických možností. Mutace dominující v nádorové populaci s vysokou pravděpodobností bezprostředně ovlivňuje odpověď na léčbu, zatímco přítomnost minoritního klonu představuje riziko expanze za přítomnosti selekčního tlaku při nesprávně zvolené terapii. Při současně stále probíhajícím intenzivním výzkumu se snad již zanedlouho dočkáme odpovědi na otázku, zda a jak velký význam mají mutace TP53 s VAF < 10 % při rozhodování o typu cílené léčby (např. z hlediska délky podávání a konkrétního typu inhibitoru) či zda převáží vliv majoritní části nádorové populace nesoucí intaktní gen TP53.
Obr. 2. Rozdělení odpovědnosti při diagnostice CLL. 
CLL – chronická lymfocytární leukemie PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
BKV, JM, ŠPav, MD, KP – příprava rukopisu
YB, AP, ŠPosp, MD – korekce a revize rukopisu
ČESTNÉ PROHLÁŠENÍ AUTORŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
PODĚKOVÁNÍ
Práce byla realizována za podpory Grantu pro specifický výzkum LF MU pod grantovým číslem MUNI/A/1224/2022 a MZ ČR – RVO (FNBr, 65269705). Podpořeno projektem Národní ústav pro výzkum rakoviny (Program EXCELES, ID: LX22NPO5102) – Financováno Evropskou unií – Next Generation EU.
Do redakce doručeno dne: 30. 9. 2022.
Přijato po recenzi dne: 30. 12. 2022.
prof. MUDr. Michael Doubek, Ph.D.
IHOK FN Brno
Jihlavská 20
625 00 Brno
e-mail: doubek.michael@fnbrno.cz
Transfuze Hematol Dnes 2023; 29(2): 117 – 123
Zdroje
1. Pospíšilová Š, Jarošová M, Doubek M. Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice. Transfuze Hematol Dnes. 2019; (1): 66–71.
2. Campo E, Cymbalista F, Ghia P, et al. TP53 aberrations in chronic lymphocytic leukemia: an overview of the clinical implications of improved diagnostics. Haematologica. 2018; 103 (12): 1956–1968. doi: 10.3324/haematol. 2018.187583
3. Malcikova J, Smardova J, Rocnova L, et al. Monoallelic and biallelic inactivation of TP53 gene in chronic lymphocytic leukemia: selection, impact on survival, and response to DNA damage. Blood. 2009; 114 (26): 5307–5314. doi: 10.1182/blood-2009-07-234708
4. Zenz T, Eichhorst B, Busch R, et al. TP53 Mutation and survival in chronic lymphocytic leukemia. J Clin Oncol. 2010; 28 (29): 4473–4479. doi: 10.1200/JCO.2009.27.8762
5. Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2021; 32 (1): 23–33. doi: 10.1016/j.annonc.2020.09.019
6. Malcikova J, Tausch E, Rossi D, et al. ERIC recommendations for TP53 mutation analysis in chronic lymphocytic leukemia – update on methodological approaches and results interpretation. Leukemia. 2018; 32 (5): 1070–1080. doi: 10.1038/s41375-017-0007-7
7. Hallek M, Cheson BD, Catovsky D, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood. 2018; 131 (25): 2745–2760. doi: 10.1182/blood-2017-09-806398
8. Smolej L, Špaček M, Pospíšilová Š, et al. Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) 2021. Transfuze Hematol Dnes. 2021; 27 (1): 91–106. doi: 10. 48095/cctahd202191
9. O’Brien S, Jones JA, Coutre SE, et al. Ibrutinib for patients with relapsed or refractory chronic lymphocytic leukaemia with 17p deletion (RESONATE-17): a phase 2, open-label, multicentre study. Lancet Oncol. 2016; 17 (10): 1409–1418. doi: 10.1016/S1470-2045 (16) 30212-1
10. Brown JR, Byrd JC, Coutre SE, et al. Idelalisib, an inhibitor of phosphatidylinositol 3-kinase p110d, for relapsed/refractory chronic lymphocytic leukemia. Blood. 2014; 123 (22): 3390–3397. doi: 10.1182/blood-2013-11-535047
11. Roberts AW, Davids MS, Pagel JM, et al. Targeting BCL2 with venetoclax in relapsed chronic lymphocytic leukemia. N Engl J Med. 2016; 374 (4): 311–322. doi: 10.1056/NEJMoa1513 257
12. Malcikova J, Pavlova S, Kunt Vonkova B, et al. Low-burden TP53 mutations in CLL: clinical impact and clonal evolution within the context of different treatment options. Blood. 2021; 138 (25): 2670–2685. doi: 10.1182/ blood.2020009530
13. Woyach JA, Ruppert AS, Heerema NA, et al. Long-term results of alliance A041202 show continued advantage of ibrutinib-based regimens compared with bendamustine plus rituximab (BR) chemoimmunotherapy. Blood. 2021; 138 (Suppl 1): 639–639. doi: 10.1182/ blood-2021-153146
14. Sharman JP, Egyed M, Jurczak W, et al. Efficacy and safety in a 4-year follow-up of the ELEVATE-TN study comparing acalabrutinib with or without obinutuzumab versus obinutuzumab plus chlorambucil in treatment-naïve chronic lymphocytic leukemia. Leukemia. 2022; 36 (4): 1171–1175. doi: 10.1038/s41375-021-01485-x
15. Al-Sawaf O, Zhang C, Tandon M, et al. Venetoclax plus obinutuzumab versus chlorambucil plus obinutuzumab for previously untreat - ed chronic lymphocytic leukaemia (CLL14): follow-up results from a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2020; 21 (9): 1188–1200. doi: 10.10 16/S1470-2045 (20) 30443-5
16. Gonzalez D, Martinez P, Wade R, et al. Mutational status of the TP53 gene as a predictor of response and survival in patients with chronic lymphocytic leukemia: results from the LRF CLL4 trial. J Clin Oncol. 2011; 29 (16): 2223–2229. doi: 10.1200/JCO.2010.32.0838
17. Stilgenbauer S, Schnaiter A, Paschka P, et al. Gene mutations and treatment outcome in chronic lymphocytic leukemia: results from the CLL8 trial. Blood. 2014; 123 (21): 3247–3254. doi: 10.1182/blood-2014-01-546150
18. Rossi D, Khiabanian H, Ciardullo C, et al. Clinical impact of small TP53 mutated subclones in chronic lymphocytic leukemia. Blood. 2013; 122 (21): 116–116. doi: 10.1182/blood.V122.21.116.116
19. Nadeu F, Delgado J, Royo C, et al. Clinical impact of clonal and subclonal TP53, SF3B1, BIRC3, NOTCH1, and ATM mutations in chronic lymphocytic leukemia. Blood. 2016; 127 (17): 2122–2130. doi: 10.1182/blood-2015-07-659144
20. Brieghel C, Kinalis S, Yde CW, et al. Deep targeted sequencing of TP53 in chronic lymphocytic leukemia: clinical impact at diagnosis and at time of treatment. Haematologica. 2019; 104 (4): 789–796. doi: 10.3324/haematol.2018.195818
21. Bomben R, Rossi FM, Vit F, et al. TP53 mutations with low variant allele frequency predict short survival in chronic lymphocytic leukemia. Clin Cancer Res. 2021; 27 (20): 5566–5575. doi: 10.1158/1078-0432.CCR-21-0701
22. Blakemore SJ, Clifford R, Parker H, et al. Clinical significance of TP53, BIRC3, ATM and MAPK-ERK genes in chronic lymphocytic leukaemia: data from the randomised UK LRF CLL4 trial. Leukemia. 2020; 34 (7): 1760–1774. doi: 10.1038/s41375-020-0723-2
23. Cherng HJ, Khwaja R, Kanagal‐Shamanna R, et al. TP53 ‐altered chronic lymphocytic leukemia treated with firstline Bruton’s tyrosine kinase inhibitor‐based therapy: A retrospective analysis. Am J Hematol. 2022; 97 (8): 1005–1012. doi: 10.1002/ajh.26595
24. Bomben R, Rossi FM, D’Agaro T, et al. Clinical impact of clonal and subclonal TP53 mutations and deletions in chronic lymphocytic leukemia: an Italian multicenter experience. Blood. 2019; 134 (Suppl 1): 480–480. doi: 10.1182/blood - 2019-124647
25. Landau DA, Carter SL, Stojanov P, et al. Evolution and impact of subclonal mutations in chronic lymphocytic leukemia. Cell. 2013; 152 (4): 714–726. doi: 10.1016/j.cell.2013.01.019
26. Malcikova J, Stano-Kozubik K, Tichy B, et al. Detailed analysis of therapy-driven clonal evolution of TP53 mutations in chronic lymphocytic leukemia. Leukemia. 2015; 29 (4): 877–885. doi: 10.1038/leu.2014.297
27. Gángó A, Alpár D, Galik B, et al. Dissection of subclonal evolution by temporal mutation profiling in chronic lymphocytic leukemia patients treated with ibrutinib. Int J Cancer. 2020; 146 (1): 85–93. doi: 10.1002/ijc.32502
28. Cafforio L, Raponi S, Cappelli LV, et al. Treatment with ibrutinib does not induce a TP53 clonal evolution in chronic lymphocytic leukemia. Haematologica. 2021; 107 (1): 334–337. doi: 10.3324/haematol.2020.263715
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2023 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Léčba pacientů s Hodgkinovým lymfomem po relapsu nebo progresi onemocnění – chemosenzitivita, transplantace a cílená léčba
- Molekulární patofyziologie ribozomopatií – onemocnění s narušenou funkcí ribozomů
- Jak klinicky interpretovat výsledky TP53 analýz u chronické lymfocytární leukemie v kontextu dostupných terapeutických režimů
- Zmeny v diagnostike a liečbe venookluzívnej choroby pečene u detí
- rFVIIIFc v léčbě hemofilie A z pohledu reálné klinické praxe tří center pro léčbu hemofilie v České republice
- Protilátka anti-K blokující vyšetření antigenu
- Standardizace PET/CT u pacientů s mnohočetným myelomem – Společné doporučení České myelomové skupiny a České společnosti nukleární medicíny
- Vzácné choroby provázené hypergamaglobulinémií a zánětlivými projevy aneb „diagnostikovat jednotku, o níž nevíme, že existuje, asi není možné…“
- Cena České hematologické společnosti za nejlepší původní vědeckou práci a monografii v oboru hematologie v roce 2022
- Prof. Milan Bláha – 85. narozeniny
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Jak klinicky interpretovat výsledky TP53 analýz u chronické lymfocytární leukemie v kontextu dostupných terapeutických režimů
- Protilátka anti-K blokující vyšetření antigenu
- Standardizace PET/CT u pacientů s mnohočetným myelomem – Společné doporučení České myelomové skupiny a České společnosti nukleární medicíny
- Molekulární patofyziologie ribozomopatií – onemocnění s narušenou funkcí ribozomů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



