-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDasatinib v 2. línii liečby chronickej myelocytovej leukémie u pacientov s rezistenciou alebo intoleranciou imatinibu na Klinike hematológie a transfuziológie
Bratislava v rokoch 2007-2011
Dasatinib in second line treatment of chronic myeloid leukaemia in patients with imatinib resistance or intolerance treated at the Clinic of Haematology and Transfusiology
Bratislava between 2007 and 2011Introduction:
Chronic myelogenous leukaemia is the first oncologic disease associated with a concrete chromosomal aberration termed the Philadelphia chromosome, which gives rise to the BCR-ABL1 fusion gene. The pathological protein arising from the transcription and translation of this gene has tyrosine kinase activity and is able to induce malignant transformation of the given cell. Bcr-Abl tyrosine kinase represents a pathogenetically relevant molecular target and disease remission can be achieved by its inhibition. Tyrosine kinase inhibitors have led to a revolution in the treatment of chronic myelogenous leukaemia and have improved patient prognosis. The initial success of imatinib – a representative of the first generation of tyrosine kinase inhibitors – however gave rise over time to several issues. Imatinib led to the selection of a group of patients who fail to respond optimally to treatment, lose the initially achieved treatment response or who do not tolerate imatinib. Aiming to offer a more optimal treatment alternative for these patients, researchers have tried to find a superior and more effective Bcr-Abl inhibitor. Thus, 2nd generation tyrosine kinase inhibitors were discovered, including dasatinib. Dasatinib improved patient overall survival as well as prognosis.Study group and methodology:
The group included 14 patients with an initially demonstrated diagnosis of chronic myeloid leukaemia in chronic phase. Patients were treated at the Clinic of Haematology and Transfusiology, Medical Faculty of Comenius University, Slovak Medical University and University Hospital Bratislava. All patients underwent first line treatment with imatinib and experienced treatment failure because of resistance, suboptimal response or imatinib intolerance. Patients were then treated by the 2nd generation of tyrosine kinase inhibitor – dasatinib from January 1, 2007 until July 31, 2012. Efficacy of dasatinib was evaluated according to the achievement of cytogenetic and molecular response at certain time points (3, 6, 9 and 12 months). Tolerability and overall survival were evaluated throughout the whole treatment period.Aim:
To show the efficacy and tolerability of dasatinib in patients following imatinib failure.Conclusion:
Dasatinib is able to achieve good cytogenetic and molecular responses with an acceptable safety profile. Its efficacy and tolerability are lower in the progressive phases of the disease.Key words:
2nd generation Bcr-Abl tyrosine kinase inhibitors, dasatinib, second line treatment, efficacy, tolerability
Autoři: M. Martišová; Z. Sninská; A. Hatalová; E. Demečková; M. Mistrík
Působiště autorů: Klinika hematológie a transfuziológie LFUK, SZU a UNB, Bratislava
Vyšlo v časopise: Transfuze Hematol. dnes,18, 2012, No. 3, p. 105-111.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
Chronická myelocytová leukémia je prvým nádorovým ochorením asociovaným s konkrétnou chromozómovou aberáciou zvanou Philadelphia chromozóm, ktorého sformovaním vzniká fúzny gén BCR-ABL1. Jeho transkripciou a transláciou vzniká patologická tyrozínová kináza spúšťajúca mechanizmy malígnej transformácie bunky. Predstavuje tak patogeneticky relevantný molekulový cieľ, ktorého blokádou dokážeme navodiť remisiu ochorenia. Inhibítory Bcr-Abl tyrozínkinázy zaznamenali preto revolúciu v liečbe chronickej myelocytovej leukémie so zlepšením prognózy pacientov. Úvodný úspech imatinibu – predstaviteľa 1. generácie inhibítorov tyrozínkinázy – však so sebou časom priniesol aj viaceré ďalšie otázky. Vyprofiloval skupiny pacientov, ktoré neodpovedali na liečbu imatinibom optimálne, ktoré iniciálne nadobudnutú odpoveď strácali, alebo liečbu netolerovali. So zámerom poskytnutia liečebnej alternatívy, pokračoval výskum do objavenia silnejšej a účinnejšej inbibície Bcr-Abl tyrozínkinázy – 2. generácie inhibítorov, s dasatinibom ako jedným z predstaviteľov, ktorý u týchto pacientov zaznamenal zlepšenie ich celkového prežívania aj prognózy.Súbor pacientov a metodika práce:
Súbor tvorí celkom 14 pacientov so vstupne potvrdenou diagnózou chronickej fázy chronickej myelocytovej leukémie, liečených na Klinike hematológie a transfuziológie Lekárskej fakulty Univerzity Komenského, Slovenskej zdravotníckej univerzity a Univerzitnej nemocnice Bratislava. Všetci pacienti absolvovali liečbu prvogeneračným inhibítorom tyrozínkinázy – imatinibom a pre jeho rezistenciu, suboptimálnu odpoveď alebo intoleranciu liečbu ukončili. V období od 1. 1. 2007 do 31. 7. 2011 absolvovali liečbu druhogeneračným inhibítorom tyrozínkinázy – dasatinibom s mediánom liečby 463,5 dňa (rozsah 105–1261 dní). V čase zahájenia dasatinibovej liečby boli 2 pacienti v blastovej fáze ochorenia, u 12 pacientov pretrvávala chronická fáza. Za účelom zhodnotenia účinnosti dasatinibu bolo v stanovených časových intervaloch (3, 6, 9 a 12 mesiacov) sledované dosahovanie cytogenetickej a molekulovej odpovede a počas celého trvania liečby aj jej tolerancia.Cieľ práce:
Sledovanie účinnosti a tolerancie dasatinibu u pacientov po ukončení prvolíniovej liečby imatinibom.Záver:
V druhej línii liečby CML je dasatinib úspešný v navodení cytogenetických aj molekulových odpovedí u pacientov v chronickej fáze ochorenia, s akceptovateľným bezpečnostným profilom. V pokročilejších štádiách ochorenia sa účinnosť jeho liečby znižuje a tolerancia liečby zhoršuje.Kľúčové slová:
druhá generácia inhibítorov Bcr-Abl tyrozínkinázy, dasatinib, druhá línia liečby, účinnosť, toleranciaÚvod
Dasatinib (Sprycel, BMS 354825), jeden z predstaviteľov druhogeneračných inhibítorov tyrozínkinázy (TKI) nie je štrukturálne príbuzný imatinibu (IM). V porovnaní s ním je však in vitro 325x účinnejší (1) voči Bcr-Abl kináze, pričom je schopný väzby na jej inaktívnu ako aj katalyticky aktívnu konformáciu (2–5). Vďaka odlišnej chemickej štruktúre týchto molekúl je pravdepodobnosť ich skríženej intolerancie nízka (6).
Dasatinib je prvým registrovaným duálnym inhibítorom Src rodiny kináz (SFK, PDGFRβ, ç-KIT a ephrin /EPH/) (2, 7, 8) a mutovanej aj nemutovanej formy Bcr-Abl kinázy. Jednotlivé mutácie majú voči nemu rozdielnu citlivosť (4, 9), s výnimkou T315I, ktorá je voči nemu rezistentná. Aj keď dasatinib inhibuje včasnejšie Ph+ progenitory ako IM (10), nie je schopný eliminácie najprimitívnejších kľudových kmeňových buniek chronickej myelocytovej leukémie (CML), o ktorých je známe, že sú voči TKI rezistentné.
Klinické štúdie fázy II demonštrovali efektivitu dasatinibu vo všetkých fázach CML pri rezistencii alebo intolerancii IM (6, 8, 11–14).
Liečebné odpovede na dasatinib po 8 mesiacoch liečby v štúdii START-C (dasatinib 70 mg 2x denne) s pacientmi v chronickej fáze (CF) CML s rezistenciou alebo intoleranciou IM, boli pozoruhodné. Zaznamenali dosiahnutie veľkej cytogenetickej remisie (VCgR) u 52 % pacientov a kompletnej cytogenetickej remisie (KCgR) u 39 % pacientov (5). V pokračovaní tejto štúdie s mediánom sledovania 15,2 mesiaca a dĺžkou liečby 12–18,4 mesiaca bola hodnotená celá kohorta pacientov (15). VCgR bola dosiahnutá u 52 % rezistentných pacientov (celkom 40 %) a u 80 % pacientov netolerujúcich IM (celkom 75 %) (6, 15, 16). Prežívanie bez progresie (progression-free survival, PFS) bolo v uvedenom mediáne 90 %. Táto štúdia dokázala, že dasatinib okrem inhibície mutovaných Bcr-Abl kináz, je účinný aj u pacientov s IM-rezistentným ochorením bez dokázaných BCR-ABL1 mutácií. To predpokladá, že dasatinib vie „obísť“ aj ďalšie mechanizmy IM rezistencie ako je napr. amplifikácia BCR-ABL1 génu, dysregulácia Src rodiny kináz a overexpresia P-gp efluxných púmp (17–19).
Štúdia START-R porovnala dasatinib (70 mg 2x denne) s eskalovanými dávkami IM (400 mg 2x denne) u pacientov po zlyhaní liečby IM v štandardnej (400 mg/deň) alebo eskalovanej dávke (600 mg/deň). S mediánom trvania liečby 14 mesiacov pri dasatinibe a 3 mesiace v ramene s IM (crossover pre nedostatok VCgR po 12 mesiacoch liečby, intoleranciu alebo progresiu) boli hodnoty KCgR 30 % pre dasatinibové a 7 % pre IM rameno (8). 2ročná analýza potvrdila, že dasatinib zaznamenal vyššie percento VCgR, KCgR a veľkej molekulovej remisie (VMR) (53 %, 44 % a 29 %) v porovnaní s vysokodávkovaným IM (33 %, 18 % a 12 %). VCgR si 18 mesiacov udržiavalo v dasatinibovom ramene 90 % pacientov, zatiaľ čo v IM ramene to bolo len 74 % pacientov. Očakávaný PFS po 2 rokoch bol pre dasatinib 86 % a IM 65 %. Pacienti dosahovali VCgR bez ohľadu na predchádzajúce predliečenie IM v štandardnej alebo eskalovanej dávke a bez ohľadu na predchádzajúcu cytogenetickú odpoveď (CgR) pri tejto liečbe (20). Pacienti, ktorí zlyhali na liečbe IM v dávke vyššej ako 400 mg/deň, dosahovali VCgR viac v dasatinibovom ramene ako v ramene s eskalovanou dávkou IM (20).
Na základe kratšieho plazmatického polčasu dasatinibu (3–5 hodín) a regenerácie kinázovej inhibície, ktorá nastupuje 8–12 hodín po jeho užití (31), stanovili prvotné farmakokinetické a farmakodynamické štúdie fosforylácie CRK-like proteínu (CRKL) (22–24), dávkovaciu schému pre dasatinib 70 mg 2x denne a táto bola následne schválená pre väčšinu klinických štúdií fázy II. Inhibícia kinázy tak bola v režimoch 2x denne v priebehu 24 hodín takmer trvalá.
Viaceré ďalšie klinické štúdie sa neskôr venovali snahe určiť najefektívnejšiu dávku dasatinibu pri minimalizácii vedľajších účinkov liečby. Randomizovaná štúdia so štyrmi dávkovacími režimami pre dasatinib (100 mg 1x denne, 50 mg 2x denne, 140 mg 1x denne a 70 mg 2x denne) u pacientov v CF CML (1) s rezistenciou alebo intoleranciou IM dokázala, že dasatinib 100 mg v jednej dennej dávke poskytuje najpriaznivejší celkový pomer benefitu a rizika. Išlo o významný objav, upozorňujúci na skutočnosť, že cieľová kináza Bcr-Abl je inhibovaná len intermitentne. V porovnaní s dovtedy schváleným dávkovacím režimom, bola dávka 100 mg 1x denne asociovaná so signifikantne lepšou toleranciou a redukovanou incidenciou s liečbou súvisiacich vedľajších účinkov. Trombocytopénia 3.–4. stupňa sa popísala u 22 % pacientov s dávkou 100 mg 1x denne v porovnaní s 32 % pacientov s dávkou 50 mg 2x denne a 37–40 % pacientov s dávkou 140 mg bez ohľadu na jej užitie v jednej alebo dvoch denných dávkach. Dlhodobejšie sledovanie ukázalo, že incidencia pleurálnych efúzií bola nižšia pri jednej dennej dávke (7 %) ako pri schéme 2x denne. Vyššie riziko pleurálnych efúzií sa popísalo u pacientov s hypertenziou a anamnézou kardiálneho ochorenia (25). Dávkovacia schéma 100 mg 1x denne taktiež zaznamenala najnižšiu zaznamenanú incidenciu prerušení a ukončení liečby (1).
Tieto zistenia podporujú názor, že niektoré toxické účinky TKI môžu vychádzať z perzistentnej expozície inhibičným liekovým koncentráciám. Maximálne dosiahnuté hladiny liečiva sú tiež relevantné, keďže pacienti liečení s dasatinibom 100 mg 1x denne vykázali menej nežiadúcich účinkov v porovnaní s pacientami s dávkou 140 mg 1x denne. Všetky skúmané dávkovacie režimy dokázali zrejmé a porovnateľné hladiny hematologickej a cytogenetickej účinnosti. Nadôvažok neboli pozorované žiadne veľké rozdiely v dĺžke trvania odpovede (kompletnej hematologickej remisie (KHR) alebo VCgR) ani v prežívaní bez progresie (PFS), či celkovom prežívaní (overall survival, OS).
Na základe týchto zistení došlo k zmene odporúčanej schémy podávania štandardnej dávky dasatinibu v CF CML na 100 mg v jednej dennej dávke.
Objavenie dasatinibu a jeho uvedenie do klinickej praxe znamenalo rýchly prístup k efektívnej a potenciálne život zachraňujúcej liečbe u pacientov s CML po zlyhaní liečby IM. Optimalizácia jeho dávkovania následne vylepšila aj jeho bezpečnostný profil.
Súbor pacientov
Súbor tvorí 14 pacientov (5 mužov/ 9 žien) liečených od 1. 9. 2009 do 31. 7. 2011 na Klinike hematológie a transfuziológie (KHaT) Lekárskej fakulty Univerzity Komenského (LFUK), Slovenskej zdravotníckej univerzity (SZU) a Univerzitnej nemocnice v Bratislave (UNB), s vekovým mediánom 45 rokov (rozsah 26–75 rokov). Všetci pacienti súboru spĺňali v čase diagnózy všeobecne platné diagnostické kritériá pre CF CML, potvrdené vyšetrením kostnej drene, ktoré zahrňovalo morfologické vyšetrenie, konvenčné cytogenetické vyšetrenie s dôkazom Ph chromozómu, vyšetrenie FISH (Fluorescent In Situ Hybridisation) a molekulovú analýzu kvantitatívnou metódou RT-PCR (Real-Time Polymerase Chain Reaction) s dôkazom BCR-ABL1 fúzneho transkriptu. V čase od 5. 9. 2002 do 13. 4. 2010 absolvovali s mediánom 610 dní (rozsah 30–1987 dní) prvú líniu liečby prvogeneračným IM v iniciálnej dávke 400 mg/deň, ktorú pre rezistenciu (9 pacientov), suboptimálnu odpoveď (1 pacient) alebo intoleranciu (4 pacienti) ukončili (graf 1). Z 9 na IM rezistentných pacientov sa primárna rezistencia predpokladala u 2 a sekundárna u 7 pacientov. Eskalácia dávok IM v tomto súbore sledovaná nebola. Hladiny IM a analýza génových mutácií neboli vyšetrené u väčšiny pacientov, nakoľko uvedené vyšetrenia neboli v čase zmeny liečby spočiatku dostupné; výnimkou bol 1 pacient, ktorý mal po zlyhaní IM potvrdené mutácie E459K a M244V.
Graf 1. Dôvody zmeny liečby z prvolíniového imatinibu na dasatinib. 
V období 1. 7. 2007 – 31. 7. 2011 absolvovali pacienti liečbu druhogeneračným dasatinibom v druhej línii. Pred zahájením dasatinibovej liečby boli 2 pacienti v BF ochorenia, u 12 pacientov sa potvrdilo pretrvávanie CF. Medián od ukončenia prvej línie do zahájenia druholíniovej liečby bol 1 deň (rozsah 0–175 dní)* a medián dasatinibovej liečby bol 463,5 dňa (rozsah 105–1261 dní). Dasatinib bol u všetkých pacientov pri zahájení 2. línie liečby podávaný perorálne v dávke 100 mg/deň.
(* Pozn. výnimkou bol pacient, ktorý po ukončení IM liečby absolvoval cykly konvenčnej chemoterapie a liečbu dasatinibom začal 17 mesiacov po ukončení liečby IM.)
Podľa stratifikácie podľa Sokala, boli v tejto skupine v čase diagnózy hodnotení 4 pacienti ako nízko, 8 stredne a 2 vysokorizikoví, v prípade Hasfordovej stratifikácie išlo o 8 pacientov s nízkym, 4 so stredným a 2 s vysokým rizikom (tab. 1).
Tab. 1. Charakteristiky pacientov s CML pred zahájením 2. línie liečby dasatinibom. 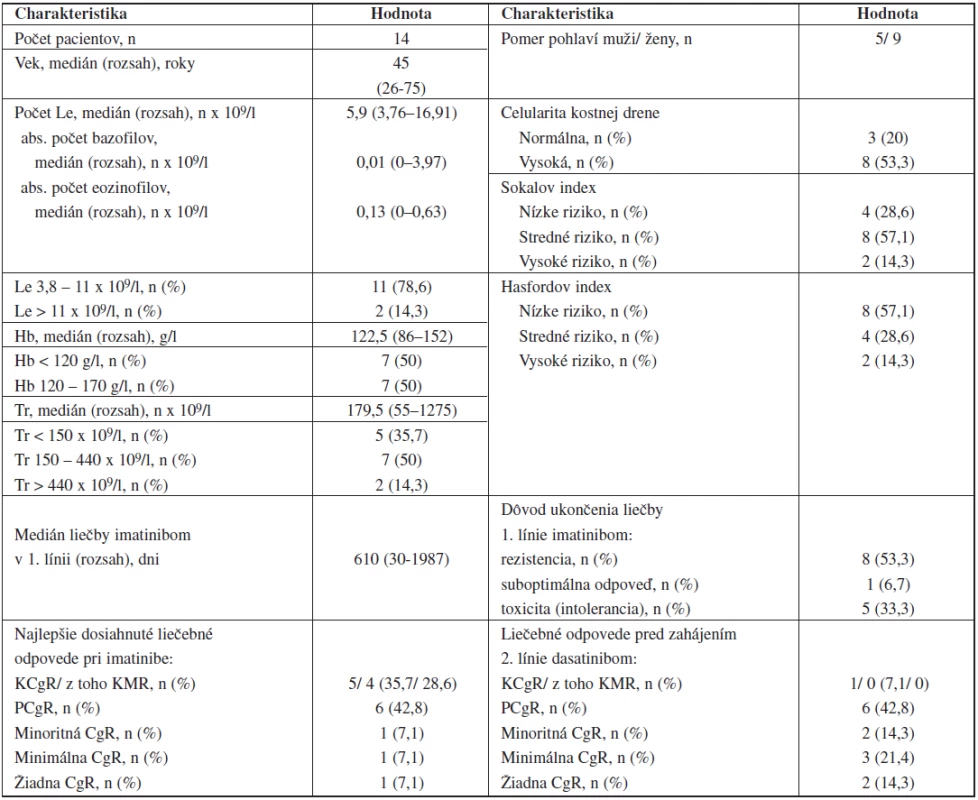
n – počet pacientov, Le – leukocyty, Hb – hemoglobín, Tr – trombocyty Referenčné hodnoty: Le 3,8-11 x 109/l; Hb 120-170 g/l; Tr 150-440 x 109/l Jeden pacient v BF ochorenia bol pri zahájení liečby klasifikovaný Sokalom aj Hasfordom (SH) ako stredne rizikový a jeden ako nízkorizikový. Pacient s pozitivitou mutácií E459K a M244V bol SH hodnotený ako stredne rizikový.
Po ukončení liečby IM (t.j. pred začatím liečby dasatinibom) mali 2 pacienti leukocytózu (do 20 x 109/l) a 1 pacient leukopéniu. 7 pacientov malo ľahkú, 1 stredne ťažkú anémiu. 4 pacienti mali ľahkú, 1 stredne ťažkú trombocytopéniu a 2 pacienti (1 v CF, 1 v BF) mali trombocytózu (tab. 1).
Pri zahájení dasatinibu bol 1 pacient v KCgR (liečba IM ukončená pre intoleranciu), 6 pacientov malo parciálnu cytogenetickú remisiu (PCgR), 2 minoritnú CgR, 3 minimálnu CgR a 2 pacienti nedosiahli žiadny stupeň CgR (tab. 1).
Metodika práce
Informácie o pacientoch boli získané z dokumentácie KHaT LFUK, SZU a UNB. Ide o retrospektívne zhodnotenie dosiahnutých cytogenetických a molekulových odpovedí na liečbu dasatinibom so sledovaním jeho tolerancie v priebehu liečby. Liečebné odpovede boli hodnotené v súlade s medzinárodne platnými definíciami European LeukemiaNet (ELN) 2009 (26, 27) pre hematologickú, cytogenetickú a molekulovú remisiu ochorenia (tab. 2) v 3, 6, 9 a 12 mesiaci od začiatku liečby. So snahou o jednoznačnosť nomenklatúry cytogenetických odpovedí bol v práci vynechaný pojem „veľká cytogenetická remisia“ (VCgR) nakoľko ide o skupinu pacientov s kompletnou cytogenetickou remisiou (KCgR) a parciálnou cytogenetickou remisiou (PCgR). Pri hodnotení CgR ako aj pri hodnotení najlepšej dosiahnutej odpovede, bola molekulová odpoveď uvádzaná samostatne a aj v rámci KCgR (nakoľko pacienti dosahujúci KCgR dosahovali v niektorých prípadoch súčasne určitý stupeň molekulovej remisie). Cytologické (morfologické), konvenčné cytogenetické a molekulové vyšetrenie (FISH, RT-PCR so sondou XL BCR sg/ ABL tr, Translocation-DualFusion (MetaSystem), merané v %IS) bolo realizované z kostnej drene v 6-mesačných intervaloch, pričom v 3-mesačných intervaloch sa súčasne sledovala cytogenetická a molekulová odpoveď v periférnej krvi. Výsledky cytogenetických a molekulových vyšetrení sú v práci uvádzané z vyšetrení periférnej krvi pre každý zo sledovaných mesiacov. Kontrolné fyzikálne a laboratórne vyšetrenia (hemogram, biochemické vyšetrenia) sa vykonávali 1x mesačne.
Tab. 2. Definícia liečebnej odpovede podľa odporúčaní ELN 200926,27. 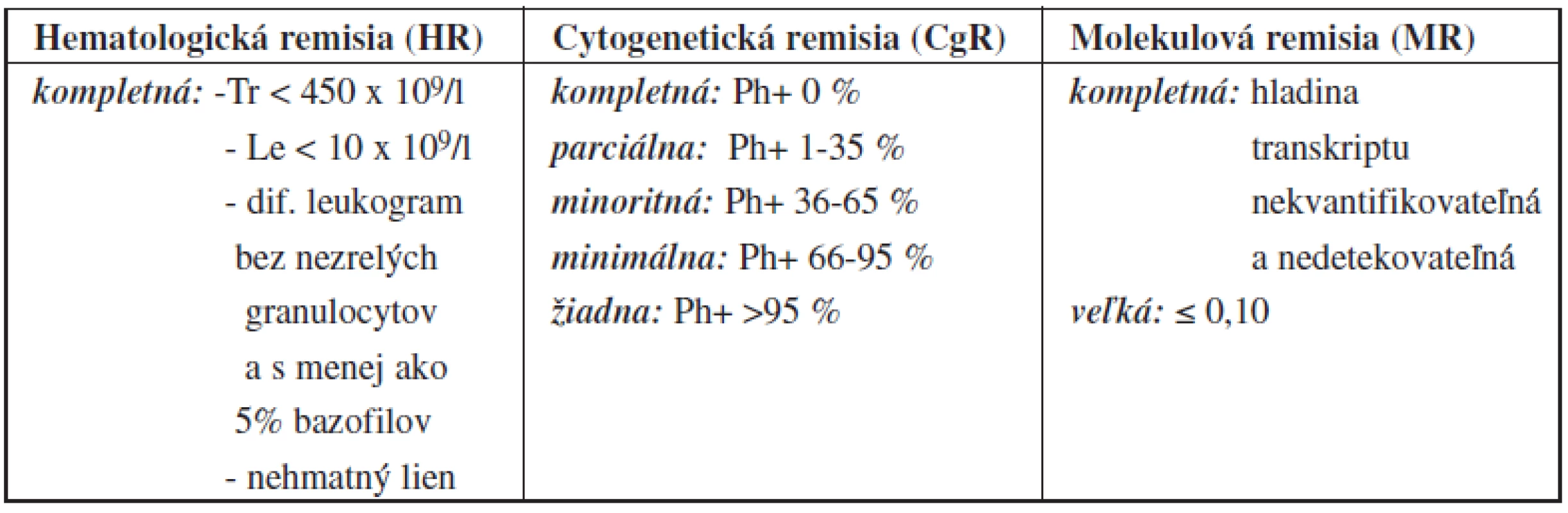
pozn. VCgR (veľká cytogenetická remisia) = PCgR+KCgR Stupeň závažnosti hematologických a nehematologických nežiadúcich účinkov bol hodnotený podľa medzinárodne platných kritérií CTCAE (Common Terminology Criteria for Adverse Event) – verzia 4.03 zo 14. 6. 2010 na základe odporúčaní EORTC (European Organisation for Research and Treatment of Cancer). Ako nezávažné boli hodnotené vedľajšie reakcie 1.–2. stupňa a ako závažné reakcie 3.–4. stupňa.
V súbore pacientov bol pri nehematologickej toxicite pod pojem „edém“ zahrnutý len periférny končatinový edém a pleurálne efúzie boli hodnotené samostatne. Predlžovanie QTc intervalu sme v súbore nesledovali.
Výsledky
Všetci pacienti na liečbe dasatinibom v druhej línii dosiahli po 3 mesiacoch liečby KHR a aspoň minimálnu CgR.
KCgR bola po 3 mesiacoch liečby dosiahnutá u 57 % pacientov, po 6 mesiacoch u 58 %, po 9 mesiacoch u 73 % a po 12 mesiacoch u 80% pacientov (tab. 3).
Tab. 3. Hodnotenie cytogenetických a molekulových odpovedí po 3, 6, 9 a 12 mesiacoch liečby dasatinibom v druhej línii. 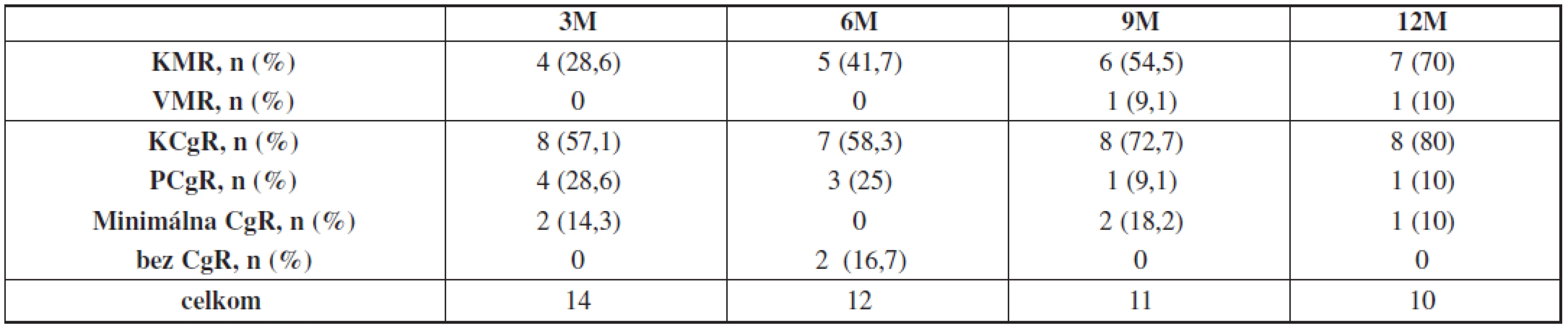
Tab. 4. Vedľajšie reakcie pri druholíniovej liečbe dasatinibom (n = 14). 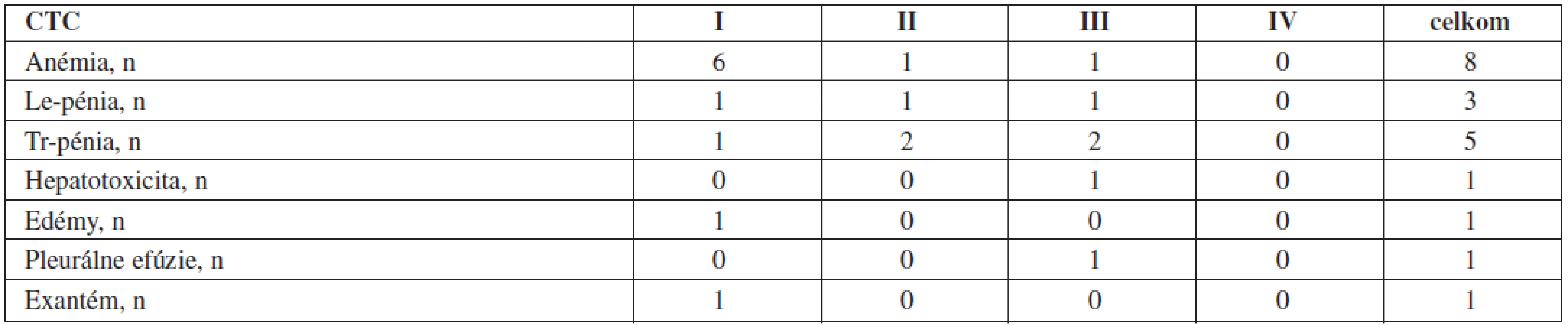
n – počet pacientov, Le-pénia – leukocytopénia, Tr-pénia – trombocytopénia KMR stúpala lineárne, po 3 mesiacoch ju dosiahlo 29 % pacientov, po 6 mesiacoch 42 %, po 9 mesiacoch 54 % a po 12 mesiacoch 70 % pacientov (tab. 3, graf 2).
Graf 2. Dosahovanie KMR v druhej línii liečby dasatinibom. 
Najlepšou dosiahnutou molekulovou odpoveďou na dasatinib v druhej línii liečby súboru KHaT bola KMR – zaznamenaná v aspoň jednom zo sledovaných mesiacov u 71,4 % pacientov. Z cytogenetických odpovedí bola najlepšou dosahovanou odpoveďou KCgR, ktorú aspoň v jednom zo sledovaných mesiacov dosiahlo 78,6 %.
Dvaja pacienti SH hodnotení ako vysokorizikoví, dosiahli pri liečbe dasatinibom už po 3 mesiacoch liečby KMR, ktorú si udržali aj v priebehu ďalších 12 mesiacov liečby.
U oboch pacientov v BF ochorenia bola najlepšou dosiahnutou odpoveďou krátkotrvajúca (1–3 mesiace) PCgR, zaznamenaná v oboch prípadoch v 3 mesiaci liečby.
Pacient s potvrdenými vstupnými mutáciami E459K a M244V dosiahol na dasatinibe najlepšiu odpoveď v 9 mesiaci liečby taktiež v podobe PCgR, ktorá trvala 6 mesiacov.
Na druholíniovej liečbe dasatinibom bolo z nezávažných hematologických prejavov toxicity (1.–2. stupeň) popísaných 7 anémií (50 %), 2 leukopénie (14,3 %), 3 trombocytopénie (21,4 %). Z nezávažných nehematologických prejavov toxicity sa vyskytol 1x exantém (7,1 %) a 1x edémy dolných končatín (7,1 %).
Zo závažných hematologických toxicít (3. stupeň) sa popísala 1x anémia (7,1 %), 1x leukopénia (7,1 %) a 2x trombocytopénia (14,3 %). V týchto prípadoch bola liečba redukovaná a pacienti stimulovaní rastovými faktormi (erytropoetín, G-CSF) do regenerácie hodnôt hemogramu. Substitúciu erytrocytovými alebo trombocytovými koncentrátmi nevyžadoval nikto. Zo závažných nehematologických toxicít (3. stupeň) sa objavila v 1 prípade hepatotoxicita (7,1 %) a v jednom prípade pleurálne efúzie (7,1 %). U pacienta s fluidothoraxom bola liečba prerušená, po odľahčovacích punkciách a normalizácii klinického stavu bol dasatinib do liečby vrátený v 50 % redukcii, ktorá však viedla k opätovnej incipientnej indukcii fluidothoraxu. Liečba bola preto následne ukončená. Pacient s hepatotoxicitou 3. stupňa liečbu taktiež prerušil. Po normalizácii hepatálnych parametrov bol dasatinib v 50 % redukcii nasadený znovu, rovnako však v krátkom čase zaznamenal vzostup hepatálnych parametrov, pre ktorý bola liečba aj v tomto prípade ukončená.
Obaja pacienti SH hodnotení ako vysokorizikoví, vyvinuli nezávažnú anémiu s trombocytopéniou, pričom 1 z nich aj spomenutý fluidothorax 3. stupňa a liečbu ukončil.
U pacientov v BF ochorenia bola zaznamenaná len hematologická toxicita v podobe anémie, leukopénie a trombocytopénie, ktoré boli 2.–3. stupňa.
Pacient s mutáciami E459K a M244V toxicitu pri dasatinibovej liečbe nezaznamenal.
Liečba dasatinibom v druhej línii bola ukončená celkom u 7 pacientov (50 %). V 2 prípadoch (14,3 %) bola príčinou toxicita liečby, v 1 prípade (7,1 %) suboptimálna odpoveď a 4 pacienti (28,6 %) boli na liečbu rezistentní. Traja z rezistentných pacientov (21,4 %) zomreli v dôsledku progresie ochorenia (tab. 5).
Tab. 5. Dôvody ukončenia liečby dasatinibom v druhej línii. 
Jeden pacient SH hodnotený ako vysokorizikový pokračuje v liečbe dasatinibom s pretrvávajúcou KMR, druhý pacient pre spomenuté prejavy nehematologickej toxicity (fluidothorax 3. stupňa) liečbu dasatinibom po 12 mesiacoch ukončil a pokračoval v liečbe treťolíniovým nilotinibom.
Obaja pacienti v BF ochorenia exitovali po 6 a 8 mesiacoch liečby na progresiu ochorenia.
Jeden pacient so vstupnou CF exitoval po 11 mesiacoch liečby na rýchlu progresiu do BF.
Liečebné odpovede pacienta s mutáciami E459K a M244V boli nedostatočné, liečbu po 15 mesiacoch ukončil pre rezistenciu a pokračoval v liečbe treťolíniovým nilotinibom.
Diskusia
Štúdiou sledujúcou účinnosť dasatinibu v druhej línii liečby CF CML počas 2ročného sledovania, bol START-C (6,16), ktorého primárnym cieľom bolo sledovanie VCgR. Po 2ročnom sledovaní bola celková miera dosiahnutých KHR 91 %, VCgR 62 %, KCgR 53 % a VMR 47 % pacientov, s celkovým prežívaním 94 % a PFS 80 %. V súbore pacientov z KHaT bola v rovnakom mediáne dosiahnutá celková miera KCgR u 79 % a KMR 71 % pacientov, čo je lepšie ako uvádza START-C a taktiež lepšie aj v porovnaní so START-R, kde v 24mesačnom sledovaní bolo dasatinibom dosiahnutých celkovo 29 % VMR (20).
Štúdia START-R s pacientami v CF CML liečenými dasatinibom (140 mg/deň) popísala prerušenie liečby u 61 % pacientov a redukciu dávky dasatinibu pre hematologickú toxicitu v 47 %. V súbore pacientov KHaT užívali pacienti dávku 100 mg/deň a liečba pre hematologickú toxicitu prerušená nebola, ale prechodnú redukciu dávky podstúpilo pre jej prejavy 26,7 % pacientov, čo je menej ako v uvedenej štúdii.
Mutácie E459K a M244V, ktoré sú uvádzané ako citlivé voči IM aj dasatinibu (28), sa u pacienta v súbore KHaT demonštrovali ako rezistentné na obe použité molekuly.
Z hľadiska tolerancie liečby, prevažovala v súbore KHaT hematologická toxicita nad nehematologickou.
Z hematologickej toxicity sa celkovo najčastejšie vyskytovala anémia (57 %), následne trombocytopénia (36 %) a najmenej častá bola leukopénia (21 %).
V štúdii START-R boli najčastejšími prejavmi závažnej hematologickej toxicity neutropénia u 48 % a trombocytopénia u 49 % pacientov (15). Naproti tomu sa v súbore KHaT závažná hematologická toxicita popísala u celkom 29 % pacientov s prevahou trombocytopénie (14 %), menej časté boli leukopénie a anémie (7 %, 7 %).
Po vyradení údajov 2 pacientov s BF ochorenia, bol podiel toxicity menší, pričom závažná hematologická toxicita sa z pôvodne uvádzaných 29 % zredukovala na 8 %. Pacienti s BF ochorenia navyše už vstupovali do liečby dasatinibom s ľahkou anémiou v oboch prípadoch, ľahkou leukopéniou a trombocytopéniou v jednom prípade, ktoré sa počas liečby zvýraznili. Jeden z pacientov v BC mal pred zahájením liečby trombocytémiu a počas užívania dasatinibu vyvinul trombocytopéniu 3. stupňa. Je možné predpokladať, že prehĺbenie cytopénie u týchto pacientov, bolo kombinovanej etiológie, spôsobené toxickým účinkom dasatinibu so súčasným prispením progresie základného ochorenia.
Celková miera nehematologickej toxicity v súbore pacientov KHaT bola 29 %, pričom v 14 % bola závažná. Išlo o hepatotoxicitu (7 %) a pleurálne efúzie (7 %).
V štúdii START-R bola nehematologická toxicita v 18 % príčinou prerušenia liečby a v 14 % príčinou jej ukončenia. V súbore KHaT pacienti pre závažné nehematologické prejavy toxicity liečbu nielen prerušili, ale pre pretrvávanie intolerancie napriek 50 % redukcii dávky, liečbu ukončili (t.j. 14 %).
Liečbu dasatinibom ukončilo v súbore KHaT celkom 50 % pacientov. Najčastejšou príčinou ukončenia bola rezistencia (29 %). Ak by sme nebrali do úvahy pacientov so vstupne potvrdenou BF ochorenia, bola by miera ukončení liečby pre rezistenciu a intoleranciu rovnaká – 17 %. Celkom 21 % pacientov počas liečby zomrelo, pričom pri vyradení údajov pacientov so vstupnou BF ochorenia, exitovalo 16,7 % pacientov zo skupiny s verifikovanou CF CML pri zahájení druholíniovej liečby.
Súbor pacientov KHaT je malý a nehomogénny a jeho hodnotenie je zaťažené chybou malých čísel, o čom svedčia lepšie výsledky účinnosti dasatinibu a nižšie percentá zaznamenaných toxicít v porovnaní s výsledkami veľkých známych klinických štúdií. Predstavuje však jednu z prvých prezentovaných 4ročných skúseností s liečbou pacientov rezistentných a netolerujúcich IM na Slovensku a pri zohľadnení uvedených skutočností môže potvrdiť, že dasatinib predstavuje dobrú a účinnú alternatívu s akceptovateľným bezpečnostným profilom pre pacientov s CML po zlyhaní liečby imatinibom.
Podiel autorov na práci
M.M. – napísanie rukopisu, liečba pacientov, vyšetrovanie pacientov
Z.S. – vyhľadávanie dát, liečba pacientov, vyšetrovanie pacientov
A.H. – liečba pacientov, vyšetrovanie pacientov
E.D., M.M. – kontrola, revízia rukopisu
MUDr. Michaela Martišová
Klinika hematológie a transfuziológie LFUK, SZU a UNB
Nemocnica sv. Cyrila a Metoda
Antolská 11
851 07 Bratislava
Slovenská republika
Doručeno do redakce: 4. 5. 2012
Přijato po recenzi: 9. 7. 2012
Zdroje
1. Shah NP, Kantarjian HM, Kim DW, et al. Intermittent target inhibition with Dasatinib 100 mg once daily preserves efficacy and improves tolerability in Imatinib-resistant and –intolerant chronic-phase chronic myeloid leukemia. J Clin Oncol 2008; 26 : 3204-3212.
2. Lombardo LJ, Lee FY, Chen P, et al. Discovery of N-(2-chloro-6--methyl-phenyl)-2(6-(4-(2-hydroxyethyl)-piperazin-1-yl)-2-methylpyrimidin-4-yl-amino)thiazole-5-carboxamide (BSM-354825), a dual Src/Abl kinase inhibitor with potent antitumor activity in preclinical assays. J Med Chem 2004; 47 : 6658-6661.
3. Tokarski JS, Newitt JA, Chang CY, et al. The structure of dasatinib (BMS-354825) bound to activated ABL kinase domain elucidates its inhibitory activity against imatinib-resistant ABL mutants. Cancer Res 2006; 66 : 5790-5797.
4. O Hare T, Walters DK, Stroffregen EP, et al. In vitro activity of Bcr-Abl inhibitors AMN107 and BMS-354825 against clinically relavant imatinib-resistant Abl kinase domain mutants. Cancer Res 2005; 65 : 4500-4505.
5. Shah NP. Dasatinib. Drugs Today (Barc) 2007; 43 : 5-12.
6. Hochhaus A, Kantarjian HM, Baccarani M, et al. Dasatinib induces notable hematologic and cytogenetic responses in CP-CML after failure of imatinib therapy. Blood 2007; 109(6): 2303-2309.
7. Doubek M. Zvládání nežádoucích účinků dasatinibu (Sprycel) – spolupráce s hematologickou ambulancí v místě bydliště pacienta, Satelitné sympózium Sprycel: jediný tyrosinkinázový inhibitor 2. generace registrovaný pro všechny fáze CML a Ph+ ALL. Olomoucké hematologické dny 2008, oral presentation.
8. Kantarjian H, Pasquini R, Hamerschlak N, et al. Dasatinib or high-dose imatinib for chronic-phase chronic myeloid leukemia after failure of first-line imatinib: a randomized phase 2 trial. Blood 2007; 109 : 5143-5150.
9. Shah NP, Tran C, Lee FY, et al. Overriding imatinib resistance with a novel ABL kinase inhibitor. Science 2004; 305 : 399-401.
10. Copland M, Hamilton A, Elrick RJ, et al. Dasatinib (BMS-354825) targets an earlier progenitor population than imatinib in primary CML, but does not eliminate the quiescent fraction. Blood 2006; 107(11): 4532-4539.
11. Guilhot F, Apperley J, Kim DW, et al. Dasatinib induces significant hematologic and cytogenetic responses in patients with imatinib-resistant or –intolerant chronic myeloid leukemia in accelerated phase. Blood 2007; 109 : 4143-4150.
12. Cortes J, Rousselot P, Kim DW, et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or –intolerant chronic myeloid leukemia in blast crisis. Blood 2007; 109 : 3207-3213.
13. Ottmann O, Dombret H, Baccarani M, et al. Dasatinib (BMS-354825) induces rapid hematologic and cytogenetic responses in patients with imatinib-resistant or –intolerant Philadelphia chromosome-positive acute lymphoblastic leukemia: Interim results of a phase II study. Blood 2007; 110 : 2309-2315.
14. National Comprehensive Cancer Network (NCCN): Clinical practise guidelines in Oncology™: Chronic myelogenous leukemia. V. 2.2007. http://www.nccn.org/professionals/physician-gls/PDF/ cml.pdf, accessed November 2007
15. Hochhaus A, Baccarani, Deininger M, et al. Dasatinib induces durable cytogenetic responses in patients with chronic myelogenous leukemia in chronic phase with resistance or intolerance to imatinib. Leukemia 2008; 22 : 1200-1206.
16. Talpaz M, Shah N, Kantarjian H, et al. Dasatinib in imatinib-resistant Philadelphia chromosome positive leukemias. N Engl J Med 2006; 354 : 2531-2541.
17. Hochhaus A, Kreil S, Corbin AS, et al. Molecular and chromosomal mechanism of resistance to imatinib (STI571) therapy. Leukemia 2002; 16 : 2190-2196.
18. Thomas J, Wang L, Clark RE et al, Active transport of imatinib into and out of cells: implications of drug resistance. Blood 2004; 104 : 3739-3745
19. Dai Y, Rahmani M, Corey SJ, et al. A Bcr/Abl-independent, Lyn-dependent form of imatinib mesylate (STI-571) resistance is associated with altered expression of Bcl-2. J Biol Chem 2004; 279 : 34227-34239.
20. Kantarjian H, Pasquini R, Lévy V, et al. Dasatinib or high-dose imatinib for chronic-phase chronic myeloid leukemia resistant to imatinib at a dose of 400 to 600 milligrams daily (two-year follow-up of a randomized phase 2 study (START-R)). Cancer 2009; 115 : 4136-4147.
21. Kantarjian HM, Cortes J. Second generation tyrosine kinase inhibitors: which and when? Hematology Education: education program for the annual congress of European Hematology Association. 2009; 3(1): 83-88.
22. Ten Hoeve J, Arlinghaus RB, Guo JQ, et al. Tyrosine phosphorylation of CRKL in Philadelphia+ leukemia. Blood 1994; 84 : 1731-1736.
23. Oda T, Heaney C, Hagopian JR, et al. Crkl is the major tyrosine-phosphorylated protein in neutrophils from patients with chronic myelogenous leukemia. J Biol Chem 1994; 269 : 22925-22928.
24. Nichols GL, Raines MA, Vera JC, et al. Identification of CRKL as the constitutively phosphorylated 39-kD tyrosine phosphoprotein in chronic myelogenous leukemia cells. Blood 1994; 84 : 2912-2918.
25. Quintas-Cardama A, Kantarjian H, O Brien S, et al. Pleural effusion in patients with chronic myelogenous leukemia treated with dasatinib after imatinib failure. J Clin Oncol 2007; 25 : 3908-3914.
26. Baccarani M, Cortes J, Pane F, et al. Chronic myeloid leukemia. An update of concepts and management recommendations of the EuropeanLeukemiaNet. J Clin Oncol 2009; 27 (35): 6041-6051.
27. Baccarani M, Saglio G, Goldman J, et al. Envolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the EuropeanLeukemiaNet. Blood 2006; 108 : 1809-1820.
28. Guidelines for mutation analysis of BCR/ABL kinase domain: Interpreting TKI-ressistance mutations in CML patients, West Midlands Regional Genetics Laboratory March 2007; Revised December 2007.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2012 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
-
Dasatinib v 2. línii liečby chronickej myelocytovej leukémie u pacientov s rezistenciou alebo intoleranciou imatinibu na Klinike hematológie a transfuziológie
Bratislava v rokoch 2007-2011 - Získaná aplastická anémie v dětském věku – dlouhodobé výsledky a rizika kombinované imunosupresivní léčby antithymocytárním globulinem a cyklosporinem A
- Stanovení mimodřeňové leukemické infiltrace u dětské akutní lymfoblastické leukemie a jeho klinické využití. Přehledný článek a vlastní výsledky
- Vzácny typ intestinálneho krvácania u pacienta s kolorektálnym karcinómom na antikoagulačnej liečbe
- Dr. Konrad Sigmund Rodan (Rosenberg) – významný anglický hematológ z Československa
- Risk factors for in-hospital venous thromboembolism in children: a case-control study employing diagnostic validation
- A phase 2 study of the safety, tolerability, and pharmacodynamics of FBS0701, a novel oral iron chelator, in transfusional iron overload
- Correlation of CD33 expression level with disease characteristics and response to gemtuzumab ozogamicin containing chemotherapy in childhood AML
- Incidence of neoplasia in Diamond Blackfan anemia: a report from the Diamond Blackfan Anemia Registry
- Reduced intensity conditioning is superior to nonmyeloablative conditioning for older chronic myelogenous leukemia patients undergoing hematopoietic cell transplant during the tyrosine kinase inhibitor era
- Excellent prognosis of late relapses of ETV6/RUNX1-positive childhood acute lymphoblastic leukemia: lessons from the FRALLE 93 protocol
- Abnormalities in IgA and IgM are associated with treatment-resistant ITP
- Přehled produkce transfuzní služby ČR za rok 2011 (transfuzní přípravky i plazma pro frakcionaci)
- Autotransfuze v České republice v roce 2011
- Prof. MUDr. Mikuláš Hrubiško, DrSc., 95. výročí narození
-
Dasatinib v 2. línii liečby chronickej myelocytovej leukémie u pacientov s rezistenciou alebo intoleranciou imatinibu na Klinike hematológie a transfuziológie
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Získaná aplastická anémie v dětském věku – dlouhodobé výsledky a rizika kombinované imunosupresivní léčby antithymocytárním globulinem a cyklosporinem A
- Prof. MUDr. Mikuláš Hrubiško, DrSc., 95. výročí narození
- Vzácny typ intestinálneho krvácania u pacienta s kolorektálnym karcinómom na antikoagulačnej liečbe
- Stanovení mimodřeňové leukemické infiltrace u dětské akutní lymfoblastické leukemie a jeho klinické využití. Přehledný článek a vlastní výsledky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



