-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antiagregace a gastroprotektiva
Antiaggregation and gastroprotective drugs
The introduction of this review focuses on the indication of gastroprotective therapy for patients taking antiaggregation and anticoagulation drugs. The review goes on to discuss the clinical results of the drug interaction with this combined therapy. In daily clinical practice physicians indicate gastroprotective therapy mainly intuitively. The Czech gastroenterological society, and Czech and European cardiology societies, do not provide clear guidelines for these indications. In 2008 the American Heart Association and American society of Gastroenterology released recommendations by a consensus of experts for the possibility of reducing the increased risk of gastrointestinal bleeding that occurs with non-steroids and antiaggregation therapy.
Key words:
antiaggregation therapy, NSAID, proton pump inhibitors.
Autoři: M. Janotka; V. Zdráhalová; P. Neužil
Působiště autorů: Nemocnice Na Homolce, Praha ; Kardiologické oddělení ; Primář: doc. MUDr. Petr Neužil, CSc., FESC. ; Kardiovaskulární centrum
Vyšlo v časopise: Prakt. Lék. 2010; 90(11): 640-645
Kategorie: Přehledy
Souhrn
Přehledné sdělení se v úvodu zabývá indikací gastroprotektiv při současné léčbě preparáty s antiagregačním a antikoagulačním účinkem. Ve druhé části jsou pak probírány klinické důsledky interakcí této společné terapie. V klinické praxi se k použití gastroprotektiv při současné léčbě antiagregancii rozhodují ošetřující lékaři spíše intuitivně. Česká gastroenterologická, kardiologická ani evropská kadiologická společnost žádná jasná doporučení v současnosti neuvádějí. V roce 2008 vydala americká kardiologická a gastroenterologická společnost konsenzus doporučení expertů zabývající se možností redukce zvýšeného rizika gastrointerstinálního krvácení při terapii nesteroidními antirevmatiky (NSAID) a antiagregancii.
Klíčová slova:
antiagrencia, antikolagulancia, gastroprotektiva, gastrointerstinální krvácení.Účinek antiagregační terapie
Na poškození žaludeční sliznice se při použití antiagregační léčby spolu s preparáty NSAID uplatňuje jak lokální, tak i systemový účinek. Systemový nežádoucí účinek je zprostředkován inhibicí COX-1 „konstitutivního enzymu“ (inhibice syntézy „ochranných“ prostaglandinů gastrointestinálním epitelem i syntezy „reparačních“ růstových faktorů trombocyty, alterace renální vazoregulace, atd.); zástupcem COX-1 inhibitorů je kyselina acetylosalicylová (ASA). Synteza COX-2 „inducibilního enzymu“ je indukovaná zánětlivými stimuly – jeho inhibicí NSAID redukují projevy zánětu. (obr. 1)
Obr. 1. Vliv nesteroidních antiflogistik a schéma ovlivnění antiagregace syntézy COX 1, COX 2 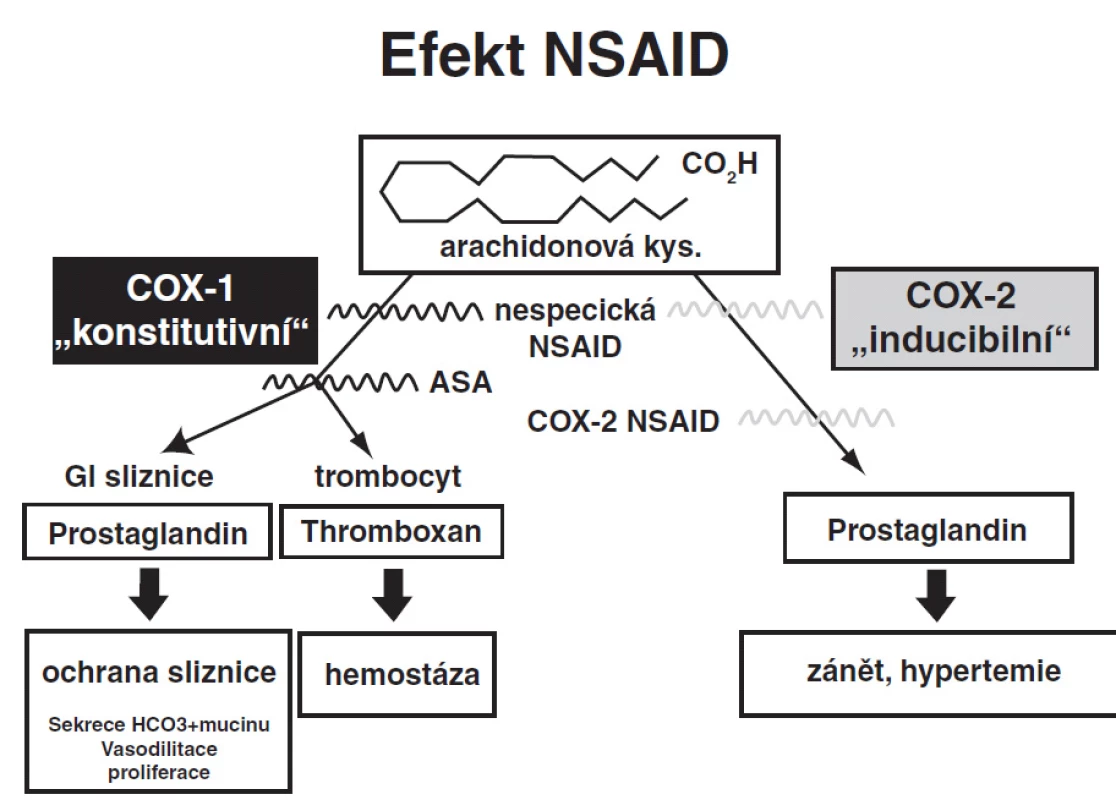
Rizikové kombinace
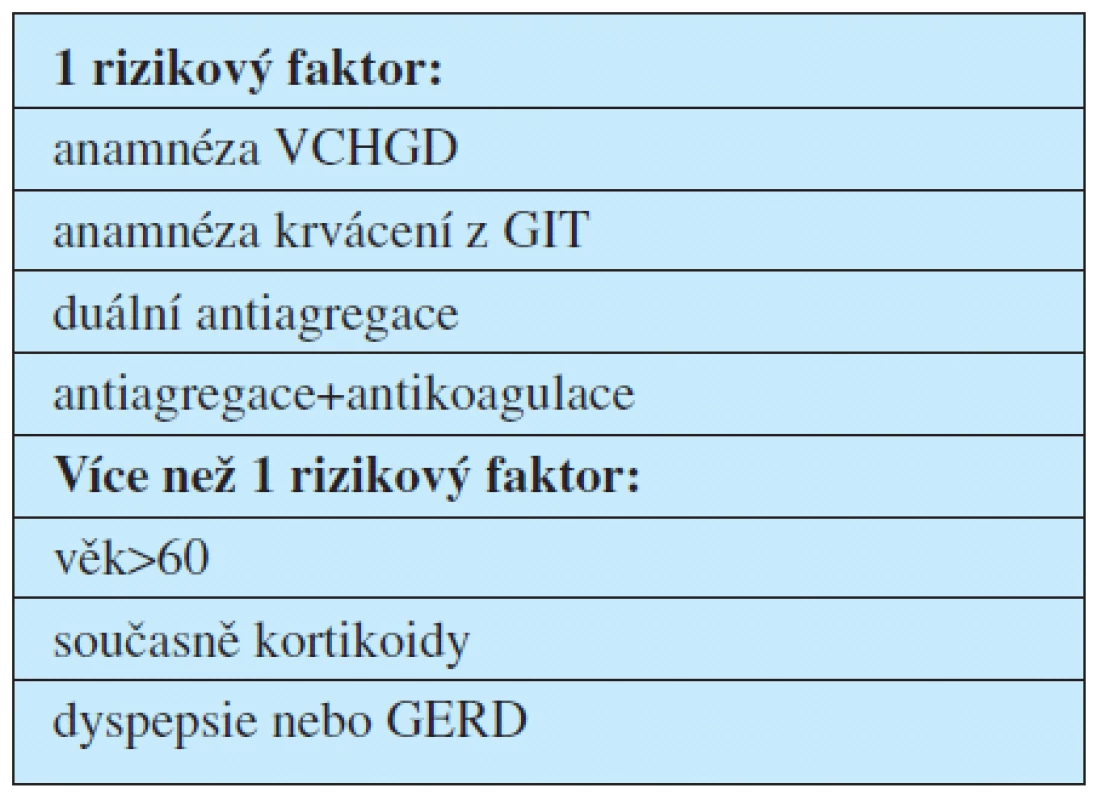
Dle doporučení by gastroprotektiva měli dostat pouze rizikoví nemocní, kteří užívají dlouhodobou antiagregační léčbu (1). Rizikoví pacienti jsou definováni v tabulce 1.
Algoritmus rozhodování pro nasazení gastroprotektivní léčby je znázorněn na obr. 2.
Obr. 2. Algoritmus rozhodování pro nasazení gastroprotektivní léčby 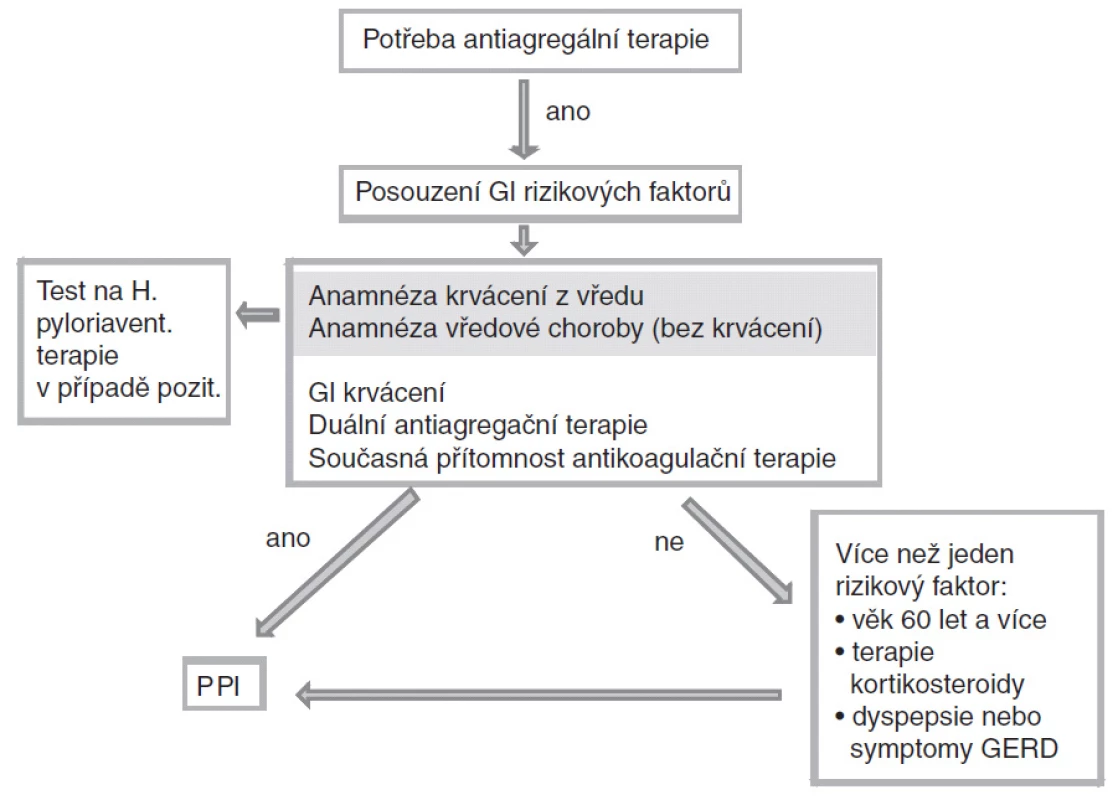
Přehled jednotlivých rizikových situací:
1) přidání NSAID k ASA.
NSAID s ASA zvyšují riziko vzniku symptomatického vředu; tím jsou míněny především bolestivost a jiné obtíže nebo krvácení, dále tzv. UGIE-upper gastrointestinal event). Toto riziko je zvýšeno při uvedené kombinační léčbě 3,8–5,6x proti samotné ASA (2–4x vyšší riziko dle dávky) (46).
Původní představa, že užívání COX-2 selektivních analgetik při terapii ASA (COX-1 inhibice) signifikantně sníží krvácivá rizika, se klinicky nepotvrdila (42). Z experimentálních prací vyplývá, že k ulcerogennímu účinku je třeba kombinované inhibice COX-1 i 2 (selektivní inhibice COX-1 nebo 2 nevedla v experimentu k žaludečním ulceracím) (44).
COX-2 inhibitory přinášejí redukci UGIE ve srovnání s COX-1 inhibitory pouze, nejsou-li v kombinaci s ASA nebo jiným NSAID. Přidání ASA ke COX-2 inhibitoru přináší stejné navýšení krvácívého rizika jako při přidání k běžnému NSAID (1,2,45).
Doporučení:
- minimalizace dávky NSAID.
- coxiby v kombinaci s ASA zvyšují riziko krvácení stejně jako neselektivní NSAID,
- nasazení gastroprotektivních farmak u rizikových pacientů
2) samostatná terapie ASA
Žádná studie neprokázala redukci rizika při použití pufrovaných nebo enteric-coated forem ASA (3, 4). Dle observačních studií se zdá, že se riziko krvácení zvyšuje 2–4x se zvyšující se dávkou ASA (i když provedené metanalýzy signifikantní rozdíl neshledávají); riziko krvácení je 2,3x vyšší při 75 mg, 3,2x vyšší při 150 mg a 3,9x vyšší při 300 mg/den (5, 6).
U stabilní ICHS nejsou data, která by upřednostňovala vyšší dávky ASA (7). U akutního koronárního syndromu se též zdá, že nemá význam zvyšovat dávku ASA, protože nedochází k navýšení efektu a dochází ke zvýšení závažných krvácivých komplikací, což bylo prokázáno ve studii CURE (8) nebo se riziko celkových závažných krvácení nemění – to bylo pozorování popsané v subanalýze studie CURRENT OASIS (7, 9).
Doporučení:
- redukce dávky ASA u chronické ICHS na 81 mg/d,
- volbou pufrovaných nebo enteric-coated forem ASA nesnížíme riziko,
- gastroprotekce pro rizikové pacienty.
3) duální antiagregace ASA + clopidogrel
Při kombinaci ASA s clopidogrelem dochází k nárůstu rizika UGIE (upper gastrointestinal event) až 7,4 x (10). V doporučeních ACC/AHA pro terapii NONSTEMI z roku 2007 byla při závažné gastrointestinální intoleranci terapie ASA doporučována záměna za clopidogrel jakožto méně rizikové farmakum (11).
Z novějších studií ale vyplývá, že riziko krvácení do gastrointestinálního traktu je stejné při monoterapii ASA 100 mg/d i clopidogrelem 75 mg/d (2,8x) (12). V dalších randomizovaných studiích byla srovnávána bezpečnost clopidogrelu s kombinací ASA+esomeprazol, kdy vyšlo jednoznačně menší riziko (1,1x) UGIE při terapii ASA + esomeprazol (47).
Doporučení:
Gastroprotekce
- v prevenci rekurence GI krvácení při terapii ASA je doporučeno přidání inhibitoru protonové pumpy k terapii ASA,
- záměna ASA za clopidogrel nesníží riziko rekurence GI krvácení.
4) kombinace antiagregace a antikoagulace
Dle metaanalýzy studií zabývající se kombinovanou léčbou Warfarin + ASA u pacientů s průkazem akutního koronárního syndromu bylo prokázáno, že tato terapie lehce snižovala komponovaný endpoint – obsahující riziko smrti (OR 0,73), nefatálního IM a ischemické CMP ve srovnání s monoterapií ASA. Tohoto efektu bylo však dosaženo za cenu dvojnásobného zvýšení rizika extrakraniálního krvácení (u většiny případů šlo o krvácení do gastrointestinálního traktu) (13).
Zvýšení rizika krvácení bylo prokázáno i při kombinaci clopidogrelu s Warfarinem ve srovnání s použitím samotného clopidogrelu (14).
Menší studie srovnávaly rizikovost duální antiagregace s trojkombinací u pacientů po PCI (duální antiagregace s Warfarinem), kdy při INR 2–2,5 nedocházelo k zásadnímu nárůstu krvácivých komplikací proti duální antiagregaci (jedná se však o malé studie) (15). Další studie potvrdila větší redukci kompozitního rizika u pacientů po IM při monoterapii Warfarinem (či kombinované terapii Warfarin + ASA) oproti monoterapii ASA, ale za cenu zvýšení krvácivých rizik (21).
Doporučení:
Gastroprotekce
- zvážit profit z přidání antikoagulace k antiagregaci,
- v případě potřeby vyššího cílového INR při souběžné antiagregaci (chlopenní protézy atd.) zvážit vysazení antiagregace (např. u stabilní ICHS) a ponechání pouze antikoagulační monoterapie,
- pokud je potřeba trojkombinace, snaha o nižší cílové INR 2,0-2,5 (pokud lze).
5) přítomnost Helicobacter pylori
Helicobacter pylori je nezávislým rizikovým faktorem pro krvácení do GIT u pacientů užívajících ASA. Jeho průkaz je spojen s 4,7 x zvýšeným rizikem krvácení (16). Z klinických studiích srovnávajících efekt eradikace Helicobacter pylori s terapií inhibitory protonové pumpy (PPI) je z dosavadních výsledků jasné, že terapie těmito inhibitory je superiorní a dostatečně redukuje riziko recidivy GI krvácení i bez současné eradikační terapie (1, 19). V jedné studii vyšla sice ekvivalence obou přístupů při terapii ASA, ale při terapii jinými NSAID v té samé studii vyšla jasná superiorita PPI (18). Data proto nejsou dostatečná k doporučení samotné eradikace Helicobacter pylori jako ekvivalentu terapie PPI.
Studií prokazujících efekt eradikace H. pylori na rekurenci GI krvácení není mnoho, ale zdá se, že eradikace vede k signifikantní redukci krvácení (17, 19). Přestože tedy není superiorní, je použití PPI doporučováno.
Doporučení:
Terapie inhibitorem protonové pumpy je superiorní eradikační terapii
- před nasazením chronické antiagregační terapie provést u pacientů s anamnézou vředové choroby test průkazu H. pylori a v případě pozitivity testu eradikační terapie
- testování - pokud není indikace ke gastroskopii, pak neinvazivní test (antigen H. pylori ve stolici, dechový test se značenou ureou),
- eradikační terapie – 14 dní kombinace omeprazol 2x20 mg + klaritromycin 2x500 mg + amoxicilin 2x1 000 mg (nebo metronidazol 2x500 mg).
6) akutní krvácení
V případě akutního krvácení z gastroduodenálního vředu u pacientů s antiagregační terapií je nutné především okamžité přerušení léčby. Otázkou zůstává potřebná doba vysazení. Často je doporučováno vysazení antiagregace do zhojení vředu. Do současné doby je známa pouze jediná randomizovaná studie, srovnávající navrácení ASA ihned po endoskopickém zastavení krvácení (ASA 80 mg/den) a vysazení antiagregace na 8 týdnů. Všichni pacienti dostávali pantoprazol infuzně po 72 hodin následně nahrazený p.o. formou. Při časné reintrodukcí ASA byl naznačen trend k vyššímu riziku rekurence krvácení do 30 dní (HR 1,9; p < 0,25), ale zároveň byla nižší i celková kardiovaskulární mortalita jak do 30 dní, tak i v době 8 týdnů při časném nasazení ASA (HR 0,2 – většina úmrtí z recidiv kardiovaskulární příhody) (1, 48).
Doporučení:
Délka přerušení je individuální dle zvážení rizik (krvácivá proti kardiovaskulárním)
- zvážit časné znovunasazení antiagregace po gastroskopickém ošetření a infuzní terapii s PPI u kardiovaskulárně rizikových pacientů.
Gastroprotektiva
V prevenci a terapii gastrointestinálního poškození asociovaného s terapií ASA/ /NSAID byla prokázána efektivita misoprostolu, H2 blokátorů a PPI. Misoprostol (analog prostaglandinu) redukuje riziko vředu o 40 %. Bohužel je jeho užívání (běžná denní dávka reprezentuje 200 mg 4 x denně) až ve 20 % spojeno s nežádoucími účinky (průjem, bolesti břicha), které pak vedou k vysazení terapie (22). Zdá se, že tradiční dávky H2 blokátorů nevedou k dostatečné prevenci vředů asociovaných s terapií NSAID.
K signifikantní redukci rizika UGIE došlo s ranitidinem až při dávkách vyšších než 150 mg/den (300 a 600 mg). Při použití PPI došlo k signifikantní redukci rizika vzniku vředů, a to již při užití běžných dávek 1x denně. Byla prokázána superiorita PPI nad H2 blokátory v běžných dávkách a také použití misoprostolu v prevenci vředů vyvolaných NSAID (nebylo ale provedeno srovnání s velkými dávkami H2 blokátorů) 1.
Doporučení:
Běžná preventivní dávka PPI p.o. (např. omeprazol 20 mg/den, lansoprazol 30 mg/d)
- misoprostol p.o. 200 mg 4x denně,
- jako alternativa vysoké dávky H2 blokátoru p.o. (např. ranitidin 150 mg/d).
Interakce
Nejkontroverznější interakcí gastroprotektiv a antiagregace je vliv PPI na účinnost clopidogrelu. PPI jsou inhibitory cytochromu P450-2C19, který metabolizuje clopidogrel na vlastní účinný metabolit (respektive zodpovídá za 45 % enzymatické aktivity při konverzi na aktivní oxo-clopidogrel a následně za 21 % konverze na thiolový derivát; viz obr. 3).
Obr. 3. Interakce gastroprotektiv a antiagregace – vliv PPI na účinnost clopidogrelu 
Téměř 30 % populace je nositelem mutace tohoto cytochromu. Studie zabývající se dopadem mutací CYP 2C19 na terapii clopidogrelem prokázaly, že při nositelství alespoň 1 mutované alely dochází jak k in vitro poruše agregace (32 % redukce hladiny aktivního clopidogrelu, 9% redukce antiagregačního účinku na trombocyty), tak i ke zvýšení rizika vzniku kardiovaskulárních příhod – je prokázáno 1,5–2 x vyšší riziko a u pacientů pod 45 let a 3,7 x vyšší riziko kardiovaskulárního úmrtí, IM a CMP (23, 24, 25).
Po provedené implantaci koronárního stentu se riziko vzniku intrakoronární trombózy ve stentu zvyšuje 3,1x a u pacientů mladších než 45 let dokonce 6x (24, 25). V případě terapie prasugrelem, jehož aktivace je méně závislá na CYP 2C19, nebyl prokázán dopad mutace tohoto cytochromu ani na laboratorní, ani na klinické parametry (49). Pro klinický dopad mutace CYP 2C19 byla věnována pozornost možným následkům farmakologické inhibice CYP 2C19 např. inhibitory protonové pumpy.
Laboratorní studie zabývající se in vitro poruchou agregace při terapii PPI a clopidogrelem přinášejí rozdílné výsledky. V podstatě potvrzují snížení antiagregačního efektu při užívání PPI, ale tento efekt kolísá a liší se u jednotlivých typů PPI (tab. 2). Jedna ze studií zjišťovala dopad užívání PPI na terapii prasugrelem; bylo zjištěno pouze lehké zhoršení antiagregačního efektu (výrazně menší než při terapii clopidogrelem) (32).
Tab. 2. Algoritmus rozhodování pro nasazení gastroprotektivní léčby 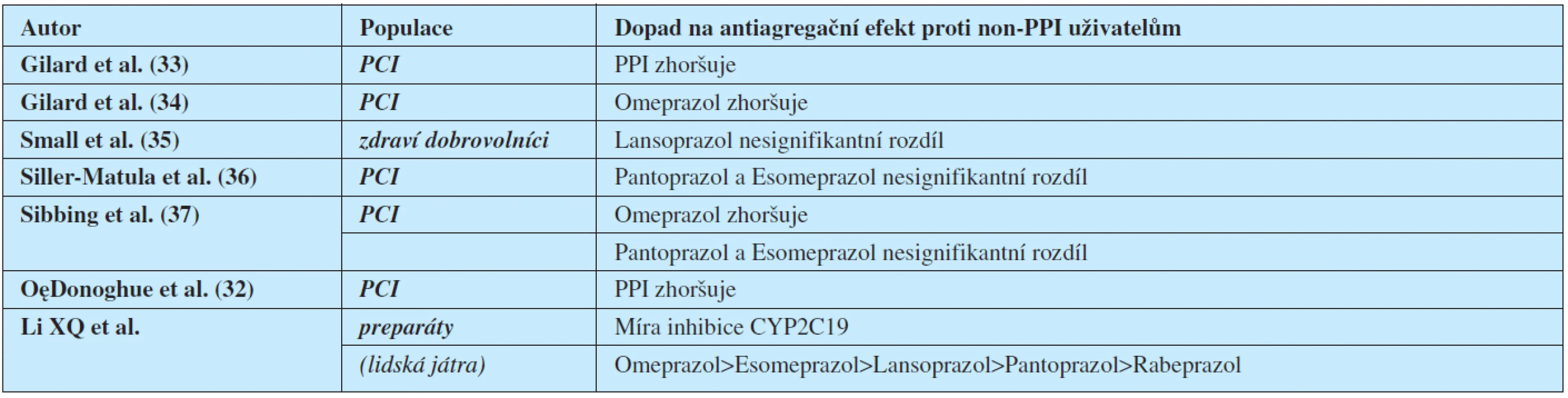
Z přehledu klinických studií je zřejmé, že výsledky jsou velmi rozporné (tab. 3). V současnosti existuje pouze jedna randomizovaná studie, která neprokázala větší kompozitní riziko KV smrti, reinfarktu a CMP jakož i samostatně riziko reinfarktů nebo potřeby revaskularizace u pacientů po AIM nebo PCI při užívání omeprazolu (26). Další studie nejsou randomizované, jde většinou o retrospektivní přehledy, a podávají značně rozdílné výsledky. Některé z nich totiž neprokazují vyšší riziko kardiovaskulární příhody při užití PPI, a to bez ohledu na typ PPI (27, 41). Některé z nich neprokazují zvýšení rizika kardiovaskulární příhody ani při srovnání skupin s a bez genetické poruchy funkce CYP2C19 (32, 39). Naopak existují studie prokazující vyšší kardiovaskulární riziko při užívání PPI.
Tab. 3. Přehled klinických studií 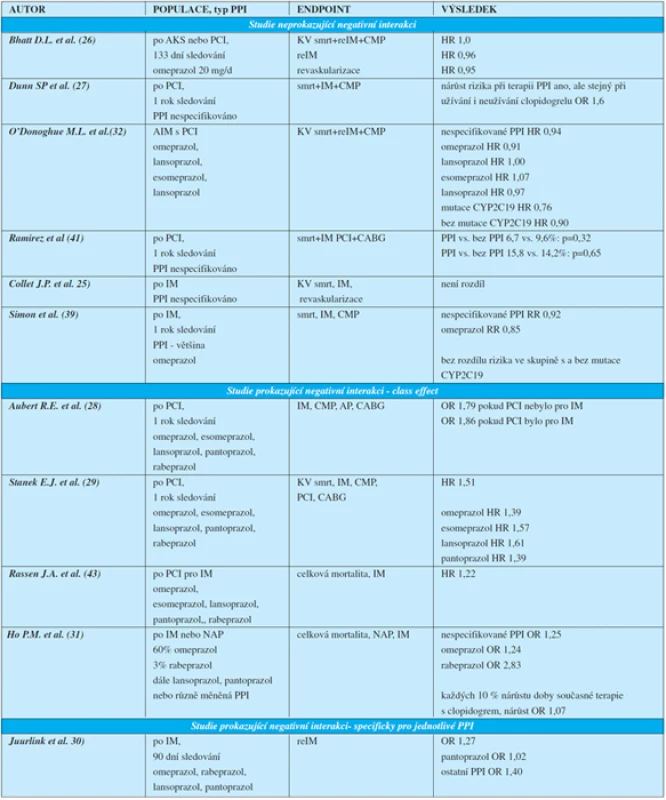
Dle některých studií se jedná o „class effect“ (28, 29, 31, 43). Podle některých výsledků lze odvozovat závislost míry zvýšení rizika reinfaktu na době trvání současného užívání PPI a clopidogrelu (31). Pokud jsou k dispozici opačné názory, které zpochybňují „class effect“, ty se pak opírají o možný klinický dopad různé míry inhibice CYP2C19 s použitím různých typů PPI – konkrétně se neprokázalo zvýšení rizika u pantoprazolu (zatím co u omeprazolu, lansoprazolu a rabeprazolu ano) (30).
V případě H2 blokátorů v kombinaci s clopidogrelem nebylo zjištěno zvýšení rizika kardiovaskulárních příhod (29, 30, 32).
V případě PPI v kombinaci s prasugrelem nebylo zjištěno zvýšení rizika kardiovaskulárních příhod a laboratorně byla zjištěna jen lehká porucha agregace (32); prasugrel se jeví jako vhodná alternativa clopidogrelu v případě obav z interakce s PPI, a to i z toho důvodu, že redukuje lépe riziko kardiovaskulárních příhod u vysoce rizikových pacientů s akutním koronárním syndromem. Významnou limitací pro jeho masivnější užívání je zvýšené riziko krvácení oproti clopidogrelu (40).
A) Doporučení autorit:
I když jasná data o negativním klinickém dopadu interakce chybí, vzhledem k obavám z populačního dopadu (velké množství preskribce PPI a prevalence ICHS) a nemožnosti jednoznačného závěru odborníci zodpovídající za používání antikoagulační a antiagregační léčby raději nedoporučili souběžnou terapii.
Níže jsou vybrané citace jednotlivých organizací pro kontrolu léčiv:
FDA:
- neužívat současně inhibitory 2C19
- omeprazol,
- esomeprazol,
- cimetidin,
- flukonazol,
- ketokonazol,
- vorikonazol,
- etravirin,
- felbamat,
- fluoxetin,
- fluvoxamin,
- ticlopidin,
- nejsou data pro doporučení jednotlivých PPI, jedná se o „class effect“.
- pečlivě zvážit potřebu nasazení a pokračování terapie PPI
- ani 12-ti hodinový rozdíl dávkování nemění interakci,
- lze užívat H2 blokátory mimo cimetidinu,
- lze užívat anacida,
- do textů léčiv s clopidogrelem přidat doporučení:
současná léčba léků inhibujících CYP2C19 (např. omeprazol) by neměla být preskribována.“
European Medicines Agency (EMA):
- do textů léčiv s clopidogrelem přidat informaci o interakci s PPI a doporučení:
„pokud možno vyhnout se souběžné terapii PPI a clopidogrel obsahujících léků.“
SÚKL:
přehodnotit nutnost a potřebu podávání PPI u pacientů užívající clopidogrel.
B) Klinická praxe:
Nejlepších výsledků v prevenci a terapii NSAID asociovaných gastroduodenálních lézí bylo dosaženo terapií PPI. Na druhé straně jsou ale data o kardiovaskulárním riziku současné terapie. Zvýšení rizika však prokazují pouze retropektivní observační studie a toto riziko ve větších observačních studiích ještě není nijak velké (1,25–1,5) (38). Jeden z možných důvodů vyššího rizika u pacientů užívajících PPI může být apriorně větší „nemocnost“, a tím horší prognóza populace, u které byla terapie PPI indikována. Možnost, že by PPI sami o sobě zvyšovaly riziko, se v observačních studiích neprokázala (29, 38).
Na druhé straně je celá řada observačních studií, které žádné zvýšení rizika léčbou PPI nenalézají, a to ani v populaci s mutovaným CYP 2C19. V současnosti je pouze jedna randomizovaná studie a ta, jak bylo uvedeno, též větší rizikovost terapie PPI neprokazuje (26). V klinické praxi se tato restriktivní opatření příliš neprojevila (co se týče souběžného podávání PPI a clopidogrelu) a je tedy postupováno volněji.
Návrh postupu:
H2 blokátory jako alternativa PPI.
- z PPI možno upřednostnit pantoprazol (nejsou však dostatečná data),
- separované podání farmak (vzhledem ke kompetetivní inhibici 2C19 a krátkému poločasu obou farmak by měl stačit 12–15 h odstup v dávkování). Např. PPI 1-0-0 a clopidogrel 0-0-1. Pro možnost pomalých metabolizerů PPI (clearance clopidogrelu je rychlejší a bývá neměřitelný do 4-6 h) eventuálně ještě prodloužení doby mezi užitím PPI a clopidogrelu např. PPI 0-0-1 a clopidogrel 0-1-0,
- prasugrel není indikován jako alternativa clopidogrelu při obavách z interakce s PPI.
Závěr
K vytvoření jasnějších doporučení bude potřeba dalších randomizovaných studií, které by měli osvětlit klinický dopad inhibice CYP2C19 inhibitory protonové pumpy, kterou prokazují laboratorní studie. Situaci by mohlo zjednodušit i zjištění rovnocennosti terapie PPI s velkými dávkami H2 blokátorů. Vhodné je přistupovat k terapii individuálně a v případě antiagregancií volit jen potřebnou intenzitu terapie (např. zvážit nutnost duální antiagregace s antikoagulací). V případě PPI, bude-li léčba indikována (rizikové skupiny), je jejich podání pravděpodobně namístě (s předchozím informováním pacienta).
Doc. MUDr. Petr Neužil, CSc.
Kardiologické oddělení
Nemocnice Na Homolce
Roentgenova 2
150 30, Praha 5
E-mail: neuzil@seznam.cz
Zdroje
1. Bhatt, D.L., Scheiman, J., Abraham, N.S. et al. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology task force on clinical expert consensus documents. Circulation 2008, 118, p. 1894-1909.
2. Silverstein, F.E., Faich, G., Goldstein, J.L. et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: A randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. JAMA 2000, 284, p. 1247-1255.
3. de Abajo, F.J., Garcia-Rodriguez, L.A. Risk of upper gastrointestinal bleeding and perforation associated with low-dose aspirin as plain and enteric-coated formulations. BMC Clin. Pharmacol. 2001, 1, p. 1.
4. Kelly, J.P. Risk of aspirin-associated major upper-gastrointestinal bleeding with enteric-coated or buffered product. Lancet 1996, 348, p. 1413-1416.
5. Weil, J., Colin-Jones, D., Langman, M. et al. Prophylactic aspirin and risk of peptic ulcer bleeding. BMJ 1995, 310, p. 827-830.
6. Derry, S., Loke, Y.K. Risk of gastrointestinal haemorrhage with long term use of aspirin: meta-analysis. BMJ 2000, 321, p. 1183-1187.
7. Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002, 324, p. 71–86.
8. Peters, R.J., Mehta, S.R. Fox, K.A. et al. Effects of aspirin dose when used alone or in combination with clopidogrel in patients with acute coronary syndromes: observations from the Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) study. Circulation 2003, 108, p. 1682–1687.
9. Mehta, S.R., Tanguay, J.F., Eikelboom, J.W. et al. Double-dose versus standard-dose clopidogrel and high-dose versus low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OASIS 7): A randomised factorial trial. Lancet 2010, DOI:10.1016/S0140-6736(10) 61088-4.
10. Hallas, J., Dall, M., Andries, A. et al. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ 2006, 333, p. 726.
11. CAPRIE Steering Committee. A randomised, blinded trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996, 348, p.1329-1339.
12. Lanas, A., Garcia-Rodriguez, L.A., Arroyo, M.T. et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclooxygenase - 2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut 2006, 55, p.1731-1738.
13. Andreotti, F., Testa, L., Biondi-Zoccai, G.G. Crea, F. Aspirin plus warfarin compared to aspirin alone after acute coronary syndromes: an updated and comprehensive meta-analysis of 25,307 patients. Eur. Heart J. 2006, 27, p. 519-526.
14. Anand, S., Yusuf, S., Xie, C. et al. Oral anticoagulant and antiplatelet therapy and peripheral arterial disease - WAVE trial. N. Engl. J. Med. 2007, 357, p. 217-227.
15. Rosini, R., Musumeci, G., Lettieri, C. Long-term outcomes in patients undergoing coronary stenting on dual oral antiplatelet treatment requiring oral anticoagulant therapy. Am. J. Cardiol. 2008, 102, p. 1618-1623.
16. Lanas, A., Scheiman, J. Low-dose aspirin and upper gastrointestinal damage: epidemiology, prevention and treatment. Curr. Med. Res. Opin. 2007, 23, p. 163-173.
17. Chan, F.K. Long-term incidence of ulcer bleeding with low-dose aspirin after eradication of H pylori: a 4-year prospective cohort study (abstr). Gastroenterology 2005, 128, A133.
18. Chan, F.K., Chung, S.C., Suen, B.Y. et al. Preventing recurrent upper gastrointestinal bleeding in patients with Helicobacter pylori infection who are taking low-dose aspirin or naproxen. N. Engl. J. Med. 2001, 344, p. 967-973.
19. Lai, K.C., Lam, S.K., Chu, K.M. et al. Lansoprazole for the prevention of recurrences of ulcer complications from long-term low-dose aspirin use. N. Engl. J. Med. 2002, 346, p. 2033-2038.
20. Sung, J., Lau, J., Ching, J. et al. Can aspirin be reintroduced with PPI inhibitor INFUSION after endoscopic hemostatis: a double-blinded randomized controlled trial. Gastroenterology 2008, 130, A44.
21. Hurlen, M., Abdelnoor, M., Smith, P. et al. Warfarin, aspirin or both after myocardial infarction. N. Engl. J. Med. 2002, 347, p. 969-974.
22. Silverstein, F.E., Graham, D.Y., Senior, J.R. et al. Misoprostol reduces serious gastrointestinal complications in patients with rheumatoid arthritis receiving nonsteroidal anti-inflammatory drugs: a randomized, double-blind, placebo-controlled trial. Ann. Intern. Med. 1995, 123, p. 241-249.
23. Simon, T., Verstuyft, C., Mary-Krause, M. et al. Genetic determinants of response to clopidogrel and cardiovascular events. N. Engl. J. Med. 2009, 360, p. 363-375.
24. Mega, J.L., Close, S.L., Wiviott, S.D. et al. Cytochrome P-450 polymorphisms and response to clopidogrel. N. Engl. J. Med. 2009, 360, p. 354-362.
25. Collet, J.P., Hulot, J.S., Pena, A. et al. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study. Lancet 2009, 373, p. 309-317.
26. Bhatt, D.L. COGENT: a prospective, randomized, placebo-controlled trial of omeprazole in patients receiving aspirin and clopidogrel. Transvascular Cardiovascular Therapeutics Annual Meeting, September 2009, San Francisco, USA.
27. Dunn, S.P., Macaulay, T.E., Brennan, D.M. et al. Baseline proton pump inhibitor use is associated with increased cardiovascular events with and without the use of clopidogrel in the CREDO trial. Circulation 2008, 118, S 815.
28. Aubert, R.E., Epstein, R.S., Teagarden, J.R. et al. Proton pump inhibitors effect on clopidogrel effectiveness: the Clopidogrel Medco Outcomes Study. Circulation 2008, 118, S 815.
29. Stanek, E.J., Aubert, R.E., Flockhart, D.A. et al. A national study of the effect of individual proton pump inhibitors on cardiovascular outcomes in patients treated with clopiodogrel following coronary stenting: The Clopidogrel Medco Outcomes. Dostupné z scaiscientificsessions.org/wednesdaymay6/LBCT_Stanek_Clopidogrel-PPI_SCAI.ppt.
30. Juurlink, D.N., Gomes, T, Ko, D.T. et al. A population-based study of the drug interaction between proton pump inhibitors and clopidogrel. CMAJ 2009, 180, p. 713-718.
31. Ho, P.M., Maddox, T.M., Wang, L. et al. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA 2009, 301, p. 937-944.
32. O’Donoghue, M.L., Braunwal, E., Antman, E.M. Pharmacodynamic effect and clinical efficacy of clopidogrel and prasugrel with or without a proton-pump inhibitor: an analysis of two randomised trials. Lancet 2009, 374, p. 989-997.
33. Gilard, M., Arnaud, B., Le Gal, G. et al. Influence of omeprazol on the antiplatelet action of clopidogrel associated to aspirin. J. Thromb. Haemost. 2006, 4, p. 2508-2509 (Letter).
34. Gilard, M., Arnaud, B., Cornily, J.C. et al. Influence of omeprazole on the antiplatelet action of clopidogrel associated with aspirin: the randomized,double-blind OCLA (Omeprazole CLopidogrel Aspirin) study. J. Am. Coll. Cardiol. 2008, 51, p. 256-260.
35. Small, D.S., Farid, N.A., Payne, C.D. et al. Effects of the proton pump inhibitor lansoprazole on the pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel. J. Clin. Pharmacol. 2008, 48, p. 475-484.
36. Siller-Matula, J.M., Spiel, A.O., Lang, I.M. et al. Effects of pantoprazole and esomeprazole on platelet inhibition by clopidogrel. Am. Heart J. 2009, 157, 148.e1-5.
37. Sibbing, D., Morath, T., Stegherr, J. et al. Impact of proton pump inhibitors on the antiplatelet effects of clopidogrel. Thromb. Haemost. 2009, 101, p. 714-719.
38. Laine, L., Hennekens, Ch. Proton pump inhibitor and clopidogrel interaction: fact or fiction? Am. J. Gastroenterol. 105 : 34-41; advance online publication, November 10, 2009; doi:10.1038/ajg.2009.638.
39. Simon, T., Mulak, G., Bataille, V., Danchin, N. Genetic determinants of response to Clopidogrel and cardiovascular events. N. Engl. J. Med. 2009, 360, p. 363-375.
40. Wiviott, S.D., Trenk, D., Frelinger, A.L. III. Prasugrel versus Clopidogrel in patients with acute coronary syndrome. N. Engl. J. Med. 2007, 357, p. 2001-2015.
41. Ramirez, J.F., Selzer, F., Chakaprani, R. Proton pump inhibitor and clopidogrel interaction, JACC 2009, 53 (Suppl 1), A27
42. Johnson, D.A. Upper GI risks of NSAIDs and antiplatelet agents. Rev. Cardiovasc. Med. 2005, 6 (suppl 4), S15–22.
43. Rassen, J.A., Choudhry, N.K., Avorn, J., Schneeweiss, S. Cardiovascular outcomes and mortality in patients using clopidogrel with proton pump inhibitors after percutaneous coronary intervention or acute coronary syndrome. Circulation 2009, 120, p. 2322–2329.
44. Wallace, J.L., McKnight, W., Reuter, B.K. et al. NSAID-induced gastric damage in rats: Requirement for inhibition of both cyclooxygenase 1 and 2. Gastroenterology 2000, 119, p. 706-714.
45. Bombardier, C., Laine, L., Reicin, A. et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. N. Engl. J. Med. 2000, 343, p. 1520-1528.
46. Abraham, N.S. Hartman, C. Castillo, D. et al. Effectiveness of national provider prescription of PPI gastroprotection among elderly NSAID users. Am. J. Gastroenterol. 2008, 103, p. 323–332.
47. Lai, K.C., Chu, K.M. Hui, W.M. et al. Esomeprazole with aspirin versus clopidogrel for prevention of recurrent gastrointestinal ulcer complications. Clin. Gastroenterol. Hepatol. 2006, 4, p. 860-865.
48. Sung, J., Lau, J., Ching, J. et al. Can aspirin be reintroduced with PPI inhibitor infusion after endoscopic hemostatis: a double-blinded randomized controlled trial (abstr). Gastroenterology 2008, 130: A44.
49. Mega, J.L., Close, S.L., Wiviot, S.D. et al. Cytochrome P450 genetic polymorphism and the response to prasugrel: relationship to pharmakinetic, pharmadynamic and clinical outcomes. Circulation 2009, 119, p. 2553-2560.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2010 Číslo 11- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
-
Evoluce a evoluční teorie pro lékaře
XI. Vývoj jazyka - Testosteron a civilizační onemocnění
- Antiagregace a gastroprotektiva
- Stopové prvky a skelet
- Nové poznatky o rýmě, aneb seznámení s Evropským konsenzem o rinosinusitidě a nosní polypóze z roku 2007 (EP3OS 2007)
- Liečba hypertonikov v ambulantnej starostlivosti na Slovensku
- Dříve projevená přání pacientů a recepce tohoto problému v České republice a v Německu
- Proporcionální zastoupení léčebných postupů u pacientů s benigní hyperplazií prostaty
- Alkohol, tabák a jiné návykové látky a reprodukční rizika
- Astma bronchiale a alergická rhinitida u zadělávačky knedlíků
- Zakladatel klinické laryngoskopie Jan Nepomuk Čermák a jeho fyziologický ústav v Praze
- Miniportréty slavných českých lékařů Profesor MUDr. Karel Mathon, neurolog stíhaný nepřízní osudu
- Nové organizační složky ČLS JEP
- Ze života odborných společností ČLS JEP
-
XXII. kongres ČLS JEP v Brne
Zobrazovacie metódy v medicíne
Živá diskusia medzi odboníkmi a praktickými lekármi - Nový preparát pro léčbu von Willebrandovy choroby
- Sofiina volba onkologů: poškodit pacienta, nebo zadlužit zaměstnavatele?
- Knihy
- JUBILEA
-
Evoluce a evoluční teorie pro lékaře
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání