-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Malobuněčný karcinom plic – nové poznatky o biologii nádoru
Small cell lung cancer – news in the tumour´s biology
Small cell lung carcinoma (SCLC) is a high grade neuroendocrinne tumour accounting for approximately 15 % of lung cancers. It is characterised by early relapse and low survival rate. The treatment has remained unchanged for decades. Histological and cytological characteristics are summarised in brief, along with genetic alterations of the tumour. A new molecular subtype classification is presented according to the expression of transciptional factors ASCL1 (SCLC-A), NEUROD1 (SCLC-D), POU2F3 (SCLC-P) and YAP1 (SCLC-Y). These subtypes represent different ways of tumorigenesis, and the distinct genomic alterations may offer new therapeutic strategies.
Keywords:
small cell lung carcinoma– ASCL1 – NEUROD1 – POU2F3 – YAP1
Autoři: Klára Pavlíčková 1; Radoslav Matěj 1,2,3
Působiště autorů: Ústav patologie a molekulární medicíny 3. LF UK, Fakultní Thomayerova nemocnice, Praha 1; Ústav patologie 3. LF UK, Fakultní nemocnice Královské Vinohrady, Praha 2; Ústav patologie 1. LF UK, Všeobecná fakultní nemocnice, Praha 3
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 1, p. 18-22
Kategorie: Přehledový článek
Souhrn
Malobuněčný karcinom plic (SCLC) je neuroendokrinní tumor vysokého stupně malignity, představující přibližně 15 % všech plicních karcinomů. Léčba tohoto nádoru zůstává desetiletí stejná, karcinom pravidelně časně relabuje, rychle generalizuje a prognóza pacientů je velmi špatná. Následující sdělení stručně shrnuje histologickou a cytologickou charakteristiku tumoru, jeho nejčastější genetické změny a představuje nové dělení nádoru do skupin dle exprese transkripčních faktorů ASCL1 (SCLC-A), NEUROD1 (SCLC-D), POU2F3 (SCLC-P) a YAP1 (SCLC-Y). Jednotlivé podskupiny malobuněčného karcinomu reprezentují současně odlišné mechanismy tumorigeneze a nastiňují nové možnosti léčby malobuněčného karcinomu plic.
Malobuněčný plicní karcinom (1) je vysoce agresivní nádor se schopností rychlého růstu a časného metastazování (2). Jedná se o nádor asociovaný s kouřením – většina pacientů je současnými nebo bývalými kuřáky (3). V České republice představuje 14,8 % ze všech plicních karcinomů (4), celosvětově je zodpovědný za 250 000 úmrtí ročně. Pětileté přežití pacientů s diagnózou malobuněčného plicního karcinomu zůstává dlouhodobě nízké, pohybuje se přibližně okolo 7 % (5). Pro úplnost je třeba doplnit, že malobuněčné karcinomy vznikají vzácně také v jiných orgánech (6).
Morfologická diagnostika
Malobuněčný plicní karcinom je nejčastěji diagnostikovaný z endobronchiální biopsie. Nádor v těchto odběrech pravidelně vykazuje výrazné odběrové artefakty, často až rozhmoždění v chromatinový prach. Jako Azzopardiho fenomén je označovaná inkrustace bazofilní DNA okolo cév. Velikost nádorových buněk nepřesahuje velikost tří klidových lymfocytů. Nádorové buňky v biopsii postrádají uspořádání; trabekulární formace či tvorba rozet může být zastižená v resekovaném tumoru. Typický je úzký lem cytoplazmy, mezibuněčné hranice jsou nezřetelné. Chromatin nádorových buněk je jemně granulární, vzhledu pepře a soli, jadérka nejsou patrná (Obr. 1). Pro diagnózu je nezbytná vysoká mitotická aktivita a přítomnost nekróz. Imunohistochemické vyšetření není podmínkou, prováděné je ale velmi často. Nádorové buňky jsou většinou pozitivní v imunohistochemickém průkazu CD56 (nejvíc senzitivním, ale také nejméně specifickém markeru, Obr. 2), méně často synaptofyzinu, chromograninu A a neuron-specifické enoláze. Vyšší senzitivitu a specificitu v průkazu neuroendokrinní diferenciace by měl mít jaderný marker INSM1 (insulinoma associated protein 1). Typická je tečkovitá cytoplazmatická pozitivita cytokeratinu (nejlépe klonu AE1/AE3, CAM5.2) (Obr. 3). Proliferační aktivita stanovená imunohistochemickým průkazem Ki-67 by měla být vyšší než 65 %, pravidelně přesahuje 80 % (Obr. 4). TTF-1 je pozitivní ve více než 90 % malobuněčných karcinomů plic, což ale nedokládá jejich primární plicní původ. P16 je pozitivní v naprosté většině malobuněčných karcinomů. Současná pozitivita p16, TTF-1 a CD56 byla recentně popsaná jako velmi senzitivní sestava v diagnostice SCLC (7). Důležité je si připomenout, že 5-10 % malobuněčných karcinomů je negativních v imunohistochemickém průkazu neuroendokrinních markerů – v tomto případě je ale nezbytné vyloučit jiný nádor, zejména pak malobuněčnou variantu dlaždicobuněčného karcinomu, lymfom, nádor z malých tmavých buněk, SMARCA4 – deficientní nediferencovaný tumor či nádory metastatické (melanom) (2).
Obr. 1. Malobuněčný karcinom. Neuspořádané buňky s jemně granulovaným chromatinem, úzkým lemem cytoplazmy a nezřetelnými mezibuněčnými hranicemi. HE, 200x. 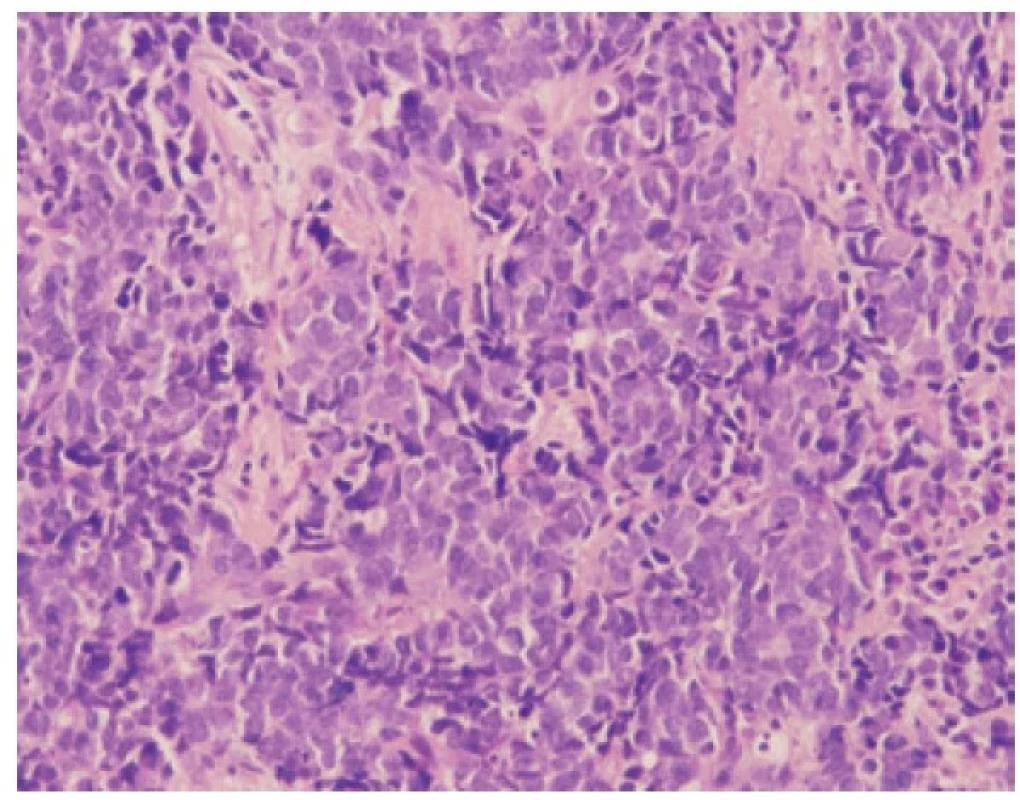
Obr. 2. Pozitivita buněk malobuněčného karcinomu v imunohistochemickém průkazu CD56. 200x. 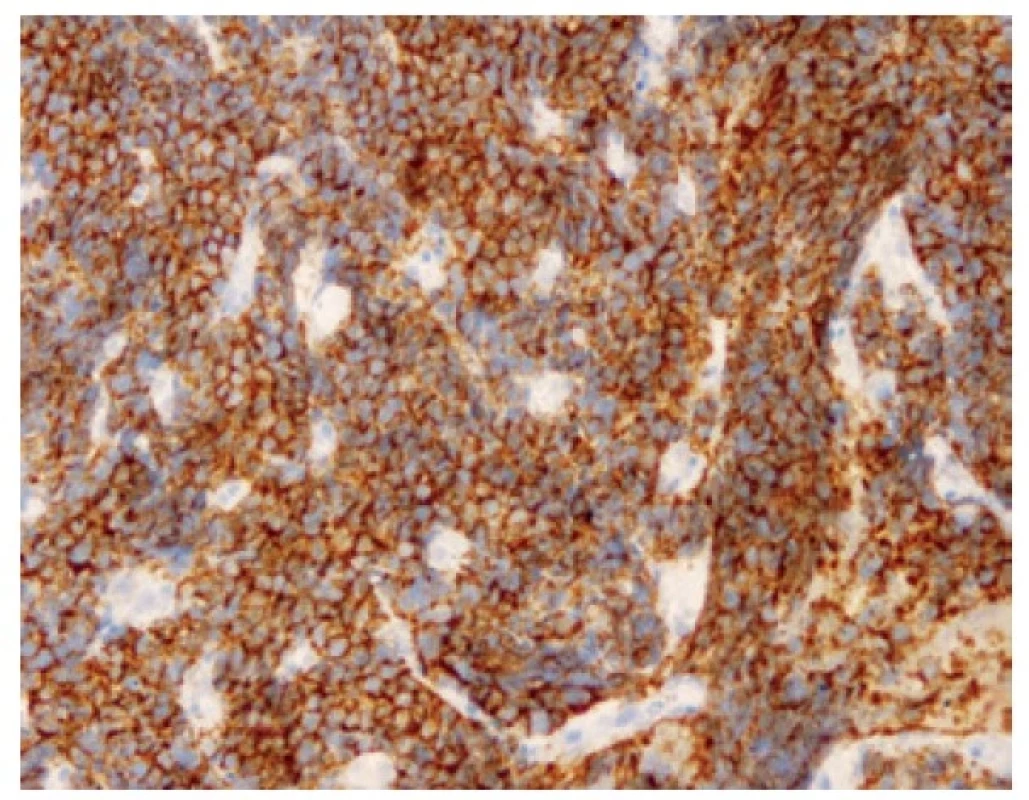
Obr. 3. Granulární cytoplazmatická pozitivita malobuněčného karcinomu v imunohistochemickém průkazu cytokeratinu AE1/AE3, kontrastující se silnou cytoplazmatickou pozitivitou výstelky žlázky. 100x. 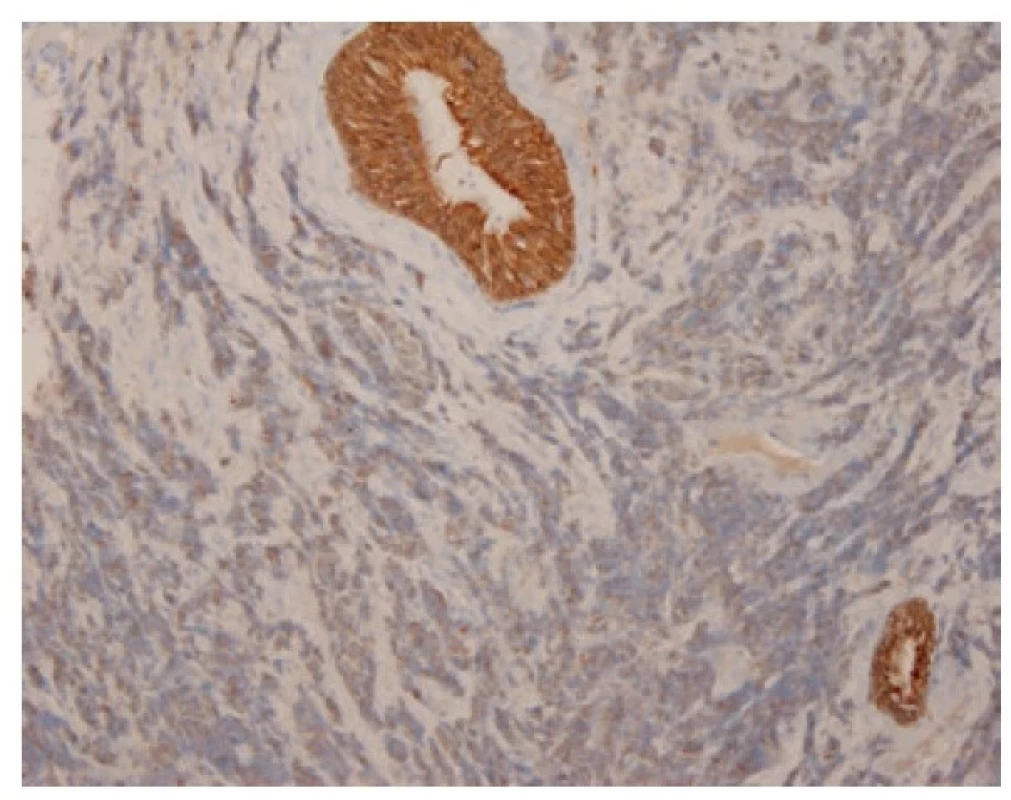
Obr. 4. Přibližně 95 % buněk pozitivních v imunohistochemickém průkazu proliferačního antigenu Ki-67. 200x. 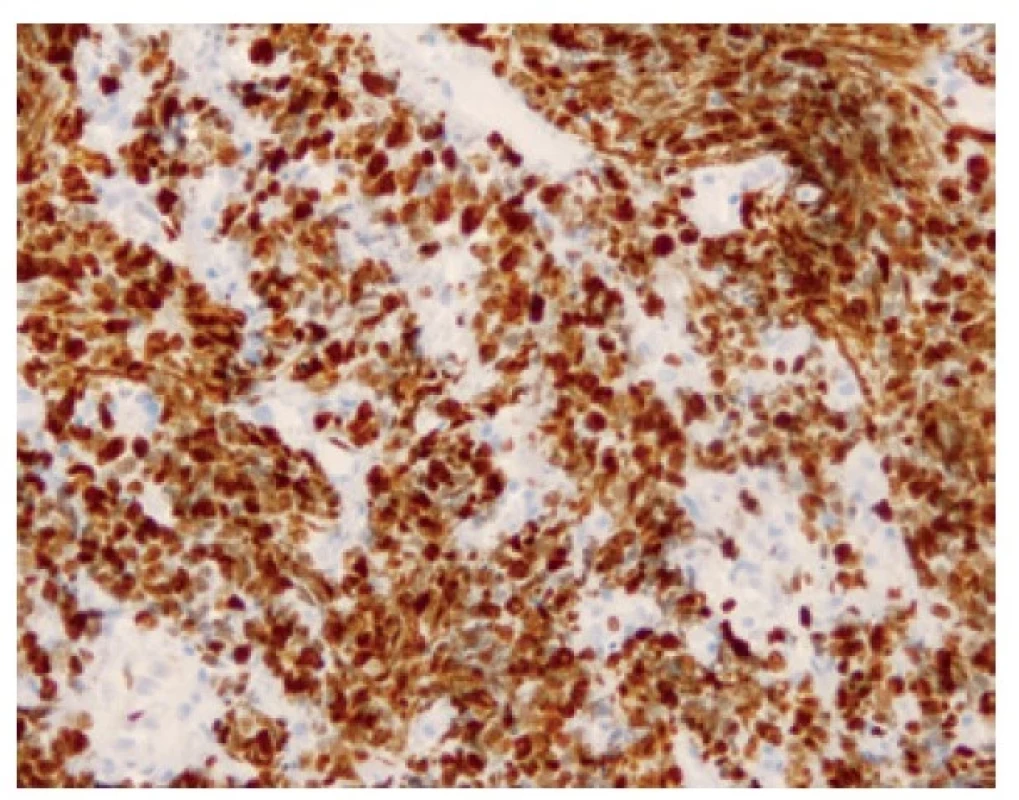
Každé pracoviště si pro diagnostiku malobuněčného karcinomu stanoví vlastní postupy a důvěryhodný panel protilátek. Na našem pracovišti užíváme v imunohistochemickém vyšetření SCLC kombinaci CD56, širokospektrého cytokeratinu, Ki-67, TTF-1 a p40. Kromě toho je klíčová multidisciplinární spolupráce s klinickými lékaři, rovněž data sérových markerů jako NSE či proGRP.
V cytologii nádor může vykazovat menší odběrové artefakty než v biopsii, i tak je ale zhmoždění nádorových buněk pro malobuněčný karcinom typické. Nádorové buňky se vyskytují jednotlivě i ve skupinách. Ve skupinách jsou k sobě buňky s minimálním množstvím cytoplazmy typicky natěsnané („puzzling“), s okraji jader „vykousanými od molů“ (Obr. 5) Pokud jsou nádorové buňky zastižené jednotlivě, můžou napodobovat buňky non-Hodgkinova lymfomu. Často vidíme apoptotická a pyknotická jádra. Chromatin nádorových buněk je hrubě granulární, bez evidentních jadérek. V cytologii mohou být buňky malobuněčného karcinomu zaměněné zejména za lymfocyty (nádorové i nenádorové), hyperplázii bazálních buněk respiračního epitelu a buňky nemalobuněčného plicního karcinomu. Obdobně jako v histologii může pomoci imunocytochemický průkaz CD56, eventuálně jiných neuroendokrinních markerů (chromogranin, synaptofyzin, NSE) (8).
Obr. 5. Cytologický vzhled malobuněčného plicního karcinomu. „Puzzling“ jader, granulovaný chromatin, nepřítomnost jadérek, mitotická aktivita. Giemsa, 200x. 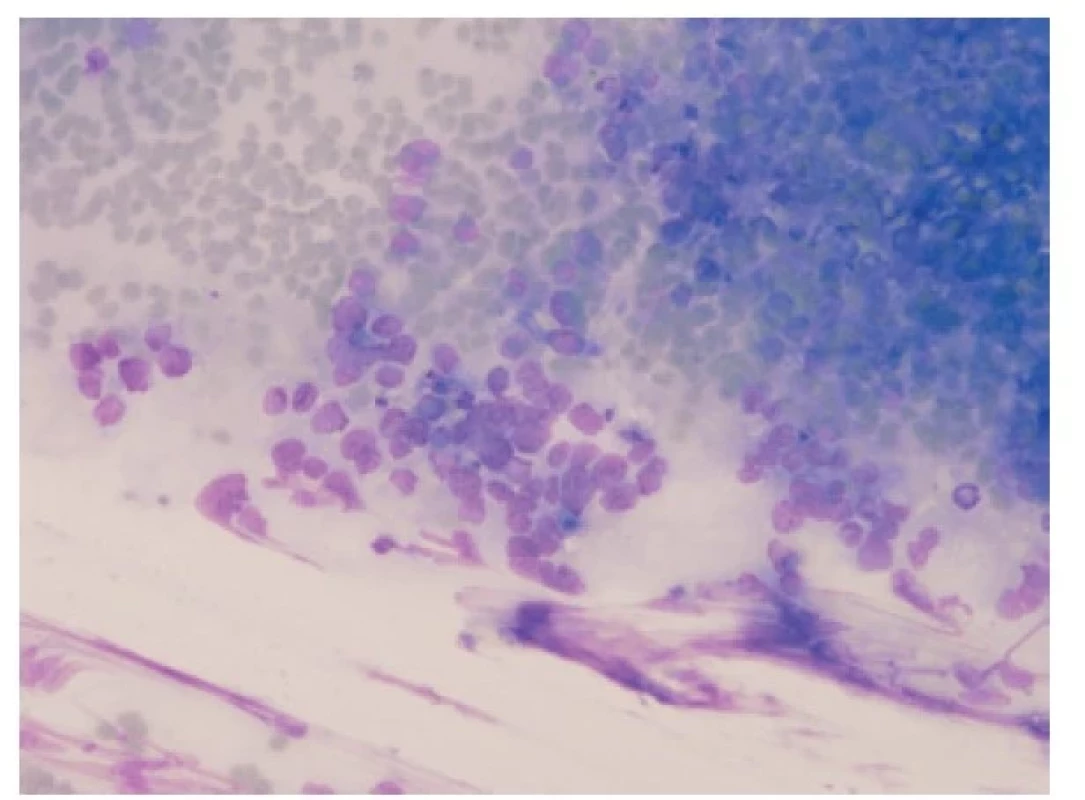
Molekulární biologie SCLC
Malobuněčný plicní karcinom pravděpodobně vychází z plicních neuroendokrinních buněk, které se vyskytují jednotlivě zejména v proximálních dýchacích cestách a uplatňují se ve vývoji a zrání plic, ale také při reparaci poškozeného plicního parenchymu a jako chemoreceptory (9).
Od osmdesátých let minulého století jsou malobuněčné karcinomy plic chápané jako součást kontinua plicních neuroendokrinních nádorů (2), tedy typického karcinoidu, atypického karcinoidu, nově ustanovené provizorní kategorie neuroendokrinního tumoru s vyšší mitotickou aktivitou/vyšším proliferačním indexem měřeným Ki-67 a velkobuněčného neuroendokrinního karcinomu. Spolu s velkobuněčným neuroendokrinním karcinomem se řadí mezi high-grade neuroendokrinní karcinomy (NEC). Pro úplnost je potřeba zmínit kombinovaný plicní karcinom, označující kombinaci SCLC s velkobuněčným neuroendokrinním karcinomem nebo s některým z nemalobuněčných plicních karcinomů. V případě kombinace s velkobuněčným neuroendokrinním karcinomem je pro diagnózu kombinovaného karcinomu nutné alespoň 10 % zastoupení tohoto nádoru; v případě nemalobuněčných nádorů není vyžadovaná žádná procentuální hranice (2).
Staging malobuněčného plicního karcinomu historicky zahrnuje limitované stádium nemoci (ipsilaterální hemithorax, nádor je možné pojmout do ozařovacího pole) a extenzivní stádium (nádor mimo ipsilaterální hemithorax, kromě hematogenních metastáz zahrnuje i nádorové postižení pleury a perikardu). TNM klasifikace malobuněčného plicního karcinomu a nemalobuněčného plicního karcinomu je společná, nyní dle 8. vydání TNM klasifikace zhoubných novotvarů. Přibližně 66 % malobuněčných plicních karcinomů je diagnostikováno v extenzivním stádiu (5) a obecně se tento nádor považuje v době diagnózy za systémové onemocnění.
Malobuněčný plicní karcinom je ve 20-40 % spojený s paraneoplastickými syndromy (10). Zajímavé je, že pacienti s SCLC schopnými vyvolat imunitní odpověď prezentující se jako paraneoplastický syndrom, měli v některých studiích delší celkové přežití (11).
Terapie malobuněčného plicního karcinomu je systémová, založená zejména na platinových cytostaticích a etoposidu, při relapsu nádoru pak na topotecanu, v kombinaci s radioterapií. Pro SCLC je typická vysoká míra odpovědi na prvotní chemoterapii, pak ale časný relaps a rezistence tumoru na další léčbu (5).
V ostrém kontrastu s naším vývojem poznání v kategorii nemalobuněčných plicních karcinomů (zpřesňování histologických prognostických markerů, rutinní testování prediktivních markerů s následným terapeutickým využitím) nedošlo v minulých několika desetiletích u malobuněčného karcinomu plic téměř k žádnému posunu v poznání biologie tumoru, a tedy ani v léčbě a přežití pacientů. Mutace v EGFR a KRAS signálních cestách se v malobuněčných plicních karcinomech téměř nevyskytují (12). Poznání molekulární biologie SCLC v době diagnózy a relapsu je přitom jedinou cestou, jak pochopit mechanismy rezistence malobuněčného plicního karcinomu k léčbě. Pochopení nádorové biologie musí pojmout změny genetické i epigenetické (13).
Relativně recentně se začaly objevovat studie založené na analýze genetických změn tohoto v mikroskopu tak stereotypně vyhlížejícího tumoru. Obdobně jako jiné nádory asociované s chronickým nikotinismem se nádorové buňky SCLC vyznačují vysoce nestabilním genomem. Časté jsou změny počtu kopií genů a zároveň vysoký počet mutací (takzvaná vysoká mutační nálož – tumour mutation burden – TMB). Pro vývoj nádoru na podkladě chronického nikotinismu svědčí častá C:G>A:T tranzice (14) a mutace v APOBEC (apolipoprotein B mRNA editing enzyme, catalytic polypeptide-like), “APOBEC signature” (15). Častá a časná je ztráta 3p (16). Většina malobuněčných plicních karcinomů je charakterizovaná inaktivací či ztrátou tumor supresorových genů, zejména RB1 (přibližně 65 % nádorů) a p53 (přibližně 65-90 % nádorů), časté jsou amplifikace transkripčních genů (SOX2, NFIB, MYCL1, MYCN, MYC, CREBBP a EP300). Část malobuněčných karcinomů vzniká pod vlivem selekčního tlaku inhibitorů tyrozin kináz při léčbě jiných nádorů s mutací EGFR nebo ALK. Tyto nádory si uchovávají EGFR mutaci a získávají výše popsanou ztrátu RB1. Naopak, až 30 % bioptických vzorků pacientů léčených pro malobuněčný plicní karcinom zastihne oblasti s nemalobuněčnou diferenciací, nejčastěji okrsky velkobuněčného karcinomu. Tento poznatek znovu připomíná teorii vývoje plicních nádorů z pluripotentních zárodečných buněk, ze kterých se diferencují i buňky neuroendokrinní. (17)
Podle exprese různých neuronálních transkripčních faktorů se v současné době rozlišuje několik subtypů SCLC. Jednotlivé níže popisované neuronální transkripční faktory současně představují odlišné kroky v tumorigenezi SCLC. Členění malobuněčných plicních karcinomů na jednotlivé podtypy dle výše popsaných transkripčních faktorů není jen teoretickou zajímavostí, ale vzhledem k odlišným genetickým i epigenetickým změnám (18) v jednotlivých skupinách SCLC nabízejí i náhled na možnou odlišnou léčbu jednotlivých podtypů malobuněčného plicního karcinomu.
Přibližně 75 % nádorů exprimuje transkripční faktor ASCL1 (acheate-scute homologue 1) (Obr. 6). Tyto nádory jsou popisované jako “klasické” podtypy SCLC (SCLC-A) (19). ASCL1 indukuje neuronální a neuroendokrinní diferenciaci, ASCL1 pozitivní tumory vykazují pozitivitu neuroendokrinních markerů. Exprese ASCL1 je asociovaná s expresí DLL3 (delta-like ligand 3), který kóduje inhibitor Notch signalizační kaskády. Notch signální dráha působí ve skupině malobuněčných plicních karcinomů jako tumor supresor tlumící neuroendokrinní diferenciaci. V nádorech vyznačujících se neuroendokrinní diferenciací, tedy v nádorech ASCL1 pozitivních, je Notch signální dráha velmi často potlačena, ať už mutací v této signální dráze, nebo výše zmíněným působením jejích inhibitorů, jako je DLL3 (12). DLL3, exprimovaný na povrchu nádorových buněk, je jedním z prvních kandidátů prediktivního testování malobuněčných plicních karcinomů s možností cílené léčby využitím vazby léčiva na buňky s aberantní DLL3 expresí (Obr. 7). (20).
Obr. 6. Malobuněčný karcinom pozitivní v imunohistochemickém průkazu ASCL1. 100x. 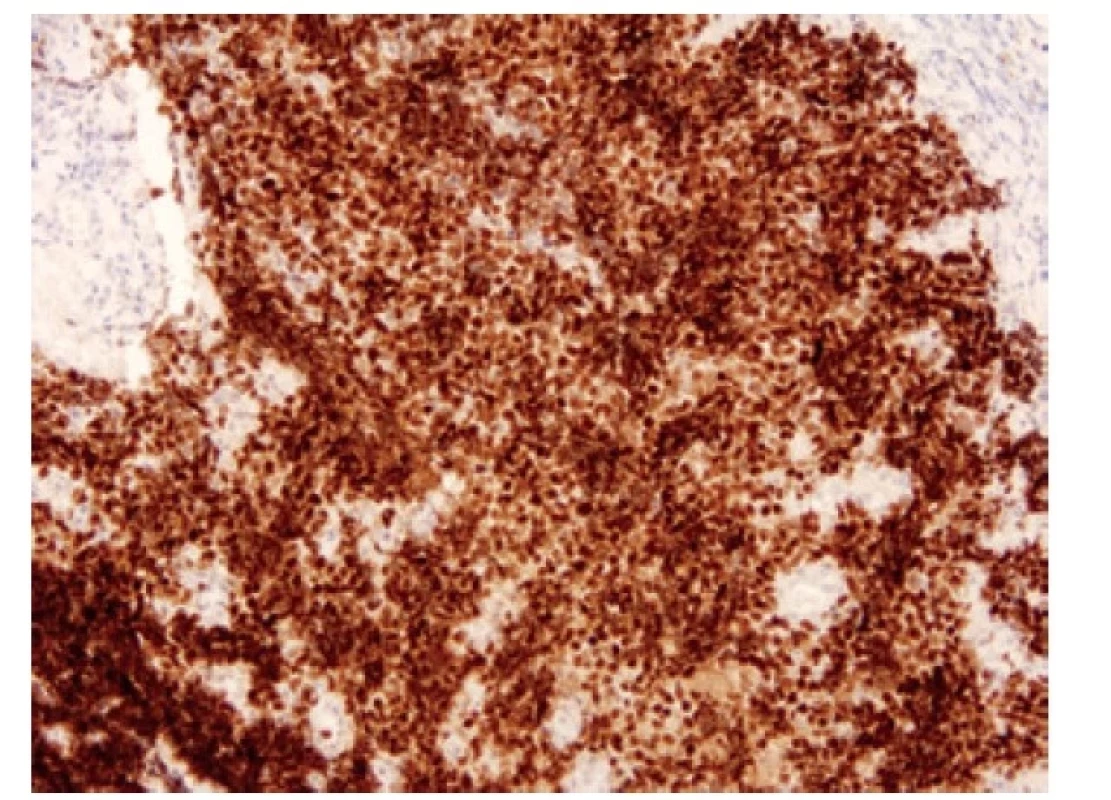
Obr. 7. Malobuněčný karcinom pozitivní v imunohistochemickém průkazu DLL3. 100x. 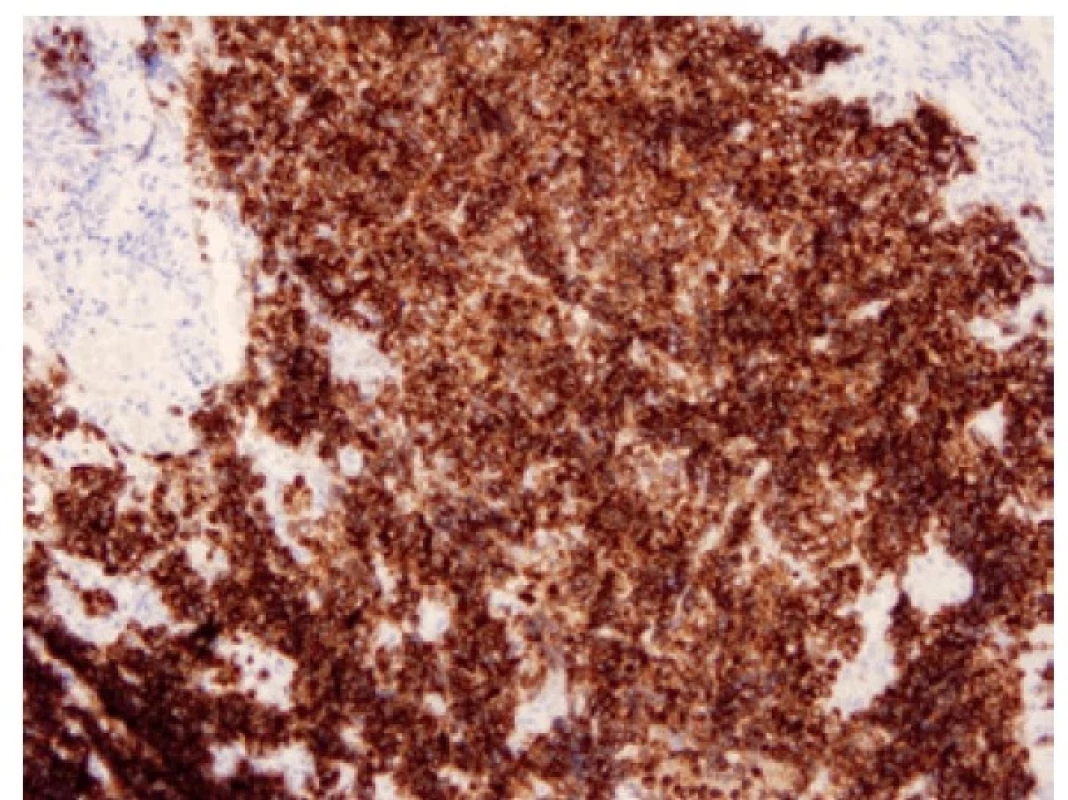
Přibližně 15 % malobuněčných plicních karcinomů exprimuje NEUROD1 (neurogenic differentiation factor 1) (Obr. 8), obvykle současně s expresí s ASCL1 (21). Tyto nádory jsou popisované jako “variantní” podtypy SCLC (SCLC-N). NEUROD1 pozitivní tumory mají často nadměrnou expresi MYC, a to MYC, MYCL i MYCN (12). Exprese neuroendokrinních markerů je u těchto nádorů slabší než u SCLC-A. (21) Ve skupině NEUROD1 pozitivních malobuněčných plicních karcinomů s overexpresí MYC je možnou cestou terapie inhibice Aurora kinázy. Ta je za normálních okolností nezbytná pro začátek mitózy. Selektivní inhibitor Aurora kinázy A je v současné době testované léčivo, vedoucí k zástavě buněčného cyklu ve fázi G2/M.
Obr. 8. Malobuněčný karcinom pozitivní v imunohistochemickém průkazu NEUROD1. 100x 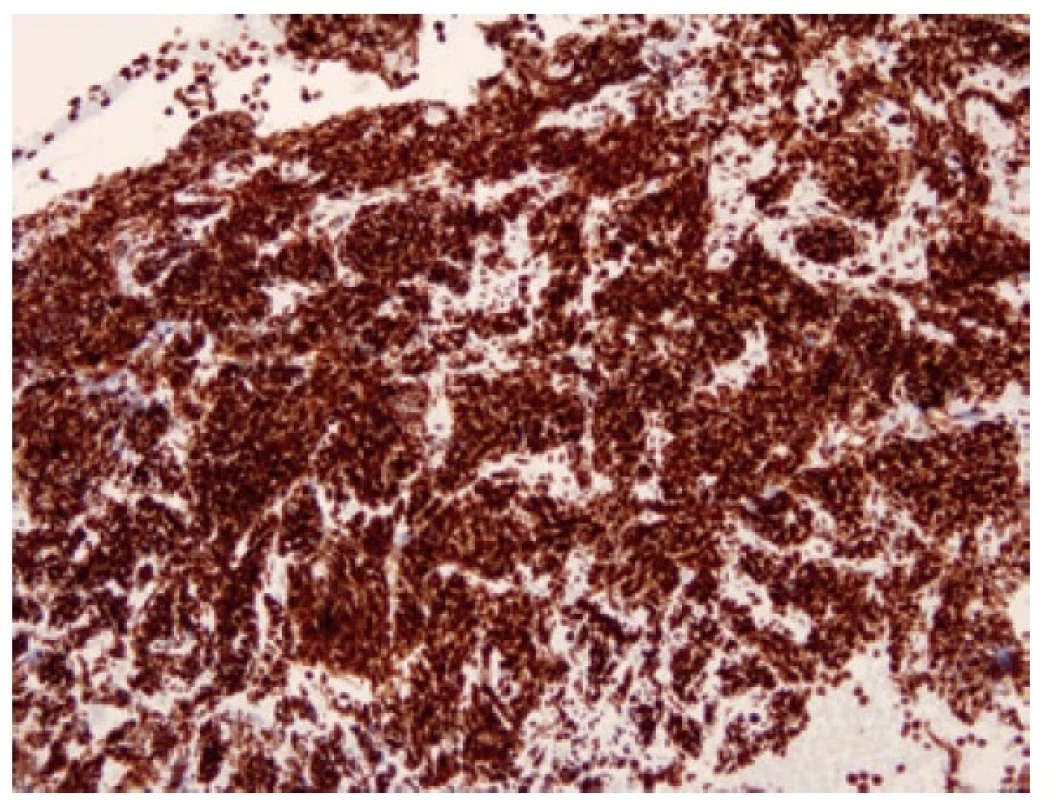
Okolo 15 % SCLC není spojeno s transkripčními faktory ASCL1 a NEUROD1 a zároveň nevykazuje pozitivitu neuroendokrinních markerů. Některé z nich exprimují POU2F3, marker chemosenzorických “tuft” buněk (buněk kartáčových) (22). Tyto nádory jsou označované jako SCLC-P. Pro tyto nádory jsou typické inaktivace PTEN, amplifikace MYC a 20q13. (1) Exprese POU2F3 byla opakovaně popisovaná u kombinovaných malobuněčných karcinomů.
Některé z malobuněčných karcinomů plic bez exprese neuroendokrinních markerů vykazují pozitivitu YAP1, označované jsou jako SCLC-Y. Pozitivita YAP1 je popisovaná u kombinovaných malobuněčných karcinomů, kde je YAP1 exprimovaný často v malobuněčné i nemalobuněčné komponentě. Zajímavým poznatkem je, že YAP1 pozitivní nádory jsou častěji nádory limitovaného stádia (23).
Novým možným podtypem SCLC jsou tzv. NAPY - nádory (24). Transkripčním faktorem těchto nádorů je pravděpodobně ATOH1. Tyto vzácné nádory overexprimují MYC a ztrácejí SLNF11 (24).
Schlafen family member 11 (SLFN11) je enzym inhibující homologní rekombinaci v místě poškozené DNA. PARP (poly ADP-ribose polymerase) proteiny detekují a označují zlomy na jednovláknové DNA a podílejí se na její opravě. Jejich množství je v malobuněčných karcinomech zvýšené. PARP inhibitory by tak mohly díky omezení DNA reparace potencovat účinky cytotoxické chemoterapie. Vysoká exprese SLNF11 s citlivostí malobuněčného plicního karcinomu na PARP inhibitory koreluje (25). Se SLNF11 souvisí i enzym EZH2 (enhancer of zeste homolog 2), který metylací histonů ovlivňuje expresi genů. EZH2 expresi SLFN11 v malobuněčných plicních karcinomech potlačuje. Následkem je rezistence SCLC k chemoterapii. V současné době se testují EZH2 inhibitory jako možná součást léčby SCLC (26).
Kombinovaná ztráta RB1 a TP53, která je u malobuněčných karcinomů pravidlem, vede k poruše funkce kontrolního bodu v G1/S fázi buněčného cyklu, nádorové buňce je tak umožněna oprava poškozené DNA v dalších fázích buněčného cyklu a tím i její přežití. Tyrozin kináza WEE1 způsobuje ve fázi G2/M zastavení buněčného cyklu. V terapii nádorů s defektní funkcí TP53 jsou tak nyní zkoušené inhibitory WEE1.
Moderní trendy terapie SCLC
Samostatnou kapitolou v protinádorové léčbě je imunoterapie, v současné době široce užívaná v terapii různých typů zhoubných nádorů. Jedná se o inhibitory kontrolních bodů (immune checkpoints inhibitors) - PD-1, PD-L1 a CTLA-4 (cytotoxic T-lymphocyte-associated protein 4). CTLA-4 je receptor exprimovaný na CD4 a CD8 lymfocytech, který se váže na CD80 a CD86 na antigen prezentujících buňkách. Po této vazbě dochází k inhibici T buněčné imunitní odpovědi. Anti-CTLA-4 protilátka posiluje protinádorovou aktivitu T lymfocytů. PD-1 je exprimovaný mimo jiné na T-lymfocytech, jeho navázání na PD-L1 na povrchu nádorových buněk vede k potlačení funkce T lymfocytů. Anti-PD-1 protilátka reaktivuje cytotoxické schopnosti T lymfocytů. CD47 je protein velmi často vysoce upregulovaný na povrchu buněk SCLC. Jeho úlohou je omezení funkce makrofágů, anti-CD47 léčivo je tedy další z možných cest protinádorové terapie. Přestože v několika studiích zabývajících se zařazením imunoterapie do léčby SCLC došlo k prodloužení celkového přežití pacientů, výsledky nedosahovaly statistické významnosti jako při užití imunoterapie u jiných typů nádorů (27). Menší efekt imunoterapie u SCLC je zdůvodňovaný nízkou expresí PD-L1, downregulací hlavního histokompatibilního komplexu a imunosupresí regulačních chemokinů v malobuněčném karcinomu. Řada pacientů s malobuněčným karcinomem potřebuje terapii kortikosteroidy (například pro syndrom horní duté žíly či mozkové metastázy), terapie steroidy ale účinky imunoterapie snižuje (28). Recentní studie naznačují, že pravidla užití prediktivních markerů pro imunoterapii nemalobuněčných plicních karcinomů nebudou přenositelná pro kategorii malobuněčného plicního karcinomu (29). V některých studiích se ukazuje, že SCLC-P a SCLC-Y mají větší počet tumor infiltrujících lymfoctů (24), což by právě z těchto skupin dělalo potenciální kandidáty imunoterapie.
ZÁVĚR
V současné době se úroveň poznání biologie malobuněčného karcinomu plic rychle zvyšuje. Pro implementaci nově získaných poznatků do klinické praxe budou jistě nezbytné rozsáhlé studie. Již nyní je ale zřejmé, že opakované vyšetření nádoru během léčby bude nezbytné, s možným využitím vyšetření cirkulujících nádorových buněk, resp. nádorové DNA (30). Terapií dle nově studovaných prognostických a prediktivních faktorů by mohl malobuněčný plicní karcinom opustit kategorii „recalcitrant cancer“, tedy nádoru vzdorujícího terapii.
PODĚKOVÁNÍ
Práce podpořena částečně MZČR (projekty RVO-VFN 64165 a RVO-FTN 64190) a její grantovou agenturou AZV (projekt NU22-03-00130), Univerzitou Karlovou (projekt Cooperatio – Laboratorní medicína) a projektem OPPK (Výzkumné laboratoře nádorových onemocnění, CZ.2.16/3.1.00/24509).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Klára Pavlíčková
Ústav patologie a molekulární medicíny 3. LF UK a FTN
Vídeňská 800, Praha 4, 140 00
tel.: 00420261083742
Zdroje
1. Baine MK, Febres-Aldana CA, Chang JC, Jungbluth AA, Sethi S, Antonescu CR, et al. POU2F3 in SCLC: Clinicopathologic and Genomic Analysis With a Focus on Its Diagnostic Utility in Neuroendocrine-Low SCLC. J Thorac Oncol 2022; 17(9): 1109-21.
2. WHO Classification of Tumours Editorial Board Thoracic Tumours. WHO Classification of Tumours, 5th Edition, Volume 5, 2021
3. Pesch B, Kendzia B, Gustavsson P, Jockel KH, Johnen G, Pohlabeln H, et al. Cigarette smoking and lung cancer--relative risk estimates for the major histological types from a pooled analysis of case-control studies. Int J Cancer 2012; 131(5): 1210-1219.
4. Pešek M. Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba. Vnitř Lék 2017.
5. Ganti AKP, Loo BW, Bassetti M, Blakely C, Chiang A, D’Amico TA, et al. Small Cell Lung Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2021; 19(12): 1441-1464.
6. Galanis E, Frytak S, Lloyd RV. Extrapulmonary small cell carcinoma. Cancer 1997;c 79(9): 1729-1736.
7. Svajdler M, Mezencev R, Saskova B, Ondic O, Mukensnabl P, Michal M. Triple marker composed of p16, CD56, and TTF1 shows higher sensitivity than INSM1 for diagnosis of pulmonary small cell carcinoma: proposal for a rational immunohistochemical algorithm for diagnosis of small cell carcinoma in small biopsy and cytology specimens. Hum Pathol 2019; 85 : 58-64.
8. Khalbuss WE, Yang H, Lian Q, Elhosseiny A, Pantanowitz L, Monaco SE. The cytomorphologic spectrum of small-cell carcinoma and large-cell neuroendocrine carcinoma in body cavity effusions: A study of 68 cases. Cytojournal 2011; 8 : 18.
9. Van Lommel A. Pulmonary neuroendocrine cells (PNEC) and neuroepithelial bodies (NEB): chemoreceptors and regulators of lung development. Paediatr Respir Rev 2001; 2(2): 171-6.
10. Nagy-Mignotte H, Shestaeva O, Vignoud L, Guillem P, Ruckly S, Chabre O, et al. Prognostic impact of paraneoplastic cushing’s syndrome in small-cell lung cancer. J Thorac Oncol 2014; 9(4): 497-505.
11. Maddison P, Gozzard P, Grainge MJ, Lang B. Long-term survival in paraneoplastic Lambert - Eaton myasthenic syndrome. Neurology 2017; 88(14): 1334-9.
12. George J, Lim JS, Jang SJ, Cun Y, Ozretic L, Kong G, et al. Comprehensive genomic profiles of small cell lung cancer. Nature 2015; 524(7563): 47-53.
13. Jones PA, Issa JP, Baylin S. Targeting the cancer epigenome for therapy. Nat Rev Genet 2016; 17(10): 630-41.
14. Pleasance ED, Stephens PJ, O’Meara S, Mc - Bride DJ, Meynert A, Jones D, et al. A smallcell lung cancer genome with complex signatures of tobacco exposure. Nature 2010; 463(7278): 184-190.
15. Roberts SA, Lawrence MS, Klimczak LJ, Grimm SA, Fargo D, Stojanov P, et al. An APOBEC cytidine deaminase mutagenesis pattern is widespread in human cancers. Nat Genet 2013; 45(9): 970-976.
16. Whang-Peng J, Kao-Shan CS, Lee EC, Bunn PA, Carney DN, Gazdar AF, et al. Specific chromosome defect associated with human small-cell lung cancer; deletion 3p(14-23). Science 1982; 215(4529): 181-182.
17. Nicholson SA, Beasley MB, Brambilla E, Hasleton PS, Colby TV, Sheppard MN, et al. Small cell lung carcinoma (SCLC): a clinicopathologic study of 100 cases with surgical specimens. Am J Surg Pathol 2002; 26(9): 1184-1197.
18. Poirier JT, Gardner EE, Connis N, Moreira AL, de Stanchina E, Hann CL, et al. DNA methylation in small cell lung cancer defines distinct disease subtypes and correlates with high expression of EZH2. Oncogene 2015; 34(48): 5869-5878.
19. Borges M, Linnoila RI, van de Velde HJ, Chen H, Nelkin BD, Mabry M, et al. An achaete-scute homologue essential for neuroendocrine differentiation in the lung. Nature 1997; 386(6627): 852-855.
20. Rudin CM, Pietanza MC, Bauer TM, Ready N, Morgensztern D, Glisson BS, et al. Rovalpituzumab tesirine, a DLL3-targeted antibody - drug conjugate, in recurrent small-cell lung cancer: a first-in-human, first-in-class, open-label, phase 1 study. Lancet Oncol 2017; 18(1): 42-51.
21. Borromeo MD, Savage TK, Kollipara RK, He M, Augustyn A, Osborne JK, et al. ASCL1 and NEUROD1 Reveal Heterogeneity in Pulmonary Neuroendocrine Tumors and Regulate Distinct Genetic Programs. Cell Rep 2016; 16(5): 1259-1272.
22. Huang YH, Klingbeil O, He XY, Wu XS, Arun G, Lu B, et al. POU2F3 is a master regulator of a tuft cell-like variant of small cell lung cancer. Genes Dev 2018; 32(13-14): 915-928.
23. Owonikoko TK, Dwivedi B, Chen Z, Zhang C, Barwick B, Ernani V, et al. YAP1 Expression in SCLC Defines a Distinct Subtype With T-cell-Inflamed Phenotype. J Thorac Oncol 2021; 16(3): 464-476.
24. Qu S, Fetsch P, Thomas A, Pommier Y, Schrump DS, Miettinen MM, et al. Molecular Subtypes of Primary SCLC Tumors and Their Associations With Neuroendocrine and Therapeutic Markers. J Thorac Oncol 2022; 17(1): 141-153.
25. Byers LA, Bentsion D, Gans S, Penkov K, Son C, Sibille A, et al. Veliparib in Combination with Carboplatin and Etoposide in Patients with Treatment-Naive Extensive-Stage Small Cell Lung Cancer: A Phase 2 Randomized Study. Clin Cancer Res 2021; 27(14): 3884 - 3895.
26. Gardner EE, Lok BH, Schneeberger VE, Desmeules P, Miles LA, Arnold PK, et al. Chemosensitive Relapse in Small Cell Lung Cancer Proceeds through an EZH2-SLFN11 Axis. Cancer Cell 2017; 31(2): 286-299.
27. Sabari JK, Lok BH, Laird JH, Poirier JT, Rudin CM. Unravelling the biology of SCLC: implications for therapy. Nat Rev Clin Oncol 2017; 14(9): 549-561.
28. Arbour KC, Mezquita L, Long N, Rizvi H, Auclin E, Ni A, et al. Impact of Baseline Steroids on Efficacy of Programmed Cell Death-1 and Programmed Death-Ligand 1 Blockade in Patients With Non-Small-Cell Lung Cancer. J Clin Oncol 2018; 36(28): 2872-2878.
29. Pavan A, Attili I, Pasello G, Guarneri V, Conte PF, Bonanno L. Immunotherapy in smallcell lung cancer: from molecular promises to clinical challenges. J Immunother Cancer 2019; 7(1): 205.
30. Mohan S, Foy V, Ayub M, Leong HS, Schofield P, Sahoo S, et al. Profiling of Circulating Free DNA Using Targeted and Genome-wide Sequencing in Patients with SCLC. J Thorac Oncol 2020; 15(2): 216-230.
Štítky
Patologie Soudní lékařství Toxikologie Pneumologie a ftizeologie
Článek Novinky v pulmopatologiiČlánek 'NEUROPATOLOGIEČlánek 'NEFROPATOLOGIEČlánek 'GYNEKOPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'PATOLOGIE GITČlánek 'CYTODIAGNOSTIKAČlánek 'PATOLOGIE ORL OBLASTIČlánek 'KARDIOPATOLOGIEČlánek 'PULMOPATOLOGIEČlánek 'UROPATOLOGIE
Článek vyšel v časopiseČesko-slovenská patologie
Nejčtenější tento týden
2023 Číslo 1- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
- Nejasný stín na plicích – kazuistika
- Současné poznatky k deficitu alfa-1-antitrypsinu a možnosti jeho léčby
- Aktuální doporučení pro diagnostiku a klasifikaci CHOPN
- Přehled bronchodilatační léčby chronické obstrukční plicní nemoci
-
Všechny články tohoto čísla
- Současné možnosti odlišení histopatologického obrazu idiopatické plicní fibrózy od fibrotické hypersenzitivní pneumonie: Jak na to?
- Malobuněčný karcinom plic – nové poznatky o biologii nádoru
- Kazuistika – Warthin-like papilokarcinom štítné žlázy
- Metylační analýza jako pomocný nástroj v cytologické diagnostice vzácnějších anogenitálních lézí – pilotní studie
- Novinky v pulmopatologii
- Tumor endolymfatického vaku – vzácná komplikace syndromu von Hippel-Lindau
- Karel Rokitanský (1804 - 1878)
- Patolog vychovává svého klinika a klinik patologa
- 'NEUROPATOLOGIE
- 'NEFROPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PATOLOGIE GIT
- 'CYTODIAGNOSTIKA
- 'PATOLOGIE ORL OBLASTI
- 'KARDIOPATOLOGIE
- 'PULMOPATOLOGIE
- 'UROPATOLOGIE
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metylační analýza jako pomocný nástroj v cytologické diagnostice vzácnějších anogenitálních lézí – pilotní studie
- Malobuněčný karcinom plic – nové poznatky o biologii nádoru
- Kazuistika – Warthin-like papilokarcinom štítné žlázy
- Tumor endolymfatického vaku – vzácná komplikace syndromu von Hippel-Lindau
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



