-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
Tumefactive Variant of Multiple Sclerosis – Two Case Reports
Diagnosis of multiple sclerosis (MS) according to the revised diagnostic criteria is based on clinical symptoms and magnetic resonance imaging (MRI). Diagnosis of MS requires elimination of more likely diagnoses. Multiple sclerosis lesions are visible on MRI as T2 hypersignal lesions typically in at least two of the four CNS areas: periventricular, juxtacortical, infratentorial and spinal cord. Tumefactive MS (TMS) is a rare variant of this disease with the estimated prevalence of about 3 cases per million people. Its radiological and clinical symptoms are different from common MS variants and could mimic other diseases, such as brain tumours and inflammatory diseases. Typical radiographic feature of TMS is defined as a solitary large lesion sized >2 cm, associated with perilesional oedema and/or the presence of ring enhancement on MR. Clinical signs and symptoms depend on lesion location and size and include headache, cognitive abnormalities, mental confusion, aphasia, apraxia and/or seizures. Since differential diagnosis of such clinical presentation and MRI is difficult, brain biopsy is often required. Diagnosis could be supported by positron emission tomography, cerebrospinal fluid examination and evoked potentials. In this report, we present two patients with tumefactive MS. The purpose of the report is to emphasize clinical and radiological features of this rare disease and to pinpoint examination procedures that could be used in differential diagnosis.
Key words:
tumefactive multiple sclerosis – magnetic resonance imaging – positron emission tomography – stereotactic brain biopsy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: I. Okáčová 1,2; Y. Benešová 1; E. Vlčková 1,2; M. Keřkovský 2,3; P. Praksová 1,2; M. Hladíková 1,2; J. Kosík 4; D. Uldrijanová 1; P. Štourač 1,2; J. Bednařík 1,2
Působiště autorů: Neurologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut, MU, Brno 2; Radiologická klinika LF MU a FN Brno 3; Neurochirurgické oddělení, Nemocnice Na Homolce, Praha 4
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(5): 641-647
Kategorie: Kazuistika
Souhrn
Diagnostika roztroušené sklerózy mozkomíšní (RS) se podle aktuálních kritérií opírá vedle klinického obrazu zejména o nálezy zobrazovacích metod, především pak magnetické rezonance (MR), kde je charakteristickým obrazem záchyt T2 hypersignálních lézí alespoň ve dvou ze čtyř typických oblastí CNS (periventrikulární, juxtakortikální, infratentoriální a/ nebo míšní), a která je také základem pro diferenciální diagnózu tohoto onemocnění vůči jiným klinicky relevantním jednotkám. Tumoriformní varianta RS je velmi vzácná forma onemocnění s prevalencí 3 : 1 milion obyvatel. Její radiologické nálezy i klinický obraz jsou do značné míry odlišné a pro RS často netypické a mohou napodobovat nádorové onemocnění nebo některé formy postižení infekčních či obecně zánětlivých. Typickým MR nálezem u tumoriformní varianty RS je přítomnost solitárních ložisek větších než 2 cm spojených s kolaterálním edémem a/ nebo přítomností prstenčitého vychytávání kontrastní látky. Klinické projevy pak souvisí s lokalizací léze a její velikostí: nejčastěji se jedná o bolesti hlavy, kognitivní změny, afázii, apraxii a/ nebo epileptické záchvaty. Vzhledem k diferenciálně-diagnostickým obtížím, které takový klinický a MR obraz představuje, je pro stanovení správné diagnózy mnohdy nezbytná stereotaktická biopsie ložiska. Přínosná může být také pozitronová emisní tomografie mozku s využitím fluorodeoxyglukózy, stejně jako zohlednění nálezů vyšetření mozkomíšního moku a evokovaných potenciálů. V prezentované práci uvádíme dvě kazuistiky pacientů s tumoriformní variantou RS. Cílem je upozornit na klinické projevy a radiologické nálezy této vzácné formy demyelinizačního onemocnění a poskytnout přehled metod využitelných v diferenciální diagnostice.
Klíčová slova:
tumoriformní varianta roztroušené sklerózy – magnetická rezonance – pozitronová emisní tomografie – stereotaktická biopsiePoužité zkratky
CNS centrální nervový systém
EDSS Expanded Disability Status Scale
MEP motorické evokované potenciály
MR magnetická rezonance
OP oligoklonální pásy
PET pozitronová emisní tomografie
PRRS primárně progresivní roztroušená skleróza
RRRS relaps-remitentní roztroušená skleróza
RS roztroušená skleróza
VEP zrakové evokované potenciály
Úvod
Současná diagnostická kritéria roztroušené sklerózy (RS) se vedle klinického obrazu opírají zejména o nálezy zobrazovacích metod, především pak magnetické rezonance (MR). Charakteristickým obrazem je přítomnost hyperintenzních lézí v T2 vážených obrazech (T2W) a v modu FLAIR (FLuid Attenuated Inversion Recovery). Tato ložiska jsou nejčastěji orientována kolmo na osu postranních komor, bývají ostře ohraničená, homogenní, mají ovoidní tvar a většinou nejsou doprovázena masivním kolaterálním edémem [1,2]. Léze jsou typicky mnohočetné a vyskytují se alespoň ve dvou ze čtyř typických oblastí centrálního nervového systému (tj. v oblasti periventrikulární, juxtakortikální, infratentoriální a/ nebo míšní).
Tumoriformní varianta RS je velmi vzácná forma onemocnění, jejíž prevalence činí 3/ 1 milion obyvatel nebo zhruba 1 – 2/ 1 000 pacientů s RS. Stejně jako RS obecně se i tato forma vyskytuje častěji u žen, onemocnění začíná přibližně ve 37 letech věku [3]. Typickým nálezem na MR je u tumoriformní varianty RS nález jednoho či více solitárních ložisek větších než 2 cm spojených s rozsáhlým kolaterálním edémem a/ nebo přítomností prstenčitého vychytávání kontrastní látky [4 – 7]. Klinický obraz tumoriformní varianty RS souvisí s lokalizací léze a její velikostí a rozsahem kolaterálního edému, resp. se související elevací intrakraniálního tlaku. Mezi nejčastější projevy patří bolesti hlavy, kognitivní změny, afázie, apraxie a/ nebo epileptické záchvaty. Tyto klinické projevy nejsou typické pro demyelinizační onemocnění a spolu s výše popsaným nálezem na MR vyšetření imponují spíše jako mozkový nádor či ložiskové zánětlivé onemocnění, např. mozkový absces, granulomatózní zánět nebo vaskulitida, čímž diagnostický proces znesnadňují. Pro stanovení správné diagnózy je v některých případech indikována stereotaktická biopsie ložiska a histologické vyšetření odebraného tkáňového vzorku [4 – 7]. V naší práci uvádíme dvě kazuistiky pacientů s tumoriformní variantou RS. Cílem je popsat klinické a radiologické nálezy tohoto vzácného onemocnění a poskytnout přehled paraklinických metod využitelných v diferenciální diagnostice.
Kazuistika 1
U 30letého muže se od 29 let rozvíjelo oslabení levostranných končetin, současně si stěžoval na difuzní bolesti hlavy s frontálním maximem. Při klinickém vyšetření byla zjištěna lehká centrální levostranná hemiparéza. MR vyšetření mozku prokázalo dvě patologická ložiska vpravo periventrikulárně a nepravidelné infiltrace při okcipitálním rohu levé postranní komory se zasahováním do kalózního tělesa, postkontrastně bylo zřetelné prstenčité sycení v části periferie ložiska (obr. 1).
Obr. 1. Kazuistika 1: vstupní MR vyšetření u pacienta s ložiskovým postižením supratentoriálně. (a) T2 vážený obraz v axiální rovině se zachycením dvou objemných hyperintenzních lézí v bílé hmotě centrum semiovale vpravo. (b) FLAIR zobrazení v axiální rovině s patol. zvýšeným signálem podél okcipitálního rohu levé postranní komory. (c, d) postkontrastní zobrazení v transverzální a sagitální rovině s obrazem prstenčitého sycení ložisek. Radiologická dokumentace ke vstupnímu vyšetření pacienta byla zapůjčena oddělením zobrazovacích metod Oblastní nemocnice Příbram (prim. MUDr. Petr Bleha), za její poskytnutí autoři děkují. 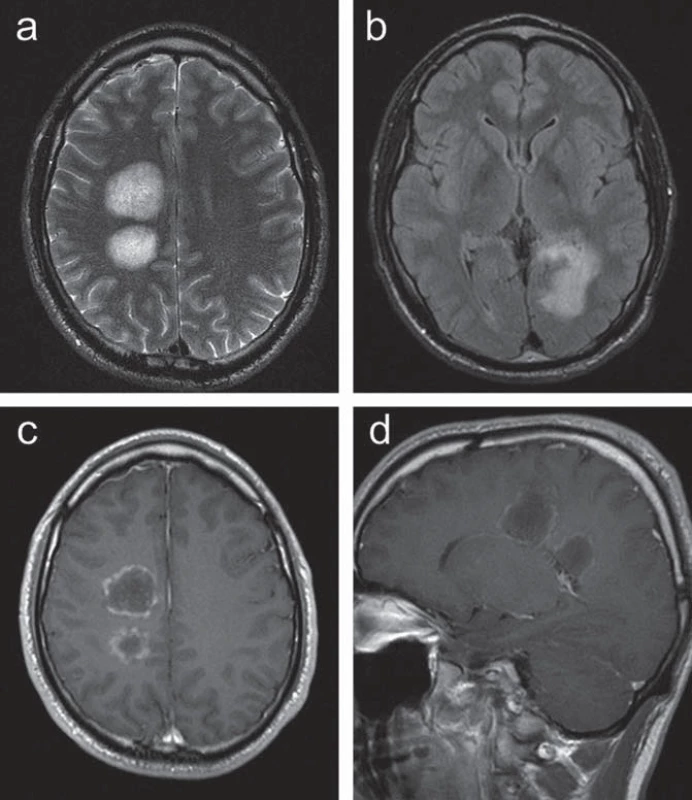
Vyšetření difuzně vážených zobrazení (Diffusion ‑ Weighted Imaging, DWI) nebylo provedeno.
V rámci diferenciální diagnostiky bylo vedle pseudotumoru demyelinizačního typu RS/ ADEM nejasné primární příčiny vysloveno podezření na možnost gliomu vyššího stupně malignity, která byla ošetřujícím lékařem vyhodnocena jako závažnější, a tedy indikovaná k prioritnímu vyloučení. Proto byla provedena stereotaktická biopsie jednoho z ložisek. Výsledek histologického vyšetření však nebyl jednoznačný, svědčil pro gliom s nízkým stupněm malignity či reaktivní nenádorovou gliózu v sousedství jiného patologického ložiska. Vzhledem k nutnosti bližší specifikace charakteru ložisek bylo provedeno vyšetření mozku pozitronovou emisní tomografií (PET) s využitím fluorodeoxyglukózy (FDG). Podezření na vysoce maligní gliom nebylo potvrzeno, protože oblasti vykazující zvýšený metabolizmus glukózy, jejichž záchyt by podporoval podezření na tento typ nádoru, nebyly nalezeny. Odlišení gliomu s nízkým stupněm malignity, reaktivní gliózy či jiného typu ložiska s nízkou metabolickou aktivitou od okolní mozkové tkáně není touto metodou možné.
Kontrolní MR vyšetření mozku s půlročním odstupem prokázalo stacionární nález. S odstupem jednoho roku od počátku onemocnění došlo k vývoji klinického stavu: vedle stacionární lehké levostranné hemiparézy se u pacienta nově objevila levostranná hemihypestezie a lehká paleocerebelární a pravostranná neocerebelární symptomatika. Také nález na kontrolním MR mozku v tomto období podstatně změnil svůj charakter (obr. 2). Vpravo došlo k výraznému zmenšení původně zachycených periventrikulárně uložených ložisek, vymizelo též jejich postkontrastní sycení. Současně se objevila řada dalších drobnějších ložisek zvýšené intenzity v T2W obrazech, a to oboustranně periventrikulárně, frontálně vlevo a temporálně vpravo. Po aplikaci kontrastní látky došlo u některých ložisek k sycení charakteru neúplného prstence. V oblasti krční míchy nebyly zachyceny změny intenzity signálu.
Obr. 2. Kazuistika 1: kontrolní MR vyšetření s odstupem jednoho roku demonstruje regresi největších ložisek vpravo periventrikulárně s částečným poklesem signálu v T2 obraze (a) a s vymizením postkontrastního sycení (c). Nově zachyceno drobné ložisko vlevo frontálně ve FLAIR obraze v axiální rovině (b), které se postkontrastně prstenčitě sytí (d). 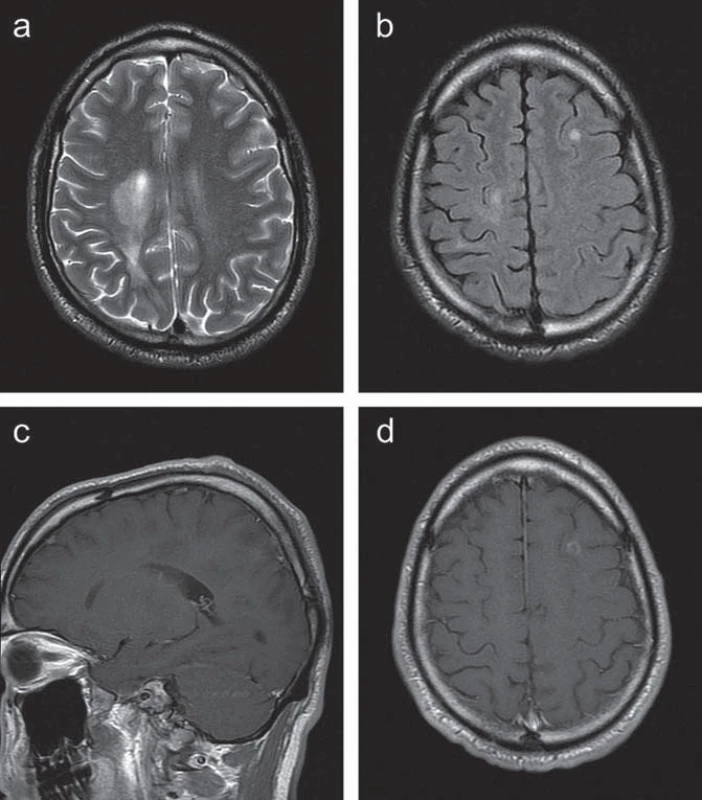
Vzhledem k vývoji nálezu na MR a změně jeho charakteru bylo vysloveno podezření na demyelinizační onemocnění CNS. V rámci došetření byla provedena lumbální punkce a elektrofyziologické vyšetření. Mozkomíšní mok nevykazoval cytologické změny ve smyslu zánětlivého postižení, zachyceny nebyly ani případné buněčné atypie korelující s eventuálním nádorovým onemocněním. Bylo zde však prokázáno 15 oligoklonálních pásů (OP), které nebyly přítomny v séru, a zvýšená intratékální syntéza imunoglobulinů třídy IgG a IgA.
Vyšetření zrakovými evokovanými potenciály (VEP) prokázalo signifikantní stranově asymetrické prodloužení latence vlny P100 vlevo korelující s demyelinizační lézí prechiazmatického úseku zrakové dráhy zleva. Vyšetření motorických evokovaných potenciálů (MEP) k dolním končetinám prokázalo horší výbavnost kortikálních odpovědí a prolongaci centrálního motorického kondukčního času vlevo svědčící pro možnost léze centrálního úseku motorické dráhy k levé dolní končetině.
U pacienta byla na základě McDonaldových kritérií diagnostikována RS [8]. Nemocnému bylo podáno 5 g metylprednizolonu intravenózně, po léčbě však nedošlo k výraznějšímu zlepšení klinického stavu. Ten je v současnosti, tj. tři měsíce od popsaného kontrolního MR, beze změn oproti výše popsanému nálezu. Terapeuticky připadala v úvahu i plazmaferéza, kterou však pacient odmítl.
Kazuistika 2
U 39leté ženy se od 27 let věku, v rozmezí tří let, manifestovaly tři epizody brnění levostranných končetin trvající vždy asi jeden týden. Pro tyto potíže nebyla nikde vyšetřena.
Ve 30 letech se levostranné parestezie opakovaly a byly provázeny trvalými pravostrannými hemikraniemi. Klinické neurologické vyšetření prokázalo frustní levostrannou hemiparézu. CT mozku prokázalo nález hypodenzní, po aplikaci kontrastní látky se nesytící expanze v hloubi pravé hemisféry. Na MR vyšetření mozku bylo potvrzeno patologické ložisko při těle pravé postranní komory tumoriformního vzhledu s menší zónou edému v okolí, což vedlo k podezření na astrocytom. Další drobnější ložisko bylo patrné v oblasti levého mozečkového pedunklu. V rámci diferenciální diagnostiky se uvažovalo o etiologii zánětlivé či demyelinizační (obr. 3). Vzhledem k podezření na tumor v případě většího ložiska supratentoriálně nicméně byla indikována a provedena stereotaktická biopsie. Histologický nález odpovídal demyelinizaci. K došetření demyelinizačního onemocnění byla proto indikována lumbální punkce. Základní cytologický a biochemický nález v mozkomíšním moku byl v normě, nebyla prokázána ani přítomnost OP pásů v séru ani v likvoru. Jedinou prokázanou abnormitou byl záchyt pozitivní MRZ reakce v mozkomíšním moku. Somatosenzitivní evokované potenciály (SEP) nervus medianus i nervus tibialis, VEP a sluchové evokované potenciály byly oboustranně zcela v normě. Vyšetření MEP prokázalo prolongaci centrálního motorického kondukčního času k levé dolní končetině, což koreluje s postižením centrálního úseku motorické dráhy v této distribuci. Pacientce byl podán metylprednizolon v dávce 3 g, následovaný sestupnou dávkou kortikoidů. V klinickém obraze přetrvávala i po přeléčení frustní levostranná hemiparéza, levostranné hemiparestezie odezněly. S odstupem tří měsíců (během nichž nedošlo ke změně klinického stavu pacientky) bylo provedeno kontrolní MR mozku s nálezem nezměněného rozsáhlého ložiska vpravo parietálně, nově se objevila další drobnější T2W hypersignální ložiska v corpus callosum a v pravém temporálním laloku (obr. 4), tedy korelující s multifokálním demyelinizačním postižením v popsané distribuci. MR krční míchy neprokázalo demyelinizační ložiska ani jiný typ abnormity. Bylo provedeno PET vyšetření mozku s nálezem hypometabolizmu FDG v rozsáhlé oblasti parietální kůry vlevo. Nález nesvědčil pro tumor s vyšším stupněm malignity.
Obr. 3. Kazuistika 2: patologické ložisko lokalizované při těle pravé postranní komory nehomogenní intenzity signálu a se zónou edému v okolí zobrazené na axiálních skenech T2 (a) a T1 (b) váženého MR zobrazení, postkontrastně s nemohogenním vysycením v části periferie ložiska při zobrazení v koronární rovině (d). Další drobnější ložisko zvýšeného signálu je patrné v oblasti levého středního pedunklu mozečku (c). 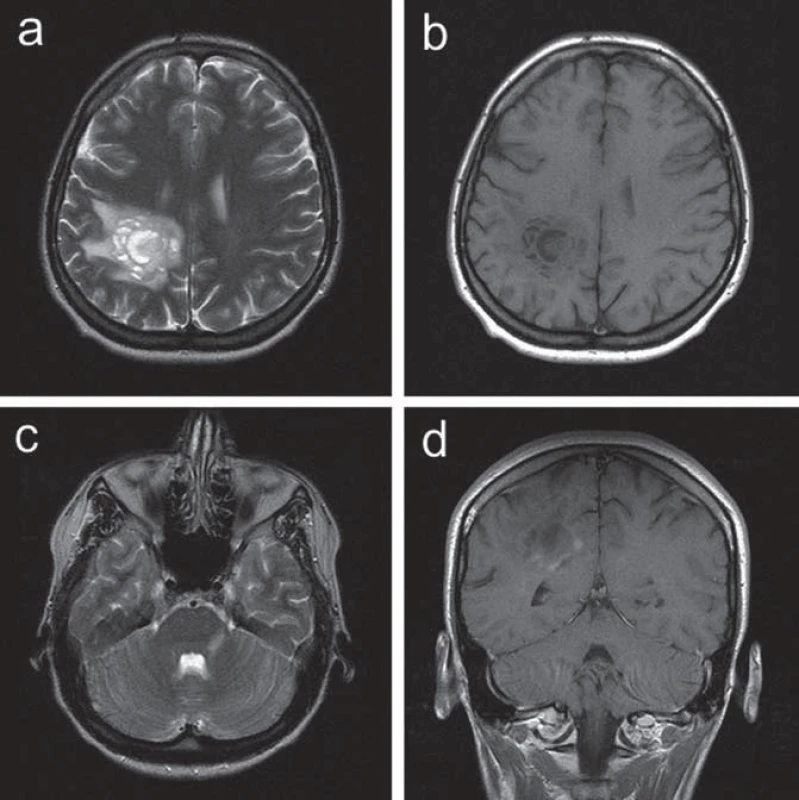
Obr. 4. Kazuistika 2: kontrolní MR vyšetření s odstupem tří měsíců. a) T2 vážený obraz v axiální rovině. Ložisko vpravo parietálně přetrvává, nyní již bez perifokálního edému. b) FLAIR zobrazení v sagitální rovině ukazuje další drobnější ložisko v rostrální části kalózního tělesa. 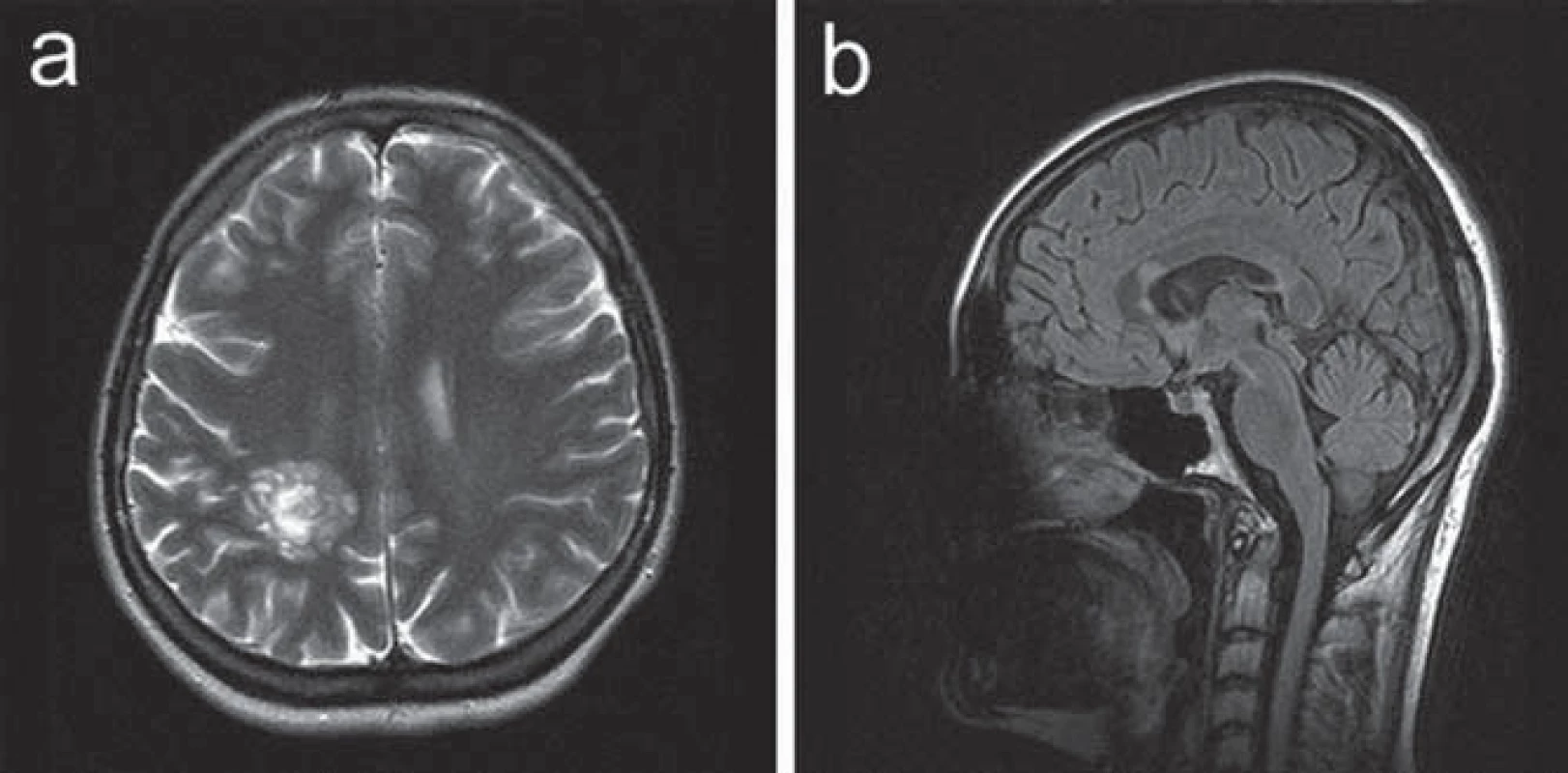
Pacientka splňovala McDonaldova diagnostická kritéria pro relabující ‑ remitentní RS (RRRS) [8], byla splněna kritéria diseminace v čase i v prostoru na MR vyšetření mozku. Po stanovení diagnózy RS byla zahájena terapie interferony. S odstupem tří let od zahájení této léčby se u pacientky objevila další ataka onemocnění, v rámci které došlo k rozvoji lehké paraparézy dolních končetin. Terapeuticky byl opět podán metylprednizolon v dávce 3 g, následovaný sestupnou dávkou kortikoidů. Paraparéza dolních končetin poté odezněla, v neurologickém nálezu přetrvávala pouze reziduální frustní levostranná hemiparéza. Na kontrolním MR mozku došlo k mírné progresi nálezu.
V současné době je pacientka léčena interferony devět let. V mezidobí došlo k mírné progresi klinického stavu, v objektivním nálezu je nyní přítomna lehká levostranná hemiparéza, tíže neurologického postižení hodnocená pomocí Expanded Disability Status Scale (EDSS) činí 3. Na MR vyšetření mozku přetrvává nezměněné ložisko v hloubi pravé hemisféry, mírně četnější jsou T2W hypersignální ložiska v ostatních oblastech mozku.
Diskuze
Prezentované kazuistiky dokumentují diagnostické obtíže obvyklé u pacientů s tumoriformní variantou RS, tedy vzácnou formou demyelinizačního onemocnění CNS s atypickými klinickými obtížemi. Zejména MR nález nekoreluje s aktuálními diagnostickými kritérii demyelinizačního onemocnění charakteru RS. Rozbor anamnestických dat, klinické neurologické vyšetření a MR nález jsou přitom v úvodu diagnostického procesu klíčové metody, z nichž vychází diferenciálně-diagnostická rozvaha i indikace dalších vyšetření vedoucích ke správnému určení charakteru léze.
V klinickém obraze jsou vedle perzistujících či progresivně narůstajících ložiskových neurologických symptomů, jejichž charakter závisí na lokalizaci léze, často udávaným symptomem trvalé (neepizodické) bolesti hlavy různého charakteru, na které si stěžovali i oba pacienti ve výše uvedených kazuistikách. Přestože epizodická bolest hlavy migrenózního i tenzního typu je u pacientů s RS signifikantně častější než v běžné populaci [9], neepizodické bolesti hlavy do obvyklého klinického obrazu RS nepatří. Také perzistence či postupná progrese neurologické symptomatiky, bez remisí klinického nálezu, není typická pro atakovitě‑remitentní RS jako nejčastější formu klinického průběhu tohoto onemocnění (nevylučuje však pochopitelně možnost méně obvyklé primárně, event. sekundárně progresivní formy RS). Charakter klinických obtíží s dominující trvalou cefaleou a postupným rozvojem fokálních neurologických symptomů tak u obou pacientů v našich kazuistikách imponoval spíše dojmem ložiskového procesu mozku nádorového či infekčního, resp. obecně zánětlivého charakteru.
Z anamnestických dat může být pro diferenciální diagnostiku významný zejména údaj o předchozích tranzitorních fokálních neurologických obtížích, imponujících jako možné ataky demyelinizačního onemocnění charakteru RS, které udávala pacientka z naší druhé kazuistiky. Protože však takové obtíže nejsou z pohledu pacienta často asociovány se současným onemocněním časově ani svým charakterem, je nutno se na ně nemocného aktivně dotazovat. I přes systematické pátrání po podobných anamnestických obtížích však u části pacientů takové předchozí symptomy korelující s případnou atakou nezjistíme. Stejně tak tomu bylo u pacienta prezentovaného v naší první kazuistice.
Vedle klinického obrazu jsou u pacientů s tumoriformní variantou RS v úvodu diagnostického procesu klíčová zobrazovací vyšetření, zejména pak MR mozku, event. CT, které je u části pacientů provedeno jako úvodní vyšetření vzhledem k atypickým klinickým příznakům.Tumoriformní léze se často zobrazí jako dobře ohraničené hypodenzní ložisko s kolaterálním edémem [10]. Charakteristickým MR nálezem je tumoriformní léze, která může mít charakter jedno ‑ či víceložiskového procesu. Léze mají nepravidelný tvar, v okolí bývá popisován edém a dochází k jejich variabilnímu sycení po podání kontrastní látky. Ložiska jsou obvykle lokalizována v bílé hmotě, u některých se mohou objevit známky centrální nekrózy, cystická degenerace a expanze do kortexu. Popsaný MR obraz tak napodobuje nejspíše nádorové onemocnění, méně často pak onemocnění infekční či jiné formy demyelinizačního onemocnění než RS [4 – 7].
Z jiných typů demyelinizační léze je v rámci diferenciální diagnostiky tumoriformních lézí na MR potřeba zvážit zejména ADEM (akutní diseminovanou encefalomyelitidu). Jedná se o vzácné imunitně zprostředkované zánětlivé onemocnění CNS postihující stejně jako RS převážně bílou hmotu mozkomíšní. Rozvoj ADEM předchází typicky v rozmezí dnů až čtyř týdnů infekce nebo vakcinace. Průběh je zpravidla monofázický. [11].
Nález na magnetické rezonanci u ADEM může napodobovat tumoriformní variantu RS, většinou se ale jedná o multifokální postižení netumoriformního charakteru, v rámci kterého jsou všechna ložiska stejného stáří a dochází k sycení kontrastní látkou. Při současném postižení míchy jsou přítomna demyelinizační ložiska přesahující dva segmenty. Na kontrolních MR nedochází k rozvoji nových ložisek, nález zůstává stacionární, nedochází k sycení ložisek [4].
Některé radiologické charakteristikytumoriformních ložisek mohou být diferenciálně-diagnosticky významné a svědčí spíše pro demyelinizační charakter léze než pro tumor či absces. Jedná se například o inkompletní prstenčité sycení léze, které je typické pro demyelinizační ložiska a naopak neobvyklé pro abscesy či léze nádorového charakteru, u nichž se většinou sytí prakticky celé ložisko anebo jeho kompletní prstenec [6,7]. Přínosný je samozřejmě také záchyt dalších ložisek netumoriformního charakteru, ale naopak typických pro demyelinizační onemocnění, která však v úvodu diagnostického procesu, tedy v době prvního záchytu tumoriformní léze, nemusí být přítomna. Jejich následný rozvoj v průběhu sledování vývoje základního procesu však může napomoci v rámci diferenciálně-diagnostické rozvahy a významně podporuje demyelinizační charakter primární léze [3].
Kromě rozvoje nových netumoriformních ložisek je v rámci longitudinálního sledování přínosné i hodnocení vývoje tumoriformní plaky jako takové. Její velikost a sycení většinou zůstává na následných MR zobrazeních stacionární nebo mírně regreduje, edém v okolí plaky mívá také tendenci k postupné regresi [3].
Popsané charakteristiky jsou dobře dokumentovány oběma prezentovanými kazuistikami.
V obecné rovině tedy vstupní MR vyšetření v základních sekvencích často neposkytuje spolehlivou možnost odlišení diferenciálně-diagnostických možností ložiskového procesu a pro stanovení správné diagnózy je u některých pacientů nezbytné doplnění dalších vyšetření, v prvním kroku nejčastěji mozkové biopsie [3,12]. U pacientů, u kterých má tumoriformní léze v MR obraze výše popsané typické atributy a zejména při nálezu dalších ložisek v lokalizacích typických pro demyelinizaci, by však mělo být na tuto možnost v rámci diferenciální diagnostiky pomýšleno, aby bioptické verifikace byly prováděny jen v nejnutnějších případech.
Přesnost stereotaktické biopsie a následného histologického vyšetření se v otázce stanovení demyelinizačního charakteru tumoriformní léze pohybuje v rozmezí od 82 do 99 % [12]. V histopatologických nálezech bývají u tumoriformních plak RS zachovány axony, dochází ke ztrátám myelinu a bývají přítomny známky proliferace makrofágů a astrocytů [3,12]. I když tyto nálezy ve většině případů verifikují demyelinizaci jako etiologii ložiskového procesu, nejsou zcela specifické a mohou napodobovat např. reaktivní nenádorovou gliózu či nízce maligní (low ‑ grade) gliom (vzhledem k přítomnosti hypercelulárního nálezu a přítomnosti atypických reaktivních astrocytů spolu se zvýšenou mitotickou aktivitou buněk). V případě, že demyelinizační léze obsahují významnou zánětlivou složku, může histologický nález imponovat jako lymfom [3,12]. Histologické vyšetření bioptované tkáně je nicméně diagnosticky přínosné i v případech, kdy nevede k jednoznačné detekci demyelinizace jako etiologie vyšetřovaného ložiska, protože s vysokou pravděpodobností vyloučí řadu diferenciálně-diagnostických možností, a to zejména závažných charakteru vysoce maligního (high‑grade) gliomu či mozkového abscesu, čímž poskytne oporu pro strategii typu „wait and see“, tedy následné sledování stavu pacienta, u něhož dojde v dalším průběhu většinou k vývoji základního onemocnění, který již umožní spolehlivé stanovení správné diagnózy, jak tomu bylo u pacienta z naší první kazuistiky.
Určitou alternativou histologického vyšetření, resp. dalším diagnostickým krokem v případě jeho nedostatečné výtěžnosti, je pozitronová emisní tomografie (PET). Jedná se o zobrazovací vyšetření mozku s využitím radionuklidů zaměřené na zjištění metabolické aktivity lézí. Nejčastěji používaným radioizotopem v PET je 18 - flouro‑2 - deoxyglukóza (18F ‑ FDG). Nejvýznamnější indikací PET s 18F ‑ FDG je diagnostika vysoce maligních lézí mozkové tkáně. Lymfomy i high‑grade gliomy mají vysokou metabolickou aktivitu, která se projeví zvýšeným vychytáváním 18F ‑ FDG v oblasti nádorového ložiska. Senzitivita a specificita PET v diagnostice high‑grade gliomů činí 88 % [13]. Využití PET s 18F ‑ FDG v diagnostice nízce maligních (a tedy méně metabolicky aktivních) lézí je limitováno skutečností, že i normální mozková tkáň v určité míře vychytává glukózu. Z tohoto důvodu je PET s využitím 18F ‑ FDG málo senzitivní v odlišení low ‑ grade gliomů od normální mozkové tkáně [14,15]. V ložiscích tumoriformní varianty RS není metabolická aktivita natolik vysoká, aby bylo možné je zobrazit pomocí 18F ‑ FDG PET. Vyšetření tedy vyloučí vysoce maligní etiologii sledovaného ložiska, jako tomu bylo u obou pacientů prezentovaných v našich kazuistikách. Obdobné nálezy jako při vyšetření 18F ‑ FDG PET, tedy obraz sníženého prokrvení, jsou popisovány i při vyšetření MR perfuzí [16]. Dalšími MR metodami, které mohou být přínosné v diferenciální diagnostice tumoriformních lézí, jsou pak např. difuzně vážená zobrazení (DWI) nebo magnetická rezonanční spektroskopie (MRS), jež však nebyly u našich pacientů využity, a prezentované kazuistiky tak nemohou dokumentovat jejich význam. Žádná z těchto metod navíc neposkytuje jednoznačnou možnost odlišení tumoriformní plaky zejména od vysoce maligních tumorů. Např. restrikce difuze (typická pro akutní – ale nikoli chronické – demyelinizační plaky) při vyšetření DWI může být u high‑grade gliomů také přítomna v důsledku vysoké celularity tumoru, obdobný obraz lze pak najít i v případě mozkového lymfomu. Vodítkem pro tvorbu radiologického závěru tak vždy zůstává celkový charakter MR nálezu spíše než hodnocení izolované sekvence.
Z dalších metod mohou být v diferenciální diagnostice tumoriformní varianty RS přínosné evokované potenciály (EP) a vyšetření mozkomíšního moku (CSF). Klíčovým přínosem evokovaných potenciálů je průkaz případné subklinické demyelinizační léze zrakové, sluchové, somatosenzitivní či motorické dráhy, a to zejména v oblastech topicky irelevantních k došetřovanému ložisku. Také v rámci vyšetření mozkomíšního moku je diferenciálně-diagnosticky přínosný především nález abnormit relevantních k demyelinizačnímu onemocnění charakteru RS.
Vyšetření EP a CSF jsou však do diagnostického procesu zařazena většinou až v momentě, kdy je demyelinizace zvažována jako možná, resp. pravděpodobná etiologie vyšetřovaného ložiska, jak tomu bylo i v případě obou pacientů prezentovaných v našich kazuistikách.
Nálezy studií reflektujících obvyklý klinický průběh tumoriformní varianty RS jsou poměrně nejednoznačné. Kepes et al [4] prokázali v souboru 31 pacientů s tumoriformní variantou RS, že tato forma RS má většinou monofázický průběh a nevyvine se v typickou relabující ‑ remitentní formu onemocnění (RRRS) [4].
Oproti tomu z multicentrické retrospektivní studie Luchinettiho et al [3], ve které bylo sledováno 168 pacientů s tumoriformní variantou RS, vyplývá, že u většiny pacientů dojde nakonec k rozvoji RRRS [3]. Na základě této studie bylo zjištěno, že interval mezi první atakou a dalším relapsem onemocnění je delší než u klasického průběhu RRRS. Průměrná délka bezpříznakového období u tumoriformní varianty RS činí 4,8 roku, u RRRS asi 1,8 roku [3]. V souladu s touto skutečností by nálezy první zmíněné studie [4] mohly odrážet právě existenci tohoto delšího bezpříznakového období, v němž klinický průběh u daného pacienta imponuje monofazickým dojmem. Z některých studií dále vyplývá, že pacienti s tumoriformní variantou RS mají v porovnání s jinými formami RS benignější průběh onemocnění [4], kterému odpovídá i delší interval do rozvoje relapsu [3].
Confavreux et al [17] naopak popsali agresivnější průběh onemocnění u pacientů po první atace RS, u kterých byla na MR mozku popsána přítomnost tumoriformní plaky [17].
Následný rozvoj RRRS stejně jako poměrně benigní průběh onemocnění s delšími intervaly mezi jednotlivými relapsy oproti jiným formám RS potvrzuje i pacientka z naší druhé kazuistiky.
Závěr
Tumoriformní varianta RS představuje vzácnou formu tohoto demyelinizačního onemocnění s klinickou manifestací a radiologickým (MR) obrazem připomínajícím spíše nádor či absces, a tedy odlišnou od běžných forem roztroušené sklerózy. Nejdůležitějším úkolem diagnostického procesu u pacientů s tumoriformní variantou RS je právě co nejčasnější rozpoznání demyelinizační etiologie ložiska, aby mohla být včas zahájena adekvátní terapie. Klinický obraz stejně jako změny na MR neposkytují v časné fázi diagnostického procesu u některých pacientů dostatečnou oporu pro odlišení demyelinizace od dalších diferenciálně--diagnosticky významných jednotek. V takových případech je v této indikaci klíčová stereotaktická biopsie. Pokud je histologický nález neprůkazný, je nutné použít další vyšetřovací metody, např. PET mozku s využitím fluordeoxyglukózy. Diagnóza může být dále zpřesněna vyšetřením CSF a/ nebo nálezem evokovaných potenciálů s průkazem subklinických demyelinizačních lézí, topicky irelevantních k vyšetřovanému ložisku. Přínosné je také sledování vývoje klinického i MR nálezu v čase: zůstává‑li klinický nález i MR ložisko stacionární a/ nebo se objeví nová klinická symptomatika, topicky irelevantní k původnímu ložisku nebo nová MR ložiska demyelinizačního charakteru, jedná se s největší pravděpodobností o RS.
V následném klinickém průběhu dojde u většiny pacientů postupně k rozvoji RRRS. Zmíněné diagnostické obtíže i následný vývoj onemocnění dobře dokumentují obě prezentované kazuistiky. U prvního pacienta se na základě klinických projevů a MR vyšetření v první řadě uvažovalo o nádorovém onemocnění, stereotaktická biopsie a PET vyšetření nepřinesly jasný výsledek. Diagnóza RS byla potvrzena na základě sledování vývoje na MR mozku a změn klinického stavu pacienta a poté verifikována vyšetřením mozkomíšního moku a evokovaných potenciálů.
U pacientky popsané v druhé kazuistice se podle klinických projevů a MR mozku také zvažovalo nádorové onemocnění jako nejpravděpodobnější etiologie vyšetřovaného ložiska. Stereotaktická biopsie však prokázala demyelinizační etiologii léze. RS byla následně potvrzena vyšetřením mozkomíšního moku a evokovaných potenciálů a verifikována dalším průběhem onemocnění i vývojem MR nálezu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Iva Okáčová
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: iva.okacova@seznam.cz
Přijato k recenzi: 4. 3. 2013
Přijato do tisku: 24. 4. 2013
Zdroje
1. Paty DW, Oger JJ, Kastrukoff LF, Hashimoto SA, Hooge JP, Eisen AA et al. MRI in the diagnosis of MS: a prospective study with comparison of clinical evaluation, evoked potentials, oligoclonal banding, and CT. Neurology 1988; 38(2): 180 – 185.
2. Barkhof F, Rocca M, Francis G, Van Waesberghe JH, Uitdehaag BM, Hommes OR et al. Validation of diagnostic magnetic resonance imaging criteria for multiple sclerosis and response to interferon beta1a. Ann Neurol 2003; 53(6): 718 – 724.
3. Lucchinetti CF, Gavrilova RH, Metz I, Parisi JE, Scheithauer BW, Weigand S et al. Clinical and radiographic spectrum of pathologically confirmed tumefactive multiple sclerosis. Brain 2008; 131(Pt 7): 1759 – 1775.
4. Kepes JJ. Large focal tumor‑like demyelinating lesions of the brain: intermediate entity between multiple sclerosis and acute disseminated encephalomyelitis: a study of 31 patients. Ann Neurol 1993; 33(1): 18 – 27.
5. Dagher AP, Smirniotopoulos J. Tumefactive demyelinating lesions. Neuroradiology 1996; 38(6): 560 – 565.
6. Schwartz K, Erickson BJ, Lucchinetti CF. Pattern of T2 hypointensity associated with ring enhancing brain lesions can help differentiate pathology. Neuroradiology 2006; 48(3): 143 – 149.
7. Kiriyama T, Kataoka H, Taoka T, Tonomura Y, Terashima M, Morikawa M et al. Characteristic neuroimaging in patients with tumefactive demyelinating lesions exceeding 30 mm. J Neuroimaging 2011; 21(2): e69 – e77.
8. Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011; 69(2): 292 – 302.
9. O’Connor AB, Schwid SR, Herrmann DN, Markman JD, Dworkin RH. Pain associated with multiple sclerosis: systematic review and proposed classification. Pain 2008; 137(1): 96 – 111.
10. Tan HM, Chan LL, Chuah KL, Goh NS, Tang KK. Monophasic, solitary tumefactive demyelinating lesion: neuroimaging features and neuropathological diagnosis. Br J Radiol 2004; 77(914): 153 – 156.
11. Kopal A, Mrklovský M, Ehler E. Akutní diseminovaná encefalomyelitida a její možná záměna s AIDP. Neurol Prax 2007; 8(6): 364 – 366.
12. Boviatsis EJ, Kouyialis AT, Stranhjalis G, Korfias S,Sakas DE. CT ‑ guided stereotactit biopsies of brain stem lesions: personal experience and literature review. Neurol Sci 2003; 24(3): 97 – 102.
13. Villringer K, Jäger H, Dichgans M, Ziegler S, Poppinger J, Herz M et al. Differential diagnosis of CNS lesions in AIDS patients by FDG ‑ PET. J Comput Assist Tomogr 1995; 19(4): 532 – 536.
14. Olivero WC, Dulebohn SC, Lister JR. The use of PET in evaluating patients with primary brain tumours: is it useful? J Neurol Neurosurg Pychiatry 1995; 58(2): 250 – 252.
15. Shields AF, Grierson JR, Dohmen BM, Machulla HJ,Stayanoff JC, Lawhorn ‑ Crews JM et al. Imaging proliferation in vivo with [F ‑ 18]FLT and positron emission tomography. Nat Med 1998; 4(11): 1334 – 1336.
16. Bakshi R, Miletich RS, Kinkel PR, Emmet ML, Kinkel WR. High‑resolution fluordeoxyglucose positron emission tomography shows both global and regional cerebral hypometabolism in multiple sclerosis. J Neuroimaging 1998; 8(4): 228 – 234.
17. Confavreux C, Vukusic S. Natural history of multiple sclerosis: implications for counselling and therapy. Curr Opin Neurol 2002; 15(3): 257 – 266.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Wilsonova nemoc
- Nová antikoagulancia v prevenci kardioembolických iktů u pacientů s nevalvulární fibrilací síní
- Kanabis ve vývoji a homeostáze nervového systému
- Homocysteín a sclerosis multiplex
- Kvantifikace postižení u pacientů s lumbální spinální stenózou
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Současné možnosti využití magnetické rezonance v diagnostice normotenzního hydrocefalu
- Neurologické komplikace dengue – možné nebezpečí pro střední Evropu
- Přesnost farmakogenetických algoritmů pro výpočet denní dávky warfarinu
- Interrater variabilita v hodnocení míry atrofie hipokampů pomocí Scheltensovy škály
- Porovnání peroperační radiační expozice při otevřené a miniinvazivní transpedikulární fixaci hrudní a bederní páteře
- Erratum
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
- Operační léčba syndromu supinátorového kanálu
- Strategie diagnostiky, terapie a dispenzarizace pacientů s hemangioblastomy v CNS z pohledu neurochirurga
- Synkopy, hluchota a slepota u karcinomu prsu – kazuistika
- Gitelmanův syndrom provázený manifestní tetanií – kazuistika
- Konzumace marihuany jako rizikový faktor ischemické cévní mozkové příhody – kazuistika
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Souběžný výskyt mutace v genu ZNF9 (myotonická dystrofie typu 2) a v genu CLCN1 (myotonia congenita) v jedné rodině – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XLI. Simpsonův paradox
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Wilsonova nemoc
- Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby
- Tumoriformní varianta roztroušené sklerózy – dvě kazuistiky
- Test 3F Dysartrický profil – normativní hodnoty řeči v češtině
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



