-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunoterapie v léčbě pokročilého cholangiokarcinomu
22. 4. 2024
Léčba karcinomu žlučových cest se dnes rychle vyvíjí. Stále jde o onemocnění diagnostikované převážně v pokročilém stadiu s nepříznivou prognózou. Po řadě let přináší první světlo do léčby pokročilých cholangiokarcinomů imunoterapie.
Dosavadní neuspokojivé výsledky léčby pokročilého CCA
Maligní nádory žlučových cest zahrnují cholangiokarcinomy (CCA), karcinomy žlučníku a karcinomy Vaterovy papily. CCA lze rozdělit dle lokalizace na intrahepatální a extrahepatální. CCA je považován za vzácný nádor, jeho incidence ale narůstá. Onemocnění je navíc většinou diagnostikováno v pozdním stadiu, což již umožňuje pouze paliativní léčbu. To objasňuje i nízké 5leté přežití, nedosahující ani 20 %.1
Základem léčby pokročilého CCA je chemoterapie. Od roku 2010 je za standard považována kombinace gemcitabin + cisplatina (GemCis) na základě výsledků studie ABC-02, která prokázala delší celkové přežití (OS) a přežití bez progrese (PFS) při této kombinované léčbě v porovnání se samotným gemcitabinem. Přesto medián OS a PFS dosahuje pouze 11,7, resp. 8,0 měsíců. Současné snahy se proto zaměřují na nalezení strategií jak tyto výsledky zlepšit.1
InzerceMožné strategie zlepšení terapeutických výsledků
Rozšíření chemoterapie
První z cest, které byly zkoumány, je trojkombinace chemoterapie v 1. linii nebo chemoterapie ve 2. linii léčby. Slibné výsledky (prodloužení PFS a OS) naznačuje přidání nab-paklitaxelu ke GemCis a u pacientů po selhání GemCis bez lézí ovlivnitelných cílenou léčbou také podávání režimu FOLFOX (5-fluorouracil /5-FU/ + oxaliplatina), který v porovnání s aktivní symptomatickou léčbou prodlužuje OS, nebo nanoliposomálního irinotekanu + 5-FU + leukovorinu (LV), což je kombinace, která prokázala prodloužení OS a PFS v porovnání s 5-FU+LV.1−4
Cílená léčba
Druhou strategií je identifikace alterací, které je možné ovlivnit cílenou léčbou, a využití personalizované léčby. Současný výzkum se zaměřuje především na mutace IDH1 a fúze FGFR2, ale zkoumány jsou i mutace BRAFV600E, amplifikace ERBB2 a mutace a fúze NTRK. Dosud schválené přípravky u konkrétních alterací zahrnují pemigatinib (schválený americkým Úřadem pro kontrolu léčiv a potravin /FDA/ v roce 2020 a Evropskou lékovou agenturou /EMA/ v roce 2021 u nádorů s mutací FGFR2),5 ivosidenib (schválený FDA v roce 2021 a EMA v roce 2023 u nádorů s mutací IDH1R132)6 a dále infigratinib (u nádorů s fúzí FGFR2),7 futibatinib (u nádorů s fúzí FGFR2)8 a dabrafenib/trametinib (u nádorů s mutací BRAFV600E)9 schválené pouze FDA v letech 2021/2022.1
Přidání imunoterapie
Třetím hlavním směrem vývoje léčby pokročilého CCA je imunoterapie. I přes nízkou incidenci prediktorů odpovědi na imunoterapii (deficience oprav chybného párování /dMMR/, vysoká mikrosatelitová nestabilita /MSI-H/ a vysoká mutační nálož nádoru) existují důkazy, že CCA jsou imunogenní tumory. Protože iniciální studie se samotnou imunoterapií nepřinesly uspokojivé výsledky, byla hodnocena kombinace imunoterapie s chemoterapií.1
Poté, co studie fáze I ukázala aktivitu a snášenlivost této kombinace, byly u nepředléčených pacientů s pokročilým CCA zkoušeny 3 postupy: sekvence chemoterapie a následné imunoterapie durvalumabem a tremelimumabem; současné podávání chemoterapie a durvalumabu; současné podávání chemoterapie, durvalumabu a tremelimumabu. Nejvyššího podílu objektivních odpovědí na léčbu (ORR: 72 %) bylo dosaženo v rameni se současným podáváním chemoterapie a durvalumabu při srovnatelném PFS u všech režimů. Role tremelimumabu v léčbě CCA tedy zůstává nejasná.1
Chemoterapie + durvalumab
Kombinace chemoterapie s durvalumabem byla dále hodnocena ve studii fáze III TOPAZ-1, ve které bylo randomizováno 685 pacientů s nepředléčeným pokročilým CCA nebo karcinomem žlučníku k podávání GemCis s přidáním durvalumabu nebo placeba.
Primárním sledovaným parametrem bylo OS, jehož medián prodloužilo přidání durvalumabu o 20 % (poměr rizik [HR] 0,80; 95% interval spolehlivosti [CI] 0,66–0,97; p = 0,021). Ve skupině s durvalumabem bylo zjištěno i významně vyšší PFS (HR 0,75; 95% CI 0,63–0,89; p = 0,001) a ORR (26,7 vs. 18,7 %), a to bez zvýšení toxicity léčby. Při přidání durvalumabu byl také pozorován trend k oddálení zhoršení celkového zdravotního stavu dle Global Health Status QLQ C30.
Analýza podskupin překvapivě neukázala významné rozdíly mezi výsledky v závislosti na expresi receptoru programované buněčné smrti (PD-1), primární lokalizaci nádoru, stadiu onemocnění nebo přítomnosti virové hepatitidy. Přínos přidání durvalumabu k chemoterapii potvrdila i aktualizovaná data z této studie.1
Změna mezinárodních doporučení
Výsledky studie TOPAZ-1 změnily mezinárodní doporučení pro léčbu CCA a karcinomu žlučníku. Evropská společnost klinické onkologie (ESMO) ohodnotila výsledky této studie vysokou známkou 4 na 5bodové škále klinického přínosu (MCBS).10 Doporučení americké National Comprehensive Cancer Network (NCCN) z roku 2022 uvádějí, že durvalumab by měl být zvážen v 1. linii léčby pokročilého CCA. EMA i FDA durvalumab v témž roce schválily v kombinaci s gemcitabinem a cisplatinou v 1. linii léčby neresekovatelného či metastazujícího karcinomu žlučových cest.1
Evropská asociace pro studium jater (EASL) a Mezinárodní asociace pro karcinom jater (ICLA) potom v roce 2023 vydaly samostatná doporučení pro diagnostiku a léčbu intrahepatálního CCA, který představuje specifickou entitu mezi CAA z hlediska své odlišné etiologie, rizikových faktorů, molekulární biologie i klinického přístupu. Intrahepatální CCA je druhý nejčastější karcinom jater s alarmující mortalitou danou pozdní diagnózou tohoto dlouho klinicky němého onemocnění, vysokou agresivitou nádoru a rezistencí k léčbě. Potřebné jsou proto co nejčasnější diagnostika, molekulární charakteristika, přesný staging a personalizovaný multidisciplinární přístup. Doporučený algoritmus diagnostiky a léčby intrahepatálního CCA dle EASL-ICLA z roku 2023 je zobrazen níže.11
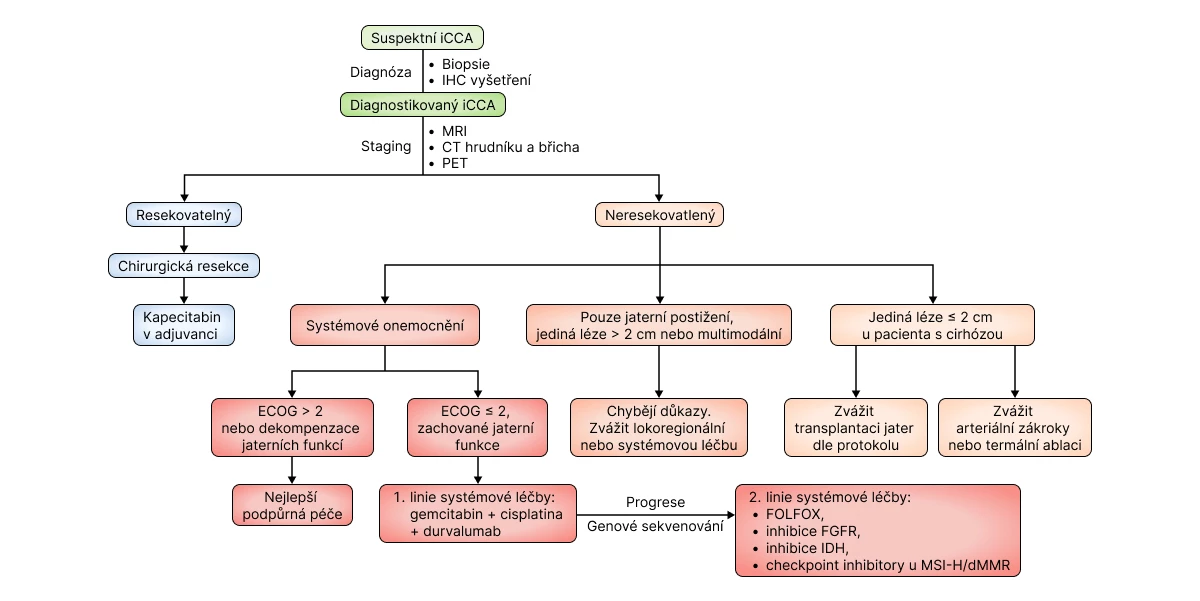
Obr. Algoritmus diagnostiky a léčby intrahepatálního cholangiokarcinomu (iCCA)2
Probíhající klinická hodnocení
Očekávány jsou výsledky studie fáze III KEYNOTE-966, která hodnotí přínos přidání pembrolizumabu k chemoterapii CCA. Pokud přinese pozitivní výsledky, potvrdí přínos strategie kombinované imunochemoterapie v léčbě pokročilého karcinomu žlučových cest. Probíhá také několik studií, které u tohoto onemocnění zkoušejí různé další kombinace inhibitorů imunitních kontrolních bodů (checkpoints) s chemoterapií, ale rovněž kombinace imunoterapie s inhibitory tyrosinkinázy a s léčbou cílenou na konkrétní biomarkery. Data jsou zatím velmi sporá.
Závěr
Většina případů CCA je zachycena v pozdním stadiu. Základem léčby pokročilého onemocnění je chemoterapie, přičemž nedávno byl prokázán přínos přidání imunoterapie. V 1. linii systémové léčby je dnes schválená a doporučená kombinace GemCis s durvalumabem. Registrovány již také byly některé přípravky pro cílenou léčbu. Pro zlepšení výsledků je potřeba časný záchyt onemocnění, multidisciplinární přístup a kombinovaná terapie. Nadějí do budoucna jsou probíhající klinická hodnocení dalších léčebných modalit.
(zza)
Zdroje:
1. Merters J., Lamarca A. Integrating cytotoxic, targeted and immune therapies for cholangiocarcinoma. J Hepatol 2023 Mar; 78 (3): 652−657, doi: 10.1016/j.jhep.2022.11.005.
2. Shroff R. T., Javle M. M., Xiao L. et al. Gemcitabine, cisplatin, and nab-paclitaxel for the treatment of advanced biliary tract cancers: a phase 2 clinical trial. JAMA Oncol 2019; 5 (6): 824−830, doi: 10.1001/jamaoncol.2019.0270.
3. Lamarca A., Palmer D. H., Wasan H. S. et al.; Advanced Biliary Cancer Working Group. Second-line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): a phase 3, open-label, randomised, controlled trial. Lancet Oncol 2021; 22 (5): 690−701, doi: 10.1016/S1470-2045(21)00027-9.
4. Yoo C., Kim A., Kim I. et al. 55P -Final results from the NIFTY trial, a phase IIb, randomized, open-label study of liposomal Irinotecan (nal-IRI) plus fluorouracil (5-FU)/leucovorin (LV) in patients (pts) with previously treated metastatic biliary tract cancer (BTC). Ann Oncol 2022; 33 (suppl. 7): S19−S26, doi: 10.1016/annonc/annonc1036.
5. SPC Pemazyre. Dostupné na: www.ema.europa.eu/en/documents/product-information/pemazyre-epar-product-information_en.pdf
6. SPC Tibsovo. Dostupné na: https://ec.europa.eu/health/documents/community-register/2023/20230504160008/anx_160008_cs.pdf
7. Kang C. Infigratinib: first approval. Drugs 2021; 81 (11): 1355−1360, doi: 10.1007/s40265-021-01567-1.
8. Javle M., King G., Spencer K., Borad M. J. Futibatinib, an irreversible FGFR1-4 inhibitor for the treatment of FGFR-aberrant tumors. Oncologist 2023 Nov 2; 28 (11): 928−943, doi: 10.1093/oncolo/oyad149.
9. Subbiah V., Kreitman R. J., Wainberg Z. A. et al. Dabrafenib plus trametinib in BRAFV600E-mutated rare cancers: the phase 2 ROAR trial. Nat Med 2023 May; 29 (5): 1103−1112, doi: 10.1038/s41591-023-02321-8.
10. ESMO-MCBS Scorecards. Durvalumab TOPAZ-1. Dostupné na: www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards/scorecard-350-1
11. European Association for the Study of the Liver; European Association for the Study of the Liver. EASL-ILCA clinical practice guidelines on the management of intrahepatic cholangiocarcinoma. J Hepatol 2023 Jul; 79 (1): 181−208, doi: 10.1016/j.jhep.2023.03.010.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Gastroenterologie a hepatologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



