-
Medical journals
- Career
Současné klinické a patologické proměnné biopsie prostaty, které predikují významné změny grade
: S. Moussa; J. Li; M. Soriano; E. A. Klein; F. Dong; J. S. Jones
: Cleveland Clinic Glickman Urological & Kidney Institute, Cleveland
: Urol List 2010; 8(1): 23-28
Cíl:
U významného procenta pacientů je na základě vyšetření patologického vzorku odebraného při radikální prostatektomii (RP) karcinom prostaty upgraded (určeno vyšší stadium) nebo downgraded (určeno nižší stadium). Vzhledem k tomu, že Gleasonovo skóre (GS) stanovené ze vzorku biopsie hraje významnou roli při volbě terapie, pokusili jsme se identifikovat klinické a patologické parametry, které umožňují predikovat tyto patologické změny.Materiál a metody:
Retrospektivním způsobem jsme hodnotili celkem 1 379 pacientů, kteří podstoupili v naší instituci RP na základě biopsie prostaty v letech 2000–2007. Pacienty jsme na základě součtu GS ze vzorku biopsie rozdělili do dvou skupin: skupina 1 = 286 pacientů s GS/biopsie 6 a skupina 2 = 1 129 pacientů s GS ≥ 7. U všech pacientů jsme měli k dispozici kompletní relevantní klinické informace. K identifikaci predikátorů změny patologického grade byla užita multivarietní logistická analýza.Výsledky:
Výsledné patologické GS po prostatektomii bylo upgraded u 430 pacientů (30,8 %), downgraded u 210 (15 %) pacientů a zůstalo beze změny u 757 (54,2 %) pacientů. V první skupině (GS 6) bylo 134 pacientů (50 %) po operaci upgraded na GS ≥ 7. V druhé skupině (GS ≥ 7) bylo GS upgraded u 296 pacientů (26,2 %), downgraded u 210 pacientů (18,6 %) a zůstalo beze změny u 623 pacientů (55,2 %). Faktory predikující upgrade patologického GS zahrnovaly: vyšší hladinu PSA (p = 0,004), počet pozitivních vzorků (p < 0,001), procento zasažení vzorku karcinomem (p = 0,002) a maximální procentuální zasažení vzorku karcinomem (p = 0,012). Uprading predikovala rovněž přítomnost perineurální invaze (p = 0,043), absence zánětu (p < 0,0001) a absence HGPIN (p = 0,0199). Naopak downgrading predikovala prostata o větší velikosti (p = 0,0041) a malé maximální procentuální zasažení vzorku karcinomem (p =0,0014).Závěr:
Muži s vyšší hladinou PSA, perineurální invazí a karcinomem o vyšším objemu jsou častěji upgraded, zatímco muži s velkou prostatou o malém objemu karcinomu jsou častěji downgraded. Tato zjištění mají významný dopad pro pacienty s karcinomem prostaty, u nichž je léčba indikována bez znalosti skutečného Gleasonova skóre (stanoveného ze vzorku RP).Klíčová slova:
biopsie, preparát odebraný během operace, karcinom prostaty, Gleasonovo skóre, migrace gradeÚVOD
Téměř naprostá většina karcinomů prostaty je v dnešní době detekována na základě histologického vyšetření vzorku odebraného pomocí biopsie jehlou. Grade tumoru, parametr vyjadřující agresivitu onemocnění, představuje jednu z nejdůležitějších proměnných při volbě vhodné léčby. V klinické praxi se běžně užívá Gleasonovo skóre (GS), které je tvořeno primárním a sekundárním grade a odpovídá agresivitě onemocnění a koreluje s prognózou a dopadem zvolené léčby.
Bylo zjištěno, že GS vzorku biopsie může být ovlivněno nevhodným odebráním vzorku a může podléhat významné chybovosti, takže ve skutečnosti poskytuje pouze omezenou informaci o skutečném stavu tumoru. Přesnější a úplnější hodnocení objemu a grade tumoru lze provést po radikální prostatektomii (RP), kdy máme k dispozici primární, sekundární i terciární GS. Tyto proměnné jsou označovány jako patologické GS. Chybné stanovení skutečné povahy karcinomu ze vzorku biopsie (na základě celkového GS) nabývá na významu zejména u pacientů, kteří zvažují podstoupení neinvazivní léčby bez exstirpace prostatické žlázy. Chybným stanovením GS může dojít k falešnému podhodnocení či nadhodnocení rizika onemocnění a zkreslení výsledků u pacientů, kteří jsou zařazeni do programu aktivního sledování (AS), podstupují brachyterapii, kryoterapii nebo radioterapii zevním paprskem. Z tohoto důvodu je tedy nezbytné určit, s jakou přesností je GS stanovené na základě biopsie schopno predikovat skutečný patologický stav onemocnění nebo patologické GS.
V této studii popisujeme klinické a patologické proměnné, pomocí nichž lze předvídat klinicky signifikantní upgrade (skutečné vyšší stadium) u populace pacientů s karcinomem prostaty. Shrnutí a zhodnocení těchto parametrů během vyšetřování před zahájením léčby by mohlo být užitečné pro volbu počáteční i další terapie. Populaci pacientů s karcinomem prostaty jsme rozdělili do dvou skupin: skupinu 1 tvoří pacienti s GS stanoveným na základě vzorku biopsie 6, skupinu 2 pacienti s GS/biopsie 7–10. Stratifikace rizika pro hodnocení výsledků se může mezi oběma skupinami lišit.
MATERIÁL A METODY
Studovaná populace zahrnovala celkem 1 397 pacientů, u nichž bylo na základě transrektální ultrazvukové biopsie (TRUSbx) stanoveno GS ≥ 6 a kteří následně podstoupili v letech 2000–2007 radikální prostatektomii. Pacienti byli vyhledáni pomocí databáze zahrnující údaje o karcinomu prostaty a biopsii prostaty (schválené IRB, HIPAA). Všechny vzorky získané pomocí transrektální biopsie byly odebrány v naší instituci, případně jsme získali patologické vzorky tkáně, které byly následně vyšetřeny našimi patology.
Informace byly zadány do databáze retrospektivním způsobem prostřednictvím klinických a patologických záznamů. Počet a lokalizace vzorků byl stanoven na základě uvážení urologa. Všechny vzorky tkáně byly vyšetřeny našimi patology, kteří stanovili patologickou diagnózu karcinomu prostaty, GS ze vzorku biopsie a patologické GS definitivního preparátu. Od roku 2004 byla téměř úplná většina vzorků odebraná při biopsii i prostatektomii vyšetřena členy našeho týmu urologických patologů. Předtím vyšetřovali vzorky různí patologové, z nichž všichni měli dostatečnou kvalifikaci, a vyšetřování vzorků získaných při biopsii prostaty bylo náplní jejich každodenní praxe. Vzorky odebrané při prostatektomii byly zpracovány po 3mm intervalech. Po vyšetření celého vzorku byly pomocí předdefinované šablony hodnoceny výsledné (patologické) GS, objem tumoru, přítomnost pozitivních okrajů a/nebo šíření karcinomu mimo prostatickou kapsulu, invaze semenných váčků a lymfatických uzlin.
U všech pacientů zařazených do studie byly k dispozici úplné informace týkající se klinických a patologických parametrů, jako jsou věk, rasa, klinické stadium, výsledek dřívější biopsie, předoperační hladina prostatického specifického antigenu (PSA), GS vzorku biopsie, celkový počet vzorků odebraných při biopsii, počet vzorků zasažených karcinomem, maximální zasažení vzorku karcinomem (v procentech), objem prostaty (měřený na základě hmotnosti vzorku odebraného při prostatektomii), patologické GS a jakékoli další patologické znaky, jako jsou kupříkladu atypie, zánět, intraepiteliální neoplazie vysokého grade (HGPIN) a perineurální invaze (vzorek biopsie a/nebo RP).
Upgrading bylo definováno následujícím způsobem:
- A. jakékoli zvýšení patologického GS oproti GS vzorku získaného při biopsii (jako celkový součet primárního a sekundárního grade)
- B. terciární grade vzorku získaného při RP > primární a sekundární GS
- C. zvýšení primárního a sekundárního grade, např.: GS 7 (3 + 4) na GS 7 (4 + 3) nebo GS 9 (4 + 5) na GS 9 (5 + 4), ačkoli v případě GS 9 může být význam výsledků pouze omezený
Downgrading bylo definováno jedním z následujících způsobů:
- A. jakýkoli pokles patologického GS oproti GS vzorku biopsie (jako celkový součet primárního a sekundárního grade)
- B. pokles primárního a sekundárního grade, např.: GS 7 (4 + 3) na GS 7 (3 + 4) nebo GS 9 (5 + 4) na GS 9 (4 + 5)
STATISTICKÁ ANALÝZA
Pro srovnání všech tří skupin (upgraded, downgraded a pacienti, jejichž patologické GS se shodovalo s GS stanoveným na základě biopsie, tzn. beze změny) jsme užili Kruskal-Willisův rank-sum test pro spojité proměnné (continuous variables) a Chí-kvadrát test pro kategoriální proměnné (categorical variables). Pro srovnání upgraded skupiny s downgraded skupinou (nebo skupinou, u níž nedošlo k žádné změně) jsme užili Wilcoxonův rank-sum test pro spojité proměnné a Chí-kvadrát test pro kategoriální proměnné.
K identifikaci predikátorů změn v patologickém grade jsme užili postupnou multivarietní logistickou regresní analýzu. Všechny změny (ať se jednalo o upgrading nebo downgrading) byly analyzovány samostatně, následně byly hodnoceny všech ny faktory (klinické, demografické, patologické), a výsledky se zkombinovaly. Statistická významnost byla nastavena na α = 0,05.
VÝSLEDKY
Klinická a patologická charakteristika studované populace je uvedena v tab. 1. Radikální prostatektomie byla provedena 56 (rozmezí 36 až 77) dní po biopsii. Výsledné patologické GS po radikální prostatektomii bylo upgraded (vyšší) u 430 (30,8 %) mužů, downgraded (nižší) u 2 150 (15 %) mužů a zůstalo nezměněno u 757 (54,2 %) mužů (tab. 2). Srovnání grade určených na základě biopsie a radikální proktektomie jsou uvedeny v tab. 3. Uvádíme příklad z první skupiny: 134 (50 %) pacientů s GS/biopsie 6 bylo po vyšetření vzorku získaného při RP upgraded na ≥ GS 7, většina těchto pacientů (118 ze 134, 88,1 %) byla upgraded na GS 7 (3 + 4). U 134 (50 %) pacientů nebyl karcinom upgraded – GS 6 (3 + 3), u všech pacientů zůstalo GS beze změny.
1. Klinická charakteristika, biopsie a patologická charakteristika vzorku (n = 1 397). 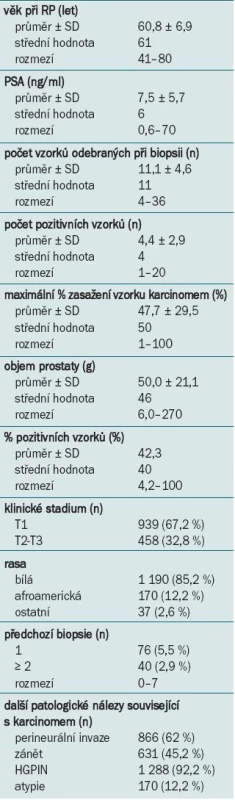
2. Výsledky srovnání GS biopsie a patologického GS. 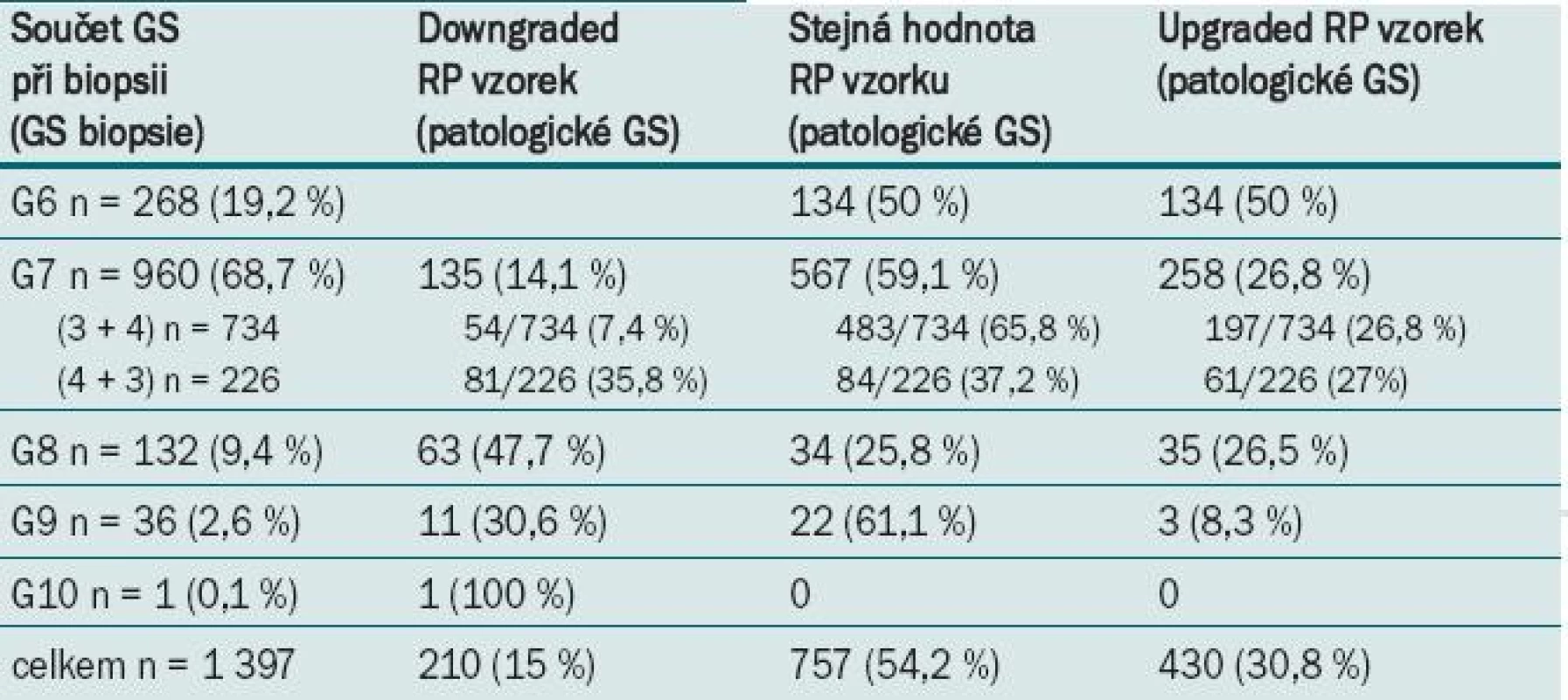
3. Výsledné patologické hodnocení a srovnání GS biopsie a patologického GS. 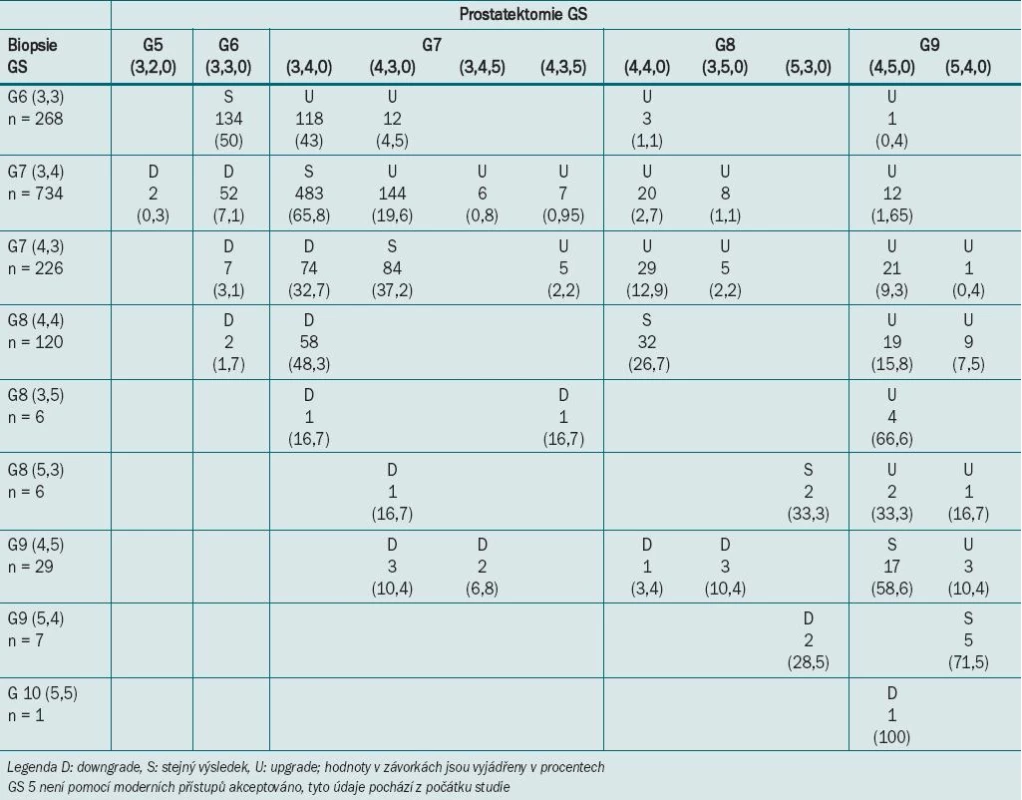
U populace mužů s GS/biopsie 6 (skupina 1) jsme pomocí univarietní analýzy srovnávali muže s upgraded a neupgraded karcinomy a zjistili jsme, že s ohledem na věk, rasu a celkový počet vzorků odebraných při biopsii byly obě skupiny srovnatelné. Upgraded pacienti měli vyšší předoperační hladinu PSA (p = 0,0208), menší objem prostaty (p = 0,0122) a větší objem karcinomu při biopsii (pozitivní vzorek, p < 0,001, celková délka karcinomu, p < 0,0001, max. % zasažení vzorku karcinomem, p = 0,014).
U populace mužů s GS vzorku biopsie ≥ 7 (skupina 2) jsme pomocí univarietní analýzy srovnávali skupiny, u nichž došlo ke změně GS, a zjistili jsme, že s ohledem na věk, rasu a celkový počet vzorků odebraných při biopsii byly obě skupiny srovnatelné (tab. 4). Upgraded pacienti měli vyšší předoperační hladinu PSA (p = 0,0016), větší maximální % zasa že ní vzorku karcinomem (p < 0,0001), menší objem prostaty (p = 0,0179) a větší počet abnormalit detekovaných během DRE (p = 0,0105). U downgraded pacientů byla zjištěna tendence častějšího výskytu zánětu (patologický nález související s výsky tem karcinomu (p = 0,0001)).
4. Upgraded skupina vs downgraded skupina u mužů s GS biopsie ≥ 7 (skupina 2). 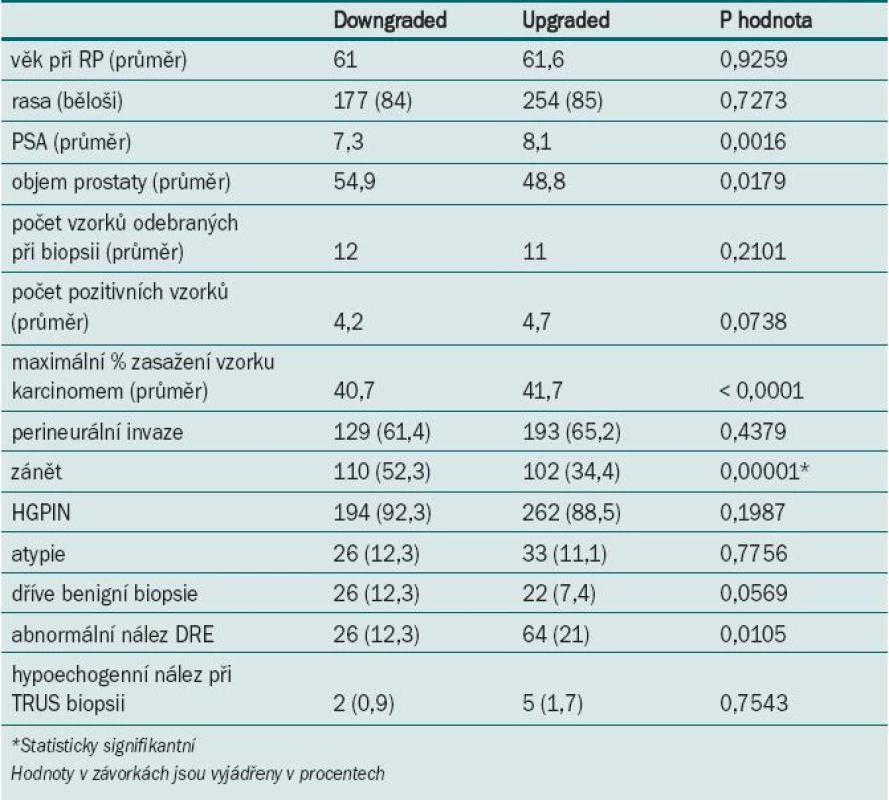
Pomocí multivarietní regresní analýzy signifikantních faktorů, do níž byli zařazeni pacienti všech tří kategorií (upgraded, downgraded, beze změny), jsme odhalili faktory zodpovědné za upgrading nebo downgrading (tab. 5–6). Stručně shrnuto – klinické a patologické proměnné, podle nichž lze předvídat upgrading patologického GS, zahrnovaly: vyšší předoperační hladinu PSA (p = 0,0045), přítomnost perineurální invaze (p = 0,043), absenci zánětu/HGPIN (jednoho/obou parametrů) jako patologického nálezu souvisejícího s karcinomem (p < 0,0001 a p = 0,0199). Model zahrnující pouze patologické faktory dále prokázal, že signifikantní proměnnou predikující upgrading je rovněž počet pozitivních vzorků (p = 0,0328).
5. Multivarietní logistická regresní analýza významných faktorů. Upgraded skupina. 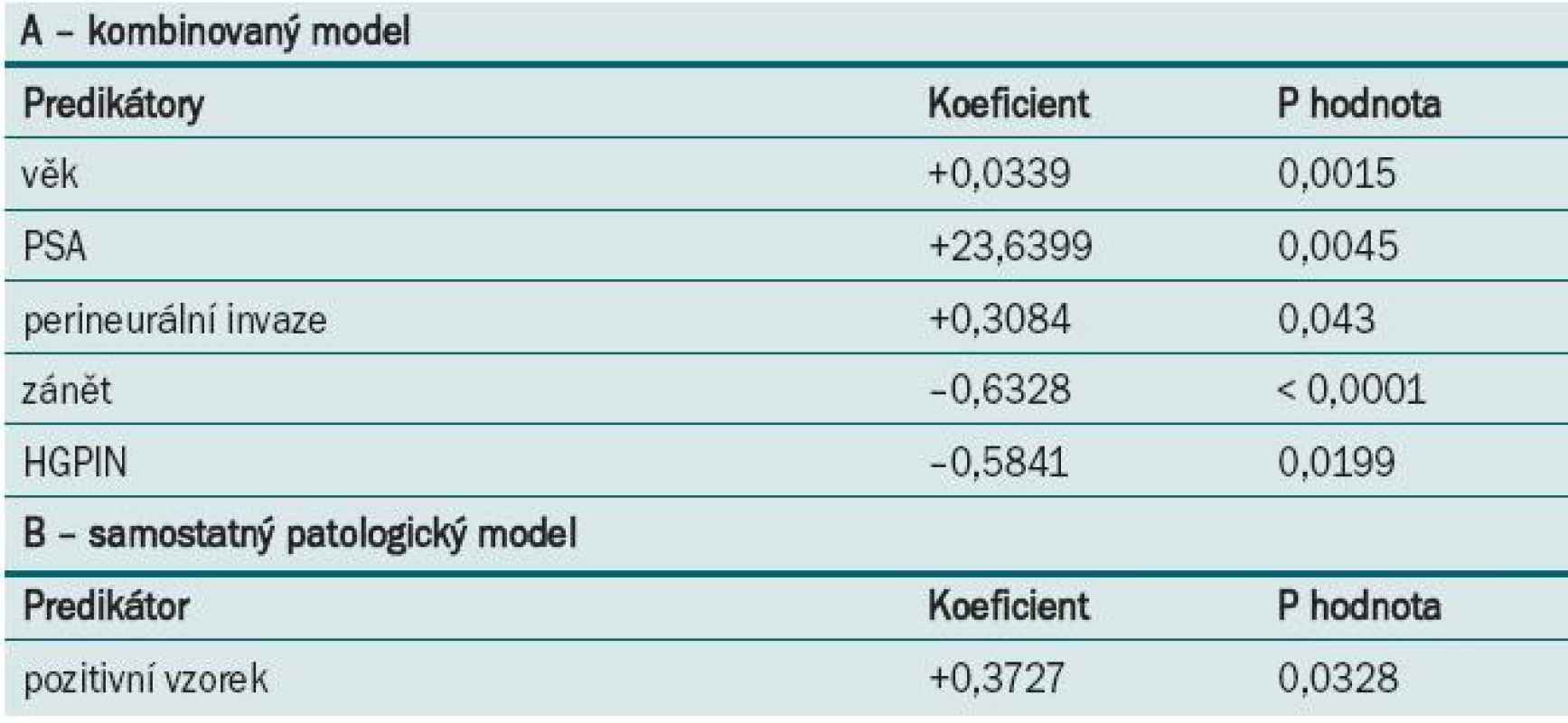
6. Multivarietní logistická regresní analýza významných faktorů. Downgraded skupina (omezeno pouze na muže s GS/biopsie ≥ 7, skupina 2). 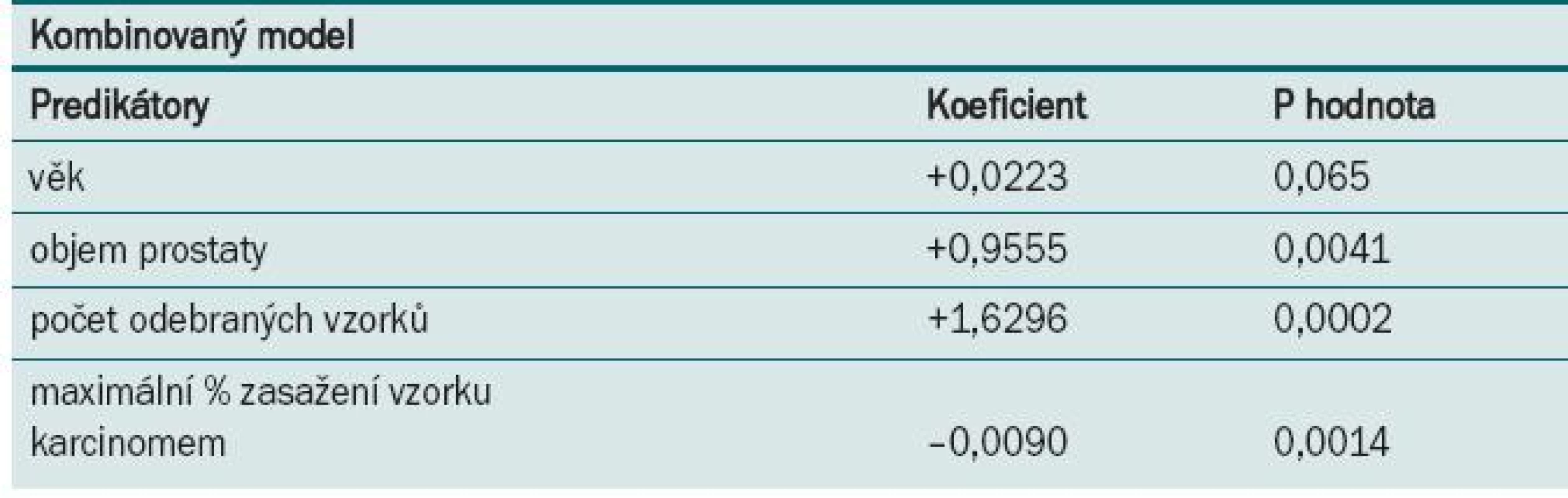
Naopak větší objem prostaty (p = 0,0041), nízké maximální % zasažení jakéhokoli vzorku karcinomem (p = 0,0014) a odběr většího počtu vzorků při biopsii (p = 0,0002) jsou faktory vedoucí s větší pravděpodobností k downgradingu GS.
Vyšší věk pacienta v době provádění RP představuje zcela specifický faktor predikující nepřesný výsledek GS/biopsie bez ohledu na to, jestli se jedná o upgrading (p = 0,0015) nebo okrajové downgrading (p = 0,065).
Dále jsme zjistili, že upgraded GS (na rozdíl od non-upgraded) bylo spojeno s nepříznivým patologickým výsledkem RP (tab. 7), konkrétně: vyšší mírou extraprostatického rozšíření karcinomu (p < 0,0001), invazí semenných váčků (p < 0,0001) a rozšířením metastáz do lymfatických uzlin (p = 0,0007).
7. Patologický dopad změn v GS. 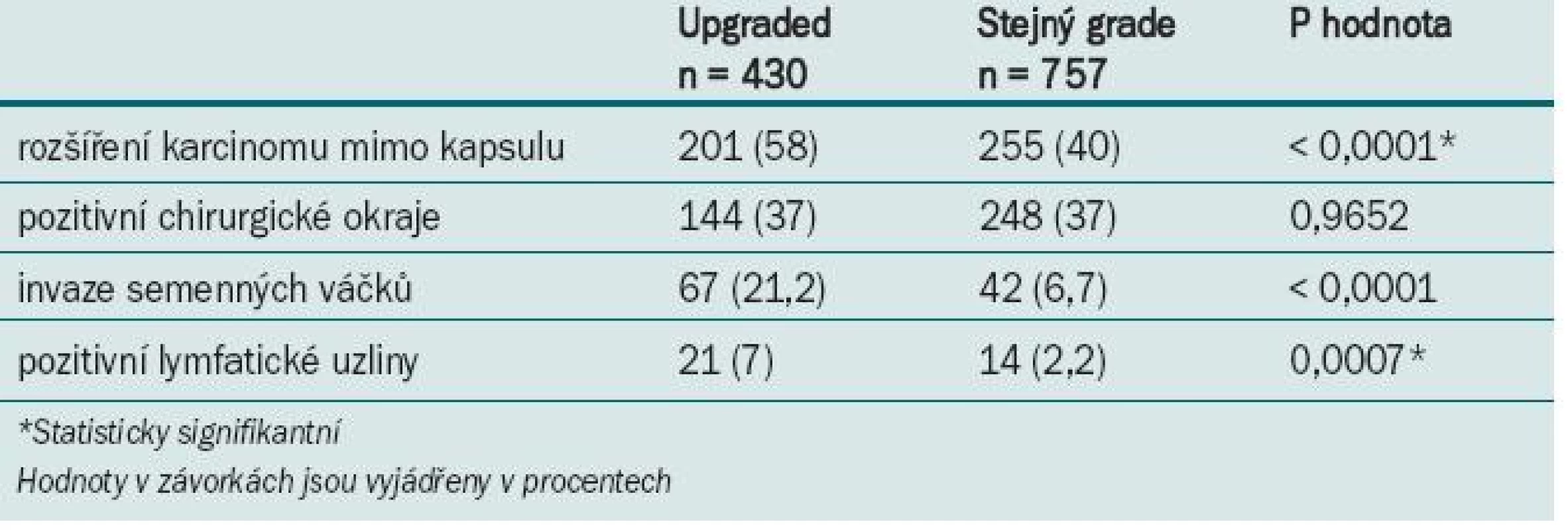
Doba přežití bez biochemické recidivy byla 86,6 % u pacientů s upgraded GS, 95,5 % u pacientů bez změny v GS (p = 0,018) a 94,7 % u pacientů s downgraded GS (p = 0,009). Z této sekundární analýzy bylo vyřazeno 232 pacientů, u nichž jsme neměli k dispozici žádnou informaci týkající se pooperační hladiny PSA. Střední doba sledování však byla pouze 30 měsíců (průměr 33 měsíců, rozmezí 1–90 měsíců).
DISKUZE
Gleasonovo skóre lze považovat za nejspolehlivější faktor pro charakteristiku biologického potenciálu karcinomu prostaty [3–5]. GS má tedy obrovský prognostický význam [6] a dále hraje významnou roli při volbě terapeutického postupu. Řada studií však prokázala, že korelace mezi GS vzorku biopsie a patologickým GS je nedostatečná [7–11].
Při studiu skupiny pacientů s GS/biopsie 6 (kteří jsou obvykle považováni za homogenní populaci) jsme zjistili, že na základě vyšší hladiny PSA a většího objemu tumoru (definováno jako větší počet vzorků nebo větší procentuální zasažení jakéhokoliv ze vzorků) lze predikovat, že při prostatektomii bude GS upgraded (k čemuž došlo u 50 % pacientů s GS vzorku biopsie 6). Rovněž u mužů s karcinomy vyššího grade (GS ≥ 7), detekovanými na základě biopsie prostaty, představovaly PSA i objem tumoru signifikantní predikátory upgradingu. Za signifikantní lze považovat rovněž přítomnost perineurální invaze, absenci HGPIN a vyšší věk pacienta.
V této studii byla u pacientů s GS/biopsie ≥ 7 prokázána podobná souvislost mezi GS ze vzorku biopsie a patologickým GS ≥ 7 (oproti pacientům s GS/biopsie 6) (55,2 % vs 50 %, p = 0,144). K upgradingu došlo přesto u 26,2 % pacientů a downgrading, které není u pacientů s GS 6 při současném užívání Gleasonova skórovacího systému možné, bylo zaznamenáno u 18,6 % pacientů s karcinomy středního a vysokého grade.
Tato zjištění mají signifikantní důsledky zejména pro ty pacienty, u nichž je indikována léčba bez benefitu kompetentních informací histologického vyšetření vzorku získaného při prostatektomii. Téměř u poloviny pacientů tedy bude karcinom ve skutečnosti vykazovat jiné známky agresivity, než předpokládáme. Největší změnou grade byla záměna pořadí primárního a sekundárního skóre u karcinomu s GS/biopsie 7, přestože v tomto případě bývá častější výskyt upgradingu. Vzhledem k tomu, že bylo jasně prokázáno, že karcinom s GS 4 + 3 = 7 má významně horší prognózu než GS 3 + 4 = 7, neměli bychom důsledky této skutečnosti podceňovat. V nedávné době byl prokázán rovněž negativní prognostický dopad terciárního GS 5, který byl zaznamenán u 18 (1,9 %) jedinců, z celkem 960 pacientů s GS 7 [12].
V současné době je zpochybňována rovněž souvislost mezi PSA a přítomností/objemem karcinomu prostaty. Některé starší studie uvádějí, že vyšší hladina PSA nijak nesouvisí s upgradingem [13–14]. V naší studii jsme však naopak dospěli k závěru, že pacienti s vyšším PSA byli mnohem častěji uprgraded. Řada starších studií prokázala, že pokud uvážíme rozsah biopsie, nepředstavuje objem karcinomu zjištěný při biopsii predikátor upgradingu [13–16], zatímco naše studie prokázala jasnou souvislost mezi větším objemem karcinomu při biopsii a klinicky signifikantním upgradingem.
Dále je zpochybňován význam perineurální invaze. Pacienti, u nichž biopsie prokázala tento nález, však byli upgraded a s velkou pravděpodobností u nich nebyl přítomen zánět ani HGPIN. Na druhou stranu downgraded pacienti měli větší prostatu a menší objem karcinomu (při biopsii). Většina pacientů podstoupila rozsáhlejší biopsii (10 nebo více vzorků), větší počet odebraných vzorků však v této studii nevedl ke zlepšení přesnosti stanovení grade.
Pacienti, jejichž karcinom má ve skutečnosti vyšší grade, než bylo stanoveno na základě biopsie, mají vyšší riziko nepříznivého patologického výsledku a vzniku biochemické recidivy po výkonu bez ohledu na to, zda je skutečný stav karcinomu znám, nebo nikoli. Neschopnost identifikovat toto riziko u pacientů bez adekvátního patologického stagingu (tj. prostatektomie) snižuje možnost predikce rizika u značného počtu pacientů, u nichž je známo GS pouze z biopsie.
Naše studie má několik omezení, jako jsou například její retrospektivní povaha a lokalizace v jediné instituci. Vzhledem k tomu, že úplnou patologickou informaci máme k dispozici pouze u pacientů, kteří podstoupí radikální prostatektomii, existuje možnost, že pacienti zařazení do programu aktivního sledování nebo podstupující neinvazivní léčbu mohou mít lepší nebo horší korelaci GS vzorku biopsie se skutečným stavem onemocnění, i když by se to zdálo nepravděpodobné. Údaje týkající se doby přežití bez biochemické recidivy nebyly dostačující a zahrnovaly pouze krátké období na to, aby mohly být považovány za signifikantní, tento problém však není předmětem tohoto výzkumu. Patologické údaje vycházely z patologických záznamů (jejich případná interpretace byla mimo možnosti tohoto výzkumu) – je tedy možné, že u některých pacientů byla přítomna, ovšem nezaznamenána, HGPIN, zejména zánět. Zdá se však nepravděpodobné, že by tento nález byl v různých skupinách rozdílný. Patologové postupovali na základě standardizovaných protokolů, aby byla minimalizována rozdílnost v přístupu (interobserver variability), tato skutečnost však může být další limitací studie.
ZÁVĚR
Jak jsme prokázali pomocí patologického GS stanoveného na základě vzorku odebraného při prostatektomii, celková přesnost GS ze vzorku biopsie je velmi omezená – téměř u poloviny pacientů byl přítomen karcinom nižšího/vyššího stadia, než bylo stanoveno na základě biopsie. Jakákoli nepřesnost může vést lékaře i pacienta k volbě odlišného léčebného postupu, než jaký by byl indikován v případě znalosti skutečného patologického stadia karcinomu.
Vyšší hladina PSA, menší velikost prostaty a větší objem karcinomu při biopsii – všechny tyto faktory mohou signalizovat přítomnost karcinomu vyššího grade. V případě, že biopsie prokáže přítomnost zánětu nebo karcinomu o nižším objemu, může naopak docházet k falešnému nadhodnocení Gleasonova skóre.
Tato skutečnost má významný dopad na volbu léčby karcinomu prostaty, zejména u pacientů, u nichž je léčba indikována bez znalosti skutečného Gleasonova skóre stanoveného na základě vyšetření vzorku prostatektomie.
Zkratky a akronymy
- PSA prostatický specifický antigen
- RP radikální prostatektomie
- GS Gleasonovo skóre
- DRE digitální rektální vyšetření
- HGPIN prostatická intraepiteliální
- neoplazie vysokého grade
- TRUS bx transrektální ultrazvuková biopsie
- AS aktivní sledování
- PCa karcinom prostaty
J. Stephen Jones, MD, FACS
Cleveland Clinic Glickman Urological
& Kidney Institute
Associate Professor of Surgery (Urology)
Cleveland Clinic Lerner College of Medicine at CWRU
Building Q, 9500 Euclid Avenue
Cleveland, OH 44195
JONESS7@ccf.org
Sources
1. Rubin MA, Bismar TA, Curtis S et al. Prostate needle biopsy reporting: how are the surgical members of the Society of Urologic Oncology using pathology reports to guide treatment of prostate cancer patients? Am J Surg Pathol 2004; 28(7): 946–952.
2. Epstein JI, Partin AW, Sauvageot J et al. Prediction of progression following radical prostatectomy. A multivariate analysis of 721 men with long-term follow-up. Am J Surg Pathol 1996; 20(3): 286–292.
3. Oesterling JE, Brendler CB, Epstein JI et al. Correlation of clinical stage, serum prostatic acid phosphatase and preoperative Gleason grade with final pathological stage in 275 patients with clinically localized adenocarcinoma of the prostate. J Urol 1987; 138(1): 92–98.
4. Schmid H, Oberpenning F, Pummer K. Diagnosis and staging of prostatic carcinoma: what is really necessary? Urol Int 1999; 63(1): 57–61.
5. Herman CM, Kattan MW, Ohori M et al. Primary Gleason pattern as a predictor of disease progression in gleason score 7 prostate cancer: a multivariate analysis of 823 men treated with radical prostatectomy. Am J Surg Pathol 2001; 25(5): 657–660.
6. Partin AW, Kattan MW, Subong EN et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA 1997; 277(18): 1445–1451.
7. Fukagai T, Namiki T, Namiki H et al. Discrepancies between Gleason scores of needle biopsy and radical prostatectomy specimens. Pathol Int 2001; 51(5): 364–370.
8. Altay B, Kefi A, Nazli O et al. Comparison of Gleason scores from sextant prostate biopsies and radical prostatectomy specimens. Urol Int 2001; 67(1): 14–18.
9. MontesinoSM, JimenezAJ, ReparazRB et al. Correlation between Gleason score on prostate biopsies diagnostic of adenocarcinoma and radical prostatectomy specimens. Arch Esp Urol 2004; 57(5): 519–523.
10. Arellano L, Castillo O, Metrebian E. Concordance of Gleason histological scoring for prostatic cancer in needle biopsies and the surgical piece obtained during radical prostatectomy. Rev Med Chil 2004; 132(8): 971–978.
11. Cookson MS, Fleshner NE, Soloway SM et al. Correlation between Gleason score of needle biopsy and radical prostatectomy specimen: accuracy and clinical implications. J Urol 1997; 157(2): 559–562.
12. Mosse CA, Magi-Galluzzi C, Tsuzuki T et al. The prognostic significance of tertiary Gleason pattern 5 in radical prostatectomy specimens. Am J Surg Pathol 2004; 28(3): 394–398.
13. Mian BM, Lehr DJ, Moore CK et al. Role of prostate biopsy schemes in accurate prediction of Gleason scores. Urology 2006; 67(2): 379–83.
14. King CR, McNeal JE, Gill H et al. Extended prostate biopsy scheme improves reliability of Gleason grading: implications for radiotherapy patients. Int J Radiat Oncol Biol Phys 2004; 59(2): 386–391.
15. Carlson GD, Calvanese CB, Kahane H et al. Accuracy of biopsy Gleason scores from a large uropathology laboratory: use of a diagnostic protocol to minimize observer variability. Urology 1998; 51(4): 525–529.
16. Kojima M, Troncoso P, Babaian RJ. Use of prostate-specific antigen and tumor volume in predicting needle biopsy grading error. Urology 1995; 45(5): 807–812.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2010 Issue 1-
All articles in this issue
- DIAGNOSIS OF PROSTATE CANCER AND PCA3
- PROSTATE BIOPSY CLINICAL AND PATHOLOGICAL VARIABLES THAT PREDICT SIGNIFICANT GRADING CHANGES IN THE CONTEMPORARY ERA
- SURGICAL TECHNIQUE FOR LAPAROSCOPIC ADRENALECTOMY
- TECHNICAL ASPECTS OF PERFORMING OF TRANSPERITONEAL LAPAROSCOPIC NEPHRECTOMY
- LAPAROSCOPIC PARTIAL NEPHRECTOMY
- RECONSTRUCTIVE LAPAROSCOPY IN PEDIATRIC UROLOGY
- LAPAROSCOPIC RECONSTRUCTION SURGERY OF UPPER URINARY SYSTEM IN CHILDREN – TECHNICAL ASPECTS
- RETROPERITONEOSCOPY
- LAPAROSCOPIC STONE SURGERY
- COMPLICATIONS IN RENAL CARCINOMA MANAGEMENT
- PSYCHOLOGICAL MECHANISM IN PATIENTS SUFFERING WITH CANCER AND BASIC PRINCIPLES OF COMMUNICATION IN INDIVIDUAL PHASES
- OUTCOMES RESEARCH IN UROLOGY
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- SURGICAL TECHNIQUE FOR LAPAROSCOPIC ADRENALECTOMY
- LAPAROSCOPIC PARTIAL NEPHRECTOMY
- LAPAROSCOPIC RECONSTRUCTION SURGERY OF UPPER URINARY SYSTEM IN CHILDREN – TECHNICAL ASPECTS
- TECHNICAL ASPECTS OF PERFORMING OF TRANSPERITONEAL LAPAROSCOPIC NEPHRECTOMY
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

