-
Medical journals
- Career
PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
: MUDr. Michal Staník
: Urologická klinika LF MU a FN Brno pracoviště Bohunice
: Urol List 2006; 4(4): 14-18
Autor podává přehled současných poznatků týkajících se indikace, rozsahu a přínosu pánevní lymfadenektomie u karcinomu prostaty. S nástupem PSA diagnostiky výrazně poklesl záchyt uzlinových metastáz při radikální prostatektomii. V nedávné době se objevily studie, které konstatují, že udávané výsledky jsou podhodnoceny omezeným rozsahem pánevní lymfadenektomie. Rozšířením lymfadenektomie o vnitřní ilické uzliny se zachytí větší počet uzlinových metastáz a ukazuje se, že tento postup může vést i ke zlepšení prognózy pacientů, hlavně při minimálním rozsahu metastatického postižení. Nicméně kontroverze ohledně její indikace přetrvávají. U většiny pacientů je pánevní lymfadenektomie nadbytečná, a proto jsou na základě údajů vycházejících z rozšířené lymfadenektomie vyvíjeny nomogramy k predikci uzlinových metastáz. Alternativou k standardnímu provedení lymfadenektomie se jeví koncept disekce sentinelové uzliny, při které - pokud je strážní uzlina bez nálezu nádorových buněk - je možné vyloučit další metastázy a od kompletní lymfadenektomie ustoupit.
KLÍČOVÁ SLOVA:
karcinom prostaty, radikální prostatektomie, limitovaná a rozšířená pánevní, lymfadenektomie, uzlinové metastázyÚVOD
Radikální prostatektomie (RAPE) je efektivní léčebnou možností u pacientů s klinicky lokalizovaným karcinomem prostaty. Dobře známý je nepříznivý vliv nálezu uzlinových metastáz na prognózu onemocnění [1]. Až do nedávné doby byla ale pánevní lymfadenektomie (PLE) jako součást RAPE považovaná jenom za stagingovou proceduru a nebyl prokázán její terapeutický přínos.
Obecně vychází PLE z ověřených principů onkologické chirurgie - systematická disekce regionálních lymfatických uzlin primárního tumoru poskytuje kontrolu lokálních recidiv i zlepšení přežití stejně jako např. u melanomu, nádoru prsu, žaludku nebo močového měchýře [2]. Kontroverze přetrvává v otázce rozsahu pánevní lymfadenektomie a její správné indikace.
V éře před PSA se využívala lymfadenektomie k identifikaci pacientů s uzlinovými metastázami, u kterých se následně upustilo od radikální prostatektomie. Protože se v té době jednalo o výkon s vysokou morbiditou, byla zahájena systémová léčba. Přestože byly již tehdy známy studie o drénujících uzlinách nádoru prostaty - externí a interní ilické uzliny, obturatorní a presakrální - omezila se lymfadenektomie jenom na obturatorní jámu s cílem snížit morbiditu, čímž se ale snížila její senzitivita.
S nástupem éry PSA a vylepšením operační techniky vedla pánevní lymfadenektomie nejenom ke zlepšení stagingu, ale pacienti s uzlinovými metastázami měli po RAPE benefit z adjuvantní systémové léčby. Plošný PSA screening znamenal posun v stadiích karcinomu prostaty, diagnostikovala se onemocnění s menším objemem lokalizovaná na prostatu, prudce poklesl i počet pacientů s pozitivními lymfatickými uzlinami (LU), z 20–40 % v éře před PSA na současných 1–7 % pacientů [3]. Na základě objemných operačních souborů pacientů, u kterých byla provedena RAPE s PLE v rozsahu obturatorní jámy, byly vypracovány nomogramy k predikci rizika uzlinových metastáz a lymfadenektomie byla prováděná jen u vysoce rizikových pacientů (PSA > 10 ng/ml, Gleasonovo skóre ≥ 7, stadium ≥ cT2a). Tento koncept je ale v poslední době konfrontován se studiemi, které potvrdily, že při rozšíření templátu lymfadenektomie o interní ilické lymfatické uzliny se zachytí větší počet uzlinových metastáz a je možný i terapeutický efekt se zlepšením přežití [1,3,4]. S tím souhlasí i data, podle kterých dojde u přibližně 30 % pacientů po RAPE k recidivě, u části z nich se jedná pravděpodobně o progresi okultních uzlinových metastáz.
ROZSAH LYMFADENEKTOMIE
Anatomické a lymfografické studie prokáaly, že lymfatická drenáž prostaty je komplexní. Lymfatické cévy tvoří periprostatickou subkapsulární síť, která se do okolí šíří 3 směry: ascendentně z kraniální části prostaty do zevních ilických uzlin, laterálně do vnitřních ilických uzlin a posteriorně z kaudální části prostaty do presakrálních uzlin.
Jako primární jsou označeny vnitřní ilické uzliny, sekundární jsou uzliny obturatorní a terciární pak zevní ilické uzliny [5]. Del Regato popsal dodatečnou drenáž apexu prostaty kolem vnitřních pudendálních cév drénujících do vnitřních ilických uzlin [6].
Standardní neboli limitovaná pánevní lymfadenektomie u karcinomu prostaty zahrnuje uzliny obturatorní jámy. Proximálním limitem disekce je větvení společných ilických cév, distálním limitem je v. iliaca circumflexa, ligamentum Cooperi a femorální kanál. Laterální hranici tvoří mediální stěna v. iliaca externa. Kaudálně se odstraní všechna tkáň kolem n. obturatorius, a pokud je to možné, ušetří se obturatorní cévy. Tento rozsah disekce je nedostatečný, protože nezahrnuje primární spádové uzliny.
Rozšířená lymfadenektomie oproti limitované obsahuje navíc disekci kolem vnitřních ilických cév a jejich větví (obr. 1).
1. Rozsah disekce u rozšířené pánevní lymfadenektomie, 1 - zevní ilické LU, 2 - obturatorní LU, 3 - vnitřní ilické LU [17]. ![Rozsah disekce u rozšířené pánevní lymfadenektomie, 1 - zevní ilické LU, 2 - obturatorní LU, 3 - vnitřní ilické LU [17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fdbe4eedcef953997de6058a69e1b79b.jpg)
Koncept rozšířené pánevní lymfadenektomie není nový, objevil se již před érou PSA [7]. V nedávné době několik skupin svými studiemi opět podpořilo důležitost disekce vnitřních ilických uzlin. Heidenreich et al uvádí, že při rozšířené PLE se zvýšil počet pacientů s uzlinovými metastázami na 26 % oproti 12 % u limitované disekce [8]. Podobně Stone et al popisuje 3krát vyšší incidenci pozitivních uzlin, 23 % při rozšířené PLE oproti 7,3 % při limitované [9].
Schumacher et al ve své studii u pacientů s rozšířenou pánevní lymfadenektomií s PSA < 10 ng/ml uvádí, že 31 % zachycených metastáz pocházelo výhradně z oblasti podél vnitřních ilických cév a dalších 43 % z oblasti obturatorní jámy nebo z míst podél zevní ilické vény [10]. Další autoři uvádějí obdobná čísla, asi 2/3 nalezených metastáz pochází z lokality podél vnitřních ilických cév a samostatně se jich v této lokalitě vyskytuje 20–30 % [4,11].
Při limitované PLE má tedy přibližně 30 % pacientů falešně negativní výsledek.
Odstranění presakrálních LU nepřináší výrazný benefit, protože jejich postižení je velice vzácné a disekce je časově náročná; podle Heidenreicha byly u 3 % pacientů nalezeny uzlinové metastázy v presakrální oblasti a podél společných ilických cév při mediánu PSA 15 [8].
Kritici rozšířené lymfadenektomie argumentují prodloužením operačního času i vyšší morbiditou. Bernská skupina uvádí prodloužení výkonu o 2krát 20 min a výskyt lymfokély, která vyžaduje drenáž kolem 2 %. Doporučují pečlivou ligaci lymfatik přicházejících z dolních končetin a zakládají pánevní drén na každou stranu [10]. Briganti et al v multicentrické studii popisuje vyšší výskyt komplikací pří rozšířené PLE, a to 19,8 % oproti 8,2 % při limitované PLE. Signifikantně vyšší byl ale jenom výskyt lymfokély: 10,3 % oproti 4,6 %, navíc nebyl uveden jasný rozdíl mezi skutečnou lymfokélou a protrahovanou lymforeou z drénů [12]. Jeschke et al uvádí u 2,8 % pacientů trauma zevní ilické žíly a žádnou lymfokélu při laparoskopické PLE [13].
Počet odstraněných uzlin
Studie Di Blasia et al ukazuje, že počet odstraněných uzlin přímo souvisí s progresí onemocnění. Odstranění 13 a více uzlin nese nejmenší riziko progrese [14]. Bader et al publikovala obdobné výsledky a nejnižší riziko progrese uvádí při odstranění 10 a více uzlin a dvojnásobně vyšší riziko při počtu pod 4 [15]. Weingartner ve své autoptické studii poukázal, že minimální počet lymfatických uzlin, které se musí odstranit, aby mohla být pánevní lymfadenektomie považovaná za kompletní, je 20 [16].
Rozšířením templátu disekce se zvýšil počet odstraněných uzlin proti limitované lymfadenektomii. Mediány odstraněných uzlin v jednotlivých studiích jsou uvedeny v tab.
1. Přehled mediánu odstraněných uzlin a zachycených uzlinových metastáz u limitované a rozšířené pánevní lymfadenektomie. 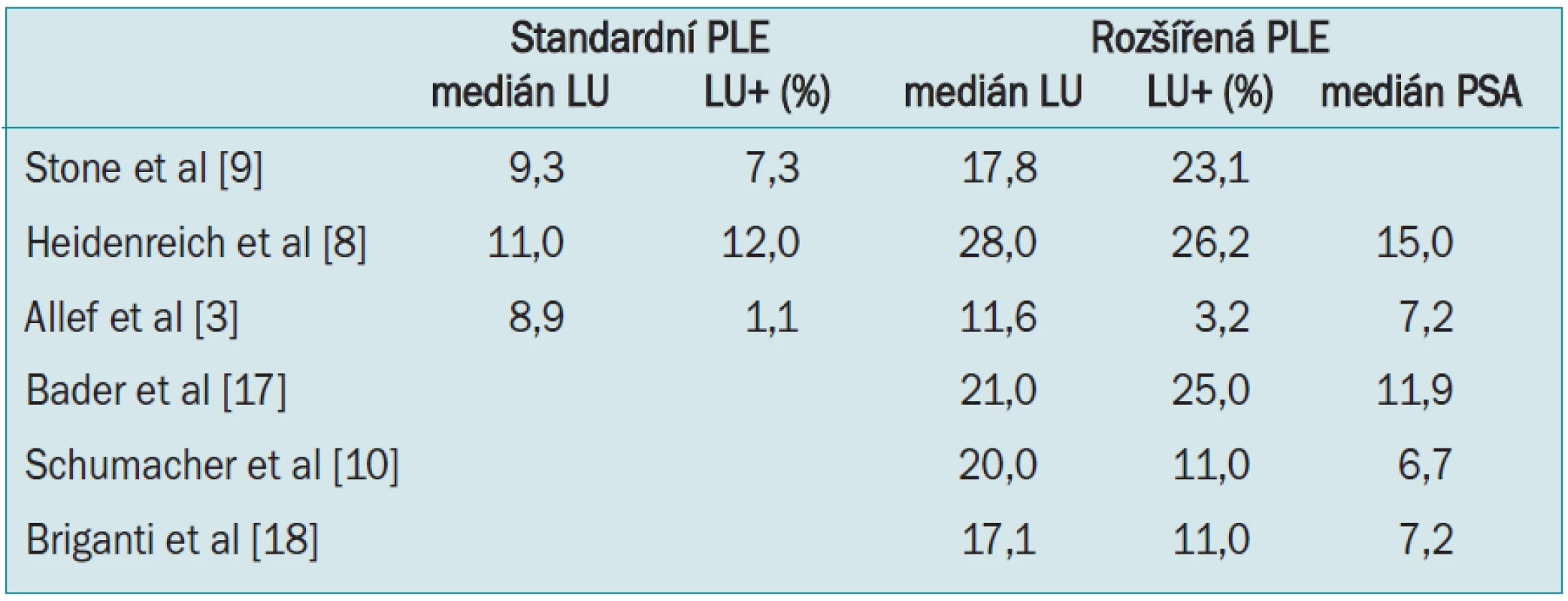
Počet vyšetřených uzlin se mění i podle způsobu zpracování materiálu. Vyšší záchyt bude zaznamenán v případě, v němž jsou zvlášť zpracovány uzliny z jednotlivých anatomických lokalit než při vyšetření paketu uzlin in toto, podobně jak to bylo zaznamenáno u karcinomu močového měchýře [19].
U koho provádět pánevní lymfadenektomii?
Pravděpodobně nikoli u všech pacientů. U skupiny s nízkým rizikem (PSA < 10 ng/ml, Gleasonovo skóre ≤ 7) je výskyt uzlinových metastáz velice vzácný jak podle nomogramů vycházejících z limitované disekce (0–1 %), tak i ze souboru s rozšířeným templátem disekce. Ve studii Bernské skupiny byla provedena u 231 pacientů s PSA < 10 ng/ml radikální prostatektomie s rozšířenou pánevní lymfadenektomií a pozitivní uzliny byly nalezeny u 11 % pacientů. U pacientů s Gleasonovým skóre (GS) ≤ 6 se jenom u 3 % vyskytly uzlinové metastázy, ale ve skupině s GS ≥ 7 až u 25 %. Autoři z toho vyvozují, že u této podskupiny pacientů, i při PSA ≤ 10 ng/ml, je nutná lymfadenektomie i s možností léčby mikrometastáz [10]. GS se přitom jeví jako silnější prognostický prediktor metastáz než PSA. Podobně Heidenreich et al uvádí 11,4 % pacientů s pozitivními uzlinami při PSA < 10 ng/ml, ale u podskupiny s GS ≤ 6 jen 2,4 % [8]. Ve studii Bhatta-Dharu mělo pouhé 1 % pacientů s PSA < 10 ng/ml a GS ≤ 6 uzlinové metastázy a autoři uvádějí, že riziko biochemické recidivy u této podskupiny pacientů je po pánevní lymfadenektomii stejné jako kdyby provedena nebyla. [20] Tuto podskupinu lze charakterizovat následujícím příkladem: u 3 pacientů ze 100 nalezneme při rozšířené disekci pozitivní uzliny, a pokud budeme uvažovat, že 1/3 z nich může mít prospěch z lymfadenektomie (což může být optimistický odhad), je nutno provést 100 lymfadenektomii pro zlepšení prognózy 1 pacienta.
Do úvahy při rozhodování, zda provádět lymfadenektomii, je nutné vzít i riziko podhodnocení gradingu a rozsahu onemocnění, které činí až 40 % [20]. Srovnáním nálezů z biopsie prostaty a definitivní histologie po RAPE Grossfeld et al zjistili, že u pacientů s bioptickým GS ≤ 6 došlo u 30 % k „upgradingu“ [21].
K predikci výskytu uzlinových metastáz slouží různé nomogramy. Ty tradiční, jako Partinovy tabulky, vycházejí jenom z limitované lymfadenektomie, a proto podhodnocují riziko uzlinových metastáz. Briganti et al vyvinul nomogram k předpovědi nálezu pozitivních uzlin při rozšířené lymfadenektomii s přesností 76 % [18]. Vycházel ze souboru 602 pacientů, u kterých byla provedena radikální prostatektomie s rozšířenou pánevní lymfadenektomií, s minimem 10 odstraněných uzlin. Vstupní parametry jsou stejné jako např. u Partinových tabulek - PSA, klinické stadium a Gleasonovo skóre. V této studii byl medián vyšetřených uzlin 17, medián PSA 7,2 ng/ml, 97 % pacientů mělo onemocnění lokalizované na prostatu a pacientů s pozitivními uzlinami bylo 11 %. Autoři dále upravili tento nomogram k predikci exkluzivních nonobturatorních uzlinových metastáz. Takový nomogram umožňuje lépe selektovat pacienty, u kterých není nutné provádět rozšířenou lymfadenektomii [22].
PŘÍNOS PÁNEVNÍ LYMFADENEKTOMIE
Pánevní lymfadenektomie přispívá ke zlepšení stagingu onemocnění, zlepšuje předpověď progrese onemocnění a identifikuje pacienty, kteří mají prospěch z okamžité adjuvantní léčby. Terapeutický efekt rozšířené pánevní lymfadenektomie u karcinomu prostaty ale není zatím jasně definován, nicméně jsou dostupná omezená data, která naznačují oddálení progrese onemocnění a zlepšení přežití, hlavně při minimálním postižení lymfatických uzlin.
Při nálezu mikrometastáz je nutné zvážit i možnost ovlivnění výsledků migrací stadií karcinomu prostaty - posun z falešně negativního N0 stadia (pTxN0) do stadia pTxN1. Pokud např. rozšířená PLE povede k záchytu většího počtu pacientů s malým objemem uzlinového postižení ve srovnání s limitovanou PLE, může u této skupiny dojít k prodloužení období bez progrese, ale nikoli ke zlepšení v přežití. Leadtime bias, tedy časová výhoda, kterou získáváme časnou diagnostikou karcinomu prostaty s mikrometastázami, může vymizet s délkou sledování.
Bernská skupina sledovala 92 pacientů s prokázanými uzlinovými metastázami, kteří neprodělali žádnou adjuvantní léčbu. 38,5 % pacientů s jedinou pozitivní uzlinou bylo bez známek progrese po 4 letech (medián 45 měsíců). Naopak jenom 10 % pacientů, kteří měli pozitivní 2 a více uzlin, bylo bez progrese [4].
Skupina z Johns Hopkins Hospital uvádí lepší prognózu pacienta při lymph node density pod 15 % (poměr pozitivních uzlin k počtu všech odstraněných uzlin).
5leté přežití bez progrese bylo 43 % u pacientů s uzlinovými metastázami při rozšířené lymfadenektomii oproti 10 % u limitované [23].
Ve studii Daneshmend et al z Los Angeles pacienti s 1 nebo 2 pozitivními uzlinami měli 10leté přežití bez recidivy ze 73 % oproti 49 % při postižení 5 a více uzlin. V této studii ale 31 % pacientů s uzlinovými metastázami prodělalo adjuvantní léčbu [1].
Několik studií naznačuje, že okamžitá androgenní blokáda po radikální prostatektomii u pacientů s uzlinovými metastázami je spojená se zlepšením přežití [24].
KONCEPT SENTINELOVÉ UZLINY U KARCINOMU PROSTATY
Koncept radioizotopem-vedené disekce sentinelové uzliny předpokládá, že lymfatická drenáž probíhá sekvenčně. Strážní uzlina, je první uzlina, kterou projdou nádorové buňky z primárního nádoru při diseminaci. Pokud je negativní sentinelová uzlina, pak můžeme předpokládat, že lymfatické řečiště distálně od ní je bez metastatického postižení. Metoda byla již úspěšně aplikována u karcinomu prsu, melanomu, v urologii je známa díky využití u karcinomu penisu.
V principu se před operací aplikují do periferní zóny prostaty koloidní částice značené radioizotopem technecia; radioizotop se šíři lymfatikami do strážních uzlin, které se scintigrafickou sondou zobrazí a naleznou při RAPE (obr. 2). Po odstranění těchto uzlin, pokud jsou negativní, lze poměrně bezpečně vyloučit další metastázy. V případě nálezu metastáz v sentinelové uzlině se pokračuje rozšířenou PLE.
2. Zobrazení pánevních sentinelových uzlin gamakamerou, 3 hod po aplikaci radioizotopu. 
Wawroschek et al vyšetřili touto metodou 350 pacientů, u 92,6 % z nich detekovali alespoň 1 sentinelovou uzlinu. Celkově 24,7 % pacientů mělo prokázané uzlinové metastázy, z toho 13 % s PSA < 10 ng/ml. Falešně negativní výsledky byly velice vzácné, jenom u 2 pacientů byly při negativní sentinelové uzlině nalezeny metastázy v jiné lokalitě. Senzitivita vyšetření byla 98 % [11].
Jeschke et al prokázali, že metodiku je možné uplatnit u laparoskopické RAPE. V souboru 72 pacientů nalezli u 12,9 % uzlinové metastázy, 72 % metastáz bylo mimo obturatorní jámu a všechny metastázy byly detekovány jenom v uzlinách označených radioizotopem. U 2 pacientů nebyla detekována žádná sentinelová uzlina. Průměrný operační čas disekce sentinelových uzlin byl 54 min. Jako výhodnější se jevil transperitoneální přístup, protože disekce vnitřních ilických uzlin byla preciznější, s nižším rizikem lymfokély [12].
ZÁVĚR
Rozšířená pánevní lymfadenektomie zachytí při léčbě lokalizovaného karcinomu prostaty větší počet uzlinových metastáz oproti standardní lymfadenektomii. Až 2/3 pacientů s metastázami má pozitivní uzliny podél vnitřních ilických cév, které nejsou zahrnuty v standardním rozsahu disekce. U nízce rizikové skupiny pacientů s PSA pod 10 ng/ml a Gleasonovým skóre pod 7 není nutné provádět lymfadenektomii, protože nález metastáz je velice vzácný. U ostatních pacientů je vhodné využívat nomogramy k predikci rizika uzlinového postižení a selektovat pacienty, kteří podstoupí rozšířenou pánevní lymfadenektomii, protože se jedná o zákrok s nezanedbatelnou morbiditou, která zároveň významně prodlužuje operační výkon. K potvrzení terapeutického benefitu lymfadenektomie jsou nutné randomizované studie a delší doba sledování.
Příslibem do budoucnosti jsou vylepšené zobrazovací techniky, kombinované zobrazení pozitronovou emisní tomografií a počítačovou tomografii a radioimunoscintigrafie, které by mohly být atraktivní, neinvazivní formou stagingu karcinomu prostaty.
MUDr. Michal Staník
Urologická klinika LF MU a FN Brno, pracoviště Bohunice
Sources
1. Daneshmand S, Quek ML, Stein JP et al. Prognosis of patients with lymph node positive prostate cancer following radical prostatectomy: long-term results. J Urol 2004; 172 : 2252-2255.
2. Skinner DG. Management of invasive bladder cancer: a meticulous pelvic node dissection can make a difference. J Urol 1982; 128 : 34-36.
3. Allaf ME, Palapattu GS, Trock BJ et al. Anatomical extent of lymph node dissection: impact on men with clinically localized prostate cancer. J Urol 2004; 172 : 1840.
4. Bader P, Buckhard FC, Markwalder R, Studer UE. Disease progression and survival of patients with positive lymph nodes after radical prostatectomy. Is there a chance of cure? J Urol 2003; 169 : 849-854.
5. Cerny J, Farah R, Rian R et al. An evaluation of lymphangiography in staging carcinoma of the prostate. J Urol 1975; 113 : 367.
6. DelRegato J, Ackermann L. Diagnosis, treatment and prognosis of cancer. 4th ed. St Louis: Mosby 1977 : 654.
7. Golimbu M, Morales P, Al-Askari S and Brown J. Extended pelvic lymphadenectomy for prostatic cancer. J Urol 1979; 121 : 617.
8. Heidenreich A, Varga Z, Von Knobloch R. Extended pelvic lymphadenectomy in patients undergoing radical prostatectomy: high incidence of lymph node metastasis. J Urol 2002; 167 : 1681.
9. Stone NN, Stock RG, Unger P. Laparoscopic pelvic lymph node dissection for prostate cancer: comparison of extended and modified techniques. J Urol 1997; 158 : 1891-1894.
10. Schumacher M, Burkhard F, Thalmann G, Fleischmann A, Studer U. Is pelvic lymph node dissection necessary in patients with a serum PSA < 10ng/ml undergoing radical prostatectomy for prostate cancer? Eur Urol 2006; 50 : 272-279.
11. Wawroschek F, Vogt H, Weckermann D et al. Radioisotope guided pelvic lymph node dissection for prostate cancer. J Urol 2001; 166 : 1715-1719.
12. Briganti A, Chun F, Salonia A et al. Complications and other surgical outcomes associated with extended pelvic lymphadenectomy in men with localized prostate cancor. Eur Urol 2006; 50 : 1006-1013.
13. Jeschke S, Nambirajan T, Leeb K et al. Detection of early lymph node metastases in prostate cancer by laparoscopic radioisotope-guided sentinel lymph node dissection. J Urol 2005; 173 : 1943-1946.
14. Di Blasio CJ, Fearn P, Seo HS et al. Association between number of lymph nodes removed and freedom from disease progression in patients receiving pelvic lymph node dissection during radical prostatectomy. J Urol 2003; 169 : 456(A1708).
15. Bader P, Spahn M, Huber R et al. Limited lymph node dissection in prostate cancer may miss lymph node metastasis and determines outcome of apparently pN0 prostate cancer. Eur Urol 2004; 3 : 16(A55).
16. Weingartner K, Ramaswamy A, Bittinger A et al. Anatomical basis for pelvic lymphadenectomy in prostate cancer: results of an autopsy and implications for the clinic. J Urol 1996; 156 : 1969.
17. Bader P, Burkhard FC, Markwalder R, Studer UE. Is a limited lymph node dissection an adequate staging procedure for prostate cancer. J Urol 2002; 168 : 514-518.
18. Briganti A, Chun F, Salonia A et al. Validation of a nomogram predicting the probability of lymph node invasion among patients undergoing radical prostatectomy and an extended pelvic lymphadenectomy. Eur Urol 2006; 49 : 1019.
19. Bochner BH, Herr HW, Reuter VE. Impact of separate versus en bloc pelvic lymph node dissection on the number of lymph nodes retrieved in cystectomy specimens. J Urol 2001; 166 : 2295.
20. Bhatta-Dhar N, Reuther A, Zippe C, Klein E. No difference in six-year biochemical faiulure rates with or without pelvic lymph node dissection during radical prostatectomy in low-risk patients with localized prostate cancer. Urology 2004; 63 : 528.
21. Grossfeld GD, Chang JJ, Broering JM, Li Y et al. Understaging and undergrading in a contemporary series of patients undergoing radical prostatectomy: results from the cancer of the prostate strategic urologic research endeavour database. J Urol 2001; 165 : 851-856.
22. Rigatti P, Chun F, Salonia A et al. A Nomogram for staging of exclusive nonobturator lymph node metastases in men with localized prostate cancer. Eur Urol 2006, v tisku.
23. Palapattu GS, Allaf ME, Trock BJ, Epstein JL and Walsh PC. Prostate specific antigen progression in men with lymph node metastases following radical prostatectomy: results of long-term followup. J Urol 2004; 172 : 1860.
24. Messing E, Manola J, Sarosdy M. Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. New Engl J Med 1999; 341 : 1781.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2006 Issue 4-
All articles in this issue
- WHAT'S NEW IN PROSTATE CANCER PATHOLOGY ASSESMENT IN 2006
- LYMPHATIC DRAINAGE OF THE PROSTATE
- PELVIC LYMPHADENECTOMY IN THE PROSTATE CARCINOMA AND ITS LIMITS
- PSA AND EARLY DETECTION OF PROSTATE CARCINOMA
- PATHOLOGY OF THE PROSTATE AND ANDROGEN AND ESTROGEN LEVELS
- EVIDENCE-BASED CLINICAL APPROACH TO ANDROGEN SUPPRESSION AND RADIOTHERAPY IN MALE PATIENTS WITH LOCALLY ADVANCED OR LOCALIZED CARCINOMA OF THE PROSTATE
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- PSA AND EARLY DETECTION OF PROSTATE CARCINOMA
- PELVIC LYMPHADENECTOMY IN THE PROSTATE CARCINOMA AND ITS LIMITS
- LYMPHATIC DRAINAGE OF THE PROSTATE
- PATHOLOGY OF THE PROSTATE AND ANDROGEN AND ESTROGEN LEVELS
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

