-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
PELVIC LYMPHADENECTOMY IN THE PROSTATE CARCINOMA AND ITS LIMITS
The article provides an overview of current knowledge of the indications for, and the extent and benefit of pelvic lymphadenectomy in prostate cancer. With the onset of PSA screening, the rate of lymph node metastases in radical prostatectomy has sharply declined. Some recent studies indicate that the reported results may be underrated due to a limited extent of pelvic lymphadenectomy. By extending lymphadenectomy to internal iliac lymph nodes more lymph node metastases could be obtained, and available data indicate that the procedure can improve the prognosis of the patient. However, there is still controversy as to the indication of lymphadenectomy, as the majority of patients do not need it. New nomograms based on data from extended lymphadenectomy have been developed to better predict the probability of lymph node metastases. The concept of the sentinel lymph node dissection appears to be an alternative to limited pelvic lymphadenectomy. If the sentinel node is free of tumour cells, further metastases can be excluded and performing extended lymphadenectomy becomes unnecessary.
KEY WORDS:
prostate cancer, radical prostatectomy, limited and extended pelvic, lymphadenectomy, lymph node metastases
Autoři: MUDr. Michal Staník
Působiště autorů: Urologická klinika LF MU a FN Brno pracoviště Bohunice
Vyšlo v časopise: Urol List 2006; 4(4): 14-18
Souhrn
Autor podává přehled současných poznatků týkajících se indikace, rozsahu a přínosu pánevní lymfadenektomie u karcinomu prostaty. S nástupem PSA diagnostiky výrazně poklesl záchyt uzlinových metastáz při radikální prostatektomii. V nedávné době se objevily studie, které konstatují, že udávané výsledky jsou podhodnoceny omezeným rozsahem pánevní lymfadenektomie. Rozšířením lymfadenektomie o vnitřní ilické uzliny se zachytí větší počet uzlinových metastáz a ukazuje se, že tento postup může vést i ke zlepšení prognózy pacientů, hlavně při minimálním rozsahu metastatického postižení. Nicméně kontroverze ohledně její indikace přetrvávají. U většiny pacientů je pánevní lymfadenektomie nadbytečná, a proto jsou na základě údajů vycházejících z rozšířené lymfadenektomie vyvíjeny nomogramy k predikci uzlinových metastáz. Alternativou k standardnímu provedení lymfadenektomie se jeví koncept disekce sentinelové uzliny, při které - pokud je strážní uzlina bez nálezu nádorových buněk - je možné vyloučit další metastázy a od kompletní lymfadenektomie ustoupit.
KLÍČOVÁ SLOVA:
karcinom prostaty, radikální prostatektomie, limitovaná a rozšířená pánevní, lymfadenektomie, uzlinové metastázyÚVOD
Radikální prostatektomie (RAPE) je efektivní léčebnou možností u pacientů s klinicky lokalizovaným karcinomem prostaty. Dobře známý je nepříznivý vliv nálezu uzlinových metastáz na prognózu onemocnění [1]. Až do nedávné doby byla ale pánevní lymfadenektomie (PLE) jako součást RAPE považovaná jenom za stagingovou proceduru a nebyl prokázán její terapeutický přínos.
Obecně vychází PLE z ověřených principů onkologické chirurgie - systematická disekce regionálních lymfatických uzlin primárního tumoru poskytuje kontrolu lokálních recidiv i zlepšení přežití stejně jako např. u melanomu, nádoru prsu, žaludku nebo močového měchýře [2]. Kontroverze přetrvává v otázce rozsahu pánevní lymfadenektomie a její správné indikace.
V éře před PSA se využívala lymfadenektomie k identifikaci pacientů s uzlinovými metastázami, u kterých se následně upustilo od radikální prostatektomie. Protože se v té době jednalo o výkon s vysokou morbiditou, byla zahájena systémová léčba. Přestože byly již tehdy známy studie o drénujících uzlinách nádoru prostaty - externí a interní ilické uzliny, obturatorní a presakrální - omezila se lymfadenektomie jenom na obturatorní jámu s cílem snížit morbiditu, čímž se ale snížila její senzitivita.
S nástupem éry PSA a vylepšením operační techniky vedla pánevní lymfadenektomie nejenom ke zlepšení stagingu, ale pacienti s uzlinovými metastázami měli po RAPE benefit z adjuvantní systémové léčby. Plošný PSA screening znamenal posun v stadiích karcinomu prostaty, diagnostikovala se onemocnění s menším objemem lokalizovaná na prostatu, prudce poklesl i počet pacientů s pozitivními lymfatickými uzlinami (LU), z 20–40 % v éře před PSA na současných 1–7 % pacientů [3]. Na základě objemných operačních souborů pacientů, u kterých byla provedena RAPE s PLE v rozsahu obturatorní jámy, byly vypracovány nomogramy k predikci rizika uzlinových metastáz a lymfadenektomie byla prováděná jen u vysoce rizikových pacientů (PSA > 10 ng/ml, Gleasonovo skóre ≥ 7, stadium ≥ cT2a). Tento koncept je ale v poslední době konfrontován se studiemi, které potvrdily, že při rozšíření templátu lymfadenektomie o interní ilické lymfatické uzliny se zachytí větší počet uzlinových metastáz a je možný i terapeutický efekt se zlepšením přežití [1,3,4]. S tím souhlasí i data, podle kterých dojde u přibližně 30 % pacientů po RAPE k recidivě, u části z nich se jedná pravděpodobně o progresi okultních uzlinových metastáz.
ROZSAH LYMFADENEKTOMIE
Anatomické a lymfografické studie prokáaly, že lymfatická drenáž prostaty je komplexní. Lymfatické cévy tvoří periprostatickou subkapsulární síť, která se do okolí šíří 3 směry: ascendentně z kraniální části prostaty do zevních ilických uzlin, laterálně do vnitřních ilických uzlin a posteriorně z kaudální části prostaty do presakrálních uzlin.
Jako primární jsou označeny vnitřní ilické uzliny, sekundární jsou uzliny obturatorní a terciární pak zevní ilické uzliny [5]. Del Regato popsal dodatečnou drenáž apexu prostaty kolem vnitřních pudendálních cév drénujících do vnitřních ilických uzlin [6].
Standardní neboli limitovaná pánevní lymfadenektomie u karcinomu prostaty zahrnuje uzliny obturatorní jámy. Proximálním limitem disekce je větvení společných ilických cév, distálním limitem je v. iliaca circumflexa, ligamentum Cooperi a femorální kanál. Laterální hranici tvoří mediální stěna v. iliaca externa. Kaudálně se odstraní všechna tkáň kolem n. obturatorius, a pokud je to možné, ušetří se obturatorní cévy. Tento rozsah disekce je nedostatečný, protože nezahrnuje primární spádové uzliny.
Rozšířená lymfadenektomie oproti limitované obsahuje navíc disekci kolem vnitřních ilických cév a jejich větví (obr. 1).
Obr. 1. Rozsah disekce u rozšířené pánevní lymfadenektomie, 1 - zevní ilické LU, 2 - obturatorní LU, 3 - vnitřní ilické LU [17]. ![Rozsah disekce u rozšířené pánevní lymfadenektomie, 1 - zevní ilické LU, 2 - obturatorní LU, 3 - vnitřní ilické LU [17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/fdbe4eedcef953997de6058a69e1b79b.jpg)
Koncept rozšířené pánevní lymfadenektomie není nový, objevil se již před érou PSA [7]. V nedávné době několik skupin svými studiemi opět podpořilo důležitost disekce vnitřních ilických uzlin. Heidenreich et al uvádí, že při rozšířené PLE se zvýšil počet pacientů s uzlinovými metastázami na 26 % oproti 12 % u limitované disekce [8]. Podobně Stone et al popisuje 3krát vyšší incidenci pozitivních uzlin, 23 % při rozšířené PLE oproti 7,3 % při limitované [9].
Schumacher et al ve své studii u pacientů s rozšířenou pánevní lymfadenektomií s PSA < 10 ng/ml uvádí, že 31 % zachycených metastáz pocházelo výhradně z oblasti podél vnitřních ilických cév a dalších 43 % z oblasti obturatorní jámy nebo z míst podél zevní ilické vény [10]. Další autoři uvádějí obdobná čísla, asi 2/3 nalezených metastáz pochází z lokality podél vnitřních ilických cév a samostatně se jich v této lokalitě vyskytuje 20–30 % [4,11].
Při limitované PLE má tedy přibližně 30 % pacientů falešně negativní výsledek.
Odstranění presakrálních LU nepřináší výrazný benefit, protože jejich postižení je velice vzácné a disekce je časově náročná; podle Heidenreicha byly u 3 % pacientů nalezeny uzlinové metastázy v presakrální oblasti a podél společných ilických cév při mediánu PSA 15 [8].
Kritici rozšířené lymfadenektomie argumentují prodloužením operačního času i vyšší morbiditou. Bernská skupina uvádí prodloužení výkonu o 2krát 20 min a výskyt lymfokély, která vyžaduje drenáž kolem 2 %. Doporučují pečlivou ligaci lymfatik přicházejících z dolních končetin a zakládají pánevní drén na každou stranu [10]. Briganti et al v multicentrické studii popisuje vyšší výskyt komplikací pří rozšířené PLE, a to 19,8 % oproti 8,2 % při limitované PLE. Signifikantně vyšší byl ale jenom výskyt lymfokély: 10,3 % oproti 4,6 %, navíc nebyl uveden jasný rozdíl mezi skutečnou lymfokélou a protrahovanou lymforeou z drénů [12]. Jeschke et al uvádí u 2,8 % pacientů trauma zevní ilické žíly a žádnou lymfokélu při laparoskopické PLE [13].
Počet odstraněných uzlin
Studie Di Blasia et al ukazuje, že počet odstraněných uzlin přímo souvisí s progresí onemocnění. Odstranění 13 a více uzlin nese nejmenší riziko progrese [14]. Bader et al publikovala obdobné výsledky a nejnižší riziko progrese uvádí při odstranění 10 a více uzlin a dvojnásobně vyšší riziko při počtu pod 4 [15]. Weingartner ve své autoptické studii poukázal, že minimální počet lymfatických uzlin, které se musí odstranit, aby mohla být pánevní lymfadenektomie považovaná za kompletní, je 20 [16].
Rozšířením templátu disekce se zvýšil počet odstraněných uzlin proti limitované lymfadenektomii. Mediány odstraněných uzlin v jednotlivých studiích jsou uvedeny v tab.
Tab. 1. Přehled mediánu odstraněných uzlin a zachycených uzlinových metastáz u limitované a rozšířené pánevní lymfadenektomie. 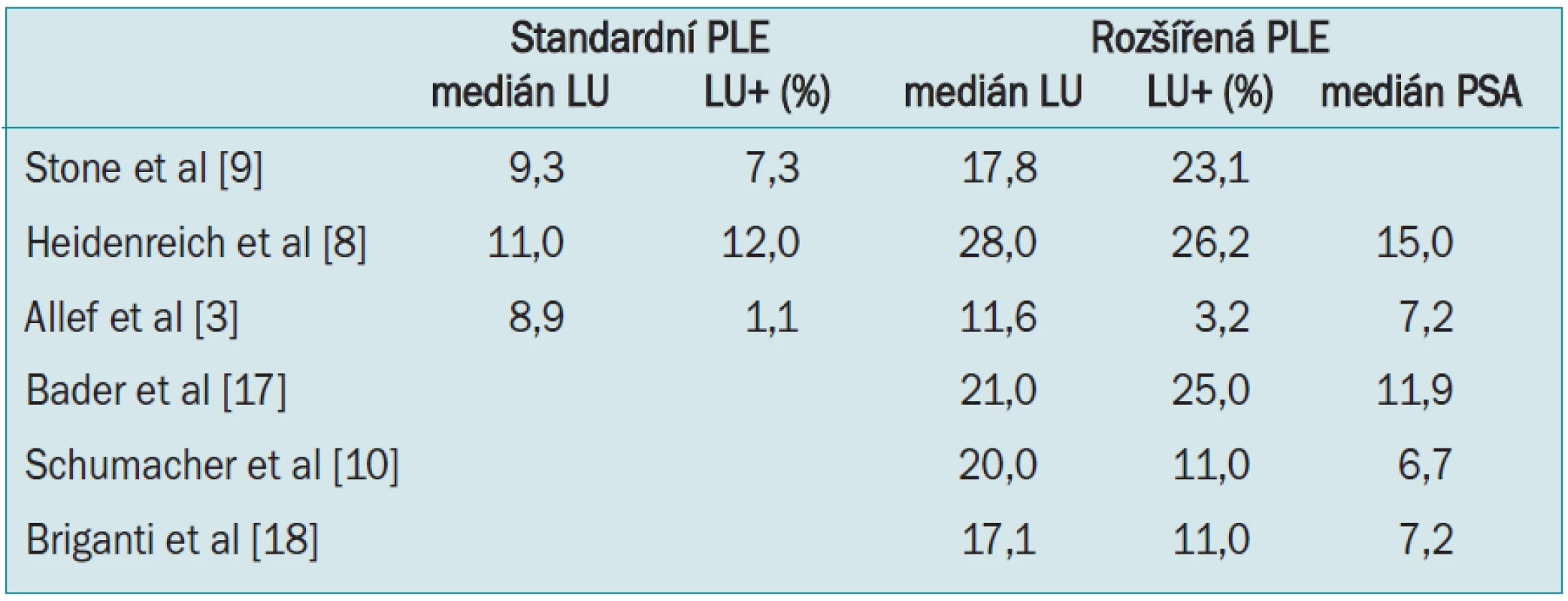
Počet vyšetřených uzlin se mění i podle způsobu zpracování materiálu. Vyšší záchyt bude zaznamenán v případě, v němž jsou zvlášť zpracovány uzliny z jednotlivých anatomických lokalit než při vyšetření paketu uzlin in toto, podobně jak to bylo zaznamenáno u karcinomu močového měchýře [19].
U koho provádět pánevní lymfadenektomii?
Pravděpodobně nikoli u všech pacientů. U skupiny s nízkým rizikem (PSA < 10 ng/ml, Gleasonovo skóre ≤ 7) je výskyt uzlinových metastáz velice vzácný jak podle nomogramů vycházejících z limitované disekce (0–1 %), tak i ze souboru s rozšířeným templátem disekce. Ve studii Bernské skupiny byla provedena u 231 pacientů s PSA < 10 ng/ml radikální prostatektomie s rozšířenou pánevní lymfadenektomií a pozitivní uzliny byly nalezeny u 11 % pacientů. U pacientů s Gleasonovým skóre (GS) ≤ 6 se jenom u 3 % vyskytly uzlinové metastázy, ale ve skupině s GS ≥ 7 až u 25 %. Autoři z toho vyvozují, že u této podskupiny pacientů, i při PSA ≤ 10 ng/ml, je nutná lymfadenektomie i s možností léčby mikrometastáz [10]. GS se přitom jeví jako silnější prognostický prediktor metastáz než PSA. Podobně Heidenreich et al uvádí 11,4 % pacientů s pozitivními uzlinami při PSA < 10 ng/ml, ale u podskupiny s GS ≤ 6 jen 2,4 % [8]. Ve studii Bhatta-Dharu mělo pouhé 1 % pacientů s PSA < 10 ng/ml a GS ≤ 6 uzlinové metastázy a autoři uvádějí, že riziko biochemické recidivy u této podskupiny pacientů je po pánevní lymfadenektomii stejné jako kdyby provedena nebyla. [20] Tuto podskupinu lze charakterizovat následujícím příkladem: u 3 pacientů ze 100 nalezneme při rozšířené disekci pozitivní uzliny, a pokud budeme uvažovat, že 1/3 z nich může mít prospěch z lymfadenektomie (což může být optimistický odhad), je nutno provést 100 lymfadenektomii pro zlepšení prognózy 1 pacienta.
Do úvahy při rozhodování, zda provádět lymfadenektomii, je nutné vzít i riziko podhodnocení gradingu a rozsahu onemocnění, které činí až 40 % [20]. Srovnáním nálezů z biopsie prostaty a definitivní histologie po RAPE Grossfeld et al zjistili, že u pacientů s bioptickým GS ≤ 6 došlo u 30 % k „upgradingu“ [21].
K predikci výskytu uzlinových metastáz slouží různé nomogramy. Ty tradiční, jako Partinovy tabulky, vycházejí jenom z limitované lymfadenektomie, a proto podhodnocují riziko uzlinových metastáz. Briganti et al vyvinul nomogram k předpovědi nálezu pozitivních uzlin při rozšířené lymfadenektomii s přesností 76 % [18]. Vycházel ze souboru 602 pacientů, u kterých byla provedena radikální prostatektomie s rozšířenou pánevní lymfadenektomií, s minimem 10 odstraněných uzlin. Vstupní parametry jsou stejné jako např. u Partinových tabulek - PSA, klinické stadium a Gleasonovo skóre. V této studii byl medián vyšetřených uzlin 17, medián PSA 7,2 ng/ml, 97 % pacientů mělo onemocnění lokalizované na prostatu a pacientů s pozitivními uzlinami bylo 11 %. Autoři dále upravili tento nomogram k predikci exkluzivních nonobturatorních uzlinových metastáz. Takový nomogram umožňuje lépe selektovat pacienty, u kterých není nutné provádět rozšířenou lymfadenektomii [22].
PŘÍNOS PÁNEVNÍ LYMFADENEKTOMIE
Pánevní lymfadenektomie přispívá ke zlepšení stagingu onemocnění, zlepšuje předpověď progrese onemocnění a identifikuje pacienty, kteří mají prospěch z okamžité adjuvantní léčby. Terapeutický efekt rozšířené pánevní lymfadenektomie u karcinomu prostaty ale není zatím jasně definován, nicméně jsou dostupná omezená data, která naznačují oddálení progrese onemocnění a zlepšení přežití, hlavně při minimálním postižení lymfatických uzlin.
Při nálezu mikrometastáz je nutné zvážit i možnost ovlivnění výsledků migrací stadií karcinomu prostaty - posun z falešně negativního N0 stadia (pTxN0) do stadia pTxN1. Pokud např. rozšířená PLE povede k záchytu většího počtu pacientů s malým objemem uzlinového postižení ve srovnání s limitovanou PLE, může u této skupiny dojít k prodloužení období bez progrese, ale nikoli ke zlepšení v přežití. Leadtime bias, tedy časová výhoda, kterou získáváme časnou diagnostikou karcinomu prostaty s mikrometastázami, může vymizet s délkou sledování.
Bernská skupina sledovala 92 pacientů s prokázanými uzlinovými metastázami, kteří neprodělali žádnou adjuvantní léčbu. 38,5 % pacientů s jedinou pozitivní uzlinou bylo bez známek progrese po 4 letech (medián 45 měsíců). Naopak jenom 10 % pacientů, kteří měli pozitivní 2 a více uzlin, bylo bez progrese [4].
Skupina z Johns Hopkins Hospital uvádí lepší prognózu pacienta při lymph node density pod 15 % (poměr pozitivních uzlin k počtu všech odstraněných uzlin).
5leté přežití bez progrese bylo 43 % u pacientů s uzlinovými metastázami při rozšířené lymfadenektomii oproti 10 % u limitované [23].
Ve studii Daneshmend et al z Los Angeles pacienti s 1 nebo 2 pozitivními uzlinami měli 10leté přežití bez recidivy ze 73 % oproti 49 % při postižení 5 a více uzlin. V této studii ale 31 % pacientů s uzlinovými metastázami prodělalo adjuvantní léčbu [1].
Několik studií naznačuje, že okamžitá androgenní blokáda po radikální prostatektomii u pacientů s uzlinovými metastázami je spojená se zlepšením přežití [24].
KONCEPT SENTINELOVÉ UZLINY U KARCINOMU PROSTATY
Koncept radioizotopem-vedené disekce sentinelové uzliny předpokládá, že lymfatická drenáž probíhá sekvenčně. Strážní uzlina, je první uzlina, kterou projdou nádorové buňky z primárního nádoru při diseminaci. Pokud je negativní sentinelová uzlina, pak můžeme předpokládat, že lymfatické řečiště distálně od ní je bez metastatického postižení. Metoda byla již úspěšně aplikována u karcinomu prsu, melanomu, v urologii je známa díky využití u karcinomu penisu.
V principu se před operací aplikují do periferní zóny prostaty koloidní částice značené radioizotopem technecia; radioizotop se šíři lymfatikami do strážních uzlin, které se scintigrafickou sondou zobrazí a naleznou při RAPE (obr. 2). Po odstranění těchto uzlin, pokud jsou negativní, lze poměrně bezpečně vyloučit další metastázy. V případě nálezu metastáz v sentinelové uzlině se pokračuje rozšířenou PLE.
Obr. 2. Zobrazení pánevních sentinelových uzlin gamakamerou, 3 hod po aplikaci radioizotopu. 
Wawroschek et al vyšetřili touto metodou 350 pacientů, u 92,6 % z nich detekovali alespoň 1 sentinelovou uzlinu. Celkově 24,7 % pacientů mělo prokázané uzlinové metastázy, z toho 13 % s PSA < 10 ng/ml. Falešně negativní výsledky byly velice vzácné, jenom u 2 pacientů byly při negativní sentinelové uzlině nalezeny metastázy v jiné lokalitě. Senzitivita vyšetření byla 98 % [11].
Jeschke et al prokázali, že metodiku je možné uplatnit u laparoskopické RAPE. V souboru 72 pacientů nalezli u 12,9 % uzlinové metastázy, 72 % metastáz bylo mimo obturatorní jámu a všechny metastázy byly detekovány jenom v uzlinách označených radioizotopem. U 2 pacientů nebyla detekována žádná sentinelová uzlina. Průměrný operační čas disekce sentinelových uzlin byl 54 min. Jako výhodnější se jevil transperitoneální přístup, protože disekce vnitřních ilických uzlin byla preciznější, s nižším rizikem lymfokély [12].
ZÁVĚR
Rozšířená pánevní lymfadenektomie zachytí při léčbě lokalizovaného karcinomu prostaty větší počet uzlinových metastáz oproti standardní lymfadenektomii. Až 2/3 pacientů s metastázami má pozitivní uzliny podél vnitřních ilických cév, které nejsou zahrnuty v standardním rozsahu disekce. U nízce rizikové skupiny pacientů s PSA pod 10 ng/ml a Gleasonovým skóre pod 7 není nutné provádět lymfadenektomii, protože nález metastáz je velice vzácný. U ostatních pacientů je vhodné využívat nomogramy k predikci rizika uzlinového postižení a selektovat pacienty, kteří podstoupí rozšířenou pánevní lymfadenektomii, protože se jedná o zákrok s nezanedbatelnou morbiditou, která zároveň významně prodlužuje operační výkon. K potvrzení terapeutického benefitu lymfadenektomie jsou nutné randomizované studie a delší doba sledování.
Příslibem do budoucnosti jsou vylepšené zobrazovací techniky, kombinované zobrazení pozitronovou emisní tomografií a počítačovou tomografii a radioimunoscintigrafie, které by mohly být atraktivní, neinvazivní formou stagingu karcinomu prostaty.
MUDr. Michal Staník
Urologická klinika LF MU a FN Brno, pracoviště Bohunice
Zdroje
1. Daneshmand S, Quek ML, Stein JP et al. Prognosis of patients with lymph node positive prostate cancer following radical prostatectomy: long-term results. J Urol 2004; 172 : 2252-2255.
2. Skinner DG. Management of invasive bladder cancer: a meticulous pelvic node dissection can make a difference. J Urol 1982; 128 : 34-36.
3. Allaf ME, Palapattu GS, Trock BJ et al. Anatomical extent of lymph node dissection: impact on men with clinically localized prostate cancer. J Urol 2004; 172 : 1840.
4. Bader P, Buckhard FC, Markwalder R, Studer UE. Disease progression and survival of patients with positive lymph nodes after radical prostatectomy. Is there a chance of cure? J Urol 2003; 169 : 849-854.
5. Cerny J, Farah R, Rian R et al. An evaluation of lymphangiography in staging carcinoma of the prostate. J Urol 1975; 113 : 367.
6. DelRegato J, Ackermann L. Diagnosis, treatment and prognosis of cancer. 4th ed. St Louis: Mosby 1977 : 654.
7. Golimbu M, Morales P, Al-Askari S and Brown J. Extended pelvic lymphadenectomy for prostatic cancer. J Urol 1979; 121 : 617.
8. Heidenreich A, Varga Z, Von Knobloch R. Extended pelvic lymphadenectomy in patients undergoing radical prostatectomy: high incidence of lymph node metastasis. J Urol 2002; 167 : 1681.
9. Stone NN, Stock RG, Unger P. Laparoscopic pelvic lymph node dissection for prostate cancer: comparison of extended and modified techniques. J Urol 1997; 158 : 1891-1894.
10. Schumacher M, Burkhard F, Thalmann G, Fleischmann A, Studer U. Is pelvic lymph node dissection necessary in patients with a serum PSA < 10ng/ml undergoing radical prostatectomy for prostate cancer? Eur Urol 2006; 50 : 272-279.
11. Wawroschek F, Vogt H, Weckermann D et al. Radioisotope guided pelvic lymph node dissection for prostate cancer. J Urol 2001; 166 : 1715-1719.
12. Briganti A, Chun F, Salonia A et al. Complications and other surgical outcomes associated with extended pelvic lymphadenectomy in men with localized prostate cancor. Eur Urol 2006; 50 : 1006-1013.
13. Jeschke S, Nambirajan T, Leeb K et al. Detection of early lymph node metastases in prostate cancer by laparoscopic radioisotope-guided sentinel lymph node dissection. J Urol 2005; 173 : 1943-1946.
14. Di Blasio CJ, Fearn P, Seo HS et al. Association between number of lymph nodes removed and freedom from disease progression in patients receiving pelvic lymph node dissection during radical prostatectomy. J Urol 2003; 169 : 456(A1708).
15. Bader P, Spahn M, Huber R et al. Limited lymph node dissection in prostate cancer may miss lymph node metastasis and determines outcome of apparently pN0 prostate cancer. Eur Urol 2004; 3 : 16(A55).
16. Weingartner K, Ramaswamy A, Bittinger A et al. Anatomical basis for pelvic lymphadenectomy in prostate cancer: results of an autopsy and implications for the clinic. J Urol 1996; 156 : 1969.
17. Bader P, Burkhard FC, Markwalder R, Studer UE. Is a limited lymph node dissection an adequate staging procedure for prostate cancer. J Urol 2002; 168 : 514-518.
18. Briganti A, Chun F, Salonia A et al. Validation of a nomogram predicting the probability of lymph node invasion among patients undergoing radical prostatectomy and an extended pelvic lymphadenectomy. Eur Urol 2006; 49 : 1019.
19. Bochner BH, Herr HW, Reuter VE. Impact of separate versus en bloc pelvic lymph node dissection on the number of lymph nodes retrieved in cystectomy specimens. J Urol 2001; 166 : 2295.
20. Bhatta-Dhar N, Reuther A, Zippe C, Klein E. No difference in six-year biochemical faiulure rates with or without pelvic lymph node dissection during radical prostatectomy in low-risk patients with localized prostate cancer. Urology 2004; 63 : 528.
21. Grossfeld GD, Chang JJ, Broering JM, Li Y et al. Understaging and undergrading in a contemporary series of patients undergoing radical prostatectomy: results from the cancer of the prostate strategic urologic research endeavour database. J Urol 2001; 165 : 851-856.
22. Rigatti P, Chun F, Salonia A et al. A Nomogram for staging of exclusive nonobturator lymph node metastases in men with localized prostate cancer. Eur Urol 2006, v tisku.
23. Palapattu GS, Allaf ME, Trock BJ, Epstein JL and Walsh PC. Prostate specific antigen progression in men with lymph node metastases following radical prostatectomy: results of long-term followup. J Urol 2004; 172 : 1860.
24. Messing E, Manola J, Sarosdy M. Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. New Engl J Med 1999; 341 : 1781.
Štítky
Dětská urologie Urologie
Článek LYMFATICKÁ DRENÁŽ PROSTATYČlánek KvízČlánek STRAVA A KARCINOM PROSTATYČlánek ZE ZAHRANIČNÍCH PERIODIK
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2006 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- LYMFATICKÁ DRENÁŽ PROSTATY
- PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
- Kvíz
- GENETICKÁ NÁCHYLNOST A OXIDAČNÍ STRES U KARCINOMU PROSTATY: INTEGROVANÝ MODEL S DOPORUČENÍMI PRO PREVENCI
- KINETIKA PSA − MŮŽE POMOCI PREDIKOVAT PŘÍTOMNOST A ZÁVAŽNOST KARCINOMU PROSTATY?
- PSA A VČASNÁ DETEKCE KARCINOMU PROSTATY
- PATOLOGIE PROSTATY A HLADINY ANDROGENŮ A ESTROGENŮ
- KLINICKÝ PŘÍSTUP K SUPRESI ANDROGENŮ A RADIOTERAPII ZALOŽENÝ NA DŮKAZECH U MUŽŮ S LOKÁLNĚ POKROČILÝM NEBO LOKALIZOVANÝM KARCINOMEM PROSTATY
- CO JE NOVÉHO V HODNOCENÍ PATOLOGIE KARCINOMU PROSTATY V ROCE 2006
- CYTOTOXICKÁ CHEMOTERAPIE U KARCINOMU PROSTATY
- ROBOTICKY ASISTOVANÁ RADIKÁLNÍ LAPAROSKOPICKÁ PROSTATEKTOMIE: SOUČASNÝ STAV
- STRAVA A KARCINOM PROSTATY
- AKTUÁLNÍ INFORMACE O KARCINOMU PROSTATY
- CO NA PUBLIKOVANÉ ČLÁNKY ŘÍKÁ PROFESOR PATRICK C. WALSH?
- ZE ZAHRANIČNÍCH PERIODIK
- GUIDELINES EAU PRO KARCINOM PROSTATY
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- STRAVA A KARCINOM PROSTATY
- PSA A VČASNÁ DETEKCE KARCINOMU PROSTATY
- PÁNEVNÍ LYMFADENEKTOMIE U KARCINOMU PROSTATY A JEJÍ HRANICE
- LYMFATICKÁ DRENÁŽ PROSTATY
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



