-
Medical journals
- Career
MOŽNOSTI LAPAROSKOPIE A RETROPERITONEOSKOPIE V LÉČBĚ PARENCHYMOVÝCH NÁDORŮ LEDVIN
ČÁST II - LEDVINU ŠETŘÍCÍ VÝKONY
Authors: doc. MUDr. Milan Hora, Ph.D.; MUDr. Jiří Klečka
Authors‘ workplace: Urologická klinika LF UK a FN Plzeň
Published in: Urol List 2005; 3(3): 35-41
Overview
Cíl, metodika: Dát přehled o miniinvazivních ledvinu šetřících laparoskopických metodikách v léčbě nádorů ledvin. Přehled současných poznatků z literatury je doplněn o vlastní postřehy autorů získaných při zavádění těchto technik do vlastní praxe ve FN Plzeň.
Výsledky:
U ledvinu šetřících metodik se provádějí dvě základní techniky. První je napodobení otevřené resekce s klampováním hilu a suturou resekované ledviny intrakorporálním uzlením. Je to metodika technicky náročná vyžadující větší zkušenosti s laparoskopickou operativou. Druhou technikou je využití kryoablace a termoablace (hlavně radiofrekvence), které nádor destruují a ponechávají jej in situ, event. umožňují bezkrevnou resekci nádorů bez klampování hilu. Tyto techniky jsou snadněji reprodukovatelné, ale dražší, náročné na technické vybavení, hrozí riziko ponechání části nádoru vitální. Stále se hledá a vyvíjí optimální fyzikální princip a přístroje. Do rutinní praxe budou tyto metodiky zařazeny patrně až po dalším zdokonalení a dlouhodobějším zhodnocení onkologických výsledků.Závěr:
Laparoskopické záchovné výkony pro nádory ledvin jsou nově zaváděné ještě se vyvíjející metodiky a není možné je paušálně doporučit do rutinní klinické praxe. Otevřené resekční výkony lze stále akceptovat jako zlatý standard. Toto tvrzení ale bude jistě během nejbližších let změněno ve prospěch výkonů laparoskopických.KLÍČOVÁ SLOVA:
laparoskopie, retroperitoneoskopie, tumor ledviny, parciální nefrektomie, resekce, kryoablace, radiofrekvenční ablaceÚVOD
Článek je pokračováním předchozího, který byl věnován miniinvazivním nefrektomiím. Tento článek se věnuje kontroverznější části miniinvazivní léčby nádorů ledvin, a to technikám ledvinu šetřícím. Snažíme se opět k literárnímu souhrnu přidat své poznatky ze stáží a z praktického provádění těchto metod na našem pracovišti.
HISTORIE
V roce 1993 byla popsána laparoskopická parciální nefrektomie jak v experimentu s prasaty [1], tak u člověka [2]. Týž rok byla provedena i první retroperitoneoskopická parciální nefrektomie [3]. Tyto první výkony u lidí byly prováděny pro změny dolního pólu ledviny při litiáze a až později přišly výkony pro tumory. První rozsáhlejší práce o laparoskopických resekcích ledvin vykazovaly vysoké procento komplikací (50 %) s nutností konverze u třetiny výkonů [4], vysoké byly i krevní ztráty, až 1,5–2 l [5-7]. K dnešnímu dni se však metodiky posunuly výrazně dopředu a jejich široké zavedení do standardní léčby je jen otázkou času. V ČR o laparoskopické léčbě tumoru ledviny prvně informovali Šafařík et al v roce 2002 [8] a žádná další práce se v ČR zatím neobjevila.
OBECNÉ DĚLENÍ METODIK
Přístup k ledvině je použit laparoskopický v lumbotomické poloze u ventrálně uložených tumorů, retroperitoneoskopický při tumorech uložených dorzálně [6,9]. Prof. Guillonneau dle osobního sdělení (obr. 1) výkon provádí vždy laparoskopicky v poloze na zádech v polosedě s 30° rotací s addukovanými dolními končetinami, operatér stojí mezi dolními končetinami pacienta. Zásadní otázkou těchto metodik je dosažení hemostázy. Z tohoto pohledu lze k dnešnímu dni popsat dvě základní techniky. První je technika s klampováním renálních cév. Jakýmsi ekvivalentem klampování hilu měl být parenchymový turniket, ale pro nespolehlivost již není doporučován [7,10-12]. Druhý způsob je bez klampování renálních cév s využitím různých fyzikálních principů umožňujících bezkrevnou resekci tumoru (harmonický skalpel, bipolární koagulace, argonový koagulátor, radiofrekvence, Hydro-Jet, mikrovlny, HIFU, Holmium Laser) [11]. Třetím směrem [5,13], který se nám ale u resekčních výkonů nezdá příliš perspektivní, je rukou asistovaná resekce. Zde je zásadní nevýhodou vytvoření zbytečně velké laparotomie (kolem 7 cm), je nutno použít relativně drahý rukáv na ruku a v případě nutnosti konverze je problematické využít střední laparotomii, protože je pacient v lumbotomické poloze. Pro úplnost je nutno ještě zmínit velmi nestandardní využití laparoskopie v léčbě nádorů ledvin. Je jí laparoskopická nefrektomie, ex vivo excize tumorů a následná autotransplantace Gibsonovým řezem do malé pánve [14].
Image 1. Salzburg, srpen 2004. Vlevo je prof. Bertrand Guillonneau, který společně s prof. Vallancienem popsal v pařížském Institut Mutualiste Montsouris v roce 1998 standardní reprodukovatelnou laparoskopickou radikální prostatektomii. Od roku 2002 působí B. Guillonneau v New Yorku v Memorial Sloan Kettering Cancer Center. Vpravo je hlavní autor článku. 
Resekce tumoru s klampováním renálních hilových cév0
Při těchto technikách se provádí stejný postup jako při otevřené operaci - preparace ledviny a tumoru, selektivní odstranění tukového pouzdra tumoru, nalezení renálních cév a jejich klampování, resekce tumoru, sutura spodiny a okrajů ledviny event. s přiložením fibrinové síky, uvolnění hilu a rekonstrukce tukového pouzdra. V různých fázích operace se metodiky u různých pracovišť liší, což se budeme snažit ve zkratce probrat. Kromě literatury a videoprojekcí prezentovaných na odborných sjezdech jsme viděli metodiku několikrát živě v The Cleveland Clinic Foundation (CCF), Ohio.
První větší sérii laparoskopické parciální nefrektomie (LPNE) s klampováním hilových cév publikovali Gill et al v roce 2002 [6]. O rok později 16 LPNE obdobnou technikou publikovali Guillonneau et al a potvrdili tím reprodukovatelnost metodiky [7]. Na sjezdu AUA v roce 2004 prezentovalo již několik pracovišť soubory přes 100 pacientů podstoupivších LPNE, přičemž autoři z CCF prezentovali dokonce 277 pacientů [15,16]. Tato čísla byla platná ale k červenci 2003 a ze stáže v CCF víme, že týdně se provádějí minimálně 2 LPNE, takže jejich soubor bude ke konci roku 2004 možná k 500 pacientům. Resekce s klampováním renálního hilu jsou sice technicky náročnější, ale čas operace je kratší a krevní ztráty jsou menší než u výkonů bez klampování [7].
Otázka operačního přístupu již byla zmíněna výše. Při preparaci ledviny se snažíme co nejvíce zachovat tukové pouzdro, abychom na závěr mohli provést jeho rekonstrukci. Tukové pouzdro přilehlé k tumoru se resekuje, odstraňuje a nechává histologicky vyšetřit. Po ozřejmení tumoru se vypreparují hilové cévy. U klampování hilu se snažíme selektivně pomocí malých cévních svorek (tzv. bulldog - obr. 2, 3) uzavřít pouze renální arterii. Tyto bulldogy lze zavést portem 12,5 mm pomocí speciálního aplikátoru. Pomocí druhé svorky lze samozřejmě zaklampovat i renální žílu, zde je poté nutno užít měkčí svorku. Klampování jen renální arterie s sebou nese riziko většího krvácení ze zpětného žilního toku (proto není technika vhodná pro hluboko jdoucí tumory) a riziko plynové embolie, čemuž lze zabránit snížením tlaku na 10 mm Hg [17]. V CCF v Ohiu dávají přednost zaklampování celého hilu en bloc dlouhými endoskopickými Satinského svorkami (obr. 4), jejichž branže jsou během celého výkonu před dutinou břišní [13]. Svorky lze poté rychleji a snadněji uvolnit, ale je nutný další port navíc a je otázkou, co se stane, přestane-li během výkonu působit svalová relaxace. Někteří autoři se domnívají, že tento postup vyžadující menší preparaci hilových cév minimalizuje možnost peroperačního traumatu cév [15]. U retroperitoneoskopických výkonů tyto dlouhé svorky nelze užít a v těchto případech i lékaři z CCF užívají malé svorky [6] (obr. 5). V literatuře se často setkáváme s doporučením identifikovat tumor peroperačně pomocí sonografu s laparoskopickou sondou. Tato technika by snad mohla být přínosná u intrarenálně uložených tumorů, které ale spíše indikujeme k otevřeným výkonům. Sami jsme měli možnost využití ultrasonografu opakovaně vidět v CCF a nepovažujeme to v naprosté většině případů za přínosné, stejně jako i další autoři [18]. Laparoskopickou sonografickou sondu navíc však nevlastníme a zatím její nákup neplánujeme. Resekci je nejlépe provádět pomocí nůžek (obr. 6, 7). Peroperační biopsii ze spodiny stejně jako při otevřených výkonech rutinně neprovádíme, jen ve vybraných případech. Následuje sutura spodiny - uzavřeme zde všechny větší cévy a event. i otevřený dutý systém ledviny (obr. 8). Uretrální katétr s metylenovou modří k ozřejmení defektu dutého systému užívaný v CCF [6] považujeme ve shodě s některými autory [19] za nadbytečný. Řadou autorů podávaný manitol před klampováním cév jsme též nepoužívali [19]. K sutuře je užit vstřebatelný materiál, zejména polyglaktin síly 3/0, k přiblížení okrajů ledviny poté týž materiál síly 2/0 [7]. Následné přiblížení okrajů je dle našich zkušeností často technicky obtížné (obr. 9), proto provedeme pouze koagulaci suturou neošetřeného parenchymu bipolární koagulací či argonovým koagulátorem [20], který však zatím nevlastníme a pouze si jej někdy půjčujeme. Na koagulovanou plochu přiložíme hemostatikum z oxidované celulózy Surgicel®. Někteří autoři po provedení resekce a po sutuře dutého systému aplikují tkáňové lepidlo [16,18,20,21]. Používá se buï fibrinové lepidlo, které je však drahé (jedno balení kolem 7 tis. Kč), navíc se musí složitě aktivovat aktivátorem či zahřátím. V poslední době se stává populární lepidlo FloSeal® Baxter [22]. Je tvořeno bovinní želatinovo-trombinovou matrix. Jeho rozsáhlé používání jsem viděli v CCF. Jeho výhoda je, že není nutno jej aktivovat a cena jednoho balení je o více než polovinu nižší. Vyvíjí se i nová lepidla na bázi fibrinového prášku [23], k jejichž aktivaci stačí styk s vlhkem. Jakékoliv tkáňové lepidlo je pro nás však finančně nedostupné, takže s ním nemáme vlastní zkušenosti. Pro vysokou cenu nelze využití tkáňového lepidla v ČR příliš očekávat, a navíc se osobně domníváme, že výkon lze provádět úspěšně i bez něj bez výrazně horších operačních výsledků u naprosté většiny případů. V případě, že se rozhodneme stehem přiblížit okraje resekované ledviny, což je technicky dosti obtížné, je vhodné to provádět přes síku ze vstřebatelného hemostatika, např. Surgicel Nu-Knit®, který je hustě tkaný a oproti běžnému Surgicelu® pevnější. Želatinovou houbu (např. Spongostan®) je obtížné přes úzký port aplikovat. Po hemostatické fázi operace se uvolní cévní svorky. Dle literatury dochází k reparaci funkce ledviny, jestliže teplá ischemie ledviny nebyla delší než 60 minut [7]. Při zchlazení ledviny na 20° C je možná ischemie ledviny až 3 hodiny [24]. V experimentu na zvířatech bylo prokázáno, že ischemie do 30 minut nevede ke zhoršení renálních funkcí, ischemie 60 a 90 minut vede k přechodnému několikadennímu zvýšení renálních testů [25]. Většina prací však udává průměrnou dobu ischemie kratší, kolem 20–30 minut [6,20,26] a závažnější renální poškození popsáno nebylo. Existují práce s dobou teplé ischemie blížící se i zmíněným 60 minutám [17,27,28] a i tyto časy mohou být bez výraznějších následků pro ledvinu [20]. Matsuda et al [17] popsali případy ischemie 71 a 115 minut bez funkčních následků. Vliv opakovaného či dokonce intermitentního klampování renálního hilu není jasný. Dle studií s hlodavci by mohly být výsledky dobré, naopak někteří autoři upozorňují na možnost reperfuzního poškození, které je mediováno volnými radikály či kalciem [20,26,29]. Laparoskopická resekce vyžaduje v průměru delší klampování než při otevřených operacích a přináší i více operačních komplikací, hlavně krvácení [6,24]. Při laparoskopii nelze také aplikovat námi oblíbenou techniku užívanou při otevřených operacích - komprese parenchymu ledviny prsty v blízkosti tumoru, s rychlou resekcí tumoru a suturou bez nutnosti kampovat, a tím i preparovat hilus. K minimalizaci následků teplé ischemie se hledají metodiky chlazení ledviny. Publikovány byly tři způsoby - obalení ledviny ledovou tříští buï přímo [24] či v extrakčním sáčku [26], perfuze zavedeným uretrálním katétrem 4°C chladným fyziologickým roztokem [7] a perfuze renální arterie opět 4°C chladným roztokem (Ringer laktát) [30]. V novějších souborných pracích se však tyto metodiky příliš nepraktikují. První metodika je technicky velmi náročná a během pobytu v CCF v dubnu 2004 jsme ji autory Gilla et al neviděli aplikovat. Druhá technika je jednoduchá a dle prací Landmana et al [31,32] lze touto technikou zchladit ledvinu až na 21°C. Landman et al použili zavedení ureteroskopického zavaděče 12 Ch do ureteru a jím přes uretrální katétr Ch 7 aplikovali fyziologický roztok -1,7°C chladný rychlostí 85 ml/min tlakem 120 cm H2O. Poslední technika vyžaduje předoperační provedení angiografie radiologem se zavedením katétru do renální arterie. Tím se technika i výrazně prodlužuje a prodražuje. Po uvolnění svorek z hilu se snažíme dle možností rekonstruovat tukové pouzdro, k čemuž využíváme klipy, intrakorporální steh či svorky určené k fixaci síky při operacích hernií. Rekonstrukce ale není tak dokonalá jako při otevřeném provedení. Tumor uložíme do sáčku a extrahujeme na rozdíl od laparoskopické nefrektomie jen minimální incizí.
Image 2. Námi používané laparoskopické cévní svorky. Svorky jsou buď tvrdší (stříbrné, určené ke klampování arterií) či měkčí (se zlatým koncem, určené ke klampování renální žíly). 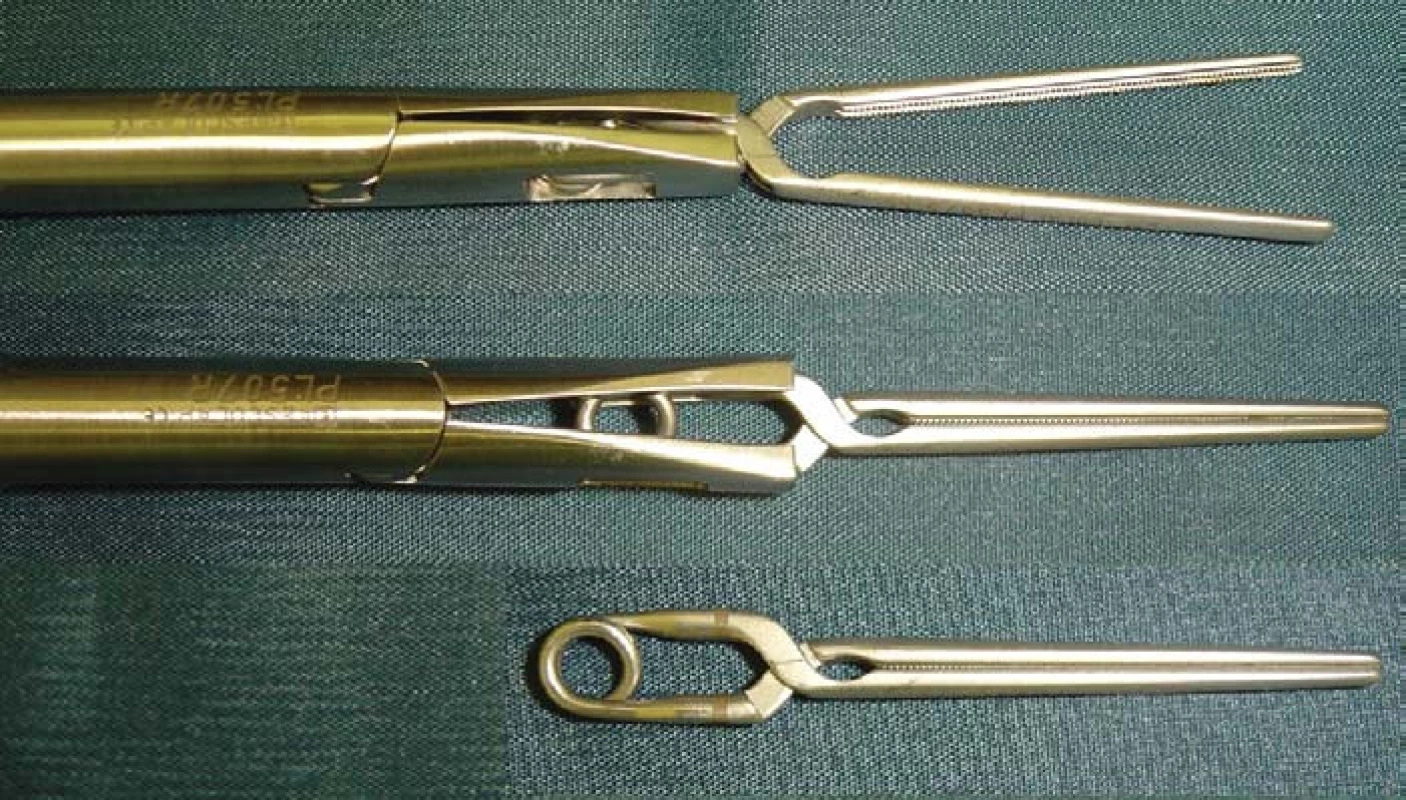
Image 3. Cévní svorka in situ. Vpravo je okraj jater, nahoře ledvina přidržovaná dvěma graspery, svorka klampuje renální arterii, před ní je renální žíla. Obrázek je nízké kvality (0,8 M pixel), neboť je získán z videozáznamu. 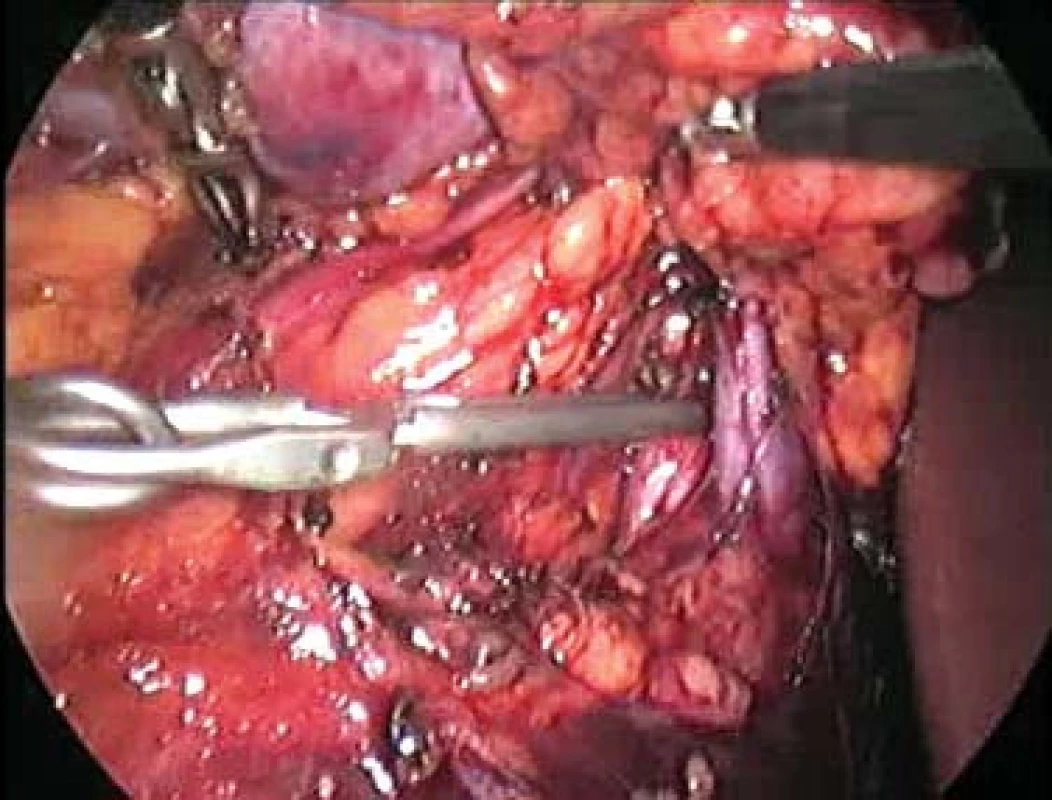
Image 4. Klampování hilu en bloc Satinského svorkami. 
Image 5. Separované klampování renálních cév při retroperitoneoskopické resekci. 
Image 6. Schéma resekce tumoru včetně resekce dutého systému. 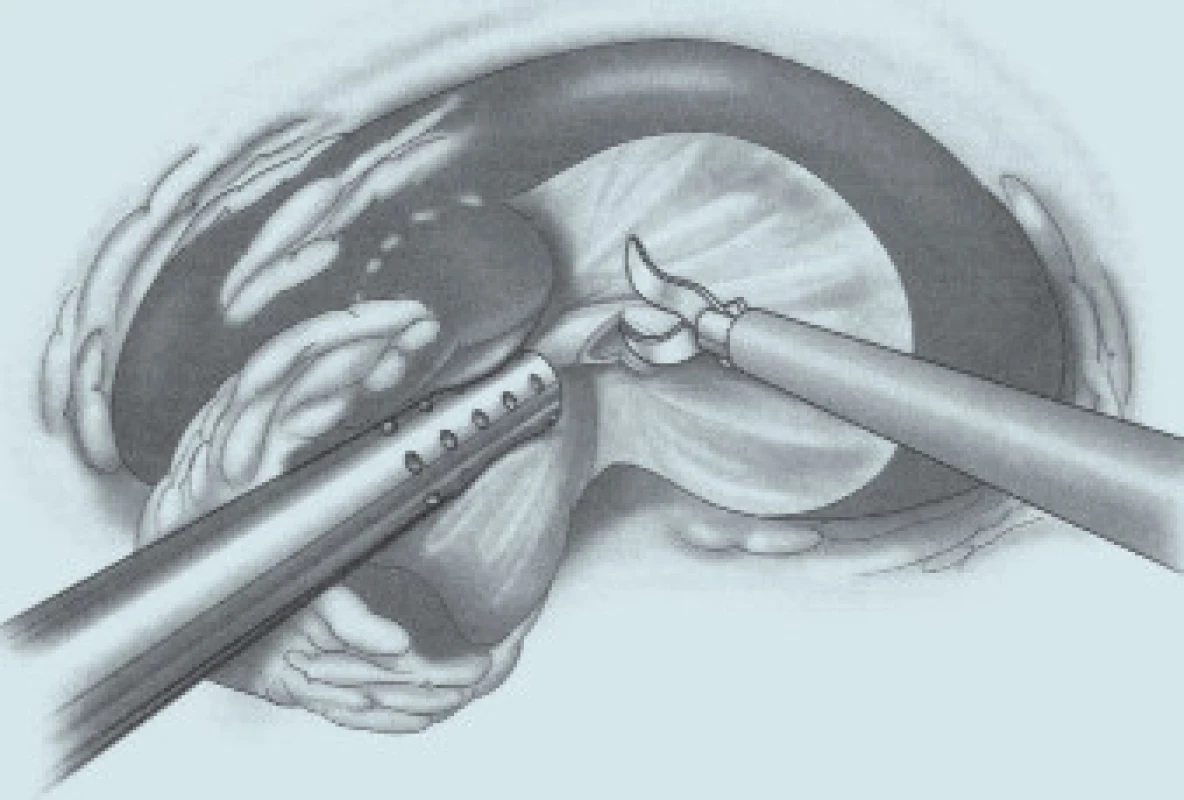
Image 7. Resekce tumoru nůžkami, vpravo je patrná odsávačka. Obrázek je pořízen z videozáznamu. 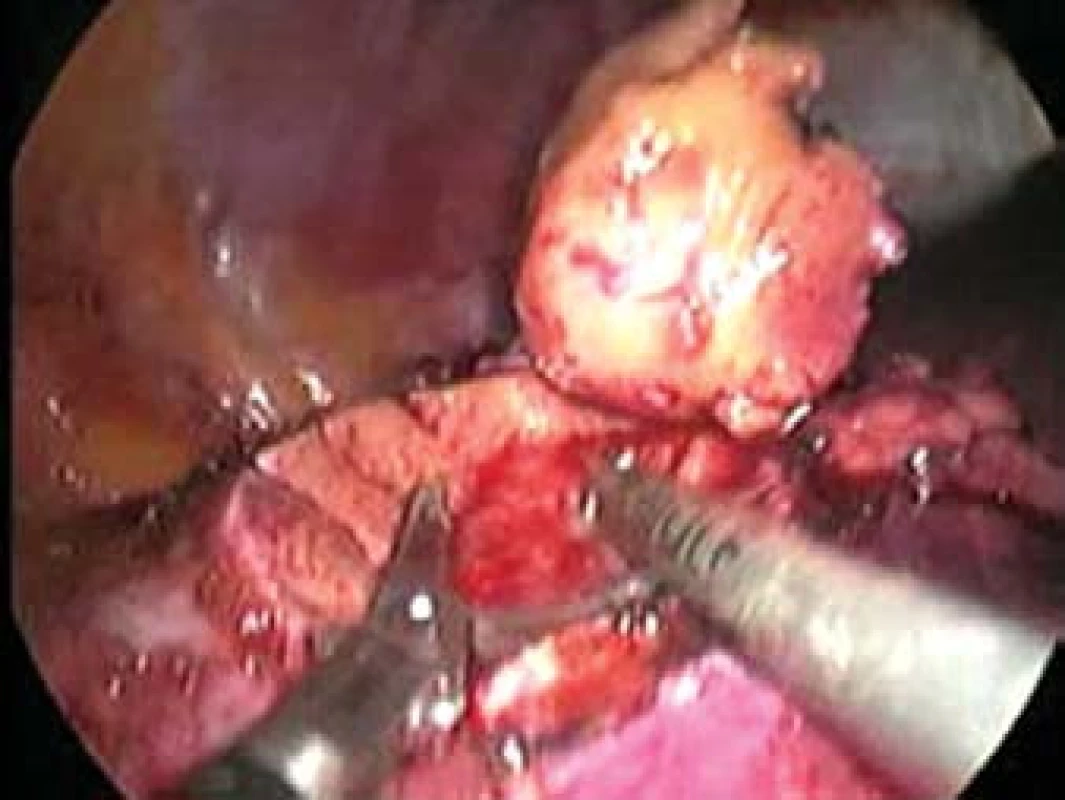
Image 8. Sutura spodiny po resekci. Obrázek je pořízen z videozáznamu. 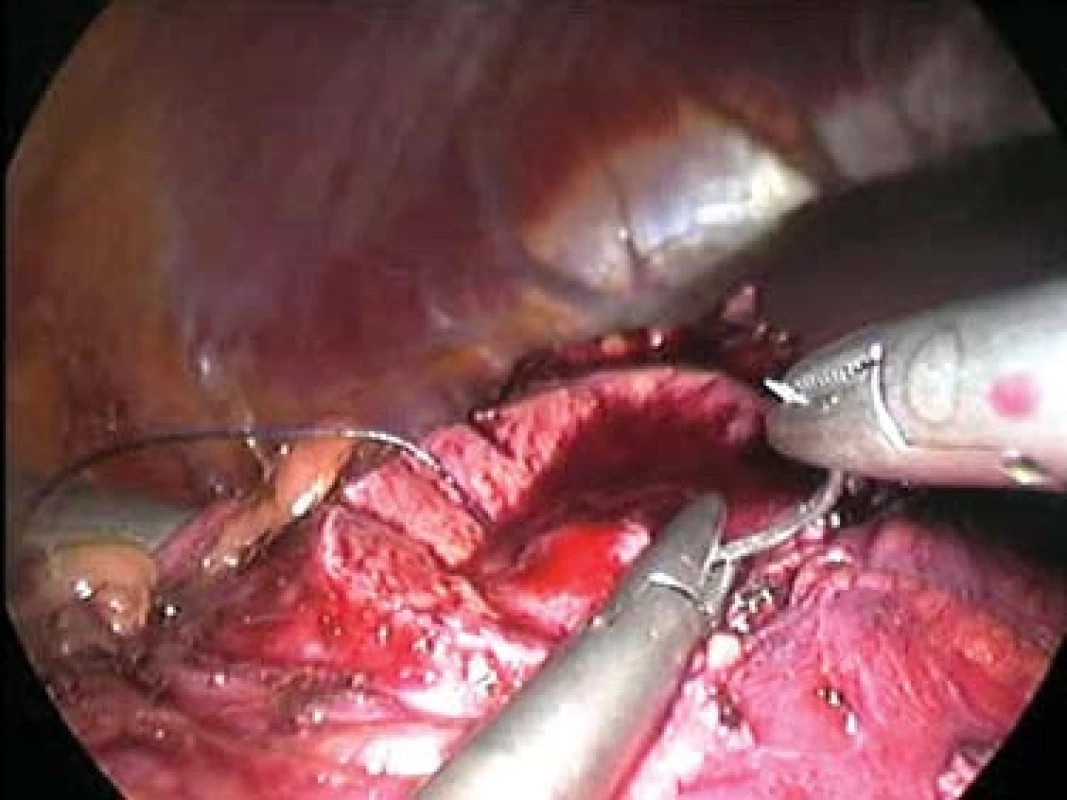
Image 9. Sutura okrajů ledviny přes celulózovou tkaninu. 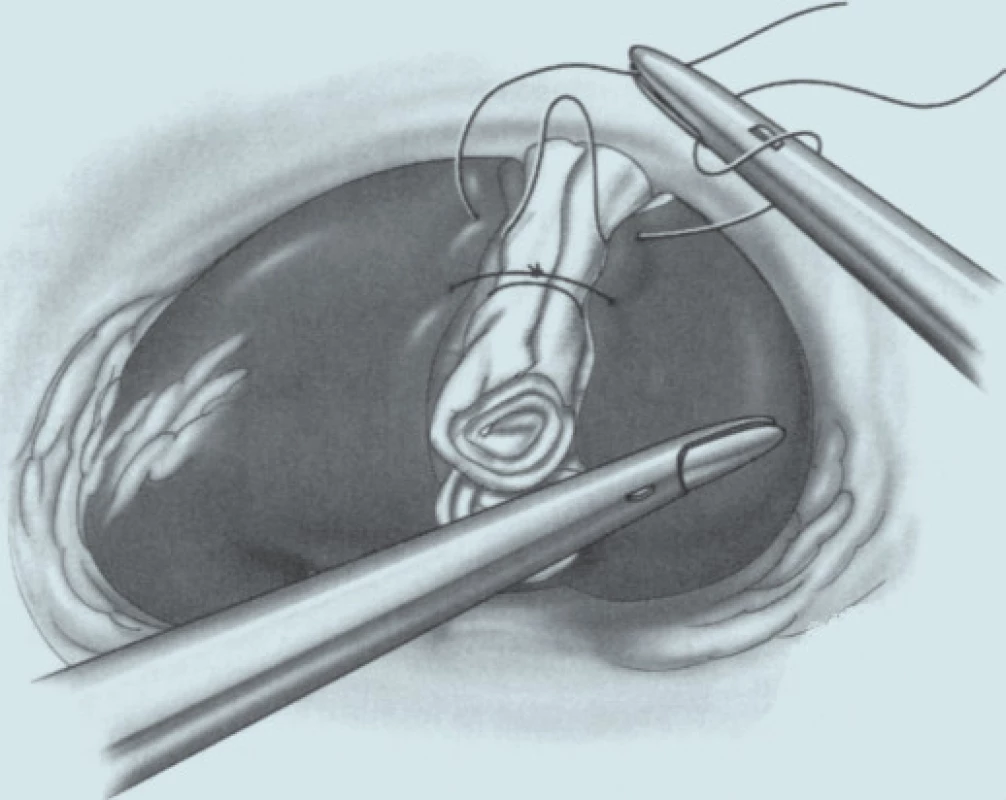
Image 10. Obrázek břicha pacienta po dokončené resekce technikou s klampováním hilu. Indikací byl tumor pravé ledviny velikosti 2 cm, jak je patrno na vloženém výřezu z CT. Ve výřezu je patrný též pooperační preparát, který byl tvořen papilárním renálním karcinomem. Týž pacient je na obrázcích 3, 7 a 8. 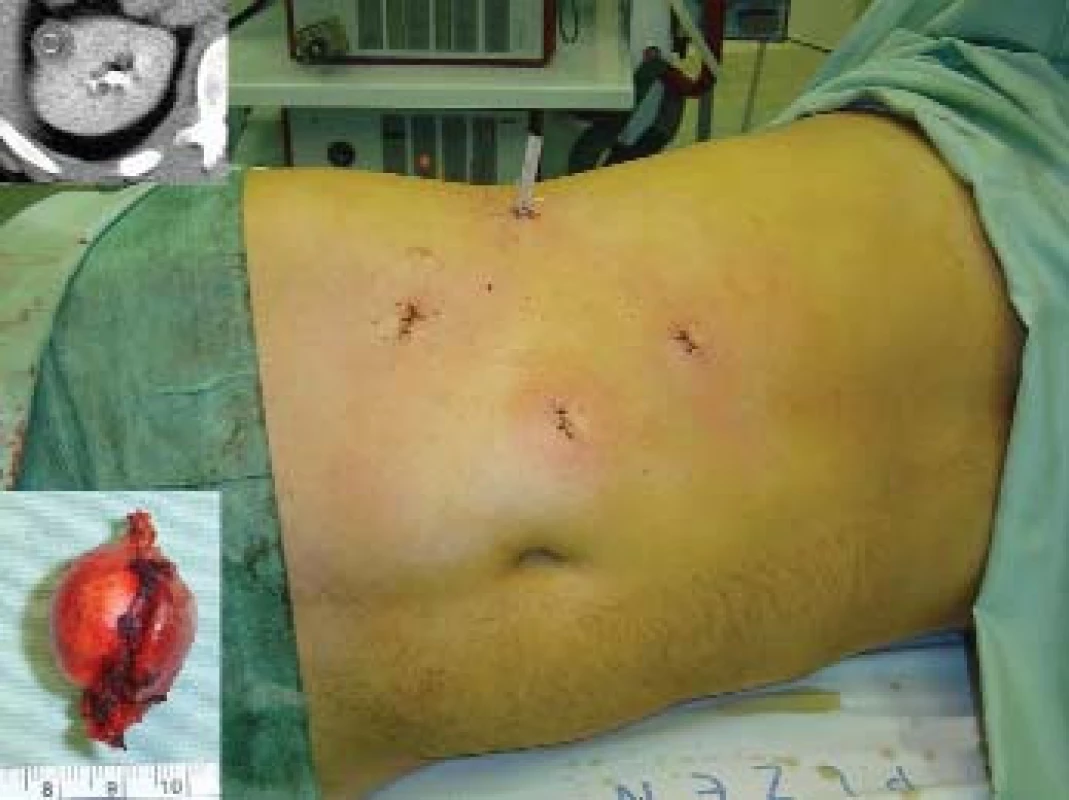
Miniinvazivní ledvinu šetřící výkony bez klampování hilových cév
Přístup k tumoru je opět buï laparoskopický či retroperitoneoskopický. K tepelné destrukci se užívají v podstatě stejné metodiky jako při přístupu transkutánním. Jedná se buï o kryoablaci či o termální ablaci. Metodiky se používají k destrukci tumoru in situ či u termoablačních technik se aplikují na spodinu tumoru, což pak umožní bezkrevnou resekci tumoru. Na rozdíl od přístupu transkutánního se oddělí tumor od okolních struktur, které by mohly být poškozeny (hlavně střevo). Může se provést biopsie s ošetřením krvácejícího vpichu. Vlastní aplikace energie se poté provádí do přesně zvoleného místa a postup destrukce tumoru včetně destrukce bezpečnostního lemu zdravé tkáně lze pozorovat okem. Jednotlivé používané metodiky vyjmenované dříve je nutno nyní okomentovat.
Nejdostupnější je koagulace - klasická monopolární či bipolární. Zde je první nevýhodou napalování tkáně na koagulační nástroj. To lze obejít argonovým koagulátorem, který přenáší energii na tkáň pomocí toku argonu a ne přímým kontaktem. Přetrvává však zásadní nevýhoda: Rozsáhle koagulovaný parenchym je křehký, což ztěžuje poté jeho eventuální suturu. Koagulační nekróza může též vést po odloučení nekrotické tkáně k rozvoji močové píštěle [7]. V souvislosti s koagulací je nutno zmínit metodiku eletrosmyčky, kterou byl v experimentu na zvířatech pomocí elektrického proudu oddělen celý pól ledviny. Tato technika se však ukázala jako velmi neúčinná [11].
Kryoablace. Začátky jejího užití u výkonů šetřících ledviny se datují do roku 1999. Nyní ji do rutinní denní praxe zavedla ve světě řada pracovišť [9] a řada dalších pracovišť ji zavádí. Ve srovnání s termoablačními metodami je kryoablace propracovanější [33]. Za laparoskopické či retroperitoneoskopické kontroly se po odebrání biopsie zavede do tumoru kryoablační sonda a aplikují se za kontroly zraku dva cykly mražení. Osobně jsme měli možnost vidět provádět kryoablaci v CCF dr. Kahouka a na urologické klinice ve vídeňském Allgemeines Krankenhaus prof. Klinglera. Tkáň po kryoablaci je křehká, může dojít k její fraktuře s následným výraznějším krvácením [34]. Největší nevýhodou je možnost ponechání části nádoru vitální a doporučované provádění biopsií s odstupem několika měsíců [9] nemusí reziduální nádor zachytit. Výsledky 5letého přežití po aplikaci této metody zatím nejsou známy [33,34]. Laparoskopické resekci bude nutno dávat přednost, kryoablace bude rezervována pro mnohočetné nádory a pro rizikové pacienty [34]. Teoreticky by byla vhodná pro méně zkušené laparoskopisty [33], zde asi bude dle našeho názoru lepším řešením otevřený výkon.
Radiofrekvenční ablace. RFA byla u tumorů ledvin popsána poprvé v roce 1997. V USA je schválena FDA (Food and Drug Administration - Úřad pro kontrolu potravin a léčiv) k ablaci lézí měkkých tkání [35]. Z termoablačních metod je používána nejdéle. Je nejpropracovanější a má nejvíce provedených klinických studií, nicméně jsou stadia II [11]. Technicky lze přístroje rozdělit na monopolární (Radionics®) a bipolární (CelonPower®). Další rozdělení je na přístroje, které regulují přívod energie dle impedance (Radionics®, CelonPower®) či dle okolní teploty (RITA®). Počáteční relativně nedobré výsledky byly dány nezkušeností personálu, volbou suboptimální techniky. Lepší výsledky mají přístroje s vnitřním chlazením sondy a výkonem 200 W (např. Radionics® Tyco Cool-tip™ RF). Dříve byl používán generátor s nízkým výkonem a relativně velký krevní průtok ledvinné tkáně v okolí sondy vedl k přílišnému ochlazení i tumorózní tkáně [35]. Dnešní výsledky RFA jsou již mnohem povzbudivější [35-37]. V experimentu byla prokázána zvýšená účinnost též u přístrojů s mnohočetnými jehlami rozevírajícími se po zavedení do tumoru (RITA®) [38]. Účinnost zvyšuje též aplikace menšího množství izotonického roztoku do okolí sondy (tzv. vlhká radiofrekvence), a aby roztok neodtekl, používá se i gel [38]. Dallaská skupina, která opakovaně publikovala své zkušenosti s RFA [36,39], nyní prezentovala soubor s 39 ošetřenými pacienty s RFA při laparoskopii [40]. Tumor ošetří s RFA a buï jej ponechají in situ, pouze odeberou biopsie, či exofytické tumory následně excidují bez klampování hilových cév. Aplikace RFA do okolí tumoru a následnou bezkrevnou resekcí je používána i jinými autory [41]. Největší nevýhodou aplikaci RFA bez excize je riziko ponechání vitální části tumoru [42]. Přístroje pro RFA jsou dostupné i v ČR (např. CelonPower®, Radionics®, RITA®). Domníváme se, že metodiku je nutno v ČR považovat za experimentální, a je ji tedy vhodné používat pouze v rámci klinických studií, a to u pacientů, u kterých jiná léčba není možná (mnohočetné tumory, solitární ledvina, pacient odmítající klasickou operaci, polymorbidní pacient). Metodiky radiofrekvence užívá i přístroj Tissue Link®, který umožňuje resekci tumoru ledviny bez klampování renálního hilu [18,43]. Přístroj pomocí radiofrekvenční tepelné energie přenášené na tkáň solným roztokem vytváří teploty pod 100°C, což vede ke slepení kolagenu, uzavření cév a zástavě krvácení bez vzniku nekróz a nalepování tkáně jako při koagulaci (teploty kolem 350°C). Nevzniká též kouř. Tento princip známe zatím z popisů z článků a z webových stránek, kde jsou dostupná i videa z užití při chirurgii jater.
Mikrovlnný tkáňový koagulátor. Principem je přeměna mikrovln o frekvenci 2 450 MHz aplikovaných monopolární anténou na teplo. Princip je používán zejména japonskými autory a urologům je znám z metody TUMT prostaty. Jeho laparoskopické užití u nádorů ledvin se datuje k roku 2001 [44]. Přístrojem se tepelně ošetří spodina tumoru a vlastní tumor je poté bez klampování hilu ostře bezkrevně resekován. Autoři jej doporučují hlavně pro malé exofytické tumory [44-46]. Metodu je stále nutno považovat za experimentální [11], laparoskopické užití bylo publikováno celkem jen u 41 případů. Po této metodě popsali autoři z japonské Osaky ztrátu funkce ledviny, prolongovaný únik moči a pozitivní okraje, nebo je obtížné identifikovat ve změněném terénu hranice. Proto přešli k technice resekce s okluzí renální arterie [17]. Dle našeho názoru nemá s rozvojem klasické resekce naději na zavedení do rutinní praxe. Zavedení metodiky v ČR by ale stejně bránila nedostupnost přístroje a patrně i jeho cena.
HIFU (fokusovaný ultrazvuk vysoké intenzity). Tento princip znají urologové z využití u nádorů prostat. Právě modifikovaný přístroj k ablaci tumorů prostat byl užit k resekcím ledvin u laboratorních zvířat [47]. Přístroj vyžaduje port 33 mm.
Hydro-jet®. Přístroj generuje slabý proud tekutiny, který disekuje parenchym ledviny, ale nepřeruší větší cévy, ty se pak přeruší klipy či koagulací. Metodika je zatím experimentální a pro české urology bude ještě dlouho či natrvalo nezajímavá. Podobnou prezervaci cév při resekci ledviny by měl zabezpečit též přístroj CUSA EXcel™ Valleylab. CUSA® (Cavitron Ultrasonic Surgical Aspirator) je ultrazvukový aspirátor pracující na frekvenci 23 či 36 kHz, který kombinací fragmentace, irigace a aspirace destruuje parenchymové buňky a ponechává pevné struktury včetně cév, které se poté selektivně ošetří koagulací. Klinické zkušenosti v urologii jsou však patrně omezené [35].
Harmonický skalpel. Jeho využití se dříve zdálo nadějné, ale není schopen zastavit větší krvácení. Zde je nutno využít další hemostatické metodiky [11]. Dle našich zkušeností je přístroj též relativně pomalý a jeho rutinní využití k resekci ledvin se nám zdá nepravděpodobné.
Laser. Holmium laser se zkouší k „bezkrevné“ resekci ledviny. Metodika je opět zatím vysoce experimentální. Jednou z jejích nevýhod je rozstřikování krve na optiku kamery [11,48]. Laser se zkouší též k termodestrukci tumoru (LITT - Laser Induced Thermotherapy) [33]. Intersticiální fotonová radiační ablace je vysoce experimentální [33]. V experimentech se zkouší i intratumorózní aplikace nekrotizujících roztoků (koncentrovaný solný roztok, kyselina octová, 95% etanol) a rozsah jejich léze lze zvětšit současnou aplikací radiofrekvence [38].
ZÁVĚR
Na závěr shrneme současné preference našeho pracoviště. Naše názory na resekční výkony u nádorů ledvin nejsou zcela jednoznačné, což je dáno tím, že se metodika ve světě stále vyvíjí a sami máme zatím jen první zkušenosti. Naši techniku modifikuje omezené dostupné instrumentárium. Provádíme klasickou techniku resekce ledviny převedenou do laparoskopické formy. Tedy techniku s vypreparováním a zaklapováním hilu (většinou jen arterie) pomocí bulldogů s následnou resekcí tumoru nůžkami, suturou dutého systému a větších cév intrakorporálním stehem s koagulací zbylého parenchymu bipolární koagulací či argonovým koagulátorem a na resekovanou plochu přikládáme Surgicel®. Pro tumory uložené např. v blízkosti renálních cév či u rizikových pacientů bude jistě někdy přínosné použít termoablační techniky (kryoablace, radiofrekvence), které zatím ale nemáme k dispozici. Tyto techniky jsou technicky pro operatéra méně náročné.
doc. MUDr. Milan Hora, Ph.D.
MUDr. Jiří Klečka
Urologická klinika LF UK a FN Plzeň
Sources
1. McDougall E M, Clayman RV, Chandhoke PS et al. Laparoscopic partial nephrectomy in the pig model. J Urol 1993; 149 : 1633-6.
2. Winfield HN, Donovan JF, Clayman RV, Godet AS. Laparoscopic partial nephrectomy: human applicability. J Urol 1993; 149-417A.
3. Gill IS, Delworth MG, Munch LC: Laparoscopic retroperitoneal partial nephrectomy. J Urol 1994, 152 : 1539-42.
4. McDougall EM, Elbahnasy AM, Clayman RV. Laparoscopic wedge resection and partial nephrectomy - the Washington University experience and review of the literature. J Soc Laparoendosc. Surg 1998; 2 : 15-23.
5. Wolf JS, Seifmen BD, Montie JE: Nephron sparing surgery for suspected malignancy: open surgery compared to laparoscopy with selective use of hand assistance. J Urol 2000; 163 : 1659-64.
6. Gill IS, Desai MM, Kahouk JH et al. Laparoscopic partial nephrectomy for renal tumor: duplicating open surgical techniques. J Urol 2002; 167 : 469-76.
7. Guillonneau B, Bermúdez H, Gholami S et al. Laparoscopic partial nephrectomy for renal tumor: single center experience comparing clamping and no clamping techniques of the renal vasculature. J Urol 2003; 169 : 483-486.
8. Šafařík L, Novák K, Dvořáček J, Novák J. Laparoskopická resekce adenokarcinomu ledviny. Čes Urol 2002; 6 : 79.
9. Nadler RB, Kim SC, Rubenstein JN et al. Laparoscopic renal cryosurgery: the Northwestern experience. J Urol 2003; 170 : 1121-5.
10. Cadeddu JA, Corwin TS: Cable tie compression to facilitate laparoscopic partial nephrectomy. J Urol 2001; 165 : 177-8.
11. Ogan K, Cadeddu JA: Laparoscopic partial nephrectomy: a procedure in evolution, Braz. J Urol 2002; 28 : 184-91.
12. Winfield HN, Donovan JF, Lund GO et al. Laparoscopic partial nephrectomy: initial experience and comparison to the open surgical approach. J Urol 1995; 153 : 1409-1414.
13. Brown JA, Hubosky SG, Gomella LG, Strup SE. Hand assisted laparoscopic partial nephrectomy for peripheral and central lesions: a review of 30 consecutive cases. J Urol 2004; 171 : 1443-6.
14. Meng MV, Freise CE, Stoller ML. Laparoscopic nephrectomy, ex vivo excision and autotransplantation for complex renal tumors. J Urol 2004, 172 : 461-4.
15. Kilciler M, Finelli A, Ramani AP et al. Laparoscopic partial nephrectomy in the presence of multiple renal vessels. J Urol 2004; 172 (Suppl 4): 342.
16. Spaliviero M, Ramani AP, Xu M et al. Bioadhesive (Floseal) in laparoscopic partial nephrectomy: impact on learning curve. J Urol 2004; 172 (Suppl 4): 343.
17. Matsuda T, Nakagawa M, Oguchi N et al. Retroperitoneoscopic partial nephrectomy with transient occlusion of renal artery for treatment of small renal tumors. Urology 2004; 64 : 26-30.
18. Simon SD, Ferrigni RG, Novicki DE et al. Mayo clinic Scottsdale experience with laparoscopic nephron sparing surgery for renal tumors. J Urol 2003; 169 : 2059-62.
19. Bove P, Bhayani SB, Rha KH et al. Necessity of ureteral catheter during laparoscopic partial nephrectomy. J Urol 2004; 172 : 458-60.
20. Shekarriz B, Shan G, Upadhyay J: Impact temporary hilar clamping during laparoscopic partial nephrectomy on postoperative renal function: a prospective study. J Urol 2004, 172 : 54-7.
21. Bak JB, Singh A, Shekarriz B. Use of gelatin matrix thrombin tissue sealant as an effective hemostatic agent during laparoscopic partial nephrectomy. J Urol 2004; 171 : 780-2.
22. User HM, Nadler RB. Application of FloSeal in nephron-sparing surgery. Urology 2003; 62 : 342-3.
23. Bishoff JT, Cornum RL, Perahia B et al. Laparoscopic heminephrectomy using a new fibrin sealant powder. Urology 2003; 62 : 1139-43.
24. Wakabayashi Y, Narita M, Kim CJ et al. Renal hypotermia using ice slush for retroperitoneal laparoscopic partial nephrectomy. Urology 2004; 63 : 773-5.
25. Baldwin DD, Maynes LJ, Berger KA et al. Laparoscopic warm ischemia in the solitary porcine kidney model. Urology 2004; 64 : 592-7.
26. Gill IS, Abreu SC, Desai MM et al. Laparoscopic ice slush renal hypothermia for partial nephrectomy: the initial experience. J Urol 2003; 170 : 52-6.
27. Kane CJ, Mitchell JA, Meng MV et al. Laparoscopic partial nephrectomy with temporary arterial occlusion: description of technique and renal functional outcomes. Urology 2004; 63 : 241-6.
28. Bhayani SB, Rha KH, Pinto PA et al. Laparoscopic partial nephrectomy: effect of warm ischemia on serum creatinine. J Urol 2004; 172 : 1264-6.
29. Gill IS, Matin SF, Desai MM et al. Comparative analysis of laparoscopic versus open partial nephrectomy for renal tumors in 200 patients. J Urol 2003; 170 : 64-8.
30. Janetschek G, Abdelmaksoud A, Bagheri F et al. Laparoscopic partial nephrectomy in cold ischemia: renal artery perfusion. J Urol 2004; 171 : 68-71.
31. Landman J, Rehman J, Sundaram CP et al. Renal hypothermia achieved by retrograde intracavitary saline prfusion. J Endourol 2002; 16 : 445-9.
32. Landman J, Venkatesch R, Lee D et al. Renal hypothermia achieved by retrograde endoscopic cold saline perfusion: technique and initial application. Urology 2003; 61 : 1023-5.
33. Mabjeesh NJ, Avidor Y, Matzkin H. Emerging nephron sparing treatment for kidney tumors: a continuum of modalities from energy ablation to laparoscopic partial nephrectomy. J Urol 2004; 171 : 553-60.
34. Cestari A, Guazonni G, Dell'acqua V et al. Laparoscopic cryoablation of solid renal masses: intermediate term followup. J Urol 2004; 172 : 1267-70.
35. Huang SH, Chiu AW, Lin CH et al. Efficacy of ultrasonic tissue dissector glue for laparoscopic partial nephrectomy in a porcine model. Int Surg 2003; 88 : 199-204.
36. Jacomides L, Ogan K, Watumull L, Cadeddu JA. Laparoscopic application of radio frequency energy enables in situ renal tumor ablation and partial nephrectomy. J Urol 2003; 169 : 49-53.
37. Matlaga BR, Zagoria RJ, Woodruff RD et al. Phase II trial of radio frequency ablation of renal cancer: evaluation of the kill zone. J Urol 2002; 168 : 2401-5.
38. Rehman J, Landman J, Lee D et al. Needle-based ablation of renal parenchyma using microwave, cryoablation, impedance - and temperature-based monopolar and bipolar radiofrequency, and liquid and gel chemoablation: laboratory studies and review of the literature. J Endourol 2004; 18 : 83-104.
39. Matsumoto E. D., Watumull, L., Johnson, D. B. et al. The radiographic evolution of radio frequency ablated renal tumors, J Urol 2004; 172 : 45-8.
40. Taylor GD, Lindenberg G, Matsumoto, ED, Cadeddu JA. Acute histologic effects of temperature-based radiofrequency ablation on renal tumor pathological interpretation. J Urol 2004; 171 : 470.
41. Corwin TS, Cadeddu JA: Radiofrequency coagulation to facilitate laparoscopic partial nephrectomy. J Urol 2001; 165 : 175-6.
42. Brausi M, Castagnetti G, Gavioli M et al. Radio Frequency (RF) ablation of renal tumours does not produce complete tumour destruction: Results of a phase II study. Eur Urol 2004; 3 : 14-17.
43. Urena R, Mendez F, Woods M et al. Laparoscopic partial nephrectomy of solid renal masses without hilar clamping using a monopolar radio frequency device. J Urol 2004; 171 : 1054-6.
44. Terai A, Ito N, Yoshimura K et al. Laparoscopic partial nephrectomy using microwave tissue coagulator for small renal tumors: usefulness and complications. Eur Urol 2004; 45 : 744-8.
45. Marota T, Kawakita M, Obuchu N et al. Retroperitoneoscopic partial nephrectomy using microwave coagulation for small renal tumors. Eur Urol 2002; 41 : 540-5.
46. Yoshimura K, Okubo K, Ichioka K et al. Laparoscopic partial nephrectomy with a microwave tissue coagulator for small renal tumor. J Urol 2001; 165 : 1893-6.
47. Paterson RF, Barret E, Siqueira TM et al. Laparoscopic partial kidney ablation with high intensity focused ultrasound. J Urol 2003; 169 : 347-51.
48. Lotan Y, Gettman MT, Lindberg G et al. Laparoscopic partial nephrectomy using holmium laser in porcine model. JSLS 2004, 8 : 51-5.
49. Doublet JD, Janetschek G, Joyce A et al. European Association of Urology. Guidelines on laparoscopy 2002 : 38. http://www.uroweb.nl/files/uploaded_ files/2002_laparoscopy_secure.pdf
50. Lam JS, Shvarts O, Pantuck AJ. Changing concept in the surgical management of renal cell carcinoma. Eur. Urol 2004; 45 : 692-705.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2005 Issue 3-
All articles in this issue
- ZAČLENĚNÍ ROBOTICKÉ RADIKÁLNÍ PROSTATEKTOMIE DO PRAXE PROVÁDĚNÍ BĚŽNÉ OTEVŘENÉ OPERATIVY
- KARCINOM PROSTATY A LAPAROSKOPICKÁ OPERACE
- PERKUTÁNNÍ ENDOPYELOPLASTIKA: SOUČASNÝ KLINICKÝ STAV
- REKONSTRUKČNÍ LAPAROSKOPIE V UROLOGII
-
MOŽNOSTI LAPAROSKOPIE A RETROPERITONEOSKOPIE V LÉČBĚ PARENCHYMOVÝCH NÁDORŮ LEDVIN
ČÁST I - NEFREKTOMIE -
MOŽNOSTI LAPAROSKOPIE A RETROPERITONEOSKOPIE V LÉČBĚ PARENCHYMOVÝCH NÁDORŮ LEDVIN
ČÁST II - LEDVINU ŠETŘÍCÍ VÝKONY - LAPAROSKOPICKÁ ADRENALEKTOMIE
- OBECNÉ KOMPLIKACE LAPAROSKOPIE
- LAPAROSKOPICKÁ OPERACE V UROLOGII - MOŽNÉ KOMPLIKACE A JEJICH PREVENCE, VČASNÉ ROZPOZNÁNÍ A EFEKTIVNÍ ŘEŠENÍ
- VÍME, CO JE TO ÚMLUVA O LIDSKÝCH PRÁVECH A BIOMEDICÍNĚ?
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- OBECNÉ KOMPLIKACE LAPAROSKOPIE
- VÍME, CO JE TO ÚMLUVA O LIDSKÝCH PRÁVECH A BIOMEDICÍNĚ?
- REKONSTRUKČNÍ LAPAROSKOPIE V UROLOGII
-
MOŽNOSTI LAPAROSKOPIE A RETROPERITONEOSKOPIE V LÉČBĚ PARENCHYMOVÝCH NÁDORŮ LEDVIN
ČÁST I - NEFREKTOMIE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

