-
Medical journals
- Career
4. MALIGNÍ LYMFOMY
Published in: Transfuze Hematol. dnes,28, 2022, No. Supplementum 2, p. 19-21.
Category:
KAM KRÁČÍ MOLEKULÁRNĚ-GENETICKÁ KLASIFIKACE VELKOBUNĚČNÝCH B LYMFOMŮ (LBCL) – IMPLIKACE PRO KLINICKOU PRAXI
Trněný M.
I. interní klinika 1. LF UK a VFN v Praze
Klasifikace velkobuněčných B lymfomů (LBCL) prodělala za posledních 30 let výrazné změny. Od původně morfologických podjednotek centroblastového a imunoblastového difúzního velkobuněčného lymfomu (DLBCL), po řadu samostatně definovaných jednotek. DLBCL blíže nespecifikovaných (DLBCL NOS) je stále nejpočetněji zastoupenou jednotkou. Na základě genové exprese rozděluje WHO klasifikace [1] tento typ do dvou základních podjednotek – DLBCL podobný buňkám zárodečného centra (germinal center B-cell like – GCB) a podobný aktivovaným B lymfocytům (activated B-cell like – ABC). Tyto dvě jednotky se mezi sebou liší řadou molekulárně-biologických odlišností, a také klinickým průběhem [2,3]. ABC DLBCL má horší průběh ve srovnání s GCB DLBCL. Dosavadní pokusy o zlepšení osudu nemocných zařazením léků vytypovaných na základě cílené terapie volené podle podtypu DLBCL NOS však zatím selhávají [4,5]. Samostatnou jednotkou v dosud poslední WHO klasifikaci definovanou zejména genetickou alterací je skupina nazvaná jako high grade B-cell lymphoma (HGBL). Je definovaná přestavbou genu MYC a současně BCL2 a/nebo BCL6 (double hit lymphoma – DHL). Tyto lymfomy mohou mít rozdílný morfologický fenotyp. V rámci DLBCL nacházíme při diagnóze tyto změnyv 5–10 % případů. Morfologicky a imunofenotypizačně obdobná skupina bez zmíněných translokací tvoří jednotku HGBL NOS (not otherwise specified). V prvních popisech zhruba před 10 lety se ukazovalo, že prognóza těchto pacientů je extrémně špatná. Je však možné, že k tomu přispěl kromě vlastní biologické podstaty i selekční bias. Většina dat, která v současnosti máme jsou založena zejména na retrospektivních analýzách, nebo analýzách podskupin v rámci prospektivních studií, když tyto podskupiny zdaleka nebyly dostatečně velké k identifikaci signifikantních rozdílů, chybí randomizovaná studie. Přesto se zdá, že pacienti léčení intenzivními režimy (DA-EPOCH-R, R-HyperCVAD/HDMTX-AraC, MTX/R-CHOEP-14/Ara-C a další) by mohli mít lepší osud, alespoň co se prodloužení doby do progrese týče (PFS) [6–9]. V otázce zlepšení celkového přežití (OS) jsou data podstatně méně jasná. Přidání cílené terapie např. venetoclaxu – inhibitoru Bcl-2 proteinu k režimu R-CHOP naznačuje lepší PFS a trend k lepšímu OS ve srovnání s historickou kontrolou Bcl-2 pozitivních DLBCL [10]. Snaha o přidání venetoclaxu k režimu DA-EPOCH-R v rámci randomizované studie u HGBL DHT však neuspěla, studie musela být pro nadměrnou toxicitu a mortalitu kombinace venetoclaxu a DA-EPOCH-R předčasně ukončena [11]. Další posun v genetické klasifikaci LBCL založený na v současnosti diskutovaných návrzích [12,13] může vést k posunu paradigmatu léčby LBCL vč. HGBL. Nelze však zapomínat na terapeutický přístup, který není založen na rozdílných molekulárně biologických charakteristikách vlastní lymfomové buňky, je k nim agnostický. Tento zahrnuje zejména terapii snažící se o využití imunitního systému, zejména aktivace T lymfocytů ať již pomocí bispecifických protilátek nebo tzv. CAR T-lymfocytů. Lze předpokládat, že snaha o optimalizaci kombinací jednotlivých strategií a jejich sekvencí může vést k dalšímu zlepšení osudu pacientů.
VOLNÁ NÁDOROVÁ DNA U HODGKINOVA LYMFOMU JAKO NÁSTROJ PRO BUDOUCÍ KLINICKÉ ROZHODOVÁNÍ
Móciková H.1, Maco M.1, Havránek O.2,3
1Hematologická klinika 3. LF UK a FN Královské Vinohrady, Praha
2Biocev, 1. LF UK, Vestec
3I. interní klinika – klinika hematologie VFN v Praze
Cirkulující nádorová DNA (circulating tumor DNA – ctDNA) je extracelulární DNA původem z nádorových buněk, která ve formě krátkých fragmentů volně cirkuluje v periferní krvi. Kvalitativní analýza ctDNA umožňuje neinvazivní stanovení tumor-specifických somatických mutací DNA v Hodgkinových a Reed-Sternbergových (HRS) buňkách a spolu s kvantitativním stanovením množství ctDNA představuje nástroj pro diagnostiku a stanovení prognózy nádorů vč. klasického Hodgkinova lymfomu (cHL). Výhodou je jednoduchost odběru vzorků periferní krve a možnost jejich opakování v průběhu léčby a po léčbě. Většina somatických mutací se vyskytuje u jednotlivých cHL podtypů podobně často (např. u nejčastěji mutovaných genů jako jsou SOCS1 a XPO1). Na druhé straně, u nodulárně-sklerotického podtypu se vyskytují častěji somatické mutace B2M a u EBER-negativního cHL a nodulárně-sklerotického podtypu častěji mutace STAT6 a TNFAIP3 genů. Somatické mutace tak mohou být využity v diagnostice. Např. XPO1 mutace jsou typické pro nodulárně-sklerotický cHL na rozdíl od mediastinálního gray-zone lymfomu a difuzního velkobuněčného B-lymfomu a STAT6 mohou napomoci diferenciální diagnóze nodulárně sklerotického podtypu cHL a HL s lymfocytární predominancí. Během léčby a po léčbě je možné monitorovat dynamiku ctDNA a selekci nových mutací. Klonální vývoj se liší v závislosti od toho, zda je pacient léčen chemoterapií, konjugátem protilátky a cytostatika nebo je léčen imunoterapií. ctDNA může v budoucnu sloužit i jako komplementární biomarker a prognostický faktor k pozitronové emisní tomografii (PET) při hodnocení odpovědi na léčbu vč. dosažení kompletní remise na „molekulární úrovni“ a monitorování minimální reziduální nemoci, např. pomocí sledování XPO1 mutací. Velký přínos ctDNA se očekává v případech falešně pozitivních PET nálezů nebo v případech suspektního relapsu. Předpokládá se, že kvantitativní analýza ctDNA umožní detekovat „molekulární“ relaps cHL dříve než zobrazovací metody.
Analýza ctDNA je rychle se rozvíjející oblast, která má potenciál využití u cHL při diagnóze k určení mutačního spektra nádorových buněk v rámci diagnostiky a určení prognózy a zároveň komplementární metoda k PET při hodnocení odpovědi a detekci relapsu.
Podpořeno granty: AZV NU22-03-00182 a výzkumným projektem Q 28 Progres udělený 3. LF UK v Praze.
ZHORŠENÍ KOGNITIVNÍCH FUNKCÍ U PACIENTŮ S HODGKINOVÝM LYMFOMEM NENÍ DŮSLEDKEM CHEMOTERAPIE, ALE JE DÁNO PŮSOBENÍM NÁDORU JAKO TAKOVÉHO
Kozák T.1, Fayette D.2, Juríčková V.2, Fajnerová I.2, Móciková H.1, Marková H.1, Gaherová L.1, Horáček J.2
1Hematologická klinika 3. LF UK, Praha
2Národní ústav duševního zdraví, Klecany
Kognitivní postižení spojené s chemoterapií je dobře dokumentované u některých typů nádorů. V případě pacientů s Hodgkinovým lymfomem existuje několik málo retrospektivních studií, které potvrzují kognitivní postižení a uvádějí je do souvislosti s podáváním kombinované chemoterapie. Do této doby nebyla uskutečněna prospektivní studie, která by dlouhodobě sledovala stav kognitivních funkcí pacientů s Hodgkinovým lymfomem léčených moderní intenzivní chemoterapií a srovnávala jej se stavem před zahájením léčby.
Cílem naší prospektivní studie bylo zjistit, zda a k jakému typu poruch kognitivních funkcí u pacientů léčných pro Hodgkinův lymfom (HL) dochází. Do studie jsme zařadili 62 pacienty s HL a take 72 zdravé dobrovolníky, kteří odpovídají sociálním charakteristikám pacientů. Všichni zařazení pacienti (a dobrovolníci) vyplnili tzv. neuropsychologickou baterii a byla u nich vyšetřena subjektivní a objektivní měřítka emočního stresu (affective distress) a kvality života. Baterie vyšetření byla provedena celkem třikrát: před zahájením terapie (baseline), 6 měsíců po jejím zahájení (po jejím ukončení) a 1 rok po začátku léčby. V rámci morfologického a funkčního sledování neurotoxicity podstoupili pacienti ve sledovaném období ve stejných intervalech funkční magnetickou rezonanci mozku a EEG.
Naše studie prokázala, že pacienti s Hodgkinovým lymfomem mají horší kognitivní funkce ve srovnání se zdravými kontrolami již před zahájením léčby. Podrobně jsme se zabývali tím, zda může být kognitivní deficit vysvětlen mírou emočního stresu, toto jsme nepotvrdili. Deficit ve verbální paměti, psychomotorické rychlosti a výkonu mají přitom tendenci přetrvávat i v období po skončení léčby. Chemoterapií byly dočasně negativně ovlivněny jen neverbální paměťové funkce.
Celkově naše výsledky NEPOTVRZUJÍ domněnky a výsledky z retrospektivních studií, že totiž chemoterapie jako taková je hlavní příčinou snížení kognitivních funkcí u pacientů s Hodgkinovým lymfomem. Prokazují naopak, že snížení kognitivních funkcí je u pacientů s Hodginovým lymfomem součástí nádorové patofyziologie.
Práce byla podpořena grantem AZV MZ CR 16-29857A.
VÝSLEDKY LÉČBY PO SELHÁNÍ ANTICD19 CAR-T TERAPIE U NEMOCNÝCH S AGRESIVNÍMI B-LYMFOMY – ANALÝZA DAT Z ČESKÉ REPUBLIKY
Sýkorová A.1, Folber F.2, Polgárová K.3, Steinerová K.4, Belada D.1, Smolej L.1, Trněný M.3,5, Pytlík R.5
1IV. interní hematologická klinika LF UK a FN Hradec Králové
2Interní hematologická a onkologická klinika MU a FN Brno
3I. interní klinika 1. LF UK a VFN v Praze
4Hematoonkologické oddělení, LF UK a FN Plzeň
5Oddělení buněčné terapie, Ústav hematologie a krevní transfuze, Praha
Úvod: U pacientů (p) s agresivními B-lymfomy je dlouhodobé období bez progrese po antiCD19 CAR-T léčbě kolem 40 %. Osud nemocných s progresí/relapsem po této terapii je špatný (medián přežití 5–6 měsíců). V současné době je limitované množství dat o léčebných přístupech pro zlepšení prognózy této skupiny nemocných, optimální management není v současné době znám.
Metody: Analyzovali jsme nemocné s agresivními B-lymfomy, kteří byli v letech 2019–2021 léčeni tisagelecleucelem a axicabtagen ciloleucelem. Jedná se o multicentrickou retrospektivní analýzu z 5 hematologických center (ÚHKT Praha, FN Brno, VFN v Praze, FN Plzeň a FN Hradec Králové), kam byli referováni nemocní z České a Slovenské republiky, kteří byli indikování k antiCD19 CAR-T léčbě po selhání ≥ 2 linií. Zaměřili jsme se na skupinu nemocných, kteří neodpovídali na tuto léčbu nebo u nich lymfom relaboval/progredoval.
Výsledky: 71 pacientů bylo léčeno antiCD19 CAR-T léčbou (56 tisagenlecleucelem a 15 axicabtagenem ciloleucelem). Medián sledování byl 6,7 měsíců (pro žijící nemocné 9,7 měsíců) a medián doby do progrese byl 3,3 měsíce. Léčebná odpověď (ORR) byla pozorována u 38 pacientů (ORR 54 %; CR 44 %). Na léčbu neodpovědělo 33 pacientů (SD a PD 46 %) a z těch, co dosáhli léčebné odpovědi, 9 zrelabovalo/zprogredovalo. Analyzovali jsme tedy skupinu 42 pacientů. Celkem 28 podstoupilo léčbu, u 14 onemocnění rychle progredovalo a léčeni nebyli. Tři pacienti byli léčeni radioterapií a 25 systémovou léčbou. Léčebná odpověď byla pozorována u 18 % nemocných (1× CR / 4× PR). Pacienti, kteří nebyli léčeni, měli častěji masivní postižení > 5 cm v době aferézy (p = 0,02) a žádný nemocný nedosáhl léčebné odpovědi po infuzi antiCD19 CAR-T lymfocytů (p = 0,02). Ze 42 pacientů se selháním antiCD19 CAR-T léčby zemřelo 30 (71 %). Medián celkového přežití (OS) pro všechny pacienty (n = 42) byl od diagnózy progrese/relapsu 2 měsíce. Medián OS byl 3,2 měsíce od diagnózy progrese/relapsu (resp. 5,6 měsíce od podání CAR-T lymfocytů) pro léčené nemocné a 0,1 měsíc (resp. 1,1 měsíc od podání CAR-T lymfocytů) pro nemocné bez léčby.
Závěr: Naše výsledky potvrzují špatnou prognózu nemocných s agresivními B-lymfomy, u nichž selhala antiCD19 CAR-T léčba. Léčebná odpověď na podávanou léčbu byla nedostatečná a u většiny nemocných lymfom progredoval. Na základě dosud publikovaných dat se zdá, že některé z nových léků zkoušených v klinických hodnoceních u relaps/refrakterních agresivních B-lymfomů (polatuzumab vedotin, bispecifické protilátky, lenalidomid, tafasitamab, selinexor, loncastuximab tesirine), by mohly být využity u části nemocných jako „bridge“ k alogenní transplantaci, která zůstává pro část těchto nemocných potenciálně kurativní léčebnou metodou.
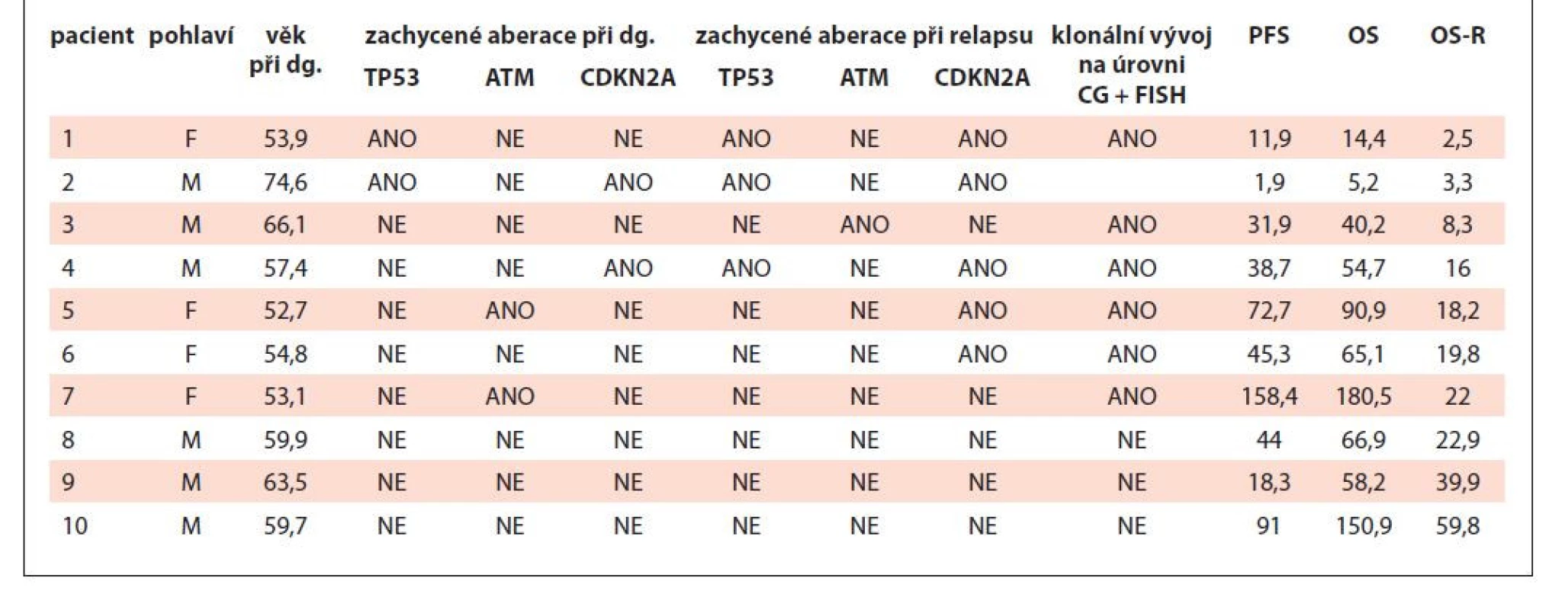
KLONÁLNÍ VÝVOJ U PACIENTŮ S RELAPSEM LYMFOMU Z BUNĚK PLÁŠŤOVÉ ZÓNY – SÉRIE PŘÍPADŮ
Hrušková A., Obr A., Urbánková H., Vatolíková M., Papajík T.
Hemato-onkologická klinika LF UP a FN Olomouc
Úvod: Lymfom z buněk plášťové zóny (MCL) tvoří asi 5 % ze skupiny nehodgkinských lymfomů. Dle klinického průběhu se rozděluje do dvou odlišných variant, klasický (nodální) MCL s agresivním chováním a non-nodální MCL s indolentním průběhem (10 % všech MCL). Cytogenetické a molekulárně-biologické vyšetřovací metody pomáhají k další prognostické stratifikaci. Pacienti s detekovanými aberacemi genů TP53, CDKN2A a kumulací cytogenetických změn tvoří skupinu s agresivním klinickým průběhem choroby, s časnými relapsy a krátkým celkovým přežitím (OS). Prognostický význam aberací genu ATM je dále studován.
Cíl: Analýza prognostického vlivu aberací genů TP53, ATM a CDKN2A v době dg. a v kontextu klonálního vývoje u pacientů s MCL.
Metody: Studie pacientů s MCL léčených na Hemato-onkologické klinice FN Olomouc (HOK) v období 4/2005–8/2021 s dostupným nádorovým infiltrátem stejného kompartmentu (kostní dřeň [KD] + periferní krev [PK], nádorová tkáň) z období diagnózy a prvního relapsu. Materiál byl u jednotlivých pacientů vyšetřen pomocí klasické cytogenetiky. Klonální vývoj byl definován jako jakákoliv cytogenetická změna vyšetřovaného materiálu z období relapsu, která nebyla přítomna u daného pacienta v době diagnózy. Metodou fluorescenční in situ hybridizace (FISH) byly vyšetřeny geny TP53, ATM a CDKN2A. U pacientů bylo hodnoceno OS, přežití bez relapsu/progrese (PFS) a parametr délky celkového přežití od data relapsu (OS-R).
Výsledky: Ve výše uvedeném období bylo na HOK léčeno 100 pacientů, z nichž u 63 došlo k relapsu onemocnění. Dostupný biologický materiál stejného kompartmentu z doby diagnózy a relapsu jsme nalezli u 10 léčených. Medián věku v době diagnózy byl 62,2 roku. Šest pacientů bylo léčených HD-AraC režimem, vč. autologní transplantace krvetvorných buněk. Čtyři pacienti byli léčeni antracyklinovým režimem. Při mediánu sledování 5,1 roku zprogredovalo 7 a zemřelo 5 pacientů. Nejkratší PFS i OS měli pacienti s klonálním vývojem a současnou delecí genu TP53 v době diagnózy. Mezi třemi pacienty s nejdelším PFS i OS byli dva s delecí genu ATM v době diagnózy. Tato aberace nebyla při relapsu přítomna. Pacienti bez detekce klonálního vývoje a s absencí sledovaných aberací měli nejdelší parametr OS-R. Blíže viz. tab. 1.
Závěr: Kombinace klonálního vývoje a delece genu TP53 v době diagnózy vedly u sledované kohorty k nejkratšímu trvání první remise a nejkratšímu celkovému přežití. Naopak delece genu ATM v době dg. se jevila jako pozitivní prediktor delšího OS i PFS. Naše závěry jsou limitovány malým počtem analyzovaných pacientů a vyžadují studii větší skupiny nemocných s MCL.
Práce byla podpořena grantem IGA_LF_2022_001.
Sources
1. Swerdlow AJ, et al. WHO classification of tumours of haematopoietic and lymphoid tissues. revised 4th edition. Lyon: IARC 2017.
2. Alizadeh AA, et al. Nature 2000; 403 : 503–511;
3. Lenz G, et al. Proc Natl Acad Sci USA. 2008; 105 : 13520–13525.
4. Younes A, et al. J Clin Oncol. 2019; 37 : 1285–1295.
5. Nowakowski GS, et al. J Clin Oncol. 2021; 39 : 1317–1328.
6. Petrich AM, et al. Blood. 2014; 124 : 2354–2361.
7. Dunleavy K, et al. Lancet Haematol. 2018; 5: e609–e617.
8. Leppä S, et al. Blood Adv. 2020; 4 : 1906–1915.
9. McMillan AK, et al. Ann Oncol. 2020; 31 : 1251–1259.
10. Morschhauser F, et al. Blood. 2021; 137 : 600–609.
11. Abramson JS, et al. ASH 2021 Blood. 2021; 138 : 523.
12. Chapuy B, et al. Nat Med. 2018; 24 : 679–690.
13. Schmitz R, et al. N Engl J Med. 2018; 378 : 1396–1407.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2022 Issue Supplementum 2-
All articles in this issue
- 1. POSTGRADUÁLNÍ SEKCE 1
- 2. WIEDERMANNOVA PŘEDNÁŠKA
- 3. POSTGRADUÁLNÍ SEKCE 2
- 4. MALIGNÍ LYMFOMY
- 5. MONOKLONÁLNÍ GAMAPATIE
- 6. AKUTNÍ LEUKÉMIE
- 7. MYELOIDNÍ NEOPLÁZIE A VZÁCNÁ ONEMOCNĚNÍ
- 8. TRANSPLANTACE A BUNĚČNÁ TERAPIE
- 9. CYTOMORFOLOGIE V HEMATOLOGII
- 10. HEMATOLOGIE A TRANSFUZE DNES
- 11. CHRONICKÁ LYMFOCYTÁRNÍ LEUKÉMIE
- 12. MYELOPROLIFERATIVNÍ NEMOCI A CHRONICKÁ MYELOIDNÍ LEUKÉMIE
- POSTEROVÁ SEKCE
- 13TH SYMPOSIUM ON ADVANCES IN MOLECULAR HEMATOLOGY
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- 10. HEMATOLOGIE A TRANSFUZE DNES
- 6. AKUTNÍ LEUKÉMIE
- POSTEROVÁ SEKCE
- 12. MYELOPROLIFERATIVNÍ NEMOCI A CHRONICKÁ MYELOIDNÍ LEUKÉMIE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career