-
Medical journals
- Career
Real-world dáta ohľadom účinnosti a bezpečnosti ibrutinibu a venetoklaxu u pacientov s chronickou lymfocytovou leukémiou, skúsenosti jedného centra
Authors: F. Farkaš 1; M. Hrubiško 1,2; A. Bátorová 1
Authors‘ workplace: Klinika hematológie a transfúziológie LF UK, SZU a UNB, Bratislava, SR 1; Katedra hematológie a transfúziológie LF SZU, Bratislava, SR 2
Published in: Transfuze Hematol. dnes,28, 2022, No. 2, p. 94-99.
Category: Original Papers
doi: https://doi.org/10.48095/cctahd2022prolekare.cz8Overview
Úvod: Liečba chronickej lymfocytovej leukémie (CLL) naďalej prechádza veľmi dynamickým vývojom. Chemoimunoterapia, ktorá bola hlavnou kostrou liečby, je do značnej miery nahradená cieľovými molekulami, ktoré sú účinnejšie a bezpečnejšie. Cieľ: Retrospektívna analýza vlastných dát na zhodnotenie výsledkov CLL pacientov liečených inovatívnou nechemoterapeutickou liečbou chemo-free. Materiál a metódy: V období od januára 2016 do septembra 2021 sme do štúdie zahrnuli 83 pacientov s chronickou lymfocytovou leukémiou, ktorí boli liečení na našom pracovisku. Celkovo 63 pacientov dostalo ibrutinib (15,9 % v prvej línii) a 20 pacientov dostalo venetoklax +/ – rituximab (85 % v monoterapii a 5 % v prvej línii). Medián veku bol 64 rokov (rozsah 39–81 rokov). Každá skupina mala medián dvoch predchádzajúcich línií liečby (rozsah 1–6). Medián sledovania bol 31 mesiacov pri ibrutinibe a 23 mesiacov pri venetoklaxe. Výsledky: Väčšina pacientov odpovedala na liečbu s celkovou mierou odpovede (overall response rate – ORR) 92 % pri ibrutinibe a 90 % pri venetoklaxe. Miera kompletnej remisie bola vyššia pri venetoklaxe (relatívne riziko – RR = 2,02; 95% CI: 1,16–3,5; p = 0,012). Trojročné prežívanie bez progresie (progression-free survival – PFS) a celkové prežívanie (overall survival – OS) bolo 82 a 83 % pri ibrutinibe, 80 a 80 % pri venetoklaxe. Nežiaduce účinky boli väčšinou mierne alebo stredne závažné. Záver: V našej práci sme konštatovali, že nové molekuly ibrutinib a venetoklax poskytujú porovnateľné výsledky u pacientov s CLL liečených mimo klinického skúšania.
Klíčová slova:
bezpečnost – ibrutinib – venetoklax – účinnost – chronická lymfocytová leukémia
ÚVOD
Liečba chronickej lymfocytovej leukémie prešla rôznymi etapami, od historickej liečby, v ktorej dominovala chemoterapia (alkylačné látky, purínové analógy, prípadne ich kombinácie), po chemo - imunoterapiu [anti-CD20 monoklonálne protilátky v kombinácii s fludarabínom a cyklofosfamidom (FCR režim) alebo s bendamustínom (BR režim) ], až po súčasnú cielenú terapiu (ako napríklad inhibítory Brutonovej tyrozínkinázy, inhibítory fosfatidylinositol 3-kinázy ako aj inhibítory BCL-2 proteínu). Príchod cielených liekov spolu s vývojom nových monoklonálnych protilátok umožnil pacientom s CLL dosiahnuť hlbšiu remisiu a zmenil súčasné terapeutické postupy i ciele liečby [1–3]. Súbežne s vývojom liečby CLL prinášajú nové molekuly určité nežiaduce účinky, ktoré sú však dobre manažovateľné [1,2]. Ibrutinib je perorálny ireverzibilný inhibítor Brutonovej tyrozínkinázy, ktorý navodí apoptózu a naruší adhéziu a migráciu CLL buniek [4]. Ibrutinib má dokázanú klinickú účinnosť u pacientov s CLL, najmä relabujúcich/refraktérnych (R/R) pacientov, vrátane pacientov s deléciou (17p) alebo TP53 mutáciou [5–9]. V multicentrickej randomizovanej štúdii tretej fázy (RESONATE) bola celková odpoveď pri ibrutinibe v monoterapii u R/R CLL okolo 42,6 % v primárnej analýze a 91 % vo finálnej analýze, z čoho bolo len 11 % kompletných remisií [7,8]. Medzi jeho nežiaduce účinky patri fibrilácia predsiení, krvácanie, infekcie, neutropénia, hypertenzia, hyperglykémia, kožný exantém a artralgia [7,8,10]. Idelalisib sa tiež zameriava na dráhu B-bunkového receptora (BCR) inhibíciou delta izoformy fosfatidylinozitol-3-kinázy (PI3Ki). Jeho kombinácia s rituximabom zlepšila u intenzívne predliečených pacientov s CLL prežívanie bez progresie (PFS) [11]. Avšak obavy z jeho toxicity (ako je reaktivácia cytomegalovírusu, kolitída, pneumonitída a pod.) obmedzujú jeho použitie pri R/R CLL. Venetoklax je účinným perorálnym selektívnym inhibítorom anti-apoptického proteínu BCL-2, ktorý naruší rovnováhu medzi apoptickými proteínmi v prospech proapoptických proteínov a následné dochádza k bunkovej apoptóze [1,2]. Venetoklax v monoterapii je veľmi účinný u pacientov s R/R CLL s celkovou odpoveďou do 66–70 % [12–14]. Kombinácia venetoklaxu s rituximabom pri R/R CLL priniesla lepšie výsledky. V multicentrickej randomizovanej štúdii tretej fázy (MURANO) bola celková odpoveď 92 %, z toho 62 % pacientov dosiahlo MRD (merateľné reziduálne ochorenie) negativitu [15]. Toxický profil bol veľmi priaznivý. Dominujúce nežiaduce účinky boli rozpadový syndróm (tumor lysis syndrome – TLS) a neutropénia [12–15].
MATERIÁL A METÓDY
V období od januára 2016 do septembra 2021 sme do štúdie zahrnuli 83 pacientov s chronickou lymfocytovou leukémiou, ktorí boli liečení na Klinike hematológie a transfúziológie Lekárskej fakulty Univerzity Komenského v Bratislave. Celkovo 63 pacientov dostalo ibrutinib a 20 pacientov dostalo venetoklax, z čoho 17 % pacientov dostalo venetoklax v monoterapii a traja pacienti v kombinácii s rituximabom v rámci časovo obmedzenej liečby podľa štúdie MURANO. Medián veku v každej kohorte (ibrutinib: 65 rokov; venetoklax: 66 rokov) bol podobný, rovnako ako podiel nepriaznivých markerov, ako je del (17p) a nemutovaný status IgHV génu (tab. 1). Väčšina pacientov dostala ibrutinib alebo venetoklax pri R/R CLL, najmä v druhej alebo v tretej línii, pričom medián počtu línií terapie na pacienta bol 2 (v rozmedzí 1–6). V prvej línii dostalo ibrutinib 15,8 % pacientov a venetoklax 5 % pacientov. V predchádzajúcej liečbe dominovala chemoimunoterapia (FCR, BR a anti-CD20 plus chlorambucil). Medián sledovania bol 31 mesiacov pri ibrutinibe a 23 mesiacov pri venetoklaxe. Indikácie pre zahájenie liečby a hodnotenie liečebného efektu boli v súlade s iwCLL (medzinárodná pracovná skupina pre CLL) kritériami. Celková odpoveď bola definovaná ako kompletná i parciálna remisia. Hodnotenie MRD prietokovou cytometriou z periférnej krvi bolo realizované každých 6 mesiacov u 30 (48 %) pacientov s ibrutinibom a 8 (40 %) pacientov s venetoklaxom. Štatistika bola vykonaná pomocou IBM SPSS programu. Biomedicínsky výskum bol vedený v súlade so správnou klinickou praxou, a bol realizovaný so súhlasom lokálnej Etickej komisie v našom inštitúte. Demografické a klinické charakteristiky pacientov sú uvedené v tab. 1.
Table 1. Demografické a klinické charakteristiky pacientov. 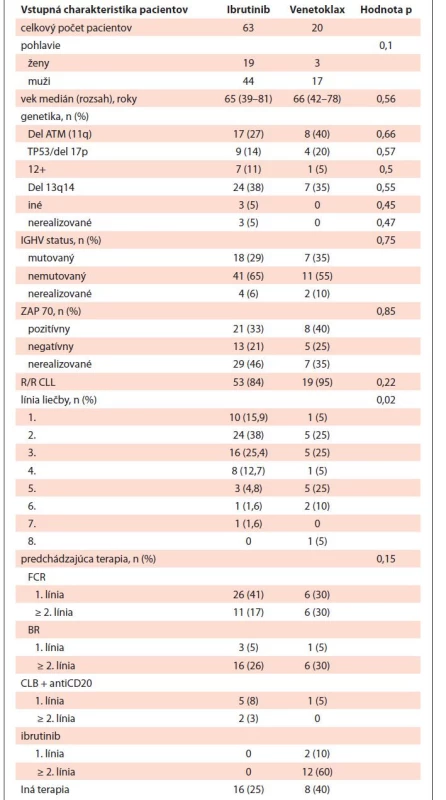
R/R – relabujúca refraktérna, Del – delécia, n – počet, FCR – fludarabín s cyklofosfamidom a rituximabom, BR – bendamustin s rituximabom, CLB – chlorambucil VÝSLEDKY
Celková odpoveď bola dosiahnutá u väč - šiny pacientov, v 92 % pri ibrutinibe a 90 % pri venetoklaxe (RR: 0,79; 95% CI: 0,16–3,77; p = 0,77). Miera kompletnej remisie bola signifikantne vyššia u pacientov, ktorí dostali venetoklax v porovnaní s ibrutinibom (60 vs. 19 %, RR: 2,02; 95% CI: 1,16–3,5; p = 0,012). Taktiež miera dosiahnutia MRD negativity bola štatisticky signifikantná u pacientov, ktorí dostali venetoklax (17 vs. 3 %, RR: 5,6; 95% CI: 1,12–28,14; p = 0.03). Trojročné prežívanie bez progresie bolo 82 % v kohorte s ibrutinibom a 80 % v kohorte s venetoklaxom (p = 0,299) (graf 1). Pacienti, ktorí dosiahli MRD negativitu mali lepšie prežívanie bez progresie (2-ročné PFS bolo 85 % s ibrutinibom a 100 % s venetoklaxom). Zreteľný efekt bol pozorovaný u pacientov s deléciou 17p (mutáciou TP53) v oboch skupinách (2-ročné PFS bolo 77 % pri ibrutinibe a 76 % pri venetoklaxe). Trojročné celkové prežívanie bolo 83 % v skupine s ibrutinibom a 80 % v skupine s venetoklaxom (p = 0,301) (graf 2). Nežiaduce účinky v našej štúdii boli väčšinou mierne alebo stredne závažné. Medzi nečastejšie nežiaduce účinky ibrutinibu boli krvácanie, kožný exantém, trombocytopénia, fibrilácia predsiení a infekcie. Dominujúce nežiaduce účinky venetoklaxu boli neutropénia, hepatopatia, kožný exantém a gastrointestinálne príznaky, ako hnačky a bolesti brucha (graf 3). Rozpadový syndróm nebol pozorovaný. V našom súbore sme zaznamenali Richterovu transformáciu celkovo u troch pacientov (3,6 %) a sekundárne malignity u štyroch pacientov (4,8 %). Celková miera prerušenia alebo ukončenia liečby bola 41,2 % u pacientov liečených ibrutinibom a 20 % u pacientov liečených venetoklaxom. V prípade ibrutinibu boli najčastejšími dôvodmi vysadenia liečby nežiaduce účinky (14,3 %), progresia CLL (14,3 %), Richterova transformácia (3,17 %), sekundárne malignity (3,17%) a nesúvisiaca príhoda úmrtia (6,3 %). V prípade venetoklaxu boli najčastejšími dôvodmi ukončenia liečby nežiaduce účinky (5 %), progresia CLL (5 %), Richterova transformácia (5 %) a nesúvisiaca príhoda úmrtia (5 %).
Graph 1. Kaplan-Mayerova krivka prežívania bez progresie u CLL pacientov liečených ibrutinibom a venetoklaxom. 
PFS – prežívanie bez progresie Graph 2. Kaplan-Mayerova krivka celkového prežívania u CLL pacientov liečených ibrutinibom a venetoklaxom. 
OS – celkové prežívanie Graph 3. Nežiaduce účinky cielenej liečby ibrutinibom a venetoklaxom. 
pac. – pacientov, HDC – horných dýchacích ciest, MC – močových ciest DISKUSIA
Inhibítory dráhy B-bunkového receptora a BCL2 proteínu majú unikátny mechanizmus účinku, významný protinádorový efekt, tvoria významný nástroj v liečbe vysoko rizikových, nepriaznivých relabovaných a refraktérnych pacientov s CLL [1,2,16–18]. Zaujímalo nás, ako v reálnej praxi mimo štúdií účinkujú necytostatické lieky. Kľúčovou nezodpovedanou otázkou zostáva, ktorý z týchto liekov optimalizuje rovnováhu bezpečnosti a účinnosti, ak sa používa v liečbe CLL. Dáta z reálnej praxe, ako sú v našom súbore, podporujú výsledky klinických štúdií hodnotiacich účinnosť a nežiaduce účinky cielených liekov ibrutinibu a venetoklaxu v liečbe CLL. V jednej veľkej retrospektívnej štúdii zo Spojeného kráľovstva, ktorá porovnávala ibrutinib (385 pacientov) a venetoklax (48 pacientov) pri R/R CLL, sa zistili podobné výsledky (ORR a OS) a nepriama výhoda PFS v prospech venetoklaxu [16]. V našej štúdii, bol počet pacientov v skupine s venetoklaxom oveľa menší v porovnaní so skupinou s ibrutinibom z dôvodu skoršieho uvádzania ibrutinibu do klinickej praxe. Uznávame, že analýzy môžu byť nedostatočné na zistenie akýchkoľvek možných rozdielov. Aj keď sú vstupné charakteristiky podobné, menšie kohorty by mohli poskytnúť väčšiu heterogenitu. Avšak cieľom našej štúdie nie je porovnanie ibrutinibu s venetoklaxom, ale vyhodnotenie výsledkov inovatívnej liečby z reálnej praxe. Vzhľadom na charakteristiku tejto populácie je vyvodzovanie záverov o terapii v prvej línii náročné a nebolo naším primárnym cieľom.
Výsledky našej analýzy poukazujú na porovnateľný efekt v zmysle dosiahnutia celkovej odpovede, predĺženia prežívania bez progresie a celkového prežívania. Pričom naznačený signifikantný rozdiel bol v dosiahnutí kompletnej remisie s negativitou merateľného reziduálneho ochorenia v prospech venetoklaxu. Hodnotenie minimálnej reziduálnej choroby je ďalšou a čoraz dôležitejšou kategóriou hodnotenia odpovede na liečbu CLL [2]. Detekcia MRD viacfarebnou prietokovou cytometriou má silný prognostický význam. Pacienti s nedetekovateľnou MRD po liečbe vykazujú dlhšie trvanie odpovede (10-ročné PFS 65 vs. 10 %) a dlhšie prežívanie (10-ročné OS 70 vs. 30 %) [19]. Bezpečnostný profil pacientov bol porovnateľný s ostatnými pacientmi liečenými v klinických štúdiách. Neboli hlásené žiadne nové závažné nežiaduce účinky v súvislosti s liečbou. Väčšina nežiaducich účinkov bola nižšieho stupňa a bola dobre manažovateľná. Vzhľadom na to, že išlo o intenzívne predliečenú skupinu pacientov, výskyt Richterovej transformácie ako aj sekundárnych malignít bol mierne vyšší ako sa uvádza v literárnych prameňoch. Vzhľadom k retrospektívnemu charakteru našej štúdie jej závery ostávajú pri vytváraní hypotéz. Avšak pri absencii prebiehajúcich randomizovaných štúdií porovnávajúcich tieto dve štandardné modality v liečbe CLL, naša štúdia prináša ucelenú informáciu z reálnej praxe pre potreby klinickej praxe, ako aj pre budúci návrh prospektívnej štúdie. Zároveň naše výsledky poukazujú na fakt, že v skupine chorých s vysokým rizikom (nepriaznivá cytogenetika, relaps) sú inhibítory signálnych dráh účinnejšou i lepšie tolerovanou alternatívou ku klasickej chemoimunoterapii, pri použití ktorej sme v minulosti ani zďaleka nedosahovali takéto priaznivé výsledky.
ZÁVER
V poslednom desaťročí je významný pokrok v pochopení patogenézy CLL i v liečbe tohto ochorenia. Klinický výskum týkajúci sa inhibície signálnych dráh vytvára základy pre vývoj nových možností liečby. V súčasnej dobe dostupná cielená liečba ibrutinibom a venetoklaxom ponúka pacientom s chronickou lymfocytovou leukémiou novú nádej a účinnejšie možnosti liečby.
V našej štúdii sme pozorovali, že nové molekuly ibrutinib a venetoklax poskytujú porovnateľné výsledky (ORR, PFS a OS) u pacientov s CLL liečených mimo klinického skúšania. Avšak toto zistenie si vyžaduje nezávislé overenie a opätovné posúdenie u pacientov liečených mimo klinických štúdií. Pričom výber liečby v klinickej praxi by mal byť založený na individuálnych faktoroch pacienta, génovom profile, dostupnosti lieku, komorbiditách, toxickom profile a preferencii pacienta.
PODIEL AUTOROV NA PRÍPRAVE RUKOPISU
FF – príprava rukopisu a revízie
MH, AB – kontrola a schválenie rukopisu
ČESTNÉ VYHLÁSENIE
Autori prehlasujú, že nemajú žiadny konflikt záujmov, článok nie je sponzorovaný.
Doručené do redakce dne: 16. 12. 2021.
Přijato po recenzi dne: 28. 2. 2022.
MUDr. Farkaš Firas, PhD.
Klinika hematológie a transfúziológie
LF UK, SZU a UNB
Antolská 11
851 07 Bratislava
Slovenská republika
e-mail: fir.farkas@gmail.com
Sources
1. Patel K, Pagel JM. Current and future treatment strategies in chronic lymphocytic leukemia. J Hematol Oncol. 2021; 14 : 69 : 1–20.
2. Hallek M. Chronic lymphocytic leukemia: 2020 update on diagnosis, risk stratification and treatment. Am J Hematol. 2019; 94 : 1266–1287.
3. Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukemia: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020; 32 : 23–33.
4. Herman SE, Gordon AL, Hertlein E, et al. Bruton tyrosine kinase represents a promising therapeutic target for treatment of chronic lymphocytic leukemia and is effectively targeted by PCI-32765. Blood. 2011; 117 : 6287–6296.
5. Molica S, Giannarelli D, Baumann T, et al. Ibrutinib as initial therapy in chronic lymphocytic leukemia: A systematic review and meta-analysis. Eur J Haematol. 2020; 104 : 512–515.
6. Dreger P, Ghia P, Schetelig J, et al. High-risk chronic lymphocytic leukemia in the era of pathway inhibitors: integrating molecular and cellular therapies. Blood. 2018; 132 : 892–902.
7. Byrd JC, Brown JR, O‘Brien S, et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med. 2014; 371 : 213–223.
8. Munir T, Brown JR, Brien SO, et al. Final analysis from RESONATE: Up to six years of follow-up on ibrutinib in patients with previously treated chronic lymphocytic leukemia or small lymphocytic lymphoma. Am J Hematol. 2019; 94 (12): 1353–1363.
9. Moreno C, Greil R, Demirkan F, et al. Ibrutinib plus obinutuzumab versus chlorambucil plus obinutuzumab in first-line treatment of chronic lymphocytic leukaemia (iLLUMINATE): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20 : 43–56.
10. Mato AR, Nabhan C, Thompson MC, et al. Toxicities and outcomes of 616 ibrutinib-treated patients in the United States: a real-world analysis. Haematologica. 2018; 103 (5): 874–879.
11. Furman RR, Sharman JP, Coutre SE, et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med. 2014; 370 (11): 997–1007.
12. Eyre TA, Kirkwood AA, Gohill S, et al. Efficacy of venetoclax monotherapy in patients with relapsed chronic lymphocytic leukaemia in the post-BCR inhibitor setting: a UK wide analysis. Br J Haematol. 2019; 185 (4): 656–669.
13. Stilgenbauer S, Eichhorst B, Schetelig J, et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion: a multicentre, open-label, phase 2 study. Lancet Oncol. 2016; 17 : 768–778.
14. Mato AR, Thompson M, Allan JN, et al. Real-world outcomes and management strategies for venetoclax-treated chronic lymphocytic leukemia patients in the United States. Haematologica. 2018; 103 (9): 1511–1517.
15. Seymour JF, Kipps TJ, Eichhorst B, et al. Venetoclax-rituximab in relapsed or refractory chronic lymphocytic leukemia. N Engl J Med. 2018; 378 : 1107–1120.
16. Eyre TA, Lamanna N, Roeker LE, et al. Comparative analysis of targeted novel therapies in relapsed, refractory chronic lymphocytic leukemia. Haematologica. 2021; 106 (1): 284–287.
17. Mato AR, Hill BT, Lamanna N, et al. Optimal sequencing of ibrutinib, idelalisib, and venetoclax in chronic lymphocytic leukemia: results from a multi-center study of 683 patients. Ann Oncol. 2017; 28 (5): 1050–1056.
18. Moreno C. Standard treatment approaches for relapsed/refractory chronic lymphocytic leukemia after frontline chemoimmunotherapy. Hematology Am Soc Hematol Educ Program. 2020; (1): 33–40.
19. Kwok M, Rawstron AC, Varghese A, et al. Minimal residual disease is an independent predictor for 10-year survival in CLL. Blood. 2016; 128 : 2770–2773.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today
2022 Issue 2-
All articles in this issue
- Novelties in translational research of acute lymphoblastic leukaemia – selection from the European School of Haematology Conference
- Mutations in epigenetic regulators – potential prognostic markers and therapeutic targets in acute myeloid leukaemia
- Real-world data on the efficacy and safety of ibrutinib and venetoclax in patients with chronic lymphocytic leukaemia, a single-centre experience
- Importance of Down syndrome in haematology
- Cena České hematologické společnosti za nejlepší původní vědeckou práci v oboru hematologie v roce 2021
- Zemřela MUDr. Eva Ivašková, CSc.
- Laudace k životnímu jubileu prof. Ing. Kyry Michalové, DrSc.
- Prof. MUDr. Miroslav Penka, CSc. – člověk i odborník plný neutuchajícího optimizmu a entuziazmu!
- Jubileum MUDr. Antonína Vítka
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Importance of Down syndrome in haematology
- Mutations in epigenetic regulators – potential prognostic markers and therapeutic targets in acute myeloid leukaemia
- Novelties in translational research of acute lymphoblastic leukaemia – selection from the European School of Haematology Conference
- Real-world data on the efficacy and safety of ibrutinib and venetoclax in patients with chronic lymphocytic leukaemia, a single-centre experience
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

