-
Medical journals
- Career
Prvních 50 COVID-19 pozitivních pacientů na Klinice hematoonkologie Fakultní nemocnice Ostrava v roce 2020
Authors: O. Šušol 1; B. Hájková 1; J. Mihályová 1,2; M. Kaščák 1; J. Ďuraš 1,2; J. Zuchnická 1; H. Plonková 1; K. Hradská 1; T. Jelínek 1,2; M. Navrátil 1,2; K. Benková 1; L. Stejskal 1,2; Z. Kořístek 1,2; T. Popková 1; D. Buff 1; I. Demel 1; L. Muroňová 1; B. Dluhošová 1; L. Szeligová 1; L. Dudová 1; H. Zelená 2,3; J. Gumulec 1,2; R. Hájek 1,2
Authors‘ workplace: Klinika hematoonkologie FN Ostrava 1; LF OU, Ostrava 2; Centrum klinických laboratoří, Zdravotní ústav se sídlem v Ostravě 3
Published in: Transfuze Hematol. dnes,27, 2021, No. 4, p. 323-329.
Category: Original Papers
doi: https://doi.org/10.48095/cctahd2021323Overview
Cíl: COVID-19 je vysoce nakažlivé virové onemocnění se signifikantní mortalitou. Jednu z nejohroženějších skupin představují pacienti s krevním nádorovým onemocněním. V našem článku hodnotíme průběh onemocnění, souvislost komorbidit a tíže průběhu a schopnost sérokonverze u skupiny pozitivních pacientů naší kliniky. Metody: Provedli jsme 1 600 diagnostických nazofaryngeálních PCR stěrů v období 8 měsíců. Zavedli jsme soubor preventivních opatření za účelem ochrany pacientů i personálu. Zaměřili jsme se na kohortu 50 pozitivních pacientů, u kterých jsme zkoumali průběh onemocnění, vliv přidružených rizikových faktorů, základní diagnózy a u 15 pacientů také schopnost sérokonverze. Výsledky: Ke snížení šíření nákazy se ukázala být zásadními striktní bariérová opatření, zejména u pacientů podstupujících autologní transplantaci krvetvorby. Nezaznamenali jsme žádné ohnisko nákazy na naší klinice a pouze jeden pozitivní případ v peritransplantačním období. Ve sledovaném souboru 50 nemocných zemřelo na virem SARS-CoV-2 způsobené komplikace 14 % (7/50) nemocných. Nejčastějšími komorbiditami byla arteriální hypertenze či jiné kardiovaskulární onemocnění, diabetes mellitus 2. typu a renální insuficience. Dvě třetiny pozitivních pacientů byly v 1. linii léčby. Neprokázali jsme hypogamaglobulinémii jako rizikový faktor těžkého průběhu choroby, stejně jako jsme nepozorovali její negativní vliv na dosažení sérokonverze. Závěr: Preventivní opatření mají význam k zabránění šíření nákazy virem SARS-CoV-2 zejména u pacientů s krevním nádorovým onemocněním. Striktní bariérová opatření a pravidelné testování nemocných i personálu byly nejúčinnějšími opatřeními v prvním roce pandemie, kdy nebyly dostupné vakcíny ani účinné léky. Nemocní s krevními nádory patří jednoznačně k vysoce rizikovým osobám z důvodu vážných, až fatálních komplikací souvisejících s infekcí virem SARS-CoV-2.
Klíčová slova:
imunosuprese – mnohočetný myelom – hematoonkologie – COVID-19 – koronavirus – imunoparéza
ÚVOD
Onemocnění respiračním virem SARS-CoV-2 v současné době představuje celosvětový zdravotnický problém. U rizikových skupin nemocných, jako jsou onkologičtí pacienti, pacienti nad 65 let věku či polymorbidní, je riziko těžkého průběhu onemocnění obzvláště vysoké [1–4]. Jako efektivní se osvědčila preventivní režimová opatření soustředící se na eliminaci rizika přenosu nákazy a na včasný záchyt a izolaci COVID-19 pozitivních osob [5,6].
Hematologičtí pacienti, zejména ti s onkologickou diagnózou, představují v rámci infekčních chorob obecně vysoce rizikovou skupinu. To vyplývá z podstaty onemocnění, kdy se na zvýšeném riziku infekční nákazy podílí zejména protilátkový či buněčný imunodeficit a cílená onkologická léčba a její nežádoucí účinky. Jde např. o dlouhodobou B-lymfopenii po terapii anti-CD20 protilátkou, imunomodulační léky v terapii mnohočetného myelomu, dlouhodobou kortikoterapii či nutnost dlouhodobé imunosupresivní léčby po alogenní transplantaci krvetvorby. Již dříve byla navíc potvrzena snížená účinnost preventivní vakcinace u těchto pacientů [7–9]. Podle jedné práce dosáhlo sérokonverze po očkování proti chřipce pouze 19 % pacientů s mnohočetným myelomem [10], přičemž u zdravé populace se účinnost pohybuje okolo 70 % v závislosti na typu vakcíny [11].
Problematika COVID-19 u pacientů s krevním nádorovým onemocněním je tématem stále většího počtu publikací. Vyjma několika multicentrických metaanalýz [12,13] byly doposud publikovány práce na menších kohortách nemocných [2,14–16]. K cílenému vypracování „anti-COVID“ opatření pro tuto velmi specifickou skupinu nemocných bude potřeba přesnějších výsledků na větších kohortách.
Z registru American Society of Hematology [17] jasně vyplývá, že hlavními rizikovými faktory úmrtí při nákaze virem SARS-CoV-2 jsou zejména diabetes mellitus 2. typu, arteriální hypertenze, kardiovaskulární onemocnění, renální insuficience, hepatopatie a primární či sekundární hypogamaglobulinemie. Zajímavé je rovněž zjištění, že většina nakažených se řadí mezi nekuřáky, oproti tomu pouze malé procento pozitivních (4,2 %, n = 553) bylo aktivními kuřáky. Nedávné studie ukázaly, že u pacientů s krevním nádorovým onemocněním se na riziku nákazy podílí zejména (nikoli překvapivě) imunokompromitace či dlouhodobá kontinuální kortikoterapie > 6 měsíců [2]. Zdá se, že za závažným průběhem onemocnění u dospělé populace stojí zejména nadprodukce prozánětlivých cytokinů (IFN-a, IFN - g, IL-1, IL-6, IL-12, TNF-a a další), vedoucí k masivní cytokinové bouři, a zvláště pak změny v buněčné imunitě (snížení počtu Tsup a Treg lymfocytů a vyšší poměr neutrofilů vůči počtu lymfocytů) [18]. K úplnému pochopení však bude třeba dalšího intenzivního studia.
V našem článku analyzujeme COVID-19 pozitivní pacienty naší kliniky v období od dubna do prosince 2020 a režimová opatření k zabránění vzniku ohniska nákazy. Detailněji pak analyzujeme skupinu 50 COVID-19 pozitivních pacientů s ohledem na základní hematologickou diagnózu, přidružené rizikové faktory a průběh onemocnění.
MATERIÁL A METODIKA
Na Klinice hematoonkologie (KHO) Fakultní nemocnice Ostrava jsme od dubna 2020 zavedli soubor preventivních pravidel, která byla zacílena především na bariérová opatření k eliminaci přenosu nákazy a ochraně nejenom našich pacientů, ale i zaměstnanců. Jednalo se o jasně stanovená pravidla, která plošně platila pro ambulantní i lůžkový trakt a jejichž dodržování bylo důsledně sledováno jak u pacientů, tak i u personálu.
Všichni zaměstnanci stejně jako pacienti kliniky byli vybaveni respirátory kvality minimálně FFP2, ochrannými brýlemi či štítem a jednorázovými rukavicemi; rovněž jakýkoli jiný personál vstupující na lůžkovou či ambulantní část (např. revizní technik) nebyl na naše pracoviště vpuštěn bez změřené teploty, FFP2 respirátoru a rukavic a bylo provedeno dotazníkové šetření na známky infekce. Pacient či člen zdravotnického personálu s naměřenou tělesnou teplotou 38 °C a vyšší byl považován za suspektního z onemocnění COVID-19 a byl mu proveden nazofaryngeální stěr. Stejnou metodou byl pravidelně 1× týdně testován veškerý personál kliniky. U všech pacientů byl test prováděn před každým cyklem protinádorové terapie (nebo i opakovaně dle posouzení ošetřujícího lékaře) a rovněž před každým příjmem k hospitalizaci, ať už plánovaným či akutním, byl proveden kontrolní nazofaryngeální stěr. K aktivní protinádorové terapii nebylo přikročeno dříve než po potvrzené COVID negativitě. Zvláštní opatření byla zavedena pro naše pacienty podstupující vysokodávkovanou chemoterapii s autologní transplantací krvetvorby. Tito pacienti byli přijati k hospitalizaci 3 dny před plánovaným zahájením vysokodávkované chemoterapie, vstupně byl proveden první nazofaryngeální stěr a s odstupem 48 hodin druhý stěr. Vysokodávkovaná chemoterapie byla zahájena pouze v případě negativity obou stěrů na SARS-COV-2.
Přítomnost SARS-COV-2 v materiálu z nazofaryngeálního stěru byla stanovena standardní RT-PCR technikou [19]. Z 50 pozitivních případů byl u 66 % (33/50) proveden diagnostický PCR test na KHO a 34 % (17/50) bylo externě vyšetřeno a dodatečně nahlášeno. Pro hodnocení vzniku ochranných protilátek jsme u 15 náhodně vybraných pacientů použili standardní metodu ELISA k vyšetření anti-SARS-CoV-2 specifických imunoglobulinů třídy IgM, IgG a IgA a k bližšímu stanovení jejich efektivity vyšetření virus neutralizačního testu, VNT [20] v časovém okně 6.–10. týdne od první PCR pozitivity (v jednom případě v 5. týdnu a v jednom případě ve 12. týdnu).
V naší práci vycházíme z těchto dat a z evidence COVID-19 pozitivních pacientů naší kliniky, kterým byla pozitivita diagnostikována v jiném zařízení a tuto skutečnost oznámili svému ošetřujícímu hematologovi na KHO. Pro potřeby analýzy byli nemocní rozděleni podle tíže průběhu onemocnění do skupin asymptomatický, mírný, středně těžký a těžký (tab. 1) [21]. Dalšími sledovanými parametry byly základní diagnóza, krevní skupina, rizikové faktory (arteriální hypertenze, diabetes, renální insuficience a další – tab. 2) a jejich vliv na závažnost průběhu onemocnění COVID-19.
Table 1. Rozdělení pacientů podle tíže průběhu onemocnění. 
Table 2. Charakteristika pacientů. 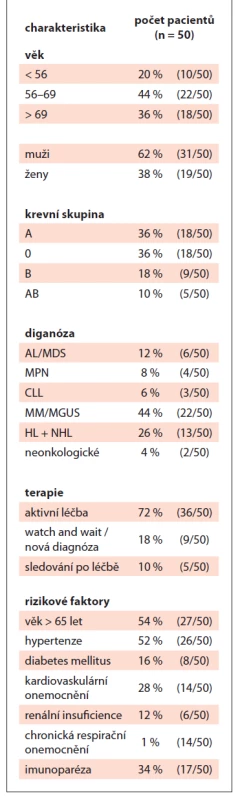
VÝSLEDKY
V období od 14. 4. 2020 do 11. 12. 2020 bylo na našem pracovišti provedeno 1 600 nazofaryngeálních stěrů pro RT-PCR vyšetření, z nichž bylo 50 pozitivních (3,1 %). Z 50 pozitivních bylo 62 % (31/50) mužů. Průměrný věk byl 64 let (medián 66, rozpětí 34–82) a u 72 % (36/50) byla indikována aktivní protinádorová léčba (tab. 2). U 32 transplantovaných pacientů byl zaznamenán pouze jeden případ peritransplantační pozitivity (tedy v období od autologní transplantace krvetvorby do 100. dne poté).
Z pozitivních pacientů mělo 10 % (5/50) těžký, 16 % (8/50) středně těžký a 14 % (7/50) mírný průběh onemocnění, 60 % (30/50) bylo asymptomatických (tab. 3).
Table 3. Přehled pozitivních pacientů na KHO FNO za období duben až prosinec 2020. 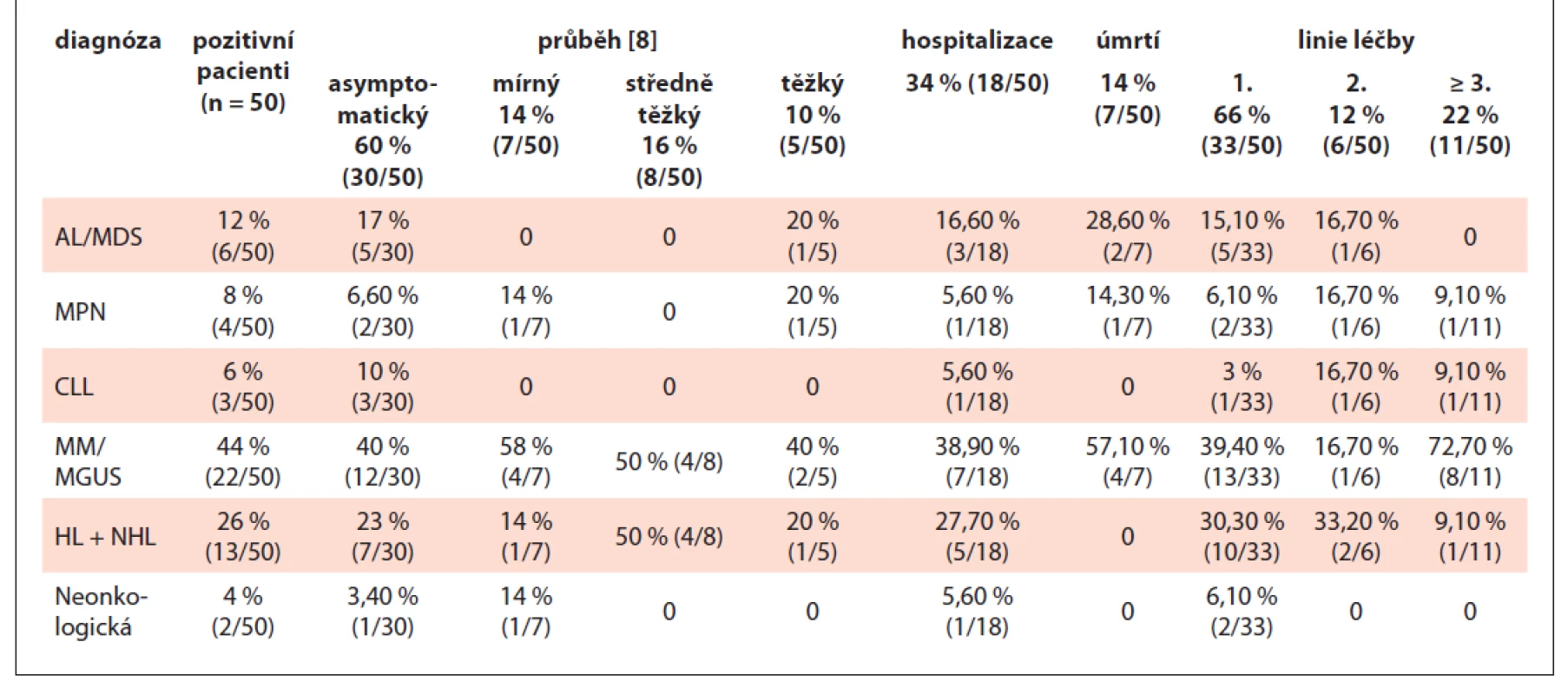
Nejčastějším symptomem byl u 36 % (18/50) suchý kašel, ve 24 % (12/50) febrilie, v 18 % (9/50) dušnost či dechová tíseň, v 16 % (8/50) celková únava a malátnost, v 8 % (4/50) nauzea či zvracení, v 6 % (3/50) bolesti svalů a kloubů. Ztrátu čichu jsme registrovali pouze u 4 % (2/50) případů. V případě více symptomů současně to byla nejčastěji kombinace kašel-febrilie-dušnost, a to ve 14 % (7/50) případů. Méně často se vyskytoval kašel s teplotami (8 %, 4/50) či kašel s dušností (6 %, 3/50).
Celkem 44 % (22/50) nemocných mělo mnohočetný myelom, 26 % (13/50) Hodgkinův/non-Hodgkinův lymfom (HL/NHL) a 12 % (6/50) akutní hemoblastózu či myelodysplastický syndrom (MDS). Chronické myeloproliferace, chronická B-lymfocytární leukemie (CLL) a neonkologické diagnózy tvořily zbytek souboru (18 %). První linii léčby v době COVID pozitivity podstupovalo 66 % (33/50) pacientů. V podskupině 22 pacientů s mnohočetným myelomem byla u 63,6 % (14) v době PCR pozitivity přítomna imunoparéza a 59 % (13) ve chvíli PCR pozitivity bylo v 1. linii léčby (tab. 3).
Nejčastějšími rizikovými faktory byl věk > 65 let (54 %), arteriální hypertenze (52 %), kardiovaskulární onemocnění (28 %), diabetes mellitus 2. typu (16 %) a renální insuficience (12 %) (tab. 2). Minimálně se vyskytovaly chronická respirační onemocnění (astma, CHOPN), hepatopatie, jiná onkologická zátěž a autoimunita. Pouze jeden rizikový faktor mělo 30 % (15/50) nemocných, shodně 24 % (12/50) mělo dva nebo tři rizikové faktory, čtyři a více rizikových faktorů jsme zaznamenali u 10 % (5/50) případů a 12 % (6/50) nemělo žádný z rizikových faktorů (graf 1).
Graph 1. (A) Četnost rizikových faktorů v souboru COVID-19 pozitivních pacientů; (B) vliv počtu přidružených rizikových faktorů na těžký průběh nemoci / úmrtí. 
Při těžkém průběhu byly nejčastějšími rizikovými faktory věk > 65let (80 %, 4/5), arteriální hypertenze (60 %, 3/5) a kardiovaskulární onemocnění (40 %, 2/5). Jeden pacient (20 %, 1/5) měl renální insuficienci a ani jeden nebyl diabetik. Všichni pacienti s těžkým průběhem měli 1 nebo více přidružených komorbidit (graf 1).
Mortalita COVID-19 pozitivních nemocných byla 14 % (7/50) a příčinou úmrtí bylo u čtyř případů multiorgánové selhání v terénu sekundární bakteriální sepse, v jednom případě respirační selhání při COVID-19 pneumonii, jeden pacient zemřel na náhlou srdeční zástavu a v jednom případě šlo o náhlé úmrtí bez objasněné příčiny. Ze sedmi úmrtí jsme zaznamenali arteriální hypertenzi u 86 %, kardiovaskulární onemocnění u 71 % a 71 % pacientů bylo starších 65let. Renální insuficience byla přítomna u 14 % a diabetes mellitus nebyl zaznamenán ani v jednom případě (graf 2). Ve všech případech byl přítomen alespoň 1 rizikový faktor (graf 1).
Graph 2. Vliv vybraných rizikových faktorů na (A) průběh nákazy virem SARS-CoV-2; (B) hospitalizaci a úmrtí COVID-19 pozitivních pacientů. 
DM – diabetes mellitus, E – „elderly“ (věk > 69 let), HT – hypertenze, KN – kardiovaskulární onemocnění, RI – renální insuficience Rozložení krevních skupin bylo následující: skupina A 36 % (18/50), skupina 0 36 % (18/50), skupina B 18 % (9/50) a skupina AB 10 % (5/50). Ze 14 pacientů s těžkým průběhem mělo 35,7 % (5/14) krevní skupinu A, 35,7 % (5/14) krevní skupinu 0 a 28,6 % (4/14) krevní skupinu B. Z pěti pacientů, kteří vyžadovali intenzivní dechovou podporu, mělo 80 % (4/5) krevní skupinu A, pouze 20 % (1/5) krevní skupinu B.
U 10 pacientů s mnohočetným myelomem, dvou pacientů s paroxysmální noční hemoglobinurií, jednoho pacienta s chronickou myeloidní leukemií, jednoho pacienta s chronickou B-lymfocytární leukemií a dvou pacientů s non-Hodgkinovým lymfomem jsme vyšetřili titr specifických protilátek. K sérokonverzi došlo u 46,7 % (7/15), tj. v kontrolním sérologickém vyšetření byly zachyceny IgG protilátky a pozitivní VNT. Z těchto pacientů bylo 71,4 % (5/7) s mnohočetným myelomem.
DISKUZE
Z 1 600 provedených stěrů jsme zaznamenali 3,1 % pozitivních a 0,44 % zemřelých – šlo o ojedinělé případy komunální nákazy pacientů v rodinném či pracovním prostředí. V žádném případě jsme nepozorovali vznik ohniska pozitivity ani u nemocných ani u našich zaměstnanců, a to i díky zavedeným opatřením, pravidelnému preventivnímu testování a zevrubné edukaci pacientů i veškerého personálu. Intenzivnější testování u pacientů podstupujících autologní transplantaci krvetvorby pravděpodobně přispělo k minimální peritransplantační pozitivitě.
Je zřejmé, že k riziku těžkého průběhu nákazy přispívají přidružené komorbidity – zejména se jedná o arteriální hypertenzi či jiná kardiovaskulární onemocnění, renální insuficienci, diabetes mellitus 2. typu a věk > 65 let [4, 22–25].
Ve srovnání s jinými kohortami (n = 138 [22]; n = 442 [23]; n = 1591 [25]; n = 463 [24]) jsme dospěli k podobným výsledkům v případě arteriální hypertenze (60 vs. 55,8 % [23] a 63,7 % [24]) a věku > 65 let (medián 71 vs. 66 let [22]). Arteriální hypertenze je však civilizační onemocnění s častou prevalencí i v rámci neonkologické populace a jednou z deseti nejčastějších příčin úmrtí ve vyspělých zemích [26].
Naopak kardiovaskulární onemocnění jsme zjistili u 40 % (vs. 14,5 % [22]; 19,2 % [23]; 21,0 % [25]) a diabetes mellitus nebyl zaznamenán ani v jednom případě (vs. 10,1 % [22]; 30,8 % [23]; 38,4 % [24]; 17,0 % [25]). Rozdíly ve výsledcích mohou vyplývat z různé velikosti jednotlivých kohort. Nezaznamenali jsme významné zvýšení rizika těžkého průběhu nákazy při sdružení dvou a více rizikových faktorů.
Srovnali jsme distribuci krevních skupin u pozitivních pacientů se závažností průběhu onemocnění, přičemž se srovnání zaměřovalo zejména na respirační selhání s nutností mechanické ventilace. Zjistili jsme, že v naší skupině pěti pacientů vyžadujících intenzivní oxygenoterapii vč. UPV a ECMO mělo 80 % krevní skupinu A, ačkoli u pacientů s těžkým průběhem byl její výskyt 37,5 %. To podporuje hypotézu ochranného vlivu anti-A protilátek na závažný průběh onemocnění s nutností oxygenační podpory. V podobné práci mělo 84 % pacientů, kteří vyžadovali mechanickou plicní ventilaci či náhradu renálních funkcí, krevní skupinu A nebo AB v porovnání s 61 % pacientů s krevní skupinou 0 nebo B. Přítomnost krevní skupiny A nebo AB byla tedy mnohem více spojena s těžkým průběhem onemocnění s nutností intenzivní péče [27]. Molekulární podklady, stojící za tímto jevem, byly sice již hypoteticky určeny [28], stále však zbývá mnohé objasnit. Do budoucna by bylo vhodné podrobit tuto problematiku detailnějšímu zkoumání, jelikož by antigeny AB0 systému mohly být jedním z klíčových prediktivních faktorů těžkého průběhu infekce SARS-COV-2.
Ze všech pozitivních pacientů byla u 28 % (14/50) (tab. 4) v době nákazy přítomna imunoparéza. V podskupině 22 nemocných s mnohočetným myelomem jsme imunoparézu zjistili u 63,6 %. To je výrazně méně ve srovnání s výsledky na větších (58 nemocných) i menších (9 nemocných) kohortách pacientů, kde tomu tak bylo v obou případech u 89 % nemocných [14,29].
Table 4. Četnost vybraných rizikových faktorů v souboru pozitivních pacientů (n = 50). 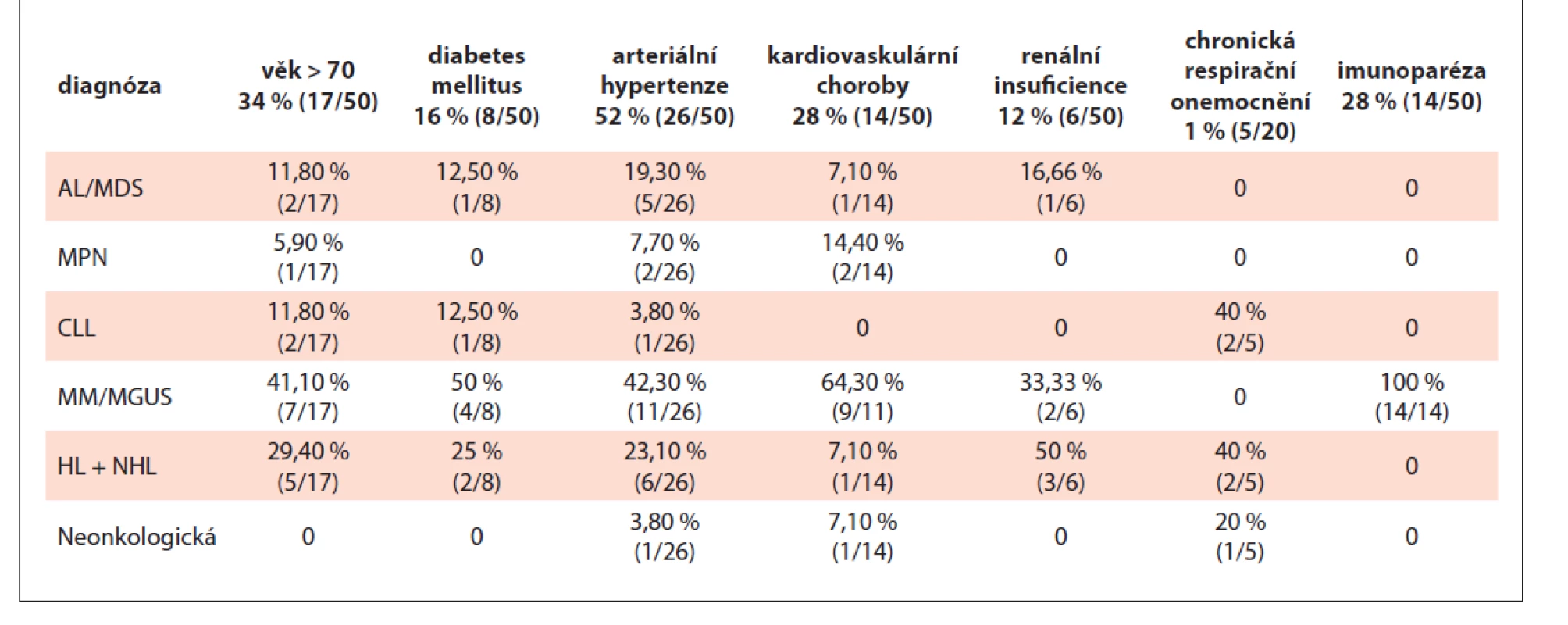
U nemocných s imunoparézou jsme nezaznamenali relativní zvýšení frekvence těžkého průběhu COVID-19 ani znevýhodnění v rámci tvorby ochranných protilátek, i když jde o početně malý soubor: 3/4 pacientů, kteří dosáhli sérokonverze, mělo imunoparézu. Podobné výsledky byly již publikovány dříve [14,29]. K úplnému porozumění však bude nutné tuto problematiku podrobit intenzivnějšímu studiu.
ZÁVĚR
Z provedených 1 600 diagnostických RT-PCR nazofaryngeálních stěrů napříč širokým spektrem diagnóz jsme identifikovali 3,1 % SARS-CoV-2 pozitivních nemocných. Mortalita na komplikace spojené s virem SARS-CoV-2 ve sledovaném souboru 50 nemocných činila 14 %. Zavedená bariérová opatření byla efektivní a na naší klinice nedošlo k šíření nákazy. Transplantační program probíhal bez přerušení, přičemž doplňkový systém intenzivního testování dále zvýšil bezpečnost nemocných podstupujících autologní transplantaci krvetvorby. Přijetí daných opatření je především v rámci hematoonkologie namístě. Účelem je předcházení rizika vzniku ohnisek nákazy a šíření SARS-CoV-2 jak u personálu, tak mezi pacienty.
Asi polovina vyšetřených pacientů (7/15) dosáhla po prodělané nákaze sérokonverze. Tento fakt je třeba zohlednit při plánování očkovací strategie vč. testování hladiny protilátek proti SARS-CoV-2 po vakcinaci.
Přestože na poli poznání SARS-CoV-2 zbývá ještě mnohé objasnit, již nyní je zřejmé, že ochranu našich nemocných lze účinně posílit efektivní prevencí, bariérovými opatřeními a kolektivní imunizací, stejně jako je tomu u ostatní neonkologické populace.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
OŠ, BH – příprava rukopisu
RH, MK, TJ, ZK, JĎ, TP, MN, JZ, HP, JG, LS, ID, DB, BD, LM, JM, KB, KH, LD, LS – korekce a revize rukopisu
PROHLÁŠENÍ O KONFLIKTU ZÁJMŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
PODĚKOVÁNÍ
Chtěli bychom poděkovat všem kolegům a personálu kliniky a rovnou měrou i pacientům za důsledné dodržování ochranných opatření. Dále bychom chtěli poděkovat lékařům Kliniky hematoonkologie FN Ostrava za revizi a odbornou korekci rukopisu.
Do redakce doručeno dne: 31. 3. 2021.
Přijato po recenzi dne: 2. 6. 2021.
prof. MUDr. Roman Hájek, CSc.
Klinika hematoonkologie
LF OU a FN Ostrava
17. listopadu 1790/5
708 52 Ostrava-Poruba
e-mail: roman.hajek@fno.cz
Sources
1. Robilotti EV, Babady NE, Mead PA, et al. Determinants of COVID-19 disease severity in patients with cancer. Nat Med. 2020; 26 (8): 1218–1223.
2. Malard F, Genthon A, Brissot E, et al. COVID--19 outcomes in patients with hematologic disease. Bone Marrow Transplant. 2020; 55 (11): 2180–2184.
3. Liang W, Guan W, Chen R, et al. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020; 21 (3): 335–337.
4. Gao Y, Ding M, Dong X, et al. Risk factors for severe and critically ill COVID‐19 patients: A review. Allergy. 2021; 76 (2): 428–455.
5. Al‐Shamsi HO, Alhazzani W, Alhuraiji A, et al. A practical approach to the management of cancer patients during the novel coronavirus disease 2019 (COVID ‐19) pandemic: An international collaborative group. The Oncologist [online]. červen 2020 [citován 11. březen 2021]; 25 (6). Dostupné z: https: //onlinelibrary.wiley.com/ doi/10.1634/theoncologist.2020-0213.
6. Brandes AA, Ardizzoni A, Artioli F, et al. Fighting cancer in coronavirus disease era: organization of work in medical oncology departments in Emilia Romagna region of Italy. Future Oncol. 2020; 16 (20): 1433–1439.
7. Gandhi M, Egner W, Sizer L, et al. Antibody responses to vaccinations given within the first two years after transplant are similar between autologous peripheral blood stem cell and bone marrow transplant recipients. Bone Marrow Transplant. 2001; 28 (8): 775–781.
8. Lo W, Whimbey E, Elting L, Couch R, Cabanillas F, Bodey G. Antibody response to a two-dose influenza vaccine regimen in adult lymphoma patients on chemotherapy. Eur J Clin Microbiol Infect Dis. 1993; 12 (10): 778–782.
9. Frerichs KA, Bosman PWC, van Velzen JF, et al. Effect of daratumumab on normal plasma cells, polyclonal immunoglobulin levels, and vaccination responses in extensively pre-treated multiple myeloma patients. Haematologica. 2020; 105 (6): e302–e306.
10. Robertson JD, Nagesh K, Jowitt SN, et al. Immunogenicity of vaccination against influenza, Streptococcus pneumoniae and Haemophilus influenzae type B in patients with multiple myeloma. Br J Cancer. 2000; 82 (7): 1261–1265.
11. Osterholm MT, Kelley NS, Sommer A, Belongia EA. Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis. Lancet Infect Dis. 2012; 12 (1): 36–44.
12. Vijenthira A, Gong IY, Fox TA, et al. Outcomes of patients with hematologic malignancies and COVID-19: a systematic review and meta-analysis of 3377 patients. Blood. 2020; 136 (25): 2881–2892.
13. Kim JS, Lee KH, Kim GE, et al. Clinical characteristics and mortality of patients with hematologic malignancies and COVID-19: a systematic review. Eur Rev Med Pharmacol Sci. 2020; 24 (22): 11926–11933.
14. Wang B, Van Oekelen O, Mouhieddine TH, et al. A tertiary center experience of multiple myeloma patients with COVID-19: lessons learned and the path forward. J Hematol Oncol. 2020; 13 (1): 94.
15. Hultcrantz M, Richter J, Rosenbaum CA, et al. COVID-19 Infections and clinical outcomes in patients with multiple myeloma in New York City: A cohort study from five academic centers. Blood Cancer Discov. 2020; 1 (3): 234–243.
16. Glenthøj A, Jakobsen LH, Sengeløv H, et al. SARS‐CoV‐2 infection among patients with haematological disorders: Severity and one‐month outcome in 66 Danish patients in a nationwide cohort study. Eur J Haematol. 2021; 106 (1): 72–81.
17. https: //www.ashresearchcollaborative.org/s/covid-19-registry/data-summaries. Navštíveno 1.2.2021 v 17 : 40.
18. Tahaghoghi-Hajghorbani S, Zafari P, Masoumi E, et al. The role of dysregulated immune responses in COVID-19 pathogenesis. Virus Res. 2020; 290 : 198197.
19. Afzal A. Molecular diagnostic technologies for COVID-19: Limitations and challenges. J Adv Res. 2020; 26 : 149–159.
20. Gauger PC, Vincent AL. Serum virus neutralization assay for detection and quantitation of serum neutralizing antibodies to influenza A virus in swine. In: Spackman E, editor. Animal influenza virus [online]. New York, NY: Springer US; 2020 [citován 11. březen 2021]. s. 321–33. (Methods in Molecular Biology; roč. 2123). Dostupné z: http: //link.springer.com/10.1007/978-1-0716-0346-8_23.
21. Chang MC, Park Y-K, Kim B-O, Park D. Risk factors for disease progression in COVID-19 patients. BMC Infect Dis. 2020; 20 (1): 445.
22. Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus–infected pneumonia in Wuhan, China. JAMA. 2020; 323 (11): 1061.
23. Ebinger JE, Achamallah N, Ji H, et al. Pre-existing traits associated with Covid-19 illness severity. Kou YR, editor. PLOS ONE. 2020; 15 (7): e0236240.
24. Suleyman G, Fadel RA, Malette KM, et al. Clinical characteristics and morbidity associated with coronavirus disease 2019 in a series of patients in metropolitan Detroit. JAMA Netw Open. 2020; 3 (6): e2012270.
25. Grasselli G, Zangrillo A, Zanella A, et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA. 2020; 323 (16): 1574.
26. https: //www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death.
27. Hoiland RL, Fergusson NA, Mitra AR, et al. The association of ABO blood group with indices of disease severity and multiorgan dysfunction in COVID-19. Blood Adv. 2020; 4 (20): 4981–4989.
28. Silva-Filho JC, Melo CGF de, Oliveira JL de. The influence of ABO blood groups on COVID-19 susceptibility and severity: A molecular hypothesis based on carbohydrate-carbohydrate interactions. Med Hypotheses. 2020; 144 : 110155.
29. Susek KH, Gran C, Ljunggren H, Alici E, Nahi H. Outcome of COVID‐19 in multiple myeloma patients in relation to treatment. Eur J Haematol. 2020; 105 (6): 751–754.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2021 Issue 4-
All articles in this issue
- Hypereozinofilie
- Je možné pomocí časné molekulární odpovědi a její kinetiky předpovědět další osud pacientů s chronickou myeloidní leukemií?
- Kongenitální neutropenie u dětí a dospělých
- Neuro-imunitné interakcie organizmu v onkogenenéze mnohopočetného myelómu a ich terapeutické využitie
- Západonilská horečka na pozadí pandemie onemocnění COVID-19
- Prvních 50 COVID-19 pozitivních pacientů na Klinice hematoonkologie Fakultní nemocnice Ostrava v roce 2020
- Ohlédnutí za 2. českým hematologickým a transfuziologickým sjezdem
- Prof. MUDr. Jaroslav Malý, CSc., slaví 75 let
- Prof. MUDr. Vladimír Mihál, CSc. – sedmdesátiletý
- Redakční sdělení
- P31. REBOUND BASOPHILIA DURING CYTOREDUCTION IN PATIENTS WITH CHRONIC MYELOID LEUKAEMIA
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypereozinofilie
- Kongenitální neutropenie u dětí a dospělých
- Neuro-imunitné interakcie organizmu v onkogenenéze mnohopočetného myelómu a ich terapeutické využitie
- Západonilská horečka na pozadí pandemie onemocnění COVID-19
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

