-
Medical journals
- Career
Transplantácia krvotvorných buniek u pacientov s myelodysplastickým syndrómom – skúsenosti jedného centra
Authors: L. Magyaricsová; S. Fliegová; D. Horváthová; J. Lukáš; M. Martišová; L. Sopko; E. Bojtárová; F. Farkaš; M. Mistrík; A. Bátorová
Authors‘ workplace: Klinika hematológie a transfuziológie Lekárskej fakulty Univerzity Komenského, Slovenskej zdravotníckej univerzity a Univerzitnej nemocnice Bratislava
Published in: Transfuze Hematol. dnes,25, 2019, No. 2, p. 168-175.
Category: Original Papers
Overview
Myelodysplastický syndróm (MDS) predstavuje heterogénnu skupinu porúch hemopoézy, ktorú charakterizuje cytopénia v periférnej krvi a zvýšené riziko prechodu do sekundárnej myeloblastovej leukémie. Ide o ochorenie vyššieho veku, pričom práve vysoký vek a komorbidity častokrát neumožňujú podať intenzívny alebo kuratívny typ liečby. Pred samotným zahájením liečby je dôležité zhodnotenie rizikovosti ochorenia ako aj zdravotného stavu pacienta. Účelom práce bolo analyzovať charakteristiky pacientov s týmto ochorením, faktory vplývajúce na prežívanie, prihojenie štepu a vznik infekčných komplikácií. V súbore 44 pacientov alogénne transplantovaných na Klinike hematológie a transfuziológie Lekárskej fakulty Univerzity Komenského, Slovenskej zdravotníckej univerzity a Univerzitnej nemocnice s poliklinikou v Bratislave (KHaT LFUK, SZU a UNB) od 1. novembra 1992 do 31. januára 2016 bol medián veku 41 rokov a prevaha mužov. Najviac chorých malo MDS RAEB II (15 pacientov), RAEB I 14 pacientov, RCMD 7 pacientov, MDS RA 8 pacientov. Častejšie boli pacienti transplantovaní od nepríbuzného darcu (33 vs. 11 pacientov), v 42 prípadoch s periférnymi krvotvornými bunkami, v 2 kostnou dreňou. Pri 9 transplantá-ciách sa štep transfundoval po prípravnom režime s redukovanou intenzitou. Akútna reakcia štepu proti hostiteľovi (GvHD) sa vyskytla u 20 pacientov, chronická GvHD u 9 pacientov. Výskyt infekčných komplikácií štatisticky významne koreloval so zvyšujúcou sa hladinou feritínu (p = 0,0000038). Čím mali pacienti pred transplantáciou vyššie štádium ochorenia (p = 0,0195), viac dní do transplantácie (p = 0,006), vyšší počet blastov v kostnej dreni (p = 0,0107) a vyššiu hladinu feritínu (p = 0,0057), tým štatisticky signifikantne prežívali kratšie. Rýchlosť regenerácie hemogramu – nepriama známka prihojenia štepu – významne závisela od prípravného režimu. Koncentráciu trombocytov > 20 x 109/l a granulocytov > 0,5 x 109/l dosiahli pacienti po prípravnom režime s redukovanou intenzitou v den +11,5, resp. 13,3 a pacienti po myeloablatívnom režime v den +14,3, resp. 16,6 (p = 0,00962, p = 0,00775) po transplantácii. Pacienti transplantovaní od súrodenca boli štatisticky významne kratšie hospitalizovaní, v porovnaní s pacientmi transplantovanými od nepríbuzného darcu (p = 0,0002). Keďže ide o ochorenie vyššieho veku a dochádza k starnutiu populácie, môžeme očakávať zvýšený výskyt tohto ochorenia. Napriek veľkým pokrokom, ktoré boli v liečbe MDS zaznamenané predstavuje transplantácia krvotvorných buniek jedinú potenciálne kuratívnu liečbu, ktorá však má množstvo obmedzení. Ďalšie poznávanie a výskum s cieľom lepšie poznať a ovplyvniť patogenézu tohto ochorenia je preto veľkou výzvou do budúcnosti.
Klíčová slova:
myelodysplastický syndrom – transplantácia kmeňových krvotvorných buniek – celkové prežívanie – infekčné komplikácie
ÚVOD
Myelodysplastický syndróm (MDS) tvorí heterogénna skupina klonálnych ochorení vychádzajúcich z kmeňovej krvotvornej bunky. Ochorenie sa vyskytuje hlavne vo vyššom veku a jeho charakteristickou črtou je inefektívna krvotvorba, ktorá vedie k periférnej cytopénii a asi u jednej tretiny pacientov progreduje do sekundárnej myeloblastovej leukémie. Zlepšenie životných podmienok a zdravotnej starostlivosti vedie k dlhšiemu prežívaniu populácie, čo ďalej vedie k zvýšenému výskytu tohto ochorenia. MDS patrí medzi závažné onkohematologické ochorenia, ktoré v poslednom období zaznamenalo vývoj a pokrok nielen v diagnostike, ale aj určovaní prognózy a liečby. Kľúčovým bodom v diagnostike myelodysplastického syndrómu je vyšetrenie periférnej krvi a kostnej drene. Morfologické a genetické vyšetrenie kostnej drene je podstatné pri zaradení pacienta do rizikovej skupiny. Pre hodnotenie rizikovosti pacienta existuje viacero skórovacích systémov. K najčastejšie používaným patrí medzinárodný prognostický skórovací systém (IPSS), v prípade pa-cientov, u ktorých sa plánuje alogénna transplantácia krvotvorných buniek (TKB) by sa mal používať nedávno revidovaný prognostický skórovací systém, IPSS-R (Revised International Prognostic Scoring System). Zaradenie pacienta do rizikovej skupiny určí potrebu liečby, jej typ, prežívanie pacienta bez liečby ako aj riziko transformácie do sekundárnej akútnej myeloblastovej leukémie. Snahou hematologickej praxe je nielen vyliečenie pacienta zo závažného základného ochorenia, ale aj zabezpečenie kvalitného života pacienta. Preto je pri rozhodovaní o terapeutickom procese veľmi dôležité nielen posúdenie rizikovosti ochorenia, ale aj zdravotného a výkonného stavu pacienta. Vek a pridružené komorbidity sú častou limitáciou voľby intenzívnej a kuratívnej liečebnej modality. Liečba MDS môže siahať od symptomatickej liečby cytopénie, kam patrí podávanie rastových faktorov, hemosubstitúcií, chelačnej a antibiotickej terapie až po transplantáciu krvotvorných buniek, ktorá naďalej zostáva jedinou kuratívnou liečebnou metódou. Cieľom práce je analyzovať a zreferovať výsledky alotransplantácie krvotvorných buniek pri MDS na Klinike hematológie a transfuziológie, Lekárskej fakulty Univerzity Komenského, Slovenskej zdravotníckej univerzity a Univerzitnej nemocnice s poliklinikou v Bratislave (KHaT LFUK, SZU a UN), analýza bola realizovaná k dátumu 1. 10. 2017.
SÚBOR PACIENTOV A METÓDY
Súbor pacientov
Do súboru sme zaradili 44 dospelých pacientov, ktorí podstúpili alogénnu transplantáciu krvotvorných buniek. Prognostické skóre bolo vypočítané podľa medzinárodného prognostického skórovacieho systému [1]. Nízke riziko bolo zaznamenané u 0, intermediárne 1 riziko u 19, intermediárne 2 riziko u 15 a vysoké riziko u 10 pacientov. Charakteristiku súboru zobrazuje tabuľka 1, graf 1. Darcom krvotvorných buniek bol HLA-zhodný súrodenec v 11 (25 %) prípadoch a zhodný nepríbuzný darca v 33 (75 %) prípadoch. Kompatibilita v HLA systéme bola v 35 prípadoch 10/10, v 9 prípadoch 9/10. AB0 kompatibilný štep bol použitý u 25 pacientov, AB0 malá inkompatibilita štepu bola prítomná u 13 pa-cientov, veľká inkompatibilita v 6 prípadoch.
Table 1. Charakteristika súboru pacientov, ktorí podstúpili transplantáciu krvotvorných buniek 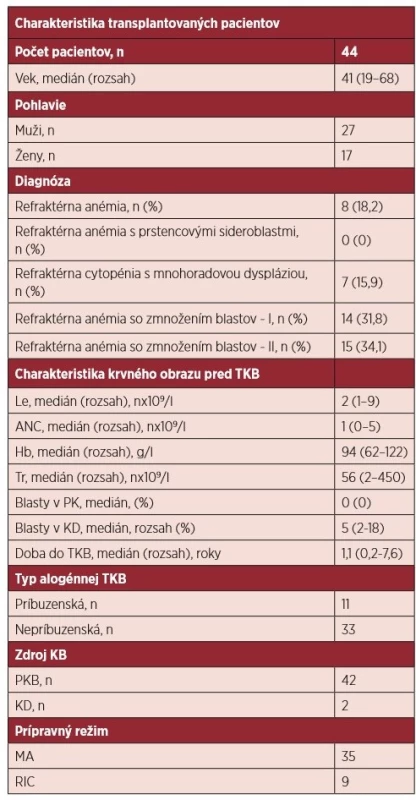
n – počet pacientov, Le – leukocyty, ANC – absolútny počet neutrofilov, Hb – hemoglobín, Tr – trombocyty, PK – periférna krv, KD – kostná dreň, TKB – transplantácia krvotvorných buniek, MA – myeloablatívny, RIC – redukovaný prípravný režim, KB – krvotvorné bunky, PKB – periférne krvotvorné bunky Graph 1. Rozdelenie pacientov, ktorí podstúpili alogénnu transplantáciu podľa medzinárodného prognostického skórovacieho systému 
Myeloablatívny režim pozostával z cyklofosfamidu 60 mg/kg telesnej hmotnosti intravenózne 2 po sebe nasledujúce dni, buď v kombinácii s celotelovým ožiarením v celkovej dávke 12 Gy rozdelených do 6 frakcií počas 3 po sebe nasledujúcich dní (u 1 pacienta), alebo v kombinácii s busulfanom 4 mg/kg telesnej hmotnosti/deň 4 po sebe nasledujúce dni (per os, alebo v dávke 4 x 0,8 mg/kg/d intravenózne). Redukovaný prípravný režim pozostával z cyklofosfamidu 300 mg/m2/d, podávaným tri po sebe nasledujúce dni intravenózne, v kombinácii s fludarabínom 30 mg/m2/d podávaným 3 po sebe nasledujúce dni intravenózne a s busulfanom 4 mg/kg telesnej hmotnosti/d 3 po sebe nasledujúce dni (per os, alebo v dávke 4 x 0,8 mg/kg/d intravenózne). V prípade nepríbuzenskej transplantácie bol súčasťou prípravného režimu aj antitymocytárny globulín, v dávke 2 mg/kg, intravenózne 3 po sebe nasledujúce dni. V rámci profylaxie reakcie štepu proti hostiteľovi dostávali pacienti cyklosporín A s metotrexátom. Každý pacient bol manažovaný podľa protokolu pre transplantáciu krvotvorných buniek, ktorý zahŕňa denné klinické vyšetrenie pacienta, meranie telesnej teploty každých 6 hodín, meranie telesnej hmotnosti, denné vyšetrovanie krvného obrazu a biochemických parametrov, profylaktické podávanie antibiotík, transfúzie erytrocytov na udržanie hemoglobínu > 90 g/l a transfúzie trombocytových koncentrátov na udržanie hodnoty trombocytov (Tr) > 20 x 109/l. Analýza korelácie feritínu s prežívaním aj výskytom infekcií ako aj výskyt septikémií bol realizovaný v podsúbre 34 chorých, pre nemožnosť dohľadania údajov. Analýza bola realizovaná k dátumu 1. 10. 2017.
Metódy
Do našej štúdie boli zahrnutí všetci pacienti, ktorým bola stanovená diagnóza myelodysplastického syndrómu a boli transplantovaní na Klinike hematológie a transfuziológie v Bratislave od novembra 1992 do januára 2016. Išlo o retrospektívno-prospektívne hodnotenie charakteristík ochorenia, liečby a prežívania pacientov. Diagnóza MDS bola potvrdená cytologickým vyšetrením kostnej drene a pacienti boli zatriedení podľa WHO kritérií [2]. IPSS riziko pacientov bolo stanovené podľa skórovacieho systému Greenberg et al., 1998 [1]. Zber údajov sme realizovali z dostupnej medicínskej dokumentácie pacientov. Pri stanovení celkového prežívania pacientov boli dni prežívania vypočítané od dňa stanovenia diagnózy, resp. od dňa realizácie transplantácie po smrť, alebo po deň posledného sledovania (t. j. 1. 10. 2017). Hodnotenie periférnych náterov krvi, aspirátov kostnej drene, ako aj trepanobioptických vyšetrení bolo realizované expertmi z odboru hematopatológie.
Štatistické analýzy
Na základný popis charakteristík súboru sme použili metódy deskriptívnej štatistiky ako priemer, medián, interquartilný rozsah a proporciálne zastúpenie v percentách (Microsoft Office Excel, 2010). Závislosť medzi 2 premennými sme merali korelačnou analýzou, s použitím Pearsonovho, resp. Spearmanovho testu. Pre porovnanie kvantitatívnych premenných sme použili Studentov test, alternatívne Wilcoxonov test pri neparametrickej distribúcii dát. Analýzu prežívania sme uskutočnili použitím Kaplan-Meierovho modelu. Za štatisticky signifikantnú sme považovali hladinu p < 0,05. Na štatistické spracovanie sme použili štatistický program Statgraphics 2007, Statpoint Technologies.
VÝSLEDKY
Transplantáciu krvotvorných buniek podstúpilo 44 pacientov. Pacienti boli transplantovaní 0,2–7,6 rokov od diagnózy, s mediánom 1,1 roka. Počet blastov v kostnej dreni pred transplantáciou bol od 2–18 %, s mediánom 5 %.
Príčinou redukcie prípravného režimu bol vek, komorbidity ako pľúcna fibróza, zvýšené renálne parametre alebo pancytopénia. Vzostup absolútneho počtu neutrofilov (ANC) nad 0,5 x 109/l a počtu trombocytov (Tr) nad 20 x 109/l sme považovali za nepriamu známku prihojenia štepu. Deň prihojenia sme určili počtom dní od transplantácie, do príslušného vzostupu ANC a Tr. U 6 pacientov nebolo prihojenie štepu možné hodnotiť. Traja pacienti exitovali ešte pred prihojením a u troch pacientov pretrvávala po transplantácii nedostatočná funkcia štepu alebo jeho zlyhanie. Ani jeden pacient nebol retransplantovaný pre vážne infekčné komplikácie, dávka CD34+ buniek transplantátu bola u všetkých pacientov súboru dostatočná. Medián prihojenia granulocytov bol 14 dní (rozsah od 11–26), medián prihojenia trombocytov bol 13 dní (rozsah od 6–25). Akútna reakcia štepu proti hostiteľovi sa objavila u 20 pacientov a liečba pozostávala z posilnenia imunosupresívnej terapie kortikosteroidom alebo mykofenolát mofetilom. Najčastejšie bola postihnutá koža a gastrointestinálny trakt. Chronická GvHD sa objavila u 9 pacientov v rozmedzí od 122–256 dní, s mediánom 175 dní. Najčastejšie išlo o GvHD kože, očí a pečene – tabuľka 2.
Table 2. Parametre a prihojenie transplantátu, reakcia štepu proti hostiteľovi 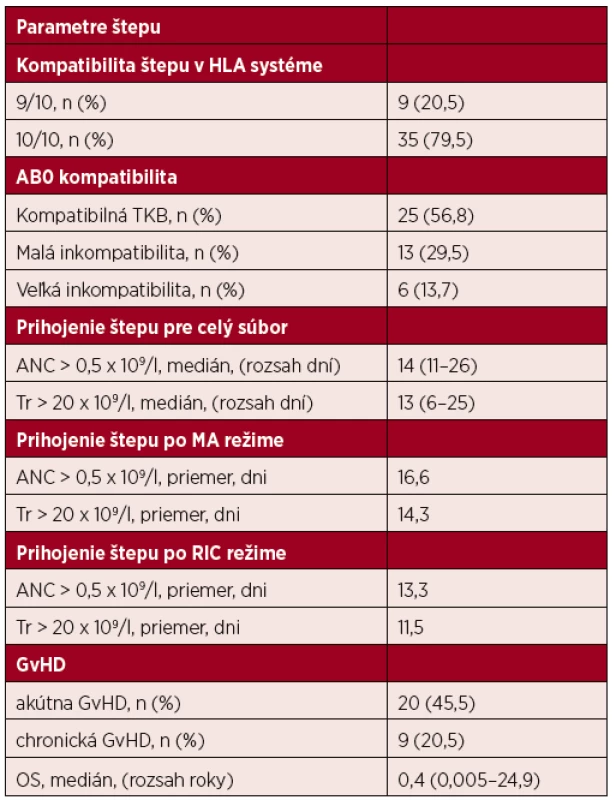
HLA – hlavný histokompatibilný komplex, TKB – transplantácia krvotvorných buniek, ANC – granulocyty, Tr – trombocyty, MA – myeloablatívny režim, RIC – redukovaný prípravný režim, GvHD – reakcia štepu proti hostiteľovi, n – počet pacientov, OS – celkové prežívanie po TKB Hladina feritínu v podsúbore 34 pacientov pred transplantáciou bola od 17,45–5204 ng/ml, s mediánom 857 ng/ml. Infekčné komplikácie sa vyskytli u 20 pacientov, najčastejšie pneumónia, sepsa so septickým šokom a kolitída. Ich výskyt štatisticky významne súvisel so zvýšenou hladinou feritínu (p = 0,0000038). Hodnoty feritínu boli výrazne vyššie u pacientov s výskytom infekcie (medián 1581,9 ng/l), ako u pacientov bez výskytu infekcie (medián 309,8 ng/l). V tomto súbore pacientov sme sledovali aj rozvoj septikémie. Zistili sme, že v 16 prípadoch (47 %) mali pacienti pozitívny záchyt mikroorganizmov v krvi. V 11 prípadoch (68,8 %) išlo o G+ baktérie, v 5 prípadoch (31,2 %) išlo o G - baktérie. Najčastejšie sa vyskytla stafylokoková infekcia (Staphylococcus hominis, Staphylococcus auricularis, Staphylococcus aureus, Staphylococcus haemolyticus, Staphylococcus epidermidis), celkom v 9 prípadoch (56,3 %), v dvoch prípadoch to bol oxacilín rezistentný Staphylococcus aureus, v jednom prípade meticilín rezistentný kmeň. ESKAPE infekcie (Enterococcus, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter, Pseudomonas aeruginosa, Enterobacter) sa vyskytli spolu v 6 prípadoch (37,5 %).
Hospitalizácia transplantovaných pacientov celého súboru pacientov trvala 14–78 dní, s mediánom 32 dní. U úspešne prepustených pacientov po transplantácii to bolo 24–78 dní, s mediánom 34 dní. Ako štatisticky významný faktor prihojenia alogénneho štepu sa ukázal prípravný režim. Koncentráciu trombocytov > 20 x 109/l dosiahli pacienti po prípravnom režime s redukovanou intenzitou v den +11,5 pacienti po myeloablatívnom režime v den +14,3 (p = 0,00962). Koncentráciu granulocytov > 0,5 x 109/l dosiahli pacienti po prípravnom režime s redukovanou intenzitou v den +13,3 pacienti po myeloablatívnom režime v den +16,6 (p = 0,00775). Pri hodnotení dĺžky hospitalizácie sme zistili, že typ darcu štatisticky významne ovplyvňuje dĺžku hospitalizácie (p = 0,0002). Pacienti transplantovaní od súrodenca boli štatisticky významne kratšie hospitalizovaní, v porovnaní s pacientami transplantovanými od nepríbuzného darcu, graf 2. Kompatibilnosť štepu významne neovplyvnila dĺžku hospitalizácie transplantovaných pacientov.
Graph 2. Dĺžka hospitalizácie pacientov v závislosti od príbuznosti darcu krvotvorných buniek (medián, smerodajná odchýlka) 
Pri skúmaní rizikových faktorov prežívania v súbore pacientov sme zistili, že štatisticky významné je štádium ochorenia (p = 0,0195), ako aj počet dní do transplantácie (p = 0,006), počet blastov v kostnej dreni pred transplantáciou (p = 0,0107) a hladina feritínu (p = 0,0057). Čím vyššie štádium ochorenia, viac dní do transplantácie a čím vyššia hladina feritínu, tým kratší interval prežívania. Skúmaním vplyvu počtu blastov v kostnej dreni pred transpantáciou sme zistili, že ak majú pacienti pred transplantáciou viac ako 10 % blastov, prežívanie je signifikantne skrátené a riziko úmrtia je 13,2 x zvýšené (p = 0,0107, 95% CI: 1.44, 120.6, Odds Ratio 13,2) – tabuľka 3.
Table 3. Rizikové faktory prežívania po transplantácii 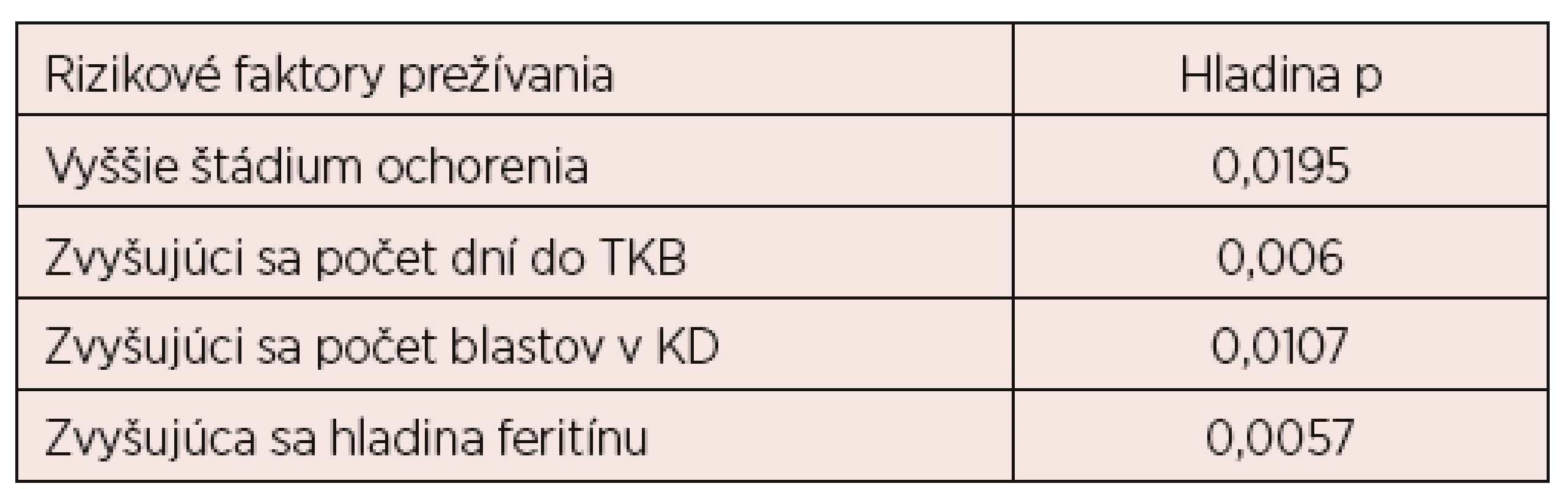
TKB – transplantácia krvotvorných buniek, KD – kostná dreň Celkové prežívanie súboru pacientov po transplantácii krvotvorných buniek od dňa diagnózy bolo s mediánom 2,9 roka (rozsah od 0,4–25,5), prežívanie pa-cientov od dňa transplantácie bolo s mediánom 0,4 roka (0,005–24,9 roka), viď Kaplan-Meyerovu krivku graf 3. V čase analýzy prežíva 16 pacientov, s mediánom 5 rokov (0,4–24,7), zomrelo 28 pacientov, z nich 10 malo MDS IPSS vysoké, 12 intermediárne-2 a 6 intermediárne-1 skóre. Príčina smrti v 11 prípadoch bola akútna GvHD, v 3 prípadoch intrakraniálna hemorágia, desať pacientov zomrelo na infekčnú komplikáciu (pneumónia, septický šok), u 3 pacientov bola prítomná nedostatočná funkcia štepu alebo jeho zlyhanie, v jednom prípade zostala príčina smrti neznáma. Do jedného roka po transplantácii zomrelo 25 (56,8 %) pacientov.
Graph 3. Kaplan-Meierova krivka prežívania transplantovaných pacientov 
Vzhľadom na to, že pacienti pochádzali z celého Slovenska a boli liečení na rôznych pracoviskách, ich predchádzajúcu liečbu, transfúznu závislosť ani prípadnú chelačnú terapiu pred transplantáciou nebolo možné zhodnotiť.
DISKUSIA
Napriek pokrokom v molekulovej patogenéze MDS a novým terapeutický postupom, ktoré dokážu predĺžiť prežívanie pacientov s MDS, ostáva transplantácia krvotvorných buniek jedinou kuratívnou liečebnou metódou u pacientov s vyšším rizikom [3]. Vzhľadom na to, že MDS predstavuje veľmi heterogénnu skupinu ochorení, je rozhodovanie o voľbe terapeutického postupu veľmi zložité. Dôležitý je nielen odhad rizikovosti pacienta v závislosti od charakteru ochorenia, ale rovnako dôležité je aj zhodnotenie zdravotného a výkonnostného stavu pacienta. Riziko ochorenia podľa IPSS-R, vek a prítomnosť komorbidít sa považujú za najdôležitejšie faktory, ktoré by sa mali brať do úvahy pri rozhodovaní o vhodnosti alogénnej TKB. Pacienti s dobrým výkonnostným statusom do veku 65–70 rokov, s intermediárnym-2 alebo vysokým rizikom, alebo pacienti s intermediárnym-1 rizikom, s excesom blastov alebo nepriaznivou cytogenetikou sú kandidátmi pre alogénnu TKB [4]. Optimálny čas na realizáciu HLA kompatibilnej alogénnej TKB je rôzny. Očakávaná dĺžka prežívania u pacientov s nízkym alebo intermediárnym rizikom podľa IPSS v čase diagnózy bola dlhšia keď sa transplantácia odložila, ale realizovala sa pred progresiou ochorenia do AML. U pacientov s intermediárnym-2 a vysokým rizikom bola okamžitá transplantácia spojená s maximálnou dĺžkou prežívania [5]. V našom súbore sme zistili štatistickú významnosť, čím dlhšie pacient čakal na transplantáciu, tým mal dlhšie prežívanie od dňa diagnózy, čo poukazuje na to, že v našom súbore sme zaznamenali vysokú peritransplantačnú mortalitu do jedného roka, porovnateľnú s publikovanými údajmi štúdie Saber et al. [6]. Ak pacient nemá príbuzného darcu, darca je vo vyhľadávaní a má komplexné zmeny karyotypu, je vhodné voliť hypometylačnú terapiu ako “bridging therapy“ do transplantácie. Ak je darca dostupný ihneď, pacient je mladý, bez komplexných zmien karyotypu, je vhodné realizovať transplantáciu s predtransplantačnou indukciou intenzívnou chemoterapiou [3].
Prebehlo veľa štúdií, ktoré sa zaoberali touto terapeutickou modalitou u pacientov s diagnózou MDS. De Witte et al. skúmali vek ako negatívny prognostický marker transplantácie. Zistili, že vek v čase transplantácie je jeden z najdôležitejších prognostických faktorov, čím vyšší vek, tým kratší interval celkového prežívania a prežívania bez ochorenia [7]. V našom súbore sme nezistili priamu koreláciu veku ani pohlavia na prežívanie, čo je pravdepodobne spôsobené vysokou mortalitou nášho súboru, ktorá sa týkala aj mladších pacientov. Signifikantným faktorom, ktorý ovplyvnil výsledok TKB v štúdii Sierra et al. bolo štádium ochorenia [8] a počet blastov v KD pred transplantáciou [9]. V našom súbore sme zistili rovnakú závislosť. S vyšším štádiom ochorenia klesalo prežívanie pacientov, ako aj pacienti s počtom blastov nad 10 % pred TKB mali 13,2 krát vyššie riziko úmrtia, ako pacienti s počtom blastov pod 10 %. Prospektívna štúdia francúzskej skupiny, porovnávala pacientov s hematologickou malignitou so štandardným rizikom, transplantovaných od zhodného príbuzného alebo nepríbuzného darcu (10/10). Štúdia nezistila signifikantný rozdiel v prežívaní medzi typom darcu [10]. Rovnako aj v našom súbore sme nezistili rozdiel v prežívaní podľa typu darcu a kompatibility štepu. Štatisticky nevýznamný bol aj prípravný režim, ktorý nebol signifikantným rizikovým faktorom prežívania pacientov po transplantácii.
Myelodysplastický syndróm je asociovaný s rizikom vzniku vážnych infekčných komplikácií. Najhlavnejší predisponujúci faktor ich vzniku je neutropénia, ale bolo dokázaných niekoľko ďalších defektov imunity, ako poškodená funkcia neutrofilov, B-, T-, aj NK buniek aj možné dôsledky preťaženia železom [11]. Preťaženie železom má negatívny vplyv na vznik bakteriálnych a mykotických infekcií, podporuje bakteriálny rast a virulenciu, alteruje fagocytózu a voľné železo poškodzuje prirodzenú rezistenciu voči infekciám [12]. Armand et al. študovali hladinu feritínu pred transplantáciou a zistili, že zvýšené hladiny feritínu sú negatívnym prognostickým ukazovateľom [13]. Aj v našom súbore sme potvrdili feritín ako negatívny faktor prežívania pacientov, ale aj ako negatívny ukazovateľ vzniku infekcie. Čím vyššia hladina feritínu, tým kratšie prežívanie a tým vyššie riziko vzniku infekčných komplikácií. Americká spoločnosť infekčných ochorení klasifikovala zvyčajne rezistentné baktérie ako ESKAPE infekcie. Pri sledovaní vzniku septikémie v našom súbore pacientov sme identifikovali 6 prípadov vzniku ESKAPE infekcií [14].
Parker et al. v štúdii, kde porovnávali myeloablatívne a redukované režimy pred transplantáciou, zistili, že pri redukovanom prípravnom režime je trvanie aplazie skrátené, je nižší výskyt mukozitídy, febrilít, použitia analgetík, antibiotík aj parenterálnej výživy [15]. Pri skúmaní významných faktorov v prihojení granulocytov a trombocytov nám spomedzi typu darcu, hladiny feritínu, kompatibilnosti štepu a prípravného režimu vyšiel signifikantný len prípravný režim. Pacienti s redukovaným prípravným režimom štatisticky významne skôr prihojili štep než pacienti s myeloablatívnym režimom. Pri hodnotení dĺžky hospitalizácie boli pacienti transplantovaní od súrodenca štatisticky významne kratšie hospitalizovaní než pacienti transplantovaní od nepríbuzného darcu. Na konci našej štúdie prežívalo 16 pacientov, zomrelo 28 pacientov po transplantácii, z toho 25 (56,8 %) v priebehu prvého roka po transplantácii. Desať pacientov s vysokým rizikom, 12 pacientov v intermediárnym-2 rizikom a 6 s intermediárnym-1 rizikom. Najčastejšou príčinou úmrtia bola akútna reakcia štepu proti hostiteľovi a infekčné komplikácie. Vysoká mortalita súboru, hlavne na GvHD a infekčné komplikácie spolu s intrakraniálnym krvácaním môže skresľovať a súvisieť s dlhým sledovaným obdobím, kedy tieto príčiny úmrtia ako aj mortalita pacientov smerom k súčasnosti klesajú.
Odporučenie
V súčasnosti je transplantácia krvotvorných kmeňových buniek jediná potenciálne kuratívna liečba pa-cientov s MDS. Cieľom transplantácie je vyliečiť hematoonkologické ochorenie pacienta. Hlavným úskalím jej realizácie je vek a komorbidity pacientov, keďže MDS je ochorenie vyššieho veku. Komorbidity, vek, IPSS IPSS-R skóre, výsledok cytogenetickej analýzy, prípravný režim a výber darcu určujú výsledok transplantácie, a preto ich musíme starostlivo zvážiť pred indikovaním pacienta na jej realizáciu. Najvhodnejším zdrojom krvotvorných buniek sú periférne krvotvorné bunky od zhodného súrodenca. Pacienti transplantovaní medzi 6–12 mesiacmi od diagnózy dosahujú najlepšie výsledky prežívania a najnižšiu mortalitu v súvislosti s transplantáciou, čo pravdepodobne súvisí s častým podávaním transfúzií, dlhšie trvajúcou cytopéniou a progresiou ochorenia. Pri odložení transplantácie, napr. pri nedostupnosti darcu, by hlavne pacienti s vyšším rizikom mali byť liečení hypometylačnou terapiou ako „bridging“ terapia do realizácie transplantácie [16]. Pri rozhodovaní o prípravnom režime sa v súčasnosti ukazuje vyšší výskyt relapsov po TKB s redukovaným prípravným režimom, preto by pacientom mladším ako 55 rokov bez komorbidít mal byť podaný myeloablatívny režim pred TKB. Naďalej sa diskutuje, či by mala byť pacientom s počtom blastov viac ako 10 % v kostnej dreni pred TKB podaná intenzívna indukčná chemoterapia ako pri akútnej myeloblastovej leukémii, alebo hypometylačná terapia, hlavne u pacientov s podaním redukovaného prípravného režimu. Cieľom predtransplantačnej liečby je dosiahnuť menej ako 5 % blastov v KD [17].
ZÁVER
Myelodysplastický syndróm je veľmi heterogénne ochorenie, ktoré môže varírovať od ľahkých zmien s takmer normálnou dĺžkou života po formy blížia-ce sa akútnej myeloblastovej leukémii. Zlepšenie životných podmienok a zdravotnej starostlivosti vedie k dlhšiemu prežívaniu populácie, no taktiež vedie aj k zvýšenému výskytu niektorých ochorení, kam patrí aj myelodysplastický syndróm. So starnúcou populáciou sa teda predpokladá aj častejší výskyt tohto ochorenia.
Je dôležité ďalšie študovanie a výskum patogenézy ochorenia, lebo napriek veľkým pokrokom, ktoré boli v liečbe MDS zaznamenané, transplantácia krvotvorných buniek naďalej zostáva jedinou liečbou, s potenciálne kuratívnym účinkom.
Podiel autorov na príprave rukopisu
ML, FS, MM, HD, BE, FF, LJ, SL, BA – manažment a vedenie terapie pacientov, vyšetrovanie pacientov.
MM – konzultant, korektúra textu.
Čestné prehlásenie
Autori práce prehlasujú, že v súvislosti s témou, vznikom a publikáciou tohto článku nie sú v strete záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou.
Do redakce doručeno dne 25. 6. 2018.
Přijato po recenzi dne 28. 3. 2019.
MUDr. Lenka Magyaricsová, PhD.
Klinika hematológie a transfuziológie
Lekárska fakulta Univerzity Komenského
Slovenská zdravotnícka univerzita
Univerzitná nemocnica s poliklinikou v Bratislave
Antolská 11
851 07 Bratislava Slovenská republika
e-mail: lenka@wnet.sk
Sources
1. Greenberg PL, Cox C, LeBeau M, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1998;89(6):2079–2088.
2. Greenberg PL, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood 2012;120(12):2454–2465.
3. Kafková A, Tóthová E. Liečba myelodysplastického syndrómu. Onkológia (Bratisl.) 2014; 9(4):231–236.
4. Malcovati L, Hellström-Lindberg E, Bowen D, et al. Diagnosis and treatment of primary myelodysplastic syndromes in adults: recommendation from the European LeukemiaNet. Blood 2013;122(17):2943–2958.
5. Cutler CS, Lee SJ, Greenberg P, et al. A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes: delayed transplantation for low-risk myelodysplasia is associated with improved outcome. Blood 2004;104(2):579–585.
6. Saber W, Cutler CS, Nakamura R, et al. Impact of donor source on hematopoietic cell transplantation outcomes for patients with myelodysplastic syndromes (MDS). Blood 2013;122 : 1974–1982.
7. de Witte T, Suciu S, Verhoef G, et al. Intensive chemotherapy followed by allogeneic or autologous stem cell transplantation for patients with myelodysplastic syndromes (MDSs) and acute myeloid leukemia following MDS. Blood 2001;98(8):2326–2331.
8. Sierra J, Perez WS, Rozman C, et al. Bone marrow transplantation from HLA-identical siblings as treatment for myelodysplasia. Blood 2002;100(6):1997–2004.
9. Warlick E, Cioc A, Defor T, et al. Allogeneic stem cell transplantation for adults with myelodysplastic syndromes: importance of pretransplant disease burden. Biol Blood Marrow Transplant 2009;15(1):30–38.
10. Yakoub-Agha I, Mesnil F, Kuentz M, et al. French Society of Bone Marrow Transplantation and Cell Therapy. Allogeneic marrow stem-cell transplantation from human leukocyte antigenidentical siblings versus human leukocyte antigen-allelic-matched unrelated donors (10/10) in patients with standard-risk hematologic malignancy: a prospective study from the French Society of Bone Marrow Transplantation and Cell Therapy. J Clin Oncol 2006;24(36):5695–5702.
11. Pullarkat V. Objectives of iron chelation therapy in myelodysplastic syndromes: more than meets the eye? Blood 2009;114(26):5251–5255.
12. Bulen JJ, Rogers HJ, Spalding PB, et al. Natural resistance, iron and infection: a challenge for clinical medicine. J Med Microbiol 2006;55(3):251–258.
13. Armand P, Kim HT, Cutler CS, et al. Prognostic impact of elevated pretransplantation serum ferritin in patients undergoing myeloablative stem cell transplantation. Blood 2007;109(10):4586–4588.
14. Sanchez CG, Quin Q, Sun K, et al. Infections in patients with myelodysplastic syndrome. Looking for the escape clause! Blood 2017;130(1):1694–1706.
15. Parker J, Shafi T, Pagliuca A, et al. Allogeneic stem cell transplantation in the myelodysplastic syndromes: interim results of outcome following reduced-intensity conditioning compared with standard preparative regimens. Br J Haematol 2002;119(1):144–154.
16. Al Ali HK, Brand R, van Biezen A, et al. A retrospective comparison of autologous and unrelated donor hematopoietic cell transplantation in myelodysplastic syndrome and secondary acute myeloid leukemia: a report on behalf of the Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation. Leukemia 2007;21 : 1945–1951.
17. Fenaux P, Haase D, Sanz G, et al. Myelodysplastic syndromes: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014;25(Suppl 3):iii57–iii69.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2019 Issue 2-
All articles in this issue
- Přehled maligních chorob odvozených od histiocytárních a dendritických buněk
- Studium klonality akutní myeloidní leukemie na myších modelech
- Corrigendum
- Analýza fluktuace dárců krve mezi státním zařízením transfuzní služby a soukromým plazmaferetickým centrem
- Hodnocení kostního obratu a významu deficitu vitaminu D u pacientů s myelofibrózou
- Transplantácia krvotvorných buniek u pacientov s myelodysplastickým syndrómom – skúsenosti jedného centra
- Cytológia imprintov lymfatických uzlín: jedenásťročné skúsenosti
- Změny v epidemiologii invazivních mykotických infekcí v českých a slovenských hematoonkologických centrech v letech 2005–2017: analýza dat FIND
- Sympozium G3 2019 – „Umělá inteligence – budoucnost onko-hematologie“
- Nový výbor Společnosti pro transfuzní lékařství
- Sekce pro hemostázu a trombózu České hematologické společnosti
- Cena České hematologické společnosti za nejlepší původní vědeckou práci a/nebo monografii v oboru hematologie v roce 2018
- Životní jubileum paní primářky MUDr. Libuše Novosadové
- Interní, hematologická a onkologická klinika LF a FN Brno, v roce 2019 slaví 30 let od založení. Vyprávění o jejím zakladateli – profesorovi Jiřím Vorlíčkovi
- Zemřel MUDr. Josef Časta (28. 4. 1931 – 4. 2. 2019)
- 28. června 2019 nás opustila MUDr. Ema Alena Kubíková-Kouřilová, CSc.
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Transplantácia krvotvorných buniek u pacientov s myelodysplastickým syndrómom – skúsenosti jedného centra
- Přehled maligních chorob odvozených od histiocytárních a dendritických buněk
- Cytológia imprintov lymfatických uzlín: jedenásťročné skúsenosti
- Analýza fluktuace dárců krve mezi státním zařízením transfuzní služby a soukromým plazmaferetickým centrem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

